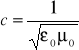1.Równania Maxwella
|
Prawo |
Równanie |
Czego dotyczy |
Doświadczenie |
1 |
Gaussa dla elektryczności |
|
ładunek i pole elektryczne |
Przyciąganie, odpychanie ładunków (1/r2). Ładunki gromadzą się na powierzchni metalu |
2 |
Gaussa dla magnetyzmu |
|
pole magnetyczne |
nie stwierdzono istnienia monopola magnetycznego |
3 |
indukcji Faradaya |
|
efekt elektryczny zmieniającego się pola magnetycznego |
indukowanie SEM w obwodzie przez przesuwany magnes |
4 |
Ampera (rozszerzone przez Maxwella) |
|
efekt magnetyczny zmieniającego się pola elektrycznego |
prąd w przewodniku wytwarza wokół pole magnetyczne prędkość światła można wyliczyć z pomiarów EM |
2.Model atomu Bohra:
Pierwszy nowoczesny model atomu zaproponował w 1912 r. Niels Bohr, młody duński fizyk. Model ten znamy jako model atomu Bohra. Jego główna idea jest następująca. Elektrony mogą zajmować tylko orbity znajdujące się w ściśle określonych odległościach od jądra. Orbity te zostały nazwane orbitami dozwolonymi lub orbitami Bohra. Przejście elektronu z niższej orbity na wyższą wymaga dostarczenia energii, której kosztem zostanie wykonana praca przeciwko sile przyciągania, jaką jądro wywiera na elektron. W odwrotnym przypadku, jeżeli elektron przechodzi z wyższej orbity na niższą, powstaje nadmiar energii, której atom musi się pozbyć. Należy podkreślić, że różne pierwiastki mają różne orbity Bohra, ponieważ energia elektronu zależy od siły, z jaką na elektron działa jądro i inne elektrony, a obie te siły są inne dla każdego pierwiastka.
Przejściom z wyższej orbity Bohra na niższą towarzyszy emisja światła. Jeżeli z jakichś powodów elektron znajdzie się na wyższej orbicie, to może spontanicznie przeskoczyć w dół na niższą orbitę. Kiedy następuje taki przeskok, różnica energii między początkową a końcową orbitą opuszcza atom w postaci fotonu. W wyniku tego procesu atom emituje światło i inne formy promieniowania elektromagnetycznego. Kiedy atom absorbuje światło, elektron przechodzi z niższej orbity Bohra na wyższą. Energia fotonu może być zaabsorbowana przez atom i użyta do przeniesienia elektronu z niższej orbity na wyższą. Istnienie orbit Bohra wyjaśnia, dlaczego różne pierwiastki wysyłają światło o różnych barwach. Elektron przenosi się z jednej orbity na drugą, emitując lub absorbując dokładnie określoną ilość energii. To z kolei oznacza, że atom danego pierwiastka jest zdolny do absorbowania i emitowania zawsze tych samych, ściśle określonych ilości energii. Ponieważ energia fotonu jest związana z długością fali, a stąd i z barwą, każdy pierwiastek może emitować i absorbować tylko pewne barwy. Z tego powodu neon świeci na czerwono, a lampy uliczne, w których świecą pary sodu, są żółte.
Atom absorbuje to, co emituje. Absorpcja światła przez atom odpowiada przejściu elektronu w górę między dwiema orbitami, podczas gdy emisja światła o tej samej długości fali odpowiada przejściu elektronu w dół między tymi samymi dwiema orbitami. Różnica energii między dwiema orbitami nie zależy od kierunku skoku kwantowego. Z tego wynika, że jeżeli atom może emitować jakąś barwę, to również musi być zdolny do jej absorbowania. Barwy emitowane przez atomy danego pierwiastka stanowią jego atomowy "odcisk palca", ponieważ nie ma takich dwóch pierwiastków, które miałyby takie same orbity Bohra. Stało się to podstawą gałęzi nauki zwanej spektroskopią. Fakt, że każdy pierwiastek emituje i absorbuje inny zestaw barw, umożliwia zidentyfikowanie jego obecności w małych próbkach materiału. Na rysunku powyżej przedstawiono szkic urządzenia, które mogłoby służyć do analizy światła pochodzącego z próbki. Różne kolory światła, emitowane przez badaną próbkę, są rozszczepione przez pryzmat, tworząc "odcisk palca" tej próbki na kliszy fotograficznej lub (częściej) w detektorze elektronicznym. Instrument taki nazywany jest spektroskopem. Odcisk palca" każdego pierwiastka i każdego związku chemicznego jest inny.
3.Widma atomowe
Na rysunku przedstawiony jest typowy układ do pomiaru widm atomowych.
Źródłem promieniowania jest jednoatomowy gaz pobudzony do świecenia metodą wyładowania elektrycznego. Promieniowanie przechodzi przez szczelinę kolimującą, a następnie pada na pryzmat (lub siatkę dyfrakcyjną), który rozkłada promieniowanie na składowe o różnych długościach fal.
Na kliszy fotograficznej uwidacznia się cecha szczególna obserwowanych widm. W przeciwieństwie do widma ciągłego emitowanego np. przez powierzchnie ciał ogrzanych do wysokich temperatur, promieniowanie wysyłane przez swobodne atomy zawiera tylko pewną liczbę długości fal. Każda z takich składowych długości fal nazywana jest linią (bo taki jest obraz szczeliny).
Na rysunku na następnej stronie pokazana jest widzialna część widma atomu wodoru.
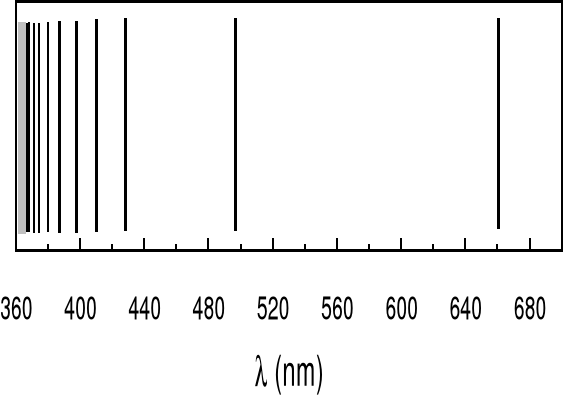
To właśnie badanie widma wodoru doprowadziło Bohra do sformułowania nowego modelu atomu. Model ten chociaż posiada pewne braki to ilustruje idę kwantowania w sposób prosty matematycznie.
Wyszukiwarka
Podobne podstrony:
Ćw nr 47, Ćwiczenie 47, Ćwiczenie 47
Ćw nr 47, Wnioski2, Wnioski:
Ćw nr 47, Ćwiczenie nr 47
Nr 47 CIEMNO ZIELONA
Dziennik Ustaw z 26 marca 2010 Nr 47 poz 278 ustawa o swiadczeniu uslug na terytorium RP, Administra
zadanie nr 47 rozwiazanie
nr 47[1]
wypracowania nr 1-47, RENESANS
2013 nr 47 Stosunki Miedzynarod Nieznany
Zestaw Nr 47
~$pracowania nr 1 47 doc
Dziennik Praw 1919 nr 47 poz 322
2008 Dz U Nr 47 poz 281 poziomy substancji w powietrzu
Zarządzenie Rektora nr 47 12 w sprawie podstawowych elementów organizacji roku akademickiego 2012 20
więcej podobnych podstron