55023

Wyznaczanie ws półczynnika elektrochemicznego i stałej Fzuadz^a
1. Tabela pomiarów:
|
Czast [s] |
Natężenie I [A] |
|
0 |
0.60 |
|
180 |
0.59 |
|
360 |
0.60 |
|
540 |
0.58 |
|
720 |
0.57 |
|
900 |
0.57 |
|
1080 |
0.59 |
|
1260 |
0.56 |
|
1440 |
0.56 |
|
1620 |
0.57 |
|
1800 |
0.57 |
|
Natężenie średnie Isr [A] |
Masa p oczątkow a ml Ig] |
Masa końcowa m2 [g] |
Różnica mas <5m [g] |
|
0.58 |
137,71 |
137,99 |
0.28 |
U. Opis ćwiczenia i
W ćwiczeniu użyłem układu pomiarowego składaj ącego się z woltametru zawierającego elektrolit w którym zostały umieszczone elektrody wykonane z blachy miedzianej przez które został przepuszczony prąd z autotransformatora i prostownika poprzez amperomierz.
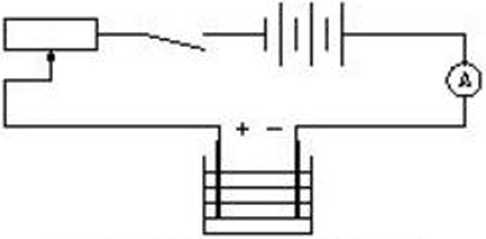
Rys. schematyczny układu
Układ został podłączony na 30 minut, podczas których co 3 minuty odczytywałem i wpisywałem do tabeli wartość natężenia prądu podczas elektrolizy.
III Obliczenia:
Pierwsze prawo elektrolizy Faraday'a stwierdza, że ilość masy m wydzielona na elektrodzie jest równa iloczynowi natężenia prądu I, czasu trwania elektrolizy t orćz równoważnika elektrochemicznego k :
m-k 1 t
Wyszukiwarka
Podobne podstrony:
ŁAWY WYZNACZANIE OGNISKOWEJ SOCZEWEK ZA POMOCĄ OPTYCZNEJ I Tabela pomiarów: Metoda pomiarów
Wyznaczanie współczynnika załamania światła refraktometrem Abbego1 Tabela pomiarów: Stężenie
2 Ćwiczenie 1 Wyznaczanie prędkości wyjścia elektronów i stałej Plancka metodą pola hamującego Przy
Wyznaczanie równoważnika elektrochemicznego miedzii stałej Far aday a I. Tabela pomiarów : Czas t
Wyznaczanie stosunku Cp/C? metodą Ciem en ta - Desormesa l Tabela pomiarów: Lp hl h2 hi
Wyznaczanie ogniskowych soczewek za pomocą lawy optycznej I Tabela pomiarów: Metoda pomiarówodległoś
DSC02930 Ul WYZNACZANIE RÓWNOWAŻNIKA ELEKTROCHEMICZNEGO STAŁEJ FAR/ U Zagadnienia
CCF20100310�001 > Wyznaczanie oporu przewodnika za pomocą mostka Wheatstone a • Tabela pomiarów i
ĆwS- Elektrochemia. Wyznaczanie charakterystyk elektrod: szklanej, antymonowej i chinhydronowej. Pom
Obraz (25) 6 Tabela pomiarów Pomiar mechaniczny Pomiar elektryczny Pomiar
Wyznaczanie przyspieszenia ziemskiego za pomocą wahadła matematycznego Tabela pomiarów i wyników do
Ćw 5- Elektrochemia. Wyznaczanie cliarakterystyk elektrod: szklanej, antymonowej i chinhydrenowej. P
EAM pomiar cisnienia tabela pomiarowa str1 LABORATORIUM ELEKTRONICZNEJ APARATURY MEDYCZNEJ - Pomiar
EAM pomiar cisnienia tabela pomiarowa str2 LABORATORIUM ELEKTRONICZNEJ APARATURY MEDYCZNEJ - Pomiar
imgugp[1] Tabela pomiarów I Pomiar mechaniczny Pomiar elektryczny Pomiar
więcej podobnych podstron