55243
W okresie rośnie ze wzrostem Z. ponieważ rośnie charakter niemetaliczny, czyli pierwiastki coraz łatwiej tworzą trwałe aniony
CHARAKTER AMFOTERYCZNY
13.............17
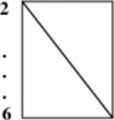
Atomy, które leżą na przekątnej i wzdłuż przekątnej mają charakter amfotcr>vzny (częściej te. które leżą pod przekątną)
ELEKTROUJEMNOŚĆ
to zdolność atomu do przyciągania bliżej siebie pary elektronowej tworzącej wiązanie chemiczne
Stosowana najczęściej skala elekiroujeniności to skala Paulinga: najniższą elektroujemność mają cez i frans a najwyższą fluor. Pierwiastki o małej elekiroujeniności nazywa się elektrododatnimi (metale), o dużej clcktroujcmności - clektroujemnymi (niemetale). Gdy rośnie elektroujemność to rosną własności niemetaliczne pierwiastka a maleją metaliczne.
POTWIERDZANIE CHARAKTERU CHEMICZNEGO
charakter zasadowy potwierdzamy pisząc równanie reakcji z czynnikiem kwasowym
Ca + S = CaS K>0 + N>Os = 2KNO,
charakter kwasowy potwierdzamy pisząc równanie reakcji z czynnikiem zasadowym
Cl2 + Ba — BaCh SO, + 2NaOH = Na;S04
charakter anifoteryczny pisząc równanie reakcji z mocnym kwasem i huk-na zasadą AIjO, + 6HC1 = 2A1C1, + 3H>
AIjO, + 2NaOH + 3H;0 = 2 Na|AI.(OH)4] + 3H2 tetrahydroksoglinian (III) sodu AI2Oj + 6NaOH + 3HjO = 2NadAI.(OH)6| + 31l> heksahydroksoglinian (Ill)sodu (liczba 6 występuje rzadko)
Na[AI.(OH)il —* 2H;0 + NaAlO; metaglinian (III) sodu NadAMOIDh —» 3H;0+ Na»AIO* ortoglinian (III) sodu
|
ZWIĄZKI Z WODOREM |
NaH |
MgH; |
A1H, |
ScH4 |
PH, |
H*S |
HCI |
|
WARTOŚCIOWOŚĆ W STOSUNKU IM> UODOKl 1 Ml 1 Ml |
I |
II |
III |
IV |
III |
n |
I |
|
RÓŻNICA W ELEKTROUJEMNOŚĆ! |
1.2 |
0.9 |
0.6 |
0.3 |
0 |
0.1 |
0.9 |
|
ZWIĄZKI Z TLENEM |
NajO |
MgO |
Al:0, |
SiO: |
P.O, P.O,,, |
SO, |
a.-o- |
|
WARTOŚCIOWOŚĆ W STOSUNKU 1K) TLENU (NAJWYŻSZA! |
I |
II |
III |
IV |
V |
VI |
VII |
|
RÓŻNICA W ELEKTROUJEMNOŚĆ! |
2.6 |
2.3 |
2 |
1.7 |
1.4 |
1 |
0.5 |
|
W ZÓR CHEMICZNY PRODUKTÓW REAKCJI TLENKÓW Z W ODĄ |
NaOlt |
Mg(OH): |
■w |
ii,po4 |
H ;S04 |
HCK)4 |
Wyszukiwarka
Podobne podstrony:
Ze wzrostem ilości Ni rośnie adsorpcja wodoru, ale również zwiększa się o 71& molowy udział Mg.P
Ilość 1 Dobro normalne (zwykłe), na które popyt rośnie wraz ze wzrostem dochodów. Charakteryzują się
Pierwiastki o umiarkowanej elektro ujemności, których charakter metaliczny rośnie ze wzrostem liczby
skanowanie0014 Odczyn zasadowy takiego roztworu rośnie ze wzrostem stężenia soli i ze spadkiem mocy
Power Wall - zapotrzebowanie na moc rośnie wraz ze wzrostem szybkości procesora Memory Wall - rosnąc
0 Konduktywność materiałów półprzewodnikowych rośnie znacznie wraz ze wzrostem temperatury w zakresi
Szybkość reakcji rośnie ze wzrostem temp. I jednocześnie skraca się czas reakcji. 2)Szczepienie wody
więcej podobnych podstron