72235
A. Bradecki, S. Jon as, A. Czyżewska. G. Krupa
Tab. 1. Skład tlenkowy surowców
|
[% masy] |
0 1 |
O 3 |
o" * |
i |
O |
CaO |
£ |
e 2 |
< £ |
£ |
2 z | |
|
ZrS»04 |
0,00 |
0,01 |
0.27 |
32.76 |
0.01 |
0.02 |
0.14 |
0.00 |
0.01 |
0.05 |
65.40 |
1.35 |
|
AIA |
0,16 |
0,00 |
99.8 |
0.05 |
0.00 |
0.03 |
0.00 |
0,00 |
0.00 |
0.03 |
0.00 |
0.00 |
rąb. 2. Skład fazowy próbek wypalonych w różnych temperaturach w czasie 5 godzin
|
%mas |
1300C |
1400'C |
1500'C |
1600'C |
|
Al,O, |
63.1 |
64.6 |
57.6 |
29.6 |
|
ZrSi04 |
36.9 |
35.4 |
30.6 |
16.9 |
|
ZrO, |
0 |
0 |
3.4 |
20 |
|
Mulit |
0 |
0 |
8.4 |
33.6 |
1300'C - 1600‘C szybkość nagrzewania 10’C/min, czas przetrzymywania próbki w zadanej temperaturze od 0,5 godz. do 60 godz. Zmiany składu fazowego próbek, analizę rozkładu pierwiastków w pobliżu przesuwającego się frontu reakcji wykonano stosując metody: FTIR, XRD i EDX. Ilościowa analiza składu fazowego została przeprowadzona metodą Rietvelda.
Aspekty termodynamiczny i kinetyczny
Korzystając z danych literaturowych [5] wykonano obliczenia termodynamiczne dla sumarycznej reakcji przebiegającej w układzie. Obliczono także zmiany entalpii swobodnej w zależności od temperatury dla reakcji rozkładu ZrSi04. Wyniki tych obliczeń zamieszczono na Rys. 1.
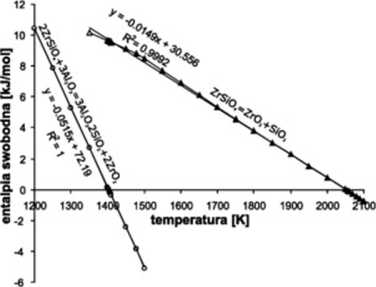
Rys. 1. Zależność entalpii swobodnych badanych reakcji od temperatury
Jak widać, reakcja w układzie ZrSi04 - AI2Oj jest termodynamicznie możliwa w temperaturach powyżej 1400K co odpowiada 1127°C. Reakcja rozkładu czystego ZrSi04 na składniki tlenkowe możliwa jest w znacznie wyższych temperaturach, ok. 1780°C. Oznacza to. że obserwowany w dalszej części pracy, rozkład ZrSi04 na Zr02 i Si O, może zachodzić w znacznie niższych temperaturach, ale w otoczeniu Ał203. W Tabeli 2 zamieszczono skład fazowy próbek wypalanych przez 5 godz. W badanym układzie modelowym nie obserwuje się produktów reakcji do temperatury 1400'C. Pojawiają się one dopiero w próbkach wypalanych w temperaturze 1500'C. Rzeczywisty temperaturowy próg kinetyczny reakcji dla użytej mieszaniny surowców znajduje się w zakresie 1400’C -1500'C. Można zauważyć silną zależność szybkości reakcji od temperatury wypalania. Ilość mulitu powstająca w temperaturze 1600°C jest około 4-krotnie większa w porównaniu z próbkami wypalonymi w 1500°C.
Wyniki badań przeprowadzonych w temperaturze 1500 C
Na Rys. 2 przedstawiono obraz SEM próbki wypalanej przez 10 godz. w temperaturze 1500°C. Widoczne są tu wyraźnie duże ziarna ZrSi04 otoczone AI2Oj. Na powierzchni ziaren cyrkonu pojawił się Zr02 produkt reakcji rozkładu ZrSiO^ZrO^^ >. która jak wcześniej wspomniano
jest możliwa w tych temperaturach w otoczeniu AI2Oj. Zróżnicowanie w grubości warstwy kryształów Zr02 świadczy, że reakcja ta przebiega w sposób uprzywilejowany na aktywnych powierzchniach ziaren ZrSi04. Pośrednio świadczy
0 tym także fakt, że widoczne są takie miejsca gdzie produkt Zr02 jeszcze się nie pojawił. Ilościowe zmiany składu fazowego w czasie reakcji przedstawia Rys. 3. Można wyróżnić na nim trzy przedziały czasowe; w pierwszym przedziale do 10 godz. widać wyraźny przyrost ilości produktów (Zr02
1 mulitu) oraz spadek zawartości ZrSi04 i AI2Os, w drugim od 10 godz. do 20 godz. szybkość reakcji ulega zmniejszeniu, w trzecim od 20 godz. rozkład ZrSi04 i krystalizacja Zr02 ulega zahamowaniu. Przyczyny takiego zachowania nie są znane. Być może decydują o tym procesy powierzchniowe na ziarnach ZrSi04. W pierwszym etapie na aktywnych powierzchniach ziaren ZrSi04 pojawiają się produkty reakcji jego rozkładu - ZrOz i Si02. Reakcja ta natrafia jednak dalej na barierę kinetyczną w tej temperaturze (wszystkie miejsca aktywne są już .wykorzystane*). Dodać także należy, że reakcja w tej temperaturze przebiega tak wolno, że wyniki uzyskane dla czasów poniżej 5 godz. mieszczą się w granicy błędu pomiarowego.
Wyniki badań przeprowadzonych w temperaturze 1600‘C
Na Rys. 4 przedstawiono obraz przekroju próbki otrzymanej w temperaturze 1600*C w czasie tylko 1 godziny. Widać tu wyraźnie ciągłą warstwę produktu Zr02 o grubości od 4pm do 16pm otaczającą ziarna cyrkonu. Po 20 godz. natomiast (Rys. 5) na obrazie SEM praktycznie nie obserwuje się już pierwotnych ziaren ZrSi04. Na wykresie zmian składu fazowego (Rys. 6) widoczne sądwa etapy czasowe, pierwszy, do 20 godz. w którym to następuje całkowity rozkład ZrSi04 i krystalizacja Zr02, oraz drugi powyżej 20 godz., gdzie następuje dalszy wzrost zawartości mulitu i równoczesny spadek zawartości Al203. Jeszcze wyraźniej podział na dwie strefy czasowe widać na widmach FTIR (Rys. 7). Tutaj jednak graniczną wartością czasu jest lOgodz.
188 MAHRlUYCERAMICTNf, 60. 4, (7008)
Wyszukiwarka
Podobne podstrony:
Kwas zas1256 Rozdział 34 Jon wodorowy i pH CHEMICZNE (tab. 34-1). Jon H‘ jest protonem (tzn. atomem
Tab. I. Skład chemiczny stali A1SI 316L (X2CrNiMol7 13 ) według normy PN 86020. Stężenie pierwiast
DSC02822 (5) odpadu oraz ilości i rodzaju zastosowanego mater Tab. 1. Skład granulatów oraz ich włas
2013-03-13 Skład tlenkowy klinkieru (cementu) portlandzkiego 7
DSC06383 (2) Geneza i geologia oceanów 93 Tab.4.2. Skład chemiczny bazaltów oceanicznych Bazalty
2010-12-28 Cement portlandzki (zarys produkcji, skład tlenkowy i mineralogiczny klinkieru
±S tt)inuł< tAb-?iWOicA»blo9S?oł»co»»)
Skład chemiczny surowców dolomitowych dla przemysłu szklarskiego * Do wytwarzania
DSC06414 126 Tab. 5.1. Główne metaliczne surowce strategiczne Zastosowanie Ważniejsze minerały (gł
skład i właściwości surowców spożywczych dokształcania się oraz korzystania z obiektywnych źródeł
skanuj0108 (27) 120 PHP i MySQL dla każdego foreach{$tab as $key -> $val){ echo("tab[$key] =
więcej podobnych podstron