87018
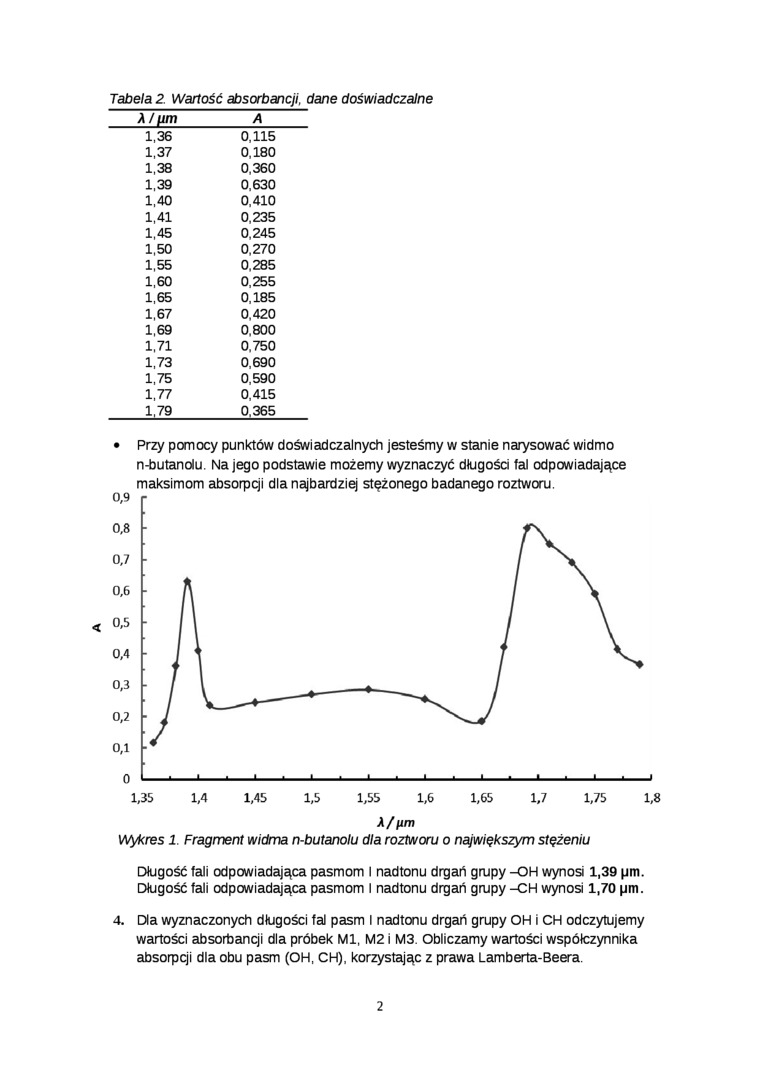
Tabela 2. Wartość absorbancji, dane doświadczalne
|
A /pm |
A |
|
1,36 |
0,115 |
|
1.37 |
0,180 |
|
1,38 |
0,360 |
|
1,39 |
0,630 |
|
1,40 |
0,410 |
|
1,41 |
0,235 |
|
1.45 |
0,245 |
|
1,50 |
0,270 |
|
1,55 |
0,285 |
|
1,60 |
0,255 |
|
1,65 |
0,185 |
|
1.67 |
0,420 |
|
1,69 |
0,800 |
|
1,71 |
0,750 |
|
1.73 |
0,690 |
|
1.75 |
0,590 |
|
1,77 |
0,415 |
|
1.79 |
0,365 |
• Przy pomocy punktów doświadczalnych jesteśmy w stanie narysować widmo n-butanolu. Na jego podstawie możemy wyznaczyć długości tal odpowiadające maksimom absorpcji dla najbardziej stężonego badanego roztworu.
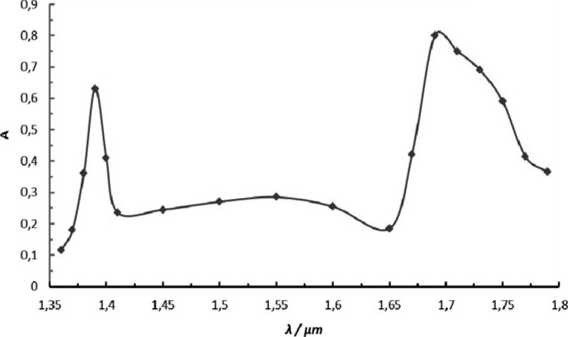
Wykres 1. Fragment widma n-butanolu dla roztworu o największym stężeniu
Długość fali odpowiadająca pasmom I nadtonu drgań grupy -OH wynosi 1,39 pin. Długość fali odpowiadająca pasmom 1 nadtonu drgań grupy -CH wynosi 1,70 pm.
4. Da wyznaczonych długości fal pasm I nadtonu drgań grupy OH i CH odczytujemy wartości absorbancji dla próbek Ml, M2 i M3. Obliczamy wartości współczynnika absorpcji dla obu pasm (OH, CH), korzystając z prawa Lamberta-Beera.
2
Wyszukiwarka
Podobne podstrony:
Tabela 1. Wartości absorbancji A wraz z wyznaczonymi stężeniami początkowymi Co, T=24,5°C nr
skanowanie0015 Znaczenie wartości Km i Vmax. Dane doświadczalne wskazują, jjg ty przjpadkji wieluenż
Slajd30 4 Rodzaje danych w GIS • Dane tabelaryczne - wartości opisujące wybrane wi
Dane doświadczalne przewodność wody (k) - 5,61 pS-cm ł Tabela 1. Dane doświadczalne. Przewodność
Dane doświadczalne przewodność wody (k) = 5,61 p-S-cm 1 Tabela 1. Dane doświadczalne. Przewodność
Dane doświadczalne przewodność wody (k) - 5,61 p-S-cm ł Tabela 1. Dane doświadczalne. Przewodność
skanuj0255 (3) 268 PHP i MySQL dla każdego Tabela 9.1. Wartości parametru prawa polecenia GRANT Nazw
więcej podobnych podstron