89832
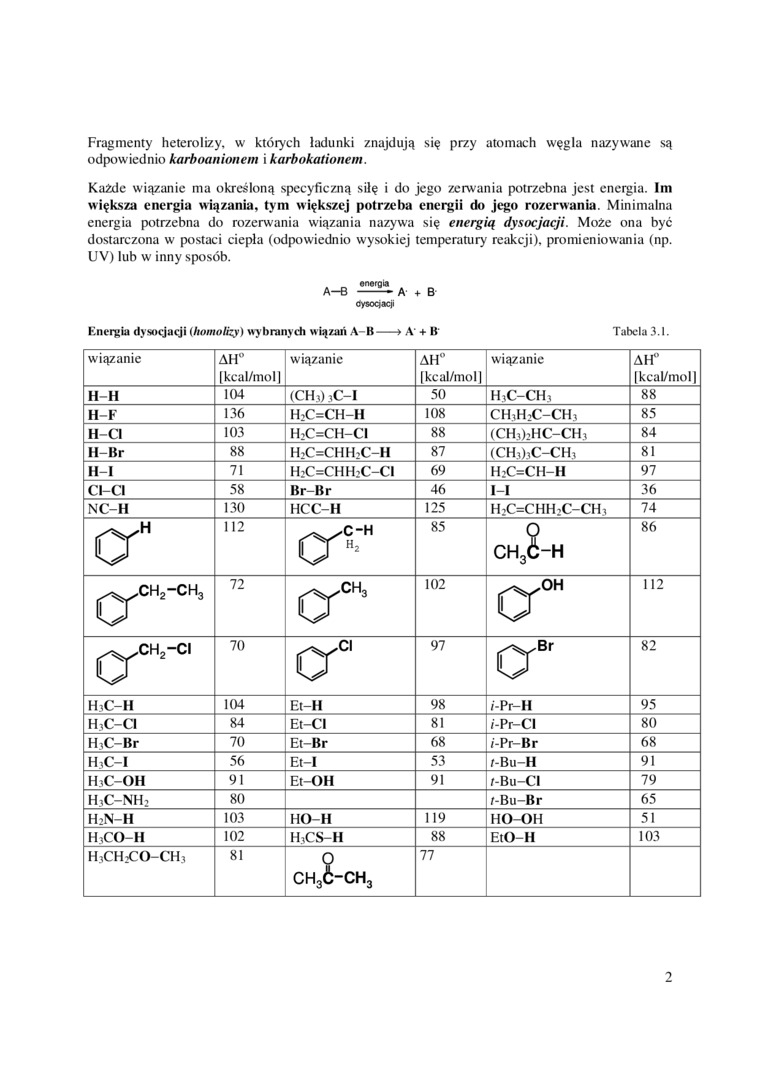
Fragmenty heterolizy, w których ładunki znajdują się przy atomach węgla nazywane są odpowiednio karboanionem i karbokationem.
Każde wiązanie ma określoną specyficzną siłę i do jego zerwania potrzebna jest energia. Im większa energia wiązania, tym większej potrzeba energii do jego rozerwania. Minimalna energia potrzebna do rozerwania wiązania nazywa się energią dysocjacji. Może ona być dostarczona w postaci ciepła (odpowiednio wysokiej temperatur)' reakcji), promieniowania (np. UV) łub w inny sposób.
A-e
dysocjacji
Kncrgia dysocjacji (homolizy) wybranych wiązań A-B-► A' + B' Tabela 3.1.
|
wiązanie |
AH° (kcal/mol| |
wiązanie |
AH° [kcal/mol] |
wiązanie |
AH° [kcal/mol] |
|
H-H |
104 |
(CH3) 3C-I |
50 |
H3C-CH3 |
88 |
|
H-F |
136 |
H2C=CH-II |
108 |
CH,H2C-CH3 |
85 |
|
H-CI |
103 |
HsOCH-CI |
88 |
(CHO2HC-CH3 |
84 |
|
H-Br |
88 |
h2c=chh2c-h |
87 |
(CHO3C-CH3 |
81 |
|
II-I |
71 |
h2c=chh2c-ci |
69 |
H2C=CH-H |
97 |
|
CI-CI |
58 |
Br-Br |
46 |
I-I |
36 |
|
NC-H |
130 |
HCC-H |
125 |
h2c=chh2c-ch, |
74 |
|
a" |
112 |
a-7” |
85 |
ch3?-h |
86 |
|
^xh2-ch3 u |
72 |
ęr |
102 |
Q 0 1 |
112 |
|
0 1 CM I o b |
70 |
ac' |
97 |
aB' |
82 |
|
HjC-H |
104 |
Et-H |
98 |
/-Pr-H |
95 |
|
HjC-Cl |
84 |
Et-CI |
81 |
i-Pr-CI |
80 |
|
HjC-Br |
70 |
Et-Br |
68 |
/-Pr-Br |
68 |
|
H,C-I |
56 |
Et-I |
53 |
r-Bu-H |
91 |
|
H3C-OH |
91 |
Et-OH |
91 |
/-Bu-CI |
79 |
|
h?c-nh2 |
80 |
t-Bu-Br |
65 | ||
|
H2N-H |
103 |
HO-H |
119 |
HO-OH |
51 |
|
H,CO-H |
102 |
HiCS-II |
88 |
EtO-H |
103 |
|
H3CH2CO-CH3 |
81 |
ch3ć-ch3 |
77 |
2
Wyszukiwarka
Podobne podstrony:
222 Badanie powierzchni ziemi. krajach związkowych, znajdujących się przy oceanie Spokojnym,
0000054 (10) ogólnie znanych i łatwo rozpoznawalnych postaci chorób kości, których opisy znajdują si
13 sprzedaż po zaniżonej cenie działek, na których znajdują się znaczne pokłady węgla). Z powodu afe
skanuj0065 2 Pokoloruj tylko te obrazki, w nazwach których głoska n znajduje się w środku wyrazu. Ro
Sport5 w każdym wyrazie jest litera, która powtarza się dwa razy. Wpisz ją do kółka. Liczby znajdują
Egzamin z fizyki I termin — zadania 1. Dwa ładunki q i — q znajdują się w odległoś
Rozwiąż poniższe zadania, a następnie zaznacz poprawne odpowiedzi. Zamaluj litery, które znajdują si
Warzywnictwo028 znajdującego się przy szypułce, a także po charakterystycznym chrzęście owocu przy ś
6 18 6.18.R. a) Na fragment liny o masie dm, znajdujący się w odległości x od jej końca, działa sił
6 (649) *c) http://assessment.netacad.net - Mozilla Firefox A Administrator sieci znajdujący się prz
c2 (4) 2UKŁAD POMIAROWY Schematy zasilania poszczególnych zespołów probierczych znajdują się przy ka
więcej podobnych podstron