3389187502
1. ELEMENTARNE PRAWA I POJĘCIA CHEMICZNE
Pierwiastek chemiczny jest to zbiór atomów o jednakowej liczbie protonów.
Miarą liczebności materii jest mol, czyli ilość substancji, która zawiera taką liczbę atomów, cząsteczek, jonów bądź innych cząsteczek materialnych, ile atomów znajduje się w 12 g węgla 12C.
Ilość ta nosi nazwę liczby Avogadra (NA) i wynosi:
Aa = 6,023-1023
1 mol - wagowo to liczba gramów odpowiadająca masie atomowej pierwiastka lub masie cząsteczkowej związku chemicznego. Mole różnych substancji różnią się masą i objętością.
Za jednostkę masy atomowej przyjęto 1/12 masy izotopu węgla 12C, wyrażoną symbolem „u” (unit).
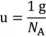
Wartość u wynosi = 1,6603-10'24 g
Masa atomowa pierwiastka jest to średnia ważona z mas izotopowych naturalnej mieszaniny izotopów, wyrażona w jednostkach masy atomowej (u).
Masa cząsteczkowa jest to masa cząsteczki związku chemicznego, wyrażona w jednostkach masy atomowej u. Masa cząsteczkowa w gramach jest równa liczbowo sumie mas atomów wchodzących w skład cząsteczki, wyrażonej w u i pomnożonej przez 1,6603-10'24 g.
Masa molowa (M) substancji jest to masa jednego mola molekuł tej substancji (atomów, cząsteczek, jonów, elektronów itp.) wyrażona w gramach. Jest to ilość gramów danej substancji liczbowo równa ilości jednostek masy cząsteczkowej u. Jest ona równa liczbowo masie atomowej lub cząsteczkowej danej substancji.
Prawo, które sformułował Avogadro. pozwala na łatwe obliczanie ilości substancji gazowych w eksperymentach, które łatwiej odmierzać niż ważyć. Tak więc w równych objętościach różnych gazów, w tych samych warunkach ciśnienia i temperatury, znajduje się taka sama ilość molekuł.
Mol dowolnego pierwiastka lub związku w stanie gazowym w warunkach normalnych (tj. 0° C, 1013 hPa) zajmuje zawsze objętość równą około 22,4 dm3. Ta objętość jest nazywana objętością molową gazów.
Jednostką energii jest elektronowolt (eV )
1 eV = 1,602-10‘,9J.
11
Wyszukiwarka
Podobne podstrony:
1. Pierwiastek chemiczny jest to: a) zbiór atomów o takiej samej
SPIS TREŚCI 1. ELEMENTARNE PRAWA I POJĘCIA CHEMICZNE............. 11 2.
Pojęcia podstawowe System informatyczny - jest to zbiór powiązanych ze sobą elementów, którego funkc
Pierwiastek chemiczny-atom Podstawowym pojęciem w chemii jest pierwiastek chemiczny. Jest to
Photo2503 Wybuch lub inaczej eksplozja chemiczna jest to gwałtowna reakcja chemiczna połączona z&nbs
9. Olimpiada Chemiczna Jest to wizytówka nie tylko Towarzystwa, ale całej polskiej chemii !!!. W oli
biotermo5 2. Potencjał chemiczny - jest to wielkość charakterystyczna dla danej substancji, określa
Inżynieria Chemiczna i Procesowa Reaktor chemiczny jest to, w najprostszym ujęciu, naczynie przystos
więcej podobnych podstron