5020057790
Budowa cząsteczek - Wiązanie jonowe -
A1 2 - Bm,Att - An,Am,By a3 ,An,Am ' pierwiastki elektrododatnie
bv>bvi,,s*4 - przyjmują elektrony z grup I,II,III; E=4-8eV
- Wiązania kowaientne - dwa pierwiastki tego samego rodzaju Hz, Oa, Nz, Elektrony walencyjne mają spiny przeciwne.
Ciała stałe - czwarta grupa układu okresowego.
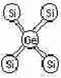
Si Ce
E=6- 10eV
- Wiązania wodorowe « o
O if 0‘
- Wiązania van der Waisa (fluktującego dipolu ) - zewnętrzna powłoka jest całkowicie wypełniona E=0,01-
0. 1.V
Rodzaje energii występujące w cząsteczkach.
1. Energia ruchu translacyjnego (postępowego) - zmienia się w sposób ciągły.
2. Energia poziomów energetycznych atomowych
E=l-10eV
3. Energia poziomów oscylacyjnych.
& --h» \v+ i y- liczba kwantowa
osc eurcl 2 I
B = Kf^io'5*? V=0,l,2,3,....
F=-kx (proporcjonalna do wychylenia)
X - (miara wychylenia ze stanu równowagi)
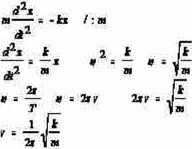
Częstotliwość oscylacji: L- moment pędu cząsteczki J - moment bezwładności określający rozkład masy w obrębie cząsteczki
4.Energia poziomów rotacyjnych
b = — l = nJĄj +1)
2J
J - liczba kwantowa odpowiadająca całkowitemu momentowi pędu cząsteczki, J=L+S ( suma wszystkich momentów składowych + wszystkie momenty spinowe)
B = 10' *eV ł 10' 6eV
Układ poziomów energetycznych w cząsteczkach.
r=2
r»?ni#a v)
vv*iwii 1 pcccn ajJ/Kyjta rwlzęyjne
Widma cząsteczkowe.
Źródłem są przejścia pomiędzy poziomami elektronowymi w atomach tworzących cząsteczkę.
X = światło widzialne - ultrafiolet (0,lnm - lpm)
Przejścia związane z przejściami elektronów między poziomami oscylacyjnymi. A.= 10jj.m - lOOpm (podczerwone)
Przejścia związane z przejściem elektronów pomiędzy poziomami rotacyjnymi A,= l - lOO^im (zakres mikrofalowy)
Zjawisko fluorescencji - Doświadczenie z parami jodu.
1. Elektrony w atomach jodu przechodzą do wyższych poziomów energet. (wzbudzanie elektronów) (barwa czerwona)
2. Elektrony przechodzą z wyższego poziomu na niższy emitując promieniowanie (barwa zielona)
Fluorescencja
Wyszukiwarka
Podobne podstrony:
BUDOWA CZĄSTECZEK - WIĄZANIA 1. Cząsteczka = trwałe połączenie 2 lub więcej
DSC00011 (25) kołaoenu Budowa cząsteczki Pomiędzy nićmi występują wiązania wodorowe, na jeden skręt
2 (1066) 2008-12-19Wiązania jonoweOddziaływanie cząsteczka - jon (dysocjacja jonowa)Wiązania jonowe
odp bud cz?s 3 Budowa atomu i cząsteczki b) H —-Ol Ba2+ IO — H Rb+
zagadnienia z biofizyki elektryka[1] I Budowa materii a) wiązania między atomami. •» wiązania międz
P1050456 Wiązanie jonowe wg kwantowej teorii wiązań Powstanie cząsteczki NaClB B U
43169 img055 (42) wiązania w cząsteczce były jonowe. Stopień utlenienia ustalamy posługując się nast
Zdjęcie0932 Wiązanie jonowe■i • Nie ma ono v.yró!nlonegokierunku •
więcej podobnych podstron