1954687383
ł jest równa ilości wymienionego w rozpatrywanej przemianie ciepła
/ 8Qv=coast = tiCv(Tb — Ta),
Ja
zaś wykonana praca to
rB
/ <5WV=const = 0.
3.3.2. Przemiana izobaryczna
W tej przemianie pojemność cieplna n moli gazu doskonałego wynosi
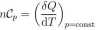
a praca 8W = pdV. Z I zasady termodynamiki nCpdT = dU + pdV = nCydT + pdV.
Ponieważ pdV = nRdT (dlaczego?), to nCpdT — nCydT = nR d T, co prowadzi do wzoru Mayera (1814-1878)
Cp-Cv = R- (18)
Ilość wymienionego w tej przemianie ciepła wynosi
J 8QP=const = uCp(Tb — Ta),
wykonana praca
r 8Wp=const = Fpdv = p(VB - VA),
Ja Ja
a całkowita zmiana energii wewnętrznej
F d£/p=const = vCv(Tb — Ta).
Ja
3.3.3. Przemiana izotermiczna
Temperatura gazu pozostaje stała, zatem
rB
/ dUT=coast = 0,
Ja
tj. w tej przemianie U = const.
Zadanie 18. Uzasadnić ostatnią równość.
Z I zasady termodynamiki wynika więc, że 8WT=const <^Qr=const-
Policzmy wartość pracy w przemianie izotermicznej:
rB rvb dV Vr Vr
Wr=Const — / pdV — const • / — — const • ln— = nRT ln —. (19)
Ja Jva V Va Ka
gdzie const = nRT, co wynika z równania Clapeyrona (3).
Zadanie 19. Uzasadnić ostatnią równość.
Całkowita ilość ciepła Qt=const wymienionego w tej przemianie wynosi
Qt=const = Wr=const. (20)
Na przykładzie tej przemiany możemy zrozumieć bliżej pojęcie przemiany kwazistacjonarnej. Gdybyśmy zbyt szybko poruszali tłokiem, pod którym znajduje się gaz, to ciśnienie wywierane przez gaz byłoby nieco mniejsze od ciśnienia wynikającego z równania izotermy. Zatem wykonana przez gaz praca byłaby mniejsza od pracy gazu wykonanej w warunkach równowagowych,
17
Wyszukiwarka
Podobne podstrony:
img096 (6.25) y2 _ -X- N ■ min (r- l,c- 1) Jeżeli ilość wierszy jest równa ilości kolumn, obydwa mie
skan0049 (3) 52 Termodynamika chemiczna Zmiana entalpii jest równa ciepłu wymienionemu przez układ z
5.5. FALOWNIKI SZEREGOWE 249 jest równa częstotliwości wytwarzanego napięcia przemiennego. Zmiana
0000037 (13) wytwarzany na jednostkę czasu w wyniku przemiany materii jest równy ilości ciepła oddaw
W tych warunkach strumień wymienianego ciepła qTG =0, rezystancja term orezy stora jest równa Rr = /
61297 str036 037 Elementy sterowania i wyposażenie wewnętrzne Ogrzewanie Powie trze jest kierowane p
dla kilku przemieszczanych mas sumaryczna zmiana momentu jest równa: k XAMyp — i.
więcej podobnych podstron