5600235791
Destylacja T-4
Technika laboratoryjna
T-4
DESTYLACJA
(opracowała Jadwiga Laska)
Wprowadzenie
Desty lacja jest jedną z najważniejszych metod rozdzielania i oczyszczania substancji ciekłych. Jest to proces polegający na ogrzewaniu cieczy do temperatury' wrzenia i skraplaniu powstających oparów w chłodnicy. Skroplmy jako destylat zbiera się w odbieralniku. Jeśli podczas desty lacji cala ilość powstających oparów wykraplana jest i zbierana jako destylat to taką desty lację nazywamy destylacją prostą. Zestaw do destylacji prostej przedstawia rys. T-4_l). Jeśli natomiast część skondensowanych oparów stale spływa do kolby destylacyjnej, destylację nazywamy rektyfikacją. Zestaw do rektyfikacji składa się, oprócz kolby, chłodnicy i odbieralnika, z kolumny włączonej pomiędzy kolbę i chłodnicę (ry s. T-4 2).
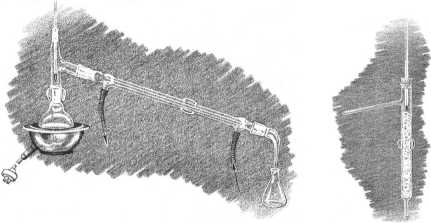
Rys. T-41. Zestaw do destylacji prostej. Rys. T-4 2. Kolumna do rektyfikacji.
Jeśli destylacji poddamy mieszaninę dwóch lub więcej substancji, całkowite ciśnienie par nad cieczą jest równe sumie ciśnień cząstkowych par wszystkich składników, które z kolei są funkcją ich ułamków molowy ch w roztworze (wyjątek stanowią jedynie mieszaniny azeotropowe).
Zgodnie z prawem Rauolta, ciśnienie cząstkowe składnika lotnego w roztworze doskonałym jest równe iloczynowi ciśnienia par czystego składnika i jego ułamka molowego w roztworze. Analogicznie, jeśli mieszanina składa się z dwóch lotnych składników, ich ciśnienia cząstkowe można wyrazić wzorami:
Pa = PAxA Pb = PbXB
gdzie: Pa.Pb-ciśnienia cząstkowe składników A i B PA. Pb ciśnienia par czystych składników xa.Xb - ułamki molowe składników A i B w roztworze.
Ciśnienie całkowite nad roztworem jest sumą ciśnień cząstkowych:
P = Pa + Pb = PAxA + PBxB
W przypadku wrzenia cieczy P - P„,m.
Jak wynika z powyższych wzorów, jeśli oba składniki zawarte w roztworze mają podobną lotność, wówczas oba zawsze są obecne również w fazie gazowej i niemożliwe jest rozdzielenie ich w desty lacji prostej. Desty lacja prosta może być yvięc z powodzeniem wvkorzystvwana do oczyszczania
Wyszukiwarka
Podobne podstrony:
Synteza Octan amylu S-lS-1SYNTEZA OCTANU n-AMYLU (opracowała Jadwiga Laska) Wprowadzenie Większość
Krystalizacja T-2 Technika laboratoryjnaT-2KRYSTALIZACJA (opracowała Jadwiga
Destylacja T-4 Technika laboratoryjna pojedynczych substancji ciekłych, lub rozdziału roztworów, w
Technika laboratoryjna Temperatura topnienia T-lT-1OZNACZANIE TEMPERATURY TOPNIENIA (opracowała Jadw
Technika laboratoryjna Temperatura wrzenia T-3T-3WYZNACZANIE TEMPERATURY WRZENIA (opracowała Jadwiga
Materiały pomocnicze do projektowania z przedmiotu:Wprowadzenie do Techniki Ćwiczenie nr 1 Opracował
Materiały pomocnicze do projektowania z przedmiotu:Wprowadzenie do Techniki Ćwiczenie nr 2 Opracował
WSTĘP Skrypt pt. „TECHNOLOGIA METALI Laboratorium" został opracowany w dwu częściach. Pierwsza
Zdjęcie552 Dalszy rczu ój wirusologii wiązał się z rozwojem technik laboratoryjm ch i metod pozwalaj
img149 6. Opracowanie wyników pomiarów6.1. Wprowadzenie Analiza wyników pomiarów j
skanuj0008 (310) 170 Ćwiczenia laboratoryjne z fizyki21.4. Opracowanie wyników pomiarów 1. &nb
SPIS TREŚCI I. OPIS TECHNICZNY I OBLICZENIA. I. PODSTAWA OPRACOWANIA. 3.
-i
więcej podobnych podstron