274845120
zanieczyszczeń powstających w procesie produkcyjnym, a przez to niekonkurencyjna z syntezą chemiczną. Z drugiej strony, prace nad wykorzystaniem enzymu - tyrozynazy, jako biokatalizatora reakcji przekształcania aminokwasu tyrozyny w L-DOPA, wykazały wyraźną opłacalność ekonomiczną takiego podejścia, szczególnie w związku z dużą trwałości enzymu i łatwością jego oddzielenia od mieszaniny reakcyjnej.
Tyrozynaza (EC 1.14.18.1) jest szeroko rozpowszechniona w organizmach żywych. Obecność tego enzymu stwierdza się zarówno w mikroorganizmach, jak i w komórkach roślin. Natomiast w organizmach ssaków największą aktywność tyrozynazy wykrywa się w melanocytach, gdzie jest ona kluczowym enzymem szlaku syntezy melaniny, barwnika nadającego skórze charakterystyczne zabarwienie.
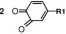
Tyrozynaza może katalizować dwie różne reakcje chemiczne: a) hydroksylację monofenoli do o-difenoli:

HO
o-difenol
monofenol
b) utlenianie o-difenoli do o-chinonów:
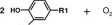
HO
o-difenol
o-chinon
H20
Spośród różnorodnych związków chemicznych o charakterze monofenoli, tyrozyna wydaje się być najważniejszym substratem tyrozynazy. Enzym ten wydajnie hydroksyluje tyrozynę do L-DOPA (o-difenol, por. powyżej), a następnie umożliwia przekształcenie cząsteczek L-DOPA do dopachinonów (o-chinon). Proces powstawania dopachinonów można zablokować przez dostarczenie do środowiska reakcji związków chemicznych o właściwościach silnie redukujących, np. askorbinianu lub NADH, co sprawia, że jedynym produktem reakcji katalizowanej przez tyrozynazę jest L-DOPA. Możliwość tę wykorzystuje się w procesie enzymatycznej produkcji L-DOPA, a pomiar ilości powstającej L-DOPA w czasie pozwala określić aktywność użytej tyrozynazy.
Powszechnie stosowaną, czułą i prostą metodą detekcji oraz ilościowego oznaczania L-DOPA w próbach nie zawierających innych o-difenoli (np. adrenaliny, 2,3-dihydroksybenzoesanu etc.) jest chemiczne przekształcenie tego aminokwasu do dinitrochinonu. Ponieważ powstały związek charakteryzuje się intensywnym, czerwonopomarańczowym zabarwieniem, możliwe jest oznaczenie jego zawartości metodami kolorymetrycznymi (1 = 460 lub 390 nm). Proces derywatyzacji L-DOPA do dinitrochinonu przebiega w dwóch kolejnych reakcjach chemicznych:

L-DOPA dinitropochodna
(o-difenol) L-DOPA
(żółte zabarwienie)
a) nitrowania L-DOPA do dinitropochodnej o charakterystycznym żółtym zabarwieniu:
b) utlenienia dinitropochodnej L-DOPA do dinitrochinonu w obecności jonów wodorotlenowych:
Celem ćwiczenia jest zapoznanie się z enzymatyczną metodą produkcji L-DOPA z wykorzystaniem tyrozynazy uzyskanej z pieczarki dwuzarodnikowej (Agaricus bisporus).
Wyszukiwarka
Podobne podstrony:
skanuj0018 (218) 31) erupcji otwartej — rozumie się przez to niekontrolowany wypły
Politechnika WrocławskaLogistyka produkcji Proces produkcji - jest to transformacja wchodzących do s
J&oęcs_p_roilukcyjny i jego elementy - charaktery sty k<i Proces produkcyjny jest to świadome
lichtarski (56) 112 *. Potencjał i driaUlnołź gospodarcza pncdiiętaioretwł procesu produkcyjnego. Są
Proces produkcyjny jest to zbiór świadomych czynności zmierzających do przekształcenia surowców w pr
6 • rozszerzoną odpowiedzialność producenta za odpady powstające w procesie produkcyjnym, jak i w pr
83724 Program dla nowych Konsultantek k03 k04 cz2 Fima Avon powstało w 1886 roku. Przez to wszystkre
Zanieczyszczenia przemysłoweAGH - jB Powstają podczas procesów produkcyjnych
CCF20121114�011 Kortykosteroidy Są to hormony steroidowe produkowane przez część korową nadnerczy. P
Kortykosteroidy, Gestageny Kortykosteroidy Są to hormony steroidowe produkowane przez część korową n
10751758`228652656661803789424 n 8. Zdolność produkcyjna to: a) całkowita ilość produktu powstała w
CCF20121114�011 Kortykosteroidy Są to hormony steroidowe produkowane przez część korową nadnerczy. P
Kortykosteroidy, Gestageny Kortykosteroidy Są to hormony steroidowe produkowane przez część korową n
więcej podobnych podstron