
POLSKIE WWW
ŚWIATOWE WWW
Układ okresowy
Powłoki
Obliczenia
Definicje
Linki do tematu
Chemia organiczna
Chemia ogólna
POWRÓT
Pochodne węglowodorów
Spis treści rozdziału - tutaj kliknij
Aminy
Nitrozwiązki
Kwasy sulfonowe
Aminy
Spis treści rozdziału - tutaj kliknij
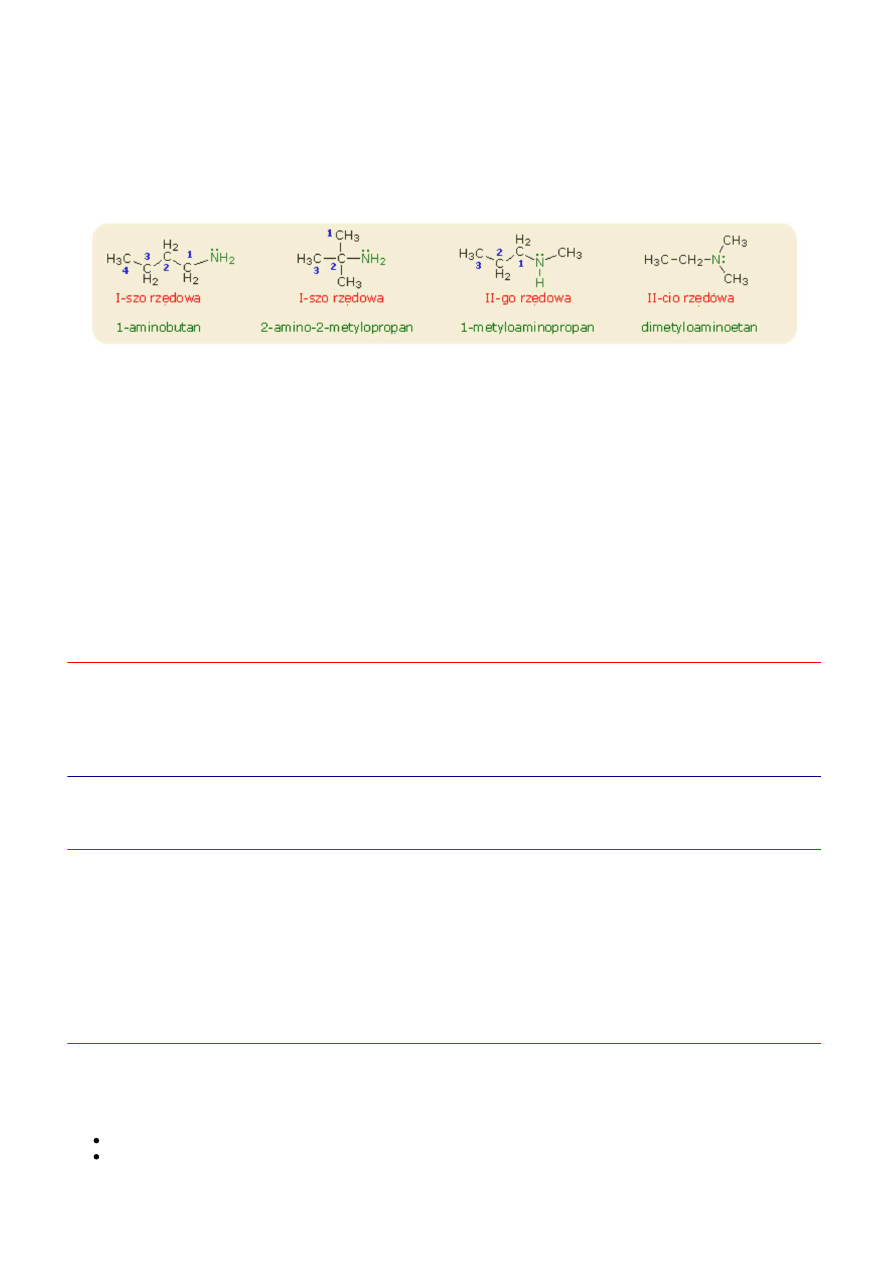
Nazewnictwo
Reakcje chemiczne
Nazewnictwo
Grupa funkcyjna Z = -NH
2
tworzy aminy I-rzędowe, -NH- tworzy aminy II-rzędowe, =N- tworzy aminy III-rzędowe
Nazwy amin alifatycznych tworzy się przez dodoanie przyrostka -amina do nazwy grupy lub grup alkilowych związanych z
atomem azotu.
Przykłady:
metyloamina
CH
3
-NH
2
dimetyloamina
(CH
3
)
2
NH
trimetyloamina
(CH
3
)
3
N
Aminy aromatyczne nazywa się na ogół jako pochodne najprostszej aminy aromatycznej - aniliny
Przykłady:
fenyloamina, anilina
C
6
H
5
-NH
2
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna10.htm
1 z 4
2012-01-22 22:13
Otrzymywanie i reakcje chemiczne
Aminy można uważać za produkty podstawienia grupami alkilowymi albo jednego, dwóch albo trzech atomów wodoru w
cząsteczce amoniaku.
Dlatego rzędowość amin wiąże się z rzędowością atomów azotu.
CH
3
NH
2
metyloamina , I-sz rzędowa
(CH
3
)
2
NH dimetyloamina , II-go rzędowa
(CH
3
)
3
N trimetyloamina, III-cio rzędowa
Otrzymywanie
Najprostszą metodą otrzymywania amin jest alkilowanie amoniaku
RBr + NH
3
+ NaOH --> RNH
2
+ H
2
O + NaBr
Obecność wolnej pary elektronowej przy azocie nadaje przede wszystkim trzem rodzajom amin charakter zasadowy
RNH
2
+ HOH --> [RNH
3
]
+
+ OH
-
Stałe dysocjacji amin alifatycznych są rzędu 10
-4
do 10
-5
, tzn. zbliżone wielkością do zasadowości roztworów wodnych
amoniaku. Mniejszą zasadowość wykazują aminy aromatyczne. ich stałe dysocjacji sa rzedu 10
-8
do 10
-13
.
Aminy z kwasami tworzą dobrze rozpuszczalne w wodzie sole aminowe.
RNH
2
+ HCl --> RNH
3
Cl
Czwartorzędowe sole aminowe maja charakter typowych soli nieorganicznych, a czwartorzędowe zasady amoniowe nie różnią
się mocą od wodorotlenku sodu.
Nitrozwiązki
Spis treści rozdziału - tutaj kliknij
Nazewnictwo
Reakcje chemiczne
Nazewnictwo
Grupa funkcyjna Z = -NO
2
tworzy związki typu R-NO
2
nitroalkany (nitroparafiny), Ar-NO
2
nitroareny (nitrozwiązki aromatyczne)
W nazwie po przedrostku
nitro
dodaje się nazwę alkanu lub arenu
Przykład:
nitrometan
CH
3
NO
2
nitrobenzen
C
6
H
5
NO
2
Otrzymywanie i reakcje chemiczne
Nitrozwiązkami nazywamy połączenia zawierające grupę nitrową - NO
2
, związaną bezpośrednio z atomem węgla.
Nitrozwiązki otrzymuje się następującymi metodami:
bezpośredniego nitrowania
metody pośrednie
Przykłady:
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna10.htm
2 z 4
2012-01-22 22:13
Bezpośrednie nitrowanie
a)
węglowodory aromatyczne
nitruje się w reakcji elektrofilowej najczęściej kwasem azotowym w obecności kwasu siarkowego,
na przykład.
C
6
H
6
+ HNO
3
--> C
6
H
5
NO
2
+ H
2
O
Produktem jest w tym przypadku jest nitrobenzen
Dalsze nitrowanie nitrobenzenu, prowadzi do otrzymania mieszaniny pochodnych meta-, orto-, para-, zawierających dwie grupy
nitrowe dołączone do pierścienia benzenowego. Udział % pochodnych w tej mieszaninie jest następujący
meta- 88%
orto- 7%
para- 1%
b)
węglowodory alifatyczne
, alkany nitruje się w reakcji podstawienia wolnorodnikowego
O
2
N-NO
2
--> 2 NO
2
.
R-H + NO
2
.
--> R
.
+ HNO
2
R
.
+ NO
2
.
--> R-NO
2
(nitroalkan)
w reakcji produktem ubocznym jest azotyn alkilu R-O-N=O
Metody pośrednie
Jedną z metod pośrednich należy wymienić reakcję halogenoalkanów z azotynem sodu, potasu albo srebra.
R-X + Na-O-N=O --> R-NO
2
(nitrozwiązek) + R-O-N=O (azotyn alkilu)
Nitrozwiązki
są to ciecze albo ciała stałe nierozpuszczalne w wodzie, silnie toksyczne. Najbardziej chrakterystyczna reakcją dla
nitrozwiązków jest reakcja redukcji do amin
Przykład
C
6
H
5
NO
2
--> C
6
H
5
NH
2
Nitroparafiny sa dobrymi rozpuszczalnikami. Stosowane są jako paliwa rakietowe.
Nitroareny służą jako półprodukty w przemyśle organicznym.
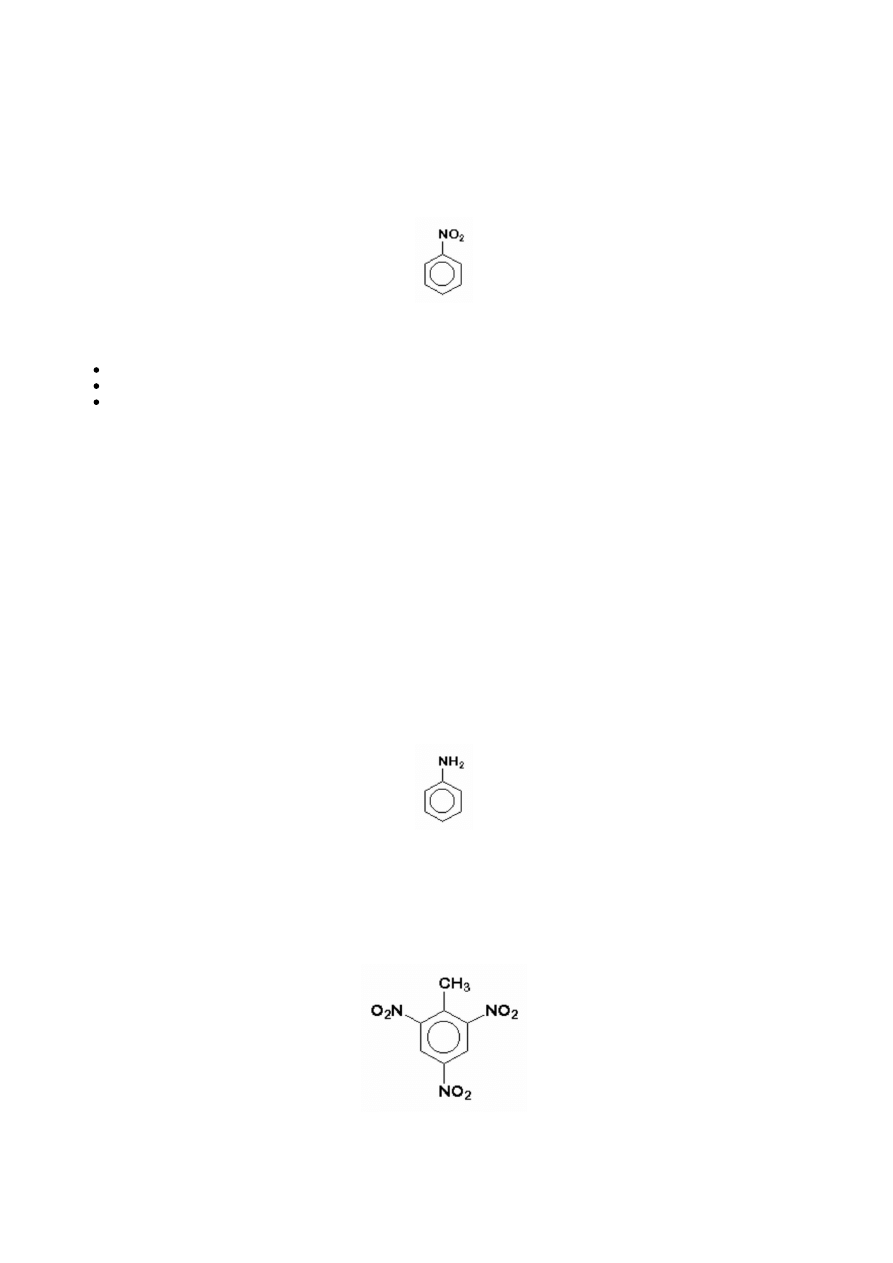
Największe zastosowanie nitrozwiązków jest w produkcji materiałów wybuchowych, z których najbardziej znany jest
trójnitrotoluen
(TNT, TROTYL) oraz kwas pikrynowy
Trójnitrotoluen
Kwas pikrynowy
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna10.htm
3 z 4
2012-01-22 22:13

Kwasy sulfonowe
Spis treści rozdziału - tutaj kliknij
Nazewnictwo
Reakcje chemiczne
Nazewnictwo
Grupa funkcyjna Z = -SO
3
H grupa sulfonowa w połączeniach tworzy związki typu R-SO
3
H, Ar-SO
3
H (kwasy sulfonowe)
Przykłady
kwas metanosulfonowy
CH
3
-SO
3
H
kwas benzenosulfonowy
C
6
H
5
-SO
3
H
Reakcje chemiczne
Specyficzne znaczenie kwasów sulfonowych w chemii związków aromatycznych polega na tym, że grupa sulfonowa może być
łatwo podstawiona innymi grupami funkcyjnymi, a ponieważ wiele kwasów sulfonowych otrzymuje się stosunkowo łatwo, są one
używane zarówno w laboratorium, jak i w przemyśle jako łatwo dostępne półprodukty do syntezy różnych pochodnych szeregu
benzenu. Kwasy sulfonowe podlegają następującym reakcjom;
hydrolizy, stapiania z alkaliami, stapiania z cyjankami, redukcji.
Hydroliza
Przy działaniu na kwasy sulfonowe parą wodną w obecności kwasów mineralnych zachodzi łatwo reakcja odwrotna do
reakcji sulfonowania (usuwanie grupy sulfonowej), przy czym powstają ponownie węglowodory aromatyczne.
CH
3
-C
6
H
4
-SO
3
H + H
2
O --> CH
3
-C
6
H
5
+ H
2
SO
4
Stapianie z alkaliami
Podczas stapiania kwasów sulfonowych z mocnymi wodorotlenkami (NaOH) zachodzi wymiana grupy
sulfonowej na hydroksylową. W wyniku reakcji powstaje fenol i siarczan sodu.
C
6
H
5
-SO
3
Na + NaOH --> C
6
H
5
OH + Na
2
SO
4
Stapianie z cyjankami
Przy stapianiu soli kwasów sulfonowych z cyjankiem potasu zachodzi wymiana grupy sulfonowej na
cyjanową.
C
6
H
5
-SO
3
K + KCN --> C
6
H
5
-CN + K
2
SO
4
Redukcja
Przez redukcję kwasów sulfonowych można otrzymać merkaptany aromatyczne, zwane tiofenolami;
C
6
H
5
-SO
3
H + 3H2 --> C
6
H
5
-SH + 3H
2
O
Tiofenole są to związki o charakterze kwasowym o odrażającym zapachu. Przez utlenianie można je ponownie przeprowadzić w
kwasy sulfonowe.
POWRÓT
GŁÓWNA
Pojęcia i prawa
/
Reakcje chemiczne
/
Budowa atomu
/
Powłoki elektronowe
/
Układ okresowy
/
Wpływ budowy
/
Wiązania chemiczne
/
Energetyka
/
Roztwory
/
Elektrolity
/
Procesy
"Redox"
/
Elektrochemia
/
Nieorganiczna
/
Organiczna
/
Chemia w przemysle
/
Spis treści serwisu - liceum
/
Kontakt z autorem strony
/
ă
Copyright - "CHEMIA OGÓLNA - 2002 - 2006"
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna10.htm
4 z 4
2012-01-22 22:13
Wyszukiwarka
Podobne podstrony:
jednofunkcyjne pochodne weglowodorow odpowiedzi
Pochodne węglowodorów sprawdzian a
Chemia Pochodne Węglowodorów
Pochodne węglowodorów o łańcuchu rozgałęzionym
7 Jednofunkcyjne pochodne węglowodorów
Chemia Poznajemy pochodne węglowodorów zawierające azot kartkówka
JEDNOFUNKCYJNE POCHODNE WĘGLOWODORÓW
Pochodne węglowodorów Gr a
Pochodne węglowodorów Gr b
Chemia Jednofunkcyjne pochodne węglowodorów
Jednofunkcyjne pochodne węglowodorów spr 1, Biologia i Chemia, Words
09 Jednofunkcyjne pochodne węglowodorów
Pochodne węglowodorów
Gimznazjum Sprawdziany Chemia Pochodne węglowodorów klucz
Pochodne weglowodorow POWTÓRZENIE, do wykorzystania w szkole
Pochodne węglowodorów sprawdzian b
Gimznazjum Sprawdziany Chemia Pochodne węglowodorów test
więcej podobnych podstron