
Metody biotechnologiczne w ochronie środowiska
dr inż. Izabela Michalak
- 1 -
1. Podstawy procesu biosorpcji
Biosorpcja jest procesem szybkiego oraz odwracalnego wiązania jonów metali z
roztworów wodnych z grupami funkcyjnymi znajdującymi się na powierzchni ściany
komórkowej biomasy. Proces ten jest niezależny od metabolizmu komórki [1].
Charakteryzuje się tym, że jest wydajny oraz selektywny. Biosorpcja może być prowadzona
w szerokim zakresie pH (od 3 do 9) i temperatury (od 4 do 90°C), nie wymaga wysokich
nakładów inwestycyjnych, koszty operacyjne są niskie. Stan równowagi zarówno adsorpcji,
jak i desorpcji jest osiągany bardzo szybko. Materiały biologiczne wiążące jony metali są
często tanie i mogą pochodzić z przemysłowej hodowli biomasy, lub być produktem
odpadowym z przemysłu [2].
2. Statyka procesu biosorpcji
Statykę procesu biosorpcji opisują izotermy adsorpcji, przedstawiające zależność
między masą jonu metalu zaadsorbowanego przez jednostkę masy adsorbentu, a
równowagowym stężeniem jonu metalu w roztworze. Wiązanie jonów metali na powierzchni
komórek następuje szybko, a proces trwa aż do ustalenia się stanu równowagi. W Tabeli 1
przedstawiono wybrane modele opisujące statykę procesu biosorpcji w układzie
jednoskładnikowym.
Tabela 1. Wybrane modele opisujące statykę procesu biosorpcji w układzie
jednoskładnikowym
Izoterma
Równanie
Nr
Opis
Lit.
Langmuir
eq
eq
eq
bC
bC
q
q
1
max
(1)
Założenie sorpcji monowarstwowej, parametry
możliwe
do
interpretacji,
model
niestrukturalny, model 2-parametrowy.
[3]
Freundlich
n
eq
eq
KC
q
/
1
(2)
Proste wyrażenie, nie można określić
maksymalnej
pojemności
biosorpcyjnej,
model niestrukturalny, równanie empiryczne,
jest równaniem wykładniczym - może być
stosowana tylko dla niskich stężeń.
[4]
Dubinin-
Radushkevich
(D-R)
ln q
eq
= ln q
max
– β’ ε
2
ε = R’T ln(1 + 1/C
eq
)
(3)
Model stosowany jest celu rozróżnienia
biosorpcji fizycznej i chemisorpcji.
[5]
BET
S
eq
eq
S
eq
eq
C
C
B
C
C
Q
BC
q
/
)
/
)
1
(
1
(
)
(
0
(4)
Prosty model adsorpcji wielowarstwowej,
możliwość
zastosowania
równania
Langmuira do każdej warstwy adsorpcyjnej,
występuje
punkt
przegięcia,
brak
odpowiednika „całkowitej pojemności).
[6]

Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 2 -
Gdzie:
q
eq -
pojemność biosorpcyjna w stanie równowagi (mg/g lub meq/g)
q
max -
maksymalna pojemność biosorpcyjna (mg/g lub meq/g)
b - powinowactwo biomasy do sorbatu (dm
3
/mg)
C
eq -
stężenie równowagowe jonów metalu w roztworze (mg/dm
3
)
K - stała modelu Freundlicha
n - stała modelu Freundlicha
β’ - stała związana z energią adsorpcji (mol
2
/kJ
2
)
ε - potencjał adsorpcyjny (potencjał Polanyi)
T - Temperatura (K)
R’ - stała gazowa (8,314 kJ/mol
.
K)
B - stała związana z energią oddziaływania z powierzchnią (izoterma BET)
Spośród wymienionych w Tabeli 1 modeli, najczęściej równowaga pomiędzy fazą
sorbatu i fazą biosorbenta opisywana jest równaniem Langmuira (1). Model ten umożliwia
nie tylko wyznaczenie maksymalnej pojemności biosorpcyjnej danego biosorbenta - q
max
(mg/g), ale także powinowactwa sorbatu do biosorbenta - b (dm
3
/mg). Wartość q
max
oznacza
maksymalnie możliwą ilość jonów metalu związanych na powierzchni biomasy przez grupy
funkcyjne w stanie równowagi. Z kolei wysoka wartość współczynnika b wskazuje na duże
powinowactwo i odpowiada nachyleniu wykresu izotermy biosorpcji w początkowym
zakresie.
Najbardziej pożądane są biosorbenty o najwyższej możliwej q
max
i najwyższym
współczynniku b
[1]. Model Langmuira zakłada, iż na powierzchni adsorbentu znajduje się
określona liczba miejsc aktywnych, zdolnych do wiązania adsorbatu; ich liczba jest
proporcjonalna do wielkości powierzchni. Jednemu miejscu aktywnemu odpowiada jedna
cząsteczka adsorbatu, która nie ma możliwości swobodnego przemieszczania się po
powierzchni adsorbentu (adsorpcja zlokalizowana). Zgodnie z teorią Langmuira, nie
występują wzajemne oddziaływania pomiędzy zaadsorbowanymi cząsteczkami lub jonami
adsorbatu, a powstała warstwa adsorpcyjna zmniejsza oddziaływanie sił adsorpcyjnych, co
uniemożliwia powstawanie następnych warstw [7].
3. Mechanizm procesu biosorpcji
Wiązanie jonów metali przez biosorbenty pochodzenia naturalnego może zachodzić na
drodze adsorpcji - fizycznej (oddziaływania elektrostatyczne oraz van der Waalsa) lub
chemicznej: wymiana jonowa, kompleksowanie, chelatowanie (oddziaływania jonowe i
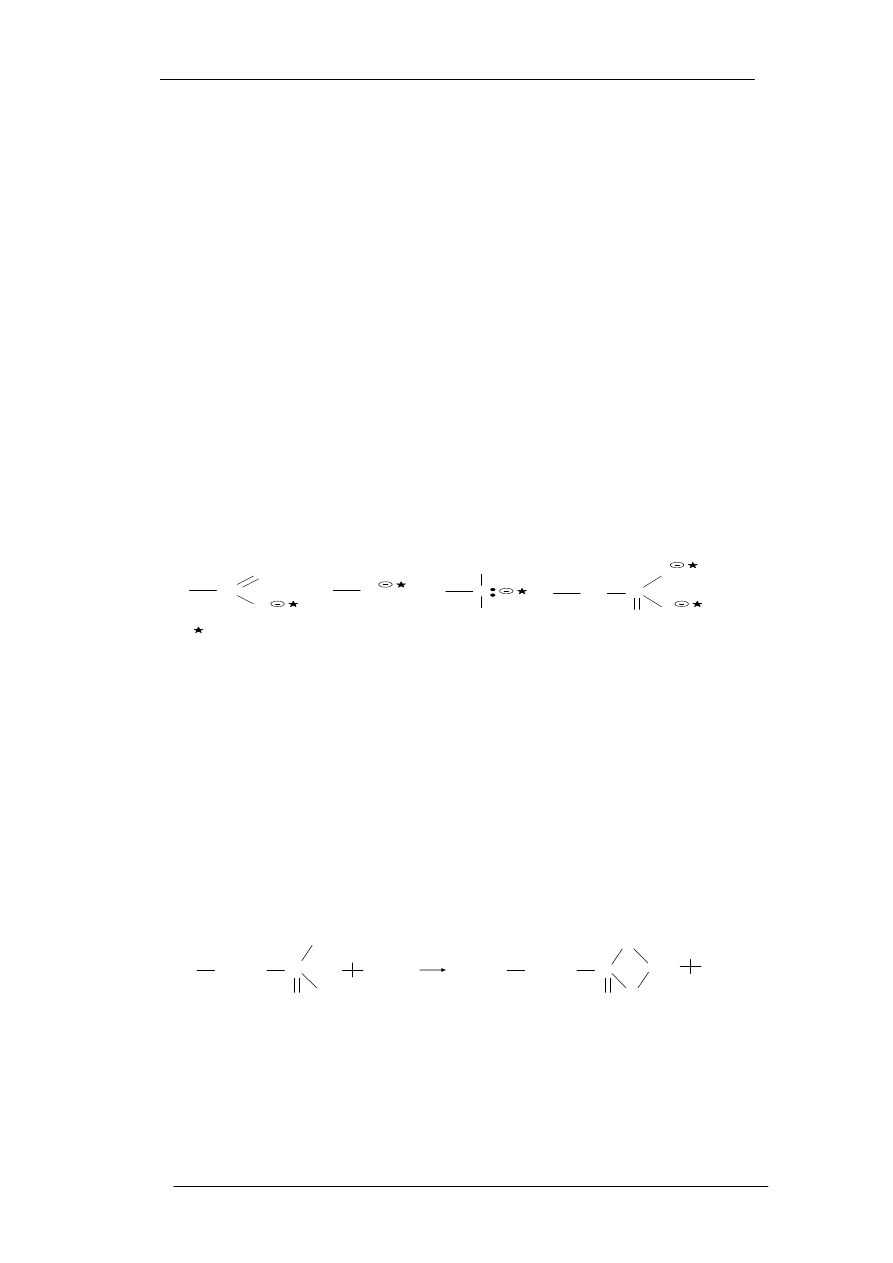
Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 3 -
kowalencyjne) [1, 8]. Wśród czynników wpływających na proces biosorpcji można wyróżnić:
właściwości fizykochemiczne jonów metali (np. masa molowa, promień jonowy, stopień
utlenienia), właściwości biosorbenta (np. budowa ściany komórkowej) oraz parametry
procesowe (np. pH, temperatura, stężenie biosorbenta, stężenie sorbatu). Analiza wpływu
parametrów na właściwości biosorpcyjne sorbentów jest warunkiem koniecznym do poznania
mechanizmu biosorpcji, który jest procesem złożonym i jak dotąd w pełni niewyjaśnionym.
Biosorpcja jest
procesem wiązania jonów mikroelementów do powierzchni komórki
makroalgi, która nie wykazuje aktywności metabolicznej [1]. Dlatego też, skład ściany
komórkowej ma duże znaczenia dla tego procesu. Ściana komórkowa biosorbentów
naturalnych zbudowana jest głównie z polisacharydów, białek i lipidów, które zawierają
liczne grupy funkcyjne (karboksylową, hydroksylową, aminową i fosforylową - Rysunek 1),
które odgrywają kluczową rolę w procesie biosorpcji kationów mikroelementów z roztworów
wodnych [1].
C
O
O
Karboksylowa
Miejsce wi
ązania jonów Me
n+
Hydroksylowa
O
Aminowa
Fosforylowa
P
O
O
O
O
N
H
H
Rysunek 1. Grupy funkcyjne znajdujące się na powierzchni ściany komórkowej naturalnych
biosorbentów
Wymiana jonowa jest jednym z dominujących mechanizmów procesu biosorpcji,
podczas której protony lub/i kationy metali lekkich (Na, Mg, Ca, K), które są naturalnie
związane z grupami funkcyjnymi znajdującymi się na powierzchni ściany komórkowej,
wymieniane są z kationami metali obecnymi w roztworze wodnym (jako przykład wymiana
jonów metalu(II) z jonami Na(I) związanymi z fosforylową grupą funkcyjną - Rysunek 2.
[9]).
P
Me
2+
O
ONa
ONa
CH
2
O
celuloza
P
O
O
O
CH
2
O
celuloza
Me
2Na
+
Rysunek 2. Wymiana jonów metalu(II) z jonami Na(I) związanymi z fosforylową grupą
funkcyjną [9]

Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 4 -
Literatura
[1] Davis T.A., Volesky B., Mucci A. A review of the biochemistry of heavy metal
biosorption by brown algae. Wat. Res., 2003, 37, 4311-4330.
[2] Kuyucak N. W: Biosorption of heavy meatals - Feasibility of biosorbents application.
CRC press, Boca Raton, 1990, 371-378.
[3] Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum. J.
Am. Chem. Soc., 1918, 40, 1361-1403.
[4] Freundlich H. Udber die adsorption in Loesungen. Z. Physik. Chem., 1907, 57, 385-470.
[5] Dubinin M.M., Raduskhevich L.V. On the characteristic curve equation for active
charcoals. Proc. Acad. Sci. U. S. S. R Phys. Chem. Sect., 1947, 55, 327-329.
[6] Brunauer S., Emmet P.H., Teller E. Adsorption of gases in multimolecular layers. J. Am.
Chem. Soc., 1938, 60, 309-314.
[7] Volesky B. W: Sorption and Biosorption - Equilibrium Biosorption Performance. BV-
Sorbex, Inc., St. Lambert, Quebec, 2004.
[8] Volesky B. W: Biosorption of heavy metals - Biosorption and biosorbents. Florida, CRC
press, 3-5, 1990.
[9] Volesky B., Holan Z.R. Biosorption of heavy metals. Biotechnol. Prog., 1995, 11, 235-
250.

Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 5 -
CZEŚĆ DOŚWIADCZALNA
Celem części doświadczalnej jest poznanie procesu wiązania jonów metali przez materiał
biologiczny w procesie biosorpcji. Wydajność procesu biosorpcji jest najczęściej opisywana
jako pojemność biosorpcyjna – q (mg/g), określana następującym wzorem:
S
eq
C
C
C
q
0
(5)
która wyraża masę jonów metalu (mg lub mmol) związanych przez 1 gram biosorbenta.
Gdzie:
C
0
– stężenie początkowe metalu w roztworze (mg/dm
3
);
C
eq
– stężenie równowagowe metalu w roztworze (mg/dm
3
);
C
S
– stężenie biomasy w roztworze (g/dm
3
).
ODCZYNNIKI
Biomasa (Tabela 2)
Uwodniony azotan chromu – Cr(NO
3
)
3
.
9H
2
O (POCh SA) (M
soli
400,15 g/mol, M
Cr
42
g/mol)
EDTA (kwas etylenodiaminotetraoctowy)
Kwas solny (0,1 mol/dm
3
) (POCh SA)
Sodu wodorotlenek (0,1 mol/dm
3
) (POCh SA)
Kwas azotowy 69 % m/m spektralnej czystości (Suprapur, Merck)
Woda dejonizowana
Bibuła filtracyjna jakościowa (średnia)
Tabela 2. Rodzaj biomasy wykorzystanej w badaniach biosorpcyjnych
Nr grupy
Biosorbent
1
Chrząstki
2
Kości kurze
3
Pszenżyto
4
Kukurydza
5
Soja
6
Jęczmień
7
Skorupy
8
Żyto
9
Włosy
10
Popiół
11
Pszenica
12
Owies

Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 6 -
SPRZĘT
Spektrokolorymetr Cary (Varian)
Analizator rtęci (AMA 254)
Mikroskop świetlny (Carl Zeiss)
Piec mikrofalowy (Milestone Start D)
pH metr (Mettler Toledo)
Łaźnia wodna (GFL, Typ 1003)
Wytrząsarka (IKA)
9 erlenmeyerek
9 kolb (100 ml)
19 probówek
WYKONANIE
1. STATYKA BIOSORPCJI JONÓW CR(III) PRZEZ NATURALNE BIOSORBENTY
Należy przygotować dziewięć roztworów Cr(III) o znanym stężeniu – Tabela 3,
wykorzystując uwodniony azotan chromu Cr(NO
3
)
3
.
9H
2
O w dziewięciu kolbkach (100 ml).
pH każdego z roztworów należy ustawić na 5. Należy określić stężenia jonów chromu w
roztworach zerowych – C
0
(mg/dm
3
). 20 ml każdego z roztworów inkubuje się z 0,02 g
biomasy przez 120 min na wytrząsarce (150 rpm) w zadanej temperaturze. Po upływie tego
czasu biosorbent oddziela się od roztworu na sączku. W pozostałym roztworze należy określić
stężenie jonów chromu – C
eq
(mg/dm
3
).
Tabela 3. Naważki Cr(NO
3
)
3
.
9H
2
O do przygotowania roztworów Cr(III) o pożądanym
stężeniu (na 100 cm
3
)
Nr
C
0
(mg/dm
3
) Naważka soli Cr(NO
3
)
3
.
9H
2
O (g/100 cm
3
)
1
10
0,0077
2
25
0,0192
3
50
0,0385
4
75
0,0577
5
100
0,0770
6
125
0,0962
7
150
0,115
8
200
0,154
9
300
0,231
Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 7 -
Spektrofotometryczna analiza stężenia jonów Cr(III) w roztworze wodnym
Do 4,0 cm
3
każdego z roztworów należy dodać taką samą masę EDTA (0,095 g) i
ogrzewać przez 10 minut w 95
o
C. Jony Cr(III) reagują z EDTA tworząc kompleks Cr-EDTA
o fioletowym zabarwieniu, który absorbuje światło o długości 540 nm. Stanowi to podstawę
metody kolorymetrycznego oznaczania stężenia jonów Cr(III). Jako odnośnik należy
wykorzystać wodę dejonizowaną z taką samą ilością EDTA. Stężenie jonów Cr(III) w
roztworach przed i po biosorpcji w zakresie stężeń 0 - 300 mg/dm
3
należy wyznaczyć z
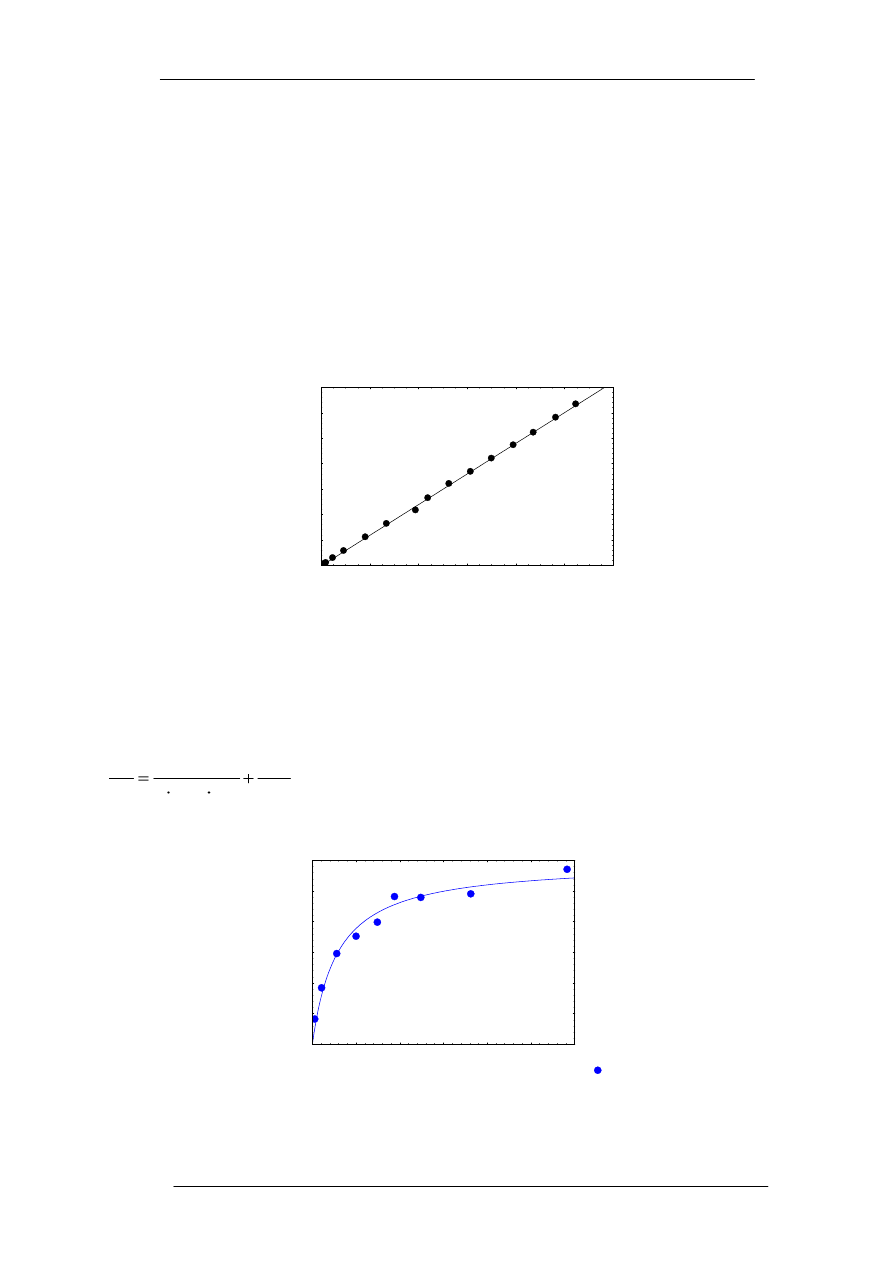
krzywej przedstawionej na Wykresie 1.
y = -1,17+603
.
x; R
2
0,999
0,0
0,1
0,2
0,3
0,4
0,5
0,6
Abs
0
50
100
150
200
250
300
350
O
d
cz
y
t I
C
P
(
m
g
/d
m
3
)
Wykres 1. Kalibracja metody kalorymetrycznej na metodę ICP-OES
Otrzymane wyniki doświadczalne należy opisać równaniem Langmuira (1). Parametry
tego modelu - q
max
i b wyznacza się metodą regresji nieliniowej (program Mathematica wersja
3.0.) lub też z linearyzacji równania Langmuira (6):
max
max
1
1
1
q
C
q
b
q
eq
eq
(6)
Przykładową izotermę równania Langmuira przedstawiono na Wykresie 2.
Zn
0
50
100
150
200
250
300
C
eq
(mg/dm
3
)
0
10
20
30
40
50
60
q
eq
(
mg/
g)
Wykres 2. Izoterma Langmuira dla biosorpcji jonów Zn(II) (pH 5, 25°C, C
S
1 g/dm
3
, C
0
10-
300 mg/dm
3
) przez makroalgę Enteromorpha prolifera

Usuwanie jonów chromu w procesie sorpcji z użyciem naturalnych biosorbentów
- 8 -
2. POBIERANIE PRÓBEK WŁOSÓW
Włosy należy pobrać z okolicy potylicy, przy użyciu nożyczek ze stali nierdzewnej (ok.
0,5 g), po umyciu włosów szamponem Johnson’s Baby i wysuszeniu. Doboru szamponu
dokonano na podstawie jego składu - spośród badanych pierwiastków obecny był jedynie sód.
3. MINERALIZACJA WŁOSÓW
Analiza wielopierwiastkowa metodą emisyjnej spektrometrii plazmowej (ICP-OES)
wymaga przeprowadzenia próbek do postaci ciekłej. W celu poznania składu mineralnego
włosów zostanie przeprowadzona mineralizacja biomasy (ok. 0,5 g) techniką rozkładu
mikrofalowego w aparacie typu Milestone Start D (USA)
przy użyciu 5,0 cm
3
69 %
stężonego kwasu azotowego spektralnej czystości. Piec mikrofalowy wyposażony jest w
układ teflonowych naczyń ciśnieniowych, wykonanych z materiału polimerowego PFA,
opornego na działanie stężonych odczynników chemicznych i minimalizującego adsorpcję
zanieczyszczeń na ściankach naczynia. Dobrane parametry procesu umożliwiły całkowitą
mineralizację tkanki włosów. Po mineralizacji, próbkę należy uzupełnić wodą podwójnie
demineralizowaną w systemie Millipore Simplicity do masy 50 g.
4. ANALIZA WŁOSÓW NA ZAWARTOŚĆ Hg
Zawartość rtęci w naturalnych biosorbentach zostanie zanalizowana na spektrometrze
AMA 254 przy następujących parametrach: masa próbki: 0,05 g, czas suszenia: 40 sekund,
czas rozkładu: 150 sekund, czas oczekiwania: 40 sekund.
5. ZDJĘCIA WŁOSÓW WYKONANE MIKROSKOPEM CARL ZEISS
W zebranych próbkach włosów należy wyznaczyć grubość włosa i profil koloru
włosa. Należy również wykonać zdjęcia biosorbenta naturalnego przed i po procesie
biosorpcji.
Wyszukiwarka
Podobne podstrony:
Instrumentalne metody analizy
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
instrumenty metodyczne
Instrumentalne metody analizy chemicznej egzamin
Cz 10 Instrumentalne metody analizy ilościowej Metody chromatograficzne
Cz 4 Instrumentalne metody analizy chemicznej Spektrometria w podczerwieni
CHROMATOGRAFIA CIECZOWA cz.2, INSTRUMENTALNE METODY ROZDZIAŁU I ANALIZY SUBSTANCJI - ŚREDNIOCIŚNIENI
Instrumentalne metody analizy m ras
Metodyka, Harcerstwo, instrumenty metodyczne, Harcerze starsi
Geodezja - szkolenie instruktorsko metodyczne PSZ, GEODEZJA(1)(1)
Instrumentalne Metody w Badaniu
Cz 8 Instrumentalne metody analityczne Metody elektrochemiczne
03. Roztwarzanie materiałów w kwasach i przez stapianie, Technologia Chemiczna, Rok III, Semestr II,
Sprawnosci harcerskie- opis instrumentu metodycznego, Harcerswo
Cz 8 2 Str 15 i 17 Instrumentalne metody analityczne Metody elektrochemiczne
Instrukcja metody elektroanalityczne, Chemia środków bioaktywnych i kosmetyków, Chemia analityczna i
04. Metody rozdzielania, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metody analizy,
więcej podobnych podstron