1. Zasoby wodne Polski
Polska jest krajem w którym zasoby wodne są mniejsze niż w innych państwach europejskich.
Zasoby wodne wynikają z tak zwanego bilansu wodnego na który składają się przychody i rozchody wody. Na przychód
wpływają opady atmosferyczne i dopływy wód z zagranicy oraz wody zgromadzone w rzekach i jeziorach . Na rozchód
wody składają się parowanie, zużycie wody na potrzeby przemysłowe , komunalne oraz odpływ powierzchniowy i
podziemny .
Obszary w Polsce o nadmiarze wód: Karpaty, Sudety, Żuławy, poje. Mazurskie. Obszary o deficycie wody: Kujawy,
górny Śląsk, okolice Łodzi.
Zasoby polskich wód podziemnych i powierzchniowych: 60 km
3
. Na Polskę spada przeciętnie 186 km
3
wody, z czego
133 km
3
paruje bezpośrednio, a pozostała ilość spływa rzekami lub wsiąka do gruntu tworząc zasoby wód podziemnych.
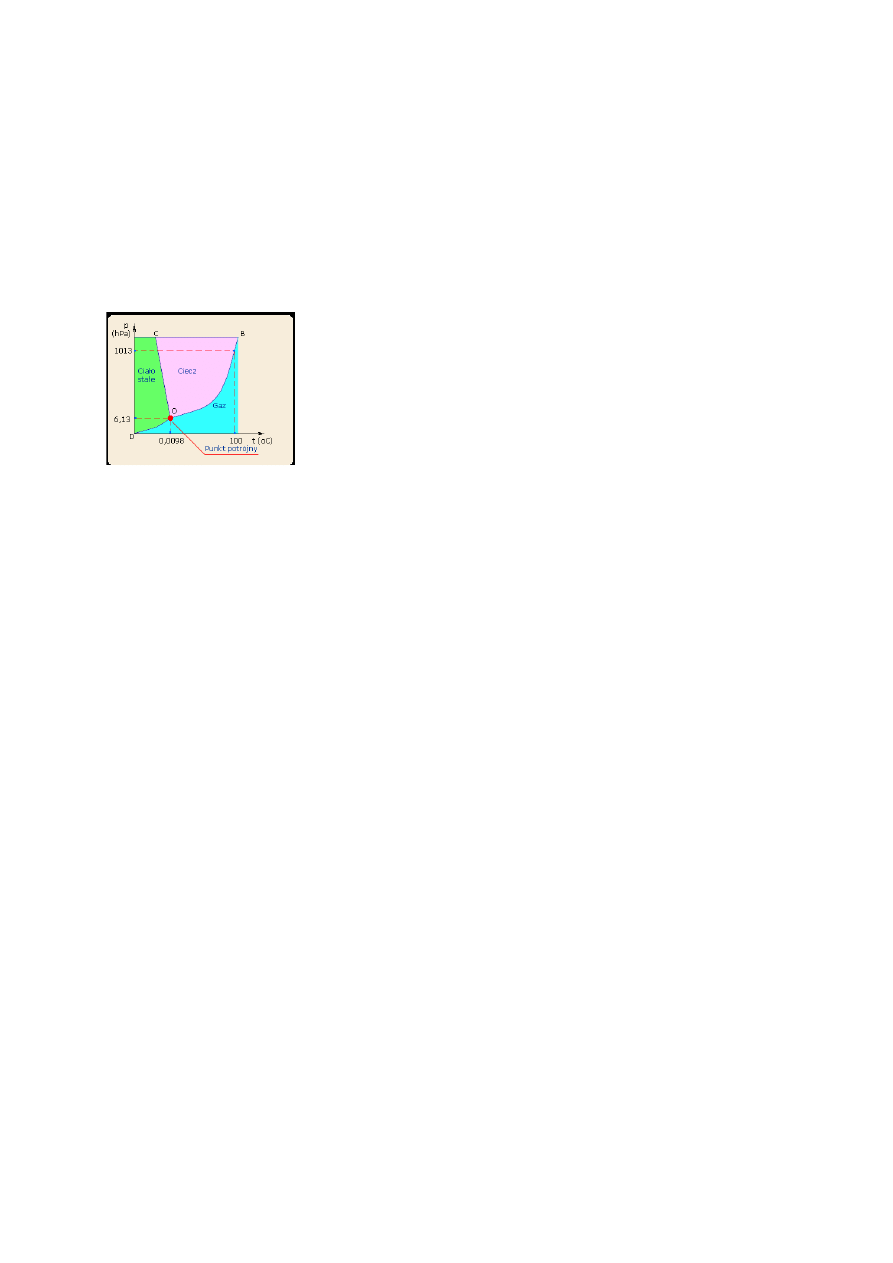
2. Wykres fazowy wody, zjawiska związane z przejściami fazowymi.
Obszar leżący na lewo od tej krzywej odpowiada fazie stałej; współrzędne punktów leżących na tym obszarze podają
temperaturę i ciśnienie, w których trwale istniejącą fazą jest jedynie faza stała, tj. lód.
Krzywa OD, zwana krzywą sublimacji, oddziela pole fazy stałej (pole lodu) od pola
gazu (pary nienasyconej).
Krzywa OB, zwana krzywą parowania, określa równowagę między cieczą a gazem.
Wszystkie trzy krzywe równowag fazowych; krzywa parowania OB, krzywa
krzepnięcia OC i krzywa sublimacji OD, przecinają się w jednym punkcie O zwanym
punktem potrójnym. Współrzędne punktu potrójnego określają ciśnienie i temperaturę ,
w których jedynie możliwe jest istnienie wszystkich trzech faz w równowadze trwałej,
tj. fazy stałej, ciekłej i pary nasyconej.
Każda substancja ma swój odrębny wykres fazowy, który można uzyskać na podstawie
pomiarów wykonanych w różnych temperaturach i pod różnymi ciśnieniami.
Do charakterystyki układów wielofazowych można zastosować tzw. regułę faz Gibbsa.
Mówi ona, że w danym układzie liczba stopni swobody n jest równa liczbie składników niezależnych s, pomniejszonej o
liczbę faz plus dwa.
n = s - f + 2
3. Gęstość wody i zjawiska z nią związane.
Gęstość w temperaturze 3,98°C: 1 kg/l (gęstość maksymalna)
Objętość, a temperatura
Wraz ze spadkiem temperatury gęstość większości substancji rośnie, a ich objętość maleje. W przypadku wody występuje
pewna anomalia. Największą gęstość, 1g/dm
3
woda osiąga w temperaturze 3,98
°
C, a nie jak można przypuszczać w
najniższej temperaturze, to jest na granicy woda - lód. 0
°
C to temperatura, w której gęstość skokowo maleje z 0,999g/dm
3
do
0,916g/dm
3
(gęstość lodu). Gęstość lodu woda osiąga ponownie w temperaturze 30
°
C.
Zmiana temperatury o 1
°
C wniskich zakresach temperatur (4 - 8
°
C) powoduje małe zmiany gęstości, natomiast w wyższych
(od około 12
°
C) znaczne.
Cecha ta jest niezwykle ważna dla zbiornika wodnego. Ma to wpływ na stabilność mas wodnych. Wody o temperaturze 4 -
10
°
C mogą być łatwo przemieszane prze wiatr, gdyż różnice gęstości między nimi są niewielkie. Powyżej 20
°
C układ jest już
bardzo stabilny. Ta właściwość wody, umożliwia również przeżycie wielu organizmom podczas mro·nych zimowych dni.
Gęsta, a zatem "ciężka" woda, która ma temperaturę zbliżoną do 4
°
C zalega przy dnie. Chłodniejsze i lżejsze wody
utrzymują się przy powierzchni. Gdy temperatura powietrza spadnie poniżej 0
°
C woda zamarza. Heksagonalna struktura lodu
powoduje, że ma on mniejszą gęstość od wody, a co za tym idzie utrzymuje się na jej powierzchni, nie powodując
ochładzania głębszych partii jeziora. Tworzy się wówczas tak zwane uwarstwienie - stratyfikacja (to zjawisko opisane
zostanie dokładniej w dalszych częściach artykułu). Podobnie rzecz ma się latem, kiedy powierzchniowe warstwy wody
ogrzewane są promieniami słonecznymi. Ich temperatura jest znacznie większa od 4
°
C, a ich gęstość jest mniejsza od warstw
przydennych.
Patrz wyżej.
4. Procesy wzbogacania wód w składniki mineralne: skład chemiczny i struktura minerałów, skład fizyczno-
chemiczny gleby, procesy wietrzenia.
Minerał to substancja chemiczna powstała w przyrodzie, o określonym składzie i określonych właściwościach fizycznych i
chemicznych. Z minerałów jest zbudowana skorupa ziemska, także Księżyc i meteoryty. Jako minerały syntetyczne określa
się uzyskiwane w toku procesów technologicznych substancje krystaliczne, których skład i struktura odpowiadają minerałom
właściwym (naturalnym): diamenty syntetyczne, korund syntetyczny i inne. Minerały odróżnia od substancji mineralnych
(np. mineraloidów) struktura krystaliczna, a od mieszanin mineralnych (np. skał, złożonych zwykle z różnych minerałów) —
jednorodność chemiczna i fizyczna.
Cechami charakterystycznymi minerałów są głównie: przynależność do określonej klasy krystalograficznej (kryształ), skład
chemiczny, właściwości mechaniczne — twardość (określana w skali Mohsa), łupliwość, przełam (np. muszlowy,
haczykowaty), właściwości optyczne: barwa, rysa (tj. barwa minerałów w stanie sproszkowanym), połysk (np. tłusty,
metaliczny), współczynniki załamania światła (dwójłomność), pleochroizm a, także inne cechy fizyczne (np. właściwości
magnetyczne, gęstość). Ze względu na właściwości barwne rozróżnia się minerały idiochromatyczne (barwne), odznaczające
się charakterystyczną, własną barwą uwarunkowaną składem chemicznym i strukturą krystaliczną (np. czerwony cynober,
niebieski azuryt), oraz minerały allochromatyczne (zabarwione), w stanie czystym bezbarwne, często zabarwione przez
domieszki (np. odmiany kwarcu: ametyst, cytryn), lecz zachowujące białą rysę. Ze względu na częste wzajemne
podstawienia jonów różnych pierwiastków chemicznych w strukturze krystalicznej minerałów (diadochia), część z nich (np.

plagioklazy, oliwiny) tworzy szeregi izomorficzne, tj. roztwory stałe o zmiennej zawartości głównych składników, lecz o tej
samej postaci krystalograficznej oraz o określonych właściwościach optycznych i fizycznych. Niektóre substancje chemiczne
występują jako minerały o różnych postaciach krystalograficznych (polimorfizm), tworząc odmiany polimorficzne: np.
węglan wapnia ma 2 odmiany polimorficzne — trygonalną (kalcyt) i rombową (aragonit). Forma kryształu minerału może
być zachowana mimo jego zastąpienia przez inny minerał (pseudomorfoza) lub przez inną odmianę polimorficzną tej samej
substancji (paramorfoza).
Minerały występują w postaci prawidłowo uformowanych dużych kryształów i ich skupień (np. szczotek krystalicznych),
częściej tworzą nagromadzenia drobnych kryształów zwanych agregatami krystalicznymi, ziarna o kształtach nieregularnych
(np. uzależnionych od kształtu pustki skalnej, w której krystalizowały), skupienia drobnokrystaliczne lub skrytokrystaliczne
(ziemiste, zbite i inne) o różnych kształtach (np. nacieki, buły). Powstają w wyniku wielu procesów geologicznych:
krystalizacji magmy, metamorfizmu, procesów hydrotermalnych, ekshalacji wulkanu, wietrzenia, diagenezy, wytrącania się
substancji chemicznych z wód powierzchniowych, działalności organizmów, w określonych warunkach fizykochemicznych
tworzą się zwykle charakterystyczne zespoły mineralne zwane paragenezami.
Zespołami minerałów występującymi w skorupie ziemskiej w dużych masach są skały. Wśród minerałów tworzących skałę
rozróżnia się minerały główne (składniki gł.), tj. będące podstawowymi składnikami skały i decydujące o jej przynależności
systematycznej, minerały poboczne (występujące pospolicie, lecz w niewielkich ilościach, i nie mające wpływu na
przynależność systematyczną skały) i minerały akcesoryczne (które występują w zmiennej ilości w danym typie skały, a ich
obfitość może być podstawą wydzielenia pewnych jej odmian). Minerały będące głównymi składnikami skał są nazywane
minerałami skałotwórczymi: należą do nich głównie krzemiany i glinokrzemiany (skalenie, amfibole, pirokseny, łyszczyki,
oliwiny, skaleniowce), kwarc, kalcyt, dolomit. Ważną grupą minerałów skałotwórczych są minerały ilaste, tj. minerały z
grupy glinokrzemianów uwodnionych o strukturze warstwowej, tworzące skupienia złożone z drobnych, nierozpoznawalnych
gołym okiem łusek; łatwo chłoną wodę, co powoduje ich pęcznienie i uplastycznienie, są głównymi składnikami skał ilastych
i gleb (np. kaolinit, montmorillonity). Głównymi składnikami większości rud są minerały kruszcowe (kruszce), tj. minerały
będące związkami (siarczkami, arsenkami, siarkosolami, tlenkami i in.) metali ciężkich (także antymonu, arsenu). Dla
minerałów kruszcowych typowe są: duże współczynniki załamania światła, nieprzezroczystość, połysk metaliczny lub
półmetaliczny (np. galena, chalkopiryt, hematyt). Wyróżnia się także minerały ciężkie (np. magnetyt, kasyteryt, ilmenit,
turmalin), dające się dzięki znacznej gęstości (powyżej 3 g/cm
3
) łatwo oddzielać (szlichowa próba) od pospolitych minerałów
skałotwórczych. Znaczna część minerałów jest wykorzystywana w gospodarce (kopaliny), głównie w przemyśle, także w
rzemiośle artystycznym (kamienie szlachetne), ich nagromadzenia (złoże) są od starożytności eksploatowane metodami
górniczymi.
Minerały to substancje chemiczne powstające w przyrodzie, o określonym składzie i określonych właściwościach
fizycznych i chemicznych oraz o strukturze krystalicznej. Z minerałów zbudowana jest skorupa ziemska, księżyc i meteoryty.
Minerały mogą mieć postać prawidłowych kryształów, częściej rozmaitych skupień krystalicznych. Ze względu na genezę
wyróżnia się minerały pierwotne i wtórne. Minerały pierwotne wydzielają się bezpośrednio z danego środowiska: mogą
krystalizować z magmy (minerały magmowe), z przegrzanych par i gorących roztworów wydzielających się z magmy
(minerały pneumatolityczne i hydrotermalne), z par i gazów wulkanicznych (minerały wulkaniczno-ekshalacycne), z wód
źródlanych, jeziornych lub morskich (minerały osadowe). Minerały wtórne powstają z minerałów pierwotnych wskutek
fizycznych i chemicznych przeobrażeń minerałów pierwotnych w wyniku procesów > wietrzenia > diagenezy > i
metamoefizmu. Minerały zwykle występują w przyrodzie w naturalnych zespołach powstających w określonych
środowiskach fizykochemicznych. Zespoły minerałów występujące w skorupie ziemskiej w wielkich masach noszą nazwę
skał.
Glebą nazywamy warstwę powierzchniową, pokrywającą skorupę ziemską. Powstała ona w wyniku długotrwałych
procesów, które przebiegały na powierzchni Ziemi. O długości tego procesu świadczy fakt, iż warstwa ziemi o grubości 2-
3cm kształtuje się od 200 do 1000 lat. Proces ten polega na oddziaływaniu czynników klimatycznych, które powodują
wietrzenie skał, jak i na oddziaływaniu organizmów. Rozdrobniona skała zatrzymuje cząstki wody i powietrze. Z czasem
pojawiają się rośliny utrwalające glebę. Bardzo ważną funkcję pełnią drobnoustroje, których zadaniem jest rozkładanie
szczątków roślinnych i zwierzęcych, wzbogacając w ten sposób glebę w próchnicę i minerały. Gleba ma następujący skład:
- materia organiczna (5%);
- minerały (45%);
- woda (25%);
- powietrze (25%).
Utrzymanie wysokiej jakości gleby zapewniają organizmy glebowe. W związku z tym można potraktować glebę jako żywą
warstwę skorupy ziemskiej. Jak wiadomo wszystko co żywe podlega ciągłym zmianom, będących wynikiem oddziaływania
czynników naturalnych, a także wpływem działalności samego człowieka.
Składniki chemiczne
Wyróżniamy następujące pierwiastki: węgiel C, glin Al., wapń Ca, żelazo Fe, chlor Cl, wodór H, potas K, magnez Mg, azot
N, sód Na, tlen O, fosfor P, siarka S, krzem Si + mangan Mn, molibden Mo, miedź Cu, kobalt Co, ołów Pb, cynk Zn, bor B,
tytan Ti.
Część mineralna to przede wszystkim: krzem Si, glin Al, żelazo Fe, wapń Ca. Krzem Si występuje w 60 do 90 % pod
postacią krzemionki. Glin Al występuje w granicach 5 do 12%. Żelazo Fe występuje w postaci Fe
2+
oraz Fe
3+
. Natomiast
wapń Ca w postaci węglanu wapnia CaCO
3
. Zawartość CaCO
3
waha się pomiędzy ilościami śladowymi, a kilkudziesięcioma
procentami. Pozostałe pierwiastki mierzymy w ppm; mogą sięgać najwyżej 1% zawartości.
Typy i procentowy udział najczęstszych gleb naszego kraju
Gleby bielicowe, płowe i brunatne są najczęstsze. Stanowią łącznie 82% wszystkich naszych gleb. Pozostałe gleby to:
- gleby błotne (9%);
- gleby mady (5%);
- czarne ziemie (2%) i czarnoziemy (1%);
- gleby rędzinowe (1%).
Struktura warstwy glebowej
W glebie tworzą się tzw. agregaty. Są one bardzo ważne, ponieważ zapewniają roślinom właściwą gospodarkę wodną i
warunki cieplne. W gruzełkach występują przestrzenie kapilarne, w których gromadzi się woda kapilarna. W większych
przestrzeniach gromadzi się woda grawitacyjna. Gdy spłynie, do wolnych miejsc dostaje się powietrze atmosferyczne,
dostarczając w ten sposób tlen O
2
. Natomiast woda czerpana jest z kapilar.
Fizyczne właściwości
Priorytetem przy ustalaniu właściwości fizycznych jest układ trójfazowy tej gleby. Na fazę stałą przypadają cząstki
mineralno-organiczne, mineralne i organiczne. Fazę ciekłą stanowi roztwór glebowy, natomiast gazową powietrze. Powietrze
na przemian z roztworem glebowym wypełnia pory. Zasadniczymi właściwościami fizycznymi są:
- skład granulo-metryczny.
Podstawowymi składnikami gleby są cząstki mineralne, które powstają w wyniku erozji wietrznej działającej na skałę
macierzystą. Do mineralnych składników zaliczamy minerały: ilaste (np. illit), krzemianowe (np. kwarc i skalenie) i
bezkrzemowe (kalcyt i gips). Większość cząsteczek jest różna, więc cząsteczki glebowe podobne pod względem składu oraz
właściwości fizycznych zakwalifikowano do grup frakcyjnych. W naszym kraju materiał glebowy dzieli się na dwie grupy:
1. Części szkieletowe, które stanowi frakcja kamieni o średnicy powyżej 20nm i frakcja żwiru o średnicy 20-1nm.
2. Części ziemiste, do których zaliczamy frakcję piasku (średnica 1-0,1nm), frakcję pyłu (średnica 0,1-0,02) i frakcję
zwaną częściami spławianymi o średnicy poniżej 0,02nm.
Do części spławianych zaliczamy ił pyłowy koloidalny, drobny i gruby. Składem granulometrycznym nazywamy udział
danej frakcji w definicyjnej jednostce masy gleby. Uznaje się to za zasadniczą cechę gleby, mającą związek z materiałem
macierzystym i jego jakością.
- gęstość gleby.
Gęstością gleby nazywamy masę jednego metra sześciennego suchej gleby, nienaruszonej strukturalnie. Jest zależna od
uziarnienia oraz struktury gleby. Wyróżniamy dwa rodzaje gęstości:
- gęstość właściwą-rzeczywistą.
Mówi o tym o ile cząstka gleby nie zawierająca powietrza ani wody ma większą masę od cząsteczek wody, które zajmują tę
samą objętość. Zależy od tzw. składu mineralnego.
- gęstość objętościowa.
Przez tą gęstość rozumiemy stosunek masy danej próbki gleby, która jest naturalna w swoim układzie do objętości całkowitej
tej próbki. Ze wzrostem tej gęstości wzrasta stopień porowatości tej gleby i jest ona bardzie zbita.
- porowatość.
Suma wolnych przestrzeni gleby. Wyróżniamy porowatość kapilarną oraz niekapilarną.
- zwięzłość.
Jest to siła, będąca miarą spojenia cząsteczek. Mierzy się ją poprzez określenie siły potrzebnej do ich rozdzielenia.
- plastyczność.
Jest cechą umożliwiającą przybieranie glebie różnych kształtów, gdy jest wilgotna. Jest zależna od wielkości cząsteczek.
- lepkość.
Jest wyrażana zdolnością przylegania gleby. Zależy od składu mechanicznego oraz wilgotności gleby.
- pęcznienie, kurczenie.
Zachodzi w glebach zawierających dużo cząstek koloidalnych. Zwiększenie objętości przez gęstość, przy nawilgotnieniu to
właśnie pęcznienie, a kurczenie przebiega w drugim kierunku.
- wodne właściwości.
Woda może przyjmować różne postacie:
- wolną, kiedy przepływa z góry w dół gleby, determinowana własną masą;
- kapilarną, wnikającą do najcieńszych kanalików glebowych. Jest rezerwuarem wilgoci w glebie i porusza się w każdym
kierunku;
- błonkową, trudnodostępną dla roślin. Powleka gruzełki oraz cząsteczki;
- higroskopową, silnie związaną i dostającą się do gleby z atmosfery. Jest obecna w ciężkich oraz próchniczych typach gleb;
- molekularną, która zatrzymuje się na cząsteczkach gleby, w wyniku działania sił adhezji. Jest zależna od typu
występujących w glebie koloidów;
- pary wodnej, znajdującej się w porach i będącej częścią składową powietrza glebowego.
- cieplne właściwości.
Mają związek z przewodnictwem i pojemnością cieplną. Intensywność nagrzewania oraz szybkość utraty ciepła gleby mają
związek z barwą oraz wilgotnością tej gleby. Ciepło może dostarczać słońce, procesy biologiczne i powietrze.
Właściwości chemiczne oraz fizyko-chemiczne
Skład chemiczny, formy, związki i przemiany pierwiastków określamy mianem właściwości chemicznych gleby. Badania są
prowadzone aby oznaczyć:
- zawartość materii organicznej gleby. Jeśli gleba jest prawidłowo użytkowana powinna występować równowaga pomiędzy
substancjami organicznymi i tworzącymi się związkami próchnicowymi. W przypadku przyspieszonej mineralizacji
możemy wnioskować, iż doszło do zakwaszenia lub akumulacji toksycznych związków. Aby zbadać ilość substancji
organicznej w glebie stosuje się metodę barwową.
- zawartość próchnicy, a także węgla organicznego utlenialnego. Węgiel i próchnica pozwalają oszacować zawartość
substancji organicznej w glebie, a także stopień jej humifikacji. Zawartość węgla w glebie świadczy o zawartości próchnicy.
Należy zastosować przelicznik 58%. Sposób oznaczenia opiera się na utlenianiu węgla C do dwutlenku węgla CO
2
.
oznaczenie przebiega w środowisku kwaśnym.

- zawartość azotu. Jest zależna od jakości oraz ilości substancji organicznej, a także od stopnia rozkładu (C\N). zawartość
azotu w glebie to zawartość azotu organicznego + zawartość związków mineralnych azotu. Oznacza się również ilość ołowiu,
kobaltu, kadmu, niklu, magnezu i manganu.
Odczyn pH, sorpcyjność i właściwości ohydo-redukcyjne określają właściwości fizyko-chemiczne.
Odczyn gleby – jest zależny od stężenia jonów wodorowych H
+
i zasadowych OH
-
. ph ma związek z aktywnością
biologiczną. Jeśli stosunek jonów kwasowych do zasadowych jest równy 1 to pH jest neutralne. W środowisku kwaśnym
występuje przewaga jonów H
+
, a w środowisku zasadowym jonów OH
-
. do oznaczenia odczynu gleby używa się dwóch
metod. Pierwsza to pomiar potencjometryczny (polega na mierzeniu różnicy potencjałów pomiędzy półogniwami. Drugą
metodą jest pomiar kolorymetryczny (mierzy się barwę cieczy, która powstaje w wyniku reakcji: płyn Helliga + gleba).
Zdolność sorpcyjna – to zdolność absorbenta do absorpcji par, gazów, cząsteczek niezdysocjonowanych oraz jonów
pochodzących z roztworu glebowego. Polega to na pochłanianiu wymienionych substancji, które zachodzi na powierzchni
tego absorbenta. W przypadku gleby sorpcja zależy od koloidalnej fazy stałej (są to cząsteczki 2*10
-3
mm). Wyróżniamy:
koloidy glebowe, Fe(OH)
2
, Fe(OH)
3
, Al.(OH)
3
, minerały ilaste, kompleksy ilasto-próchnicze i próchnicę. Wyróżniamy trzy
typy sorpcji: biologiczną, chemiczną i wymienną. W glebie funkcjonuje ta ostatnia. Jej istotą jest wymiana wcześniej
zaabsorbowanych jonów na te znajdujące się w roztworze glebowym. Maksymalną ilość kationu H
+
, którą jest w stanie
zaabsorbować 100 g materiału glebowego nazywa się pojemnością sorpcyjną gleby. W czasie zachodzących reakcji redoks
dochodzi do przyłączania lub oddawania elektronów. W czasie przemian materii organicznej w glebie dominują procesy
utleniania (są nieodwracalne).
Zjawisko erozji
Jest to najczęstsza przyczyna degradacji gleby. Erozja polega na mechanicznym oddziaływaniu na powierzchnię Ziemi w
sposób niszczący czynnikami zewnętrznych oraz na przenoszeniu owych produktów niszczenia. Rozróżniamy dwa typy
erozji wodną i wietrzną. Przykładem erozji wodnej jest spłukiwanie elementów gleby przez opad atmosferyczny, np. w
postaci deszczu. Nasilenie tego rodzaju erozji zależy od stopnia w jakim występuje roślinność. Najlepiej osłonięte są gleby
porośnięte trawami, leżące w lasach. Niestety człowiek wycina lasy i niszczy roślinność. Odsłania w ten sposób glebę
zwiększając jej podatność na erozję. Najbardziej odczuwalne jest to na górzystych obszarach, gdzie spływowi
powierzchniowemu (powodującemu erozję) sprzyja nachylenie terenu. Również erozję rzeczną zaliczamy do erozji wodnej.
Rzeka w czasie przepływu zabiera ze sobą rozdrobnione podłoże, elementy spłukiwanej gleby z terenów przybrzeżnych do
rzek. Natomiast brzegi morskie ulegają erozji wywołanej przez wodę morską uderzającą z dużym impetem o brzeg.
Wiatr również jest czynnikiem erozjo-twórczym. Erozja tego rodzaju polega na przenoszeniu drobin piasku oraz próchnicy
glebowej pod wpływem wiatru. W wyniku nasilenia erozji wietrznej dochodzi do burz pyłowych. Polska jest obszarem, gdzie
zjawiska te uległy zdecydowanemu nasileniu. Dotyczy to głównie obszarów wylesionych, gdzie występują wyraźne deficyty
wody.
Procesy towarzyszące tworzeniu się gleby
Wpływ środowiska naturalnego, w naturalnych warunkach jest czynnikiem warunkującym tworzenie się gleby ze skał. Skały
lub minerały pochodzące ze skorupy naszej Ziemi, jeśli dotrą na powierzchnię, mogą być skałą macierzystą przyszłych gleb.
Powstawanie gleb z takiego surowego materiału ma związek z wietrzeniem oraz procesami biochemicznymi. Wyróżnia się
trzy typy wietrzenia: chemiczne, biologiczne oraz fizyczne. Przebiegają równocześnie, ale z innym nasileniem. Pod
wpływem wietrzenia zmianie ulega wygląd składników mineralnych od zewnętrznej strony skały. Odporność na działanie
wiatru jest różna u różnych skał. Skały typu grubokrystalicznego ulegają trudniej wietrzeniu. Utwory zbudowane z jednego
rodzaju minerału są bardziej odporne, od tych wielo-mineralnych. Kolejność wietrzenia jest następująca: najpierw zachodzi
wietrzenie fizyczne (dochodzi do rozdrobnienia), potem dochodzi do wietrzenia chemicznego i biologicznego.
Wietrzenie typu chemicznego –
Na podstawie przemian skalenia potasowego prześledzić można powstawanie różnych produktów wietrzenia, w zależności
od obecności potasu:
w wypadku, gdy cały potas został wymyty do roztworu, powstającym minerałem wtórnym j
est
4K[AlSi
3
O
8
] + 6H
2
O ® Al
4
[(OH)
8
Si
4
O
10
] + 8SiO
2
+ 4KOH
skaleń potasowy + woda ® kaolinit + krzemionka + potas
jeżeli pewna część potasu nie ulegnie wymyciu i pozostanie w obrębie sieci krystalicznej, powstającym minerałem wtórnym
jest
5K[AlSi
3
O
8
] + 4H
2
O ® KAl
4
[(OH)
4
AlSi
7
O
20
] + 8SiO
2
+ 4KOH
skaleń potasowy + woda ® illit + krzemionka + potas
Wietrzenie- jego efektem jest zmiana struktury minerałów. Wytwarzane są nowe minerały zwane wtórnymi. Rozkład skał
oraz minerałów poprzez wietrznie typu chemicznego oraz mineralnego jest bardzo skuteczne w klimacie wilgotnym.
Czynnikami bardzo istotnymi dla wietrzenia chemicznego są woda, dwutlenek węgla, kwasy mineralne, organiczne i tlen.
Podczas tego wietrzenia na zwałowiskach dochodzi do:
- utlenienia (ma zasięg na głębokość do której dochodzi tlen),
- redukcji (zachodzi tam, gdzie nie występuje wolny tlen; niekiedy redukcję wywołują kwasy),
- hydratacji (jeśli woda jest składnikiem minerałów, zmieniając ich właściwości chemiczne oraz fizyczne - 2Fe
2
O
3
+3H
2
O =
2Fe
2
O
3
*3H
2
O),
- hydrolizy ( hydrolizie z minerałów trudno ulega siarczan (VI) wapnia i węglan wapnia - jeszcze trudniej; w przypadku
minerałów zasadowych istnieje możliwość do wymiany z wodorem CaSiO
3
+HOH=H
2
SiO
3
+Ca(OH)
2
),
- karbonatyzacji (ma ona związek z powstawanie węglanów, a substratem są dwuwęglany. Karbonatyzacja jest związana z
rozkładem minerałów glebowych. Ma związek z hydrolizą minerałów, które następnie przechodzą w inne).
W trakcie oddychania korzeni uwalnia się dużo dwutlenku węgla, tworzącego połączenia z kationami. Ze wzrostem
koncentracji dwutlenku węgla wzrasta wietrzenie chemiczne.

Wietrzenie chemiczne daje minerały wtórne, mające znaczną aktywność i zalicza się je do minerałów ilastych, a z nich z
kolei zbudowane są iły oraz gliny. W glinie oprócz minerałów wtórnych znajduje się również kwarc, substancje organiczne i
uwodnione tlenki żelaza. Wyróżniamy następujące grupy glin:
- montmorylonitowa, czyli (OH)
4
Al
4
Si
8
O
20
*H
2
O – powstaje w warunkach kwaśniejszych od kaolinitowej. Stanowi główny
składnik tzw. glin bentonitowych, dobrze sorbuje i występuje w piaskowym typie gleb o frakcji poniżej 0,002mm.
- kaolinitowa, czyli (OH)
8
Al
4
S
i4
O
10
– zaliczamy do niej kaolinit. Tworzy się podczas wietrzenia skał typu
glinokrzemianowego w warunkach kwaśnych. Spotyka się ją najczęściej na zwałach obydwóch rodzajów węgla.
- illitowa – zaliczamy do niej illit, który jest najbardziej powszechnym produktem procesu wietrzenia skał lądowych. Można
ją spotkać na zwałach z odpadów węglowych.
Wietrzenie typu biologicznego – gleby i skały osadowe rzadko zawierają jedynie jeden rodzaj iłów. Celem rekultywacji jest
zintensyfikowanie procesów glebotwórczych, w których znaczną rolę pełni wietrzenie biologiczne. Dochodzi do niego w
wyniku oddziaływania organizmów na skały lub poprzez chemiczne przetworzenie minerałów, przy użyciu produktów
rozkładu materii organicznej (kwasy huminowe i dwutlenek węgla). Ten typ wietrzenia odgrywa ważną rolę podczas
powstawania gleby. Z tego wynika tak wielkie znaczenie materii organicznej podczas rekultywacji obszarów bezglebowych.
Próchnica może powstawać jedynie w glebie. Stanowi ona aż 90% substancji organicznej znajdującej się w glebie.
Substancja organiczna to 5% gleby. W czasie humifikacji (humus = próchnica) powstają związki organiczne, które
sklasyfikowano do 4 grup:
- fulwokwasy;
- kwasy hymato-melanowe;
- huminy (są to sole stymulujące, bądź hamujące wzrost organizmów żywych);
- kwasy huminowe.
5. Wodne układy dyspersyjne
Pojęcie i klasyfikacja koloidów
Stan koloidalny jest stanem skupienia materii równie powszechnym jak stan gazowy, ciekły lub stały. Cechą
charakterystyczną stanu koloidalnego jest niski stopień rozdrobnienia. Układy koloidalne lub krótko - koloidy, są to układy
dyspersyjne, najczęściej dwuskładnikowe, o wyglądzie układów fizycznie jednorodnych, chociaż w rzeczywistości oba
składniki nie są ze sobą zmieszane cząsteczkowo.
Składnik tworzący fazę ciągłą układu nazywamy ośrodkiem dyspersyjnym lub rozpraszającym, drugi zaś fazą rozproszoną
lub składnikiem rozproszonym. Faza rozproszona składa się z cząstek koloidalnych o wymiarach od 1 do 100 nm, a nawet do
500 nm. Należy tu jednak zaznaczyć, że do układów koloidalnych zaliczamy nie tylko te, które mają wszystkie trzy wymiary
"koloidalne", lecz także i te, w których dwa a tylko nawet jeden wymiar jest koloidalny, czyli ma wartość od 1 do 500nm. W
związku z tym układy koloidalne można podzielić na układy z cząstkami trójwymiarowymi, układy z cząstkami
blaszkowatymi i układy z cząstkami nitkowatymi. Jeżeli cząstki fazy rozproszonej mają jednakową wielkość, układ
nazywamy mono lub izo-dyspersyjnym, jeżeli różną - polidyspersyjnym. Układy koloidalne, które spotykamy w przyrodzie
czy laboratorium mają jednak najczęściej charakter polidyspersyjny.
Układy dyspersyjne o wymiarach cząstek większych od 500 nm nazywamy układami mechanicznymi (zawiesinami lub
suspensjami, w których cząstki ulegają sedymentacji), zaś układy o wymiarach cząstek rozproszonych mniejszych od 1nm
układami o rozdrobnieniu cząsteczkowym (roztworami rzeczywistymi).
Stan rozproszenia koloidalnego jest bardzo rozpowszechniony, zarówno w świecie przyrody ożywionej (różnorodne białka,
pektyny, węglowodany) i nieożywionej (gliny, mgły, pył wulkaniczny), jak również wśród związków otrzymanych sztucznie
w laboratorium chemicznym (mydła, niektóre barwniki, siarka koloidalna, tlenki metali itd.). Oprócz tego w przyrodzie
występuje dużo związków, których cząsteczki mają wymiary charakterystyczne dla układów koloidalnych, zwane są one
eukoloidami (np. skrobia, celuloza, kauczuk, keratyna, kolagen glikogen itd.), znane są również syntetyczne eukoloidy, jak
polistyreny i inne tworzywa sztuczne. Podczas rozpuszczania eukoloidów powstają samorzutnie układy koloidalne.
Najbardziej rozpowszechnione są układy koloidalne o ciekłym ośrodku dyspersyjnym, zwane roztworami koloidalnymi,
liozolami lub zolami. Jeżeli ośrodek dyspersyjny jest wodą, zwane są hydrozolami, jeżeli alkoholem alkozolami, jeżeli
benzenem - benzenozolami itd. Ogólnie, jeżeli ośrodek dyspersyjny jest cieczą organiczną, układy koloidalne nazywa się
organozolami, jeżeli zaś gazem gazozolami (w przypadku powietrza - aerozolami).
6. Kształtowanie się składu wód od opadowych do podziemnych
Było na wykladzie
Czynniki kształtujące skład wód powierzchniowych
W odróżnieniu od wód podziemnych, w kształtowaniu składu chemicznego wód powierzchniowych znacznie większą rolę
odgrywają zanieczyszczenia antropologiczne. Stąd o ostatecznym składzie decydują produkty procesów naturalnych
przebiegających w środowisku wodnym oraz zanieczyszczenia obcego pochodzenia. Ponieważ wody powierzchniowe w
sposób bezpośredni narażone są na wpływ skutków działalności gospodarczej człowieka, charakteryzują się one zmiennością
składu fizyczno-chemicznego i większą różnorodnością substancji w nich występujących niż wody podziemne. Poziom
zanieczyszczenia wód powierzchniowych koreluje (zależy od) ze sposobem zagospodarowania zlewni, stopniem degradacji
środowiska oraz warunkami atmosferycznymi panującymi w danym regionie. W wodach powierzchniowych, poza
substancjami obecnymi w wodach podziemnych, występują zanieczyszczenia stanowiące poważny problem z uwagi na fakt,
iż wiele z nich należy do substancji uciążliwych, a często i toksycznych dla środowiska naturalnego.
Do głównych czynników kształtujących skład wód powierzchniowych należą:
- budowa geologiczna zlewni,
- topografia zlewni,

- procesy wietrzenia i rozpuszczania minerałów budujących zlewnię,
- prędkość i natężenie przepływu wody decyduje o wielkości wymiany między substancjami występującymi w wodzie i
zdeponowanymi na dnie rzek,
- mieszanie się wód o różnym składzie,
- warunki atmosferyczne (temperatura, opady atmosferyczne),
- lokalizacja wód w stosunku do źródeł zanieczyszczeń.
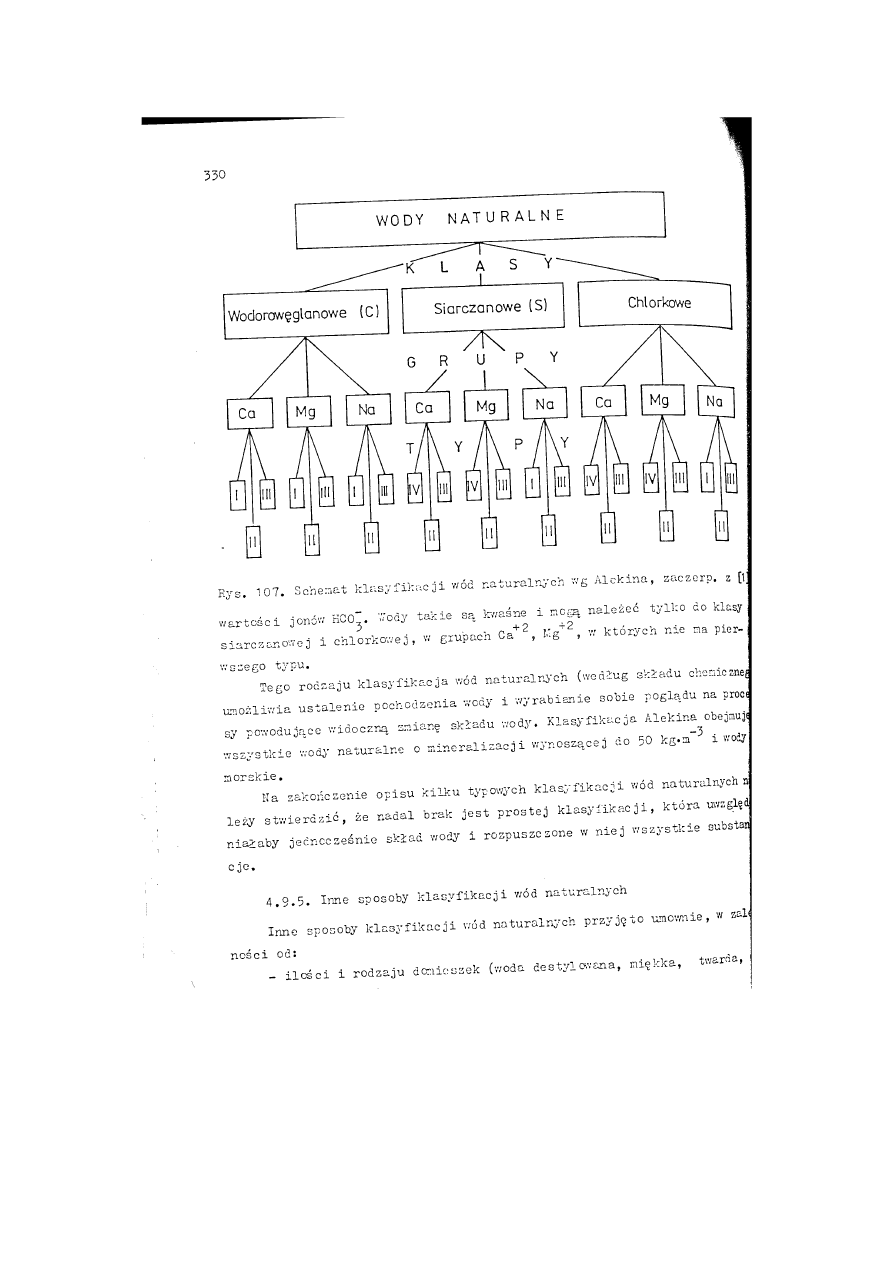
7. Klasyfikacja wód naturalnych według (a)
składu jonowego
i (b) stopnia mineralizacji.*

(b)
Jednocześnie klasyfikacja wody wg stopnia ogólnej mineralizacji – zawarta w przepisach ww.
rozporządzenia, tj.:

-
niskomineralizowana – ogólna zawartość składników mineralnych nie jest większa od
500 mg/l;
średniomineralizowana – ogólna zawartość składników mineralnych nie jest większa od
-
1500 mg/l;
-
wysokozmineralizowana – ogólna zawartość składników mineralnych jest większa od
1500 mg/l;
8. Podstawowe wskaźniki składu jonowego wody
9. Eutrofizacja wód
To wzrost trofii, czyli żyzności wód głównie wzrost stężeń związków fosforu i azotu. Związki te dopływają do wód w
postaci mineralnej, bądź też jako materia organiczna, która ulegając rozkładowi, dostarcza przyswajalnych dla roślin form
mineralnych tych pierwiastków. Eutrofizacja oznacza ?eu? ? dobry podczas mamy do czynienia właśnie z niedobrą,
nadmierną trofią. Eutrofizacja jest efektem nadmiernego dopływu substancji odżywczych (troficznych, biogennych),
(spływającej w ściekach komunalnych i
przemysłowych
), które w nadmiarze stanowią jeden z rodzajów zanieczyszczeń.
Eutrofizacja jezior jest procesem naturalnym. Stale bowiem dopływają do nich substancje z zewnątrz ? ze zlewni i atmosfery.
Normalnie jednak jest to proces bardzo powolny. Został on przyśpieszony dziesiątki i setki razy w
wyniku
gospodarki
ludzkiej ? zrzutu ścieków komunalnych i przemysłowych, wycinki lasów, intensyfikacji rolnictwa, w tym nawożenia
mineralnego. Dotyczy to zarówno zbiorników jak i cieków. Proces ten nasilił się szczególnie w ostatnim półwieczu.
Eutrofizacja początkowo umiarkowany wzrost produkcji biologicznej, w tym pożądanej produkcji ryb. Po przekroczeniu
pewnej granicy ? wywołuje jednak wiele niekorzystych efektów.
PRZYCZYNY I SKUTKI
1. Zmiany zagospodarowania zlewni jezior
2. Wycinanie i wypalanie lasów
3. Zwiększanie terenów uprawnych
4. Celowe obniżenie poziomu jezior np. dla uzyskania terenów rolniczych
5. Stosowanie nawozów sztucznych
6. Przejście z hodowli na wielkotowarowy chów zwierząt.
7. Melioracja terenów rolniczych, a zwłaszcza gleb torfowych.
8. Likwidowanie oczek wodnych.
9. Doprowadzanie ściekówPrzyczyną eutrofizacji jest obciążenie zewnętrzne ?czyli to co wchodzi do jezior zwłaszcza
związki biogenne.
1. Nadmierny rozwój glonów fitoplanktonowych (?zakwity wody?) zmniejszających przezroczystość wody, pogarszających
jej właściwości organoleptyczne. Zwykle wzrasta też udział sinic - grupy, której wiele gatunków utrzymuje się blisko
powierzchni, tworząc kożuchy. wiatry spychają te kożuchy do jednego brzegu, wtłaczają do zatok powstają ogromne
zagęszczenia, masowa śmiertelność tych glonów fauny, nagromadzenie szkodliwych produktów rozpadu! Często sinice
przyżyciowo, a także w efekcie rozkładu wydzielają substancje toksyczne.2.W strefie litoralu pogorszenie warunków
świetlnych w efekcie nadmiernego rozwoju fitoplanktonu powoduje ustępowanie roślinności zanurzonej.3. Masowo
rozwijają się w literału glony nitkowate, tworzące maty) - kożuchy na dnie i na roślinności zanurzonej, a także na młodych
pędach roślinności wynurzonej, przyspieszając zanik pierwszej, a następnie częściowo także i drugiej. Kożuchy glonów
nitkowatych zupełnie uniemożliwiają rekreacyjne użytkowanie strefy litoralu.4. Zanik tlenu w strefach głębinowych
powoduje wyginięcie większości gatunków zwierząt, w tym w pierwszej kolejności gatunków reliktowych; przy dalszym
wzroście trofii w hypolimnionie w coraz
większym
stężeniu występuje siarkowodór. 5. W sytuacjach skrajnych zupełne
wyczerpanie tlenu i występowanie siarkowodoru zachodzi także w warstwach powierzchniowych (zwłaszcza w okresach
bezwietrznych i przy wysokiej temperaturze); ma to miejsce w zaawansowanej hipertrofii, a zwłaszcza saprotrofii.
Siarkowodór może się ulatniać i zatruwać atmosferę w okolicy. Zimą, zwłaszcza po pokryciu lodu śniegiem (i w
konsekwencji przy braku fotosyntezy i produkcji tlenu), występują przyduchy zimowe - śmiertelność organizmów, zwłaszcza
ryb, w efekcie braku tlenu.6. Omówione zmiany w litoralu, a także deficyty tlenowe, powodują znaczne pogorszenie
warunków tarła i rozrodu ryb, a w konsekwencji zasadnicze zmiany składu i stosunków dominacji w zespołach ryb. Ustępują
ryby łososiowate, ustępuje szczupak, zaczynają dominować ryby karpiowate, głównie mało cenne.7. Deficyty tlenowe w
strefach głębinowych oraz zanik roślinności litoralnej potęguje eutrofizację. W skrajnych (a niestety nierzadkich)
przypadkach dochodzi do tak silnego zanieczyszczenia zbiornika substancją organiczną (saprotrofizacji), (nie może się ona
efektywnie rozkładać; woda ulega zatruciu produktami niepełnego rozkładu tej substancji.
Zbiorniki wodne pod, względem ich żyzności klasyfikuje się jako:
1. oligotroficzhe - ubóstwo soli mineralnych, niska produkcja pierwotna
2. a- i b-mezotroficzne - zbiorniki pośrednie

3. eutroficzne -bogactwo soli mineralnych, wysoka produkcja materii organicznej. Wyróżnia się tu: umiarkowaną eutrofię,
politrofię i hipertrofię.
Eutrofizacja jest procesem naturalnym. Zachodzi ona od początku istnienia zbiorników wodnych. Jeziora, w chwili
powstania, był głównie oligotroficzne (małożyzne, ubogie). Jednak położenie jezior w zagłębieniach terenu oraz otoczenie
zlewnią, często bogato zagospodarowaną, sprawia, iż stale dopływa do nich materia organiczna i nieorganiczna wraz z
zawartymi w niej biogenami. To pozwala na wyróżnienie 2 rodzajów eutrofizacji:
? NATURALNĄ - przebiega bardzo powoli od chwili powstania jeziora. Wywołana głównie zmianami klimatycznymi. Jej
rola w środowisku wodnym jest znikoma i niezauważalna dla człowieka.
? ANTROPOGENICZNĄ (cywilizacyjna, sztuczna) - związana z gospodarką ludzką, tzn. z dopływem
ścieków
,
wycinaniem lasów czy intensyfikacją rolnictwa. Proces ten nasila się zwłaszcza w ostatnim półwieczu. ŹRÓDŁA
Eutrofizacja
prowadzi do dominacji organizmów beztlenowych takich jak saprobionty i gromadzenia się znacznych ilości materii
organicznej (mułów) w wyniku czego morze dojść do coraz większego wypłacania się stref brzegowych mórz.
Eutrofizacja
może być pochodzenia naturalnego lub antropogenicznego. Antropopresja to oddziaływanie człowieka na środowisko
przyrodnicze i występujące w nim biocenozy. Obecnie ten czynnik wykazuje zdecydowaną działalność negatywną.
Eutrofizacja
wód pochodzenia naturalnego to nic innego jak dostarczanie materii organicznej przez pierwiastki znajdujące się w
atmosferze i jest ona ściśle regulowana przez świat zwierzęcy
10. Związki azotowe jako wskaźniki zanieczyszczenia wód
Stopień zanieczyszczenia wód określa się za pomocą tzw. wskaźników zanieczyszczenia, który mówi o stężeniu danej
substancji w miligramach na 1 dm
3
wody. Jednym z najważniejszych wskaźników zanieczyszczenia wód powierzchniowych
jest stężenie rozpuszczonego tlenu, które może przyjmować maksymalną wartość 8,9 mg/dm3 - mniejsze stężenie tlenu
świadczy o zanieczyszczeniu wód związkami organicznymi, rozkładalnymi biochemicznie; spadek stężenia tlenu poniżej 4
mg/dm3 powoduje obumieranie wielu organizmów wodnych. Innymi wskaźnikami zanieczyszczenia wód naturalnych są:
biochemiczne zapotrzebowanie tlenu, będące miarą zawartości rozkładalnych biochemicznie związków organicznych;
chemiczne zapotrzebowanie tlenu - miara zawartości wszystkich związków organicznych; obecność zawiesin mineralnych i
organicznych, a także nieorganicznych i organicznych związków azotu, fosforu.
Prócz sposobów oceny zanieczyszczenia wód opartych na wskaźnikach fizycznych i chemicznych stosuje się metody badania
stanu biologicznego wody. Najczęściej jest stosowany tzw. system saprobowy, wykorzystujący wyniki analizy
hydrobiologicznych wód.
W zależności od składu organizmów wodnych, wody dzieli się na:
oligosaprobowe - czyste,
zanieczyszczone
II klasa - woda do hodowli ryb z wyjątkiem łososiowatych, do hodowli zwierząt gospodarskich, urządzania isk, rekreacji i
sportów wodnych;
III klasa - woda służąca do nawadniania terenów rolniczych, ogrodniczych i upraw pod szkłem, zaopatrzenia
zakładów przemysłowych z wyjątkiem tych, które wymagają wody o jakości wody pitnej.
związki azotu – mogą być pochodzenia organicznego, jako produkty biochemicznego rozkładu białek roślinnych i
zwierzęcych, których źródłem są ścieki oraz organizmy wodne i nieorganiczne – pochodzące z mineralnych
nawozów azotowych, ścieków przemysłowych, z opadów atmosferycznych oraz z powietrza atmosferycznego.
Najczęściej występującymi w wodach nieorganicznymi związkami azotu są : azot amonowy , azot azotynowy i
azot azotanowy. Obecność w wodzie azotu amonowego wskazuje na świeże zanieczyszczenie wody związkami
organicznymi zawierającymi azot , np. ściekami bytowymi. Woda do picia i na potrzeby gospodarcze nie może
zawierać azotu amonowego !!!!!!.
azot organiczny – może być pochodzenia roślinnego i zwierzęcego, ponadto źródłem tej formy azotu mogą być
ścieki miejskie i przemysłowe.
11. Metale ciężkie w wodach i ich toksyczne oddziaływanie
Metale ciężkie - umownie metale, których gęstość przekracza 5 g/cm³ . Metalami ciężkimi są np.: miedź, kadm, ołów, rtęć,
cynk, chrom, nikiel, molibden i arsen.
Zatrucia metalami ciężkimi
Ze względu na znaczną toksyczność wielu tych metali i zdolność do kumulacji (np. w kościach, nerkach, mózgu) ich sole
oraz tlenki mogą być przyczyną groźnych zatruć ostrych i przewlekłych, chorób układu krążenia, układu nerwowego, nerek,
chorób nowotworowych. Metale ciężkie w postaci pierwiastkowej natomiast się zwykle nie wchłaniają.

Zatrucia metalami ciężkimi notuje się szczególnie wśród pracowników określonej gałęzi przemysłu, co powoduje liczne
choroby zawodowe np. ołowicę w wytwórniach bieli ołowiowej i wśród drukarzy. Zatrucia wywołane są też spożywaniem
pokarmów zanieczyszczonych związkami metali, np. rtęcica. Do metali ciężkich zaliczamy: ołów (Pb), rtęć (Hg), arsen (As) i
kadm (Cd).
12. Naturalne związki organiczne w wodach
Rozpuszczone związki pochodzenia organicznego
Organiczne związki zanieczyszczające wodę powstają w wyniku rozkładu roślinnej materii roślinnej (przede wszystkim są to
kwasy huminowe oraz bulwowe), działalności rolnictwa, przemysłu papierniczego, ścieków komunalnych oraz ścieków
odprowadzanych z zakładów przemysłowych. W skład tych zanieczyszczeń wchodzą: detergenty, oleje, tłuszcze,
rozpuszczalniki, pozostałości pestycydów oraz herbicydów. Czasami bywa tak, że obecne w wodzie związki pochodzenia
organicznego są wyługowane z rurociągów oraz zbiorników. Mogą także pochodzić z proszków do prania.
Sposób oczyszczania wody także może być źródłem zanieczyszczeń. Dlatego tez powinien być tak zaprojektowany, aby
usuwać zanieczyszczenia z wody zasilającej, jednocześnie nie wprowadzać dodatkowych zanieczyszczeń, które mogą
pochodzić w wyniku przeprowadzanego oczyszczania.
Związki pochodzenia organicznego, które są obecne w wodzie często nadają wodzie zabarwienie żółto-brązowe i
jednocześnie są w stanie zablokować jonowymienne żywice oraz zanieczyścić wodę już wyprodukowaną. Poziom
zanieczyszczenia pochodzenia organicznego jest mierzony przy pomocy testu na absorpcję tlenu, tzw. test OA, czyli oxygen
absorber, który wykorzystujące roztwór nadmanganianu potasu. Stosowany jest także test chemicznego zapotrzebowania na
tlenu, tzw. COD. Coraz częściej stosuje się analizatory węgla organicznego, tzw. TOC, czyli total organic carbon).
Analizatory te wykazują dużą czułości podczas wykrywania niskich stężeń związków pochodzenia organicznego
organicznych w analizowanych próbkach wody. Sprzęt ten jest w stanie zmierzyć całkowicie utleniony węgiel pochodzenia
organicznego, tzw. TOC. Woda charakteryzująca się niska zawartością TOC jest szczególnie istotna dla następujących
technik: analiza fluoroscencyjna, HPLC. Istotne także jest to, aby woda używana w systemach detekcji ultrafioletowej
charakteryzowała się małym poziomem absorpcji światła ultrafioletowego (0,0001 jednostki absorpcyjne przy długości fali
254 nm).
13. Zanieczyszczenie wód ropą naftową i jej pochodnymi
Zanieczyszczenie wody odpadami ropopochodnymi prowadzi do zaniku w nich tlenu oraz do osadzania się na ich dnie
trujących substancji, które powodują zamieranie wszystkich organizmów.
Niewątpliwie najgroźniejsze dla otwartych mórz i oceanów są katastrofy tankowców i szybów wydobywczych. Pływające
plamy ropy uniemożliwiają dostęp tlenu do wody, przez co giną w niej wszystkie organizmy (rośliny i zwierzęta). Warto
zauważyć, że już samo mycie ładowni tankowców powoduje roczny wyciek do mórz i oceanów od 8 do 20 min baryłek ropy
naftowej. Ekologicznych katastrof tankowców było wiele, jedną z pierwszych był wypadek Torrey Canyon na wodach
przybrzeżnych Kornwalii w 1967 roku. W pobliżu wycieku na plażach, niemal wszystkie formy życia uległy zagładzie, a źle
zorganizowana akcja ratunkowa spowodowała dalsze zniszczenia. Pełna odnowa ekosystemu trwała 6 lat i nie można
jednoznacznie stwierdzić, czy tamtejsze środowisko wróciło do postać z przed katastrofy.
Do kolejnego wielkiego zatrucia środowiska ropą naftową doszło w 1978 roku w wodach przybrzeżnych Bretanii za sprawą
statku Amoco Cadiz. Na ekranach naszych telewizorów mogliśmy zobaczyć, jak w 1989 r. z ładowni Exxon Yaldez wyciekło
aż 26 tysięcy baryłek ropy naftowej, doprowadzając do skażenia wód przybrzeżnych Alaski na długość 1600 km. W akcji
ratunkowej brało udział około 11 tysięcy ludzi, skutki katastrofy udało się złagodzić tylko na ok. 20% powierzchni
zanieczyszczonej linii brzegowej.
W styczniu 1993 roku do opinii publicznej dotarły kolejne zdjęcia katastrofy ekologicznej, kiedy to przewożący 84 tysiące
ton ropy naftowej tankowiec The Braer rozbił się na południe od Szctlandów. Wszystkie tego typu katastrofy prowadziły i
prowadzą nadal do skażenia wód, powietrza i gleby, zagrożenia wyginięciem roślin, ptaków, ryb i ssaków. Wypadki tego
typu to również wielkie straty finansowe poniesione przy usuwaniu ich skutków, oraz później przez ludność zamieszkującą
skażoną okolicę. Pomimo rosnącej świadomości zagrożeń, po morzach i oceanach wciąż krążą statki z niebezpiecznymi
ładunkami.
Pisząc o katastrofach ekologicznych związanych z ropą naftową nie sposób nie wspomnieć o podpalenie kuwejckich szybów
naftowych w czasie wojny w Zatoce Perskiej. Szacuje się, że do zatoki dostało się wtedy od 2,5 do 5 min baryłek ropy
naftowej. Zginęło ok. 25 tysięcy ptaków morskich, a rybacy stracili wiele bogatych łowisk. Rzeczywiste skutki tych działań,
dla człowieka i ziemi, są trudne zarówno do zmierzenia, jak i oszacowania.
14. Uboczne produkty dezynfekcji







15. Sposoby oznaczania stężenia związków organicznych wody (DZT, OWO, utlenialność, CHZT)
Wskaźniki fizyczne i tlenowe
•
oznaczanie zawartości zawiesiny metodą wagową
•
oznaczanie zawartości suchej pozostałości metodą wagową
•
oznaczanie tlenu rozpuszczonego – metodą Winklera
•
oznaczanie BZT
5
– metodą rozcieńczeń
•
oznaczanie ChZT – metodą dwuchromianową i nadmanganianową
Do oceny ogólnego zanieczyszczenia wody substancjami organicznymi wykorzystuje się następujące wskaźniki:
•
BZT (biochemiczne zapotrzebowanie na tlen), sprowadzające się do oznaczenia biochemicznego
zapotrzebowania tlenu (BZT
5
)
•
ChZT (chemiczne zapotrzebowanie na tlen), polegające na określeniu ubytku masy po prażeniu
próbki w temperaturze 550 - 600 °C, na oznaczeniu utlenialności, ogólnego węgla
organicznego oraz chemicznego zapotrzebowania tlenu (ChZT).
•
OWO (ogólny węgiel organiczny),
•
RWO (rozpuszczony węgiel organiczny),
•
absorbcja w nadfiolecie,
•
EWCH (ekstrakt węglowo-chloroformowy),
•
EWA (ekstrakt węglowo-alkoholowy)
Wyszukiwarka
Podobne podstrony:
Chemia wody egzamin, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Chemia nieorganiczna egzamin
biłyk,Chemia wody, Eutrofizacja wód
Chemia pytania egzaminacyjne
temat 12, chemia wody-w-
UBOCZNE PRODUKTY, Chemia wody - (A. Biłyk)
chemia lekw egzamin 820
chemia fizyczna egzamin id 1122 Nieznany
Egzaminy z org. 2011, III semestr, Chemia organiczna, dodatkowe pliki z płyty - chemia organiczna, e
instrukcja cw 1, II rok, II semestr, Chemia wody i powietrza
chemia wody zaliczenie
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZENIE TLENU W WODZIE
zagadnienia Chemia Ogólna egzamin 10 11
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZANIE CHLORKÓW I SIARCZANÓW
biłyk,Chemia wody, opracowanie zagadnień
kwicińska,CHEMIA WODY I POWIETRZA,ODCZYN
więcej podobnych podstron