
POLITECHNIKA GDAŃSKA
WYDZIAŁ CHEMICZNY
KATEDRA TECHNOLOGII CHEMICZNEJ
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH
METODY BIOTECHNOLOGICZNE W OCHRONIE ŚRODOWISKA
BADANIE AKTYWNOŚCI DEHYDROGENAZ
MIKROORGANIZMÓW OSADU CZYNNEGO METODĄ
SPEKTROFOTOMETRYCZNĄ Z TTC
PRZYGOTOWAŁA
mgr inż. Marta Chrzanowska
mgr inż. Justyna Łuczak
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

1. Wprowadzenie
Oczyszczanie biologiczne ścieków za pomocą osadu czynnego polega na wychwytywaniu
zanieczyszczeń przez mikroorganizmy osadu czynnego i ich dalszym rozkładzie w celu
wbudowania ich w biomasę. Oczyszczanie jest możliwe jeżeli zapewnimy mikroorganizmom
odpowiednią ilość substratów, które są źródłem C:N:P oraz innych makro i mikroelementów,
a proces prowadzimy w warunkach tlenowych przy pH 6 - 8. Reakcje rozkładu
zanieczyszczeń przebiegają przy udziale enzymów, występujących w komórkach
drobnoustrojów. O efektywności utleniania substratów decyduje aktywność enzymów
łańcucha oddechowego mikroorganizmów. W procesie tlenowym odłączony od utlenionego
substratu atom wodoru jest przenoszony przez łańcuch oddechowy na końcowy akceptor,
którym jest tlen. Pierwszymi enzymami łańcucha oddechowego są dehydrogenazy, enzymy z
grupy oksydoreduktaz, które biorą udział w procesach utleniania komórkowego, katalizując
odłączanie atomu wodoru od substratu i przenoszenie protonów i elektronów na dalsze
ogniwa łańcucha oddechowego. Aktywność dehydrogenaz może służyć jako wskaźnik
aktywności mikroorganizmów osadu czynnego. Aktywność dehydrogenaz jest zależna od
rodzaju mikroorganizmów, ich fazy wzrostu i żywotności oraz składu fizyko-chemicznego
ścieków, a także od obciążenia osadu ładunkiem zanieczyszczeń. W celu wykonania
oznaczenia konieczne jest rozbicie kłaczków osadu ze względu na zlokalizowanie enzymów
łańcucha oddechowego.
Metoda spektrofotometryczna z chlorkiem trójfenylotetrazoliowym (TTC) służy do
kontroli procesu oczyszczania ścieków metodą osadu czynnego. Badanie to jest szczególnie
konieczne w przypadku oczyszczania ścieków zawierających szereg związków toksycznych,
inhibitorów reakcji biochemicznych. Metoda oznaczania dehydrogenaz służy do oceny
aktywności
biochemicznej
mikroorganizmów
w
procesach
utleniania
związków
organicznych. Oznaczanie tych enzymów stosuje się do kontroli prawidłowości przebiegu
procesu oczyszczania ścieków oraz określania stopnia adaptacji osadu czynnego do ścieków
przemysłowych. W przypadkach pogarszania się efektu oczyszczania ścieków, pomiar
aktywności dehydrogenaz daje podstawę do wprowadzania zmian parametrów technicznych.
Czynnikami przeszkadzającymi w oznaczaniu są światło i tlen.
2. Degradacja fenolu
Fenole są związkami toksycznymi (powodującymi uszkodzenia narządów miąższowych)
stosowanymi w przemyśle jako półprodukty. Występują głównie w ściekach pochodzących z
przemysłu petrochemicznego, farmaceutycznego, papierniczego, hutniczego, tworzyw
sztucznych. Największe ilości znajdują się w ściekach pochodzących z produkcji fenolu i
acetonu – stężenie 3000-15000 ppm. Po wstępnym usuwaniu fizyko-chemicznym (adsorpcja
na wymieniaczu anionowym) stężenie fenolu często nadal jest wysokie i wynosi od 300 do
400 ppm. Prowadzonych jest wiele badań dotyczących biodegradacji fenolu w procesach
mikrobiologicznych lub enzymatycznych. Za degradację związku odpowiedzialne są m.in.
bakterie Actinetobacter calcoaceticus, Pseudomonas sp. CF600, Pseudomonas putida WAS2,
drożdże np. Trichosporon oraz enzymy m.in. oksydaza o-dwufenolanowa otrzymywana z
grzybów, oksydaza polifenolowa lub peroksydazy.
Ograniczenia metod mikrobiologicznych, to przede wszystkim możliwość oczyszczania
ścieków o niskich stężeniach fenolu (do 30 ppm) oraz małej objętości. Metody te
charakteryzują się długim czasem reakcji, dużą wrażliwością na zmiany temperatury i pH.
Szeroko stosowaną obecnie metodą oczyszczania ścieków zarówno miejskich jak i
przemysłowych jest biologiczna metoda oczyszczania ścieków z wykorzystaniem osadu
czynnego. Zasadą oczyszczalni biologicznej jest otrzymanie zawiesiny osadu w ściekach
podczas mieszania i napowietrzania. Ilość osadu czynnego w oczyszczalni jest regulowana
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

poprzez odprowadzanie tzw. osadu nadmiernego oraz recylkulację. Układy technologiczne
oczyszczania ścieków metodą osadu czynnego różnią się między sobą stopniem
biologicznego oczyszczenia. Systemy oczyszczania ścieków metodą osadu czynnego różnią
się między sobą:
- stopniem obciążenia osadu ładunkiem zanieczyszczeń
- wiekiem osadu
- czasem napowietrzania
- sprawnością i efektywnością oczyszczania ścieków.
Usuwanie węglowodorów ze ścieków metodą osadu czynnego polega na ich adsorpcji na
kłaczkach oraz rozkładzie biologicznym. Wymagana jest wstępna aklimatyzacja osadu do
danego rodzaju ścieków.
3. Zasada metody (PN-82 C-04616.08)
Oznaczenie aktywności dehydrogenaz w osadzie czynnym polega na pomiarze ilości
trójfenyloformazanu (TF) wytworzonego z chlorku trójfenylotetrazoliowego (TTC).
Aktywność dehydrogenaz przejawia się w procesie odwodornienia substratu – glukozy,
dodanego do próbki osadu czynnego i przeniesienia wodoru na bezbarwny związek
biologicznie czynny TTC, który ulega redukcji do TF o zabarwieniu czerwonym. Reakcja
odwodornienia glukozy przez dehydrogenazy zachodzi podczas inkubacji odtlenionych
próbek w określonym czasie, temperaturze i odczynie. Intensywność zabarwienia zależy od
ilości wytworzonego formazanu i jest proporcjonalna do aktywności enzymatycznej
mikroorganizmów. TF zostaje wyekstrahowany z próbki za pomocą alkoholu n-butylowego.
Intensywność zabarwienia ekstraktu oznacza się spektrofotometrycznie przy długości fali 490
nm.
W oznaczeniu uwzględnia się badanie próbki kontrolnej bez dodatku substratu
egzogennego – glukozy, w celu określenia intensywności oddychania endogennego
mikroorganizmów osadu czynnego. Jeżeli aktywność dehydrogenaz w próbce z dodatkiem
glukozy jest równa lub niższa niż aktywność dehydrogenaz w próbce bez dodatku glukozy, w
której zachodzi oddychanie endogenne, oznacza to że dodana glukoza nie stanowi źródła dla
mikroorganizmów osadu, a więc osad czynny wykazuje aktywność tylko w stosunku do
substratów wewnątrz komórkowych.
Ze względu na trudności w określaniu żywej biomasy, oznaczane są zawartości
zawiesin ogólnych osadu, w których skład wchodzą żywe organizmy i zawiesiny. Jako wynik
oznaczenia przyjmuje się iloraz ilości trójfenyloformazanu do zawartości zawiesin ogólnych.
4. Przebieg ćwiczenia
4.1.
Cel ćwiczenia
Celem ćwiczenia jest zbadanie zmian aktywności dehydrogenaz mikroorganizmów osadu
czynnego metodą spektrofotometryczną z TTC podczas oczyszczania ścieków zawierających
fenol.
4.2.
Sposób przeprowadzenia pomiarów
Zbadać aktywność dehydrogenaz mikroorganizmów osadu czynnego przed oraz po
dodaniu fenolu. Do zlewki ustawionej na mieszadle wlać 500 cm
3
osadu czynnego, dodać
fenol w ilości podanej przez prowadzącego. Oznaczyć aktywność dehydrogenaz po 5, 10 i 15
min.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
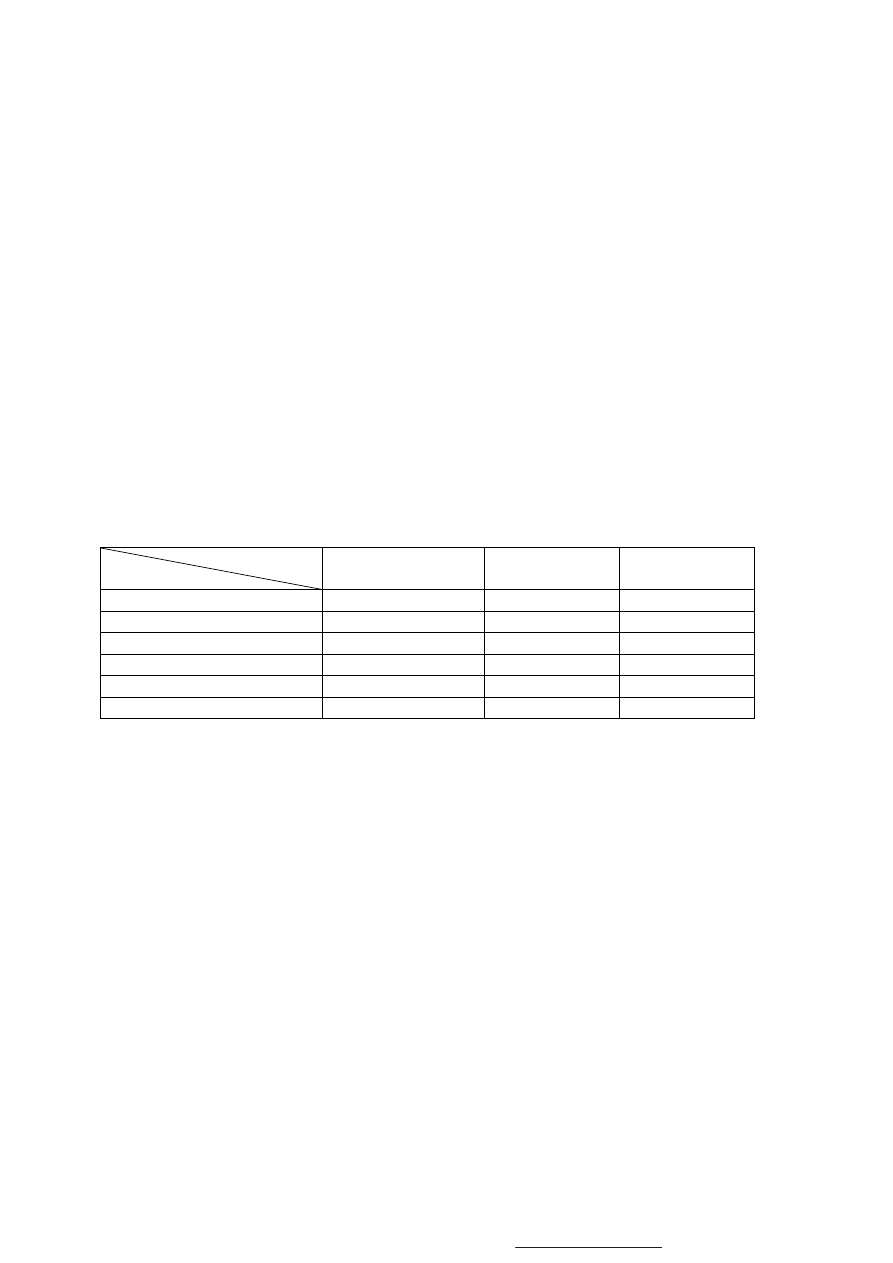
4.2.1. Przygotowanie skali wzorców i sporządzenie krzywej wzorcowej
Do siedmiu cylindrów Nesslera pojemności po 50 cm
2
odmierzyć kolejno: 0,5; 1,0; 2,0; 4,0;
6,0; 8,0; 10,0 cm
2
roztworu wzorcowego roboczego TF i uzupełnić alkoholem n-butylowym
do objętości 50 cm
2
. Tak przygotowane wzorce zawierają odpowiednio: 0,1; 0,2; 0,4; 0,8; 1,6;
2,0
µ
mola TF we wzorcu. Z każdego przygotowanego wzorca pobrać próbkę i zmierzyć jej
absorbancję przy długości fali 490 nm, w kuwetach o grubości warstwy absorbującej 1 cm,
stosując jako odnośnik alkohol n-butylowy. Krzywa wzorcową wykreślić odkładając na osi
odciętych zawartość TF w
µ
molach, a na osi rzędnych, odpowiadające im wartości
absorbancji.
4.2.2. Przygotowanie próbki osadu do badań
Z komory napowietrzania pobrać próbkę ścieków w ilości 50 cm
3
osadu. Całość odwirować w
wirówce przy 5000 obr/min przez 10 minut i zdekantować ciecz nadosadową. Osad przenieść
ilościowo do cylindra miarowego o pojemności 50 cm
3
i uzupełnić do kreski wodą
buforowaną. Całość wymieszać. Przelać zawiesinę do pojemnika homogenizatora nożowego.
Homogenizować przez 0,5 min przy 2500 obr/min.
4.2.3. Wykonanie oznaczenia
W pięciu probówkach pomiarowych z doszlifowanymi korkami pojemności 25-30 cm
2
przygotować roztwory wg tabeli (objętości poszczególnych składników w cm
3
):
Probówka
Roztwór
1,2
3,4
5
(próba ślepa)
Bufor Tris-HCl
5
5
5
Homogenat osadu czynnego
5
5
-
Woda buforowana
-
2
5
Glukoza
2
-
2
Siarczy sodu
1
1
1
TTC
2
2
2
Po zamknięciu korkiem zawartość próbek dokładnie wymieszać. Inkubować w ciemności w
temperaturze 37
o
C przez 30 minut. Po upływie tego czasu zatrzymać reakcje dodając do
każdej próbki po 0,1 cm
3
stężonego kwasu siarkowego – całość dokładnie wymieszać. Do
każdej próbki wlać po 10 cm
3
butanolu i wytrząsać tak długo, aż czerwono zabarwiony
formazan całkowicie rozpuści się w butanolu. Próbkę termostatować przez 5 minut w
temperaturze 90
o
C. Pobrać 5 cm
3
ekstraktu butanolowego i odwirować przy 1000 obr przez
15 minut. Zmierzyć absorbancję klarownego roztworu ekstraktu w spektrofotometrze przy
długości fali = 490 nm, stosując jako odnośnik próbę ślepą. Z dwóch równoległych pomiarów
absorbancji próbek z dodatkiem glukozy odczytać na krzywej wzorcowej zawartość TF w
µ
molach i obliczyć średnią arytmetyczną. Podobnie obliczyć średnią arytmetyczną dwóch
pomiarów dla próbek bez dodatku glukozy. Z krzywej wzorcowej odczytać ilość utworzonego
formazanu w obu próbkach.
4.2.4. Obliczenie wyniku oznaczenia
Aktywność dehydrogenaz osadu czynnego wobec egzogennego substratu (glukozy) oraz
wobec substratów endogennych (substancji zapasowych zawartych w komórkach) obliczyć w
µ
molach na 1 mg suchej masy osadu wg wzoru:
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro

sm
a
A
⋅
⋅
=
5
200
1
1
gdzie:
a
1
– odczytana z krzywej wzorcowej średnia ilość TF w dwóch równoległych próbkach osadu
odpowiadająca próbce osadu o objętości 5 cm
3
, odpowiednio z glukozą lub bez glukozy,
[
µ
M],
sm – sucha masa osadu, [mg/cm
3
]
5 – współczynnik przeliczeniowy z objętości 10 cm
3
na 50 cm
3
alkoholu n-butylowego,
200 – współczynnik przeliczeniowy z objętości 5 cm
3
na 1 dm
3
,
4.2.5. Opracowanie wyników
a) Wykonać krzywa wzorcową przedstawiająca zależność zawartości TF w
µ
molach od
odpowiadających im wartości absorbancji,
b) Podać aktywność dehydrogenaz dla próbek z glukozą oraz dla próbek bez glukozy,
wykonać wykresy zmiany aktywności dehydrogenaz w czasie,
c) Sformułować wnioski.
PDF stworzony przez wersj
ę demonstracyjną pdfFactory Pro
Wyszukiwarka
Podobne podstrony:
Metoda osadu czynnego, metoda zloza biologicznego
Flokulacja kłaczków osadu czynnego przez stymulacją tlenowej aktywności biologicznej
METODA OSADU CZYNNEGO, Ochrona Środowiska
14[1]. Charakterystyka i metody oczyszczania sciekow metoda osadu czynnego, pytania dyplomowe
Mikroskopowe badanie osadu czynnego, Studia - inżynieria & ochrona środowiska (inż. mgr.), Technolog
Mikroskopowe badanie osadu czynnego, Technologia Wody i Ścieków
MIKROBIOLOGIA laboratorium 12-13 Mikrobiologia osadu czynnego, Oczyszczalnia - badania
Usuwanie fosforu ze ścieków metodą osadu czynnego polega na pobieraniu fosforanów z wody osadowej pr
Badanie składu osadu czynnego
11 Ścieki i ich oczyszczanie Analiza sanitarna wody metodą membranową Analiza mikroskopowa osadu czy
Badania aktywnosci mineralnych Nieznany
cw 3 Badanie aktywnosci katalazy
Określanie żywotności i proliferacji komórek metodami spektrofotometrycznymi
OCENA BIOCENOZY OSADU CZYNNEGO Nieznany
Badanie statystycznego charakteru rozpadu promieniotwórczego, Promieniowanie metodą absorbcyjną, Cel
Badanie aktywności amylazy instrukcja 2013
Badanie aktywności optycznej )03A8 nasze, Sprawozdania
więcej podobnych podstron