
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
1
VI. ORESOWOŚĆ WŁAŚCIWOŚCI
PIERWIASTKÓW CHEMICZNYCH
1. Stany skupienia: gazowy, ciekły i stały.
Gazy
H, He
N, O, F, Ne
Cl, Ar,
pozostałe helowce
Ciecze
Br, Hg
(Ga, Cs, Fr - posiadają temp. topnienia
od +27 do +30
o
C)
Ciała stałe: pozostałe pierwiastki

Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
2
2. Promieniotwórczość
2.1. Naturalna
a) Pierwiastki ciężkie od Z = 84 do Z = 92 z wyjątkiem
Z = 85 (At), tj. Po, Rn, Fr, Ra, Ac, Th, Pa i U,
występują
wyłącznie
w
postaci
naturalnych
izotopów promieniotwórczych.
Izotopy tych pierwiastków tworzą 3 szeregi
promieniotwórcze:
1) 4n Torowy
232
Th
→
→
→
→
208
Pb
2) 4n+2 Uranowo-radowy
238
U
→
→
→
→
206
Pb
3) 4n+3 Uranowo-aktynowy
235
U
→
→
→
→
207
Pb
b) Izotopy promieniotwórcze o Z < 84:
40
K,
14
C,
3
H
i
inne
naturalne
izotopy
promieniotwórcze

Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
3
2.2. Sztuczna
a) Tc (Z = 43), Pm (Z = 61), At (Z = 85)
b) Pierwiastki o Z > 92
c) sztuczne izotopy promieniotwórcze pierwiastków
o Z < 92
np. Cs-137, I-131, Co-60.
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
4
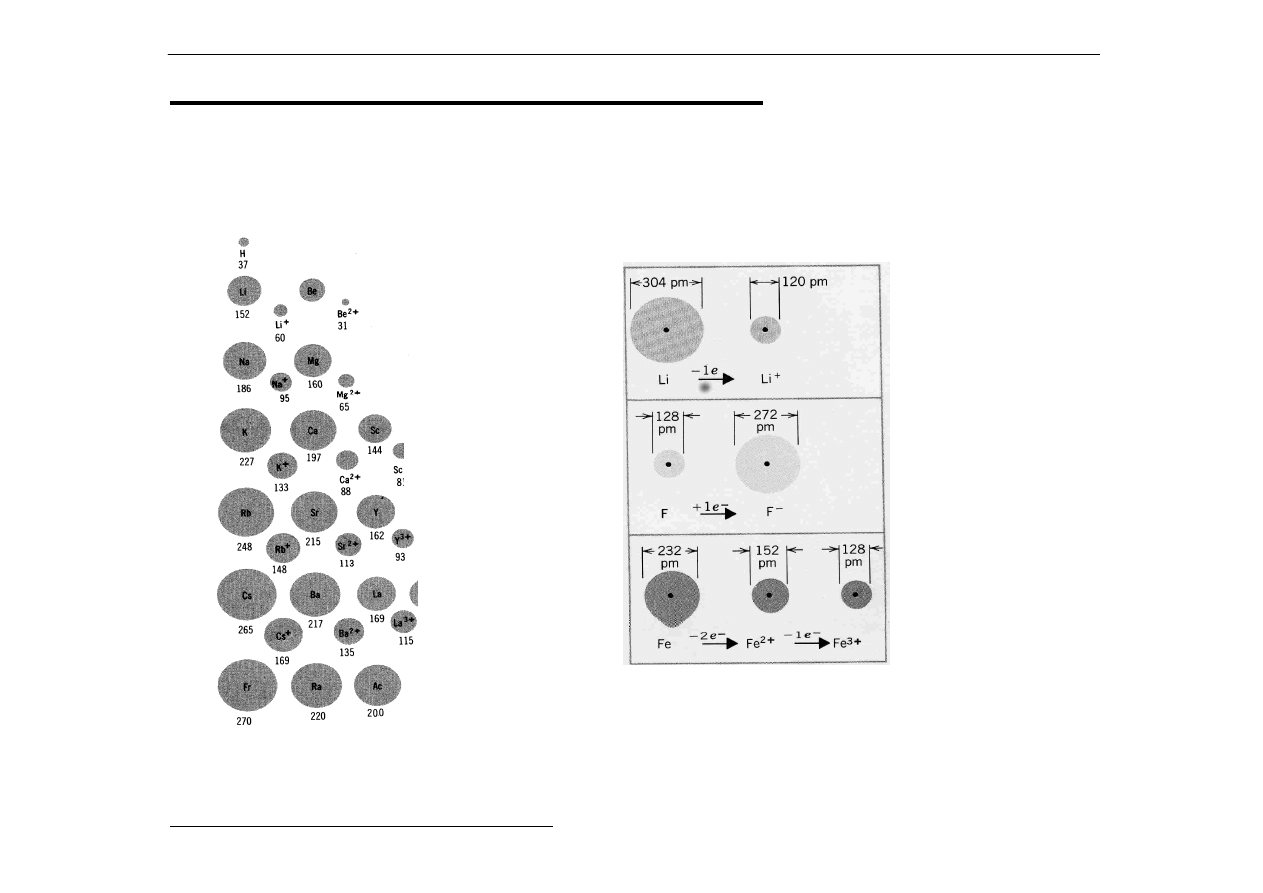
3. Promienie atomowe i jonowe
Promienie atomowe i jonowe podane są tutaj
w pm (pikometrach).
b) Promienie atomowe a promienie
jonowe dla kationów i anionów
a)
Pierwsze 3 grupy
układu okresowego
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
5
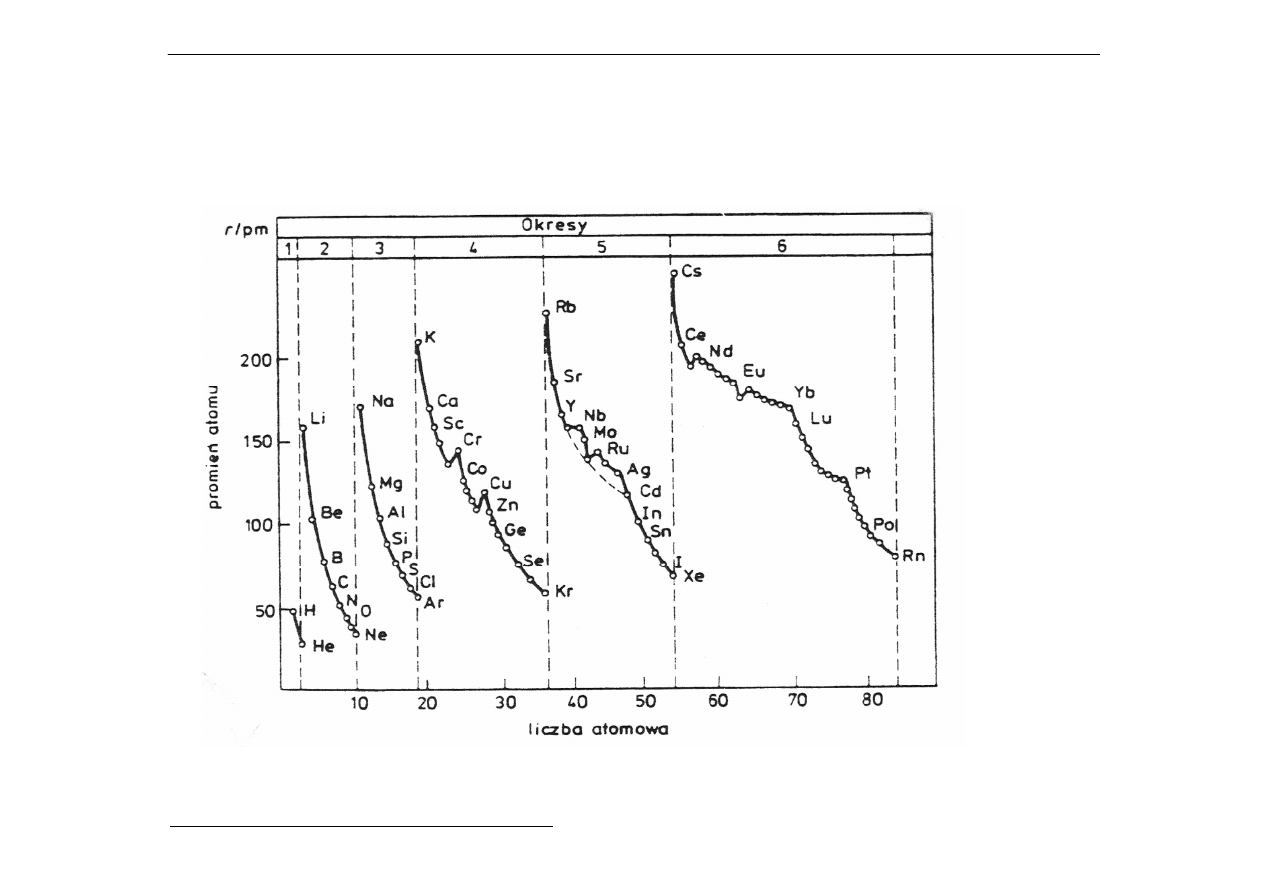
c) Promienie atomowe pierwiastków w poszczególnych
okresach (w pm):
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
6
d) Promienie atomowe a układ okresowy
Pewne
odstępstwa,
zwane
kontrakcją
lantanowcową, pokazane zostaną przy omawianiu
pierwiastków d-elektronowych, (Kurs CHC1041w).
wzrost promienia
w
z
r
o
s
t
p
r
o
m
ie
n
ia

Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
7
4. Energia jonizacji (I)
Energia jonizacji jest to energia
potrzebna do oderwania elektronu z atomu
i przeniesienia go poza sferę oddziaływania
A + energia (1)
→
→
→
→
A
+
+ e
A
+
+ energia (2)
→
→
→
→
A
2+
+ e
A
2+
+ energia (3)
→
→
→
→
A
3+
+ e
energia (1) << energia (2) << energia (3)
Energię jonizacji podajemy w eV/atom lub kJ/mol
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
8
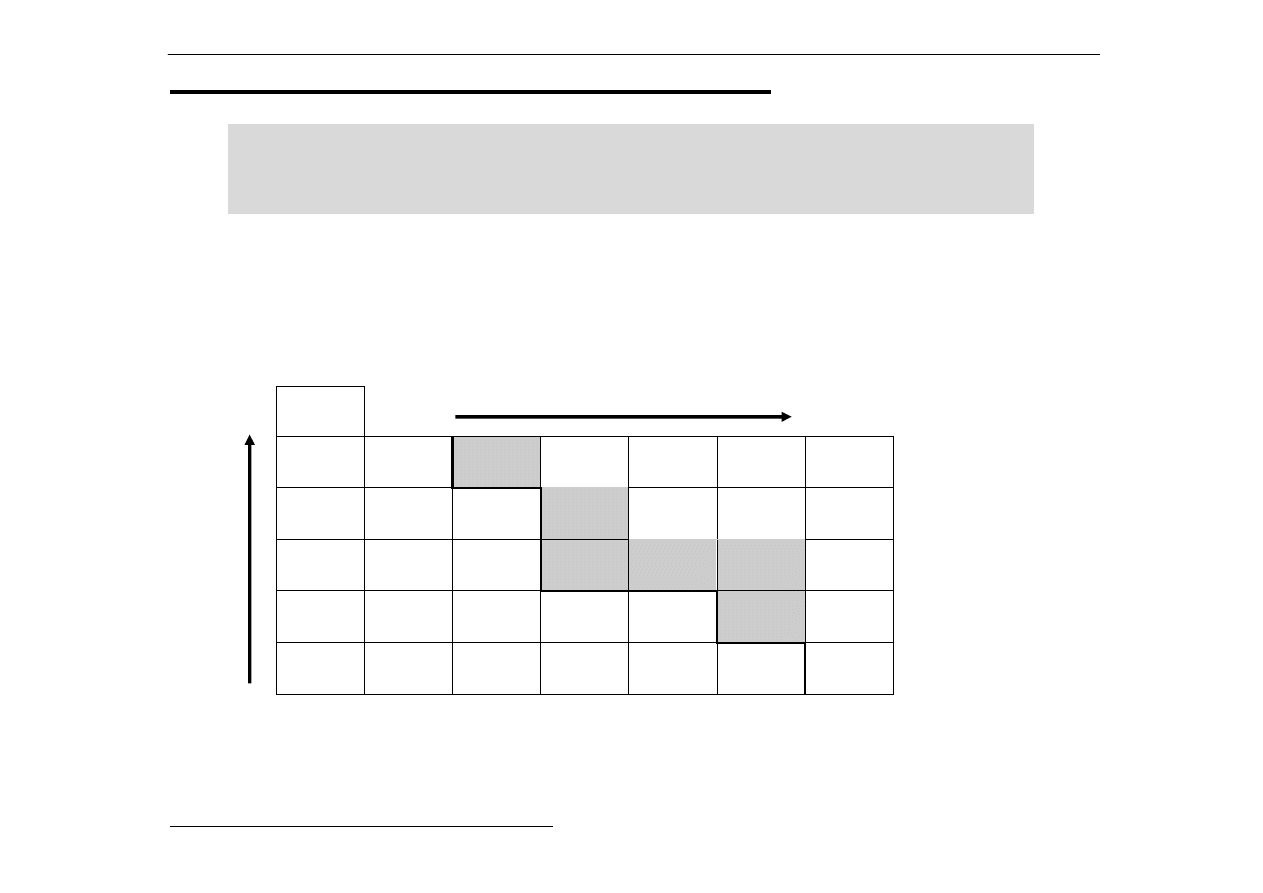
Ogólny trend:
Na
Mg
Al
Si
P
S
Cl
Ar
E(1),
kJ/mol 496 738 578 787 1010 995 1255 1521
Szczególna trwałość konfiguracji typu s
2
(Mg) i s
2
p
3
(P)
wzrost energii jonizacji
w
zr
o
s
t
e
n
.
j
o
n
iza
c
ji
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
9
5. Elektroujemność pierwiastków
Jest to umowna miara skłonności atomu
do przyciągania elektronów podczas tworzenia
wiązania chemicznego
Jest kilka skal, tj. Paulinga, Mullikana oraz Allreda
i Rochowa
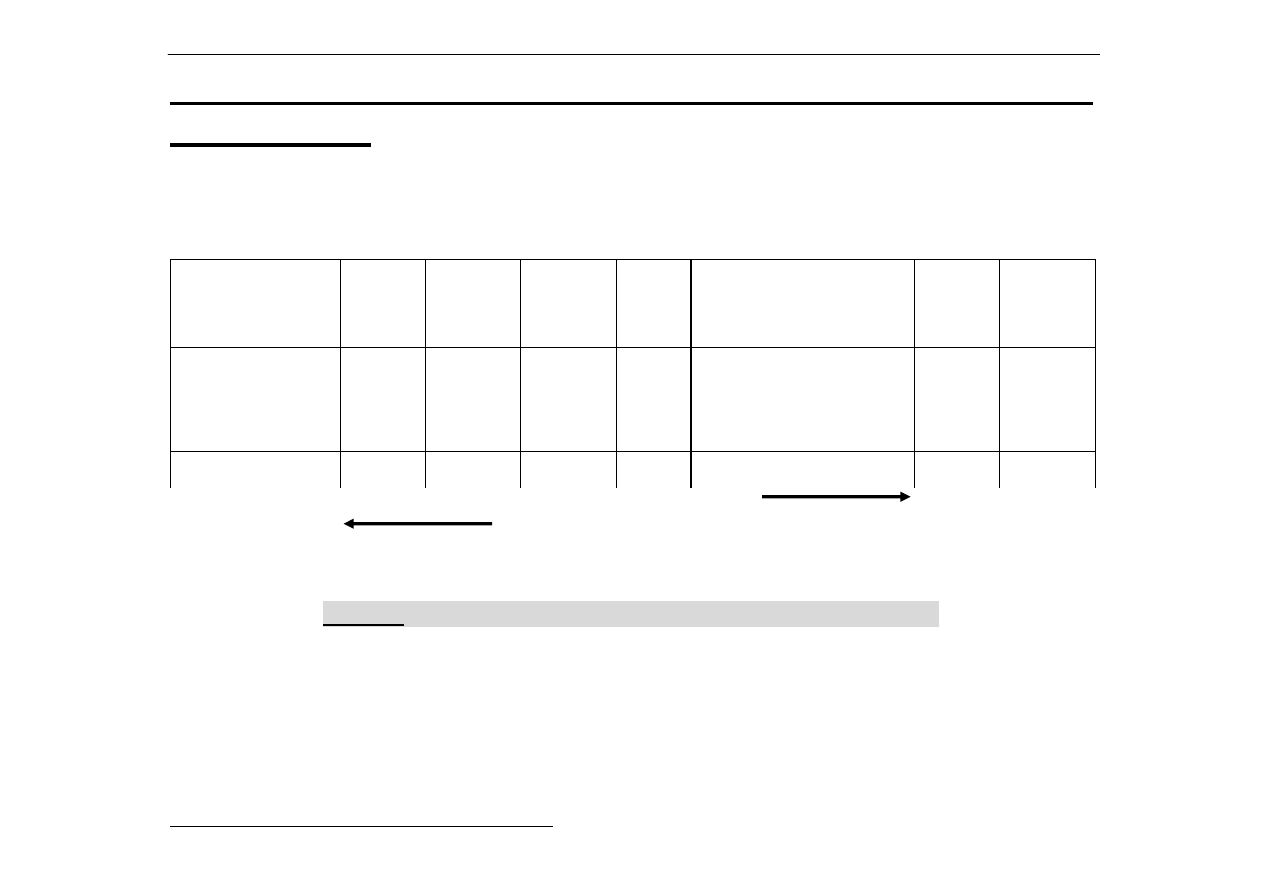
Elektroujemność (wg Paulinga) pierwiastków
grup głównych:
H
2,1
Li
1,0
Be
1,5
B
2,0
C
2,5
N
3,0
O
3,5
F
4,0
Na
1,0
Mg
1,2
Al
1,5
Si
1,8
P
2,1
S
2,5
Cl
3,0
K
0,8
Ca
1,0
Ga
1,6
Ge
1,8
As
2,0
Se
2,4
Br
2,8
Rb
0,8
Sr
1,0
In
1,7
Sn
1,8
Sb
1,9
Te
2,1
I
2,5
Cs
0,7
Ba
0,9
Tl
1,8
Pb
1,8
Bi
1,9
Po
2,0
At
2,2
Metale - elektroujemność < 1,8
Półmetale - elektroujemność 1,8 - 2,1 z wyjątkiem selenu (2,4)
Niemetale - elektroujemność > 2,1
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
10
6. Stopnie utlenienia pierw. grup głównych w tlenkach
i wodorkach
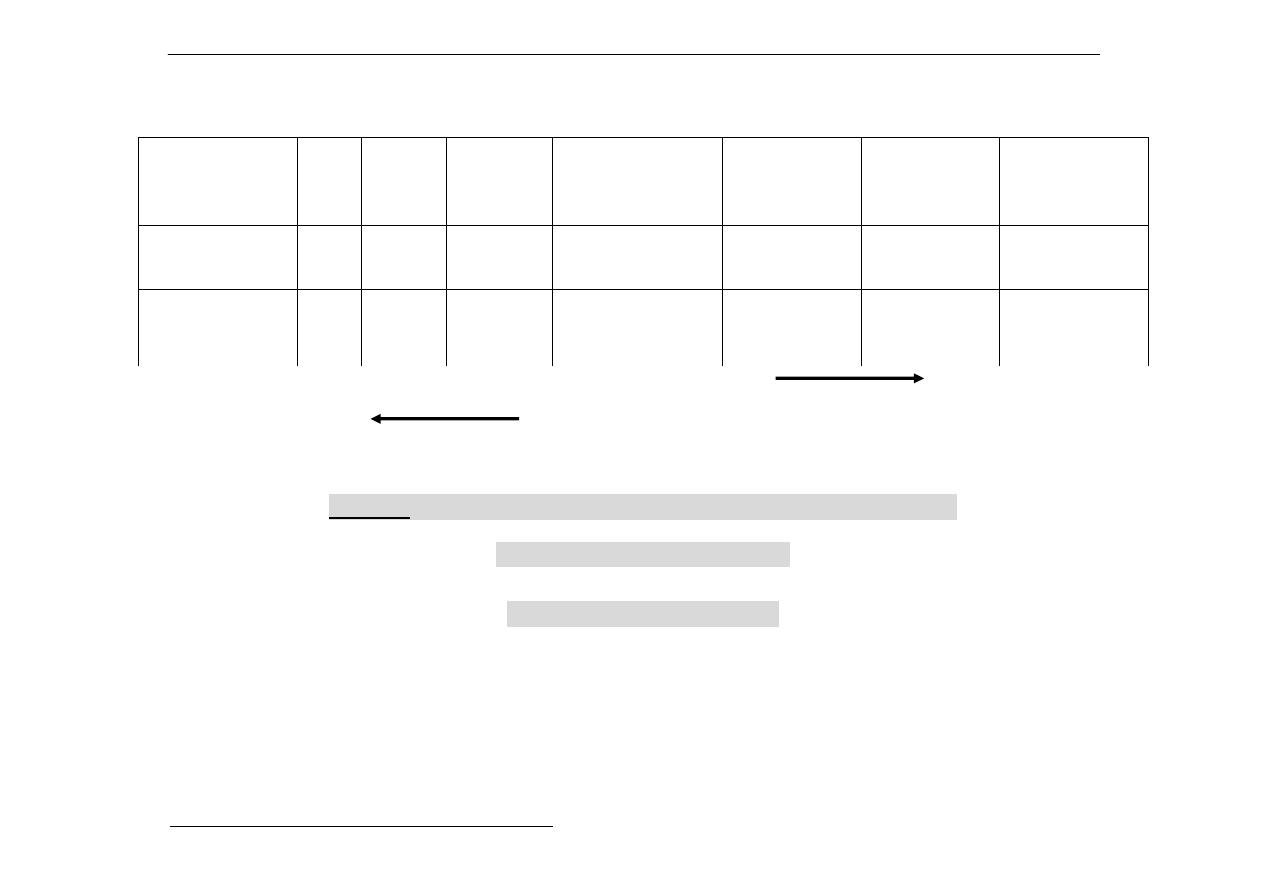
a) Tlenki
Numer
grupy
głównej
I
II
III
IV
V
VI
VII
Maksymalne
stopnie
utlenienia
pierwiastka
+1
+2
+3
+4
+5
+6
+7
Tlenki
Na
2
O
MgO
Al
2
O
3
SiO
2
(P
2
O
5
)
2
= P
4
O
10
SO
3
Cl
2
O
7
Wzrost kwasowości
wzrost zasadowości
Uwaga: stopień utlenienia tlenu w tlenkach jest –2
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
11
b) Wodorki
Numer
grupy
głównej
I
II
III
IV
V
VI
VII
Wodorki
LiH BeH
2
(BH
3
)
2
B
2
H
6
CH
4
NH
3
H
2
O
HF
Stopnie
utlenienia
pierwiastka
+1
+2
+3
+4 -8 = -4
+5 -8 = -3 +6 -8 = -2 +7 -8 = -1
Wzrost kwasowości
wzrost zasadowości
Uwaga : stopnie utlenienia wodoru w wodorkach są :
–1 (LiH, BeH
2
, B
2
H
6
) lub
+1 (CH
4
, NH
3
, H
2
O, HF)
Władysław Walkowiak – PCHN_SKP
Rozdział VII. Okresowość właściwości pierwiastków chemicznych
12
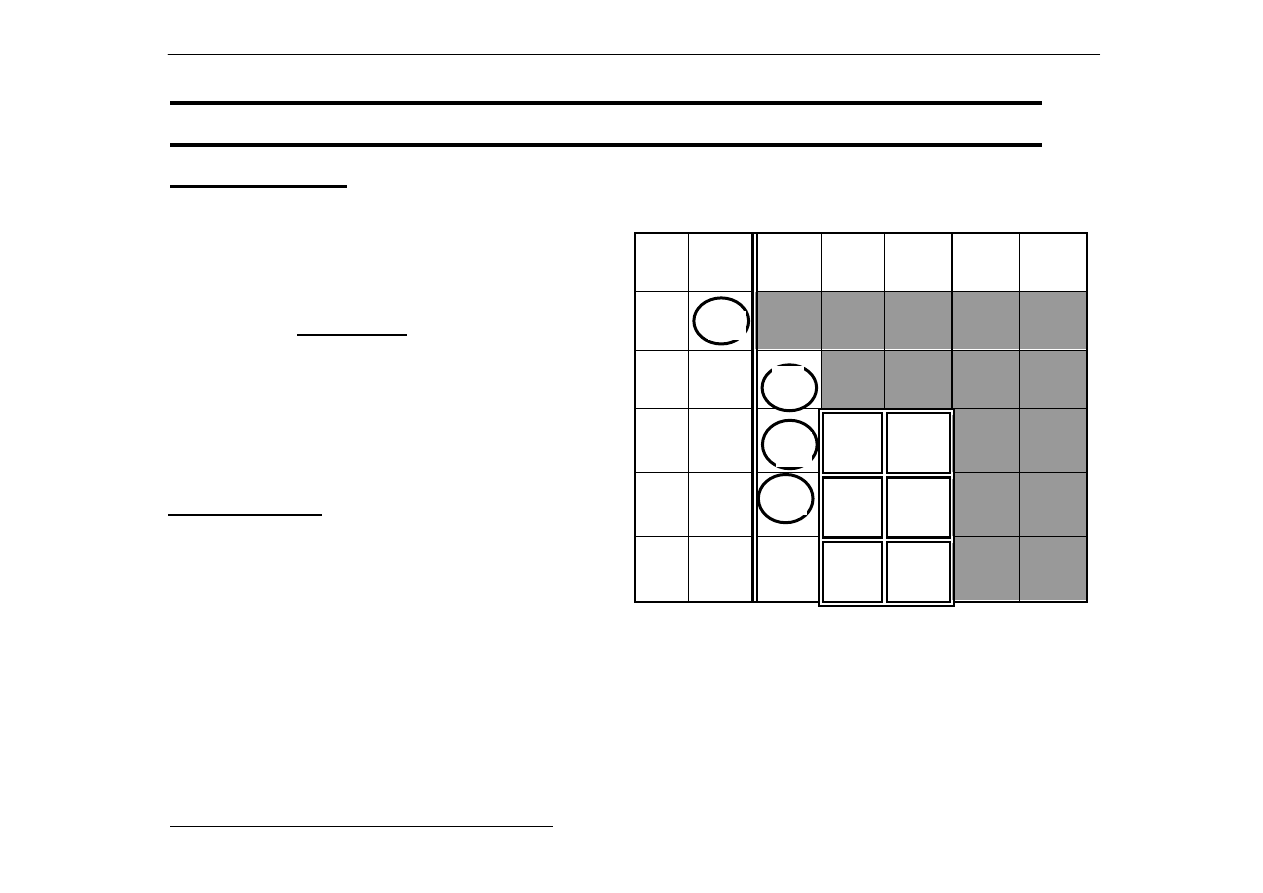
7.
Kwasowe,
zasadowe
i
amfoteryczne
właściwości
tlenków
pierwiastków
grup
głównych
I
II
III
IV
V
VI
VII
Ge
As
Sn
Sb
Pb
Bi
U w a g a: amfoteryczny
≡≡≡≡
obojnaczy, tzn. w zależności od warunków
kwasowo-zasadowych kwasowy albo zasadowy
Koniec rozdziału VI
Be
Al
Ga
Pola jasne - tlenki zasadowe.
Pola ciemne - tlenki kwasowe.
Pierwiastki w kółkach posiadają
tlenki o właściwościach
amfoterycznych na wyższych
stopniach utlenienia.
Natomiast pierwiastki
w kwadratach
posiadają tlenki o
właściwościach
amfoterycznych na niższych
stopniach utlenienia
(np. SnO – amfoteryczny a SnO
2
ma
właściwości
kwasowe).
In
Wyszukiwarka
Podobne podstrony:
Układ okresowy, a właściwości pierwiastków
WYKŁAD 7. Okresowosc wlasciwosci pierwiastkow, chomikowe, WYKŁADY z Chemii
Walkowiach, Chemia ogólna, Okresowość właściwości pierwiastków chemicznych
Układ okresowy, a właściwości pierwiastków
Arkusz WSiP Właściwości pierwiastków bloku d
chemia, wlasciwosci pierwiastkow2, Wodór
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
39 Właściwości pierwiastków grup głównych w powiązaniu z konfiguracją elektronową elektronów walency
AS V właściwości pierwiastków bloku s i p M komentarz
AS V właściwości pierwiastków bloku s i p M
Mikrobiologia Woda właściwosci fiz, chem, biol i bakteriologiczne
wlasciwosci pierwiastkow2
więcej podobnych podstron