
1
Zadanie 1.
Dostałeś w spadku działkę budowlaną w okolicach Polkowic. Teren jest
częściowo uzbrojony. Jest kanalizacja, ale wodę musisz mieć swoją.
Zamawiasz studnię wierconą, która kosztuje Cię dość sporo bo
zwierciadło wód gruntowych, jak się okazało, jest tam głęboko.
Podobno, jak twierdzi sąsiad: „to przez te kopalnie pod nami”. Z
przerażeniem myślisz, że Twoja woda może pochodzić z poziomu
piaskowców kruszconośnych bogatych w chloroargiryt. Zanim wyślesz
próbkę do analizy na srebro postanawiasz policzyć, ile srebra byłoby
w wodzie, gdyby była ona w równowadze z chloroargirytem. Ponadto
woda z tej studni wierconej jest bardzo zimna (ma ok. 10
o
C).
Zastanawiasz się, czy jak się ogrzeje, np. przy myciu zębów, to czy
nie wytrąci się chloroargiryt?
a) czy chloroargiryt jest trwałym minerałem w reakcji
rozpuszczania?
AgCl Ag
+
+ Cl
-
(dla T=25
o
C i P=1atm.)
b) oblicz stałą równowagi K
(równą w tym wypadku stałej
rozpuszczalności K
sp
) dla temperatury wody w studni 10
o
C. Jeżeli
założymy, że jedynym źródłem Ag i Cl w wodzie jest
rozpuszczający się chloroargiryt to stężenie srebra w wodzie
studziennej wyniesie
mol/dm
3
(ponieważ K
sp
= [Ag
+
]
[Cl
-
],
[Ag
+
]=[Cl
-
]).
c) jeśli Twoja woda studzienna ogrzeje się do 25
o
C to, czy
spowoduje to wytrącenie się chloroargirytu?
Zadanie 2.
Powtórz to samo zadanie przyjmując, że piaskowce kruszconośne są
bogate w bromoargiryt (AgBr).
Zadanie 3.
Dostarczono Ci wyniki analiz chemicznych zestawione w mg/dm
3
dla
dwóch wód mineralnych (nr 1,2) i dwóch powierzchniowych (nr 3,4).
przedstaw wyniki w mmol/dm
3
i mval/dm
3
sprawdź poprawność analizy (oblicz bilans jonowy i podaj błąd
analizy %)
oblicz twardość wód (mval/dm
3
) i dokonaj klasyfikacji na jej
podstawie
przedstaw wyniki analiz chemicznych na diagramach Pipera i
Stiffa
porównaj parametry ChZT i BZT dla wód powierzchniowych i podaj
wnioski

2
Zadanie 1.
a)
W celu ustalenia czy chloroargiryt w reakcji rozpuszczania jest
trwałym minerałem należy obliczyć energię swobodną Gibbsa
reakcji.
AgCl Ag
+
+ Cl
-
(dla T=25
o
C i P=1atm.)
Dane do zadania należy odczytać z tablic termodynamicznych:
ΔH
o
[J/mol]
S
o
[J/mol]
K
Chloroargiryt
-127070
96,23
Ag
+
105750
73,38
Cl
-
-167080
56,73
W wyniku obliczenia energii swobodnej Gibbsa reakcji można ustalić,
czy chloroargiryt jest minerałem trwałym podczas rozpuszczania w
warunkach normalnych.
Energię swobodną reakcji obliczono z zależności:
ΔG = ΔH – T
ΔS
gdzie:
T = 25 [
o
C] = 298,15 [K] - temperatura
ΔH
o
reakcji
= ΔH
o
produktów
- ΔH
o
substratów
= [105750 + (-167080)] - (-127070)
ΔH
o
reakcji
= 65740 [J/mol]
ΔS
o
reakcji
= ΔS
o
produktów
- ΔS
o
substratów
= (73,38 + 56,73) - 96,23
ΔS
o
reakcji
= 33,88 [J/mol]
ΔG
o
reakcji
= ΔH
o
reakcji
– T
ΔS
o
reakcji
= 65740 – 298,15
33,88
ΔG
o
reakcji
= 55638,68 [J/mol] > 0
Wartość energii swobodnej Gibbsa jest większa od 0 (ΔG
o
> 0), co
wskazuje na to, że reakcja zachodzi samorzutnie w lewo. Samorzutny
przebieg reakcji w lewą stronę świadczy o tym, że chloroargiryt jest
minerałem trwałym podczas rozpuszczania w warunkach normalnych. Poza
tym reakcja ma dodatnią entalpię (ΔH
o
> 0), więc należy do procesów
endotermicznych, czyli takich, którym towarzyszy pochłanianie ciepła
z otoczenia.

3
b)
W celu obliczenia stałej równowagi K (równej w tym wypadku
stałej rozpuszczalności K
sp
) dla temperatury wody w studni 10
o
C
należy w pierwszej kolejności wyznaczyć stałą rozpuszczalności
w warunkach normalnych (K
sp25
) korzystając z równania:
0 = ΔG
o
r
+ RTlnK
sp25
gdzie:
R = 8,314 [J/mol*K] - stała gazowa
T
25
= 25
o
C = 298,15 [K] - temperatura
ΔG
o
r
=
55638,68 [J/mol] - energia swobodna Gibbsa
0 = 55638,68 + 8,314
298,15lnK
sp25
-55638,68 = 2478,8191
lnK
sp25
lnK
sp25
= -22,4456
K
sp25
= e
-22,4456
= 1,79
10
-10
/
log
logK
sp25
= -9,75
K
sp25
= 10
-9,75
Następnym krokiem jest wykorzystanie równania Van’t Hoff’a do
obliczenia stałej rozpuszczalności K
sp10
(dla 10
o
C):
ln(K
sp10
/K
sp25
)= (-ΔH
o
r
/R)
(1/T
10
- 1/T
25
)
gdzie:
ΔH
o
r
= 65740 [J/mol] - entalpia
K
sp10
= ? - stała rozpuszczalności dla temperatury 10
o
C
K
sp25
= 10
-9,75
- stała rozpuszczalności dla temperatury 25
o
C
R = 8,314 [J/mol
K] - stała gazowa
T
10
= 10
o
C = 283,15 [K] - temperatura
T
25
= 25
o
C = 298,15 [K] - temperatura

4
ln(K
sp10
/10
-9,75
) = (-65740/8,314)
(1/283,15 - 1/298,15)
ln(K
sp10
/10
-9,75
) = -1,405
lnK
sp10
- ln10
-9,75
= -1,405
lnK
sp10
+ 22,450 = -1,405
lnK
sp10
= -23,855
K
sp10
= e
-23,855
= 4,36
10
-11
/
log
logK
sp10
= -10,36
K
sp10
= 10
-10,36
Po obliczeniu stałej rozpuszczalności K
sp
dla poszczególnych
temperatur (10
o
C i 25
o
C) zauważono, że stała rozpuszczalności wzrasta
wraz ze wzrostem temperatury, co jest tożsame z tym, że ze wzrostem
temperatury rośnie sama rozpuszczalność.
Stężenie srebra (Ag) w wodzie studziennej wynosi
:
–
= 6,607
10
-6
[mol/dm
3
]
c)
W celu określenia, czy po podgrzaniu wody studziennej do 25
o
C
wytrąci się chloroargiryt, niezbędnym jest ustalenie wartości
współczynnika nasycenia SI lub analiza punktu b) i powiązane z
nią wnioski. W związku z tym, że wartość stałej
rozpuszczalności K
sp
wraz ze wzrostem temperatury jest coraz
większa (mniej ujemna) stwierdzono, że przy takiej tendencji
rozpuszczalność samego chloroargirytu jest łatwiejsza, a co za
tym idzie, minerał ten nie wytrąci się w podgrzanej do 25
o
C
wodzie.

5
Zadanie 2.
a) W celu ustalenia czy bromoargiryt w reakcji rozpuszczania jest
trwałym minerałem należy obliczyć energię swobodną Gibbsa reakcji.
AgBr Ag
+
+ Br
-
(dla T=25
o
C i P=1atm.)
Dane do zadania należy odczytać z tablic termodynamicznych:
ΔH
o
[J/mol]
S
o
[J/mol]
K
Bromoargiryt
-100580
107,11
Ag
+
105750
73,38
Br
-
-121500
82,84
W wyniku obliczenia energii swobodnej Gibbsa reakcji można ustalić,
czy bromoargiryt jest minerałem trwałym podczas rozpuszczania w
warunkach normalnych.
Energię swobodną reakcji obliczono z zależności:
ΔG = ΔH - T
ΔS
gdzie:
T = 25 [
o
C] = 298,15 [K] - temperatura
ΔH
o
reakcji
= ΔH
o
produktów
- ΔH
o
substratów
= [105750 + (-121500)] - (-100580)
ΔH
o
reakcji
= 84830 [J/mol]
ΔS
o
reakcji
= ΔS
o
produktów
- ΔS
o
substratów
= (73,38 + 82,84) - 107,11
ΔS
o
reakcji
= 49,11 [J/mol]
ΔG
o
reakcji
= ΔH
o
reakcji
– T
ΔS
o
reakcji
= 84830 - 298,15
49,11
ΔG
o
reakcji
= 70187,85 [J/mol] > 0
Wartość energii swobodnej Gibbsa jest większa od 0 (ΔG
o
> 0), co
wskazuje na to, że reakcja zachodzi samorzutnie w lewo. Samorzutny
przebieg reakcji w lewą stronę świadczy o tym, że bromoargiryt jest
minerałem trwałym podczas rozpuszczania w warunkach normalnych. Poza
tym reakcja ma dodatnią entalpię (ΔH
o
> 0), więc należy do procesów
endotermicznych, czyli takich, którym towarzyszy pochłanianie ciepła
z otoczenia.

6
b)
W celu obliczenia stałej równowagi K (równej w tym wypadku
stałej rozpuszczalności K
sp
) dla temperatury wody w studni 10
o
C
należy w pierwszej kolejności wyznaczyć stałą rozpuszczalności
w warunkach normalnych (K
sp25
) korzystając z równania:
0 = ΔG
o
r
+ RTlnK
sp25
gdzie:
R = 8,314 [J/mol
K] - stała gazowa
T
25
= 25
o
C = 298,15 [K] - temperatura
ΔG
o
r
= 70187,85 [J/mol] - energia swobodna Gibbsa
0 = 70187,85 + 8,314
298,15lnK
sp25
-70187,85 = 2478,8191lnK
sp25
lnK
sp25
= -28,3150
K
sp25
= e
-28,3150
= 5,05
10
-13
/
log
logK
sp25
= -12,298
K
sp25
= 10
-12,298
Następnym krokiem jest wykorzystanie równania Van’t Hoff’a do
obliczenia stałej rozpuszczalności K
sp10
(dla 10
o
C):
ln(K
sp10
/K
sp25
)= (-ΔH
o
r
/R)
(1/T
10
- 1/T
25
)
gdzie:
ΔH
o
r
= 84830 [J/mol] - entalpia reakcji
K
sp10
= ? - współczynnik rozpuszczalności dla 10
o
C
K
sp25
= 10
-12,298
- współczynnik rozpuszczalności dla 25
o
C
R = 8,314 [J/mol
K] - stała gazowa
T
10
= 10
o
C = 283,15 [K] - temperatura
T
25
= 25
o
C = 298,15 [K] - temperatura

7
ln(K
sp10
/10
-12,298
)= (-84830/8,314)
(1/283,15 - 1/298,15)
ln(K
sp10
/10
-12,298
) = -1,813
lnK
sp10
- ln10
-12,298
= -1,813
lnK
sp10
+ 28,317 = -1,813
lnK
sp10
= -30,13
K
sp10
= e
-30,13
= 8,22
10
-14
/
log
logK
sp10
= -13,09
K
sp10
= 10
-13,09
Po obliczeniu stałej rozpuszczalności K
sp
dla poszczególnych
temperatur (10
o
C i 25
o
C) zauważono, że stała rozpuszczalności wzrasta
wraz ze wzrostem temperatury, co jest tożsame z tym, że ze wzrostem
temperatury rośnie sama rozpuszczalność.
Stężenie srebra (Ag) w wodzie studziennej wynosi
:
= 2,851
10
-7
[mol/dm
3
]
c)
W celu określenia, czy po podgrzaniu wody studziennej do 25
o
C
wytrąci się bromoargiryt, niezbędnym jest ustalenie wartości
współczynnika nasycenia SI lub analiza punktu b) i powiązane z
nią wnioski. W związku z tym, że wartość stałej
rozpuszczalności K
sp
wraz ze wzrostem temperatury jest coraz
większa (mniej ujemna) stwierdzono, że przy takiej tendencji
rozpuszczalność samego bromoargirytu jest łatwiejsza, a co za
tym idzie, minerał ten nie wytrąci się w podgrzanej do 25
o
C
wodzie.
8
Zadanie 3.
a)
Przedstawienie wyników w mmol/dm
3
i mval/dm
3
W celu przeliczenia danych z mg/dm
3
na mmol/dm
3
podzielono wartości
podane w mg/dm
3
przez masy molowe odpowiednich pierwiastków/związków
chemicznych. Dane w mval/dm
3
uzyskano w wyniku pomnożenia wartości w
mmol/dm
3
przez ładunki odpowiednich jonów.
Próbka 1
Składnik
mg/dm
3
mmol/dm
3
mval/dm
3
Kationy
Ca
2+
394,5
9,84
19,68
Mg
2+
46,92
1,93
3,86
Na
+
62,9
2,74
2,74
K
+
7,61
0,19
0,19
Li
+
0,12
0,02
0,02
Fe
2+
5,72
0,10
0,20
Mn
2+
2,18
0,04
0,08
Sr
2+
0,91
0,01
0,02
Ba
2+
0,69
0,01
0,02
SUMA
521,55
14,88
26,81
Aniony
HCO
3
-
1595
26,15
26,15
SO
4
2-
7,71
0,08
0,16
Cl
-
1,9
0,05
0,05
Br
-
b.d.
b.d.
b.d.
I
-
b.d.
b.d.
b.d.
SUMA
1604,61
26,29
26,36
Pozostałe
CO
2
2820
-
-
H
2
S
b.d.
-
-
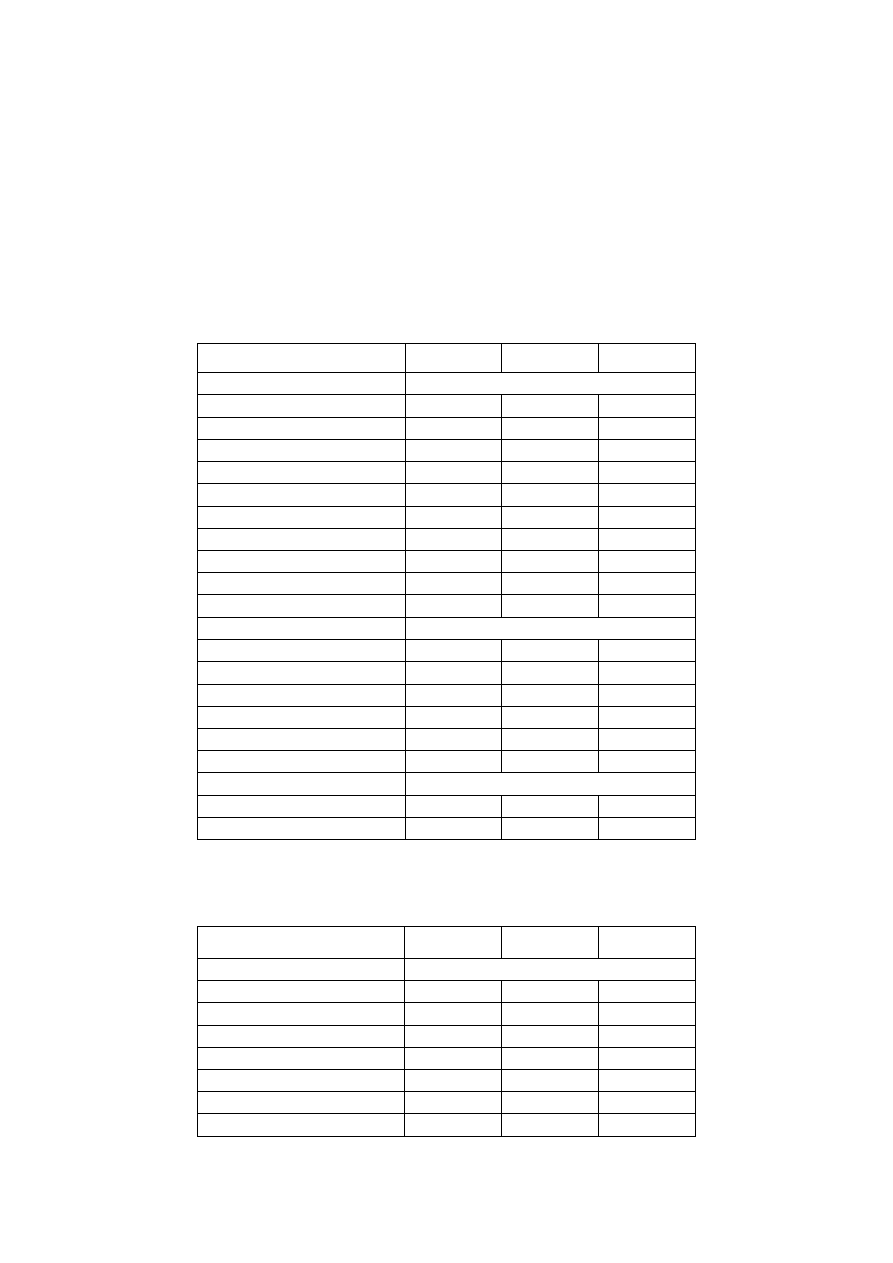
Próbka 2
Składnik
mg/dm
3
mmol/dm
3
mval/dm
3
Kationy
Ca
2+
423,5
10,57
21,14
Mg
2+
40,56
1,67
3,34
Na
+
6,08
0,26
0,26
K
+
3,63
0,09
0,09
Li
+
0,02
0,003
0,003
Fe
2+
14,20
0,25
0,50
Mn
2+
0,86
0,02
0,04
9
Sr
2+
3,00
0,03
0,06
Ba
2+
0,57
0,004
0,008
SUMA
492,42
12,90
25,44
Aniony
HCO
3
-
1456
23,87
23,87
SO
4
2-
27,80
0,29
0,58
Cl
-
6,2
0,17
0,17
Br
-
0,05
0,0006
0,0006
I
-
0,03
0,0002
0,0002
SUMA
1490,08
24,34
24,62
Pozostałe
CO
2
2292
-
-
H
2
S
b.d.
-
-
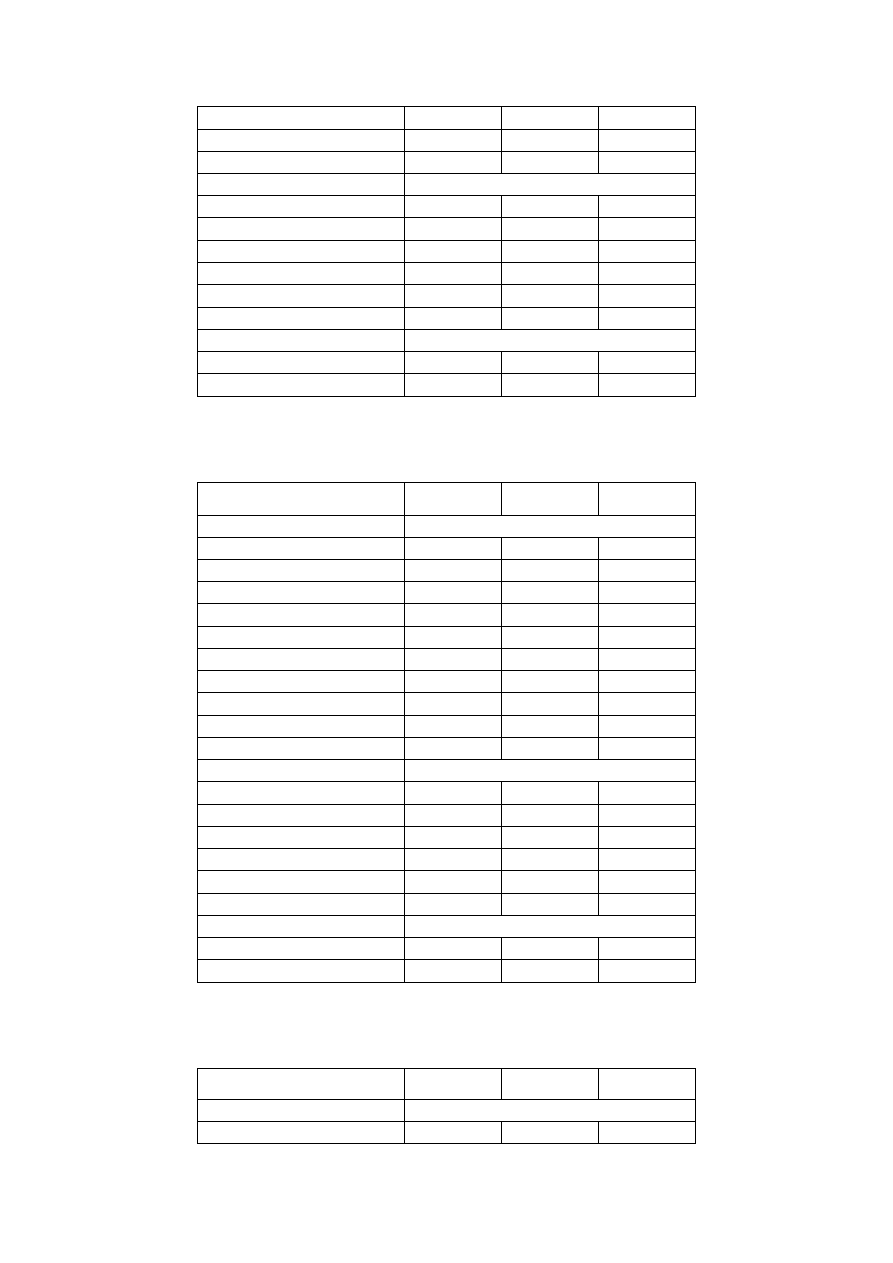
Próbka 3
Składnik
mg/dm
3
mmol/dm
3
mval/dm
3
Kationy
Ca
2+
37,92
0,95
1,90
Mg
2+
18,94
0,78
1,56
Na
+
7,08
0,31
0,31
K
+
1,83
0,05
0,05
NH
4
+
0,31
0,02
0,02
Li
+
0,01
0,001
0,001
Fe
2+
0,01
0,0002
0,0004
Mn
2+
0,003
0,0001
0,0002
Sr
2+
0,88
0,01
0,02
SUMA
66,98
2,11
3,86
Aniony
HCO
3
-
201,3
3,30
3,30
SO
4
2-
12,97
0,14
0,28
Cl
-
4,30
0,12
0,12
PO
4
3-
0,25
0,003
0,009
NO
3
-
3,69
0,06
0,06
SUMA
222,51
3,62
3,77
Pozostałe
ChZT-Cr
22,65
-
-
BZT
5
9,06
-
-
Próbka 4
Składnik
mg/dm
3
mmol/dm
3
mval/dm
3
Kationy
Ca
2+
43,00
1,07
2,14
10
Mg
2+
10,48
0,43
0,86
Na
+
23,70
1,03
1,03
K
+
1,25
0,03
0,03
NH
4
+
0,24
0,01
0,01
Li
+
0,01
0,001
0,001
Fe
2+
0,07
0,001
0,002
Mn
2+
0,018
0,0003
0,0006
Sr
2+
0,70
0,01
0,02
SUMA
79,47
2,59
4,09
Aniony
HCO
3
-
240,0
3,94
3,94
SO
4
2-
19,00
0,20
0,40
Cl
-
10,10
0,28
0,28
PO
4
3-
0,90
0,01
0,03
NO
3
-
2,91
0,05
0,05
SUMA
272,91
4,47
4,70
Pozostałe
ChZT-Cr
6,24
-
-
BZT
5
2,50
-
-
b)
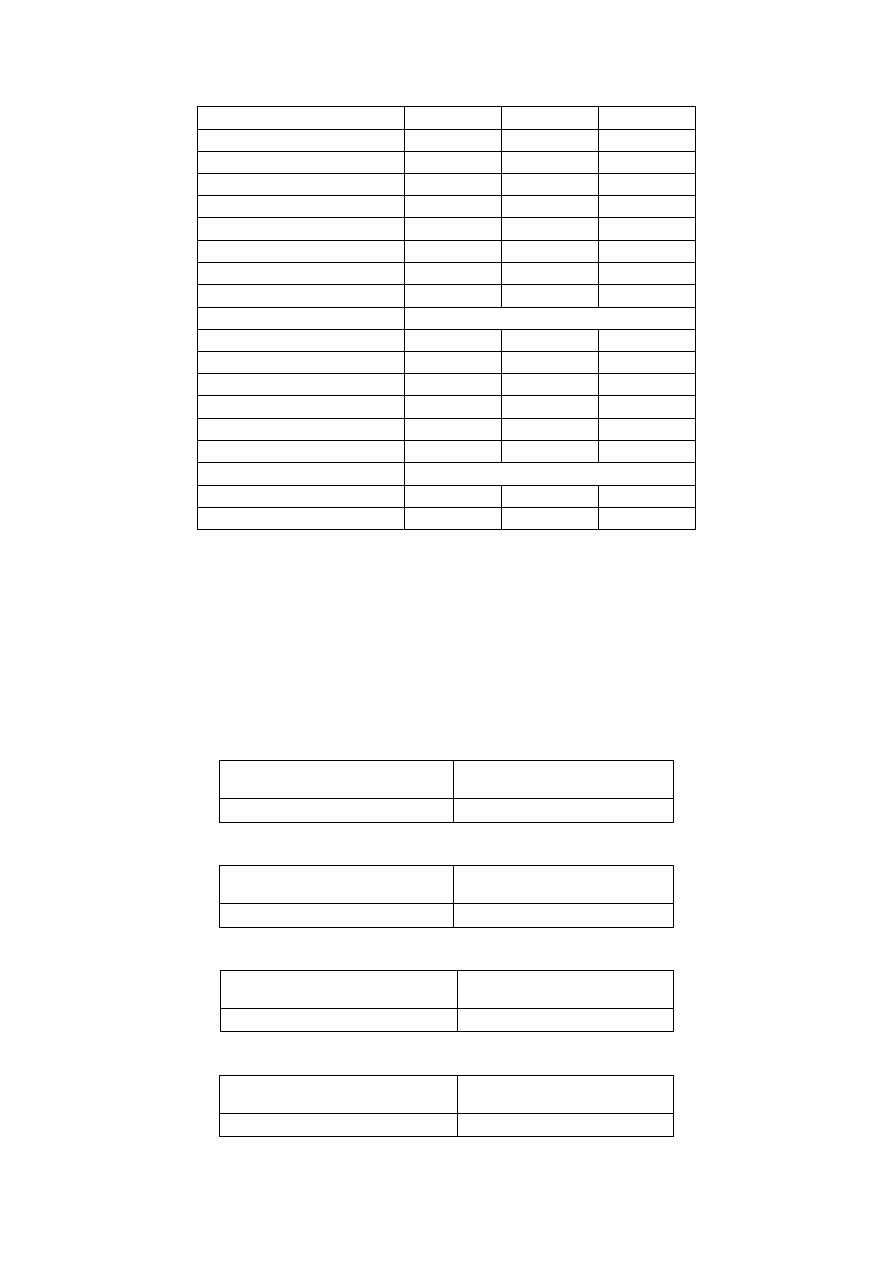
Poprawność analizy (bilans jonowy i błąd analizy %)
Dobrze wykonana analiza charakteryzuje się tym, że suma kationów
wyrażona w formie równoważnikowej powinna być równa sumie anionów
wyrażonej w takiej samej formie, zatem powinna zachodzić poniższa
zależność:
Próbka 1
26,81
26,36
Próbka 2
25,44
24,62
Próbka 3
3,86
3,77
Próbka 4
4,09
4,70
11
Pospolitym jest jednak, że między sumami kationów i anionów
występują różnice. Ma to również miejsce w przypadku powyższych
czterech próbek. Oceny poprawności wykonanej analizy chemicznej wody
można dokonać na podstawie wielkości błędu analizy (%) uzyskanego
przez porównanie zawartości anionów i kationów wyrażonych w mval/dm
3
.
Z powyższych odliczeń wynika, że analizy 1, 2 oraz 3 zostały
wykonane poprawnie, gdyż wartość błędu analizy, mierzona w
procentach, dla wszystkich trzech próbek mieści się w przedziale od
0% do 5%. W przypadku próbki numer 4 błąd analizy wykracza poza
granicę 5%, co wskazuje na niepoprawne wykonanie analizy.
c)
Twardość wody
W celu wyznaczenia twardości wody obliczono sumę kationów
odpowiedzialnych za twardość wody (Mg
2+
,
Ca
2+
, Fe
2+
, Mn
2+
, Sr
2+
), po
czym pomnożono uzyskaną sumę przez 2,8 otrzymując
.
Próbka 1
Kation
mmol/dm
3
Razem
[mmol/dm
3
]
Ca
2+
19,68
23,84
66,75
Mg
2+
3,86
Fe
2+
0,20
Mn
2+
0,08
Sr
2+
0,02
Próbka 2
Kation
mmol/dm
3
Razem
[mmol/dm
3
]
Ca
2+
21,14
25,08
70,22
Mg
2+
3,34
Fe
2+
0,50
Mn
2+
0,04
Sr
2+
0,06
12
Próbka 3
Kation
mmol/dm
3
Razem
[mmol/dm
3
]
Ca
2+
1,90
3,46
9,69
Mg
2+
1,56
Fe
2+
0,0004
Mn
2+
0,0002
Sr
2+
0,02
Próbka 4
Kation
mmol/dm
3
Razem
[mmol/dm
3
]
Ca
2+
2,14
3,02
8,46
Mg
2+
0,86
Fe
2+
0,002
Mn
2+
0,0006
Sr
2+
0,02
Stopnie twardości wody:
woda bardzo miękka (<0,5
N);
woda miękka (5-10
N);
woda średnio twarda (10-20
N);
woda twarda (20-30
N);
woda bardzo twarda (>30
N).
Otrzymane wyniki wskazują na to, że próbki numer 1 i 2 to próbki
wody bardzo twardej, zaś próbki o numerach 3 i 4 to próbki wody
miękkiej.
d)
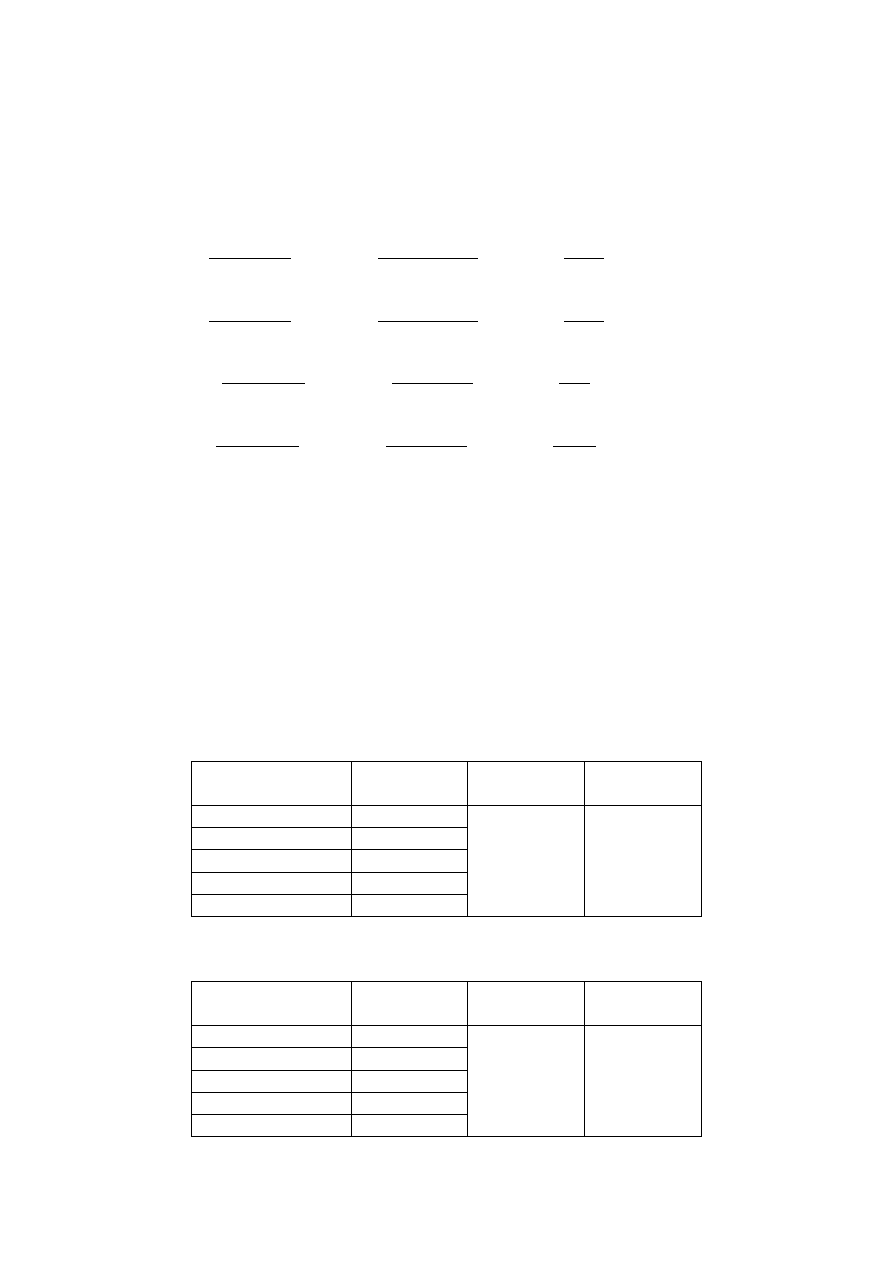
Diagram Pipera
W celu naniesienia danych na diagram Pipera obliczono sumę
odpowiednich kationów i anionów, po czym wyznaczono ich udział
procentowy (tabela 1).
Tabela 1
Kationy [%]
Numer próbki
1
2
3
4
Ca
2+
74,35
85,14
49,74
52,71
Mg
2+
14,58
13,45
40,84
21,18
Na
+
+K
+
11,07
1,41
9,42
26,11
Aniony [%]
Cl
-
0,19
0,69
3,24
6,06
HCO
3
-
99,20
96,95
89,19
85,28
SO
4
2-
0,61
2,36
7,57
8,66
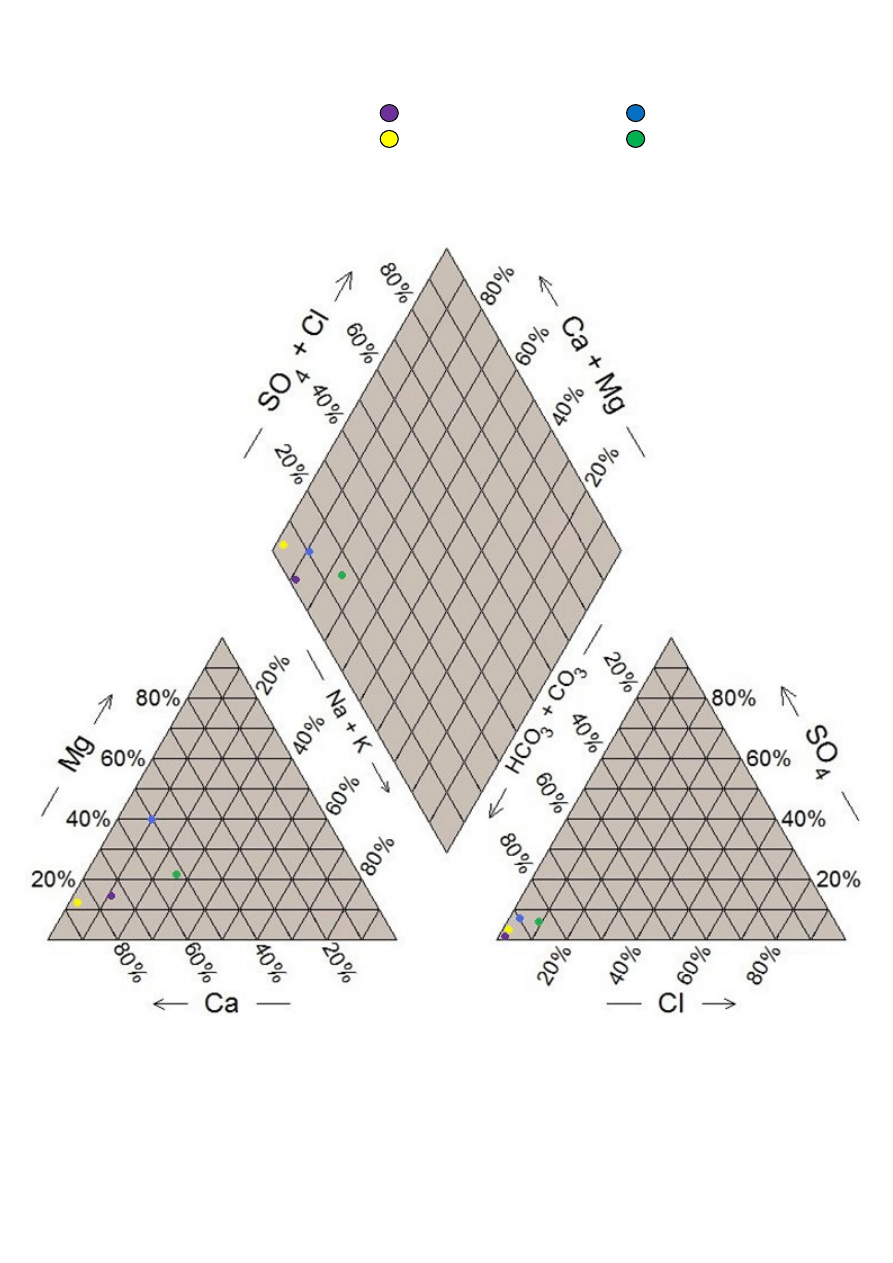
13
Próbka 1 - Próbka 3 -
Próbka 2 - Próbka 4 -
14
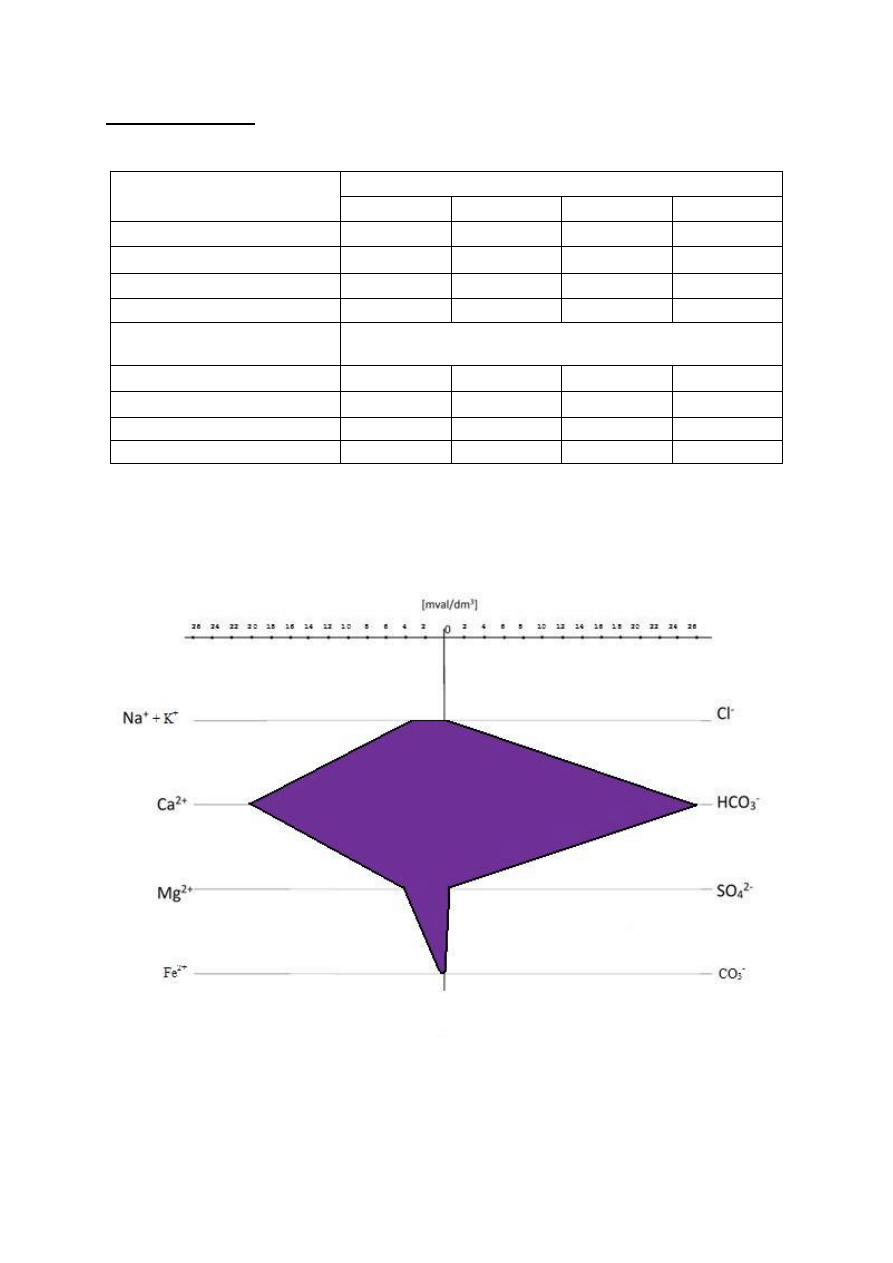
Diagramy Stiffa:
Tabela 2
Kationy [mval/dm
3
]
Numer próbki
1
2
3
4
Na
+
+K
+
2,93
0,35
0,36
1,06
Ca
2+
19,68
21,14
1,9
2,14
Mg
2+
3,86
3,34
1,56
0,86
Fe
2+
0,2
0,5
0,0004
0,002
Aniony
[mval/dm
3
]
Cl
-
0,05
0,17
0,12
0,28
HCO
3
-
26,15
23,87
3,30
3,94
SO
4
2-
0,16
0,58
0,28
0,40
CO
3
2-
0
0
0
0
Próbka 1
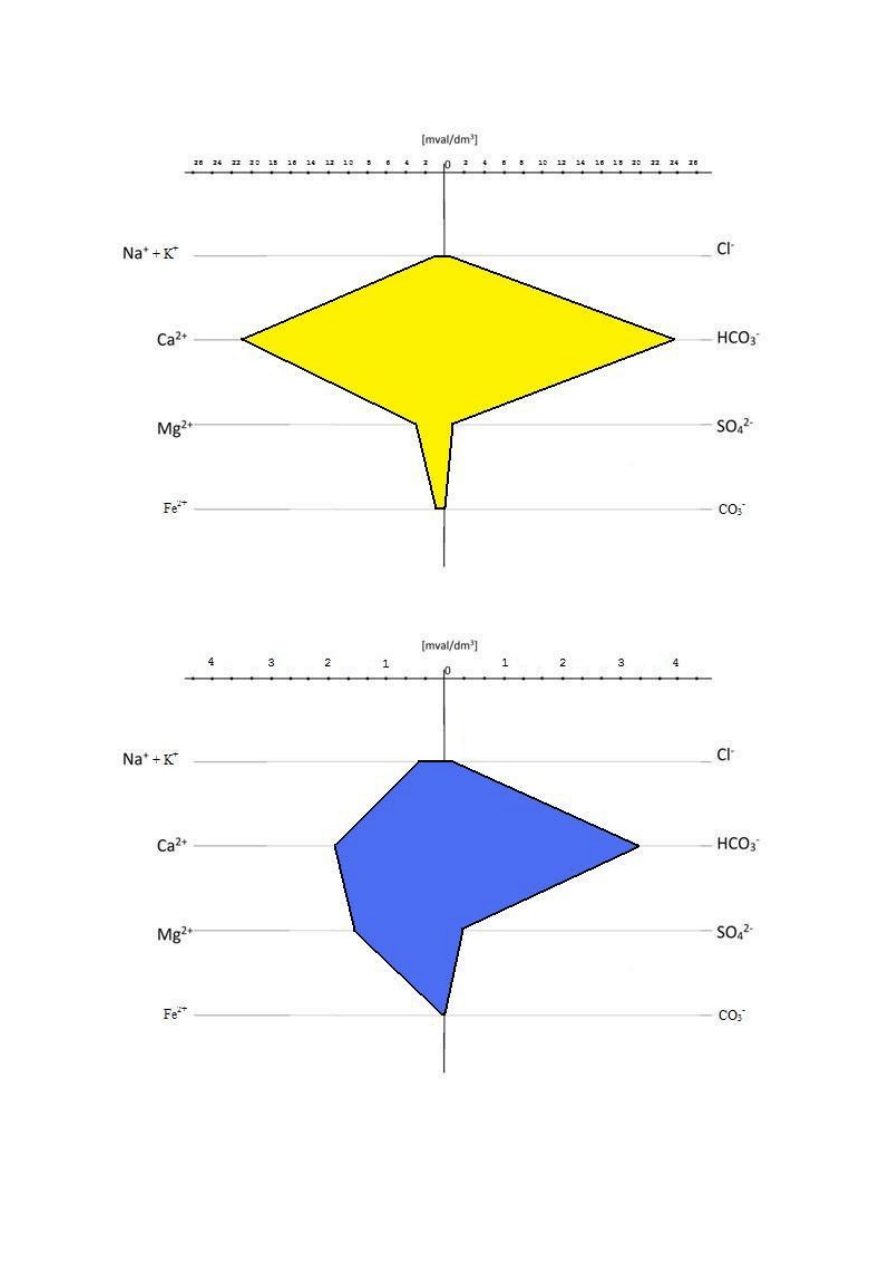
15
Próbka 2
Próbka 3
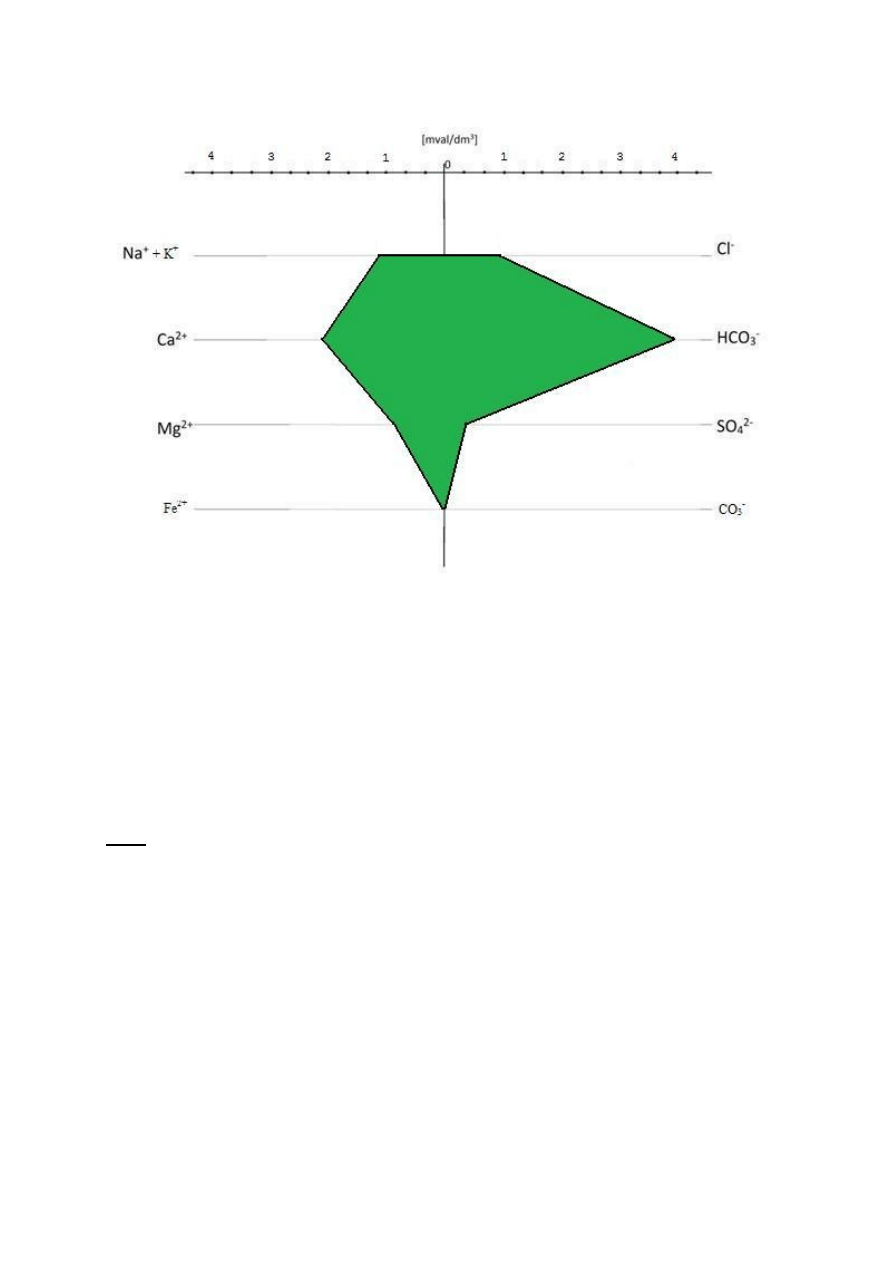
16
Próbka 4
Z diagramów odczytano, że wszystkie cztery próbki zawierają
najwięcej kationu Ca
2+
i anionu HCO
3-
, a najmniej kationu Fe
2+
i
anionu Cl
-
. Poza tym zauważono brak występowania anionu CO
3
2-
.
e)
Porównanie parametrów ChZT i BZT dla wód powierzchniowych.
BZTn – biochemiczne zapotrzebowanie tlenu - umowny wskaźnik
określający biochemiczne zapotrzebowanie na tlen, czyli ilość tlenu,
wyrażoną w mg/dm3, wymaganą do utlenienia związków organicznych
(zawartych w jednostce objętości wody lub ścieków w temp. 20 C, w
określonym czasie) przez mikroorganizmy (bakterie aerobowe). Wartość
tę uzyskuje się w wyniku pomiaru zużycia tlenu przez badaną próbkę
wody lub ścieków w ciągu 5 lub 20 dni (oznaczając to odpowiednio
BZT5 lub BZT20). BZTn jest wskaźnikiem czystości wody i jakości
oczyszczanych ścieków: im wyższa wartość BZTn tym większe
zanieczyszczenie (ilość związków organicznych).

17
BZT
5
Próbka 3
9,06
Próbka 4
2,50
ChZT – chemiczne zapotrzebowanie tlenu - umowny wskaźnik określający
chemiczne zapotrzebowanie na tlen, czyli ilość tlenu równoważna
ilości utleniacza zużytego do utlenienia substancji zawartych w
jednostce objętości badanej wody. W czasie oznaczania ChZT utleniane
są głównie substancje organiczne i niektóre nieorganiczne.
ChZT-Cr
Próbka 3
22,65
Próbka 4
6,24
Wnioski:
Próbka 4 reprezentuje wodę o mniejszym zanieczyszczeniu niż próbka
3, gdyż wskaźnik BZT
5
dla tej próbki jest niższy. Z reguły im wyższa
wartość wskaźnika BZT
5
tym większe zanieczyszczenie (ilość związków
organicznych). Ma to również odzwierciedlenie w wysokości wskaźnika
ChZT, czyli zapotrzebowania na tlen. Im więcej związków
organicznych, tym większe zapotrzebowanie na tlen, potrzebny do
utlenienia substancji zawartych w jednostce objętości badanej wody.
Wyszukiwarka
Podobne podstrony:
Geochemia projekt 1
geochemia projekt 2 id 187962 Nieznany
geochemia projekt 1 ost
geochemia projekt 1
Projekt 1, Ochrona Środowiska studia, 3 rok (2008-2009), Semestr V (Rok 3), Geochemia, Ćwiczenia, Ge
geochemia projekt 2
geochemia projekt 2
hydrogeochemia-projekt-temat, GIG, semestr 5, Geochemia
projekt nr 4, Rok III, V semestra, geochemia, chomikuj, projekt nr 4 (mrr mrr)
projekt 1-temat, AGH Wggioś górnictwo i geologia - materiały, Geochemia
projekt 2 nasze, Rok III, V semestra, geochemia, chomikuj, kolos 3 (mrr mrr)
PROJEKT 1 GEOCHEMIA (11)
PROJEKT NR 2 (14) Geochemia
Projekt I geochemia nr 6(2)(1)(1)
Projekt Geochemia (1)
Projekt Geochemia111
Projekt Geochemia
więcej podobnych podstron