
ANALIZA JAKOŚCIOWA ANIONÓW
Podział anionów na grupy analityczne wg R. W. Bunsena
Nr grupy
Aniony
Odczynnik
AgNO
3
Ba(NO
3
)
2
I
Cl
–
, I
–
AgCl, AgI
Biały osad
*
Żółty osad
*
-
II
S
2–
, NO
2
–
Ag
2
S, AgNO
2
Czarny osad Biały osad
-
III
CO
3
2–
, C
2
O
4
2–
, SO
3
2–
Ag
2
CO
3
, Ag
2
C
2
O
4
, Ag
2
SO
3
Biały osad Biały osad Biały osad
BaCO
3
, BaC
2
O
4
, BaSO
3
Biały osad Biały osad Biały osad
IV
S
2
O
3
2–
, PO
4
3–
Ag
2
S
2
O
3
, Ag
3
PO
4
Żółty osad
**
Żółty osad
BaS
2
O
3
, Ba
3
(PO
4
)
2
Biały osad Biały osad
V
NO
3
–
-
-
VI
SO
4
2–
-
BaSO
4
Biały osad
VII
SiO
3
2–
Ag
2
SiO
3
Żółty osad
BaSiO
3
Biały osad
*
- Osad nierozpuszczalny w kwasie azotowym,
**
- Osad szybko ciemnieje (przekształca się w czarny Ag
2
S)
REAKCJE CHEMICZNE
Typy reakcji red-ox:
1. Przebiegające w środowisku kwaśnym
2. Przebiegające w środowisku zasadowym
3. Przebiegające w środowisku obojętnym
4. Obojnaczość właściwości red-ox
5. Dysproporcjonowania
6. Utleniania substancji, w których reduktorem
są atomy na różnych stopniach utlenienia
REAKCJE KWAS - ZASADA
1.
SYNTEZY
2. ANALIZY
3. WYMIANY
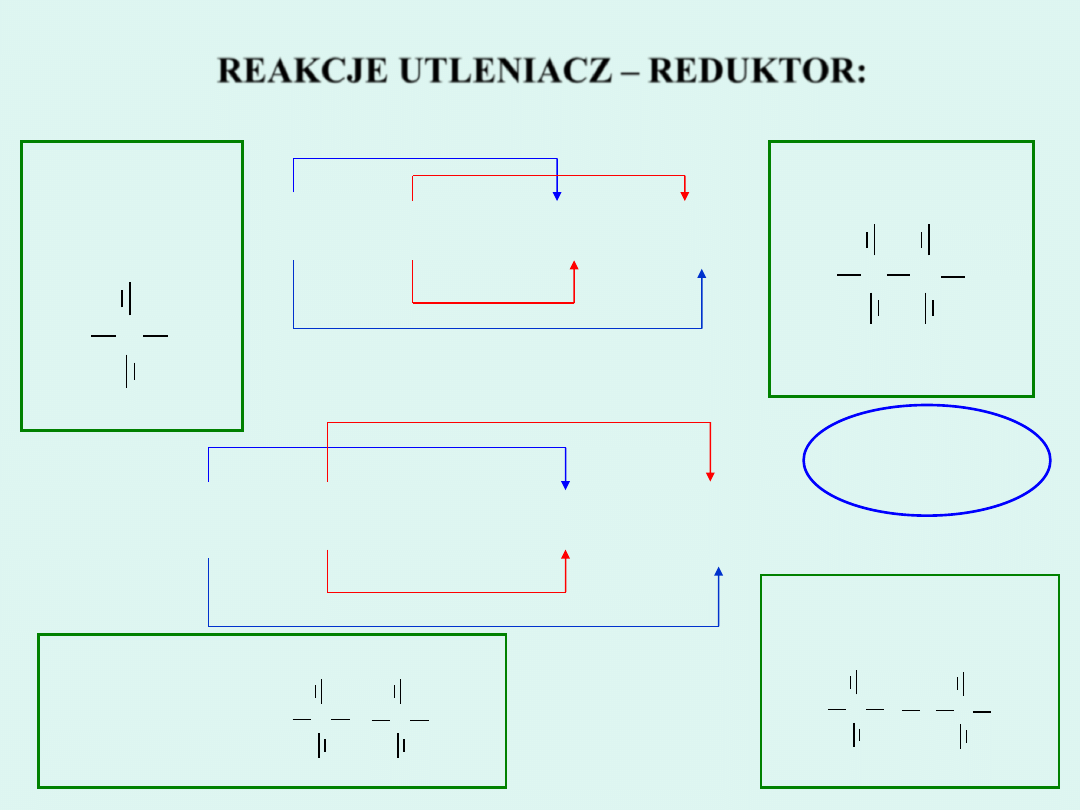
REAKCJE UTLENIACZ - REDUKTOR
1.
SYNTEZY
2. ANALIZY
3. WYMIANY
WARTOŚCIOWOŚĆ A STOPIEŃ UTLENIENIA
WARTOŚCIOWOŚĆ jest to liczba wiązań chemicznych
jaką tworzy atom pierwiastka w cząsteczce związku chemicznego
STOPIEŃ UTLENIENIA jest liczba elektronów
jaką atom przyjmuje lub oddaje tworząc wiązania chemiczne
-II
I
I
O
H
H
O
H
H
O
I
I
-II
0
O
O
0
0
O
O
O
0
0
0
II
Ca H
H
-I
-I
N
H
H
H
I
I
I
-III
I
C
C
H
O
H
H
H
I
I
I
I
-III
-II
0 0
I -I
H - H H - Cl
Cr
2
O
7
2
–
-XIV
XII
VI
-II
REAKCJE UTLENIACZ
– REDUKTOR W ŚRODOWISKU KWAŚNYM
MnO
4
–
+ C
2
O
4
2-
+ H
+
= Mn
2+
+ CO
2
+ H
2
O
VII
III
II
IV
Utlenianie
Redukcja
Utleniacz
Reduktor
MnO
4
–
+
5e
+ 8 H
+
= Mn
2+
+ 4 H
2
O
C
2
O
4
2-
= 2 CO
2
+
2e
VII
II
III
IV
·2
·5
2 MnO
4
–
+ 5C
2
O
4
2-
+ 16 H
+
= 2 Mn
2+
+ 10 CO
2
+ 8 H
2
O
C
2
O
4
2-
-II
-VIII
III
VI

REAKCJE UTLENIACZ – REDUKTOR:
SYNTEZA
0
0
-III
I
H
2
+ N
2
= NH
3
REAKCJE UTLENIACZ – REDUKTOR:
ANALIZA
4HgO
2 Hg
2
O + O
2
REAKCJE UTLENIACZ – REDUKTOR:
WYMIANA
II
-II
I
0
MnO
4
–
+ NO
2
–
+ H
+
= Mn
2+
+ NO
3
–
+ H
2
O
MnO
4
–
+
5e
+ 8 H
+
= Mn
2+
+ 4 H
2
O
NO
2
–
+ H
2
O = NO
3
–
+ 2 H
+
+
2e
2 MnO
4
–
+ 5 NO
2
–
+ 6 H
+
= 2 Mn
2+
+ 5 NO
3
–
+ 3 H
2
O
VII
III
II
V
* 2
* 5
Utleniacz
Reduktor
Utleniacz
Reduktor
Utleniacz
Reduktor
Reakcja redukcji:
Reakcja utlenienia:
REAKCJE UTLENIACZ – REDUKTOR:
Przebiegające w środowisku zasadowym
Zn + NO
3
–
+ OH
–
= [Zn(OH)
4
]
2–
+ NH
3
NO
3
–
+
8e
+ 6 H
2
O = NH
3
+ 9 OH
–
Zn + 4 OH
–
= [Zn(OH)
4
]
2–
+
2e
NO
3
–
+ 4 Zn + 7 OH
–
+ 6 H
2
O = NH
3
+ 4 [Zn(OH)
4
]
2–
∙ 4
Utleniacz
Reduktor
-III
II
II
V
-III
0
0
Al + NO
2
–
+ OH
–
= [Al(OH)
4
]
–
+ NH
3
NO
2
–
+
6e
+ 5 H
2
O = NH
3
+ 7 OH
–
Al + 4 OH
–
= [Al(OH)
4
]
–
+
3e
NO
2
–
+ 2 Al + OH
–
+ 5 H
2
O = NH
3
+ 2 [Al(OH)]
4
–
REAKCJE UTLENIACZ – REDUKTOR:
Przebiegające w środowisku zasadowym
Utleniacz
Reduktor
∙ 2
0
0
III
-III
III
III
-III
III

REAKCJE UTLENIACZ – REDUKTOR:
Przebiegające w środowisku obojętnym
Sn
2+
+ Hg
2+
= Sn
4+
+ Hg
Hg
2+
+
2e
= Hg
Sn
2+
= Sn
4+
+
2e
Utleniacz
Reduktor
II
II
IV
0
0
II
II
IV
SiO
2
+ 2 Mg = Si + 2 MgO
-II
IV
0
0
II
-II
Reduktor
Utleniacz

REAKCJE UTLENIACZ – REDUKTOR:
Przebiegające w środowisku obojętnym
ClO
4
–
+ 2 Mn(OH)
2
+ H
2
O = ClO
3
–
+ 2 Mn(OH)
3
VII
V
II
III
Redukcja
Utlenienie
ClO
4
–
+
2e
+ H
2
O = ClO
3
–
+ 2 OH
–
VII
V
II
III
Utleniacz
Mn(OH)
2
+ OH
–
= Mn(OH)
3
+
e
Reduktor
· 2
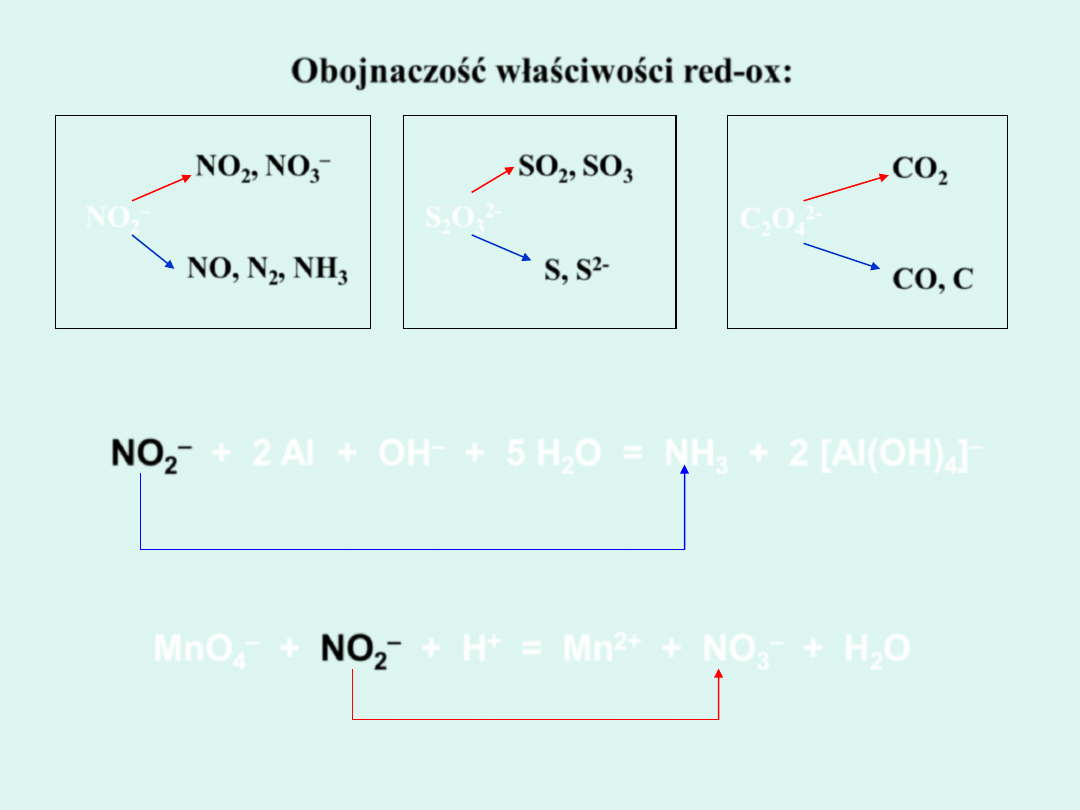
Obojnaczość właściwości red-ox:
NO
2
–
+ 2 Al + OH
–
+ 5 H
2
O = NH
3
+ 2 [Al(OH)
4
]
–
MnO
4
–
+
NO
2
–
+ H
+
= Mn
2+
+ NO
3
–
+ H
2
O
NO
2
–
NO
2
, NO
3
–
NO, N
2
, NH
3
IV
V
III
II
0
-III
S
2
O
3
2-
SO
2
, SO
3
S, S
2-
II
IV
VI
0
-II
C
2
O
4
2-
CO
2
CO, C
III
IV
II
0
III
-III
III
V
Redukcja
Utlenienie
REAKCJE UTLENIACZ – REDUKTOR:
Reakcje dysproporcjonowania
S
2
O
3
2–
+ OH
–
= SO
4
2–
+ S
2–
S
2
O
3
2–
+ 10 OH
–
= 2 SO
4
2–
+ 5 H
2
O +
8e
S
2
O
3
2–
+ 3 H
2
O +
8e
= 2 S
2–
+ 6 OH
–
S
2
O
3
2–
+ 2 OH
–
= SO
4
2–
+ S
2–
+ H
2
O
Utleniacz
Reduktor
Jak można zapobiec reakcji dysproporcjonowania jonów tiosiarczanowych?
REAKCJE UTLENIACZ – REDUKTOR:
Porównanie właściwości utleniająco-redukujących
I
2
+
SO
3
2–
+ 2 OH
–
= 2 I
–
+ SO
4
2–
+ H
2
O
2 I
–
+ 2
NO
2
–
+ 4 H
+
= I
2
+ 2
NO + 2 H
2
O
Co jest silniejszym utleniaczem:
SO
4
2–
,
czy
NO
2
–
?
Potencjał red-ox (E):
I
I
E
/
2
/
1
2
2
3
2
4
2
/
/
2
/
1
SO
SO
I
I
E
E
Utleniacz
Reduktor
2
3
2
4
2
2
/
/
2
/
1
/
SO
SO
I
I
NO
NO
E
E
E

REAKCJE UTLENIACZ – REDUKTOR:
Reakcje utleniania substancji,
w których reduktorem są atomy na różnych stopniach utlenienia
Cu S + 4 H O = SO + 2 Cu + 8 H +
10e
2
2
2-
4
2+
+
I
VI
-II
-8e
-2e
NO
3
–
+
1e
+ 2 H
+
= NO
2
+ H
2
O
Cu
2
S + 10 NO
3
–
+ 12 H
+
= 2 Cu
2+
+ SO
4
2–
+ 10 NO
2
+ 6 H
2
O
∙ 10
REAKCJE UTLENIACZ – REDUKTOR:
3 SO
4
2–
+ S
2
O
3
2–
= 3 SO
3
2–
+ S
2
O
6
2–
4 SO
4
2–
+ S
2
O
3
2–
+
2 H
+
= 2 SO
3
2–
+ 2 S
2
O
6
2–
+ H
2
O
VI
II
IV
V
VI
II
IV
V
Kwas ditionowy
HO
S
S
O
O
O
O
OH
HO
S
O
O
S
O
O
OH
S
S
HO
S
O
S
OH
Kwas
tetrationowy
Kwas
tiosiarkowy
Kwas
pirosiarkowy
O
HO
S
O
O
S
O
O
OH
Co to jest
katenacja?
Wpływ środowiska kwasowo-zasadowego na przebieg reakcji chemicznej

REAKCJE UTLENIACZ
– REDUKTOR:
2 S
2
O
3
2-
+ I
2
= S
4
O
6
2-
+ 2 I
-
HO
S
O
S
OH
HO
S
S
O
O
O
O
OH
HO
S
O
O
S
O
O
OH
S
S
O
HO
S
O
O
S
O
O
OH
Co to jest katenacja?
HO
S
O
O
S
O
O
OH
(S)n
O
HO
S
O
O
S
O
O
OH
O
HO
S
O
O
O-O-H
HO
S
O
O
O
OH
S
II
Utlenianie
?
0
-I
Redukcja
Kwas tiosiarkowy, (H
2
S
2
O
3
)
Kwas pirosiarkowy(VI), (H
2
S
2
O
7
)
Kwas nadtlenosiarkowy, (H
2
SO
5
)
Kwas caro
Kwas nadtlenodisiarkowy, (H
2
S
2
O
8
)
Kwas pirosiarkowy(IV), (H
2
S
2
O
5
)
Kwas ditionowy, (H
2
S
2
O
6
)
Kwas tetrationowy, (H
2
S
4
O
6
)
Kwas politionowy, (H
2
S
n
O
6
)
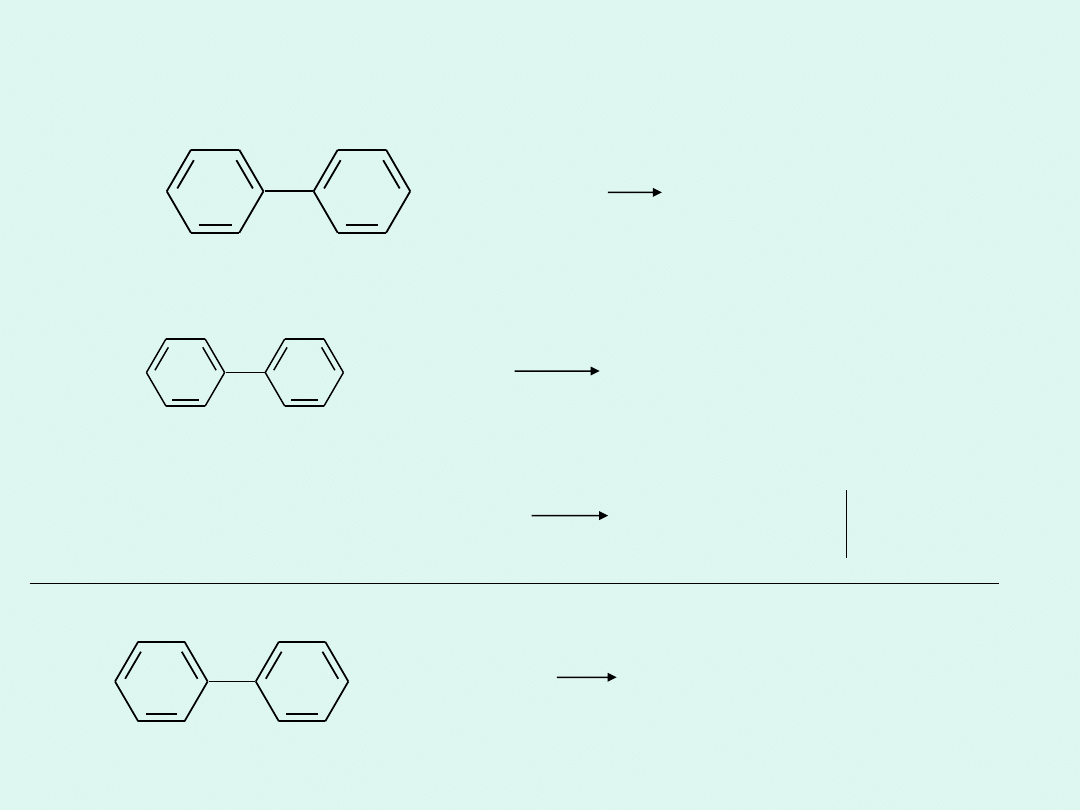
Mineralizacja bifenylu metodą Kjeldahla
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
+ H
2
SO
4
SO
2
+ CO
2
+ H
2
O
Δ
Reakcja połówkowa dla reduktora:
Reakcja połówkowa dla utleniacza:
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
+ 24 H
2
O 12 CO
2
+
58e
+ 58 H
+
IV
H
2
SO
4
+ 2 H
+
+
2e
SO
2
+ 2 H
2
O
• 29
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
+ 29 H
2
SO
4
29 SO
2
+ 12 CO
2
+ 34 H
2
O
IV
IV
VI
IV
VI
Δ
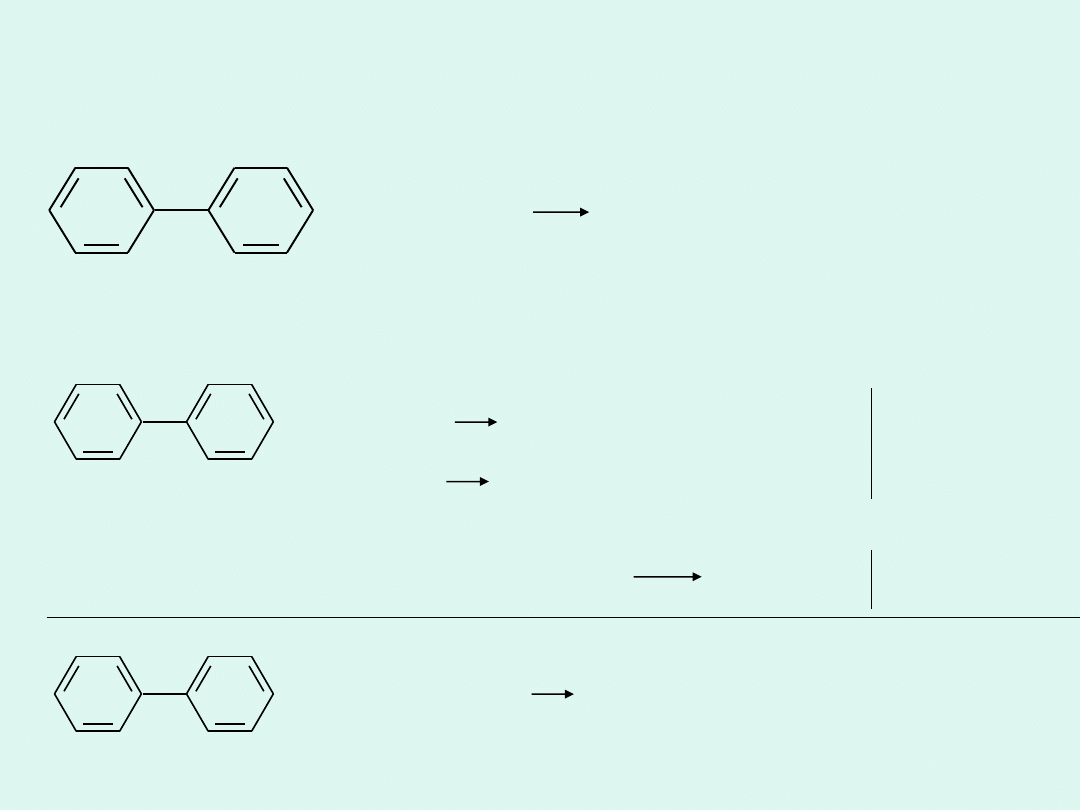
Mineralizacja bifenylu metodą Lassaigne’a
+ Na + O
2
CO
2
+ Na
+
+ OH
-
+ H
2
O
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
Reakcje połówkowe dla reduktora:
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
4
+ 4 Na + 59 O
2
48 CO
2
+ 4 Na
+
+ 4 OH
–
+ 18 H
2
O
Reakcja połówkowa dla utleniacza:
O
2
+ 2 H
2
O +
4 e
4 OH
–
• 59
0
-II
0
0
I
IV
+ 58 OH
–
12 CO
2
+
58 e
+ 34 H
2
O
0
0
-I
-I
-I
-I
-I
-I
-I
-I
-I
-I
Na Na
+
+
e
• 4
0
I
IV
Δ
Δ
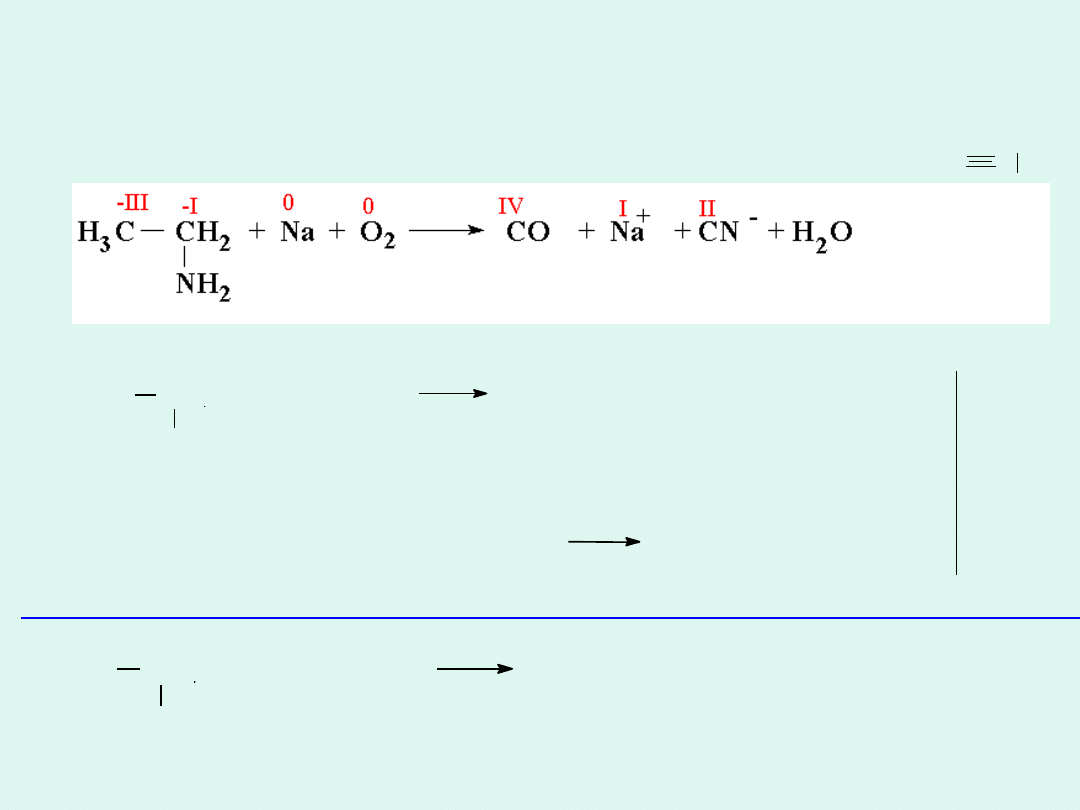
Mineralizacja organicznych związków azotu
metodą Lassaigne’a
:C
N
-
II
-III
2
2
IV
II
I
H C
2
CH + Na + 2 H O CO + Na
+
+ CN
–
+ 11 H
+
+
11e
3
NH
2
-III -I
0
O + 4 H +
4 e
2 H O
2
2
+
0
-II
Δ
2
4
H C
2
CH + 4 Na + 11 O 4 CO
2
+ 4 Na
+
+ 4 CN
–
+ 14 H
2
O
3
NH
2
∙ 4
∙ 11
2
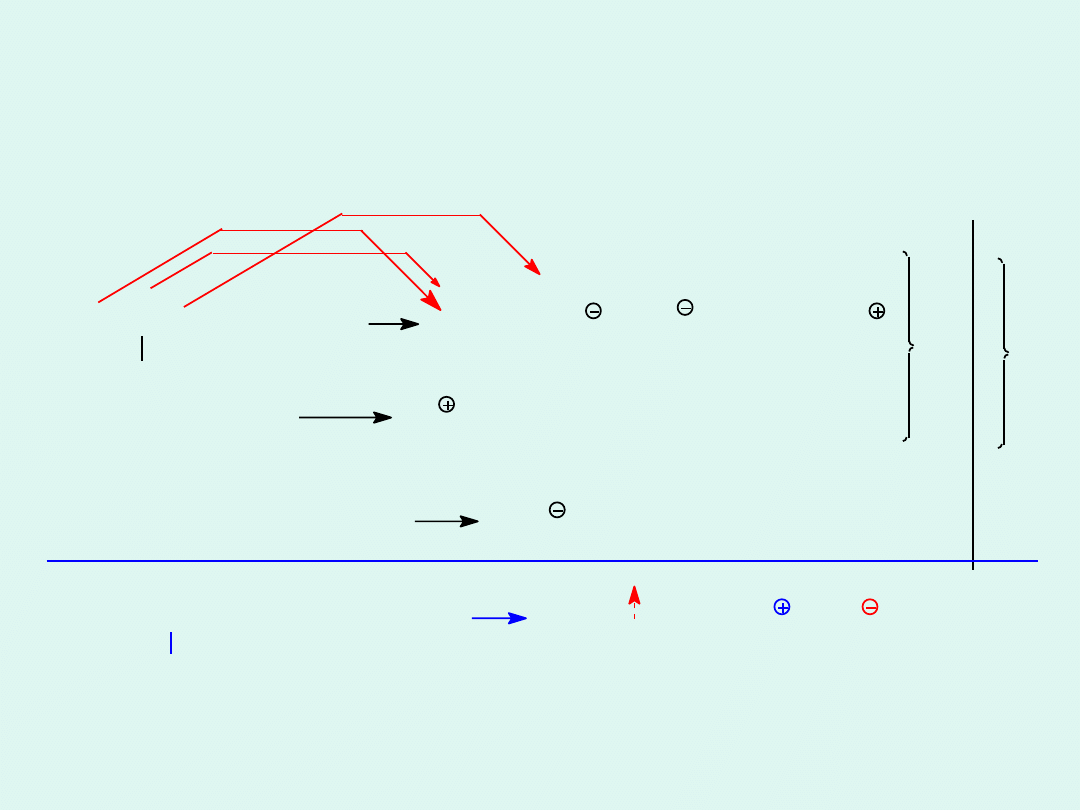
O +
4e
+ 2 H O 4 OH
2
2
Na Na +
1e
-III
I
0
IV
II
-2e
-3e
-7e
CH -C=CH-NH + 4 H O 2 CO + CN + Cl +
12e
+ 14 H
2
2
2
3
Cl
+13e
4
13
4 CH -C=CH-NH + 4 Na + 13 O 8 CO + 4 HCN + 4 Na + 4 Cl + 10 H O
Cl
2
3
2
2
Mineralizacja
metodą Lassaigne’a
Reakcje mineralizacji
NO
2
NH
2
-III
III
I
-I
-I
-I
-I
I
+ 10 H
2
O = 6 CO
2
+
20 e
+ 18 H
+
+ 2 NH
4
+
Cr
2
O
7
2-
+
6 e
+ 14 H
+
= 2 Cr
3+
+ 7 H
2
O
·3
·10
NO
2
NH
2
-III
III
I
-I
-I
-I
-I
I
3
+ 10 Cr
2
O
7
2-
+ 86 H
+
= 20 Cr
3+
+ 6 NH
4
+
+ 18 CO
2
+ 40 H
2
O
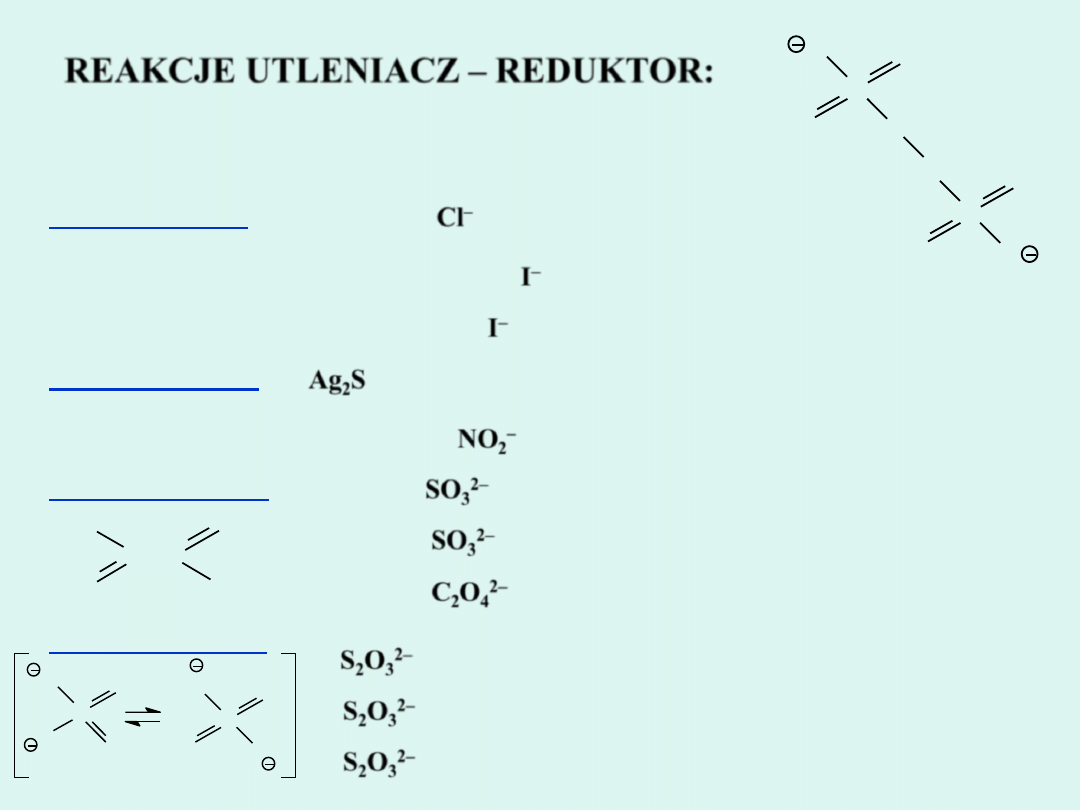
REAKCJE UTLENIACZ – REDUKTOR:
Reakcje wykorzystywane jako reakcje charakterystyczne
w analizie anionów
I grupa anionów:
II grupa anionów:
III grupa anionów:
IV grupa anionów:
2 MnO
4
–
+ 10
Cl
–
+ 16 H+ = 2 Mn
2+
+ 5 Cl
2
+ 8 H
2
O
Cl
2
+ 2
I
–
= 2 Cl
–
+ I
2
2 NO
2
–
+ 2
I
–
+ 4 H
+
= 2
NO + I
2
+ 2 H
2
O
3
Ag
2
S
+ 2 NO
3
–
+ 8 H
+
= 3 S + 6 Ag
+
+ 2
NO + 4 H
2
O
2 I
–
+ 2
NO
2
–
+ 4 H
+
= I
2
+ 2
NO + 2 H
2
O
I
2
+
SO
3
2–
+ 2 OH
–
= 2 I
–
+ SO
4
2–
+ H
2
O
2 MnO
4
–
+ 5
SO
3
2–
+ 6 H
+
= 2 Mn
2+
+ 5 SO
4
2–
+ 3 H
2
O
2 MnO
4
–
+ 5
C
2
O
4
2–
+ 16 H
+
= 2 Mn
2+
+ 10
CO
2
+ 8 H
2
O
S
2
O
3
2–
+ 2 OH
–
= SO
4
2–
+ S
2–
+ H
2
O
2
S
2
O
3
2–
+ I
2
= 2 I
–
+ S
4
O
6
2–
5
S
2
O
3
2–
+ 8 MnO
4
–
+ 14 H
+
= 10 SO
4
2–
+ 8 Mn
2+
+ 7 H
2
O
C - C
O
O
OH
HO
III III
O
O
O
S
S
-I
V
S
O
O
O
S
0
IV
S
S
V
S
S
O
O
O
O
O
O
0
0
V
KATENACJA
KATENACJA
DELOKALIZACJA
ELEKTRONÓW
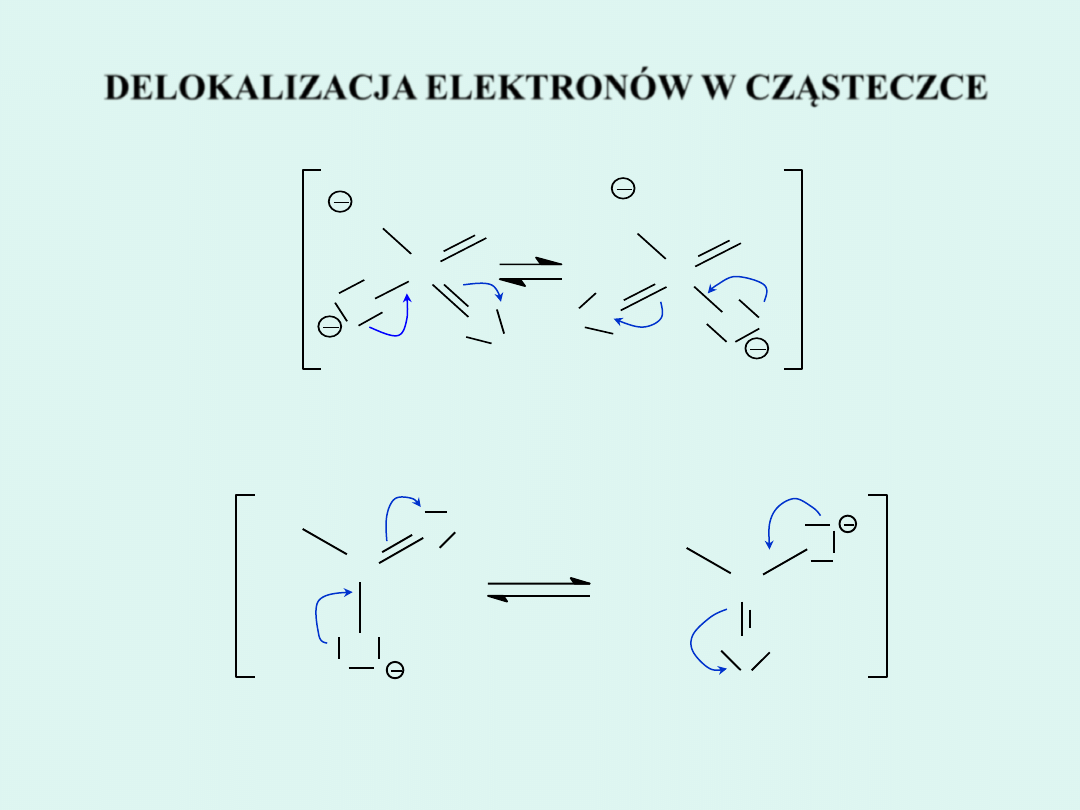
DELOKALIZACJA ELEKTRONÓW W CZĄSTECZCE
O
O
O
S
S
-I
V
S
O
O
O
S
0
IV
C
O
O
HO
C
O
O
HO
III
III
Jakie warunki muszą być spełnione, aby wystąpiło zjawisko delokalizacji elektronów w cząsteczce?
REAKCJE UTLENIACZ – REDUKTOR:
Reakcje wykorzystywane jako reakcje charakterystyczne
w analizie anionów
Reakcja obrączkowa:
Reakcja z wykorzystaniem papierka jodowo - skrobiowego:
[Fe(NO)
6
]
3+
FeSO
4
,
kryszt.
Badany roztwor
H
2
SO
4,stęż
Fe
2+
+
NO
2
–
+ 2 H
+
= Fe
3+
+
NO + H
2
O
Fe
3+
+ 6 NO = [Fe(NO)
6
]
3+
Kation heksanitrozylżelazo(III)
2 IO
3
–
+ 5 SO
2
+ 8 OH
–
= I
2
+ 5 SO
4
2–
+ 4 H
2
O
SO
3
2–
+ 2 H
+
=
SO
2
+ H
2
O
I
2
+ SO
2
+ 4 OH
–
= 2 I
–
+ SO
4
2–
+ 2 H
2
O
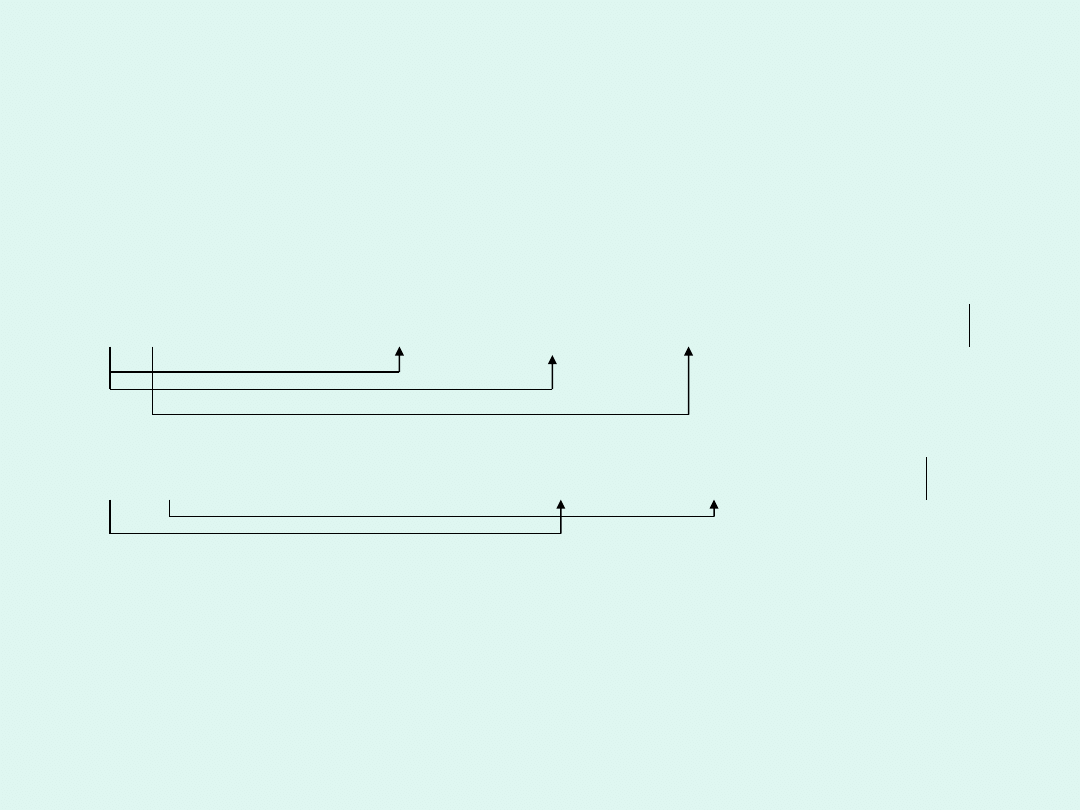
PbN
6
+ Cr(MnO
4
)
2
→ Pb
2
O
3
+ PbO + NO + Cr
2
O
3
+ MnO
2
15PbN
6
+ 44Cr(MnO
4
)
2
→ 5Pb
2
O
3
+ 5PbO + 90NO + 22Cr
2
O
3
+ 88MnO
2
*5
0
0
III
II II
3PbN
6
+ 22H
2
O → Pb
2
O
3
+ PbO + 18NO + 44e + 44H
+
IV
VI
III
IV
2Cr(MnO
4
)
2
+ 10e + 10H
+
→ Cr
2
O
3
+ 4MnO
2
+ 5H
2
O
-36e
-6e
-2e
+8e
+2e
*22
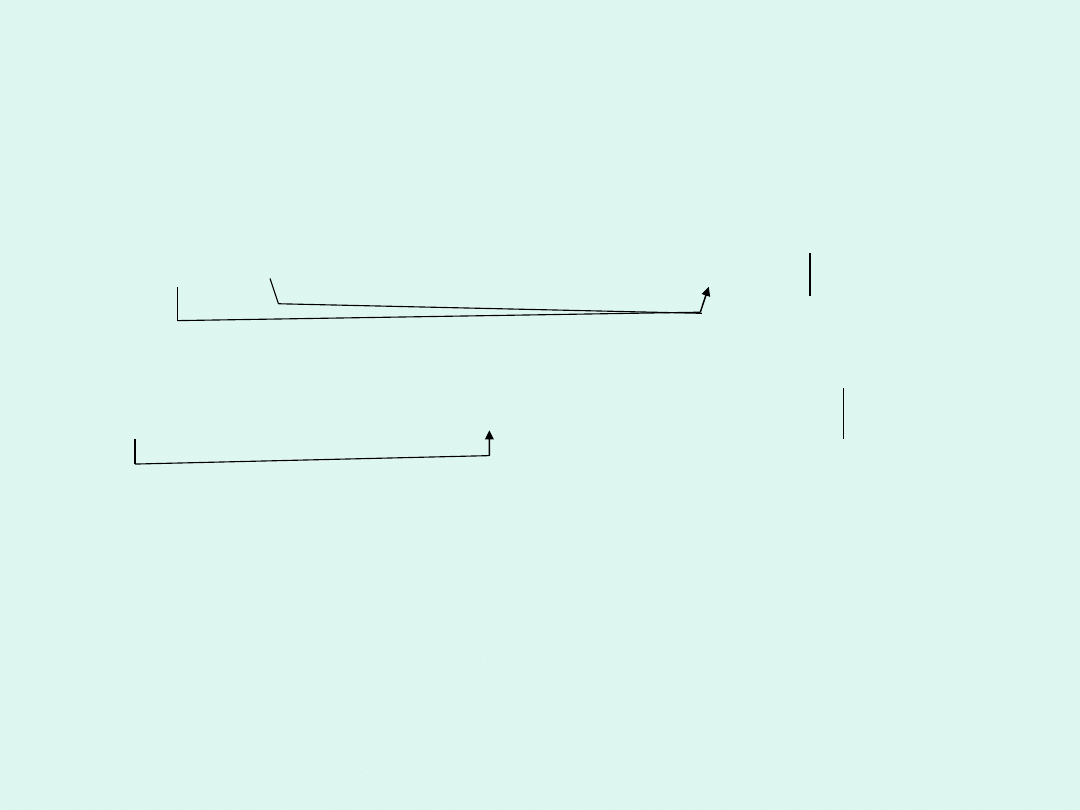
P
2
I
4
+ P
4
+ H
2
O → PH
4
I + H
3
PO
4
5P
2
I
4
+ 13P
2
+ 64H
2
O → 20PH
4
I + 16H
3
PO
4
0 II -III
P
2
+ P
2
I
4
+
16e
+ 16H
+
→ 4PH
4
I
0 V
P
2
+ 8H
2
O → 2H
3
PO
4
+
10e
+ 10H
+
+6e
+10e
-10e
*5
*8
Wyszukiwarka
Podobne podstrony:
Analiza anionów
analiza anionów, Aniony
ANALIZA ANIONÓW - ćwiczenia z 13.11, ANALIZA ANIONÓW
Analiza anionów na przykładzie I grupy
sprawozdanie analiza anionów, UP Wrocław, IŚ I SEM, Chemia
analiza anionów (2)
Sprawozdanie analiza anionów
ANALIZA ANIONÓW I VII GRUPY ANALITYCZNEJ
4 Analiza jakościowa Analiza Anionów
Sprawozdanie analiza anionów
Analiza jakościowa kationów i anionów, Analiza jakościowa
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
Analiza kationow i anionow
Analiza kationow i anionow wersja 2
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
TEMAT 2, TEMAT: BADANIE WŁAŚCIWOŚCI I ANALIZA JAKOŚCIOWA ANIONÓW
Analiza jakościowa kationów i anionów, Energetyka, I rok, chemia
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
więcej podobnych podstron