Analiza jakościowa
ANALIZA ANIONÓW
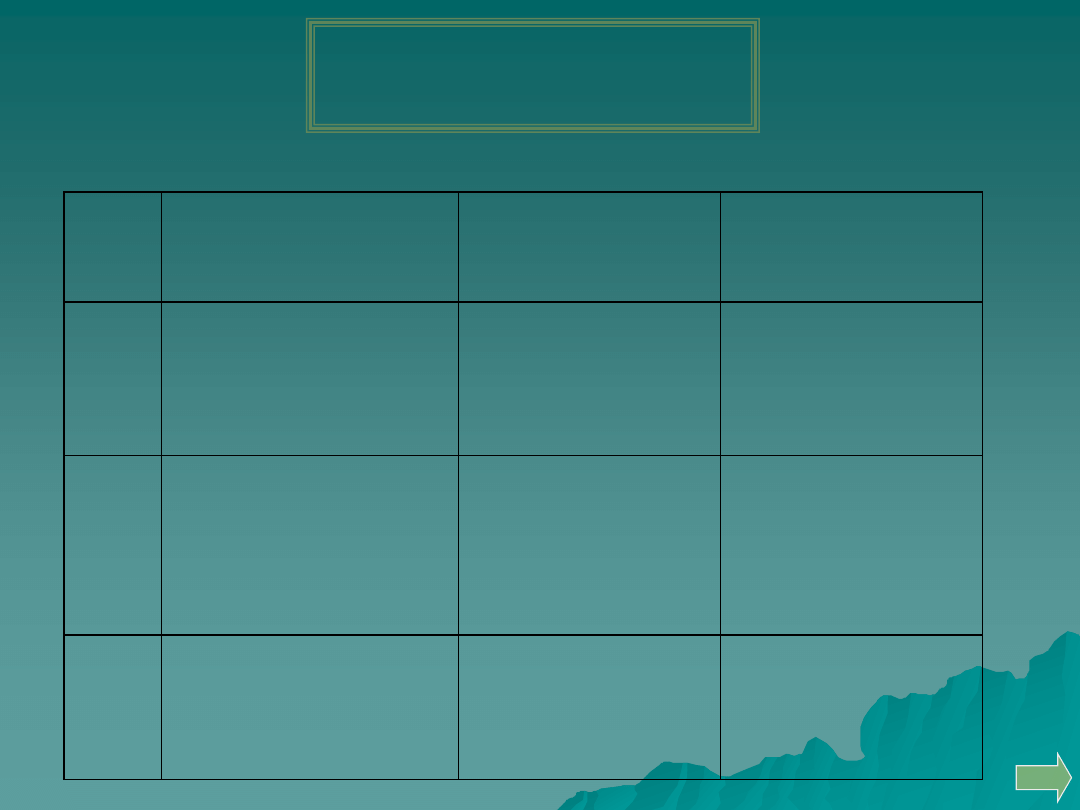
Podział anionów na grupy wg Bunsena
Grupa
Aniony
Reakcje 1mol l
-1
AgNO
3
Reakcje z 0,25 mol l
-1
BaCl
2
I
Cl
-
, Br
-
, I
-
, CN
-
, SCN
-
,
Fe(CN)
6
4-
, Fe(CN)
6
3-
,
ClO
-
Jony Ag
+
wytrącają białe
osady nierozpuszczalne w
6mol l
-1
HNO
3
Nie tworzą osadów
II
S
2-
, NO
2
-
, CH
3
COO
-
Jony Ag
+
wytrącają białe
osady rozpuszczalne w
6mol l
-1
HNO
3
Nie tworzą osadów
III
CO
3
2-
, SO
3
2-
, BO
3
2-
,
C
2
O
4
2-
, C
4
H
4
O
6
2-
Jony Ag
+
wytrącają białe
osady rozpuszczalne w
6mol l
-1
HNO
3
Jony Ba
2+
wytrącają
osady rozpuszczalne w
6mol l
-1
HNO
3

Grupa
Aniony
Reakcje 1mol l
-1
AgNO
3
Reakcje z 0,25 mol l
-1
BaCl
2
IV
S
2
O
3
2-
, CrO
4
2-
, Cr
2
O
7
2-
,
AsO
4
3-
, AsO
3
3-
, PO
4
3-
Jony Ag
+
wytracają
barwne osady
rozpuszczalne w HNO
3
Jony Ba
2+
wytrącają
osady rozpuszczalne w
HNO
3
V
NO
3
-
, ClO
3
-
, ClO
4
-
,
MnO
4
-
Jony Ag
+
osadu nie
wytrącają
Jony Ba
2+
osadu nie
wytrącają
VI
SO
4
2-
, F
-
, SiF
6
2-
Jony Ag
+
osadu nie
wytrącają
Jony Ba
2+
wytrącają
osad trudno
rozpuszczalny w HNO
3
VII
SiO
3
2-
Jony Ag
+
wytracają żółty
osad rozpuszczalny w
HNO
3
Jony Ba
2+
wytrącają
biały osad rozpuszczalny
w HNO
3

Analiza jakościowa I grupy anionów
Cl
-
, Br
-
, I
-
, CN
-
, SCN
-
,
Fe(CN)
6
4-
, Fe(CN)
6
3-
, ClO
-
Jon chlorkowy
Reakcje charakterystyczne jonu Cl
-
.
1.
Azotan (V) srebra (I) AgNO
3
z roztworów zawierających
jony Cl
-
wytrąca biały, trudno rozpuszczalny w wodzie, serowaty
osad AgCl:
AgCl
Cl
Ag

2.
Stężony kwas siarkowy (VI) H
2
SO
4
nie utlenia jonów Cl
-
,
w reakcji na gorąco uwalnia się bardziej lotny HCl, który
z amoniakiem tworzy białe dymy NH
4
Cl:
O
H
Cl
NH
HCl
O
H
NH
NaHSO
HCl
SO
H
NaCl
2
4
2
3
4
4
2
2
2
2
2
2
4
2
2
3
2
4
4
2
2
4
2
2
2
2
8
2
5
16
10
2
2
3
2
2
2
I
KCl
KI
Cl
O
H
Mn
Cl
H
Cl
MnO
O
H
NOCl
Cl
HNO
HCl
O
H
MnSO
SO
Na
Cl
SO
H
MnO
NaCl
3.
Utleniacze: KMnO
4
, PbO
2
, MnO
2
, KClO
3
, stężony HNO
3
w środowisku kwasowym (H
2
SO
4
) utleniają jony Cl
-
do wolnego
chloru:

O
H
CrO
Na
NaCl
NaOH
Cl
CrO
O
H
NaHSO
KHSO
Cl
CrO
SO
H
O
Cr
K
NaCl
2
4
2
2
2
2
4
4
2
2
4
2
7
2
2
2
2
4
3
4
2
2
6
2
2
2
2
2
Cl
Hg
Hg
Cl
4.
Stały dichromian (VI) potasu, K
2
Cr
2
O
7
– reakcja chromylowa.
Ogrzewanie suchych chlorków roztartych ze stałym K
2
Cr
2
O
7
i zwilżonym stężonym H
2
SO
4
powoduje wydzielenie się żółtych
dymów dichlorku ditlenku chromu (VI) – CrO
2
Cl
2
(z fluorkami
powstaje lotny difluorek ditlenek chromu (VI); bromki i jodki
utleniają się w tych warunkach do wolnego bromu i jodu):
5.
Azotan (V) rtęci (I) Hg
2
(NO
3
)
2
wytrąca z roztworów jonów Cl
-
biały osad Hg
2
Cl
2
:

Jon bromkowy
Reakcje charakterystyczne jonu.
1.
Azotan (V) srebra (I) AgNO
3
wytrąca z
roztworów bromków żółty , trudno rozpuszczalny w
wodzie osad AgBr:
O
H
BrH
NH
Ag
O
H
NH
AgBr
AgBr
Br
Ag
2
2
3
2
3
2
]
)
(
[
2
2.
Stężony kwas siarkowy (VI) H
2
SO
4
w reakcji z bromkami
wypiera gazowy HBr, który w następnym etapie reakcji zostaje
częściowo utleniony di wolnego bromu:
O
H
SO
Br
H
SO
Br
NaHSO
HBr
SO
H
NaBr
2
2
2
2
4
4
4
2
2
4
2
Brom

3.
Woda chlorowa – woda nasycona chlorem (lub roztwór
chloraminy T) dodawana do roztworów zawierających jony Br
-
utlenia
je do wolnego bromu. Brom można wyekstrahować chloroformem.
Chloroform barwi się przy tym na kolor od żółtego do
brunatnoczerwonego w zależności od stężenia bromu.
Cl
Br
Br
Cl
2
2
2
2
NaClO
NH
SO
H
C
CH
O
H
N
SO
H
C
CH
Na
Cl
2
2
4
6
3
2
2
4
6
3
O
H
NO
Br
H
HNO
Br
SO
Br
O
S
Br
2
2
3
2
4
2
2
8
2
4
2
3
6
2
6
2
2

4.
Dichromian (VI) potasu K
2
Cr
2
O
7
w środowisku kwasowym
(stężony H
2
SO
4
) utlenia jony Br
-
do wolnego bromu:
O
H
Cr
Br
H
O
Cr
Br
2
3
2
2
7
2
7
2
3
14
6
5.
Bromian (V) potasu KBrO
3
utlenia jony Br
-
do wolnego bromu:
O
H
Br
H
BrO
Br
2
2
3
3
3
6
5

6.
Manganian (VII) potasu KMnO
4
w środowisku kwasowym (H
2
SO
4
)
utlenia jony Br
-
do wolnego Br
2
:
O
H
Br
Mn
H
Br
MnO
2
2
2
4
8
5
2
16
10
2
Wykrywanie jonów Br
-
w trudno rozpuszczalnych bromkach (np. AgBr).
Do umieszczonego w próbówce osadu AgBr dodaje się rozcieńczonego
H
2
SO
4
i cynku. Podczas reakcji jony Ag
+
redukują się do metalicznego
srebra:
2
2
2
2
Zn
Br
Ag
Zn
AgBr
7.
Fluoresceina, C
20
H
12
O
5
. Związek ten reaguje z wolnym bromem
przechodząc w czerwoną tetrabromofluoresceinę (eozynę).
O
H
Br
Pb
H
Br
PbO
2
2
2
2
2
4
2
Wykrywanie jonów Cl
-
w obecności Br
-
. W roztworze wodnym
węglanu amonu (NH
4
)
2
CO
3
w wyniku hydrolizy znajduje się pewna
ilość amoniaku. Ilość ta jest wystarczająca do rozpuszczenia AgCl;
AgBr przy tak małym stężeniu nie rozpuści się.
AgCl
Br
Cl
AgBr
2
2
2
2

Jon jodkowy
Reakcje charakterystyczne jonu I
-
1.
Azotan (V) srebra (I) AgNO
3
wytrąca z roztworów zawierających
jony I- żółtokremowy, trudno rozpuszczalny w wodzie osad AgI. Jodek
srebra (I) praktycznie nie rozpuszcza się w NH
3
∙H
2
O i w rozcieńczonym
HNO
3
. AgI reaguje z cyjankami i tiosiarczanami (VI) tworząc
odpowiednie związki kompleksowe.
2.
Stężony kwas siarkowy (VI) H
2
SO
4
utlenia jony I
-
do wolnego I
2
.
W porównaniu z jonami bromkowymi reakcja ta przebiega szybciej:
O
H
SO
I
H
SO
H
I
2
2
2
4
2
2
2
2

3.
Octan ołowiu (II) Pb(CH
3
COO)
2
wytrąca z roztworów
zawierających jony jodkowe żółty osad jodku ołowiu (II):
2
2
2
2
2
2
PbI
I
Pb
PbI
Pb
I
4.
Woda chlorowa lub chloramina T utlenia jony I
-
do wolnego jodu.
Wydzielony jod zabarwia wówczas roztwór na brunatno, natomiast po
wyekstrahowaniu jodu do warstwy chloroformowej powstaje zabarwienie
fioletowe:
H
ClH
IO
O
H
Cl
I
Cl
I
Cl
I
12
10
2
6
5
2
2
3
2
2
2
2
2

5.
Manganian (VII) potasu KMnO
4
w środowisku kwasowym na
zimno utlenia jony I
-
do wolnego jodu:
O
H
I
Mn
H
I
MnO
2
2
2
4
8
5
2
16
10
2
6.
Jony Hg
2+
wytrącają z roztworów zawierających jony I
-
czerwony
osad jodku rtęci (II) HgI
2
, który reaguje z nadmiarem jonów I
-
,
tworząc jony kompleksowe tetrajodortęcianu (II) [HgI
4
]
2-
:
2
4
2
2
2
]
[
2
2
HgI
I
HgI
HgI
I
Hg

7.
Jony Cu
2+
wytrącają z roztworów zawierających jony I
-
biały,
trudno rozpuszczalny w wodzie osad Cu
2
I
2
; wydzielający się w reakcji
jod zabarwia osad Cu
2
I
2
na kolor jasnobrązowy:
H
SO
I
O
H
SO
I
I
I
Cu
CuI
I
Cu
2
2
2
4
2
2
4
2
2
3
2
2
2
2
2
2
8.
Jony azotanowe (III), NO
2
-
utleniają w środowisku kwasowym
jony I
-
do wolnego I
2
:
O
H
NO
I
H
NO
I
2
2
2
2
2
4
2
2
9.
Jodan (V) potasu KIO
3
utlenia jony I
-
w środowisku kwasowym
do wolnego jodu:
O
H
I
H
I
IO
2
2
3
3
3
6
5

Jon cyjankowy
Reakcje charakterystyczne jonu CN
-
1.
Azotan (V) potasu AgNO
3
reaguje z jonami CN
-
tworząc
początkowo biały osad cyjanku srebra (I):
]
)
(
[
]
)
(
[
]
)
(
[
2
2
2
CN
Ag
Ag
Ag
CN
Ag
CN
Ag
K
KCN
AgCN
AgCN
Ag
CN
2.
Azotan (V) rtęci (I) Hg
2
(NO
3
)
2
reaguje z roztworem wodnym
KCN wytrącając metaliczną rtęć, tworzy się przy tym łatwo
rozpuszczalny w wodzie Hg(CN)
2
(odróżnienie od jonów Cl
-
, Br
-
, J
-
:
Hg
CN
Hg
Hg
CN
2
2
2
)
(
2

3.
Sproszkowana siarka podczas ogrzewania ze stałymi cyjankami
tworzy tiocyjaniany:
SCN
CN
S
4.
Disiarczek diamonu (NH
4
)
2
S
2
tworzy z jonami CN
-
jony SCN
-
:
2
2
2
S
SCN
S
CN
5.
Tiosiarczan (VI) sodu Na
2
S
2
O
3
przeprowadza jony CN
-
w jony SCN
-
:
2
3
2
3
2
SO
SCN
O
S
CN
2
2
2
2
2
2
2
4
2
1
2
)
(
2
1
2
8
2
)
(
3
4
2
6
I
CuI
I
Cu
CN
CuCN
CN
Cu
OH
MnO
CN
O
H
MnO
CN
6.
Utleniacze – KMnO
4
, H
2
O
2
, Cl
2
utleniają jony CN
-
do dicyjanu:

7.
Siarczan (VI) żelaza (II) FeSO
4
wytrąca z roztworów
cyjanków biały, trudno rozpuszczalny w wodzie osad Fe(CN)
2
;
związek ten reaguje z nadmiarem cyjanków tworząc „błękit pruski”
– heksacyjanożelazian (II):
3
6
4
3
4
6
4
6
2
2
2
]
)
(
[
4
]
)
(
[
3
]
)
(
[
4
)
(
2
)
(
)
(
2
CN
Fe
Fe
Fe
CN
Fe
CN
Fe
CN
CN
Fe
OH
CN
Fe
OH
Fe
CN
8.
Chlorek żelaza (III) FeCl
3
działając na roztwory cyjanków
(z wyjątkiem Hg(CN)
2
, ponieważ sól ta jest bardzo słabym
elektrolitem, reaguje tylko z metaliczną Hg, KI oraz H
2
S) wytrąca
czerwonobrunatny osad wodorotlenku żelaza (III), który reaguje
z nadmiarem cyjanków:
2
3
3
3
3
6
)
(
)
(
3
3
3
3
3
CO
HCN
CN
OH
Fe
OH
Fe
Fe
OH
OH
HCN
HOH
CN

9.
Jony Cu
2+
reagują z jonami CN
-
tworząc nietrwały żółty osad
Cu(CN)
2
. Związek ten rozkłada się na biały, trudno rozpuszczalny
cyjanek miedzi (I) i gazowy dicyjan. Osad CuCN rozpuszcza się
w nadmiarze cyjanków przechodząc w kompleks cyjankowy:
2
2
2
2
2
)
(
)
(
2
)
(
2
)
(
2
CN
Cu
CN
CuCN
CN
CuCN
CN
Cu
CN
Cu
CN
Cu
10.
Siarczek miedzi (II) CuS rozpuszcza się w KCN według reakcji:
S
K
CN
CN
Cu
K
KCN
CuS
2
2
4
3
2
)
(
]
)
(
[
2
10
2
I
ICN
I
CN
2
Roztwór jodu ze skrobią odbarwia się pod wpływem cyjanków.
Powstaje wtedy cyjanek jodu:

Jon tiocyjanianowy (rodankowy)
Reakcje charakterystyczne jonu SCN
-
1.
Azotan (V) srebra (I) AgNO
3
wytrąca z roztworów tiocyjanianów
biały osad tiocyjanianu srebra:
SCN
CN
Ag
CN
AgSCN
SCN
Ag
SCN
AgSCN
AgSCN
SCN
AgSCN
]
)
(
[
2
]
)
(
[
2
2
2
3
2.
Manganian (VII) potasu KMnO
4
utlenia jony SCN
-
w środowisku
kwasowym zgodnie z równaniem:
O
H
SO
Mn
CN
H
MnO
SCN
2
2
4
2
2
4
8
10
12
)
(
5
16
12
10

3.
Azotan (V) rteci (II) Hg(NO
3
)
2
podczas stopniowego dodawania
do KSCN wytrąca biały osad Hg(SCN)
2
. Osad ten reaguje z nadmiarem
KSCN z utworzeniem bardzo trwałego kompleksu [Hg(SCN)
4
]
2-
:
]
)
(
[
]
)
(
[
]
)
(
[
2
)
(
)
(
2
4
2
2
4
2
4
2
2
2
SCN
Hg
Co
Co
SCN
Hg
SCN
Hg
SCN
SCN
Hg
SCN
Hg
Hg
Hg
SCN
4.
Jony kobaltu Co
2+
dodane do roztworu o dużym stężeniu jonów
SCN
-
tworzą jony tetratiocyjanianokobaltu (II), które barwią mieszaninę
acetonu i eteru dietylowego na kolor niebieski:
2
4
2
2
2
]
)
(
[
2
)
(
)
(
2
SCN
Co
SCN
SCN
Co
SCN
Co
SCN
Co

5.
Siarczan (VI) miedzi (II) CuSO
4
dodany do roztworów
tiocyjanianów tworzy początkowo szmaragdowe zabarwienie,
a następnie wytrąca się czarny osad tiocyjanianu miedzi (II):
H
SO
CuSCN
O
H
SO
Cu
SCN
SCN
Cu
Cu
SCN
4
2
2
2
)
(
2
2
2
4
2
2
2
2
2
6.
Kwas azotowy (V) HNO
3
rozkłada tiocyjaniany według reakcji:
NO
NH
CO
SO
O
H
HNO
SCN
16
6
6
6
4
16
6
4
2
2
4
2
3
7.
Silne reduktory Zn, Al, Mg w kwasowym środowisku redukują
jony SCN
-
:
C
S
H
Cl
NH
AlCl
KCl
HCl
Al
KSCN
3
3
3
4
3
18
4
3
2
4
3

Jon heksacyjanożelazianowy (III)
Reakcje charakterystyczne jonu [Fe(CN)
6
]
3-
1.
Azotan (V) srebra (I) AgNO
3
wytrąca z roztworów zawierających
jony [Fe(CN)
6
]
3-
pomarańczowoczerwony osad heksacyjanożelazianu
(III) srebra (I) –Ag
3
[Fe(CN)
6
]. Osad ten jest nierozpuszczalny
w rozcieńczonym HNO
3
; rozpuszcza się w NH
3
∙H
2
O i KCN.
]
)
(
[
)
(
3
6
3
3
6
CN
Fe
Ag
CN
Fe
Ag
2.
Siarczan (VI) żelaza (II) FeSO
4
lub chlorek żelaza (II)
FeCl
2
reagują z jonami [Fe(CN)
6
]
3-
tworząc niebieski osad
FeK[Fe(CN)
6
] lub „błękit Turnbulla” Fe
3
[Fe(CN)
6
]
2
2
6
3
3
6
2
6
6
3
2
]
)
(
[
]
)
(
[
2
3
2
]
)
(
[
]
)
(
[
CN
Fe
Fe
CN
Fe
Fe
KCl
CN
Fe
FeK
CN
Fe
K
FeCl
2
6
3
3
6
2
]
)
(
[
)
(
2
3
CN
Fe
Cu
CN
Fe
Cu
3.
Siarczan (VI) miedzi (II) CuSO
4
wytrąca z roztworów
zawierających jony [Fe(CN)
6
]
3-
zielony osad Cu
3
[Fe(CN)
6
]
2
, trudno
rozpuszczalny w rozcieńczonych kwasach:

Jon heksacyjanożelazianowy (II)
Reakcje charakterystyczne jonu [Fe(CN)
6
]
4-
1.
Azotan (V) srebra (I) AgNO
3
wytrąca z roztworów zawierających
jony [Fe(CN)
6
]
4-
biały osad heksacyjanożelazianu (II) srebra (I) –
Ag
4
[Fe(CN)
6
], praktycznie nierozpuszczalny w rozcieńczonym HNO
3
i
NH
3
∙H
2
O, a rozpuszczalny w KCN i Na
2
S
2
O
3
:
]
)
(
[
)
(
4
6
4
4
6
CN
Fe
Ag
CN
Fe
Ag
2.
Chlorek żelaza (III) FeCl
3
wytrąca z roztworów zawierających
jony [Fe(CN)
6
]
4-
niebieski osad heksacyjanożelazianu (II) żelaza (III)
Fe
4
[Fe(CN)
6
]
3
(„błękit pruski”), rozkładający się pod wpływem zasad:
3
6
4
4
6
3
]
)
(
[
]
)
(
[
3
4
CN
Fe
Fe
CN
Fe
Fe

3.
Manganian (VII) potasu KMnO
4
w środowisku kwasowym,
na zimno utlenia jony heksacyjanożelazianowe (II) do jonów
heksacyjanożelazianowych (III):
)
4
]
)
(
[
5
8
]
)
(
[
5
2
2
3
6
4
4
6
H
Mn
CN
Fe
H
MnO
CN
Fe
4.
Jony miedzi (II) Cu
2+
tworzą z jonami [Fe(CN)
6
]
4-
czerwonobrunatny osad Cu
2
[Fe(CN)
6
], trudno rozpuszczalny
w rozcieńczonym CH
3
COOH:
]
)
(
[
2
]
)
(
[
6
2
2
4
6
CN
Fe
Cu
Cu
CN
Fe
5.
Chlorek rtęci (II) HgCl
2
Cl
Fe
CN
Hg
HgCl
CN
Fe
6
)
(
3
3
]
)
(
[
2
2
2
4
6

Jon chloranowy (I)
3
2
2
2
2
2
3
2
2
ClO
Cl
ClO
O
H
ClO
Cl
OH
Cl
H
CL
ClO
O
H
Cl
Reakcje charakterystyczne jonu ClO
-
:
1.
Azotan (V) srebra (I) AgNO
3
reaguje z jonami ClO
-
tworząc
biały osad chlorku srebra (I):
3
2
2
3
ClO
AgCl
Ag
ClO
O
H
Cl
H
Cl
HClO
SO
Na
HClO
SO
H
NaClO
2
2
4
2
4
2
2
2
2
2.
Rozcieńczony kwas siarkowy (VI) H
2
SO
4
i solny HCl reagują
z chloranami (I) wydzielając HClO:

3.
Octan ołowiu (II) Pb(CH
3
COO)
2
wytrąca z roztworów
zawierających jony ClO
-
- biały osad Pb(ClO)
2
. Osad ten po pewnym
czasie staje się pomarańczowo-czerowny w wyniku tworzenia PbO
2
.
Jony ClO
4
-
nie dają analogicznej reakcji:
HCl
HClO
PbO
O
H
ClO
Pb
COO
CH
ClO
Pb
COO
CH
Pb
ClO
2
2
2
3
2
2
3
)
(
2
)
(
)
(
2
HCl
Ag
O
O
Ag
HClO
HCl
O
Ag
Ag
HClO
2
2
2
2
2
4.
Srebro metaliczne Ag w postaci pyłu reaguje z jonami ClO
-
z wydzieleniem tlenu:

5.
Jodek potasu KI osadzony na bibule w obecności skrobi (papierek
jodoskrobiowy) pod wpływem NaClO zabarwia się na niebiesko pod
wpływem wydzielonego jodu:
Cl
OH
I
O
H
I
ClO
2
2
2
2
6.
Roztwór jonów Br
-
lub I
-
pod wpływem chloranów (I)
utleniają się do wolnego bromu lub jodu:
O
H
Cl
I
H
ClO
I
O
H
Cl
Br
H
ClO
Br
2
2
2
2
2
2
4
2
2
2
2
4
2
2

Analiza jakościowa II grupy anionów
S
2-
, CH
3
COO
-
, NO
2
-
Jon siarczkowy
Reakcje charakterystyczne jonu S
2-
1.
Jony Ag
+
wytrącają czarny siarczek Ag
2
S, rozpuszczalny po
ogrzaniu w kwasie azotowym (V) z wydzieleniem koloidowej siarki:
O
H
NO
S
Ag
H
NO
S
Ag
S
Ag
S
Ag
2
0
3
2
2
2
4
2
3
6
8
3
2
2.
Manganian (VII) potasu KMnO
4
w środowisku kwaśnym
odbarwia się, utleniając jony S
2-
do wolnej siarki:
O
H
S
Mn
S
H
Mno
2
0
2
2
4
8
5
2
5
16
2

3.
Stężony H
2
SO
4
rozkłada siarczki na gorąco z wydzieleniem wolnej
siarki:
O
H
S
SO
SO
Na
SO
H
S
Na
2
0
2
4
2
4
2
2
2
2
4.
Kwasy nieutleniające (HCl, rozcieńczony H
2
SO
4
) rozkładają
siarczki rozpuszczalne w wodzie i część nierozpuszczalnych
z wydzieleniem siarkowodoru:
S
H
H
S
FeSO
S
H
SO
H
FeS
2
2
4
2
4
2
2
5.
Substancje utleniające (Cl
2
, HNO
3
, K
2
CrO
4
) utleniają siarczki
do wolnej siarki:
Cl
S
S
Cl
O
H
NO
S
H
S
NO
2
4
2
3
8
3
2
0
2
2
2
0
2
3

Jon octanowy
Reakcje charakterystyczne jonu CH
3
COO
-
1.
Jony Ag
+
wytrącają ze stężonych roztworów biały osad octanu
srebra (I) rozpuszczalny w gorącej wodzie:
COOAg
CH
COO
CH
Ag
3
3
2.
Rozcieńczony H
2
SO
4
wydziela z roztworu octanów wolny kwas
octowy o charakterystycznym zapachu:
4
2
3
4
2
3
2
SO
Na
COOH
CH
SO
H
COONa
CH

3.
Jony Fe
3+
dają z jonami octanowymi roztwór o zabarwieniu
ciemnoczerwonym pochodzącym od octanu żelaza (III),
przechodzący po zagotowaniu w kłaczkowaty osad hydroksooctanu
żelaza (III). Reakcja wymaga środowiska obojętnego ,ponieważ
kwasy rozkładają octan żelaza (III) do wolnego kwasu octowego.
COOH
CH
Fe
H
COO
CH
Fe
COOH
CH
COO
CH
OH
Fe
O
H
COO
CH
Fe
COO
CH
Fe
COO
CH
Fe
3
3
3
3
3
3
2
2
3
3
3
3
3
3
3
3
)
(
2
)
(
2
)
(
)
(
3
4.
Etanol. Bezwodne octany ogrzewane z etanolem w obecności
stężonego kwasu siarkowego (VI) ulegają reakcji estryfikacji, w wyniku
czego powstaje octan etylu o charakterystycznym przyjemnym zapachu,
przypominającym zapach jabłek:
5.
Arszenik As
2
O
3
, bezwodne octany prażone z tritlenkiem diarsenu
tworzą tlenek kakodylu o przykrej woni, przypominającej zapach
czosnku:
O
CH
As
CO
NaCO
O
As
COONa
CH
2
2
3
2
3
3
2
3
]
)
(
[
2
2
4

Jon azotanowy (III)
O
H
NO
HNO
HNO
2
3
2
2
3
Reakcje charakterystyczne jonu NO
2
-
2
2
2
2
2
2
)
(NO
Ag
NO
AgNO
AgNO
NO
Ag
1.
Jony Ag
+
wytrącają z roztworu zawierającego jony NO
2
-
biały
osad azotanu (III) srebra (I), rozpuszczalny w nadmiarze jonów NO
2
-
z utworzeniem jonu kompleksowego:

2.
Rozcieńczony H
2
SO
4
rozkłada azotany (III) na zimno
z wydzieleniem brunatnego gazu.
)
(
2
)
(
2
2
3
2
2
2
3
2
2
4
4
2
2
brunatny
NO
powietrza
z
O
NO
O
H
NO
HNO
HNO
HNO
NaHSO
SO
H
NaNO
3.
Manganian (VII) potasu KMnO
4
utlenia azotany (III)
w środowisku kwaśnym do azotanów (V):
O
H
NO
Mn
H
NO
MnO
2
3
2
2
4
3
5
2
6
5
2
4.
Jony jodkowe I
-
utleniają się wobec azotanów (III) do wolnego
jodu:
O
H
NO
I
H
NO
I
2
2
2
2
2
4
2
2

5.
Siarczan (VI) żelaza (II) FeSO
4
ulega częściowo utlenieniu do
Fe
2
(SO
4
)
3
, kosztem redukcji azotanu (III) do NO. Nadmiar jonu Fe
2+
tworzy z NO brunatne zabarwienie w wyniku powstania jonu Fe(NO)
2+
.
Reakcja zachodzi w środowisku kwasowym:
2
2
2
3
2
2
)
(
2
NO
Fe
NO
Fe
O
H
NO
Fe
H
Fe
NO
6.
Stałe sole amonu NH
4
+
gotowane z azotanami (III) redukują je
do wolnego azotu. Reakcja ta pozwala usunąć jony NO
2
-
z analizy:
O
H
N
e
O
H
NO
2
0
2
2
2
6
5
e
H
N
NH
3
4
0
4
O
H
N
NH
NO
2
2
4
2
2

7.
Metale Al lub Zn (w postaci pyłu) w środowisku zasadowym
redukują jony NO
2
-
do amoniaku, który poznaje się po zapachu
lub zmianie na niebiesko papierka lakmusowego.
e
OH
Al
OH
Al
x
OH
NH
e
O
H
NO
3
)
(
4
2
7
6
5
4
0
3
2
2
4
3
2
0
2
)
(
2
5
2
OH
Al
NH
O
H
OH
Al
NO
8.
Jony Co
2+
w środowisku kwasu octowego tworzą krystaliczny żółty
osad soli kompleksowej, w której kobalt jest trójwartościowy –
heksazotano(III)kobaltanu(III) potasu K
3
[Co(NO
2
)
6
]; jony NO
2
-
częściowo redukują się do NO:
O
H
COO
CH
NO
NO
Co
K
COOH
CH
K
NO
Co
2
3
6
2
3
3
2
2
2
]
)
(
[
2
3
7
Wyszukiwarka
Podobne podstrony:
Analiza jakościowa kationów i anionów, Analiza jakościowa
Analiza jakościowa kationów i anionów, Energetyka, I rok, chemia
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
Analiza jakościowa kationów i anionów- płyny proste, Analiza jakościowa
Analiza jakościowa Kationów i anionów(1.0 pkt), Mechanika i Budowa Maszyn, Chemia sprawozdania
Analiza jakościowa kationów i anionów, Analiza jakościowa
sprawozdanie elementy analizy jakościowej kationów i anionów
Analiza anionów
analiza anionów, Aniony
ANALIZA ANIONÓW - ćwiczenia z 13.11, ANALIZA ANIONÓW
Analiza anionów na przykładzie I grupy
sprawozdanie analiza anionów, UP Wrocław, IŚ I SEM, Chemia
analiza anionów (2)
analiza anionów
Sprawozdanie analiza anionów
ANALIZA ANIONÓW I VII GRUPY ANALITYCZNEJ
Sprawozdanie analiza anionów
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
więcej podobnych podstron