
Transport leków przez błony biologiczne
Zanim lek dotrze do odpowiedniego receptora i wywoła określony
efekt farmakologiczny, musi przedostać się z miejsca podania (np.
przewód pokarmowy) do miejsca działania (np. mózg). Przemieszcza-
jąc się pomiędzy kompartmentami organizmu lek musi przekraczać
różne bariery biologiczne. Są to najczęściej podwójne, fosfolipidowe
błony komórek.
Istnieją też bardziej złożone bariery, np.:
o bariera nabłonkowa tworzona przez śluzówkę przewodu po-
karmowego składa się ze ściśle przylegających do siebie ko-
mórek (lek aby dostać się do organizmu musi pokonać dwie
błony komórkowe – zewnętrzną i wewnętrzną)
o śródbłonek naczyniowy jest bardziej skomplikowaną barierą -
w szczelinach między jego komórkami znajduje się luźna ma-
sa białkowa nie przepuszczająca większych cząsteczek
•
w mózgu i w łożysku występują bardzo ścisłe połączenia
między komórkami śródbłonka
•
z kolei w wątrobie i śledzionie śródbłonek nie jest ciągły, co
pozwala na łatwiejsze przechodzenie leków
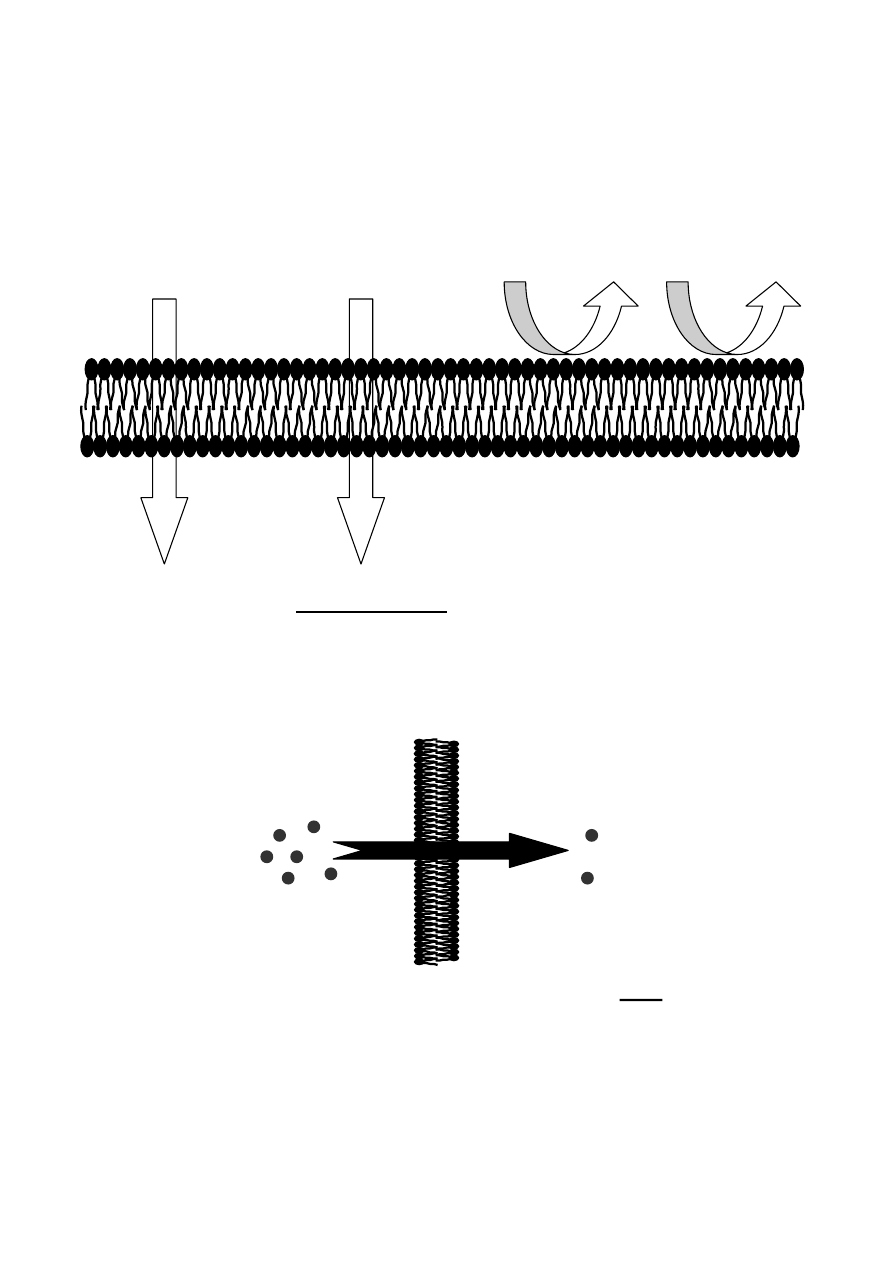
Przechodzenie cząsteczek substancji przez błony komórkowe zachodzi
za pośrednictwem czterech głównych mechanizmów:
1. Dyfuzji biernej przez lipidy
2. Dyfuzji przez pory wodne
3. Transportu przenośnikowego
4. Pinocytozy
Dyfuzja przez pory wodne ma małe znaczenie z punktu widzenia farma-
kokinetyki leków, ponieważ mała średnica porów uniemożliwia przejście
leków o wielkości > 1nm.
Pinocytoza polega na utworzeniu z zagłębienia błony komórkowej pę-
cherzyka z zawartością zewnątrzkomórkową. Pęcherzyk ten może uwol-
nić się do wnętrza komórki lub zostać wydalony po drugiej stronie (np.
przechodzenie insuliny przez barierę krew-mózg). Mechanizm ten rów-
nież rzadko pośredniczy w dystrybucji leków.
Najważniejsze z punktu widzenia farmakokinetyki leków są procesy dy-
fuzji biernej przez lipidy oraz transportu przenośnikowego.
1
Dyfuzja bierna przez lipidy
Dyfuzja bierna jest podstawowym mechanizmem przenikania leków
przez błony biologiczne. Niezjonizowane substancje o właściwościach
lipofilnych przechodzą bez problemu przez błonę lipidową. Siłą napędo-
wą tego przemieszczania się jest gradient stężenia substancji po obu
stronach błony.
Przepływ [mol/s] = P × ∆C ×
h
A
grubość błony (h)
powierzchnia błony (A)
stężenie
wewnętrzne (C
w
)
stężenie
zewnętrzne (C
z
)
mocznik
benzen
DUŻE
NIENAŁADOWANE
CZĄSTECZKI
POLARNE
H
+
Na
+
HCO
3
-
K
+
Ca
2+
Mg
2+
Cl
-
glukoza
JONY
MAŁE
NIENAŁADOWANE
CZĄSTECZKI
POLARNE
CZĄSTECZKI
HYDROFOBOWE
N
2
O
2
H
2
O CO
2
P –
współczynnik przenikalności leku
∆C – przezbłonowy gradient stężeń (C
z
– C
w
)
A – powierzchnia błony
h – grubość błony
2

Współczynnik przenikalności P dla substancji biernie przechodzącej
przez błonę komórkową zależy od dwóch wartości wynikających z bu-
dowy leku:
D – współczynnik dyfuzji – miara poruszania się cząsteczek w lipidach.
Zależny od kształtu oraz wielkości cząsteczki.
K – współczynnik rozdziału – miara rozpuszczalności danej substancji w
tłuszczach. Zależny od polaryzacji cząsteczki.
Współczynnik rozdziału K jest jedną z najważniejszych wartości za-
leżnych od budowy leku, która określa przenikanie leku przez błonę lipi-
dową. Oznacza się go badając dystrybucję danej substancji pomiędzy
wodą a olejem roślinnym:
[Lek w oleju]
1000
[Lek w wodzie] 1
K=1000
Lek łatwo rozpuszczalny w lipidach. Łatwo
przenika przez błony lipidowe o ile nie jest zbyt
duży.
[Lek w oleju]
1
[Lek w wodzie] 1000
K=0.001
Lek słabo rozpuszczalny w lipidach. Źle prze-
chodzi przez błony komórkowe.
Rozpuszczalność w tłuszczach jest jedną z najważniejszych cech charak-
teryzujących dany lek, wpływa bowiem m.in. na szybkość jego wchła-
niania z jelit, przechodzenie do mózgu i tkanek czy szybkość eliminacji
przez nerki.
3
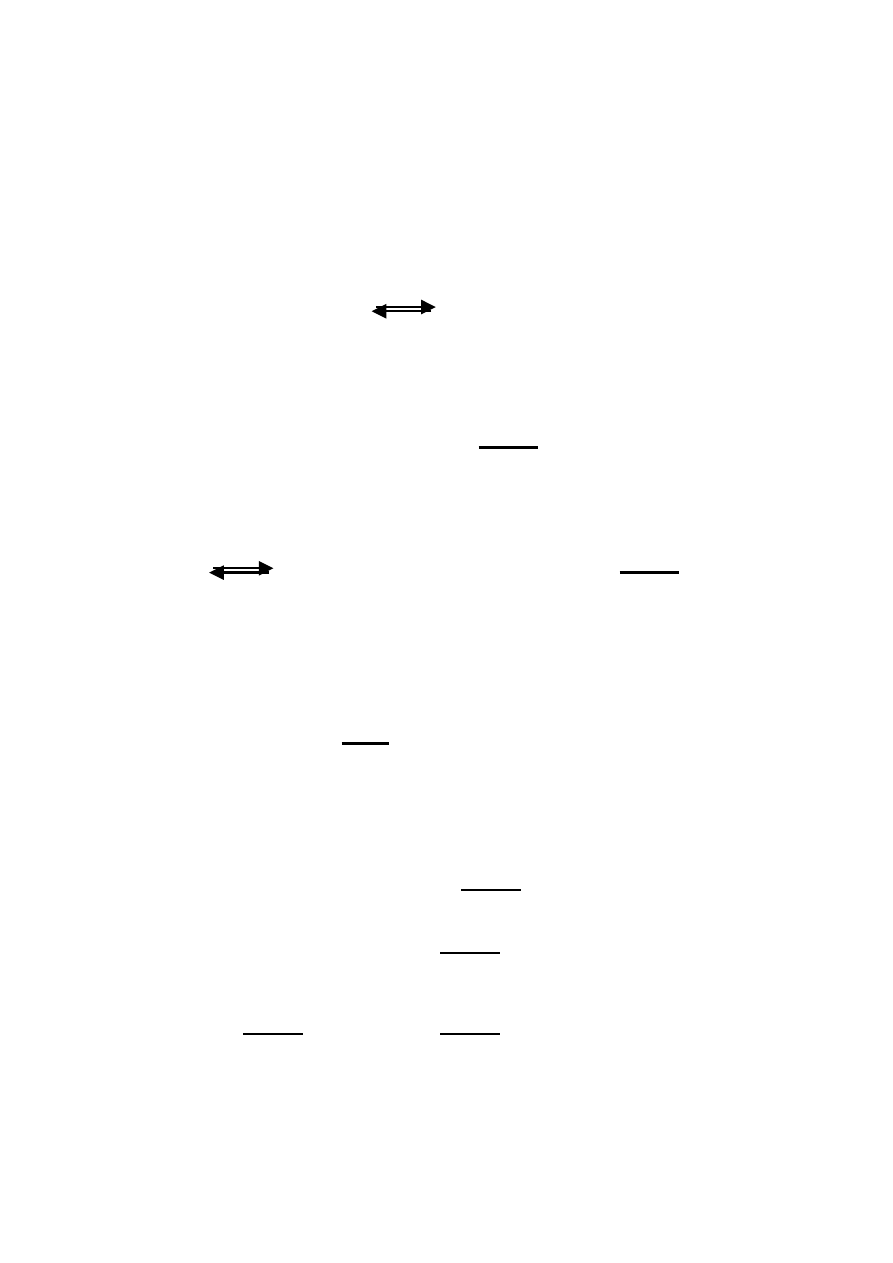
pH i stan zjonizowania
Większość leków to słabe kwasy lub zasady, w związku z czym istnieją
one zarówno w formie zjonizowanej jak i niezjonizowanej, a wzajemny
stosunek tych form zależy od pH środowiska. Ma to podstawowe zna-
czenie dla procesów wchłaniania i dystrybucji ponieważ przez błonę
lipidową przenikać może tylko lek w postaci niezjonizowanej.
Dla słabej zasady reakcja jonizacji wygląda następująco:
BH
+
K
a
B + H
+
a stałą dysocjacji pK
a
można obliczyć z równania Hendersona-
Hasselbalcha:
pK
a
= pH + log
[BH
+
]
[B]
Dla słabego kwasu odpowiednie wzory to:
K
a
pK
a
= pH + log
[A
-
]
[AH]
A
-
+ H
+
AH
Obliczmy przykładowo pK
a
strychniny wiedząc, że w środowisku żołądka
(pH = 2) zmierzona przez nas liczba zjonizowanych cząsteczek strych-
niny wynosi 10
7
a niezjonizowanych 10:
pK
a
= 2 + log 10
7
10
1
= 2 + log 10
6
= 2 + 6 = 8
Policzmy teraz ile razy więcej w żołądku (pH = 2) jest cząsteczek nie-
zjonizowanych kwasu salicylowego (pK
a
= 3) niż cząsteczek zjonizowa-
nych:
pK
a
= pH + log
[A
-
]
[AH]
[AH]
3 = 2 + log
[A
-
]
[AH]
[A
-
]
[A
-
]
= 1 czyli
[AH]
= 10
1
log
Wynika z tego, że w środowisku żołądka jest dziesięciokrotnie więcej
niezjonizowanych cząsteczek kwasu salicylowego niż zjonizowanych.
4
Wartość pK
a
można zdefiniować również jako takie pH, przy którym
liczba cząsteczek zjonizowanych i niezjonizowanych leku jest dokładnie
taka sama.
Stopień jonizacji leków w zależności od pH
niskie pH
pH = pK
a
wysokie
pH
Słaby kwas AH > A
+
H
+
AH = A
+
H
+
A
+
H
+
> AH
Słaba zasada
BH
+
> B
BH
+
= B
B > BH
+
Chlorochina
Desmetylimipramina
Amfetamina
Atropina
Histamina
Propranolol
Chlorpromazyna
Mepyramina
Dopamina
1
2
4
5
6
7
8
9
3
10
12
11
Noradrenalina
Chlordiazepoksyd
Trimetoprim
Ergometryna
Morfina
Diazepam
SŁABA
ZASADA
SILNA
ZASADA
pK
a
Kwas askorbinowy
Fenytoina
Tiopental
Fenobarbital
Sulfametoksazol
Chlorotiazyd
Warfaryna
Penicyliny
Aspiryna
Probenecid
Metotreksat
L-DOPA
SŁABY
KWAS
SILNY
KWAS
Wartości pK
a
niektórych leków o odczynie kwaśnym i zasadowym
(za: Rang 2000, „Pharmacology”, Churchil Livingstone, Edinburgh)
Jeśli nie wiadomo, czy lek jest słabym kwasem czy zasadą można to
czasem odgadnąć – leki bywają rozpowszechniane w postaci soli:
•
słabe kwasy tworzą sole z silnymi zasadami (np. sól sodowa ampi-
cyliny)
•
słabe zasady tworzą sole z silnymi kwasami (np. chlorowodorek
epinefryny)
5
Wpływ różnic pH na rozmieszczenie leków w organizmie
Jeśli pomiędzy kompartmentami wodnymi przedzielonymi błoną lipido-
wą istnieją różnice pH, to ilość cząsteczek leku w tych kompartmentach
może się znacznie różnić. Mówi o tym prawo podziału pH sformułowane
przez Brodiego. Zgodnie z tym prawem jeśli błona rozdziela dwie fazy
wodne o różnym pH, to:
•
słaby kwas będzie gromadził się po stronie o większym pH
(bo tam jest silniej zjonizowany)
•
słaba zasada będzie gromadziła się po stronie o mniejszym pH
(bo tam jest silniej zjonizowana)
Słaby kwas pK
a
6
Słaba zasada pK
a
6
pH 7,4
pH 5,0
pH 7,4
pH 5,0
90 [BH
+
]
10 [B]
[BH
+
] 1
[B] 10
1 [A
-
] [H
+
]
10 [AH]
[A
-
] [H
+
] 90
[AH] 10
∑ = 100
∑ = 11
∑ = 11
∑ = 100
(za: Danysz 1996, „Podstawy farmakologii”, Volumed, Wrocław)
Nie wszystkie leki podlegają jednak w pełni prawu podziału pH – niektó-
re bowiem substancje nawet w postaci niezjonizowanej nie są wystar-
czająco rozpuszczalne w lipidach aby przejść przez błony biologiczne
(np. aminoglikozydy posiadające w swej budowie cząsteczkę cukru).
6
Na poniższym rysunku przedstawiono w jaki sposób słaby kwas (aspiry-
na) oraz słaba zasada (petydyna) byłyby rozmieszczone w wyidealizo-
wanych warunkach w trzech kompartmentach organizmu ludzkiego – w
soku żołądkowym (pH 3), osoczu (pH 7,4) oraz moczu (pH 8).
Sok żołądkowy
pH 3
Osocze
pH 7,4
Mocz
pH 8
(za: Rang 2000, „Pharmacology”, Churchil Livingstone, Edinburgh)
>10
6
30
100
Zjonizowana zasada
BH
+
Niezjonizowana
zasada B
>400
100
Niezdysocjowany
kwas AH
Anion A
-
< 0,1
Aspiryna
sł
aby kwas pK 3,5
Petydyna
sł
aba zas
ada pK 3
,5
Zakłada się, że przez błony przechodzi wyłącznie forma niezjonizowana
i dlatego osiąga takie samo stężenie w każdym kompartmencie. Forma
zjonizowana nie przechodzi przez błony, więc po pewnym czasie całko-
wite stężenie leku (forma zjonizowana + forma niezjonizowana) w każ-
dym kompartmencie będzie inne. Słabe kwasy gromadzić się będą w
kompartmencie o wysokim pH i vice versa. Zjawisko takie nazywa się
pułapką jonową.
Przykładowe konsekwencje pułapki jonowej:
•
Zakwaszenie moczu:
o przyspiesza wydalanie słabych zasad (dlatego podajemy Fu-
ragin z witaminą C)
o opóźnia wydalanie słabych kwasów
•
Alkalizacja moczu
o przyspiesza wydalanie słabych kwasów (dlatego w zatruciu
aspiryną alkalizuje się mocz)
o opóźnia wydalanie słabych zasad
7
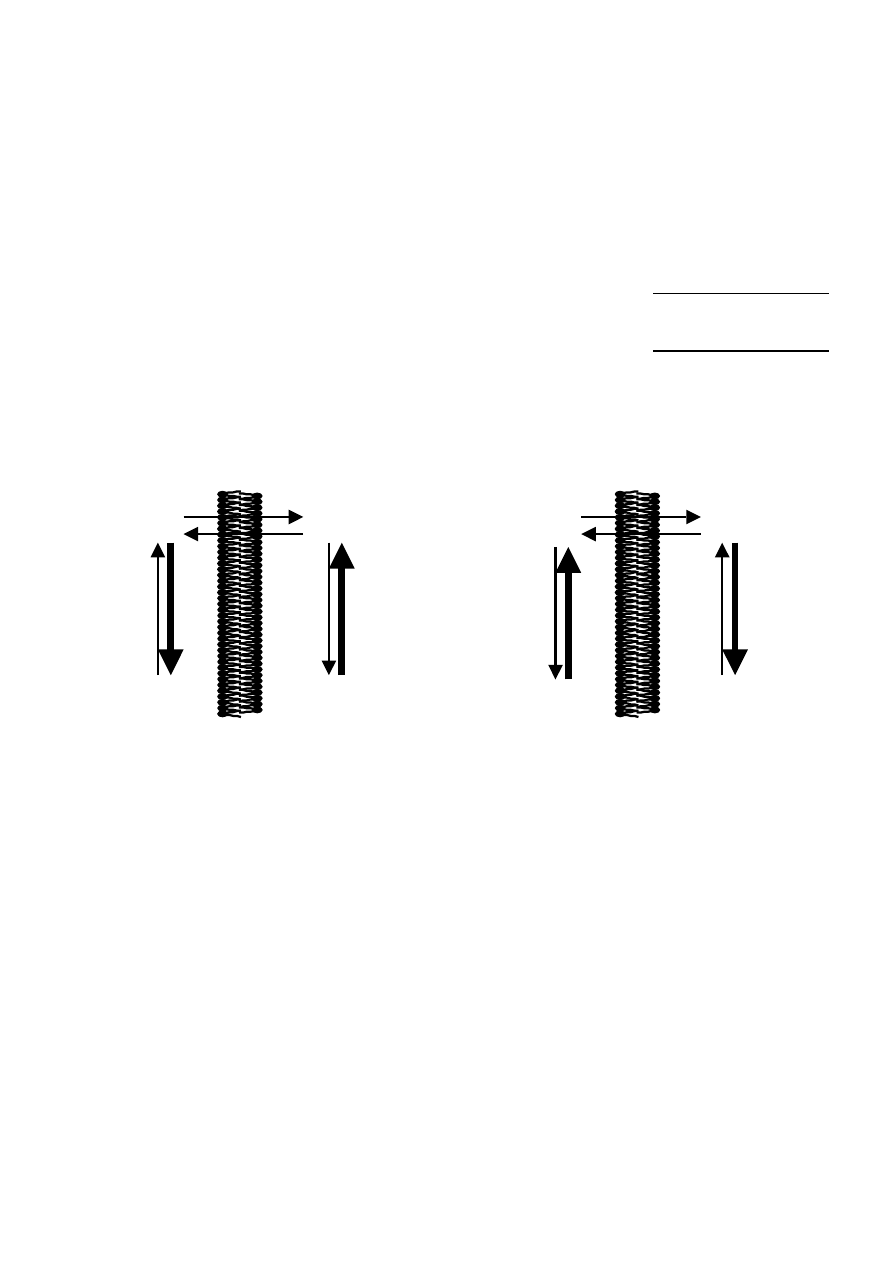
Transport leków z użyciem nośników
Duża część błon komórkowych posiada mechanizmy wyspecjalizowane
w transporcie istotnych z punktu widzenia fizjologii substancji takich jak
cukry, aminokwasy czy neuroprzekaźniki. Transport taki odbywa się
zwykle przy pomocy wyspecjalizowanego przezbłonowego białka prze-
nośnikowego wiążącego jedną lub więcej cząsteczek danej substancji i
uwalniającego je po drugiej stronie błony. Taki sposób przenikania sub-
stancji przez błony charakteryzuje się, w odróżnieniu od dyfuzji biernej,
następującymi cechami:
•
możliwością transportu przez błonę substancji hydrofilnych
•
wybiórczością względem przenoszonych substancji (niekoniecznie
dużą)
•
wysycaniem się przenośników przy wysokich stężeniach substratu
•
możliwością wystąpienia kompetycyjnego hamowania przez konku-
rujące substancje
Wyróżniamy dwa rodzaje transportu przenośnikowego:
1. Dyfuzja ułatwiona:
•
odbywa się zawsze zgodnie z gradientem stężeń więc nie może sama
wytwarzać takiego gradientu
•
nie wymaga zużytkowania energii
•
może odbywać się przy użyciu białka transportującego (np. wit. B12)
bądź kanału jonowego (np. K
+
, Na
+
)
•
w transporcie leków raczej nie odgrywa istotnego znaczenia
2. Transport aktywny
•
może odbywać się wbrew gradientowi stężeń (wykorzystuje energię
czerpaną z rozkładu ATP)
•
może generować gradient elektrochemiczny
•
ma istotne znaczenie w transporcie błonowym leków np. w:
o kanalikach nerkowych
o drogach żółciowych
o barierze krew-mózg
o przewodzie pokarmowym
8
Wyszukiwarka
Podobne podstrony:
14. Transport cząsteczek przez błony biologiczne, Studia, biologia
Transport przez błony biologiczne, Studia, I rok, Wykłady z biofizyki
wyklad 3 Transport przez blony biologiczne 1
33 TRANSPORT BIERNY I TRANSPORT AKTYWNY JONOW SODU I POTASU PRZEZ BLONY BIOLOGICZNE
Transport przez błony biologiczne, Studia, I rok, Wykłady z biofizyki
Opracowanie-PODAWANIE LEKÓW PRZEZ BŁONY ŚLUZOWE, Pielęgniarstwo licencjat AWF, Podstawy pielęgniarst
01 transport subst. przez błony, Transportery pierwotne:
Biologia część V Transport przez błony
Biologia część V, Transport przez błony
biologia transport przez błony
Błony biologiczne i transport przez błony
Transport przez błony
Transport przez blony (1)
65 Transport przez błony
Transport przez blony
Transport przez błony za pomocą antybiotyków jonoforowych, biochemia, licencjat, praca
więcej podobnych podstron