
KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM IV
Część 2
ZABURZENIA RYTMU SERCA
Pod redakcją:
Mirosława Dłużniewskiego
Artura Mamcarza
Patryka Krzyżaka
AKADEMIA MEDYCZNA
WARSZAWA 2003

© Copyright by Mirosław Dłużniewski, Artur Mamcarz
& Patryk Krzyżak
ISBN 83-89517-13-2
Recenzent:
Prof. dr hab. n. med. Grzegorz Opolski
Druk i oprawa:
B-2 Sp. z o.o.
Projekt graficzny serii:
Urszula Janiszewska
Korekta:
Magdalena Zielonka
Katedra i Klinika Kardiologii
II Wydziału Lekarskiego Akademii Medycznej w Warszawie
ul. Kondratowicza 8, 03-242 Warszawa
tel.: (22) 326 58 24, fax: (22) 326 58 26
web site: www.amkard.waw.pl
e-mail: klinika@amkard.waw.pl

KARDIOLOGIA PRAKTYCZNA
DLA LEKARZY RODZINNYCH
I STUDENTÓW MEDYCYNY
TOM IV
Część 2
ZABURZENIA RYTMU SERCA

Autorzy:
Dr n. med. Wojciech Braksator
Lek. med. Ewa Burbicka
Lek. med. Marek Chmielewski
Lek. med. Agnieszka Cudnoch-Jędrzejewska
1
Lek. med. Katarzyna Cybulska
Prof. dr hab. n. med. Mirosław Dłużniewski
Lek. med. Włodzimierz Gierlak
Lek. med. Maciej Janiszewski
Lek. med. Małgorzata Kalinowska
Lek. med. Liliana Kostana
Lek. med. Edyta Kostarska-Srokosz
Dr n. med. Jarosław Król
Lek. med. Patryk Krzyżak
Prof. dr hab. n. med. Jerzy Kuch
Dr hab. n. med. Marek Kuch
Lek. med. Ewa Kucharczyk-Petryka
Lek. med. Andrzej Kurowski
2
Lek. med. Franciszek Majstrak
2
Dr hab. n. med. Artur Mamcarz
Dr n. med. Włodzimierz Mojkowski
Lek. med. Michał Moszczeński
Dr n. med. Witold Pikto-Pietkiewicz
Dr n. med. Jacek Sawicki
Lek med. Grzegorz Suwalski
2
Prof. dr hab. n. med. Kazimierz B. Suwalski
2
Lek. med. Piotr Suwalski
2
Dr n. med. Joanna Syska-Sumińska
Dr n. med. Edmund Szczepańczyk
Prof. dr hab. n. med. Ewa Szczepańska-Sadowska
1
Dr n. med. Andrzej Światowiec
Lek. med. Monika Tomaszewska-Kiecana
Lek. med. Karol Wrzosek

z Katedry i Kliniki Kardiologii II Wydziału Lekarskiego AM
1
z Katedry i Zakładu Fizjologii Doświadczalnej i Klinicznej AM
2
z Oddziału Klinicznego Kardiochirurgii I Katedry i Kliniki Kardiologii
AM w Warszawie


SPIS TREŚCI
Część 2
1. Napadowe tachyarytmie nadkomorowe – przyczyny i strategia
postępowania
Jacek Sawicki, Jarosław Król
3
2. Migotanie przedsionków – obraz kliniczny,
zasady postępowania
Joanna Syska-Sumińska, Andrzej Światowiec,
Mirosław Dłużniewski
15
3. Zespół WPW
Włodzimierz Mojkowski, Michał Moszczeński,
Mirosław Dłużniewski
30
4. Komorowe zaburzenia rytmu serca. Kogo leczyć? Jak leczyć?
Jarosław Król, Mirosław Dłużniewski
43
5. Zaburzenia rytmu serca w ostrych zespołach wieńcowych
Włodzimierz Gierlak, Marek Kuch
53
6. Komorowe zaburzenia rytmu serca w stabilnej
chorobie wieńcowej
Jarosław Król, Monika Tomaszewska-Kiecana
67
7. Zaburzenia rytmu w niewydolności serca
Edmund Szczepańczyk, Mirosław Dłużniewski
73
8. Zaburzenia rytmu serca w zespole wypadania płatka zastawki
mitralnej
Wojciech Braksator, Patryk Krzyżak, Mirosław Dłużniewski
84
9. Znaczenie zaburzeń rytmu serca w kardiomiopatii
przerostowej
Włodzimierz Gierlak, Marek Kuch, Wojciech Braksator,
Mirosław Dłużniewski
94
10. Nagły zgon sercowy u sportowców
Jerzy Kuch, Artur Mamcarz, Wojciech Braksator
105
11. Zaburzenia rytmu serca u sportowców. Zasady diagnostyki,
leczenia i orzekania
Artur Mamcarz, Wojciech Braksator, Jerzy Kuch
112
12. Nagły zgon sercowy
Andrzej Światowiec, Mirosław Dłużniewski
127
1

13. Wszczepialne kardiowertery-defibrylatory serca
Michał Moszczeński, Włodzimierz Mojkowski,
Mirosław Dłużniewski
135
14. Resuscytacja krążeniowo-oddechowa
Karol Wrzosek, Małgorzata Kalinowska, Artur Mamcarz
141
15. Proarytmia
Karol Wrzosek, Jarosław Król
161
16. Arytmogenna kardiomiopatia prawej komory
Witold Pikto-Pietkiewicz, Maciej Janiszewski, Marek Kuch
167
17. Zaburzenia rytmu serca u kobiet ciężarnych
Edyta Kostarska-Srokosz, Ewa Burbicka, Mirosław Dłużniewski
178
18. Chirurgiczne leczenie migotania przedsionków
Piotr Suwalski, Franciszek Majstrak, Grzegorz Suwalski,
Andrzej Kurowski, Kazimierz B. Suwalski
191
19. Chirurgia tachyarytmii komorowych
Piotr Suwalski, Franciszek Majstrak, Grzegorz Suwalski,
Andrzej Kurowski, Kazimierz B. Suwalski
209
2

I.
NAPADOWE TACHYARYTMIE NADKOMOROWE
– PRZYCZYNY I STRATEGIA POSTĘPOWANIA
Jacek Sawicki, Jarosław Król
WSTĘP
Tachyarytmie nadkomorowe obejmują dość szeroką grupę zaburzeń ryt-
mu, a mianowicie: częstoskurcze nadkomorowe, migotanie i trzepotanie
przedsionków oraz częstoskurcze przedsionkowo-komorowe u chorych z ze-
społami preekscytacji.
Migotanie i trzepotanie przedsionków będzie omówione w oddzielnym
rozdziale, podobnie zespół preekscytacji, z tego powodu w niniejszym roz-
dziale skoncentrujemy się na częstoskurczach nadkomorowych.
DEFINICJA
Częstoskurcz nadkomorowy jest to szybki rytm serca, powyżej 100/min,
powstający powyżej rozwidlenia pęczka Hisa. Zatem zespoły QRS są „wą-
skie”, ich czas trwania nie przekracza 0,12 s – mówimy wówczas o często-
skurczu z „wąskimi” zespołami QRS. Niekiedy częstoskurcz nadkomorowy
przebiega z „szerokimi” zespołami QRS (powyżej 0,12 s). Tak się dzieje
w przypadku antydromowego częstoskurczu przedsionkowo-komorowego
w zespole preekscytacji lub też, gdy przed wystąpieniem częstoskurczu obec-
ny był blok odnogi pęczka Hisa, ewentualnie gdy w czasie częstoskurczu wy-
stępuje zjawisko aberracji przewodzenia śródkomorowego. Tego rodzaju
częstoskurcz nadkomorowy wymaga różnicowania z częstoskurczem komo-
rowym i jest to jedno z trudniejszych zadań, przed którym staje lekarz dy-
żurny Oddziału Intensywnej Opieki Kardiologicznej.
Częstoskurcz nadkomorowy zwykle przebiega w postaci napadowej, tzn.
pojawia się nagle i nagle ustaje (tachycardia supraventricularis paroxysmalis,
paroxysmal supraventricular tachycardia, SVT). Niekiedy jednak częstoskurcz
ma charakter ustawiczny (incessant tachycardia); w takich wypadkach w ba-
daniu holterowskim obserwujemy liczne epizody arytmii przeplatające się
z rytmem zatokowym, a łączny czas trwania częstoskurczu obejmuje ponad
połowę doby. Długotrwale utrzymujący się częstoskurcz nadkomorowy
szczególnie często stwierdza się u dzieci oraz w przebiegu zespołu preekscy-
tacji. Bardzo oporny na leczenie jest zwłaszcza częstoskurcz przedsionkowo-
-komorowy z wolnym wstecznym przewodzeniem przedsionkowo-komorowym
(long R-P' tachycardia), inaczej zwany także częstoskurczem Coumela. Utrzy-
mywanie się tej arytmii latami prowadzi do rozwoju niewydolności serca,
czyli do tachykardiomiopatii.
3

ETIOLOGIA
Tachyarytmie nadkomorowe mogą występować zarówno u osób zdrowych,
jak również w przebiegu różnych strukturalnych schorzeń serca. Najczęst-
szymi chorobami serca, w przebiegu których pojawia się częstoskurcz nadko-
morowy, są:
Wiele schorzeń wymienionych poniżej sprzyja występowaniu napadowego
częstoskurczu nadkomorowego nawet u osób bez istotnej choroby serca, na-
leżą do nich:
Wyróżnia się 3 podstawowe mechanizmy powstawania częstoskurczów
nadkomorowych. Są to: fala pobudzenia nawrotnego (re-entry), wzmożony
automatyzm i aktywność wyzwalana (triggered activity).
OBJAWY
Typowym objawem u chorego z napadem tachyarytmii nadkomorowej jest
uczucie kołatania serca, które pojawia się nagle i nagle ustępuje. Kołataniu
serca może towarzyszyć osłabienie, zawroty głowy, „mroczki” przed oczami,
• nadczynność tarczycy;
• zator tętnicy płucnej;
• niedokrwistość;
• stany gorączkowe;
• zaburzenia wodno-elektrolitowe;
• stany napięcia emocjonalnego;
• leki sympatykomimetyczne/wagolityczne;
• trójcykliczne leki antydepresyjne, pochodne fenotiazyny,
hormony tarczycy.
• choroba wieńcowa i zawał serca;
• niewydolność serca;
• zapalenie mięśnia sercowego;
• kardiomiopatie;
• wady zastawkowe.
4

omdlenie, bóle w klatce piersiowej, duszność i wielomocz. Pojawienie się po-
ważnych zaburzeń hemodynamicznych, takich jak: obrzęk płuc, ciężka hipo-
tonia lub wstrząs, wskazuje na obecność strukturalnej choroby serca, szcze-
gólnie u osób starszych i wymaga diagnostyki kardiologicznej po ustąpieniu
arytmii.
KLASYFIKACJA CZĘSTOSKURCZÓW NADKOMOROWYCH
Rozwój wiedzy na temat mechanizmów powstawania omawianych arytmii
oraz wysoka skuteczność nowoczesnych niefarmakologicznych metod lecze-
nia, np. ablacja prądem o częstotliwości radiowej (RF), zmusza nas do bar-
dziej precyzyjnego określenia typu częstoskurczu i miejsca jego powstawa-
nia. Zatem nie należy dzisiaj zadowalać się ogólnym stwierdzeniem:
częstoskurcz nadkomorowy.
Zgodnie z aktualnym podejściem częstoskurcze nadkomorowe dzieli się
na dwie główne kategorie:
Generalnie rzecz biorąc, pobudzenie nerwu błędnego poprzez masaż zato-
ki szyjnej lub podanie adenozyny, wywołuje przemijający blok P-K i prowa-
dzi do przerwania częstoskurczu z łącza P-K, natomiast w częstoskurczu
przedsionkowym zwalnia częstość serca jedynie przejściowo, co uwidacznia
aktywność elektryczną przedsionków. Rozróżnienie tych 2 głównych typów
częstoskurczów nadkomorowych ma istotne znaczenie z kilku powodów.
W leczeniu doraźnym częstoskurcze z łącza P-K udaje się umiarowić, stosując
zabiegi zwiększające napięcie nerwu błędnego lub podając leki blokujące
przewodzenie w węźle P-K (adenozyna, werapamil). Metody te są mało sku-
teczne w częstoskurczach przedsionkowych, w których bardziej skuteczne są
leki zmieniające właściwości elektrofizjologiczne mięśnia przedsionka (leki
antyarytmiczne klasy IA, IC i III – ajmalina, propafenon, flekainid, sotalol,
amiodaron). Zwykle jednak farmakoterapia jest niewystarczająca i aby przy-
wrócić rytm zatokowy, konieczne jest zastosowanie kardiowersji elektrycz-
nej. Jeśli częstoskurcz przedsionkowy (a szczególnie trzepotanie przedsion-
ków) trwa powyżej 48 godzin, a pacjent nie został uprzednio przygotowany
lekami przeciwkrzepliwymi z grupy pochodnych kumaryny, istnieje uzasad-
nione ryzyko powikłań zakrzepowo-zatorowych. Wreszcie prawdopodobień-
• częstoskurcze z łącza przedsionkowo-komorowego, w których
węzeł P-K jest częścią obwodu pętli re-entry;
• częstoskurcze przedsionkowe, w których arytmia powstaje
w przedsionkach bez udziału łącza P-K.
5
stwo strukturalnej choroby serca jest wyższe w tachyarytmiach przedsionko-
wych niż w częstoskurczach z łącza P-K.
Poniżej przedstawiono podział częstoskurczów nadkomorowych:
Poniżej omówione zostaną najczęstsze rodzaje częstoskurczów nadkomo-
rowych.
Nawrotny częstoskurcz węzłowy, AVNRT (atrio-ventricular
nodal reentrant tachycardia)
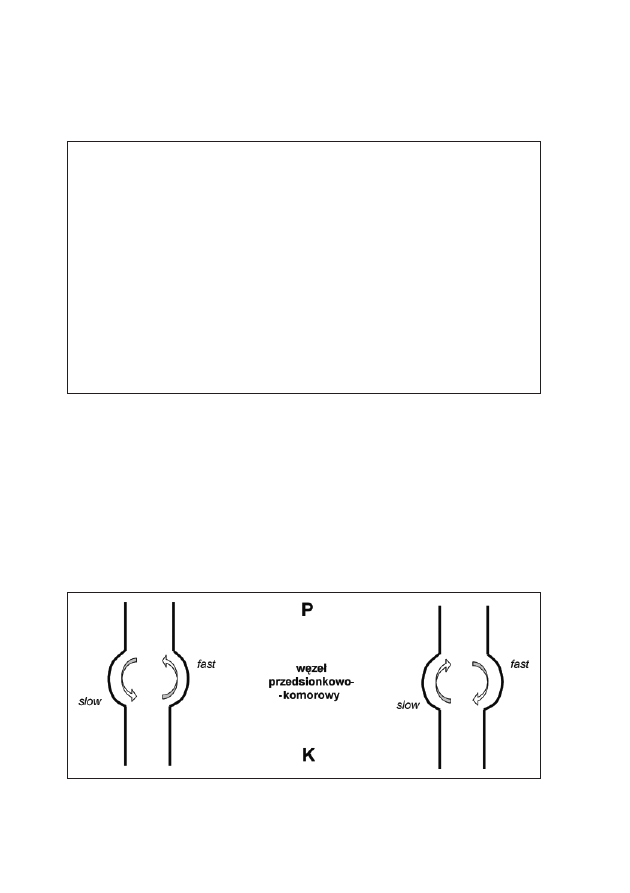
Podłożem tego częstoskurczu jest obecność „szybkiej” – fast i „wolnej”
– slow drogi przewodzenia w obrębie łącza P-K. Częstoskurcz związany jest
z krążeniem fali pobudzenia nawrotnego w obrębie łącza P-K.
Rycina 1: Schemat powstawania nawrotnego częstoskurczu węzłowego
a) postać typowa tzw. slow-fast (90-95% przypadków),
b) postać nietypowa fast-slow
• częstoskurcz z łącza P-K:
– nawrotny częstoskurcz węzłowy (AVNRT);
– nawrotny częstoskurcz P-K w zespole WPW (AVRT);
– węzłowy częstoskurcz ektopowy (JET) – bardzo rzadki,
występuje głównie u dzieci.
• częstoskurcz przedsionkowy:
– trzepotanie przedsionków;
– częstoskurcz przedsionkowy;
– nawrotny częstoskurcz z węzła zatokowego (SNRT);
– przyspieszenie zatokowe.
6

Przedwczesne pobudzenie przedsionkowe przewodzi się do komór drogą
wolną, ponieważ droga szybka pozostaje w okresie refrakcji. Następnie
w wyniku powrotu pobudliwości drogi szybkiej, pobudzenie to wstecznie
przewodzi się do przedsionka i w ten sposób zamyka pętlę re-entry. Jest to
najczęstsza postać SVT, stanowi ponad połowę wszystkich przypadków. Wy-
stępuje głownie u osób bez organicznej choroby serca, bardzo często u ko-
biet. W ogólnej populacji występuje u około 0,2%. Ponieważ komory
i przedsionki ulegają pobudzeniu w tym samym czasie, w zapisie EKG nie
widzimy załamków P, a jedynie zespoły QRS.
Częstoskurcz nawrotny przedsionkowo-komorowy, AVRT
(atrio-ventricular reentrant tachycardia)
Występuje w obecności drogi dodatkowej łączącej przedsionki i komory.
Pobudzenie z przedsionków do komór szerzy się drogą fizjologiczną poprzez
łącze P-K, wraca natomiast drogą dodatkową. W takim przypadku często-
skurcz nazywamy ortodromowym, jest to typowy częstoskurcz przedsionko-
wo-komorowy w zespole WPW. W przypadku, gdy przewodzenie wsteczne
do przedsionka jest wydłużone (wolne przewodzenie K-P w drodze dodat-
kowej), bardzo często częstoskurcz ma charakter utrwalony, jest bardzo
oporny na leczenie i może prowadzić do tachykardiomiopatii.
O częstoskurczu przedsionkowo-komorowym antydromowym mówimy,
gdy pobudzenie z przedsionka do komory przewodzi się drogą dodatkową,
wraca natomiast drogą fizjologiczną. Wówczas szerokość zespołów QRS
przekracza 0,12 s. Jest to częstoskurcz z „szerokimi” zespołami QRS, wyma-
ga różnicowania z częstoskurczem komorowym.
Rycina 2: Ortodromowy nawrotny częstoskurcz P-K
7

Warto także przypomnieć, że częstoskurcze przedsionkowo-komorowe
w zespole preekscytacji mogą być zainicjowane przedwczesnym pobudze-
niem komorowym. W typowym częstoskurczu ortodromowym przedsionko-
wo-komorowym załamki P zwykle pojawiają się tuż za zespołami QRS.
Częstoskurcz przedsionkowy, jednokształtny częstoskurcz przedsionkowy,
PAT (paroxysmal atrial tachycardia)
Ten typ częstoskurczu charakteryzuje się jednorodną morfologią załamków
P. Może on mieć charakter częstoskurczu nawrotnego. Wówczas w obrębie
mięśnia przedsionka prawego lub lewego krąży fala pobudzenia nawrotne-
go. Drugim mechanizmem powstawania PAT jest obecność ogniska ektopo-
wego, które wytwarzając impulsy szybciej niż węzeł zatokowy, narzuca swój
rytm. Jest to związane ze wzmożonym automatyzmem mięśnia przedsionka.
Częstoskurcz przedsionkowy u dzieci i osób młodych może występować
w sercach zdrowych, ale najczęściej jest skutkiem przebytych operacji kar-
diochirurgicznych. U dorosłych ektopowy częstoskurcz przedsionkowy jest
najczęściej spowodowany organiczną chorobą serca i występuje w przebie-
gu zawału serca, choroby wieńcowej, wady serca, przewlekłej choroby płuc,
a także w wyniku działania alkoholu, kokainy czy metyloksantyn.
Szczególną postacią częstoskurczu przedsionkowego jest częstoskurcz
przedsionkowy z blokiem (PAT z blokiem), który występuje w następstwie
zatrucia glikozydami naparstnicy, ale może też pojawić się w przebiegu róż-
nych chorób serca. W zapisie EKG załamki P zwykle występują przed ze-
społami QRS, ale mają inny kształt niż załamki P rytmu zatokowego.
Rycina 3: Ektopowy częstoskurcz przedsionkowy
8
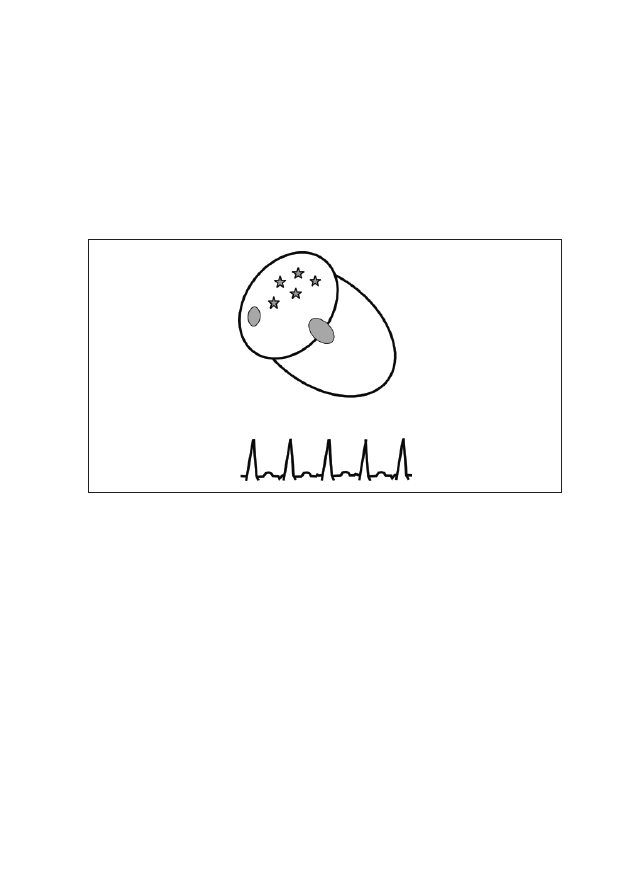
Częstoskurcz przedsionkowy wielokształtny (multifocal atrial tachycardia)
Jest to niemiarowy częstoskurcz przedsionkowy, powstający w co najmniej
3 ogniskach. U podłoża tej arytmii leży patologiczny automatyzm mięśnia
przedsionków lub aktywność wyzwalana. Najczęściej ten rodzaj tachyarytmii
przedsionkowej pojawia się w przebiegu serca płucnego, ciężkiej niewydolno-
ści serca, może też być wynikiem stosowania metyloksantyn lub sympatykomi-
metyków. Rokowanie jest poważne z uwagi na schorzenie podstawowe. W le-
czeniu poleca się stosowanie werapamilu, diltiazemu i beta-adrenolityków.
Nawrotny częstoskurcz zatokowy, SNRT (sinus node reentrant tachycardia)
Źródłem tej arytmii jest mięsień przedsionka leżący w bezpośrednim są-
siedztwie węzła zatokowego lub też sam węzeł zatokowy. Nawrotny często-
skurcz węzłowy odróżnia od przyśpieszenia zatokowego nagły początek i na-
gły koniec arytmii, podczas gdy w przyśpieszeniu zatokowym następuje
stopniowe przyśpieszanie częstości serca i stopniowe zwalnianie. Zwykle
SNRT przebiega z częstością 100-180/min, przerywa go masaż zatoki szyjnej
lub podanie adenozyny. W terapii przewlekłej stosuje się werapamil, diltia-
zem i leki beta-adrenolityczne.
Przyśpieszenie zatokowe (sinus tachycardia)
Przyśpieszenie zatokowe rozpoznajemy, gdy częstość serca w spoczynku
przekracza 100/min, ale zwykle jest poniżej 160/min. Przyczynami tachykar-
dii zatokowej mogą być: gorączka, niedokrwistość, hipowolemia, reakcja
Rycina 4: Chaotyczny częstoskurcz przedsionkowy
9
emocjonalna, ból, nadczynność tarczycy, niewydolność serca. Masaż zatoki
szyjnej lub podanie adenozyny tylko przejściowo zwalniają częstość serca.
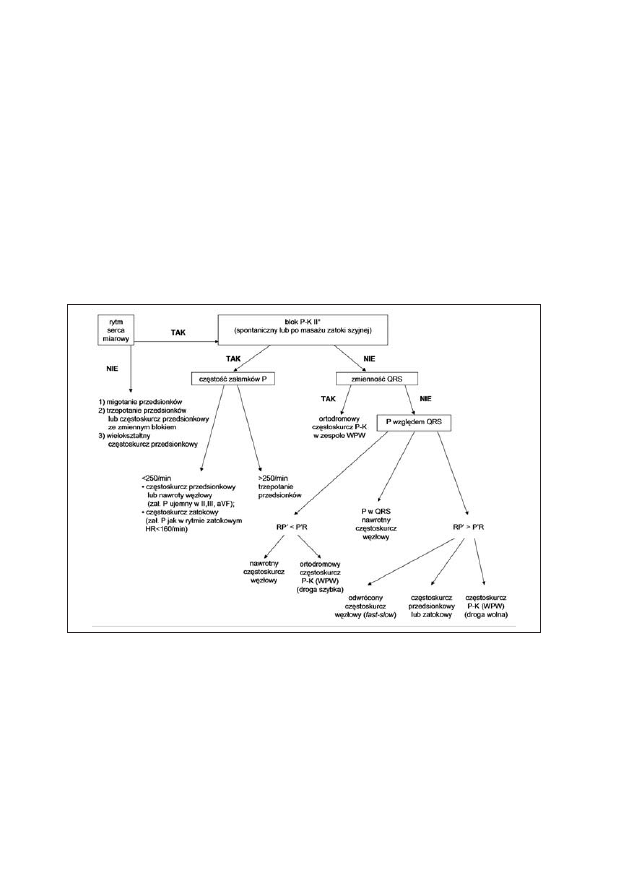
DIAGNOSTYKA
Podstawą rozpoznania częstoskurczu nadkomorowego, a nawet określenia
typu częstoskurczu, jest badanie EKG. Bardzo pomocna w diagnostyce typów
częstoskurczu jest ocena pobudzenia nerwu błędnego na przebieg arytmii
(masaż zatoki szyjnej) oraz wpływ adenozyny. Użyteczną metodą jest badanie
holterowskie, które pozwala zobaczyć początek i koniec częstoskurczu. Innym
bardzo ważnym badaniem w diagnostyce tachyarytmii nadkomorowych jest
badanie elektrofizjologiczne, jak również zapis EKG z elektrody przełykowej.
ROKOWANIE
W przeciwieństwie do komorowych zaburzeń rytmu, w ocenie nadkomoro-
wych arytmii panuje dość powszechna opinia, że mają one łagodny charak-
ter, a prognoza jest dobra. Tym niemniej tachyarytmie nadkomorowe mogą
powodować liczne subiektywne i obiektywne objawy z utratami przytomno-
ści włącznie, zatem w istotny sposób obniżają komfort życia. Mogą także
Rycina 5: Schemat diagnostyki różnicowej tachyarytmii nadkomorowych na podstawie
badania EKG
10

sprzyjać arytmiom komorowym, mogą powodować niedokrwienie mięśnia
sercowego, zatorowość obwodową, a przy długotrwałym utrzymywaniu się
wywoływać kardiomegalię i niewydolność serca. Zatem bezwzględnie wyma-
gają leczenia, jednakże z uwagi na fakt, iż w większości przypadków arytmie
te nie powodują bezpośredniego zagrożenia życia, na plan pierwszy wysuwa
się bezpieczeństwo stosowanej terapii.
LECZENIE
Leczenie tachyarytmii nadkomorowych polega na:
W profilaktyce ważne jest usunięcie czynników usposabiających do wystą-
pienia napadu częstoskurczu, z kolei w wyborze leczenia profilaktycznego
należy uwzględnić rodzaj częstoskurczu, ciężkość objawów klinicznych to-
warzyszących napadowi arytmii, obecność organicznej choroby serca będącej
podłożem arytmii i częstotliwość napadów.
Ogólny schemat postępowania w przypadku SVT:
Leczenie częstoskurczów z łącza przedsionkowo-komorowego
Nawrotny częstoskurcz węzłowy jest najczęstszą postacią SVT. Zatem me-
tody powodujące blok P-K (zwiększenie napięcia nerwu błędnego lub poda-
1. uspokojenie chorego;
2. działania zwiększające napięcie nerwu błędnego
(masaż zatoki szyjnej);
3. adenozyna i.v. 6 mg, 12 mg, 18 mg lub werapamil 5-10-15 mg i.v.;
4. szybki częstoskurcz HR >200/min lub zaburzenia
hemodynamiczne:
• jeśli TAK
– stymulacja antyarytmiczna lub kardiowersja elektryczna,
• jeśli NIE
– leki antyarytmiczne (ajamalina, propafenon, flekainid,
sotalol, amiodaron),
– stymulacja antyarytmiczna, kardiowersja elektryczna.
• przerwaniu napadu i przywróceniu rytmu zatokowego;
• profilaktyce nawrotu arytmii.
11

nie adenozyny/werapamilu) na ogół są bardzo skuteczne i powodują poprzez
przerwanie pętli re-entry przerwanie częstoskurczu i powrót rytmu zatoko-
wego. Podobnie jest w przypadku częstoskurczu przedsionkowo-komorowe-
go w przebiegu zespołu WPW.
Po umiarowieniu zawsze należy wykonać badanie EKG. W przypadku,
gdy stwierdza się cechy preekscytacji, chory powinien być w terminie póź-
niejszym poddany badaniu elektrofizjologicznemu, którego głównym celem
jest wyselekcjonowanie chorych zagrożonych nagłym zgonem. Tacy chorzy
powinni być następnie zakwalifikowani do ablacji prądem RF drogi dodat-
kowej. Jeśli po umiarowieniu częstoskurczu z łącza P-K nie stwierdza się
w kontrolnym EKG cech preekscytacji, to dalsze postępowanie z chorym
zależy od ciężkości i częstotliwości napadów arytmii. Jeśli napady są bar-
dzo częste lub są źle tolerowane, to rozpoczyna się leczenie profilaktyczne
farmakologiczne (werapamil, diltiazem, beta-adrenolityk, ewentualnie leki
antyarytmiczne z grupy I lub III). Jeśli pomimo farmakoterapii nie udaje
się kontrolować arytmii lub też pojawia się działanie proarytmiczne, to wła-
ściwym dalszym sposobem leczenia będzie ablacja prądem RF wolnej dro-
gi przewodzenia w łączu P-K. Większość chorych z częstoskurczem z łącza
P-K może być bezpiecznie i skutecznie leczona w oddziałach pomocy do-
raźnej, z których po umiarowieniu mogą być bezpośrednio wypisani do do-
mu. Diagnostyka, o której była mowa powyżej, może być wykonana w wa-
runkach ambulatoryjnych. Warto także pouczyć chorego, jak może sam sobie
pomóc, tzn. jak przerwać częstoskurcz w domu. Można tego dokonać próbą
Valsalvy, prowokacją wymiotów, spryskiwaniem twarzy zimną wodą. Inną
metodą jest przyjęcie doraźnie doustnie leku antyarytmicznego o sprawdzo-
nej skuteczności, tzw. pocket drug. Wreszcie nie należy zaniedbać korekcji
czynników, które sprzyjają wystąpieniu arytmii (jak choćby korekta zabu-
rzeń elektrolitowych, unikanie nadmiaru alkoholu, kofeiny, przemęczenia
czy niewyspania).
Leczenie częstoskurczów przedsionkowych
Nieco odmiennie wygląda postępowanie z chorymi z częstoskurczami
przedsionkowymi, które bardziej przypomina leczenie napadowego migota-
nia/trzepotania przedsionków. Po pierwsze, zabiegi zwiększające napięcie
nerwu błędnego lub podanie leków zwalniających przewodzenie w węźle P-K
nie prowadzi do umiarowienia, a jedynie przejściowo zwalnia częstość serca.
Wyjątkiem jest SNRT – częstoskurcz ten jest „adenozynowrażliwy”, podob-
nie jak nieliczne przypadki trzepotania przedsionków. Po drugie, farmakote-
rapia jest mniej skuteczna, gdy chodzi o przywracanie rytmu zatokowego.
12

Uważa się, że najbardziej skuteczne są leki antyarytmiczne klasy Ic i klasy
III. Jednak leki z klasy Ic mogą być przeciwwskazane w przypadku współist-
niejącej ciężkiej organicznej choroby serca. Ponadto stosowanie tych leków
niesie za sobą dwa niebezpieczeństwa. Pierwsze z nich to nasilenie stopnia
bloku P-K i znaczne zwolnienie częstości serca, natomiast drugie to para-
doksalne przyśpieszenie rytmu, wynika to ze zwolnienia rytmu przedsionków
do takiej częstości, przy której następuje przewodzenie P-K w stosunku 1:1.
Zatem bardziej skuteczne, a na pewno bardziej bezpieczne będzie wykona-
nie kardiowersji elektrycznej. Po trzecie, w przypadku trzepotania przed-
sionków, o ile arytmia trwa ponad 48-72 godzin, przed umiarowieniem należy
zastosować antykoagulację w celu uniknięcia powikłań zakrzepowo-zatoro-
wych. Natychmiastową kardiowersję elektryczną można zastosować w przy-
padkach ciężkiej dekompensacji hemodynamicznej i najlepiej po wykluczeniu
echokardiografią przezprzełykową obecności skrzeplin w lewym przedsion-
ku. U chorego po kardiowersji powinno się stosować antykoagulację przez
4 tygodnie z powodu „ogłuszenia przedsionków”.
Do leków, które stosuje się w celu kontroli częstości rytmu komór należą
digoksyna, werapamil oraz beta-adrenolityki. Chorzy po umiarowieniu czę-
stoskurczu przedsionkowego także mogą być wypisani z oddziału pomocy
doraźnej do domu. Podobnie, możliwy jest wypis w przypadku braku powro-
tu rytmu zatokowego, ale tylko wówczas, gdy uda się uzyskać zadowalającą
kontrolę częstości rytmu i o ile arytmia jest dobrze tolerowana przez chore-
go. Mimo wszystko taki chory powinien mieć zaplanowaną diagnostykę kar-
diologiczną, a przede wszystkim badanie ECHO serca, pozwoli to bowiem
na ustalenie strategii dalszego postępowania. Jeżeli rozważane jest wykona-
nie w przyszłości kardiowersji, warto włączyć antykoagulację. Hospitalizacji
wymagają wszyscy chorzy, którzy źle tolerują arytmię lub u których współ-
istnieje poważne schorzenie serca (ostry zawał serca, niestabilna choroba
wieńcowa, zdekompensowana niewydolność serca).
Zapamiętaj!
1. Napadowe tachyarytmie nadkomorowe stanowią bardzo zróżnicowaną
grupę zaburzeń rytmu. Zawsze należy dążyć do ustalenia podstawowego ty-
pu częstoskurczu – czy jest to częstoskurcz z łącza P-K, czy też jest to tachy-
arytmia przedsionkowa. Ustalenie tego jest o tyle istotne, gdyż ma to bar-
dzo duży wpływ na strategię postępowania z chorym.
2. Najczęstszym SVT jest nawrotny częstoskurcz węzłowy (AVNRT), stanowi
ponad 50% przypadków, często występuje u osób młodych i bez organicznej
13

choroby serca, łatwo umiarawia się zabiegami zwiększającymi napięcie ner-
wu błędnego lub podaniem adenozyny bądź werapamilu.
3. Podobną sytuację mamy w przypadku częstoskurczu P-K w zespole WPW
(AVRT). Tylko, gdy napady są bardzo częste lub przebiegają z burzliwymi
objawami, wskazane jest leczenie profilaktyczne, które obejmuje m.in. abla-
cję szlaku wolnego w AVNRT lub drogi dodatkowej w zespole WPW.
4. Częstoskurcze przedsionkowe zwykle współistnieją z organiczną chorobą
serca, występują u osób starszych i ich leczenie przypomina postępowanie
w migotaniu/trzepotaniu przedsionków.
5. Osobny problem stanowi częstoskurcz ustawiczny, którego podłożem jest
wolno przewodząca droga dodatkowa i który może prowadzić do tachykar-
diomiopatii. Leczeniem z wyboru jest ablacja drogi dodatkowej.
Warto przeczytać:
Nadkomorowe zaburzenia rytmu. Standardy postępowania w chorobach
układu krążenia PTK. Kard. Pol. 1997, 46 supl. I, 51-63.
G. Opolski: Nadkomorowe zaburzenia rytmu. Medical Science Review, Me-
dical Journal for Continuous Education. Kardiologia 1998: 83-92.
M. Trusz-Gluza: Zaburzenia rytmu serca: Nadkomorowe zaburzenia rytmu
serca oraz Stany zagrożenia życia pochodzenia sercowego: Częstoskurcze. In-
terna t. 1 i 3, W. Januszewicz i F. Kokot (red.), Wyd. Lek. PZWL, Warsza-
wa 2002.
Y. Bashir, N. Lever: Częstoskurcze z wąskimi zespołami QRS. Nagłe sta-
ny w kardiologii, C. Davies i Y. Bashir (red.), Via Medica, Gdańsk 2002:
218-244.
14

II.
MIGOTANIE PRZEDSIONKÓW – OBRAZ KLINICZNY,
ZASADY POSTĘPOWANIA
Joanna Syska-Sumińska, Andrzej Światowiec, Mirosław Dłużniewski
DEFINICJA
„Migotanie przedsionków to arytmia charakteryzująca się całkowicie zdez-
organizowaną depolaryzacją przedsionków, nieprowadzącą do ich efektywnego
hemodynamicznie skurczu. Aktywność elektryczna przedsionków może być wy-
kryta za pomocą elektrokardiografii jako nieregularne wychylenia linii izoelek-
trycznej o małej i zmiennej amplitudzie oraz częstotliwości od 350 do
600/min”.
Douglas P. Zipes, 1992
Migotanie przedsionków należy do najczęściej występujących w populacji
dorosłych arytmii przedsionkowych. Częstość jego występowania wzrasta
wraz z wiekiem, z 0,5% w grupie wiekowej 50-59 lat, do 4% w grupie 60-69
lat, a nawet 9% u osób powyżej 70. roku życia. Odsetek ten jest wyższy wśród
mężczyzn, ale bezwzględna liczba kobiet z migotaniem przedsionków jest
podobna. Arytmia ponad dwukrotnie częściej występuje wśród osób rasy
białej niż czarnej.
Badania epidemiologiczne populacji Framingham wskazują na stały wzrost
występowania migotania przedsionków, zwłaszcza w grupie osób powyżej
75. r.ż., co związane jest zarówno ze spadkiem liczby zgonów z przyczyn ser-
cowo-naczyniowych, jak i wydłużaniem długości życia.
PODZIAŁ MIGOTANIA PRZEDSIONKÓW
Migotanie przedsionków doczekało się wielu podziałów uwzględniających
objawy kliniczne, obraz EKG i czas trwania arytmii. Przydatna klinicznie kla-
syfikacja musi opierać się na odpowiedniej liczbie cech charakterystycznych
oraz uwzględniać implikacje terapeutyczne.
Nowy podział migotania przedsionków (1998 rok) zaproponowany
przez grupę ekspertów wyróżnia migotanie napadowe, przetrwałe i utrwa-
lone.
Napadowe migotanie przedsionków
Jest to nawracająca forma arytmii, ustępująca samoistnie bez stosowania
kardiowersji farmakologicznej czy elektrycznej, trwająca do 48 godzin.
15

Przetrwałe migotanie przedsionków
Jest to postać migotania przedsionków wymagająca zastosowania środków
farmakologicznych bądź kardiowersji elektrycznej, w celu odwrócenia rytmu.
Umiarowienie trwającego ponad 48 godzin migotania przedsionków wyma-
ga wdrożenia leczenia przeciwzakrzepowego.
Utrwalone migotanie przedsionków
Jest to arytmia niepoddająca się kardiowersji bądź nawracająca po kilku mi-
nutach/godzinach od umiarowienia. Terminem tym określa się także przypadki
migotania przedsionków, których z różnych przyczyn nie planujemy umiarawiać.
Istotne znaczenie z praktycznego punktu widzenia ma podział migotania
przedsionków na pierwsze wykryte i kolejne. Od tego uzależniamy decyzję
o wdrożeniu bądź nie przewlekłego leczenia antyarytmicznego. Nadal obo-
wiązuje podział uwzględniający etiologię arytmii, wyróżniający postać samo-
istną migotania przedsionków oraz postać wtórną.
W samoistnym migotaniu przedsionków można wyodrębnić postać zależ-
ną od wzmożonego napięcia nerwu błędnego albo układu sympatycznego.
Cechy migotania przedsionków zależnego od napięcia układu współczulne-
go i przywspółczulnego przedstawiono w tabeli 1.
ETIOLOGIA
Zastawkowe i niezastawkowe choroby serca
Migotanie przedsionków może występować w przebiegu różnorodnych
chorób. Istotnym czynnikiem odpowiedzialnym za arytmogenność komórek
Tabela 1: Cechy migotania przedsionków uzależnione od napięcia układu autonomicznego
UKŁAD WSPÓŁCZULNY
UKŁAD PRZYWSPÓŁCZULNY
• rzadsze napady;
• wyłącznie w ciągu dnia;
• wywołane wysiłkiem
lub stresem;
• towarzyszy im poliuria;
• korzystny wpływ
beta-adrenolityków.
• częściej płeć męska (M:K 4:1);
• wiek 40-50 lat;
• nie przechodzi w utrwalone;
• napady w nocy, w spoczynku,
po posiłku;
• poprzedzone bradykardią;
• beta-adrenolityki zwiększają
ilość napadów.
16

mięśniowych jest powiększenie i rozciągnięcie przedsionka powstałe na sku-
tek wzrostu ciśnienia wewnątrzprzedsionkowego. Takie warunki powstają
najczęściej w obecności organicznych chorób serca. Rozstrzeń przedsionka
pojawia się w niewydolności serca oraz jako konsekwencja wad zastawkowych.
Wady serca stanowią jedną z najczęstszych przyczyn migotania przedsion-
ków. Badania epidemiologiczne potwierdziły, że obecność wady reumatycz-
nej blisko 10-krotnie zwiększa ryzyko przewlekłego migotania przedsionków
u mężczyzn i aż 27-krotnie w populacji kobiet.
Wśród nabytych wad serca zaawansowana niedomykalność mitralna sprzy-
ja występowaniu migotania przedsionków, blisko 75% chorych ma stwier-
dzaną arytmię.
W stenozie mitralnej częstość występowania migotania przedsionków oce-
nia się na ok. 30-40%.
Migotanie przedsionków dotyczy również chorych z rozpoznawanym wy-
padaniem płatka zastawki mitralnej. Ryzyko arytmii zależy od stopnia wypa-
dania oraz towarzyszącej niedomykalności zastawki mitralnej.
Wady zastawki aortalnej rzadziej są przyczyną migotania przedsionków
niż opisywane wyżej wady zastawki mitralnej. Na ogół arytmia dotyczy cho-
rych z zaawansowaną stenozą czy niedomykalnością z objawami niewydol-
ności lewej komory i poważnie obciąża rokowanie.
Wśród wad wrodzonych migotanie przedsionków najczęściej występuje
w ubytku przegrody międzyprzedsionkowej. Stwierdzane jest u 50% chorych
powyżej 40. roku życia.
U blisko 30% chorych poddanych zabiegom kardiochirurgicznym, migo-
tanie przedsionków pojawia się w czasie zabiegu bądź bezpośrednio po nim.
Czynnikami wpływającymi na występowanie zaburzeń rytmu jest stopień za-
awansowania wady, obecność nadciśnienia płucnego oraz wielkość lewego
przedsionka.
Dużą grupę przyczyn różnych postaci migotania przedsionków stanowią obec-
nie niezastawkowe choroby serca. Czynnikami sprzyjającymi powstaniu aryt-
mii jest obok powiększenia jamy lewego przedsionka, przerost lewej komory.
Migotanie przedsionków stwierdza się u pacjentów z nadciśnieniem tęt-
niczym oraz chorobą niedokrwienną serca. Obecność arytmii świadczy wów-
czas o nieprawidłowej funkcji komory, jako konsekwencji przerostu czy nie-
dokrwienia.
Napadowe migotanie przedsionków pojawia się u około 10-20% chorych
z ostrym zawałem mięśnia sercowego. Powikłanie to występuje najczęściej
17

w pierwszych 48 godzinach zawału. Jako przyczynę rozpatruje się przemija-
jące niedokrwienie bądź zawał przedsionka, przeciążenie przedsionków jako
konsekwencję podwyższonego ciśnienia końcoworozkurczowego oraz zapa-
lenie osierdzia. Większość autorów jest zgodna, że migotanie przedsionków
w przebiegu świeżego zawału jest czynnikiem rokowniczo obciążającym, bę-
dącym wyrazem dysfunkcji lewej komory i zastoinowej niewydolności serca.
Migotanie przedsionków skojarzone z zawałem ściany przedniej wiąże się
ze wzrostem śmiertelności.
Zaobserwowano, że u 5-40% pacjentów poddanych zabiegom wszczepienia
pomostów aortalno-wieńcowych występuje migotanie przedsionków, najczęściej
między 24 a 60 godziną po operacji. Czynnikiem predysponującym do wystąpie-
nia napadu arytmii jest wiek chorego, najwyższa zapadalność dotyczy grupy cho-
rych w wieku 65-70 lat. Istotnym czynnikiem zwiększającym ryzyko arytmii jest
zaprzestanie podawania beta-adrenolityków w okresie przedoperacyjnym.
Migotanie przedsionków występuje często u pacjentów z nadciśnieniem
tętniczym, zwłaszcza w sytuacji współistniejącego przerostu mięśnia lewej
komory, powiększenia serca oraz jego niewydolności. Badania epidemiolo-
giczne podkreślają, że nadciśnienie tętnicze obok cukrzycy, przerostu lewej
komory oraz zaburzeń okresu repolaryzacji w zapisie EKG stanowi najistot-
niejszy czynnik ryzyka migotania przedsionków.
Następną w kolejności przyczyną migotania przedsionków są kardiomio-
patie oraz zapalenie mięśnia sercowego.
W kardiomiopatii przerostowej migotanie przedsionków występuje rzad-
ko, na ogół w późnym okresie choroby, powodując pogorszenie obrazu kli-
nicznego i narastanie cech niewydolności serca.
Kardiomiopatia rozstrzeniowa znacznie częściej jest przyczyną występo-
wania migotania przedsionków. Arytmia dotyczy ok. 30% chorych z tym roz-
poznaniem. Czynnikiem sprzyjającym jest wysokie ciśnienie w lewym przed-
sionku, wtórne do podwyższonego ciśnienia końcoworozkurczowego w lewej
komorze. Zwraca uwagę szczególnie częste, u ponad 25% chorych, pojawia-
nie się migotania przedsionków w kardiomiopatii alkoholowej.
Migotanie przedsionków może towarzyszyć zapaleniu mięśnia sercowego
w różnych okresach choroby, zapaleniu wsierdzia oraz osierdzia.
Często pojawia się w przebiegu serca płucnego, a w formie napadowej
w zatorowości płucnej.
W grupie przyczyn napadowego migotania przedsionków należy wymie-
nić zespół preekscytacji WPW (20% chorych), a także chorobę węzła zato-
kowego i zespół tachykardia-bradykardia.
18

POZASERCOWE PRZYCZYNY MIGOTANIA PRZEDSIONKÓW
Wśród wielu czynników mogących wyzwolić migotanie przedsionków wy-
mienia się zaburzenia jonowe i metaboliczne, takie jak:
Jedną z najczęstszych przyczyn pozasercowych migotania przedsionków
jest nadczynność tarczycy. W przebiegu hipertyreozy arytmia pojawia się
w formie napadowej u ok. 20% chorych, szczególnie po 40 r.ż. Czynnikami
predysponującymi są wzrost pobudliwości przedsionków, przyspieszenie
czynności serca na skutek aktywacji adrenergicznej, ponadto nasilony efekt
metaboliczny w samym mięśniu sercowym wynikający z toksycznego wpły-
wu nadmiaru hormonów tarczycowych.
Migotanie przedsionków, zastoinową niewydolność krążenia oraz niewydol-
ność wieńcową w przebiegu nadczynności tarczycy określa się nazwą zespołu
tarczycowo-sercowego.
SAMOISTNE MIGOTANIE PRZEDSIONKÓW
Migotanie przedsionków zarówno w formie napadowej, jak i przewle-
kłej, może wystąpić u osób klinicznie zdrowych. Taką postać migotania
przedsionków nazywamy samotnym, odosobnionym lub samoistnym.
Częstość występowania tej postaci arytmii szacuje się na ok. 30%. Część
autorów podkreśla rolę nadużywania alkoholu jako czynnika etiologicz-
nego samoistnego migotania przedsionków. Do wyraźnego zwiększenia
ilości przypadków dochodzi w okresie weekendowym, co można kojarzyć
z częstszym spożywaniem alkoholu w tym okresie – stąd także angloję-
zyczne określenie tego migotania przedsionków jako holiday heart syn-
drome.
• hipokaliemia;
• hipokalcemia;
• hipomagnezemia;
• hipoglikemia;
• hipotermia;
• hipoksja;
• schorzenia infekcyjne.
19
KONSEKWENCJE KLINICZNE MIGOTANIA PRZEDSIONKÓW
Chorobowość związana z migotaniem przedsionków związana jest z nie-
korzystnymi skutkami szybkiej czynności komór, braku skurczu przedsion-
ków i powstawania w nich skrzeplin. Długo utrzymująca się przyspieszona
czynność komór może stać się przyczyną rozwoju tachykardiomiopatii, spad-
ku ciśnienia tętniczego krwi, objawów zastoju w krążeniu płucnym, a także
niedokrwienia mięśnia sercowego, ze względu na wzrost zapotrzebowania
energetycznego.
Brak mechanicznego skurczu przedsionka prowadzi do zmniejszenia po-
jemności minutowej o blisko 20%, nasilenia zastoinowej niewydolności ser-
ca oraz zmniejszenia tolerancji wysiłku.
Napady migotania przedsionków pogarszają jakość życia u 2/3 pacjentów.
Migotaniu przedsionków towarzyszą nie tylko zaburzenia elektrofizjolo-
giczne i hemodynamiczne, ale również neurohormonalne. Aktywacja układu
adrenergicznego ze wzrostem uwalniania katecholamin jest pierwszą odpo-
wiedzią na spadek rzutu serca. Następnie, na skutek centralizacji krążenia
kosztem ukrwienia nerek, dochodzi do pobudzenia układu renina-angioten-
syna-aldosteron i stymulacji wydzielania wazopresyny. Już w pierwszych mi-
Tabela 2: Przyczyny migotania przedsionków
WADY SERCA
NIEZASTAWKOWE
CHOROBY SERCA
PRZYCZYNY
POZASERCOWE
SAMOISTNE
MIGOTANIE
PRZEDSIONKÓW
• niedomykalność
mitralna;
• stenoza mitralna;
• stenoza aortalna;
• niedomykalność
aortalna;
• stenoza trójdzielna;
• niedomykalność
trójdzielna;
• ubytek przegrody
międzyprzedsionkowej
• operacje wad
zastawkowych;
• wypadanie płatka
zastawki mitralnej.
• choroba
niedokrwienna
serca;
• ostry zawał serca;
• CABG;
• nadciśnienie
tętnicze;
• kardiomiopatia
przerostowa;
• kardiomiopatia
rozstrzeniowa;
• zapalenie mięśnia
sercowego;
• IZW;
• serce płucne;
• WPW;
• choroba
węzła zatokowo-
-przedsionkowego.
• nadczynność
tarczycy;
• zator tętnicy
płucnej;
• hipoglikemia,
hipotermia,
hipoksja;
• zaburzenia
gospodarki
elektrolitowej;
• czynniki
infekcyjne;
• czynniki
toksyczne i leki.
• nadużycie
alkoholu;
• stres;
• znaczny wysiłek
fizyczny.
20

nutach migotania przedsionków, na skutek przeciążenia objętościowego
przedsionków i spadku rzutu serca, uwalniane są peptydy natriuretyczne.
One odpowiadają za nasilenie diurezy i natriurezy. Aktywacja neurohormo-
nalna stanowi mechanizm obronny i kompensujący zaburzenia hemodyna-
miczne.
RYZYKO POWIKŁAŃ ZATOROWYCH
Najgroźniejszym powikłaniem migotania przedsionków jest udar mózgu
w mechanizmie zakrzepowo-zatorowym. Upośledzenie czynności skurczo-
wej oraz rozstrzeń przedsionków powodują powstawanie skrzeplin najczę-
ściej w lewym przedsionku, a szczególnie w uszku lewego przedsionka, któ-
re stanowią materiał zatorowy.
Migotanie przedsionków jest odpowiedzialne za około 15% wszystkich
udarów.
Roczne ryzyko udaru mózgu w migotaniu przedsionków jest zależne od
wieku i jak wynika z badań Framingham rośnie z 1,5% w grupie wiekowej
50-59 lat, do 23,5% w grupie wiekowej 80-89 lat. Nawet przy braku ewident-
nych objawów udaru, migotanie przedsionków prowadzi do deficytów po-
znawczych w przebiegu niemych klinicznie zawałów lakunarnych i korowych.
Analiza wielu prób klinicznych wyodrębniła niezależne czynniki progno-
styczne większego ryzyka udaru u pacjentów z migotaniem przedsionków.
Należą do nich:
Obecność jednego z wymienionych powyżej czynników powoduje, że ryzy-
ko powikłań zatorowych wzrasta do 4%/rok.
Identyfikacja tzw. krwi echogennej w lewym przedsionku za pomocą echo-
kardiografii przezprzełykowej wskazuje na 2-4-krotnie zwiększone ryzyko
udaru mózgu.
Ryzyko powikłań zakrzepowo-zatorowych w migotaniu przedsionków
w porównaniu z populacją bez arytmii wzrasta 5-krotnie, w przypadku współ-
• zaawansowany wiek pacjenta >65 r.ż.;
• nadciśnienie tętnicze;
• cukrzyca;
• przebyty incydent przemijającego niedokrwienia OUN;
• przebyty udar mózgu;
• niewydolność serca.
21

istnienia reumatycznej wady serca nawet 17-krotnie. Z każdym rokiem trwa-
nia migotania przedsionków ryzyko zwiększa się o 5-7%. Dane te wskazują
na konieczność wdrożenia leczenia przeciwzakrzepowego u każdego chore-
go z migotaniem przedsionków, jeżeli nie występują przeciwwskazania do
takiego leczenia.
Optymalne wartości INR podczas leczenia przeciwzakrzepowego powinny
utrzymywać się w granicach 2,0-3,0. Zmniejszenie wskaźnika INR z 2,0 do
1,7 powoduje dwukrotny wzrost ryzyka incydentów naczyniowo-mózgowych.
Wartości INR przekraczające 4,0 zwiększają ryzyko krwawień, zwłaszcza
u osób starszych powyżej 75 r.ż.
Decyzja o wdrożeniu leczenia przeciwzakrzepowego powinna opierać się
na dokładnej analizie rodzaju arytmii. Pomocnym w praktyce klinicznej mo-
że być następujący algorytm:
UTRWALONE MIGOTANIE PRZEDSIONKÓW
Przewlekła ANTYKOAGULACJA (INR 2,0-3,0)
W sytuacji istniejących przeciwwskazań do przewlekłego leczenia
przeciwzakrzepowego należy włączyć leczenie kwasem
acetylosalicylowym w dawce 150-325 mg.
PRZETRWAŁE MIGOTANIE PRZEDSIONKÓW
ANTYKOAGULACJA (INR 2,0-3,0)
4 tygodnie przed i 4 tygodnie po umiarowieniu. Od tej zasady
można odstąpić, jeżeli napad migotania przedsionków trwa poniżej
48 godzin lub za pomocą echokardiografii przezprzełykowej
wykluczymy obecność tzw. krwi echogennej lub skrzepliny w lewym
przedsionku. Wówczas podajemy heparynę drobnocząsteczkową
w jednorazowej pełnej dawce 1,0 mg/kg m.c.
NAPADOWE MIGOTANIE PRZEDSIONKÓW
• napady występujące rzadko, nieobecne czynniki ryzyka powikłań
zatorowych
– KWAS ACETYLOSALICYLOWY 150-325 mg;
• napady częste i obecny przynajmniej jeden czynnik ryzyka
– ANTYKOAGULANTY (INR 2,0-3,0).
22

Niezwykle ważnym elementem terapii oprócz przywrócenia rytmu zatoko-
wego jest zapobieganie nawrotom arytmii, a przynajmniej zmniejszenie czę-
stości napadów i czasu ich trwania.
W sytuacji przetrwałego migotania przedsionków istnieją dwie drogi po-
stępowania. Pierwsza to przywrócenie i utrzymanie rytmu zatokowego, dru-
ga zaś to pozostawienie migotania przedsionków i właściwa kontrola rytmu
komór. Decyzję podejmuje lekarz, analizując pełen obraz kliniczny, biorąc
pod uwagę zarówno zmiany morfologiczne w mięśniu sercowym, jak i współ-
istniejące schorzenia. Próbę odwrócenia rytmu należy podjąć w sytuacji
trwałego wyeliminowania przyczyny, np.: operacja wady serca, wyleczenie
nadczynności tarczycy itp.
Natomiast w sytuacji wieloletniego migotania przedsionków bądź często
nawracających epizodów arytmii, biorąc pod uwagę ryzyko proarytmii pod-
czas mało skutecznej terapii antyarytmicznej, wielokrotnie decydujemy o po-
zostawieniu migotania, a koncentrujemy się jedynie na kontroli rytmu ko-
mór. Ostatnio opublikowane wyniki badania AFFIRM (Atrial Fibrilation
Follow-Up Investigation of Rhythm Management) oraz polskiego badania
HOT-CAFE wskazują na taką samą skuteczność obu strategii, z tendencją
do większej przeżywalności pacjentów w grupie kontroli częstości komór po-
łączonej z leczeniem przeciwzakrzepowym w porównaniu z grupą agresyw-
nie leczoną antyarytmicznie w celu utrzymania rytmu zatokowego. Wybór
sposobu terapii niejednokrotnie jest trudny, a ostatnio opublikowane stan-
dardy postępowania Europejskiego i Amerykańskich Towarzystw Kardiolo-
gicznych stanowią próbę usystematyzowania wiedzy dotyczącej postępowa-
nia z chorym z migotaniem przedsionków, ale nie wyjaśniają wszystkich
wątpliwości.
FARMAKOTERAPIA – JAK WYBRAĆ SKUTECZNY LEK?
Elektrofizjologicznym podłożem migotania przedsionków jest zjawisko re-
-entry, a cechą charakterystyczną jest obecność wielu krążących fal nawrot-
nych typu micro-re-entry w obu przedsionkach oraz skrócenie i rozproszenie
okresów refrakcji komórek.
CELE PRZYWRACANIA RYTMU ZATOKOWEGO
• eliminacja objawów klinicznych towarzyszących arytmii;
• zapobieganie powikłaniom zatorowym;
• zapobieganie niekorzystnej przebudowie mięśnia sercowego.
23

Skuteczny lek powinien wobec tego wydłużać okres refrakcji komórek
przedsionków.
Wśród leków antyarytmicznych mających zastosowanie w przerywaniu na-
padu migotania przedsionków należy wymienić:
Znaczenie beta-adrenolityków (klasa II) oraz glikozydów naparstnicy
w przerywaniu napadów arytmii jest znacznie mniejsze. Stanowią one pod-
stawę terapii służącej kontroli rytmu komór w utrwalonym migotaniu przed-
sionków.
Skuteczność kardiowersji farmakologicznej oceniana jest na ok. 45-90%.
Jak wybrać skuteczny lek?
• Ustalić, czy napad jest prowokowany przez pobudzenie nerwu błędne-
go, czy układu adrenergicznego:
wzmożone napięcie układu adrenergicznego
zastosuj:
1. beta-adrenolityk;
2. propafenon (j.w.);
3. amiodaron (j.w.).
wzmożone napięcie nerwu błędnego
zastosuj:
1. ajmalina (25-75 mg i.v.);
2. antazolina (100-300 mg i.v.);
3. chinidyna (200 mg do łącznej dawki 1,6-2,0 g;
4. amiodaron (150-300 mg i.v.);
5. propafenon (2 mg/kg i.v., lub 450-600 mg p.o.).
• chinidyna, ajmalina – klasa Ia;
• propafenon, flekainid – klasa Ic;
• amiodaron, sotalol – klasa III.
24

• kluczem do wyboru odpowiedniego leku jest określenie stopnia uszko-
dzenia lewej komory:
• napad migotania przedsionków u chorego z zespołem preekscytacji
(WPW):
Kolejnym ważnym zagadnieniem wymagającym omówienia jest postępo-
wanie po przywróceniu rytmu zatokowego, zapobiegające nawrotowi aryt-
mii. Otóż badania porównujące skuteczność profilaktyki antyarytmicznej
i placebo przez okres roku oceniają wartość pierwszej na 30-80%, drugiej
na 25%. Jeżeli napady migotania przedsionków występują rzadko 2-3 razy
na rok, bilans korzyści i strat (efekt proarytmii podczas stosowania leków
antyarytmicznych) przemawia przeciwko przewlekłemu leczeniu antyaryt-
micznemu. Wówczas najbardziej optymalne pozostaje leczenie interwencyj-
ne napadu arytmii. W sytuacji częstych nawrotów arytmii musimy rozważyć
wdrożenie przewlekłego leczenia antyarytmicznego oraz przeciwkrzepli-
wego.
• leki pierwszego rzutu:
– ajmalina,
– amiodaron,
– sotalol.
• leki bezwzględnie przeciwwskazane:
– digoksyna,
– werapamil.
• chory bez choroby serca:
– propafenon,
– ajmalina,
– antazolina;
• chory z dysfunkcją lewej komory:
– amiodaron,
– chinidyna,
– glikozydy naparstnicy.
25
O wyborze leku do przewlekłego stosowania w profilaktyce nawrotu aryt-
mii powinna decydować choroba podstawowa serca oraz stopień upośledze-
nia funkcji lewej komory. Pomocnym przy wyborze leku może okazać się po-
niższe zestawienie oparte na współczesnych badaniach klinicznych (tab. 3).
KONTROLA CZĘSTOŚCI RYTMU W UTRWALONYM
MIGOTANIU PRZEDSIONKÓW
Do najczęściej stosowanych leków służących kontroli częstości rytmu ko-
mór w utrwalonym migotaniu przedsionków należą glikozydy naparstnicy,
beta-adrenolityki i antagoniści kanałów wapniowych z grupy pochodnych
niedyhydropirydynowych, czyli werapamil i diltiazem.
Wybór leku uzależniony jest od choroby podstawowej oraz stopnia uszko-
dzenia mięśnia lewej komory, podobnie jak w przypadku profilaktyki nawro-
tu arytmii (tab. 4).
Tabela 4: Wybór leku do kontroli częstości rytmu
Tabela 3: Zasady wyboru leku w profilaktyce nawrotów migotania przedsionków
bez choroby serca
• antagonista kanałów wapniowych
lub beta-adrenolityk;
nadciśnienie tętnicze
• antagonista kanałów wapniowych
lub beta-adrenolityk;
choroba niedokrwienna serca
• beta-adrenolityk
antagonista kanałów wapniowych;
niewydolność serca
• glikozydy naparstnicy
lub/i beta-adrenolityk lub/i amiodaron;
Bez choroby
serca
ChNS
Przerost lewej
komory
Dysfunkcja lewej
komory
Leki z wyboru
• beta-
-adrenolityki;
• propafenon.
• beta-
adrenolityki;
• sotalol.
• propafenon;
• beta-
-adrenolityki;
• werapamil.
• amiodaron;
• glikozydy
naparstnicy.
Leki II rzutu
• ajmalina;
• chinidyna.
• amiodaron.
• chinidyna;
• ajmalina;
• amiodaron.
Leki
przeciwwskazane
• grupa Ic.
• grupa Ic.
26
KARDIOWERSJA ELEKTRYCZNA
Kardiowersja elektryczna jest bezpieczną i skuteczną metodą przywraca-
nia rytmu zatokowego u pacjentów z migotaniem przedsionków. Idea terapii
prądem elektrycznym polega na przywróceniu homogenności elektrycznej
serca za pomocą impulsu prądu o ustalonej energii zsynchronizowanego
z załamkiem R zespołu QRS. Dochodzi wówczas do przerwania krążących
fal nawrotnych, a wiodącą rolę przejmuje rozrusznik zatokowy. W każdym
przypadku przed zastosowaniem kardiowersji należy skontrolować poziom
elektrolitów we krwi i wyrównać niedobory. Należy sprawdzić wartość INR
(zalecana 2,0-3,0), zwolnieni z obowiązku leczenia przeciwzakrzepowego są
pacjenci z udokumentowanym czasem trwania arytmii poniżej 48 godzin.
Zabieg wykonujemy w krótkotrwałej anestezji. Najczęściej stosowanym pre-
paratem usypiającym jest etomidat w dawce 0,15-0,3 mg/kg i.v.
Wskazania do zabiegu kardiowersji elektrycznej dzielimy na nagłe i pla-
nowe.
Planowy zabieg kardiowersji elektrycznej wykonujemy u pacjentów z prze-
trwałym migotaniem przedsionków, nie leczonych farmakologicznie bądź le-
czonych nieskutecznie po odpowiednim przygotowaniu przeciwkrzepliwym.
Kandydatami do tej formy terapii są pacjenci:
WSKAZANIA NAGŁE
• objawy małego rzutu;
• objawowa hipotonia;
• obrzęk płuc;
• wstrząs kardiogenny;
• ostra niewydolność wieńcowa;
• zaburzenia przepływu mózgowego.
kardiomiopatia przerostowa
• beta-adrenolityk lub antagonista
kanałów wapniowych lub amiodaron;
przewlekła choroba
oskrzelowo-płucna
• antagonista kanałów wapniowych
i/lub glikozydy naparstnicy;
miażdżyca zarostowa tętnic
obwodowych
• antagonista kanałów wapniowych
i/lub glikozydy naparstnicy.
27

Kardiowersja elektryczna może być bezpiecznie wykonywana u kobiet
w ciąży.
Jedynym bezwzględnym przeciwwskazaniem do wykonania zabiegu kar-
diowersji elektrycznej jest zatrucie preparatami glikozydów naparstnicy.
Alternatywną formą leczenia prądem elektrycznym jest wykorzystanie
elektrody przezprzełykowej. Używamy wówczas istotnie mniejszych warto-
ści energii elektrycznej do przywracania rytmu zatokowego.
Wykorzystywane są również inne metody leczenia migotania przedsion-
ków, których omawianie przekracza ramy tego opracowania. Należą do nich
przezskórna ablacja prądem stałym, prądem o częstotliwości radiowej, odpo-
wiednie rodzaje stymulacji, a także chirurgiczne leczenie arytmii.
Zapamiętaj!
1. Migotanie przedsionków jest najczęstszą arytmią przedsionkową.
2. Wyróżniamy migotanie napadowe, przetrwałe i utrwalone.
3. Najczęstsze przyczyny migotania przedsionków:
• wada serca – niedomykalność mitralna,
• niezastawkowa choroba serca – nadciśnienie tętnicze,
• pozasercowa – nadczynność tarczycy.
4. Najgroźniejszym powikłaniem migotania przedsionków jest udar mózgu.
5. Przetrwałe migotanie przedsionków jest wskazaniem do leczenia przeciwza-
krzepowego.
6. Glikozydy naparstnicy i werapamil są przeciwwskazane w leczeniu napa-
du migotania przedsionków w zespole WPW.
7. Kardiowersja elektryczna jest bezpieczną i skuteczna metodą przywracania
rytmu zatokowego, również u kobiet w ciąży.
8. Zatrucie glikozydami naparstnicy jest przeciwwskazaniem do wykonania
kardiowersji elektrycznej.
WSKAZANIA PLANOWE
• po usunięciu bezpośredniej przyczyny arytmii (operacja wady,
wyleczenie nadczynności tarczycy);
• po przebytych incydentach zatorowych;
• z arytmią trwającą nie dłużej niż 24 miesiące.
28

Warto przeczytać:
Wytyczne ACC/AHA/ESC dotyczące leczenia chorych z migotaniem przed-
sionków – Biblioteka „Kardiologii Polskiej” 2003.
Migotanie przedsionków, G. Opolski i A. Torbicki (red.), Wydawnictwo Me-
dyczne Urban & Partner, Wrocław 2000.
29

III.
ZESPÓŁ WPW
Włodzimierz Mojkowski, Michał Moszczeński, Mirosław Dłużniewski
W 1930 roku Wolff, Parkinson i White zaobserwowali zwiększoną ilość napa-
dów kołatań serca w grupie 11 młodych pacjentów, u których występowały:
krótki czas PQ oraz aberracje zespołu QRS. Zjawiska tego nie łączono z obec-
nością dodatkowych szlaków przewodzenia, choć o ich istnieniu już wiedziano.
Zidentyfikował je pod koniec XIX stulecia Kent, ale uznał je za część układu
bodźcoprzewodzącego. W połowie lat trzydziestych ubiegłego wieku wypraco-
wano model preekscytacji komór oraz obiegu częstoskurczu z wykorzystaniem
dodatkowej drogi przewodzenia. W 1945 roku Rosenbaum wprowadził podział
zespołu WPW na 2 typy w zależności od zmian elektrokardiograficznych ob-
serwowanych w odprowadzeniach przedsercowych: typ A – bliższy obrazowi
bloku prawej odnogi pęczka Hisa oraz B – bliższy obrazowi bloku odnogi le-
wej. W latach 70. rozpoczęto wykonywanie badań elektrofizjologicznych, co
pozwoliło na zrozumienie mechanizmów tachykardii, a także z czasem na loka-
lizację szlaków arytmogennych. Przełomowym momentem w leczeniu zespołu
WPW stanowiło wprowadzenie w latach 80. metody operacyjnego przecięcia
drogi dodatkowej za pomocą krioablacji (zamrażania). Wykonywane w trakcie
tych zabiegów mappingi epikardialne przyczyniły się do dalszego skorelowania
obrazu EKG z lokalizacją dodatkowej drogi przewodzenia, umożliwiając
w miarę precyzyjne określenie jednego z 4 obszarów jej występowania, na pod-
stawie standardowego EKG. Jednakże operacje kardiochirurgiczne były zbyt
inwazyjne, by mogły być stosowane na szeroką skalę. Kolejnym kamieniem mi-
lowym na drodze „walki” z omawianą anomalią było zastosowanie w drugiej
połowie lat 80. prądu wysokiej częstotliwości (radiowej), dostarczanego po-
przez elektrodę endokawitarną w celu ablacji dróg dodatkowych za pomocą
efektu termicznego. Pozwoliło to na zwiększenie liczby zabiegów i wysoką sku-
teczność przy minimalnej ilości powikłań czy niepowodzeń.
PODSTAWY ANATOMICZNE I ELEKTROKARDIOGRAFICZNE
Anatomiczną nieprawidłowością, stanowiącą substrat arytmii, jest obecność
dodatkowego połączenia przedsionków i komór włóknami mięśniowymi zwa-
ne dodatkową drogą przewodzenia. Jest to anomalia wrodzona, nie dzie-
dziczna. W ogromnej większości istnieje jedna droga dodatkowa, rzadziej wy-
stępują dwie lub więcej. Drogi te przeważnie łączą wolne ściany komór
i przedsionków, mogą występować w przegrodzie, a także wnikać lub częścio-
wo omijać prawidłowe struktury układu bodźcoprzewodzącego. Czynnościo-
wo najczęściej przewodzą impuls w obu kierunkach, bez dekrementu, czyli
zależnego od częstości opóźnienia (jak to ma miejsce w łączu przedsionko-
wo-komorowym). Przewodzenie w nich odbywa się więc na zasadzie: „wszyst-
30
ko albo nic” i może osiągać wysokie częstości (powyżej 200/min). Jeśli droga
dodatkowa przewodzi tylko wstecznie, tj. od komory do przedsionka, to taki
stan nazywa się utajonym zespołem WPW, gdyż przewodzenie przedsionko-
wo-komorowe zawsze odbywa się strukturami prawidłowymi i w EKG nigdy
nie występują typowe cechy preekscytacji komór. Do tych ostatnich należą:
krótki czas PQ, szeroki zespół QRS z charakterystyczną falą delta, zmiany
załamka T, wtórne do asynchronicznego przebiegu depolaryzacji. Trzeba pod-
kreślić wybitnie czynnościowy charakter omawianych zmian, co sprawia, że
tylko 18% osób z zespołem WPW ma permanentne cechy preekscytacji
w EKG, u pozostałej części są one przemijające. Mechanizm powstawania
tych zmian, czyli preekscytacji komór oraz zasady rozpoznania położenia dro-
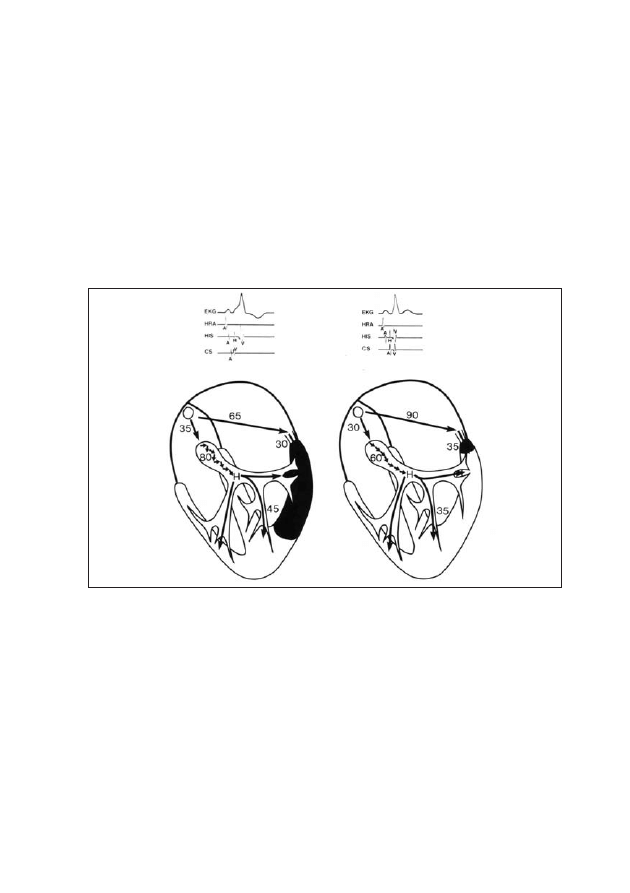
gi dodatkowej na podstawie analizy krzywej EKG przedstawia rycina 1.
Rycina 1: Schematyczne przedstawienie czynników wpływających na powstanie objawów
preekscytacji komór u pacjenta z zespołem WPW (z lewostronną drogą dodatkową)
podczas rytmu zatokowego. Górna część zawiera elektrokardiogramy:
1. EKG - z powierzchni ciała oraz wewnątrzsercowe: 2. HRA - z prawego
przedsionka, 3. HIS - z okolicy pęczka Hisa, 4. CS - z zatoki wieńcowej.
Strona lewa: Czas przewodzenia z węzła zatokowego do komór przez prawidłowe struktury
zajmuje 160 ms (35 ms do węzła przedsionkowo-komorowego (p-k), 80 ms w węźle p-k, oraz
45 ms w systemie His-Purkinje). Natomiast czas potrzebny do osiągnięcia drogi dodatkowej
wynosi 65 ms, a przewodzenie nią do komór 30 ms, co daje łącznie 95 ms. W ten sposób komory
aktywowane są o 65 ms wcześniej i w EKG obserwuje się charakterystyczne cechy preekscytacji
(fala delta).
Strona prawa: W tym przypadku czas przewodzenia z węzła zatokowego do drogi dodatkowej
jest dłuższy (90 ms), jak również przewodzenie tą drogą (35 ms), przy nieco skróconych czasach
przewodzenia w normalnych strukturach wynoszących łącznie 125 ms. W rezultacie czasy te
wyrównują się (125 ms) i zjawisko preekscytacji praktycznie nie występuje. Zespół QRS
pozostaje niezmieniony (wąski).
31
Rycina 3: Mapping epikardialny - pasek z kilkunastoma (16-25) elektrodami
dwubiegunowymi umieszczony dookoła rowka przedsionkowo-komorowego
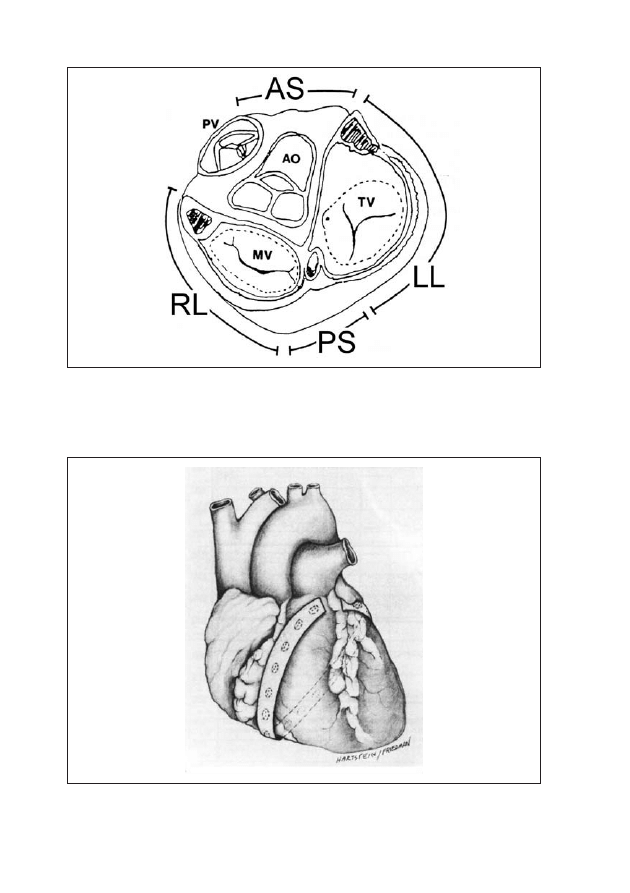
Rycina 2: Schematyczny przekrój serca na poziomie pierścieni zastawek. Lokalizacja rejonów
występowania dróg dodatkowych (możliwych do wyodrębnienia na podstawie EKG)
Skróty: AS - okolica przednioprzegrodowa, LL - okolica lewostronna boczna, PS - okolica
tylnoprzegrodowa, RL - okolica prawostronna boczna.
32
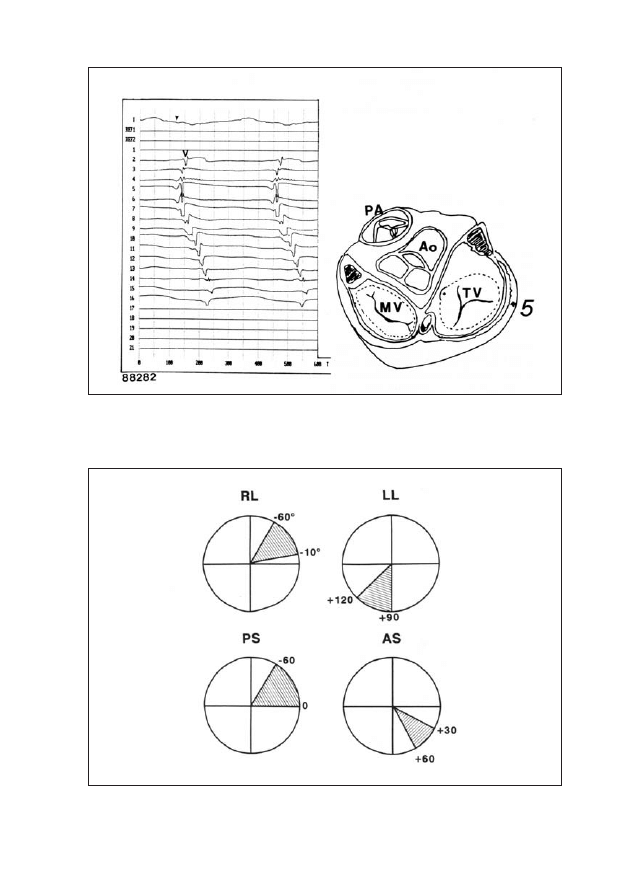
Rycina 5: Odchylenie osi zespołu QRS dla poszczególnych lokalizacji drogi dodatkowej
(oznaczenia jak w poprzednich rycinach)
Rycina 4: Jednoczasowy zapis z elektrod z ryciny 3. Miejsce najwcześniejszej aktywacji komór
w trakcie preekscytacji znajduje się w okolicy elektrody numer 5 - droga
prawostronna boczna
33

Rycina 6: Preekscytacja spowodowana drogą przednioprzegrodową. Fala delta jest dodatnia
w I, II, III, aVL, aVF i w V1. Oś zespołu QRS = 60°
Skróty: Jak w poprzednich rycinach oraz
i - zwrot fali delta izoelektryczny,
(+) - zwrot fali delta dodatni,
(-) - zwrot fali delta ujemny.
Tabela 1: Zwrot fali delta w różnych położeniach drogi dodatkowej
Odprowadzenie
LL
PS
RL
AS
I
-i
+
+
+
II
+
-i+
+
+
III
+
-
+i-
+
AVL
-
+
+
+
AVF
+
-
+
+
V1
+
+-i
-i
-
V2
+
+
-i
-
V6
-i+
i-+
+
+
34
Rycina 8: Elektrokardiogram w przypadku drogi lewostronnej bocznej. Fala delta negatywna
w I, aVL, pozytywna w II, III, aVF i V1. Cechy bloku odnogi prawej
w odprowadzeniach przedsercowych. Oś zespołów QRS = +120°
Rycina 7: Przykład EKG z drogą dodatkową tylnoprzegrodową. Fala delta negatywna w II,
III i aVF. Oś zespołu QRS = -60°
35

OBJAWY KLINICZNE
Podstawową dolegliwością osób posiadających dodatkową drogę przewo-
dzenia są napadowe tachykardie o częstości 160-220/min. Przejawiają się jako
kołatania serca. Mogą towarzyszyć im zasłabnięcia, zawroty głowy. Przeważ-
nie występują one w mechanizmie fali nawrotnej (re-entry), o ortodromalnym
lub antydromalnym obiegu. Częstotliwość występowania, szybkość arytmii,
zależy od wielu czynników, takich jak okres refrakcji czy czas przewodzenia
poszczególnych elementów uczestniczących w propagacji pobudzenia. Nie
bez znaczenia jest także stan napięcia układu autonomicznego. Ponieważ
większość ataków ma miejsce u ludzi młodych, są one na ogół dobrze tolero-
wane hemodynamicznie. Napadowy charakter schorzenia o trudnym do
sprecyzowania momencie wystąpienia arytmii zmniejsza komfort życia, mo-
że stać się powodem rozwoju nerwic, ogranicza możliwości zawodowe. Ze-
spół ten może także przebiegać całkowicie bezobjawowo.
Szczególne zagrożenie dla osób z zespołem WPW stanowi napad migota-
nia przedsionków, gdyż w przypadku obecności drogi dodatkowej o szybkim
przewodzeniu częstość komór może dochodzić do 300/min z konsekwencja-
mi hemodynamicznymi (zasłabnięcie), jak i elektrycznymi (degeneracja do
trzepotania/migotania komór) prowadzącymi do nagłego zgonu.
Trzecim rodzajem arytmii występującym w zespole WPW mogą być
tzw. częstoskurcze ustawiczne, długotrwałe, o niezbyt dużej częstości, np.
120-130/min, występujące u osób z wolno przewodzącą wstecznie drogą do-
datkową (tzn. wolniej od łącza przedsionkowo-komorowego). Stan ten mo-
Rycina 9: EKG u pacjenta z prawostronną boczną drogą dodatkową. Fala delta pozytywna
w I, aVL, negatywna w III, aVF i w V1. Oś zespołów QRS = -10°
36
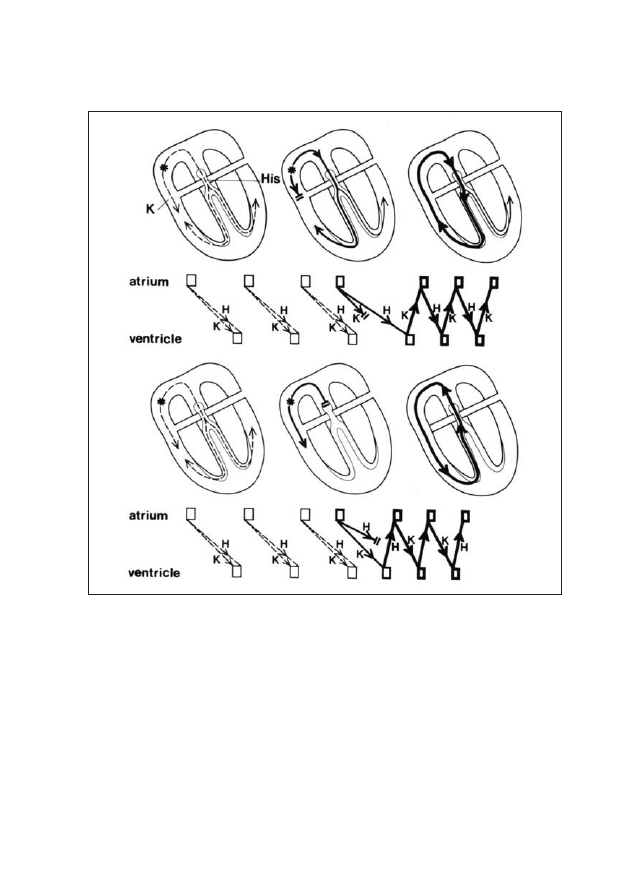
że prowadzić do kardiomiopatii roztrzeniowej, która cofa się po ablacji dro-
gi dodatkowej.
Rycina 10: Formy częstoskurczów nawrotnych w zespole WPW w mechanizmie fali nawrotnej
(re-entry) sprowokowanych przedwczesnym pobudzeniem przedsionkowym.
W panelu górnym pierwsze 3 pobudzenia przewodzone są do komór zarówno
drogą fizjologiczną (pęczkiem Hisa - H), jak i drogą dodatkową (pęczek Kenta - K).
Czwarte pobudzenie (przedwczesne) nie przewodzi się do komór drogą
dodatkową, będącą jeszcze w okresie refrakcji, natomiast przewodzi się jedynie
szlakiem fizjologicznym, mającym w tym przypadku krótszy okres refrakcji. Po
aktywacji komór bodziec przewodzi się wstecznie przez drogę dodatkową,
depolaryzując przedsionek zapoczątkowując obieg częstoskurczu nazywany
ortodromalnym. Dolny panel przedstawia odwrotny przebieg pobudzenia.
Czwarte, przedwczesne pobudzenie przedsionkowe natrafia na blok
przewodzenia w pęczku Hisa, będącym w okresie refrakcji i jest przewodzone
zstępująco, do komór przez drogę dodatkową. Po depolaryzacji komór powraca
do przedsionka wstecznie szlakiem fizjologicznym i pętla fali nawrotnej zamyka
się. Taki kierunek obiegu częstoskurczu nazywamy antydromalnym
37
ROLA BADANIA ELEKTROFIZJOLOGICZNEGO I ABLACJA
Rolą badania elektrofizjologicznego jest ustalenie mechanizmu arytmii.
Dokonuje się tego poprzez programowaną stymulację prawego lub lewego
przedsionka, rzadziej komór. Przedwczesny impuls lub parę impulsów do-
starcza się na rytmie własnym lub narzuconym. Ma to na celu ocenę czasu
efektywnej refrakcji drogi dodatkowej łącza przedsionkowo-komorowego
oraz prowokację częstoskurczu bądź migotania przedsionków, a więc identy-
fikację czynników zagrożenia życia. W badaniu metodą inwazyjną wprowa-
dza się, z nakłucia żyły udowej bądź podobojczykowej, przeważnie 4 wielo-
biegunowe elektrody endokawitarne: pierwszą do prawego przedsionka,
drugą do prawej komory, trzecią w okolicę pęczka Hisa, czwartą do zatoki
wieńcowej (w celu rejestracji pobudzeń i ewentualnej stymulacji lewego
przedsionka). W ten sposób otrzymuje się pełen obraz propagacji tachykar-
dii. Po ustaleniu położenia drogi dodatkowej można w trakcie jednej sesji
wprowadzić elektrodę ablującą celem przerwania przewodzenia w drodze
dodatkowej.
Przydatną metodą skriningową jest stymulacja przezprzełykowa lewego
przedsionka. Szczególną jej zaletą jest bezkrwawość i wynikająca z tego
powtarzalność, np. w ocenie skuteczności profilaktyki farmakologicznej.
Ostatnio wykorzystuje się ją do sprawdzania skuteczności wykonanej
ablacji. Niekiedy stosowana jest terapeutycznie – dla przerwania często-
skurczu.
Rycina 11: Migotanie przedsionków
38
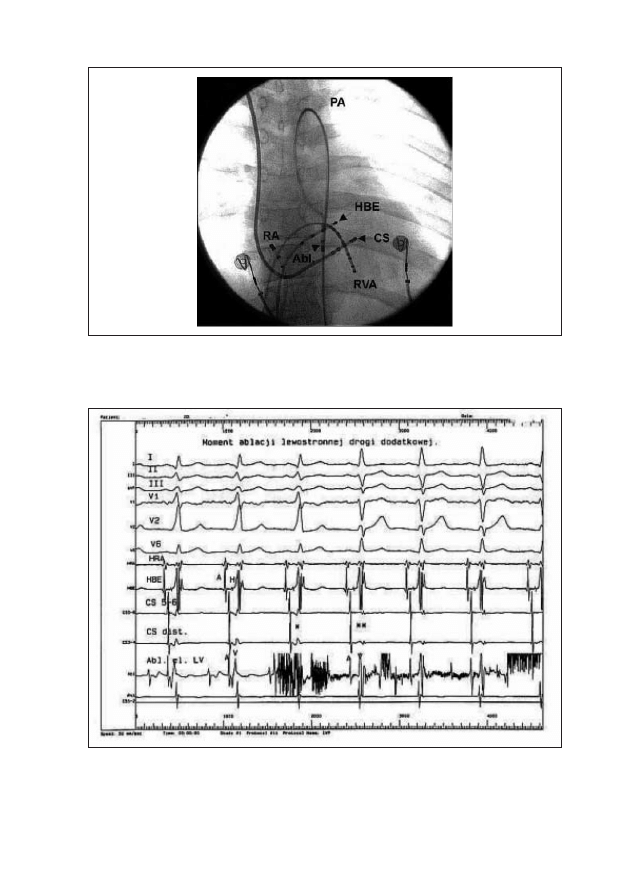
Rycina 13: Zapis elektrokardiograficzny z wielu elektrod w czasie badania elektrofizjologicznego
i ablacji drogi dodatkowej lewej (z poprzedniego rtg). HRA - elektrogram
z prawego przedsionka, HBE - elektrogram z elektrody z okolicy pęczka Hisa,
H - pobudzenie pęczka Hisa, CS - elektrogram z zatoki wieńcowej,
Abl - elektrogram z elektrody ablującej
Rycina 12: Ułożenie elektrod do badania elektrofizjologicznego i ablacji. RA - prawy
przedsionek, HBE - okolica pęczka Hisa, CS - zatoka wieńcowa, RVA - koniuszek
prawej komory, Abl. - elektroda ablująca (w komorze lewej wprowadzona przez
dostęp tętniczy)
39

FARMAKOTERAPIA
Farmakoterapia w zespole WPW ma dwa zastosowania: pierwsze – prze-
rwanie napadowego częstoskurczu, drugie – profilaktykę wystąpienia aryt-
mii.
Podczas napadu częstoskurczu szybkość interwencji uzależniona jest od
tolerancji hemodynamicznej arytmii przez pacjenta. Pierwszą metodą jej
przerwania powinna być próba Valsalvy (napinanie nerwu błędnego poprzez
rozciąganie klatki piersiowej głębokim wdechem, zatrzymaniem powietrza
i zastosowaniem tłoczni brzusznej), kilkakrotnie powtórzona. Jest ona sku-
teczniejsza w przypadku częstoskurczu ortodromalnego. Przy dobrej tole-
rancji arytmii można zalecić doraźne doustne przyjęcie leku beta-adrenoli-
tycznego czy prajmaliny, rzadziej propafenonu i powtórzenie manewrów
wagalnych. Werapamil i naparstnica są przeciwwskazane, o czym będzie mo-
wa dalej.
Utrwalony częstoskurcz wymaga przeważnie interwencji w ośrodku kwali-
fikowanej pomocy. Metodą z wyboru jest dożylne podanie ajmaliny, beta-
-adrenolityku, rzadziej amiodaronu. Środki te wydłużają czas refrakcji
i przewodzenia w pętli fali nawrotnej, doprowadzając do zablokowania pato-
logicznej propagacji bodźca. Wspomniane werapamil i naparstnica mogą być
groźne, gdyż skracają okres refrakcji drogi dodatkowej. Może to spowodo-
wać przyspieszenie częstoskurczu, a nawet jego degenerację do migotania
komór.
Profilaktyka farmakologiczna zespołu WPW jest bardzo trudnym zada-
niem. O jej wprowadzeniu decyduje ilość i rodzaj występujących zaburzeń
rytmu, niemożność lub trudności z wykonaniem ablacji lub brak zgody
chorego na postępowanie pozafarmakologiczne. Przy permanentnej far-
makoterapii zawsze winno kierować się zasadą mniejszego zła, a więc do-
bór środków zależy nie tylko od ich skuteczności, ale i od minimalizowa-
nia skutków ubocznych, gdyż dotyczy ona ludzi w młodym wieku. Dlatego
też preferuje się sotalol (beta-adrenolityk posiadający właściwości anty-
arytmicznych leków grupy III), propafenon. Prajmalina jest bardziej tok-
syczna, powodując m.in. zastój żółci. Przy takim podejściu do profilaktyki
farmakologicznej lekiem ostatniej szansy jest amiodaron, ze względu na
toksyczne działanie cząsteczki jodu na tarczycę (przeważnie doprowadza
do nadczynności), pomimo jego największej skuteczności. W przypadku za-
pobiegania migotaniom przedsionków wystarczy zwykły beta-adrenolityk.
Jak już wspomniano, skuteczność takiej terapii można sprawdzać poprzez
stymulację przezprzełykową przedsionków oraz całodobowe EKG metodą
Holtera.
40

SPORT
Jak już wielokrotnie wspominano, omawiane zjawisko dotyczy ludzi mło-
dych, aktywnych fizycznie. Stąd też nie zaleca się im stosowania specjalnego
trybu życia. Należy unikać zachowań prowokujących napady arytmii, takich
jak gwałtowne ruchy czy ekstremalny wysiłek fizyczny. Uprawiający sport za-
wodniczo muszą być poddani badaniu elektrofizjologicznemu w celu ruty-
nowej identyfikacji ryzyka. W przypadku istnienia drogi o krótkiej refrakcji,
winno się wykonać jej ablację.
OBSERWACJE ODLEGŁE
Przez długi czas obecność preekscytacji komór traktowano jako nie-
groźną anomalię elektrokardiograficzną. Poza napadami częstoskurczów
osoby z zespołem WPW nie cierpią na żadną ustawiczną dolegliwość
i trudno traktować je jako chorych. Dokładniejsze obserwacje, w tym wie-
lokrotnie wykonywane całodobowe EKG metodą Holtera, dowiodły, że
częstość występowania arytmii u nich jest większa niżby się spodziewa-
no. Krótkotrwałe napady częstoskurczów nie są w większości zauważane
przez pacjentów. Stany takie mogą stopniowo prowadzić do rozwoju kar-
diomiopatii rozstrzeniowej zwanej czasami tachykardiomiopatią. Częściej
powstaje ona u osób z ustawicznym częstoskurczem, przeważnie wolnym
(120-140/min), równie często niezauważanym przez chorego. Jak już
wspominano, wykonanie ablacji w takim przypadku może przyczynić się
do zmniejszenia sylwetki serca. Stąd też wskazane jest monitorowanie
sylwetki serca za pomocą okresowo wykonywanych badań echokardio-
graficznych. Szczególna łatwość dostępu w Polsce do diagnostycznej sty-
mulacji serca metodą przezprzełykową, stanowi duże ułatwienie w oce-
nie czynników ryzyka i właściwie każda osoba z zespołem WPW winna
zostać skierowana na takie badanie. W szczególności dotyczy to młodzie-
ży w wieku szkolnym, ale dotychczas nawet standardowe EKG nie jest
uznane za celowe w badaniach skriningowych. Warto też zauważyć stop-
niowe zmniejszanie się z wiekiem populacji osób z zespołem WPW. Nale-
ży sądzić, że oprócz przypadków nagłych zgonów, interwencji medycznej
(ablacje), przyczyną tego są naturalne procesy miażdżycowe powodują-
ce zanikanie przewodzenia w drodze dodatkowej. Spotyka się bowiem
chorych posiadających elektrokardiogramy z lat młodzieńczych z cecha-
mi preekscytacji, nieobecnymi już w wieku późniejszym (na ogół powy-
żej 60. roku życia).
41

Zapamiętaj!
1. Zespół WPW jest wrodzoną anomalią niedziedziczną, polegającą na istnie-
niu dodatkowego połączenia elektrycznego przedsionków i komór serca.
2. Jest to klasyczny anatomiczny substrat dla częstoskurczów nadkomorowych
w mechanizmie fali nawrotnej o przebiegu wstępującym bądź zstępującym,
przeważnie o charakterze napadowym, które są przyczyną dolegliwości pa-
cjentów.
3. Włókna o szybkim przewodzeniu mogą stanowić zagrożenie życia, stąd
wszyscy ludzie z elektrokardiograficznymi cechami tego zespołu winni być
kierowani do pracowni elektrofizjologicznych, w celu ich identyfikacji i wy-
konania zabiegu ablacji drogi dodatkowej.
Warto przeczytać:
A. Stanke: Elektrokardiogram bez tajemnic. Gdańsk 2002.
M. Pytkowski: Inwazyjna diagnostyka i leczenie chorych z częstoskurczami
nadkomorowymi. Postępy Nauk Medycznych 2002/1.
B. Dąbrowska, A. Dąbrowski: Podręcznik elektrokardiografii. Warszawa
2000.
M. Dłużniewski (red.): Zaburzenia rytmu serca. Warszawa 1997.
W. Mandel: Cardiac Arrhythmias. Philadelphia 1995.
A. Bayes de Luna: Elektrokardiografia kliniczna. Gdańsk 1999.
42

IV.
KOMOROWE ZABURZENIA RYTMU SERCA.
KOGO LECZYĆ? JAK LECZYĆ?
Jarosław Król, Mirosław Dłużniewski
Komorowe zaburzenia rytmu (KZR) mogą powodować wiele objawów
podmiotowych od łagodnych, takich jak uczucie kołatania serca przy więk-
szych emocjach, do nagłego zgonu włącznie. Minione piętnaście lat przynio-
sło wiele zmian w podejściu do leczenia KZR. Początkowo po stwierdzeniu,
że nagłe zgony spowodowane są zazwyczaj migotaniem komór, a wyjątkowo
tylko asystolią uważano, że komorowe zaburzenia rytmu zawsze wymagają
leczenia farmakologicznego. Na podstawie obserwacji, które wskazywały, że
zagrożenie nagłym zgonem u chorych po przebytym zawale serca rośnie
wraz z częstością pobudzeń dodatkowych komorowych, rejestrowanych
w dobowym zapisie EKG metodą Holtera z jednej strony, a stopniem uszko-
dzenia lewej komory z drugiej, próbowano ustalić wskazania do rutynowego
stosowania leków antyarytmicznych. Badania CAST i CAST II miały wyka-
zać skuteczność leków antyarytmicznych w zapobieganiu nagłym zgonom
w grupie chorych po zawale serca z KZR udokumentowanymi badaniem
holterowskim. W grupie chorych leczonych aktywnymi lekami antyarytmicz-
nymi (enkainid, flekainid oraz moricizina) stwierdzono znamiennie więcej
zgonów niż w grupie otrzymującej placebo. Badania te przypomniały o daw-
no znanym zjawisku proarytmicznego działania leków antyarytmicznych,
które opisane początkowo u chorych leczonych chinidyną, okazało się groź-
ne także przy stosowaniu innych, nowszych leków. Niepowodzenie programu
CAST spowodowało odwrót od stosowania nie tylko leków z grupy I wg Vau-
ghana-Williamsa, ale leków antyarytmicznych jako takich.
Wprowadzenie nowych metod leczenia ostrej fazy zawału serca (ZS), pole-
gających na przywracaniu przepływu w niedrożnych tętnicach wieńcowych
wyraźnie poprawiło rokowanie. Jednocześnie nastąpił wzrost liczby chorych
przewlekle leczonych z powodu ChNS, w tym także chorych po zawale, często
z objawami niewydolności serca (NS), która w świetle wieloletnich obserwa-
cji prowadzi do nagłego zgonu, co świadczy o współistnieniu NS i KZR. Wia-
domo jednak, że zagrożenie nagłym zgonem u chorych z KZR i NS dotyczy
nie tylko chorych po zawale serca. Przerost lewej komory w przebiegu kar-
diomiopatii przerostowej, częściej przy długotrwałym nadciśnieniu tętniczym
i coraz częściej opisywana rozkurczowa niewydolność serca to inne potencjal-
ne przyczyny prowadzące do nagłego zgonu. Zaburzenia humoralno-metabo-
liczne (w tym nadczynność tarczycy zwykle wymieniana jako przyczyna nad-
komorowych zaburzeń rytmu), niektóre schorzenia w obrębie jamy brzusznej
43

to pozasercowe czynniki wyzwalające KZR. Wydłużenie QT spowodowane
genetycznie uwarunkowanymi zmianami w obrębie kanałów jonowych – po-
tasowych i sodowych lub skutek stosowanych leków, nie tylko antyarytmicz-
nych, to kolejna przyczyna zagrożenia nagłym zgonem.
Znajomość patofizjologicznych mechanizmów towarzyszących wymienionym
stanom chorobowym pozwala dziś na leczenie KZR nie tylko w sposób objawo-
wy, jak ma to miejsce z użyciem leków antyarytmicznych, ale także przyczyno-
wo, co powinno być kardynalną zasadą leczenia. Gdy przyczyną zaburzeń rytmu
są zaburzenia jonowe, naturalnym sposobem leczenia jest wyrównanie tych za-
burzeń. Zwykle jednak związek przyczynowo-skutkowy nie jest tak prosty i za-
stosowanie jednego tylko środka nie może przynieść efektu. Najgroźniejsze za-
burzenia rytmu występują, gdy u chorego z uszkodzeniem mięśnia sercowego
pojawią się zaburzenia homeostazy oraz czynne niedokrwienie.
Sama obecność komorowych zaburzeń rytmu w spoczynkowym badaniu
EKG nie upoważnia do rozpoczęcia leczenia farmakologicznego. Wyjątkiem
jest rozpoznanie częstoskurczu komorowego, który będąc stanem zagrożenia
życia, wymaga natychmiastowej interwencji. Standardy PTK przewidują w tej
sytuacji zastosowanie kardiowersji elektrycznej lub gdy stan hemodynamicz-
ny pacjenta na to pozwala, podania dożylnie leków antyarytmicznych. Le-
kiem pierwszego wyboru jest lidokaina, a gdy nie jest ona skuteczna – zale-
cane jest wykonanie kardiowersji lub podanie amiodaronu. Postępowaniem
Tabela 1: Przyczyny komorowych zaburzeń rytmu
PRZYCZYNY
SERCOWO-NACZYNIOWE
PRZYCZYNY POZASERCOWE
• choroba niedokrwienna serca;
• wady zastawkowe;
• kardiomiopatie;
• nadciśnienie tętnicze;
• zapalenie mięśnia sercowego;
• zawał serca;
• zespół WPW, zespół
wydłużonego QT;
• arytmogenna kardiomiopatia
prawej komory.
• nadczynność tarczycy;
• zaburzenia jonowe;
• choroby układu oddechowego
(POChP);
• niedokrwistość;
• ostre infekcje wirusowe;
• gorączka;
• choroby w jamie brzusznej
(kamica, przepuklina rozworu
przełykowego);
• skutek stosowania leków.
44
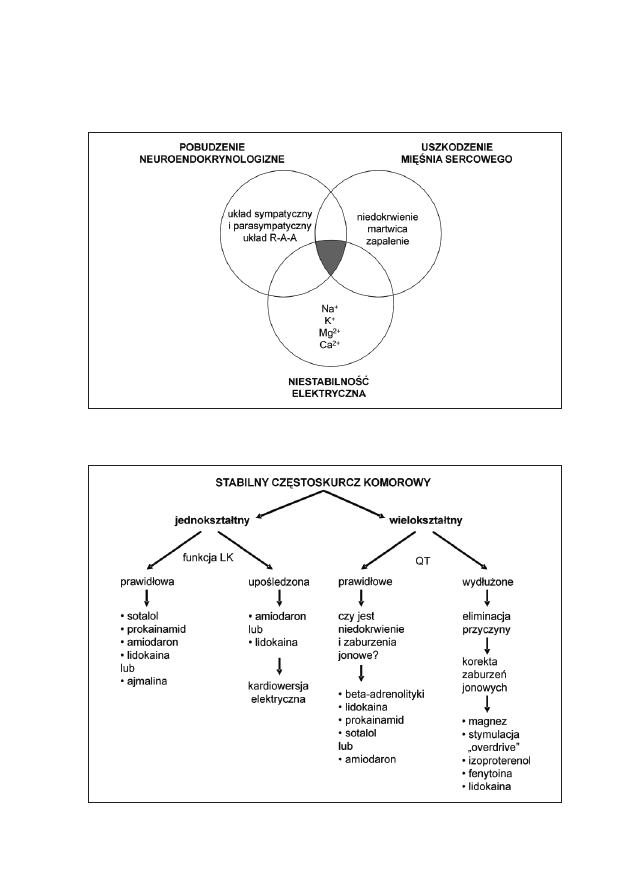
alternatywnym może być stymulacja przeciwarytmiczna, polegająca na krót-
kotrwałym narzuceniu sercu przez elektrodę przełykową lub wewnątrzser-
cową rytmu o częstości wyższej niż leczony częstoskurcz (ryc. 2).
Rycina 2: Postępowanie w częstoskurczu komorowym (standardy PTK)
Rycina 1: Mechanizmy sprzyjające powstawaniu komorowych zaburzeń rytmu serca
45
Pacjenci z rozpoznanym na podstawie spoczynkowego badania EKG nie-
utrwalonym częstoskurczem komorowym bez objawów zaburzeń hemody-
namicznych wymagają w zależności od rodzaju częstoskurczu (jedno-
kształtny lub wielokształtny) odmiennego postępowania. Częstoskurcz
jednokształtny z prawidłową funkcją lewej komory może być leczony far-
Tabela 2: Leki wydłużające QT
LEKI ANTYARYTMICZNE
• ajmalina;
• amiodaron;
• bretylium;
• dofetilid;
• prokainamid;
• propafenon;
• chinidyna;
• sotalol.
INNE LEKI KARIOLOGICZNE
• prenylamina;
• papaweryna.
LEKI PSYCHIATRYCZNE
• amitryptylina;
• clopramide;
• chlorpromazyna;
• citalopram;
• doxepin;
• droperidol;
• fluphenazyna;
• haloperidol;
• imipramina;
• lit;
• thioridazyna;
• trifluoperazyna.
LEKI PRZECIWBAKTERYJNE,
PRZECIWGRZYBICZE,
PRZECIWWIRUSOWE
I ANTYMALARYCZNE
• amantadyna;
• klarytromycyna;
• chloroquina;
• klotrimazol;
• erytromycyna;
• ketokonazol;
• spiramycyna.
46

makologicznie sotalolem, prokainamidem, amiodaronem lub ajmaliną.
Gdy funkcja lewej komory jest upośledzona po próbie leczenia amiodaro-
nem lub lidokainą, leczenie wymaga zastosowania kardiowersji elektrycz-
nej. Leczenie częstoskurczu wielokształtnego wymaga oceny czasu QT, co
może być kluczem do ustalenia przyczyny zaburzeń rytmu. Gdy czas QT
jest prawidłowy, ocenić należy obecność ostrego niedokrwienia i zaburzeń
jonowych. Gdy te oczywiste przyczyny zaburzeń rytmu są wykluczone, moż-
na rozpocząć leczenie lekami beta-adrenolitycznymi, lidokainą, sotalolem
lub amiodaronem. Pacjent z wydłużonym QT wymaga zastanowienia, czy
przyczyną wydłużenia QT nie jest jeden ze stosowanych leków. Pamiętać
trzeba, że lekiem tym niekoniecznie musi być lek z grupy leków kardiolo-
gicznych.
Stosowanie leków antyarytmicznych, zwłaszcza tych, które wpływają na czas
QT wymaga szczególnej ostrożności i monitorowania QT w trakcie leczenia.
Dotyczy to zwłaszcza chorych leczonych amiodaronem w okresie nasycania
lekiem (wydłużenie QT jest wskaźnikiem osiągnięcia terapeutycznego po-
ziomu leku). Podobnie jest z sotalolem.
Skoro stosowanie leków antyarytmicznych jest tak ryzykowne, to jak bez-
piecznie postępować z chorymi z zaburzeniami rytmu?
Odpowiedź jest prosta, ale w codziennej praktyce klinicznej trudno się
do niej stosować, zwykle bowiem doraźna poprawa po leczeniu objawo-
wym zmniejsza poczucie choroby u pacjenta i pozwala zapomnieć o zagro-
żeniu. Leczenie przyczynowe jest trudniejsze, wymaga więcej cierpliwości,
wykonania niekiedy trudno dostępnych badań i procedur, czasem zniechę-
cających chorego i lekarza. Gdy tło niedokrwienne zaburzeń rytmu wyda-
je się prawdopodobne, konieczna jest koronarografia i pilna interwencja
wieńcowa. Tak bywa, gdy podczas badania wysiłkowego wystąpi często-
skurcz komorowy. Gdy zaburzenia rytmu towarzyszą zaburzeniom hormo-
nalnym (najczęściej chorobom tarczycy), to leczenie choroby podstawowej
powinno być skuteczne w zwalczeniu zaburzeń rytmu. Przerost lewej ko-
mory w przebiegu nadciśnienia sprzyja zaburzeniom rytmu. Badanie PRE-
VENT wykazało wpływ enalaprilu, a badania SHEP – chlortalidonu na
przerost lewej komory w nadciśnieniu. Stąd stosowanie ACE inhibitorów
i leków moczopędnych w nadciśnieniu może pośrednio zapobiegać zabu-
rzeniom rytmu serca.
47
Coraz częściej mówi się o pleotropowym działaniu statyn. Jak już wykaza-
no, leki te redukują umieralność z powodu chorób układu krążenia, w tym
także zgony nagłe, a więc powodowane zaburzeniami rytmu. Nie zawsze
więc do leczenia zaburzeń rytmu konieczne są leki antyarytmiczne.
Nie można jednak całkowicie zrezygnować ze stosowania wybranych le-
ków antyarytmicznych. Po pierwsze w stanach nagłych, gdy pacjent jest wy-
dolny hemodynamicznie, nadal stosuje się interwencyjnie leki z grupy I lub
III wg Vaughana-Wiliamsa. Leki, takie jak lidokaina, prokainamid czy ajma-
lina oraz amiodaron mogą być z powodzeniem stosowane doraźnie paren-
teralnie, pomimo że nie są lekami najnowszej generacji.
Przewlekłe farmakologiczne leczenie KZR wymaga po pierwsze oceny
zagrożenia, jakie stanowią zaburzenia rytmu. I tak pacjenci z łagodny-
mi, bezobjawowymi KZR nie wymagają farmakoterapii. Gdy zaburze-
niom rytmu towarzyszą przykre objawy podmiotowe, próba stosowania
beta-adrenolityków jest zwykle skuteczna. Postępowanie psychologicz-
ne, wyjaśnienie istoty dolegliwości, ich związku ze stresem, przemęcze-
niem lub używkami, zazwyczaj przynosi skutek, choć wymaga to więcej
sVT (sustained ventricular tachycardia) - utrwalony częstoskurcz komorowy,
nsVT (non-sustained ventricular tachycardia) - nieutrwalony częstoskurcz komorowy,
VF (ventricular fibrillation) - migotanie komór.
Tabela 3: Podział zaburzeń rytmu wg Biggera
ARYTMIE
ŁAGODNE
ARYTMIE
ŚMIERTELNE
ARYTMIE
POTENCJALNIE
ZŁOŚLIWE
rodzaj arytmii
VEB, „pary” (?)
nsVT (?)
idiopatyczny sVT
sVT, VF
VEB, „pary” nsVT
VEB, „pary”, nsVT
obecna choroba
organiczna serca
NIE
poważna
różny stopień
zaawansowania
ryzyko nagłego
zgonu
minimalne
wysokie
minimalne
→ wysokie
objawy
BEZ lub
umiarkowane
poważne
BEZ
→ umiarkowane
leczenie dla
usunięcia objawów
TAK
TAK
TAK
zapobieganie
nagłemu zgonowi
NIE!
TAK!
zawsze
indywidualizowane,
zależnie od zagrożenia
nagłym zgonem
48
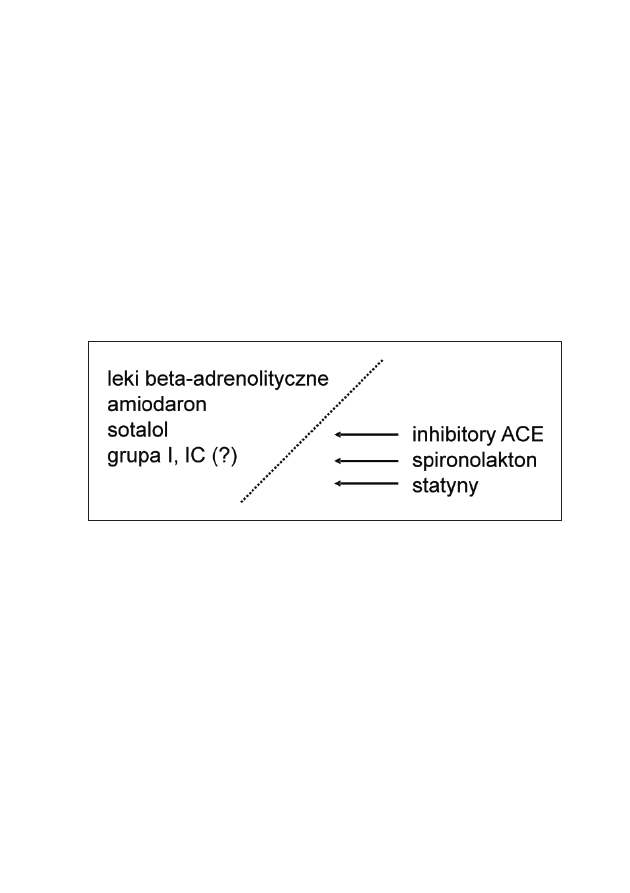
czasu niż przepisanie recepty na lek antyarytmiczny. W tej grupie cho-
rych stosowanie leków z klasy I i III należy uznać za błąd. Zaburzenia
rytmu potencjalnie złośliwe, towarzyszące różnym chorobom organicz-
nym serca i układu krążenia mogą stanowić wskazanie do farmakolo-
gicznego leczenia, ale zawsze po ocenie możliwości leczenia przyczyno-
wego, zwykle polegającego na poprawie ukrwienia wieńcowego. W tym
przypadku obowiązuje zasada, że lekiem pierwszego wyboru jest beta-
-adrenolityk. Trudno dziś znaleźć pacjenta z przeciwwskazaniami do sto-
sowania tej grupy leków, a wiele prób klinicznych udokumentowało ich
skuteczność i bezpieczeństwo. Gdy lek z grupy beta-adrenolityków nie
jest wystarczająco skuteczny, można czasem podać dodatkowo lek z gru-
py I, nie rezygnując z beta-adrenolityku. Najczęściej lekiem tym bywa
prajmalina lub propafenon. Niektórzy chorzy wymagają podania amio-
daronu lub sotalolu.
Dobór leku antyarytmicznego polega na kontrolowaniu jego skuteczno-
ści w kolejnych badaniach EKG metodą Holtera, rzadko kolejnych badań
elektrofizjologicznych, które wykonuje się raczej w celu kwalifikacji do le-
czenia niefarmakologicznego. Odrębną grupę stanowią chorzy z rozpo-
znaniem kardiomiopatii rozstrzeniowej lub przerostowej. Zaburzenia ryt-
mu u tych chorych we wczesnym okresie choroby można zaliczyć do
potencjalnie złośliwych, ale leczenie ich jest trudne i wymaga doświadcze-
nia. Wraz z postępem choroby narasta ryzyko nagłego zgonu spowodowa-
nego zaburzeniami rytmu. Dlatego stosowanie leków antyarytmicznych
ma w tej grupie chorych znaczenie profilaktyczne. Amiodaron zajmuje
pierwsze miejsce w leczeniu KZR w obu rodzajach kardiomiopatii. U cho-
rych z przerostową postacią, można stosować sotalol oraz z myślą o po-
tencjalnym hamującym wpływie na rozwój przerostu także leki z grupy an-
tagonistów kanałów wapniowych. W kardiomiopatii rozstrzeniowej można
Rycina 3: Terapia empiryczna z oceną skuteczności kolejnych leków antyarytmicznych
49

stosować beta-adrenolityki. Zawsze do rozważenia jest leczenie niefarma-
kologiczne.
KZR u pacjentów z poważnym uszkodzeniem serca, po rozległym zawa-
le, z zaawansowaną kardiomiopatią przerostową, rozstrzeniową, z arytmo-
genną kardiomiopatią prawej komory czy ze stenozą aortalną, stanowią za-
grożenie nagłym zgonem. U chorych tych pojawiają się i często nawracają
najcięższe formy zaburzeń rytmu, takie jak częstoskurcz komorowy lub mi-
gotanie komór. Chorzy ci wymagają wielokierunkowego postępowania.
Z jednej strony konieczne jest profilaktyczne podawanie leków antyaryt-
micznych, najczęściej amiodaronu, zawsze leków wymaganych w leczeniu
choroby podstawowej oraz poszukiwania możliwości zastosowania jednej
z nowoczesnych metod leczenia niefarmakologicznego.
Coraz częściej stosowane metody leczenia niefarmakologicznego to
ablacja prądem o częstotliwości radiowej tkanki wywołującej zaburzenia
rytmu. Jej skuteczność w leczeniu częstoskurczów z drogi odpływu prawej
komory jest udokumentowana i stosowana z powodzeniem u wielu cho-
rych.
Innym sposobem leczenia najgroźniejszych zaburzeń rytmu jest wszcze-
pienie kardiowertera-defibrylatora (implantable cardioverter-defibrillator,
ICD). Badania AVID i MADIT wykazały skuteczność takiego postępowa-
nia u chorych z uszkodzeniem lewej komory po zawale serca i częstoskur-
czami komorowymi. Badania MADIT II pozwoliły też na ustalenie wskazań
do wszczepienia ICD.
Tabela 4: Postępowanie u chorych z zaburzeniami rytmu w przebiegu kardiomiopatii
KARDIOMIOPATIA
ROZSTRZENIOWA
• amiodaron;
• inhibitory enzymu konwertującego;
• leki beta-adrenolityczne;
• ablacja, implantacja kardiowertera-
-defibrylatora, przeszczep serca;
KARDIOMIOPATIA
PRZEROSTOWA
• sotalol, amiodaron;
• antagoniści kanałów wapniowych (?);
• implantacja stymulatora;
• myectomia, miotomia, implantacja
kardiowertera-defbrylatora;
50

Zapamiętaj!
1. Tylko przyczynowe leczenie zaburzeń rytmu serca nie wiąże się z ryzykiem
działania proarytmicznego.
2. Zawsze należy uwzględnić możliwość lub konieczność leczenia niefarmako-
logicznego zaburzeń rytmu serca.
3. Inhibitory konwertazy, leki beta-adrenolityczne, statyny i spironolakton to
leki o udokumentowanym wpływie na redukcję występowania zgonów na-
głych, a więc pośrednio działające antyarytmicznie.
WZGLĘDNE WSKAZANIA DO WSZCZEPIENIA ICD
• chorzy z kardiomiopatią przerostową, rozstrzeniową lub
zespołem wydłużonego QT z grupy wysokiego ryzyka śmierci
sercowej (prewencja pierwotna).
BEZWZGLĘDNE WSKAZANIA DO WSZCZEPIENIA ICD
• nagłe zatrzymanie krążenia w przebiegu częstoskurczu
komorowego lub migotania komór, gdy przyczyna nie była
przemijająca lub odwracalna;
• częstoskurcz komorowy z utratą przytomności, ostrą
niewydolnością lewej komory, wstrząsem kardiogennym,
u chorych z EF <35%;
• utrwalony częstoskurcz komorowy bez znaczących zaburzeń
hemodynamicznych, oporny na zastosowane leczenie;
• utraty przytomności o nieustalonej etiologii u osób,
u których w czasie badania elektrofizjologicznego
wywołano utrwalony częstoskurcz komorowy lub
migotanie komór;
• nieutrwalony częstoskurcz komorowy u chorych po
zawale serca, z dysfunkcją lewej komory (EF <35%),
u których w badaniu elektrofizjologicznym wywołuje się
utrwalony częstoskurcz komorowy (prewencja
pierwotna).
51

Warto przeczytać:
A.J. Moss, W.J. Hall, D.S. Cannom et al.: Improved survival with an im-
planted defibrillator in patients with coronary disease at high risk for ventricu-
lar arrhythmia. N Engl J Med 1996; 335: 1933-1940.
AVID investigators: A comparison of antiarrhythmic drug therapy with im-
plantable defibrillators in patients resuscited from near fatal ventricular arrhy-
thmias. N Engl J Med 1997; 337: 1576-1583.
Standardy PTK: Leczenie komorowych zaburzeń rytmu serca.
(www.ptkardio.pl)
52

V.
ZABURZENIA RYTMU SERCA W OSTRYCH
ZESPOŁACH WIEŃCOWYCH
Włodzimierz Gierlak, Marek Kuch
WSTĘP
Występowanie zaburzeń rytmu serca wynika z zakłócenia metabolizmu ko-
mórek roboczych mięśnia sercowego, komórek bodźcotwórczych i komórek
układu bodźcoprzewodzącego. Ostre niedokrwienie jako przyczyna ograni-
czenia przemian tlenowych komórek mięśnia sercowego często powoduje
wystąpienie arytmii. Jednak w zależności od miejsca powstawania przed-
wczesnych depolaryzacji, toru ich rozchodzenia się, nadmiernej stymulacji
adrenergicznej oraz kształtowania się sytuacji hemodynamicznej pacjenta
– otrzymujemy zróżnicowaną manifestację kliniczną komorowych i nadko-
morowych zaburzeń rytmu serca.
Pojedyncze komorowe pobudzenia dodatkowe, te same, które sporadycz-
nie występują na co dzień i nie stanowią zagrożenia, trafiając na podatny
substrat niedokrwionej tkanki mięśnia sercowego, mogą prowokować wystą-
pienie groźnych, złożonych komorowych zaburzeń rytmu serca, do których
zaliczamy nieutrwalone częstoskurcze komorowe (non-sustained ventricular
tachycardia, nsVT), utrwalone częstoskurcze komorowe (ventricular tachy-
cardia, VT) oraz migotanie komór (ventricular fibrillation, VF).
Z tego powodu należy uznać, że komorowe zaburzenia rytmu serca są jed-
nym z ważnych objawów niedokrwienia mięśnia sercowego. Najważniejsze
pytanie, na które staramy się znaleźć odpowiedź, to w jaki sposób wyróżnić
pacjentów zagrożonych nagłym zgonem sercowym z przyczyn arytmicznych.
W tym celu wykorzystujemy całodobowe monitorowanie zapisu EKG, ba-
damy występowanie późnych potencjałów (LP), wykonujemy programowaną
stymulację komór. Niestety, w okresie ostrym, jedyną dostępną metodą jest
całodobowe monitorowanie czynności serca, stanowiąc podstawę podejmo-
wanego leczenia antyarytmicznego. Stąd tak ważna jest znajomość patofi-
zjologicznych podstaw arytmii w ostrym niedokrwieniu, aby skutecznie i bez-
piecznie przeciwdziałać groźnym dla życia zaburzeniom rytmu serca.
Podstawowym etiologicznym różnicowaniem komorowych zaburzeń ryt-
mu serca jest podział na arytmie niedokrwienne i reperfuzyjne. Mechani-
Rycina 1: Mechanizm powstawania zaburzeń rytmu serca
53
zmy powstawania w obu przypadkach są wręcz przeciwstawne, lecz zagroże-
nie nagłym zgonem sercowym (NZK) w ostrych zespołach wieńcowych jest
podobne.
MECHANIZMY POWSTAWANIA ARYTMII NIEDOKRWIENNYCH
Omawiając powstawanie przedwczesnych komorowych pobudzeń dodat-
kowych na podłożu niedokrwiennym, należy rozpocząć od zaburzeń biologii
komórki. Niedokrwienie, czy też na poziomie komórkowym raczej – niedo-
tlenienie, powoduje zahamowanie szlaku przemian tlenowych, a w konsekwen-
cji istotnie ogranicza możliwości syntezy ATP (podstawowego substratu
energetycznego komórki). W procesach niecałkowitego spalania w alterna-
tywnych szlakach metabolicznych, które aktywowane są w niedokrwieniu,
dochodzi do gromadzenia resztkowych produktów w komórkach. „Niedo-
pałki metaboliczne” mają silnie toksyczne działanie w obrębie komórki.
W ten sposób w cyklu przemian glukozy powstaje kwas mlekowy. W wyni-
ku zahamowanego cyklu przemian tłuszczów powstaje nadmiar acyloCoA.
Szlak przemian fosfolipidów zostaje zahamowany na etapie lizofosfamidu.
Dodatkowym czynnikiem sprzyjającym narastaniu niedokrwienia jest aku-
mulacja substancji osmotycznie czynnych. W konsekwencji dochodzi do
„ucieczki” potasu i magnezu z komórki do przestrzeni pozakomórkowej,
z jednoczesnym „przeładowaniem” komórek jonami wapnia i sodu. Powyż-
sze procesy ostatecznie prowadzą do uszkodzenia struktur błonowych,
a w efekcie do obumarcia komórek.
Rycina 2: Potencjał czynnościowy prawidłowy (t
1
) i hipopolaryzacyjny (t
2
)
54
Jeszcze na etapie zaburzeń w transporcie jonów Na
+
/Ca
2+
i K
+
/Mg
2+
ka-
skada postępującego niedokrwienia skutkuje upośledzeniem przebiegu po-
tencjału czynnościowego, warunkującego sprawną czynność komórek zarów-
no bodźcoprzewodzących, jak i mięśnia roboczego.
W sytuacji niedokrwienia mięśnia sercowego miocyty nie osiągają założone-
go fizjologicznie poziomu -90 mV, gwarantującego sprawny przebieg poten-
cjału czynnościowego. Proces repolaryzacji osiąga jedynie wartości ok. -60 czy
-80 mV. Konsekwencją jest przeniesienie odpowiedzialności za realizację fa-
zy zero potencjału czynnościowego z szybkiego prądu sodowego (aktywacja
poniżej -90 mV) na wolniejszy prąd wapniowy (głównie on ulega aktywacji
przy potencjale komórki rzędu -60 mV). Opisane zjawisko hipopolaryzacji
prowadzi również do miejscowego opóźnienia przewodzenia fali pobudze-
nia wobec wydłużenia potencjałów czynnościowych aktywowanych komórek.
Niedokrwiona tkanka charakteryzuje się ponadto dużą niejednorodnością
refrakcji oraz wzmożeniem pobudliwości. Zróżnicowanie stref niedokrwie-
nia charakteryzujących się różną repolaryzacją i refrakcją prowadzi do powsta-
nia różnicy potencjałów. Różnica ta prowadzi zaś do powstania przepływu
prądu (fali pobudzenia), która to w zależności od aktywności sąsiadujących
komórek, może zamienić się w nawrotną falę pobudzenia (re-entry).
O powstaniu nawrotnej fali pobudzenia możemy mówić wtedy, gdy fala
depolaryzacji generowana z miejsca niedokrwionego, nie wygasa po każdym
Rycina 3: Pobudzenie krążące w kształcie cyfry 8
55

kolejnym pobudzeniu zatokowym, ale ponownie rozchodzi się dzięki depola-
ryzacji komórek nieuszkodzonych na obwodzie strefy zawału, które były już
poprzednio pobudzone i właśnie zdążyły wyjść z okresu refrakcji. Jest to naj-
częstszy mechanizm powstawania groźnych komorowych zaburzeń rytmu
serca w przebiegu ostrych zespołów wieńcowych.
Innym czynnikiem sprzyjającym wyzwoleniu arytmii komorowej jest zja-
wisko automatyzmu patologicznego. Wzrost automatyzmu patologicznego
jest najczęściej wynikiem nadmiernej stymulacji adrenergicznej, lecz może
dotyczyć również każdej częściowo zdepolaryzowanej komórki. Aktywacja
automatyzmu patologicznego następuje powyżej -60 mV i jest zależna od
prądu wapniowego. Już samo przyspieszenie automatyzmu jest arytmogen-
ne, ponieważ powoduje zaburzenia przewodzenia na skutek depolaryzacji
rozpoczynającej się z bardziej dodatniego potencjału spoczynkowego.
Ponadto, w ślad za pogłębiającym się niedokrwieniem, dochodzi do zabu-
rzenia homeostazy humoralnej ustroju na skutek wzmożonego wyrzutu amin
katecholowych, zjawiska określanego mianem burzy hormonalnej. Działanie
katecholamin polega na zwiększeniu zapotrzebowania tlenowego organizmu
oraz nasileniu działania znajdujących się w nadmiarze wolnych kwasów tłusz-
czowych i w ten sposób ułatwiają wyzwolenie arytmii/pobudzeń dodatkowych.
Ponadto pobudzenie adrenergiczne zwiększa patologiczny automatyzm ko-
mórek mięśniowych i jednocześnie obniża próg migotania komór. W odpo-
wiedzi na wzmożone wydzielanie katecholamin dochodzi również do nad-
produkcji hormonów tarczycy, co nasila zapotrzebowanie tlenowe mięśnia
sercowego.
MECHANIZMY POWSTAWANIA ARYTMII REPERFUZYJNYCH
Po dokonaniu się zawału, w przypadku całkowitego zamknięcia tętnicy
wieńcowej, nie dochodzi do wypłukiwania „produktów niedokrwienia” po-
wstałych na skutek dokonanej martwicy komórek. Dzięki leczeniu fibrynoli-
tycznemu oraz pierwotnej angioplastyce tętnic wieńcowych przywrócony zo-
staje przepływ wieńcowy przez tętnice epikardialne. Zjawisko to nosi nazwę
reperfuzji. Jakkolwiek reperfuzja pozwala ograniczyć strefę zawału, to jed-
nak temu korzystnemu zjawisku towarzyszy wiele szkodliwych procesów na
poziomie komórek mięśnia sercowego. Podczas reperfuzji, z przestrzeni po-
zakomórkowej wypłukiwane są substancje gromadzone w okresie przemian
beztlenowych, takie jak: purynowe produkty rozpadu ATP, jony wodorowe
i substancje osmotycznie czynne. Istotny jest toksyczny udział wolnych rod-
ników tlenowych w uszkodzeniu reperfuzyjnym. Zasadniczym ich źródłem
w reperfuzji są gromadzące się w obszarze zawałowym leukocyty. Podczas
56

reperfuzji dochodzi również do wewnątrzkomórkowej kumulacji jonów wap-
nia. Akumulacja w niedokrwionym obszarze substancji osmotycznie czynnych
(np. kwasu mlekowego), a następnie ich uwolnienie, jest przyczyną wystąpie-
nia tzw. szoku hipoosmotycznego, polegającego na gwałtownym przemiesz-
czaniu się wody do wnętrza komórek. Również w czasie reperfuzji dochodzi
do zwiększonego napływu jonów sodu do komórki. W konsekwencji obu
tych procesów dochodzi do obrzęku komórek, aż do rozrywania błon komór-
kowych włącznie. Wszystkie wymienione mechanizmy uszkodzenia reperfu-
zyjnego prowadzą do niestabilności elektrycznej mięśnia sercowego i w kon-
sekwencji generowania arytmii reperfuzyjnej.
KOMOROWE ZABURZENIA RYTMU SERCA W OSTRYCH
ZESPOŁACH WIEŃCOWYCH W PRAKTYCE KLINICZNEJ
Pojedyncze zaburzenia rytmu serca zarówno komorowe, jak i nadkomo-
rowe towarzyszą nam w życiu codziennym, choć nie mają one znaczenia
w przypadku osób zdrowych. Zaburzenia rytmu serca mogą też towarzyszyć
każdej postaci choroby niedokrwiennej serca. Największe zagrożenie nagłym
zgonem sercowym w mechanizmie złożonych komorowych zaburzeń rytmu
występuje w pierwszych godzinach ostrego zawału serca. Przyczyną wysokiej
śmiertelności (dochodzącej nawet do 30-40% pacjentów) w tym okresie cho-
roby jest migotanie komór. Dopiero wprowadzenie leczenia fibrynolityczne-
go pozwoliło na skrócenie czasu „rodzenia” ostrego zawału serca, okresu
najbardziej arytmogennego.
W przeszłości, wobec niestosowania leczenia przeciwzakrzepowego, do-
chodziło także do tak zwanych zawałów kroczących, z powiększaniem ob-
szaru uszkodzenia zawałowego, jak i niedokrwionego na skutek postępo-
wania procesu zakrzepowego tętnic wieńcowych. W takim przypadku
oprócz przedłużającego się niedokrwienia dochodziło również do pogor-
szenia sytuacji hemodynamicznej serca, co również potęgowało występowa-
nie arytmii komorowej. Wprowadzenie leczenia fibrynolitycznego ograni-
czyło czas występowania arytmii do okresu reperfuzyjnego, bez rozciągnięcia
na cały okres okołozawałowy. Skróceniu uległ okres generowania zarówno
komorowych zaburzeń rytmu serca o podłożu niedokrwiennym, jak i reper-
fuzyjnym. Udrożnienie zamkniętej tętnicy wieńcowej zwykle skutkuje wy-
zwoleniem złożonych komorowych zaburzeń rytmu serca (pobudzenia wie-
lokształtne, R/T oraz salwy) przemijających najczęściej w okresie kilku
godzin. Potwierdzają to badania wskazujące na występowanie nsVT (na
które składa się 3 lub więcej pobudzeń, nie trwających jednak dłużej niż
30 s), nawet u 80% chorych w okresie ostrym. Jeżeli ugruntuje się model
57

leczenia ostrego zawału serca, zakładający rozpoczęcie leczenia fibrynoli-
tycznego w okresie przedszpitalnym przez zespół reanimacyjny pogotowia
ratunkowego (PR), to należy się liczyć ze zwiększeniem częstości występo-
wania komorowych arytmii reperfuzyjnych jeszcze przed dotarciem pacjen-
ta do Oddziału Intensywnej Opieki Kardiologicznej (OIOK). Dlatego tak
ważne jest profesjonalne zorganizowanie zespołów reanimacyjnych PR wy-
posażonych w odpowiedni sprzęt pozwalający na skuteczne udzielenie po-
mocy pacjentowi ze świeżym zawałem serca. Podstawową metodą zabezpie-
czenia pacjenta przed złożonymi komorowymi zaburzeniami rytmu serca
podczas ostrych zespołów wieńcowych są ośrodki z oddziałami IOK, wpro-
wadzone w końcu lat 60. Dopiero stałe monitorowanie rytmu serca oraz
funkcji życiowych pacjenta doprowadziło do zmniejszenia odsetka nagłych
zgonów sercowych w przebiegu niestabilnej dusznicy bolesnej czy ostrego
zawału serca. Zaburzenia rytmu serca i przewodzenia stanowią najczęściej
występujące powikłanie OZW.
Komorowe pobudzenia przedwczesne
Przedwczesne pobudzenia dodatkowe komorowe są obecne u prawie
90% pacjentów z ostrym zawałem serca. Jednak proste jednoośrodkowe czy
wieloośrodkowe pobudzenia przedwczesne komorowe nie wymagają w fa-
zie ostrej rutynowego leczenia. Dopiero występowanie złożonych komoro-
wych zaburzeń rytmu serca wymaga stosowania leków antyarytmicznych.
Należy jednak pamiętać, że możliwym działaniem ubocznym stosowania le-
ków antyarytmicznych jest wystąpienie bradykardii, asystolii bądź rozkojarze-
nia elektryczno-mechanicznego. Dlatego pierwszoplanowe postępowanie
w leczeniu arytmii komorowej powinno obejmować usunięcie odwracalnych
przyczyn arytmii, poprzez wyrównanie istniejących zaburzeń elektrolito-
wych czy też metabolicznych oraz zapobieganie niedokrwieniu mięśnia ser-
cowego. Zarówno hipokaliemia, jak i kwasica metaboliczna nierzadko towa-
rzyszące ostrym zespołom wieńcowym będą sprzyjać wystąpieniu zaburzeń
rytmu serca. Ponadto dobór leków antyarytmicznych zakłada stosowanie
preparatów o możliwie najniższym potencjale działania proarytmicznego.
Ostatecznie, jak się obecnie uważa, nawet występowanie nsVT w ostrym za-
wale serca, nie wymaga zapobiegawczego leczenia antyarytmicznego, o ile
nie pogarsza sytuacji hemodynamicznej pacjenta. Strategia postępowania
sprowadza się jedynie do bacznego monitorowania z możliwością natych-
miastowego wykonania kardiowersji. Jak dowiodły badania wieloośrodko-
we, występowanie nsVT podczas ostrego zespołu wieńcowego nie pogarsza
rokowania pacjenta.
58
Częstoskurcz komorowy
Częstoskurcz komorowy należy do groźnych, złożonych komorowych za-
burzeń rytmu serca. Według starej klasyfikacji Lowna mieści się w klasie IV
B. W przebiegu ostrych zespołów wieńcowych najczęściej mamy do czynie-
nia z monomorficznym (jednokształtnym) częstoskurczem komorowym. Sta-
tystycznie może on wystąpić u co 10 pacjenta z ostrym zawałem serca. Roz-
poznanie opiera się na stwierdzeniu rytmu o częstości komór 140-250/min,
z szerokimi zespołami QRS.
W różnicowaniu należy brać pod uwagę częstoskurcz nadkomorowy
z aberracją przewodzenia śródkomorowego oraz częstoskurcz przedsion-
kowo-komorowy typu antydromowego. W przebiegu utrwalonego VT zwykle
występują istotne zaburzenia hemodynamiczne, w wyniku których docho-
dzi do obrzęku płuc lub wstrząsu. Częstoskurcz komorowy może również
zdegenerować do migotania komór, a ostatecznie do asystolii – dając ob-
raz kliniczny NZK. W przypadku wystąpienia zaburzeń hemodynamicz-
nych, VT wymaga natychmiastowego przerwania za pomocą kardiowersji
elektrycznej. Jeśli arytmia nie powoduje załamania hemodynamicznego,
możliwe jest zastosowanie kardiowersji farmakologicznej poprzez podanie
Rycina 4: Częstoskurcz komorowy jednokształtny
59
aVR
V
1
V
2
V
3
V
4
V
5
V
6
aVL
aVF
I
II
III

w iniekcji dożylnej lidokainy lub amiodaronu. Po przywróceniu rytmu za-
tokowego pacjent wymaga stosowania zapobiegawczego lidokainy lub amio-
daronu we wlewie dożylnym w dawce podtrzymującej przez okres 6 do 24
godzin.
Wielokształtny częstoskurcz komorowy (torsade de pointes) jest najczęściej
konsekwencją wystąpienia zaburzeń gospodarki wodno-elektrolitowej, proaryt-
micznego wpływu leków antyarytmicznych bądź działania ubocznego leków
przeciwdepresyjnych. Arytmia ta może występować także w zespole wydłu-
żonego QT, który również może być konsekwencją niedokrwienia. Zdecydo-
wanie rzadziej może być prowokowany bezpośrednio niedokrwieniem mię-
śnia sercowego.
Rycina 6: Nieutrwalony częstoskurcz komorowy
Rycina 5: Schemat leczenia jednokształtnego częstoskurczu komorowego (wg standardów PTK)
60
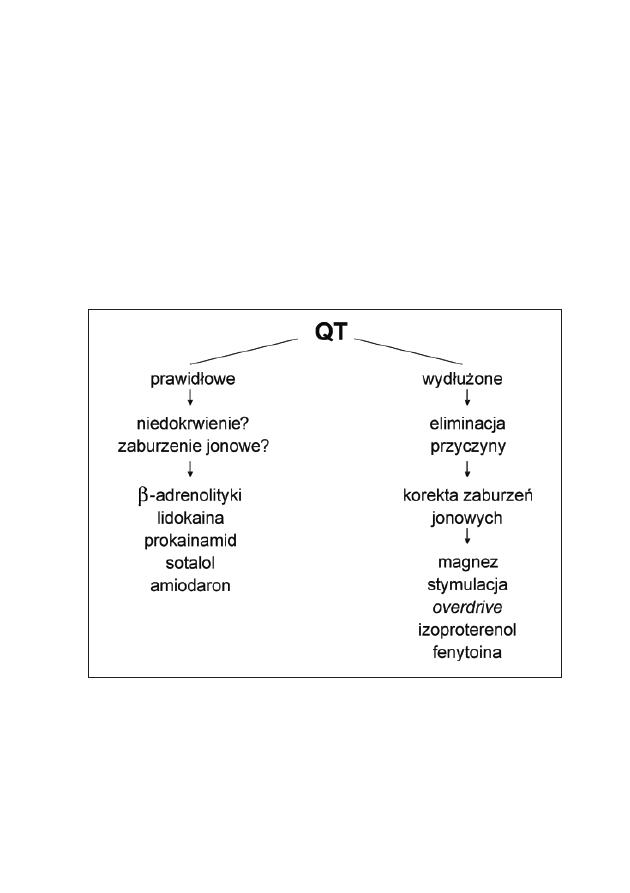
Wielokształtny częstoskurcz komorowy wymaga przerwania defibrylacją
elektryczną. Wystąpienie wielokształtnego VT jest wskazaniem do profilak-
tycznego leczenia antyarytmicznego przez okres od 6 do 24 godzin. Należy
jednocześnie pamiętać o usunięciu możliwych pozawieńcowych przyczyn
arytmii, takich jak zaburzenia gospodarki wodno-elektrolitowej czy kwasica
metaboliczna. Wielokształtny VT stanowi większe zagrożenie niż częstoskur-
cze jednokształtne, wynika bowiem z nałożenia się kilku przyczyn zdolnych
wyzwolić arytmię komorową. Równocześnie proces stabilizacji rytmu serca
wymaga kilku czy kilkunastogodzinnego okresu czasu dla wyrównania kwa-
sicy metabolicznej, czy też ustąpienia proarytmicznego działania leków, któ-
re to zdarzenia dodatkowo mogą powikłać przebieg ostrego zespołu wień-
cowego.
• Dawkowanie lidokainy w leczeniu złożonych komorowych zaburzeń
rytmu serca
Wstępny bolus w dawce 1-1,5 mg/kg masy ciała, następnie dodatkowe
wstrzyknięcia do łącznej dawki 3 mg/kg m.c. Wlew podtrzymujący w dawce
2-4 mg/min (30-50 µg/kg m.c./min). Chorzy ze współistniejącą niewydolno-
Rycina 7: Schemat leczenia wielokształtnego częstoskurczu komorowego
61
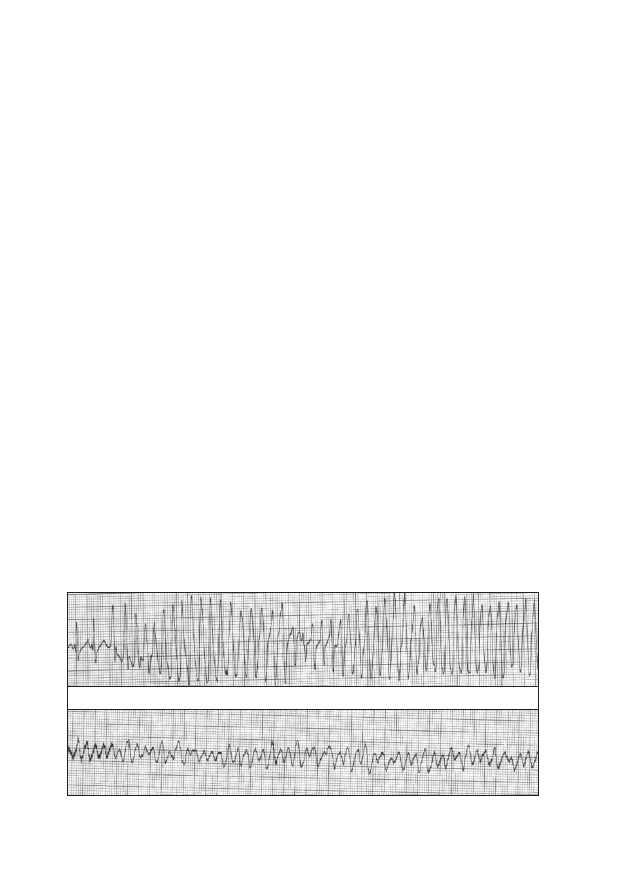
ścią serca, w podeszłym wieku oraz z niewydolnością wątroby powinni otrzy-
mywać zredukowane dawki lidokainy.
• Dawkowanie amiodaronu w leczeniu złożonych komorowych zaburzeń
rytmu serca
Początkowo bolus 150 mg dożylnie w ciągu 10 minut, następnie z prędkością
1 mg/min przez 6 godzin, potem wlew podtrzymujący w dawce 0,5 mg/min.
Obecnie przyjmuje się, że dawka nasycająca w leczeniu amiodaronem
w pierwszej dobie leczenia nie powinna przekraczać 1200 mg.
Migotanie komór
Migotanie komór to rytm serca, który nie jest w stanie wyzwolić skutecz-
nej sekwencji skurczu komór i poprzez całkowitą nieskuteczność hemody-
namiczną jest najczęstszą przyczyną nagłego zatrzymania krążenia w ostrym
zawale serca (3-10%). Jest to najczęstsze powikłanie w pierwszych 12 go-
dzinach zawału. Wagę zagrożenia wynikającego z wystąpienia VF ilustruje
statystyka, według której migotanie komór odpowiada aż za 85-90% zgo-
nów w okresie przedszpitalnym i we wczesnym okresie szpitalnym. Jednak
pierwotne VF nie stanowi czynnika ryzyka nagłego zgonu sercowego wśród
pacjentów po przebytym zawale serca. Natomiast jak wykazano, wtórne VF,
występujące po 48 godzinie od wystąpienia zachorowania, wskazuje na du-
że zagrożenie nagłym zgonem sercowym (śmiertelność do 30% w pierw-
szym roku obserwacji). Leczeniem z wyboru jest natychmiastowe wykona-
nie defibrylacji elektrycznej oraz prowadzenie zapobiegawczego leczenia
antyarytmicznego, tak jak w przypadku wystąpienia częstoskurczu komoro-
wego.
Rycina 8: Migotanie komór
62
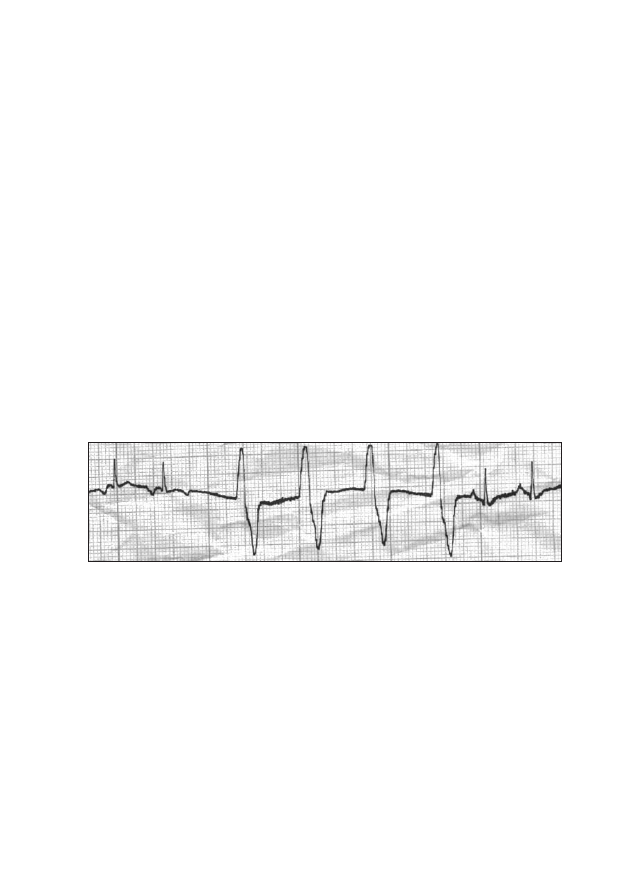
Przeprowadzenie skutecznej defibrylacji w pierwszych 30 sekundach od
wystąpienia migotania komór nie wymaga zwykle podjęcia pełnej reanima-
cji, manifestacja kliniczna zdarzenia ogranicza się bowiem do objawów ze-
społu MAS (zasłabnięcie, chwilowa utrata przytomności, drgawki, prężenia,
porażenie funkcji zwieraczy). Wystarczające jest zapewnienie drożności dróg
oddechowych, aby nie dopuścić do zapadania tylnej ściany gardła (rękoczyn
Esmarcka) oraz być może krótkotrwała wentylacja workiem AMBU przez
maskę twarzową, przy zachowanej skutecznej hemodynamicznie czynności
serca (obecne tętno na tętnicach udowych) do momentu odzyskania przy-
tomności i samodzielnej, wydolnej czynności oddechowej. W innym przy-
padku pacjent wymaga podjęcia kompleksowych działań resuscytacyjnych.
Przyspieszony rytm komorowy
Przyspieszony rytm komorowy należy do zaburzeń rytmu pojawiających
się najczęściej w ostrej fazie zawału. Jest to forma złożonych komorowych
zaburzeń rytmu serca, która nie wymaga leczenia, jeżeli zapewnia skuteczną
hemodynamicznie czynność serca. Jest to rytm generowany przez ektopo-
wy ośrodek bodźcotwórczy zlokalizowany w obrębie komór, o częstości
60-100/min, rzadziej do 120/min.
Przyspieszony rytm komorowy występujący u pacjentów z ostrym zawałem
mięśnia sercowego leczonych fibrynolitycznie lub za pomocą pierwotnej an-
gioplastyki jest traktowany jako marker reperfuzji naczynia odpowiedzial-
nego za tworzące się uszkodzenie. W sporadycznych przypadkach może pro-
wadzić do interferencji z rytmem zatokowym, prowokując pobudzenia
komorowe typu R/T. Z praktycznego punktu widzenia ważne jest odróżnie-
nie przyspieszonego rytmu komorowego od częstoskurczu komorowego
(różnicująca jest częstość rytmu serca).
Tachyarytmie nadkomorowe
Nie tylko złożone komorowe zaburzenia rytmu serca mogą stanowić za-
grożenie dla pacjentów z ostrymi zespołami wieńcowymi. Tachyarytmie nad-
Rycina 9: Przyspieszony rytm komorowy
63

komorowe z szybką czynnością komór, takie jak migotanie i trzepotanie
przedsionków czy częstoskurcz nadkomorowy, mogą być również czynnikiem
prowadzącym do niestabilności wieńcowej, wobec zwiększenia zapotrzebo-
wania mięśnia sercowego na tlen, z pogłębieniem niedokrwienia mięśnia ser-
cowego, nierzadko przekraczając ograniczoną rezerwę przepływu wieńco-
wego. Migotanie przedsionków pojawiające się u pacjentów z rozległym
zawałem serca może stanowić wyraz szybko narastającej niewydolności ser-
ca. Z tego powodu wystąpienie migotania przedsionków w ostrej fazie za-
wału serca jest niezależnym, niekorzystnym czynnikiem rokowniczym. Po-
nadto napad migotania przedsionków prawie trzykrotnie (z 0,6% do 1,7 %)
zwiększa ryzyko wystąpienia powikłań zatorowych, występujących w pierw-
szych 4 dobach zawału serca. Napady migotania przedsionków z wolną czyn-
nością komór, choć nie wymagają leczenia, mogą w konsekwencji powodo-
wać spadek rzutu minutowego nawet o 20-30%. Wynika to z utraty rytmu
zatokowego, pogorszenia funkcji skurczowej lewej komory w przebiegu
ostrego zawału serca oraz nierzadko – z towarzyszącego zjawiska ogłuszenia
mięśnia sercowego. Na podstawie prowadzonych rejestrów ocenia się, że mi-
gotanie przedsionków występuje u 10-16% chorych z ostrym zawałem ser-
ca. Jeśli wystąpi migotanie przedsionków z szybką czynnością komór, jed-
nak bez zaburzeń hemodynamicznych, należy uzyskać zwolnienie czynności
serca bądź powrót rytmu zatokowego. W tej sytuacji lekami z wyboru są le-
ki beta-adrenolityczne lub amiodaron. Jeżeli w konsekwencji napadu migo-
tania przedsionków z szybką czynnością komór (140-200/min) dochodzi do
załamania hemodynamicznego, szybkiego narastania niewydolności serca
lub objawów niestabilności wieńcowej, to leczeniem z wyboru pozostaje kar-
diowersja elektryczna.
Zaburzenia przewodzenia w ostrych zespołach wieńcowych
Osobnym problemem wikłającym przebieg ostrych zespołów wieńcowych
są zaburzenia przewodzenia. Bradykardia zatokowa występuje u 25-40%
chorych z ostrym zawałem serca, najczęściej przy lokalizacji obejmującej
ścianę dolną i tylną. Wynika to z unaczynienia układu bodźcotwórczoprze-
wodzącego z dorzecza prawej tętnicy wieńcowej. Bradykardii może towarzy-
szyć spadek ciśnienia tętniczego w wyniku reakcji wazowagalnej w następ-
stwie odruchu Bezolda-Jarischa. Leczenie polega na stosowaniu atropiny
w dawkach podzielonych. Blok przedsionkowo-komorowy I stopnia występu-
je rzadziej niż w 15% przypadków ostrych zawałów serca. Nie wymaga żad-
nego postępowania leczniczego.
Blok przedsionkowo-komorowy II stopnia występuje rzadziej niż w 10%
ostrych zawałów serca, najczęściej w przypadku ostrego zawału ściany dolnej.
64

W przypadku bloku przedsionkowo-komorowego II stopnia, typu perio-
dyki Wenckebacha (Mobitz I) wystarczającym postępowaniem jest monito-
rowanie czynności serca. Kolejnym stopniem zaawansowania bloku przed-
sionkowo-komorowego jest blok II stopnia, typu Mobitz II, najczęściej
towarzyszący zawałom ściany przedniej, choć występuje tylko w 1% wszyst-
kich zawałów serca. Wystąpienie zaburzeń przewodzenia o tym charakterze
stanowi wskazanie do założenia elektrody do czasowej stymulacji serca. Wy-
stępowanie zaawansowanego bloku przedsionkowo-komorowego III stop-
nia spotyka się w około 5% ostrych zawałów serca. Najczęściej dotyczy to
zawałów ściany dolnej. Ten rodzaj zaburzeń przewodzenia jest podstawo-
wym wskazaniem do czasowej stymulacji serca.
PODSUMOWANIE
Ten krótki przewodnik po zaburzeniach rytmu i przewodzenia, stanowią-
cych najczęstsze powikłania ostrych zespołów wieńcowych, nie wyczerpuje
w pełni rozległego tematu. Pozwala jednak zorientować się w zasadach po-
stępowania antyarytmicznego w ostrym okresie niestabilnej dusznicy bole-
snej czy zawału serca. Należy pamiętać, że najważniejszym leczeniem anty-
arytmicznym jest leczenie przyczynowe ostrych zespołów wieńcowych
(angioplastyka tętnic wieńcowych dla wszystkich OZW troponinododatnich
bądź leczenie fibrynolityczne dla OZW z uniesieniem odcinka ST). Jakkol-
wiek sama reperfuzja niesie ze sobą, o czym wspomniano wcześniej, ryzyko
groźnych dla życia zaburzeń rytmu serca, to jest ono jednak niewspółmiernie
małe w stosunku do ryzyka zgonu w sytuacji, gdy reperfuzji nie uzyskamy.
Ważne jest również to, że reperfuzję uzyskuje się w warunkach maksymal-
nej możliwej kontroli, a więc w OIOK i Pracowniach Hemodynamicznych.
Leczeniem, jedynie o nieznacznie mniejszym znaczeniu i równie ściśle zwią-
zanym z reperfuzją, jest terapia mająca na celu stworzenie optymalnych wa-
runków hemodynamicznych dla pracy chorego serca (azotany, leki beta-adre-
nolityczne, leki przeciwpłytkowe, leki kardioprotekcyjne). Dopiero na trzecim
miejscu należy wymienić leczenie antyarytmiczne, przy użyciu leków, które
mają wpływ na pobudliwość błony komórkowej, na przebieg potencjału
czynnościowego miocytów czy też przewodzenie bodźca. O ile dwa pierwsze
sposoby terapii można nazwać leczeniem przyczynowym, to stosowanie le-
ków antyarytmicznych stanowi jedynie postępowanie objawowe, jednak nie-
zastąpione w stanach zagrożenia życia.
Szerszego omówienia wymaga strategia leczenia antyarytmicznego u pacjen-
tów po przebytym zawale serca czy też z krytycznymi zwężeniami tętnic wień-
cowych, lecz te zagadnienia przekraczają ramy niniejszego opracowania.
65

Zapamiętaj!
1. Komorowe zaburzenia rytmu serca są jednym z objawów ostrych zespołów
wieńcowych.
2. Komórkowym mechanizmem odpowiedzialnym za występowanie komoro-
wych zaburzeń rytmu jest niejednorodność fazy pobudzenia miocytów pro-
wadząca do powstania fali re-entry.
3. Ze względu na wysokie ryzyko wystąpienia złożonych komorowych zabu-
rzeń rytmu serca w przebiegu OZW pacjent wymaga stałego monitorowania
czynności serca w warunkach OIOK.
4. Leczenia wymagają złożone komorowe zaburzenia rytmu serca, takie jak:
nieutrwalony częstoskurcz komorowy (nsVT), utrwalony częstoskurcz ko-
morowy (VT) oraz migotanie komór (VF).
5. Leczenie należy rozpocząć od usunięcia odwracalnych przyczyn sprzyjających
wystąpieniu komorowych zaburzeń rytmu serca (hipokaliemia, kwasica).
6. Złożone komorowe zaburzenia rytmu serca prowadzące do załamania he-
modynamicznego wymagają natychmiastowego leczenia kardiowersją (VT)
lub defibrylacją (VF).
7. Lekami z wyboru w farmakoterapii złożonych komorowych zaburzeń rytmu
serca w OZW są lidokaina i amiodaron.
8. W ostrych zespołach wieńcowych wystąpienie zaburzeń przewodzenia pod
postacią bloku przedsionkowo-komorowego II i III stopnia wymaga zabez-
pieczenia czasową stymulacją endokawitarną.
Warto przeczytać:
A. Beręsewicz: Komórkowe mechanizmy zaburzeń rytmu serca. Nowa Klini-
ka 1996; 3: 481-491.
W. Rydlewska-Sadowska: Zaburzenia rytmu serca. PZWL, Warszawa 1985.
M. Dłużniewski (red.): Zaburzenia rytmu serca. Fundacja „Dla Serca”,
Warszawa 1997.
A. Bayes de Luna: Elektrokardiografia kliniczna. Via Medica, Gdańsk 1999.
66
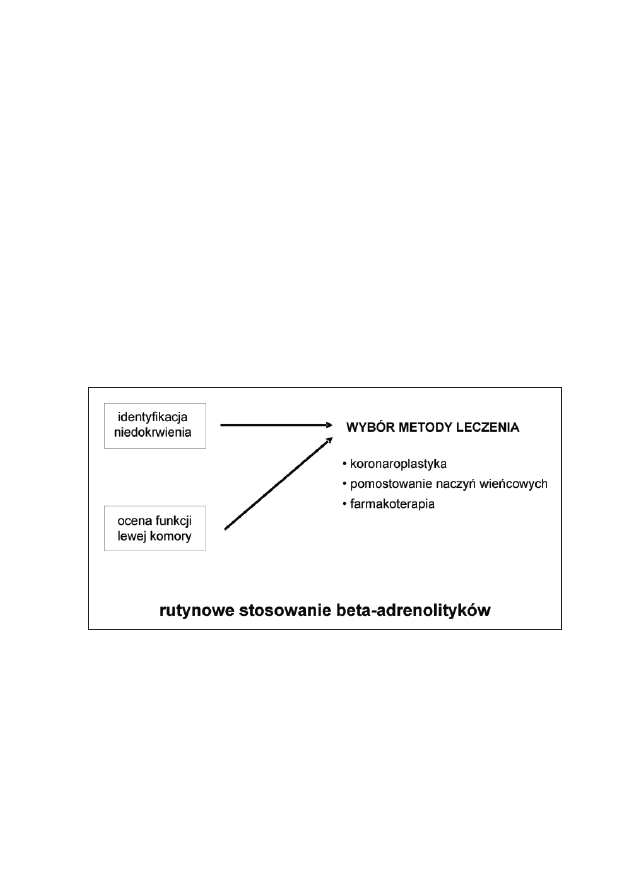
VI.
KOMOROWE ZABURZENIA RYTMU SERCA W STA-
BILNEJ CHOROBIE WIEŃCOWEJ
Jarosław Król, Monika Tomaszewska-Kiecana
Wśród potencjalnych przyczyn komorowych zaburzeń rytmu niedokrwie-
nie występuje najczęściej ze względu na rozpowszechnienie choroby niedo-
krwiennej serca. Migotanie komór i związana z nim nagła śmierć sercowa to
najważniejsze powikłania zawału serca i ostrej niewydolności wieńcowej. Te
ostre stany kliniczne wciąż bywają pierwszym objawem choroby. Ostre, prze-
dłużające się niedokrwienie powoduje zaburzenia jonowe polegające na nie-
doborze jonów potasu w komórkach oraz wzroście stężenia jonów potasu
w przestrzeni zewnątrzkomórkowej w obszarze zaopatrywanym przez za-
mkniętą tętnicę wieńcową. Skutkiem tych zaburzeń jest upośledzenie roz-
przestrzeniania się pobudzenia w tkance objętej martwicą i niejednorodność
elektryczna mięśnia sercowego, co ułatwia powstawanie ognisk pobudzeń
ektopowych w komorach najczęściej w mechanizmie re-entry.
Współczesne metody leczenia zawału serca, polegające na udrożnieniu
„dozawałowej” tętnicy wieńcowej, spowodowały zmiany w przebiegu tej cho-
roby. Szpitalna faza leczenia ostrego zawału serca trwa teraz znacznie kró-
cej, coraz częściej chory dzięki szybkiej interwencji na naczyniach wieńco-
wych może powrócić do wykonywanej przed zawałem pracy zawodowej.
Postęp w diagnostyce i leczeniu choroby niedokrwiennej serca spowodował
istotny wzrost liczby pacjentów leczonych przewlekle przez wiele lat, często
do późnej starości. Chorzy ze stabilną chorobą wieńcową to według klasyfi-
kacji Kanadyjskiego Towarzystwa Kardiologicznego (Canadian Cardiovascu-
Rycina 1: Arytmia w stabilnej chorobie wieńcowej, postępowanie pierwszoplanowe
67
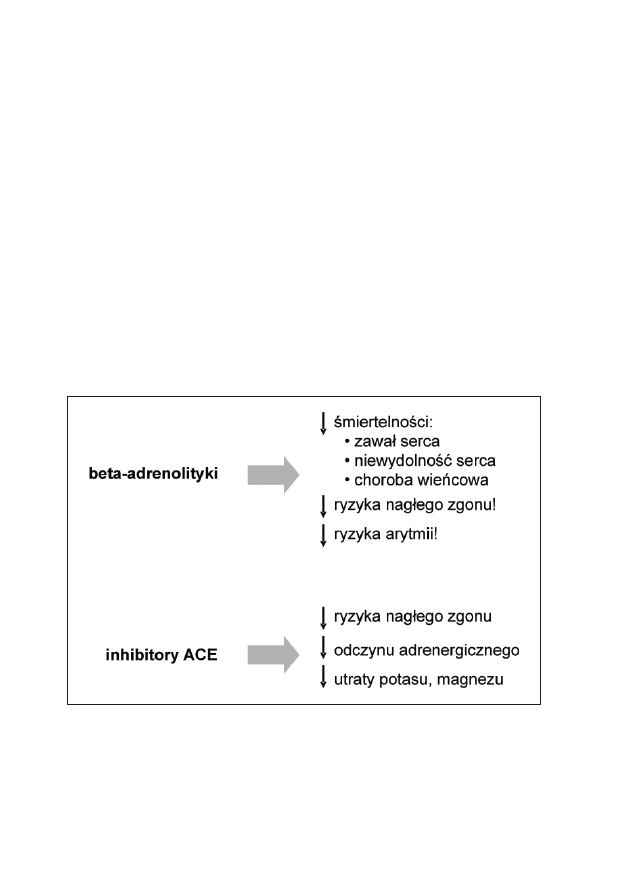
lar Society, CCS) chorzy z dolegliwościami dławicowymi występującymi
w przewidywalnych warunkach, pod wpływem wysiłku, stresu, zimna, w okre-
ślonych porach dnia. O stabilności świadczy niezmienne, w dłuższym czasie,
natężenie dolegliwości i skuteczność stosowanych objawowo azotanów. Kla-
syfikacja CCS obejmuje cztery klasy. O pacjentach stabilnych można mówić,
gdy spełniają kryteria klas I-III i w ostatnim czasie nie przeszli z klasy niższej
do wyższej.
Coraz rzadziej spotyka się obecnie klasyczne powikłania zawału, takie jak
bloki przedsionkowo-komorowe powodujące konieczność stosowania cza-
sowej stymulacji komór oraz groźne komorowe zaburzenia rytmu. Rutynowe
dziś postępowanie farmakologiczne, które polega na stosowaniu kwasu ace-
tylosalicylowego i leków przeciwpłytkowych, leków beta-adrenolitycznych,
inhibitorów enzymu konwertującego angiotensynę oraz statyn, już od pierw-
szych dni zawału korzystnie wpłynęło na rokowanie w fazie wczesnej, jak
i odległej. Udokumentowano wpływ wymienionych leków na śmiertelność
ogólną, a także na częstość występowania nagłych zgonów, co wskazuje na
ich pośrednie działanie antyarytmiczne.
Według wielokrotnie cytowanej klasyfikacji zaburzeń rytmu zapropono-
wanej przez Biggera, ta grupa chorych to pacjenci z potencjalnie groźnymi
komorowymi zaburzeniami rytmu. Grupa, o której mówi się, że jest nie tylko
największa, ale niejednorodna, w której znajdują się chorzy z zaawansowany-
Rycina 2: Korzystne efekty podawania beta-adrenolityków i ACE-inhibitorów w komorowych
zaburzeniach rytmu
68
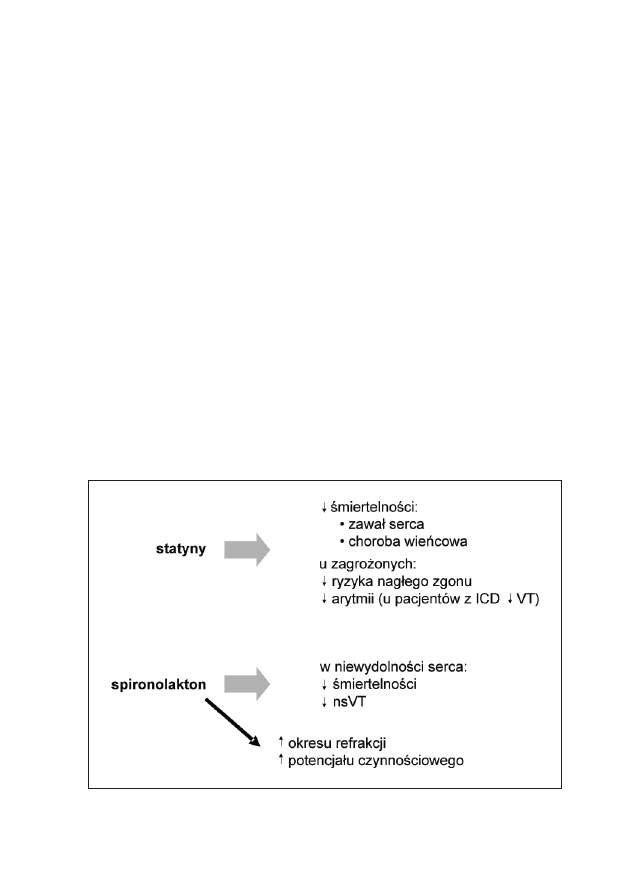
mi chorobami serca, często z licznymi czynnikami ryzyka, takimi jak nadci-
śnienie tętnicze, cukrzyca, otyłość i palenie papierosów. Jak zawsze najsku-
teczniejsze leczenie to leczenie przyczynowe. Leczenie czynników ryzyka jest
równie istotne, jak leczenie samej choroby serca. W grupie chorych ze stabil-
ną choroba wieńcową leczenie to polega na takim prowadzeniu chorego, aby
nie doszło do zaostrzenia niewydolności wieńcowej, gdyż w stanach ostrych
zaburzenia rytmu przestają być potencjalnie złośliwe, a zaczynają stanowić
zagrożenie życia.
Wyniki kolejnych obserwacji klinicznych wykazują u pacjentów ze stabilną
chorobą wieńcową, podobnie jak w ostrym zawale serca, że stosowanie le-
ków, które mają nie tylko hemodynamiczne działanie na krążenie wieńco-
we, ale istotnie ochronnie wpływają na śródbłonek naczyń, stabilizują blasz-
kę miażdżycową, skutecznie redukują częstość nagłych zgonów. Doniesienia
o korzystnym działaniu inhibitorów konwertazy, leków beta-adrenolitycz-
nych i statyn uzupełniają wyniki badania RALES wykazujące podobne ko-
rzystne efekty spironolaktonu u chorych z niewydolnością serca. A pamię-
tać należy, że niewydolność serca w wieku podeszłym, który coraz częściej
osiągają chorzy z chorobą niedokrwienną serca, bardzo niekorzystnie wpły-
wa na rokowanie. Objawy niewydolności serca i komorowe zaburzenia rytmu
powodują znaczny wzrost ryzyka nagłego zgonu i dlatego tak ważne jest od-
krycie tego nowego wskazania do stosowania starego leku.
Rycina 3: Korzystne efekty podawania statyn i spironolaktonu w komorowych zaburzeniach
rytmu
69

Zakwalifikowanie chorego do grupy ze stabilną chorobą wieńcową nie
zwalnia z obowiązku okresowej oceny stanu chorego. Poza badaniem
klinicznym i bardzo dokładnym zbieraniem wywiadu, należy kontrolo-
wać podstawowe wskaźniki biochemiczne, takie jak morfologia krwi ob-
wodowej, stężenie cholesterolu, kreatyniny, glikemii oraz jonów sodu,
potasu i magnezu. Każde zaburzenia biochemiczne mogą pośrednio
wpłynąć na wystąpienie zaburzeń rytmu. Spoczynkowe badanie EKG,
chociaż mało przydatne w ocenie zaburzeń rytmu, jest rutynowym bada-
niem podczas wizyt kontrolnych. Badanie echokardiograficzne powinno
być wykonane przy każdej zmianie stanu klinicznego chorego, dostarcza
ono informacji o istnieniu morfologicznych zmian w sercu, zaburzeniach
kurczliwości, przeroście lewej komory czy dysfunkcji zastawkowej, które
mogą stać się tzw. substratem arytmii. Monitorowanie ambulatoryjne
EKG metodą Holtera zajmuje wśród badań chorych z zaburzeniami ryt-
mu miejsce najważniejsze. Badanie to wykonuje się w celu oceny wstęp-
nej zaburzeń rytmu, a następnie w celu kontroli skuteczności postępo-
wania leczniczego.
Komorowe zaburzenia rytmu w prostych formach, sporadycznych poje-
dynczych pobudzeń dodatkowych, występują u około 60% zdrowych osób.
Natomiast u chorych z chorobą niedokrwienną serca rejestrowane są aż
w 90% przypadków. Zwykle nie są to zaburzenia wymagające ostrej inter-
wencji, doraźnego stosowania leczenia farmakologicznego lekami antyaryt-
micznymi. Obowiązuje tu zasada niestosowania leków klasy I wg Vaughana-
-Williamsa. Do dyspozycji pozostają leki klasy II (beta-adrenolityki), a gdy to
nie daje efektu, pomimo optymalnego leczenia choroby podstawowej, także
klasy III (amiodaron lub sotalol). Wszystkie zastrzeżenia dotyczące farmako-
logicznego leczenia zaburzeń rytmu są szczególnie istotne u chorych z choro-
bą niedokrwienną serca.
Czasem jednak w tej grupie chorych rejestruje się złożone arytmie komo-
rowe wywołane niedokrwieniem, o czym świadczy ich związek z typowymi
zmianami odcinka ST. Niekiedy niedokrwienie nie wywołuje dolegliwości
bólowych i wtedy odczuwane przez pacjenta kołatanie serca może być ekwi-
walentem bólu wieńcowego. Zdarza się także podczas testu wysiłkowego, że
przyczyną zakończenia badania są komorowe zaburzenia rytmu, nie odczu-
wane przez chorego, pojawiające się jeszcze przed wystąpieniem bólu lub
zmęczenia. Każda złożona arytmia komorowa związana z niedokrwieniem
jest wskazaniem do pilnej koronarografii. Zabieg poprawiający przepływ
w zwężonej tętnicy wieńcowej może być zabiegiem zapobiegającym nagłemu
zgonowi.
70
Przebieg testu wysiłkowego, jaki pokazano powyżej, zobowiązuje do wy-
konania koronarografii w trybie pilnym, a po zabiegu na tętnicach wieńco-
wych koniecznie należy powtórzyć test, aby ocenić, czy usunięto rzeczywistą
przyczynę zaburzeń rytmu. Wynik testu po interwencji wieńcowej powinien
wykazać lepszą tolerancję wysiłku, a wysiłek nie powinien powodować wy-
stąpienia arytmii.
Chorzy ze stabilną niewydolnością wieńcową rzadko mają wskazania do
wykonania badań elektrofizjologicznych. Istnieją jednak sytuacje, gdy zabu-
Rycina 4: Komorowe zaburzenia rytmu nasilające się w trakcie testu wysiłkowego:
a) pary pobudzeń komorowych na początku testu;
b) seria pobudzeń komorowych w kolejnej minucie testu
a)
b)
71

rzenia rytmu wykazują oporność na leczenie farmakologiczne, wówczas wy-
konuje się te badania, aby zakwalifikować pacjenta do wszczepienia kardio-
wertera-defibrylatora lub do zabiegu ablacji.
Zapamiętaj!
1. Komorowe zaburzenia rytmu rejestrowane u chorych ze stabilną chorobą
wieńcową zwykle zaliczane są do potencjalnie złośliwych, ale w okresie za-
ostrzenia choroby podstawowej stanowią zagrożenie życia.
2. Złożona arytmia komorowa związana z niedokrwieniem świadczy o zagro-
żeniu nagłym zgonem, wymaga pilnie badania koronarograficznego, a za-
bieg na tętnicach wieńcowych może być przyczynowym leczeniem zaburzeń
rytmu.
3. Stosowane rutynowo w chorobie niedokrwiennej serca leki beta-adrenoli-
tyczne, inhibitory konwertazy, statyny, a także spironolakton to grupy leków,
wykazujące skuteczność w przeciwdziałaniu nagłym zgonom sercowym.
Warto przeczytać:
T. H. Lee: Management of chronic ischemic heart disease. Heart disease.
A textbook of cardiovascular medicine. 6th edition. A Harcourt Health
Sciences Company 2001.
Przewlekła choroba niedokrwienna serca. Część 1, 2. ACCSAP (Kardiologia
Kliniczna Dorosłych – Program Samokształcenia); ACC, AHA (wydanie
polskie pod patronatem PTK).
Scandinavian Simvastatin Survival Study Group: Randomised trial of cho-
lesterol lowering in 4444 patients with coronary heart disease. Lancet 1994,
344: 1383-1389.
M. Accad, A. D. Michaels: Postępowanie po zawale mięśnia sercowego.
Current Treatment Options in Cardiovascular Medicine 2002, 4: 41-54.
Kardiologia po Dyplomie 2002, 1: 3: 8-21.
72
VII. ZABURZENIA RYTMU W NIEWYDOLNOŚCI SERCA
Edmund Szczepańczyk, Mirosław Dłużniewski
Niewydolność serca (NS) jest heterogennym zespołem chorobowym o róż-
norodnej etiologii – obejmuje pierwotne schorzenia mięśnia sercowego, jak
kardiomiopatię rozstrzeniową, następstwa choroby niedokrwiennej serca
i przerostu mięśnia sercowego (zwłaszcza w nadciśnieniu tętniczym), patolo-
gie zastawkowe, zapalenia mięśnia sercowego i inne. NS jest poważną dia-
gnozą, obciążoną wysoką śmiertelnością (50% w ciągu 5 lat). Zgon w NS ma
najczęściej charakter zgonu nagłego, u podłoża którego istnieją często po-
ważne zaburzenia rytmu serca.
Zaburzenia rytmu serca, często towarzyszące jego niewydolności, zwłasz-
cza przewlekłej i progresywnej – same w sobie mogą nasilać jego niewydol-
ność. Przykładem niech będą chociażby migotanie przedsionków czy kardio-
miopatia tachyarytmiczna.
Niewydolność serca to nie tylko upośledzenie jego funkcji mechanicz-
nej, ale również progresywny proces prowadzący do jego dysfunkcji elek-
trycznej.
Istnieje cały szereg dowodów, uzyskanych w trakcie badań elektrofizjolo-
gicznych na modelu zwierzęcym, ale i u ludzi (materiał uzyskany w trakcie
przeszczepu serca) na to, że w niewydolnym sercu powstaje wiele sytuacji
arytmogennych.
Nie ma specyficznego rodzaju zaburzeń rytmu serca dla niewydolności ser-
ca. Wydawać by się mogło, że w zaawansowanej NS, podobnie jak w pozawa-
Rycina 1: Zależność niewydolności serca i zaburzeń rytmu
73
łowym jego uszkodzeniu, częstą przyczyną zgonów jest przetrwały często-
skurcz komorowy i migotanie komór.
Oceniano np. pacjentów z niewydolnością serca, którzy mieli nagłe zatrzy-
manie krążenia (NZK) i byli skutecznie reanimowani. U ok. 60% stwierdzo-
no właśnie te najpoważniejsze zaburzenia rytmu serca. Jednakże, prawie
u 40% tych pacjentów stwierdzono bradykardię lub rozkojarzenie elektro-
mechaniczne.
Tabela 1: Czynniki promujące groźne zaburzenia rytmu serca w jego niewydolności
ANATOMICZNE
• dysfunkcja komory;
• rozstrzeń jam serca;
• tętniak;
• przerost mięśnia.
STRUKTURALNE
• różnego rodzaju zmiany zwyrodnieniowe;
• złogi amyloidu;
• rozplem tkanki łącznej;
• apoptoza komórek m. sercowego;
• zmiany bliznowate (mięsień „zraniony”).
HEMODYNAMICZNE
• rozciągnięcie jam serca (hiperwolemia);
• wzrost naprężenia ścian.
JATROGENNE
• leki inotropowo dodatnie;
• naparstnica;
• diuretyki
• leki antyarytmiczne (zjawisko proarytmii).
CZYNNIKI
WSPÓŁDZIAŁAJĄCE
• niedokrwienie mięśnia sercowego;
• zaburzenia jonowe:
– hipokaliemia,
– hipomagnezemia.
• przeładowanie cytozolu wapniem;
• wzrost stężenia sercowego
katecholamin;
• aktywacja adrenergiczna
i układu R-A-A;
• redukcja napięcia parasympatycznego.
74

W niewydolności serca obserwuje się zaburzenia dyslokacji jonowej i zwią-
zane z tym zmiany elektrofizjologiczne mięśnia sercowego:
Nie wiadomo dotąd, które z tych zmian mają charakter adaptacji do nie-
wydolności serca, a które są niekorzystne, prowadzące m.in. do arytmii.
W niewydolności serca, bardziej niż w chorobie niedokrwiennej, zazna-
cza się wpływ zaburzonej hemodynamiki, jako czynnika generującego
arytmię.
Wymienione wyżej czynniki, zwłaszcza element rozciągnięcia jam i wzrostu
napięcia ścian serca (stałe elementy zastoinowej NS), są wręcz substratami
arytmii. Wykazano np. że wzrost ciśnienia późnorozkurczowego (jeden z naj-
lepszych wskaźników stopnia NS) przekłada się liniowo na skracanie refrak-
cji komórek mięśnia sercowego.
Z kolei różnorakie zmiany strukturalne, związane z przebytą martwicą,
zwyrodnieniem spowodowanym starzeniem się serca, a zwłaszcza przerost
mięśnia (przybytek masy mięśniowej, rozrost zrębu, przyrost kolagenu), pro-
wadzą do mozaiki współistnienia obszarów o różnorodnej aktywacji elek-
trycznej (zwłaszcza przedłużonej), fragmentaryzacji pobudzenia itp. Wszyst-
ko to usposabia do powstania arytmii.
Do tego niezwykle istotnym w stwarzaniu sytuacji arytmogennych jest ak-
tywacja układu adrenergicznego i układu R-A-A w niewydolności serca i to
na wszystkich jej etapach. Zwiększone zaś uwalnianie sercowe katecholamin
prowadzi bezpośrednio do uruchomienia (wzrostu stężenia) wolnych kwa-
sów tłuszczowych (WKT).
Znany jest efekt destabilizacyjny WKT na błony komórkowe, zmieniający
ich właściwości elektryczne (tzw. efekt detergentowy). Przekłada się to na
inicjowanie groźnych zaburzeń rytmu serca.
• wydłużenie czasu trwania pobudzenia mięśnia komór (zjawisko
podobne do zespołu wydłużonego QT);
• redukcję fazy 1 pobudzenia;
• zmianę ekspresji wymiennika jonowego Na
+
/Ca
2+
;
• wzrost stężenia wewnątrzkomórkowego Ca
2+
(co jest zjawiskiem
arytmogennym poprzez aktywację zależnych od wapnia procesów
w komórce), np. poprzez aktywację zależnej od wapnia kinazy
kalmodulinowej (CaM-kinazy) przy przedłużającej się aktywacji
komór.
75
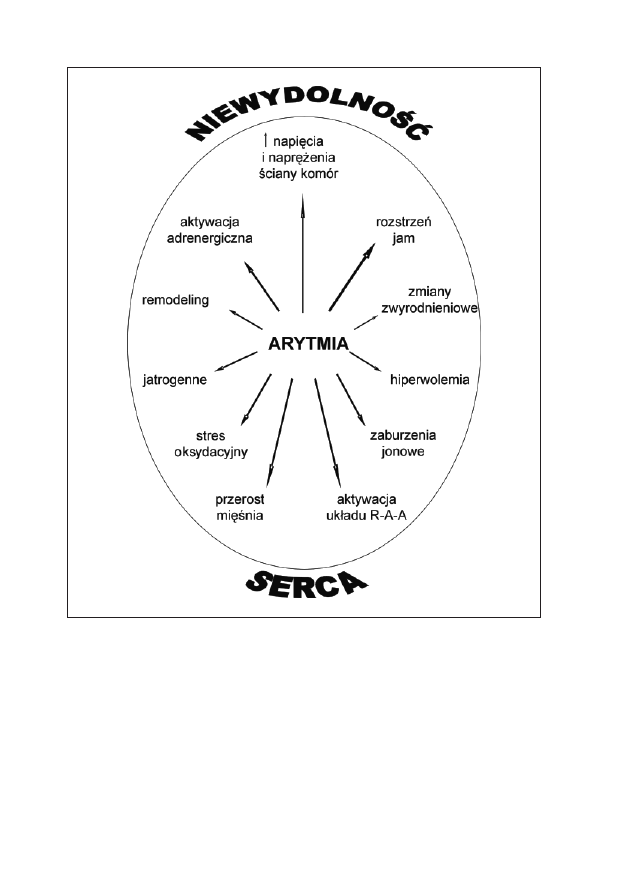
W zaawansowanej NS dochodzi często do downregulation i zmniejszenia
gęstości receptorów typu ß. Może to prowadzić do zmniejszenia potencjalnie
arytmogennej stymulacji beta-adrenergicznej z jednej strony, ale są sugestie,
że z kolei stymulacja receptorów ß jest potencjalnie arytmogenna.
Warto podkreślić, że niedokrwienie mięśnia sercowego (częsty czynnik pa-
togenetyczny prowadzący do NS i niezależnie od niej – do arytmii), może
ulec modyfikacji czy eliminacji, natomiast NS jest procesem o trudnym do
przewidzenia przebiegu.
Rycina 2: Relacje pomiędzy niewydolnością serca a arytmią (wspólne czynniki
patogenetyczne)
76

DIAGNOSTYKA ZABURZEŃ RYTMU SERCA W NIEWYDOLNOŚCI
SERCA
Stosuje się w zasadzie te same metody i techniki diagnostyczne, które są
używane dla oceny zaburzeń rytmu serca w innych schorzeniach:
Zmienność częstości serca dobrze koreluje z ogólną śmiertelnością w NS,
ale nie ma dużej specyficzności.
Filtrowany, wysokiej rozdzielczości zapis EKG dostarcza istotnych danych
o obecności tzw. późnych potencjałów (late potentials, LP), uznawanych za pew-
ne substraty arytmii. Podkreśla się ich znaczenie w większości przypadków
NS, zwłaszcza o etiologii niedokrwiennej czy pozapalnej, ale nie jest już ono
jednoznaczne w NS towarzyszącej pierwotnej kardiomiopatii rozstrzeniowej.
Z kolei programowana stymulacja komór ma istotne znaczenie w ocenie
zagrożenia arytmią u pacjentów z NS na tle miażdżycowym, ale też jest dys-
kredytowana w przypadkach kardiomiopatii rozstrzeniowej.
Nowe techniki wielopunktowego zapisu EKG (np. z 64 elektrod), a zwłasz-
cza wykorzystanie trójwymiarowego, przestrzennego mappingu nasierdzio-
wego i wewnątrzsercowego (z 142 do 232 punktów) pozwalają na stworzenie
swoistej mapy elektroanatomicznej arytmii.
Ostatnio, dzięki tym technikom wykazano, że pierwsze pobudzenia inicju-
jące częstoskurcze komorowe w niewydolnym sercu są bardzo często umiej-
scowione w warstwie podwsierdziowej. Mogą być indukowane zarówno
w mechanizmie re-entry, jak też i bez niego.
LECZENIE ZABURZEŃ RYTMU SERCA
W NIEWYDOLNOŚCI SERCA
Generalnie sprowadza się ono do:
• długotrwała rejestracja EKG;
• ocena zmienności rytmu serca;
• filtrowane EKG, wysokiej rozdzielczości;
• wielopunktowy nasierdziowy zapis EKG
• wielopunktowy, przestrzenny (trójwymiarowy)
zapis EKG;
• programowana stymulacja komór.
77

Szereg danych z badań klinicznych wskazuje, że najlepszym sposobem le-
czenia zaburzeń rytmu w NS jest sumienne, wielokierunkowe leczenie nie-
wydolności serca i przeciwdziałanie jej progresji.
Poprawa hemodynamiki w NS przekłada się bezpośrednio na zmniejszenie
zaburzeń rytmu serca. Wykazano np. że zmniejszenie ciśnienia zaklinowa-
nia w tętnicy płucnej i późnorozkurczowego oraz ciśnienia tętniczego syste-
mowego po wlewie NTG czy nitroprusydku sodu prowadzi do wyraźnego
ograniczenia arytmii. Trudniej jest wtedy wyzwolić częstoskurcz komorowy
w trakcie programowanej stymulacji komór.
Wiele prac podkreśla zależność liniową zaburzeń rytmu serca od geometrii
uszkodzonej lewej komory. Poprawa geometrii lewej komory w trakcie skur-
czu daje wyraźne zmniejszenie aktywności ektopowej komór, co znalazło po-
twierdzenie po stosowaniu ACE-I (m.in. badania V-HeFT).
Ciągle dyskutowana jest rola leków inotropowo dodatnich, a zwłaszcza na-
parstnicy o potencjalnie arytmogennym działaniu. Bezpieczeństwo jej sto-
sowania wiąże się z uprzednim wykluczeniem niedokrwienia, zaburzeń jo-
nowych, kwasicy oraz uwzględnienie jej synergistycznego działania
w połączeniu z innymi lekami. Należy jednak tutaj podkreślić znaczenie na-
parstnicy jako leku potencjalnie antyarytmicznego, szczególnie jeżeli chodzi
o arytmie nadkomorowe (np. migotanie przedsionków), zwłaszcza przy
obecności rozstrzeni jam serca i jego niewydolności.
Inne leki inotropowo dodatnie stosowane w NS, mogą z kolei indukować
groźne zaburzenia rytmu serca. Przykładem niech będzie milrinon (inhibi-
tor fosfodiesterazy PDE), gdzie w badaniu PROMISE obserwowano wzrost
śmiertelności związanej z groźnymi zaburzeniami rytmu i to pomimo dobro-
czynnego wpływu leku na hemodynamikę. Obiecujące są aktualnie kończą-
ce się badania nad zastosowaniem w NS innego inhibitora PDE – vesnari-
nonu, w trakcie których wykazano obniżenie śmiertelności i zaburzeń rytmu,
ale przy dawce 60 mg/dobę, a po przekroczeniu dawki 120 mg/dobę – ich
wzrost.
• adekwatnego leczenia niewydolności serca;
• rozważnego stosowania leków antyarytmicznych;
• eliminowania lub modyfikacji przejściowych substratów arytmii;
• działań zmniejszających napięcie układu adrenergicznego i R-A-A;
• poprawy metabolizmu komórkowego niewydolnego mięśnia
sercowego.
78

Przełomowym w ostatniej dekadzie stało się lepsze poznanie patomecha-
nizmów NS i wprowadzenie do jej terapii leków zmniejszających napięcie
układu adrenergicznego – leków beta-adrenolitycznych (LBA) oraz prze-
ciwdziałających aktywacji układu R-A-A (ACE-I, antagoniści aldosteronu).
Korzyści z zastosowania LBA w leczeniu niewydolności serca wykazano
w wielu znaczących badaniach: CIBIS II i III (bisoprolol), MERIT-HF (me-
toprolol), COPERNICUS (karwedilol) i innych. Uzyskano znaczącą reduk-
cję śmiertelności przekraczającą 30%.
LBA działają antyarytmicznie poprzez:
Trwają dyskusje nad ich skutecznością terapeutyczną, jeżeli chodzi o NS
i zaburzenia rytmu, w powiązaniu z ich właściwościami – kardioselektywno-
ścią, lipo- czy hydrofilnością. Wydaje się, uwzględniając wymienione wyżej
patomechanizmy zaburzeń rytmu w NS, że większe znaczenie w jej terapii
miałyby LBA o większej kardioselektywności i lipofilności. Z kolei niektóre
unikalne właściwości (wazodilatacyjne, przeciwzapalne, antyoksydacyjne)
nowych LBA, np. karwedilolu mogą dać jeszcze lepsze efekty. Wskazuje na
to metaanaliza 31 prac poświęconych zastosowaniu LBA mających właści-
wości rozszerzające naczynia – mogą one w większym stopniu niż LBA bez
tych właściwości ograniczać śmiertelność w NS, zwłaszcza tę, związaną
z groźnymi zaburzeniami rytmu serca.
Również ograniczenie aktywności układu R-A-A ma istotną rolę
w zmniejszaniu zaburzeń rytmu serca w jego niewydolności, na co wskazu-
je cały szereg danych z wielu badań klinicznych z zastosowaniem ACE-I
i antagonistów aldosteronu. Wykazano znaczne zmniejszenie zaburzeń ryt-
mu serca i ograniczenie śmiertelności u chorych z nasiloną niewydolnością
serca.
• bezpośredni wpływ na parametry elektrofizjologiczne;
• zmniejszenie napięcia nerwu błędnego;
• supresję pobudzeń dodatkowych;
• podwyższenie progu migotania komór;
• zapobieganie hipokaliemii związanej ze zwiększonym napięciem
układu współczulnego;
• przeciwdziałanie proarytmicznemu wpływowi katecholamin
(m.in. ograniczanie uwalniania WKT);
• poprawę perfuzji podwsierdziowej.
79

Należy dążyć do eliminacji przejściowych substratów arytmii pojawiają-
cych się w niewydolności serca:
LECZENIE ANTYARYTMICZNE ZABURZEŃ RYTMU SERCA
TOWARZYSZĄCYCH JEGO NIEWYDOLNOŚCI
Stosowanie leków antyarytmicznych (LAA) przy współistnieniu niewy-
dolności serca stwarza wiele problemów. Po pierwsze – w miarę progresji
dysfunkcji mięśnia sercowego spada efektywność LAA i to liniowo – w za-
leżności od stopnia jego niewydolności. Ponadto stosowanie LAA przy
współistnieniu niewydolności serca częściej wykazują niekorzystne efek-
ty:
Potwierdzeniem tego niech będą chociażby wyniki badań CAST (flecainid
vs placebo) czy SWORD (d-sotalol vs placebo), gdzie stwierdzono wzrost ry-
zyka zgonu u pacjentów ze znaczną dysfunkcją lewej komory (EF <40%)
po zastosowaniu tych leków.
Stwierdzono też, że pacjenci z niewydolnością serca otrzymujący LAA
grupy I (blokujące kanał sodowy) mają 3,7-4,7 razy większe ryzyko zgonu
sercowego (w tym śmierci arytmicznej) niż pacjenci bez niewydolności
serca.
• nasila się ich działanie inotropowo ujemne;
• częściej występuje proarytmia;
• częściej obserwuje się groźną bradyarytmię.
• niedokrwienia mięśnia sercowego (szybka poprawa perfuzji,
rewaskularyzacja);
• zaburzeń jonowych, zwłaszcza poprzez suplementację potasu
i magnezu;
• kwasicy i osłabienia przemian energetycznych poprzez
zastosowanie leków metabolicznych i związków
wysokoenergetycznych;
• przerostu mięśnia sercowego (stosowanie leków prowadzących
do regresji przerostu);
• wad zastawkowych poprzez korektę
kardiochirurgiczną.
80

Wykazano też (metaanaliza) istotną zależność skuteczności LAA od war-
tości frakcji wyrzutowej (EF). I tak:
W odniesieniu np. do propafenonu – to jego skuteczność przy obecności
tętniaka pozawałowego z niewydolnością serca wynosi tylko 9%, natomiast
przy braku tętniaka wzrasta do 44% (u takiego odsetka pacjentów stwierdza
się pozytywny efekt terapeutyczny).
Istotnym postępem w terapii groźnych zaburzeń rytmu serca towarzyszą-
cych jego niewydolności stało się wszczepianie kardiowerterów-defibrylato-
rów (implantable cardioverter-defibrillator, ICD). Porównanie tego sposobu
leczenia z tradycyjnym stosowaniem LAA (głównie z amiodaronem i d-sota-
lolem – badania MADIT, MUSTT, AVID, CIDS) wskazuje na znamienną
redukcję zgonów (średnio o 27%) w grupie z zastosowaniem ICD w stosun-
ku do pacjentów otrzymujących tylko LAA.
Uwzględniając powyższe – wszyscy pacjenci z niewydolnością serca i współ-
istniejącymi zaburzeniami rytmu powinni w pierwszej kolejności otrzymywać
wielokierunkową terapię niewydolności serca. Uznanymi elementami takiej
terapii są diuretyki, naparstnica, leki beta-adrenolityczne, ACE-I, spirono-
laktony.
Leczenie antyarytmiczne w niewydolności serca powinno być prowadzo-
ne ostrożnie w wyselekcjonowanych przypadkach. Nie powinno się stosować
LAA w arytmiach asymptomatycznych, stwierdzanych dość często, np. w ba-
daniach holterowskich.
• przy EF <30% – skuteczność LAA ocenia się na 36%;
• przy EF >30% – skuteczność LAA wzrasta do 64%.
Tabela 2: Bezpieczeństwo stosowania leków antyarytmicznych
LEKI
ANTYARYTMICZNE
RYZYKO ZGONU
WSKAŹNIK
I
↑
1,11
II (beta-adrenolityki)
↓
0,81
III (leki wydłużające
czas refrakcji)
↓
0,78
81

„Profilaktyczne” ich stosowanie w niewydolności serca również nie jest
wskazane. Stosowanie niektórych LAA w niewydolności serca powinno być
w ogóle zakazane.
U pacjentów z udokumentowanym NZK, którzy zostali skutecznie wyre-
animowani ze stanu śmierci klinicznej, dążyć się powinno do implantacji
ICD, w przypadkach braku takiej możliwości – stosować przewlekle amio-
daron (w najniższej skutecznej dawce).
Uzasadnione jest również stosowanie LAA dla podtrzymania rytmu zato-
kowego u pacjentów z napadowym migotaniem przedsionków lub kontroli
częstości serca w przypadku utrwalonego FA.
Najnowsze rodzaje terapii antyarytmicznej u pacjentów z niewydolno-
ścią serca bazują na terapii genowej. Istnieje bowiem ścisły związek po-
między zmianą ekspresji genów w niewydolności serca, a towarzyszącymi
jej zaburzeniami rytmu. Zatem oddziaływanie na ekspresję genów staje
się przyszłościową opcją terapeutyczną zaburzeń rytmu w niewydolności
serca.
Zapamiętaj!
1. Zaburzenia rytmu w niewydolności serca mają złożoną etiologię, podob-
nie jak heterogenny jest patomechanizm niewydolności serca.
2. Zaburzenia rytmu towarzyszące niewydolności serca mają znaczący udział
w dużej śmiertelności w tym zespole chorobowym.
3. Niektóre substraty arytmii w niewydolności serca mają przejściowy, usu-
walny charakter, zatem adekwatna terapia może przynieść znaczące zmniej-
szenie arytmii.
4. Główny wysiłek terapeutyczny w leczeniu zaburzeń rytmu serca w jego nie-
wydolności powinien być skierowany na wielokierunkowe leczenie niewy-
dolności, a zwłaszcza poprawę hemodynamiki.
5. Każdy z leków antyarytmicznych ma działanie kardiodepresyjne, co przy
współistnieniu niewydolności serca ma istotne znaczenie.
6. Efektywność leków antyarytmicznych w niewydolności serca znacząco spa-
da, łatwiej też o ich proarytmiczny niekorzystny efekt.
7. Uwzględniając powyższe – stosowanie leków antyarytmicznych w niewydol-
ności serca powinno być bardzo rozważne i ograniczone.
82

Warto przeczytać:
J. Kjekshus: Arrhythmias and mortality in congestive heart failure. Am. J.
Cardiol. 1990, 65: 421-481.
D. Levy et al.: Long-term trends in the incidence of and survival with heart
failure. N. Engl. J. Med. 2002, 347: 1397-1402.
F. Naccarella et al.: Do ACE inhibitors or angiotensin II antagonists reduce
total mortality and arrhythmic mortality? A critical review of controlled cli-
nical trials. Curr. Opin. Cardiol. 2002, 12: 6-18.
W. G. Stevenson et al.: Atrial fibrillation in heart failure. N. Engl. J. Med.
1999, 341: 910-911.
83
VIII. ZABURZENIA RYTMU SERCA W ZESPOLE
WYPADANIA PŁATKA ZASTAWKI MITRALNEJ
Wojciech Braksator, Patryk Krzyżak, Mirosław Dłużniewski
WSTĘP
Wypadanie płatka zastawki mitralnej (mitral valve prolapse, MVP, prolaps
mitralny) zostało po raz pierwszy stwierdzone w badaniach hemodynamicznych
przez Barlowa i Pococka w 1963 roku jako cofanie się płatka zastawki mitralnej
do lewego przedsionka. Tak też brzmi definicja MVP: jest to skurczowe prze-
mieszczenie płatka (płatków) lub jego fragmentu do lewego przedsionka. Za-
uważono, że zjawisku temu towarzyszą różne objawy kliniczne i nazwano je ze-
społem wypadania płatka lub zespołem Barlowa (1966). Szybki rozwój metod
ultradźwiękowych w latach 70. i 80. spowodował zbyt częste rozpoznawanie
MVP. Echokardiografia (ECHO) jest metodą z wyboru w rozpoznawaniu wy-
padania płatka. Czułość metody to 88-100%, a swoistość 82-100% wg różnych
opracowań. Kryteria echokardiograficzne zmieniały się na przestrzeni lat, były
zbyt dowolne, co spowodowało nadużywanie rozpoznania MVP, nawet do 30%
populacji badanej. Sprzyjało to przypisywaniu niespecyficznych dolegliwości pa-
cjenta temu właśnie zespołowi. Obecnie stosowane, bardziej surowe kryteria
rozpoznania wg badań Framingham powodują ograniczenie tendencji do „nad-
rozpoznawalności” MVP, a wynik ECHO jest wiarygodny. Jest to 0,3-7,0% ba-
danej populacji. Podstawowym kryterium rozpoznania MVP w badaniu ECHO
jest skurczowe przemieszczenie płatka w kierunku lewego przedsionka poza
pierścień mitralny, w badaniu echokardiograficznym, w projekcji przymostko-
wej w osi długiej (tzw. projekcja LAX) o >2 mm (ryc. 1).
Rycina 1: Badanie echokardiograficzne dwuwymiarowe; projekcja LAX. Strzałka wskazuje
wpuklanie się płatków mitralnych do lewego przedsionka
84

Wypadanie płatka dzielimy na pierwotne i wtórne. Wtórne jest zjawiskiem
związanym z zaburzeniami geometrii komory i aparatu mitralnego w prze-
biegu innych chorób, np. zawału serca, kardiomiopatii przerostowej, nadci-
śnienia tętniczego, ale także chorób tkanki łącznej, jak np. zespołu Marfana.
Nie jest znana przyczyna pierwotnego MVP. Uważa się, że powodem wypa-
dania jest zwyrodnienie śluzakowate (myxomatosus) aparatu zastawkowego.
Częściej MVP rozpoznaje się u kobiet. Prolapsowi mitralnemu do 30% to-
warzyszy wypadanie płatka zastawki trójdzielnej. Opisywane jest genetycz-
ne podłoże zmian zastawkowych; często MVP występuje rodzinnie.
Znaczenie kliniczne MVP obejmuje trzy problemy:
Wszystkie te elementy składają się na zespół wypadania płatka zastawki
mitralnej i tworzą obraz dolegliwości pacjenta wymagający oceny klinicznej,
diagnostyki i ewentualnego leczenia. Warto np. pamiętać, że u pacjentów
z MVP i niedomykalnością mitralną obowiązuje profilaktyka infekcyjnego
zapalenia wsierdzia. W tym opracowaniu skupiamy uwagą na problemie za-
burzeń rytmu serca w zespole MVP.
ZABURZENIA RYTMU
Nie ma wątpliwości, iż zaburzenia rytmu serca występują u osób z wypada-
niem płatka zastawki mitralnej często. Arytmia jest powodem niepokoju,
jedną z głównych przyczyn zgłoszenia się pacjenta do lekarza. Jest to bardzo
niejednorodna grupa. Wiąże się to przede wszystkim z różnymi chorobami
będącymi przyczyną prolapsu mitralnego. Pacjenci ci różnią się też występo-
waniem niedomykalności mitralnej czy zaburzeń biochemiczno-humora-
lnych. Podobnie arytmie w zespole wypadania płatka są różne i mają różny,
mniej lub bardziej istotny ciężar gatunkowy, od pojedynczych i łagodnych
do groźnych częstoskurczów komorowych (bardzo rzadko). W grupach pa-
cjentów zdrowych, badanych echokardiograficznie z innych przyczyn, np.
w badaniach własnych sportowców wyczynowych, częstość wypadania płatka
sięga 18%, a nieliczne zaburzenia rytmu nie mają istotności klinicznej.
Z drugiej jednak strony bulwersują doniesienia, gdzie u młodych zdrowych
osób doszło do zatrzymania krążenia w mechanizmie migotania komór, a je-
dyną nieprawidłowością, jaką stwierdzono, było wypadanie płatka mitralnego.
• zaburzenia biochemiczno-humoralne;
• niedomykalność zastawki mitralnej;
• zaburzenia rytmu serca.
85

W zespole Barlowa można stwierdzić całą gamę rodzajów arytmii. Najczę-
ściej są to pojedyncze komorowe i nadkomorowe skurcze dodatkowe. Wy-
stępowanie zaburzeń rytmu oceniane jest na 15-70%. W znacznej mierze
częstość i istotność stwierdzanej arytmii zależy od grupy badanej. W grupie
z rozpoznanym wypadaniem płatka, Swartz i wsp. stwierdzili zaburzenia ryt-
mu u 55% pacjentów. U 45% badanych rozpoznano arytmię komorową,
a u 6% nawet częstoskurcz komorowy. W badaniach Dłużniewskiego i wsp.
arytmię wykryto u 56% badanych. Byli to chorzy bezobjawowi, nie skarżyli
się na uczucie nierównej pracy serca. Wskazaniem do badania metodą
Holtera były objawy osłuchowe i wykazanie prolapsu w badaniu ECHO.
W materiale własnym zaburzenia rytmu wykryto u dwóch na trzech pacjentów,
z czego komorowe zaburzenia rytmu obserwowano u ponad połowy bada-
nej grupy. Nie stwierdzano groźnej arytmii. Wszyscy chorzy byli bezobjawo-
wi. W reprezentatywnych badaniach Framingham u osób z bezobjawowym
wypadaniem płatka arytmie nadkomorowe występowały u 25%, a komorowe
u 20% badanych. Są też doniesienia naukowe, w których częstość arytmii
jest mniejsza. Duren i wsp. nadkomorowe arytmie stwierdzili u 9%, a komo-
rowe u 19% pacjentów. U 30% pacjentów w długotrwałej obserwacji (śred-
nio 6 lat) stwierdzono istotne zdarzenia sercowe. Cztery osoby zmarły nagle
w mechanizmie migotania komór. U 2 innych stwierdzono migotanie komór
przerwane skutecznie, a u 54 częstoskurcz komorowy. Obserwowano też in-
ne powikłania. W 18 przypadkach rozpoznano infekcyjne zapalenie wsier-
dzia, 4 osoby zmarły. Niestety opisywane są zgony w przebiegu wypadania
płatka także przez innych autorów. Największą, 17-osobową grupę opisał
Pocock. W badaniu pośmiertnym u tych chorych stwierdzono duże zmiany
zastawkowe, wyrażające się zwyrodnieniem śluzakowatym, licznymi złoga-
mi mukopolisacharydów, a także zwapnieniami. Znane są także w Polsce
przypadki zatrzymania krążenia w mechanizmie migotania komór. Kula
i wsp. opisali zatrzymanie krążenia u młodej dziewczyny bez rozpoznanej
dotychczas choroby, gdzie po udanej resuscytacji stwierdzono wypadanie
płatka zastawki mitralnej.
Nie ma jednolitej opinii na temat tego, czy występowanie groźnych zabu-
rzeń rytmu jest związane z wypadaniem płatka. Istnieją poglądy, jak np. te
przedstawione powyżej, gdzie wykazano jednoznaczny związek arytmii
z MVP. Z drugiej jednak strony pojawiają się prace, które wprawdzie wy-
kazują zaburzenia rytmu u osób z prolapsem, jednak określają zagrożenie
SCD jako niskie. W badaniach własnych w blisko 200-osobowej grupie pa-
cjentów nie zarejestrowano groźnej dla życia arytmii. Co więcej, w cztero-
letniej obserwacji nie stwierdzono istotnej progresji choroby i groźnych po-
wikłań.
86

PRZYCZYNY ZABURZEŃ RYTMU U OSÓB Z ZESPOŁEM
WYPADANIA PŁATKA ZASTAWKI MITRALNEJ
Opisywanych jest wiele mechanizmów zaburzeń rytmu w zespole wypada-
nia płatka zastawki mitralnej.
Postulowane są dwie podstawowe przyczyny arytmii. Opisują je doświad-
czalne badania Crileya i Zeilenga. Pierwszy sugerowany mechanizm MVP
polega na wytworzeniu impulsu elektrycznego dla przedsionka lub komory
przez nadmierny ruch pogrubiałego, wydłużonego płatka zastawki mitral-
nej, rozciąganego przez prąd krwi. Drugi mechanizm zakłada powstanie ek-
topowego bodźca w zmienionym płatku zastawki. Oba mechanizmy wskazu-
ją na mechaniczne przyczyny powstania zaburzeń rytmu. Inni badacze
potwierdzili arytmogenną reakcję zastawki na rozciąganie, a także na wlew
z katecholamin.
Opisane są także inne mechanizmy arytmii. Niektórzy badacze zauwa-
żyli łączne występowanie MVP i zespołu preekscytacji. W tych przypad-
kach za arytmię odpowiedzialna jest dodatkowa droga przewodzenia lub
rozszczepienie przewodzenia w węźle przedsionkowo-komorowym.
U niektórych osób z prolapsem mitralnym zauważono wydłużenie od-
stępu QT. Kolejny opisywany mechanizm arytmii to odcinkowe zaburze-
nia kurczliwości lewej komory. W tych przypadkach za wystąpienie aryt-
mii odpowiedzialna jest asynergia skurczu, podobnie jak w zawale
i chorobie niedokrwiennej serca. Stwierdzenie u osób z MVP zaburzeń
kurczliwości, głównie w postaci hipokinezy, wiązane jest przez niektó-
rych autorów z zaburzeniami perfuzji. Zaburzenia takie występują wsku-
tek asymetrycznego i nierównomiernego unerwienia mięśnia sercowego
z lewego – dominującego i prawego – słabszego zwoju gwiaździstego.
Ma to w konsekwencji prowadzić do powstania zaburzeń kurczliwości,
wydłużenia QT i powstawania groźnych arytmii. Prace opisujące zabu-
rzenia kurczliwości w zespole Barlowa pojawiają się również współcześ-
nie.
Bardzo ważnym zjawiskiem, które uważa się za odpowiedzialne za
arytmię, jest obecność fali zwrotnej przez zastawkę mitralną. Wykazano,
że zaburzenia rytmu występują istotnie częściej u pacjentów z obecną
falą zwrotną i to niezależnie od jej istotności hemodynamicznej. Kolejna
grupa nieprawidłowości, które mogą być odpowiedzialne za arytmię
u tych chorych to zaburzenia biochemiczno-humoralne. Przedstawiono
je poniżej.
87

Zwiększenie stężenia katecholamin w surowicy krwi u osób z MVP nie bu-
dzi wątpliwości. Potwierdzono związek między ich podwyższonym stężeniem
a odstępem QT w EKG. Im wyższy poziom katecholamin, tym dłuższy od-
stęp QT. Ponadto katecholaminy powodują zwiększone zużycie tlenu przez
mięsień sercowy. Może to zwiększać dyspersję i wydłużać okres repolaryza-
cji. W rutynowym badaniu EKG wyraża się to wydłużeniem odstępu QT
i ułatwia powstanie arytmii komorowych.
Na podstawie licznych doniesień można stwierdzić, iż przewlekle zwięk-
szone stężenie krążących w surowicy amin katecholowych w zespole wypada-
nia płatka jest jedną z istotnych przyczyn arytmii, zwłaszcza w warunkach
przewlekłego, a także ostrego stresu, który towarzyszy dzisiejszej rzeczywi-
stości.
Ważnym współmechanizmem arytmii są zaburzenia gospodarki magnezo-
wej. W wielu pracach wykazano występowanie tych zaburzeń u pacjentów
z MVP. Stwierdza się zmniejszone stężenie magnezu w surowicy, a także
w erytrocytach i limfocytach u prawie połowy chorych z wypadaniem płatka
mitralnego. Towarzyszy temu zwiększone wydalanie Mg z moczem i zwięk-
szenie retencji magnezu w próbie obciążeniowej. Zwiększona utrata magne-
zu może wynikać ze zwiększonej aktywności adrenergicznej. Aminy katecho-
lowe poprzez pobudzanie wydzielania aldosteronu powodują wtórny
niedobór magnezu. Niedobory te mają wpływ na działanie pompy sodowo-
-potasowej w błonie komórkowej, co wpływa na zmiany stężenia potasu i so-
du. Wskutek tego dochodzi do zmiany potencjału czynnościowego i działania
arytmogennego. Ciekawym i do końca niewyjaśnionym zjawiskiem są zabu-
rzenia gospodarki wapniowej. Wyraża się to zwiększonym wydalaniem jo-
nów wapniowych z moczem u osób z MVP. Wśród możliwych przyczyn za-
burzeń gospodarki magnezowo-wapniowej wymienia się także predyspozycje
ZABURZENIA BIOCHEMICZNO-HUMORALNE
• zwiększenie stężenia adrenaliny i noradrenaliny w surowicy;
• zwiększenie wydalania amin katecholowych z moczem;
• zmniejszenie stężenia magnezu w surowicy i elementach
morfotycznych krwi;
• zwiększenie wydalania magnezu z moczem;
• zwiększenie retencji magnezu w próbie obciążeniowej;
• zwiększenie wydalania wapnia z moczem.
88

genetyczne. Konieczna jest ocena poziomu jonów w surowicy, a w miarę
możliwości ich wydalania z moczem u każdego chorego z arytmią i zespo-
łem wypadania płatka zastawki mitralnej.
PROPONOWANE POSTĘPOWANIE U PACJENTÓW Z ZESPOŁEM
WYPADANIA PŁATKA ZASTAWKI MITRALNEJ
Podstawowym problemem jest postawienie właściwego rozpoznania.
Zgodnie ze standardami Amerykańskich Towarzystw Kardiologicznych, po-
twierdzonych w standardach Sekcji Echokardiografii Polskiego Towarzystwa
Kardiologicznego podstawą rozpoznania MVP jest badanie kliniczne – do-
brze zebrany wywiad i badanie przedmiotowe oraz osłuchiwanie pacjenta.
Podstawowe czynności lekarza, który powziął kliniczne podejrzenie wypa-
dania płatka to:
• wiarygodne badanie echokardiograficzne, zgodne ze standardami,
z oceną morfologii i czynności zastawki, w tym fali zwrotnej;
• dobowa rejestracja rytmu serca metodą Holtera u pacjentów
z arytmią. Jest to obiektywizacja odczuć chorego. Ma na celu
przede wszystkim wykrycie istotnych zaburzeń rytmu,
ale także znaczenie psychologiczne dla pacjenta, który
czuje się zagrożony;
• ocena stężenia jonów magnezu, potasu, sodu i wapnia
w surowicy. Wskazana jest ocena wydalania magnezu i wapnia
z moczem;
a dodatkowo u wybranych chorych z MVP:
• badanie elektrofizjologiczne – stymulacja przezprzełykowa w celu
potwierdzenia lub wykluczenia dodatkowych dróg przewodzenia
(zespół preekscytacji);
• wysiłkowe badanie EKG w celu oceny istotności arytmii i wydolności
pacjenta. U niektórych osób nawet badanie stres-echo dla oceny
zaburzeń kurczliwości i narastania fali zwrotnej podczas wysiłku.
Nie należy zapominać, że postawienie rozpoznania MVP nie
wyklucza możliwości istnienia innych chorób, zwłaszcza choroby
niedokrwiennej serca;
• test pionizacyjny u pacjentów z zasłabnięciami bez wiarygodnego
ich wyjaśnienia w poprzednich badaniach.
89
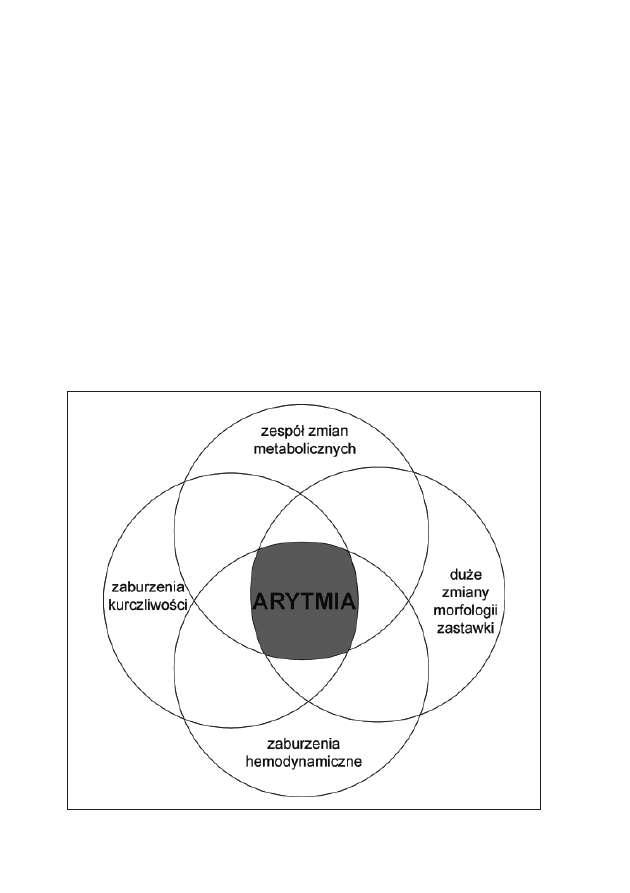
KTÓRY PACJENT Z ZESPOŁEM WYPADANIA PŁATKA JEST
SZCZEGÓLNIE ZAGROŻONY ZABURZENIAMI RYTMU?
Najbardziej zagrożeni pacjenci to tacy, u których jednocześnie występują
wszystkie możliwe przyczyny arytmii: zaburzenia humoralne, istotna niedo-
mykalność mitralna towarzysząca dużym zmianom morfologii zastawki i za-
burzenia kurczliwości. Sytuacja taka na szczęście jest rzadka, jednak możli-
wa. Doniesienia o groźnych dla życia zaburzeniach rytmu mają na ogół
charakter kazuistyczny, a prace omawiające przypadki nagłego zatrzymania
krążenia (NZK) w przebiegu wypadania płatka są analizami wieloletnich ob-
serwacji i prawdopodobnych powodów arytmii. Nie są one niezbitym dowo-
dem na istnienie zwiększonego zagrożenia nagłą śmiercią sercową, choć nie
można ich lekceważyć. Według Boudoulasa, jednego ze współczesnych znaw-
ców problemu, zagrożenie NZK u pacjentów z prolpasem mitralnym nie jest
istotnie większe niż przeciętnie w populacji. Warto jednak zapamiętać na-
stępujący schemat, który przypomina o możliwym nałożeniu się wielu przy-
czyn, a w efekcie stanowić może o zagrożeniu (ryc. 2).
Rycina 2: Zagrożenie zaburzeniami rytmu w zespole wypadania płatka zastawki mitralnej
90

LECZENIE PACJENTÓW Z WYPADANIEM PŁATKA ZASTAWKI
MITRALNEJ
Nie leczymy wyłącznie objawów choroby, zawsze staramy się leczyć ich
przyczyny. Tak też jest w zespole wypadania płatka zastawki mitralnej: nie
leczymy objawu, jakim jest arytmia, tylko korygujemy stwierdzone w trakcie
diagnostyki zaburzenia. Zawsze należy najpierw przeprowadzić rozmowę
z pacjentem, wyjaśniając mu, na czym polega jego problem. Na ogół infor-
macja, iż nie ma groźnej wady serca już pozwala na poprawę samopoczucia
i zmniejszenie odczuwanych dolegliwości.
Korekcji wymagają przede wszystkim zaburzenia gospodarki jonowej. Sto-
sujemy substytucję magnezu i potasu, możliwe jest podawanie związków fos-
foranowych zmniejszających wydalanie wapnia. Podstawową grupą leków,
jakie można zastosować to leki beta-adrenolityczne zmniejszające odczyn
adrenergiczny. Beta-adrenolityki zwykle poprawiają samopoczucie, zmniej-
szają zaburzenia rytmu. Niekiedy stosuje się leki blokujące kanały wapniowe.
Są to preparaty z grupy diltiazemu lub werapamilu, mające większe powi-
nowactwo do układu bodźcoprzewodzącego. Zastosowanie innych leków
przeciwarytmicznych wymaga zastanowienia i wydaje się, że ich dobór po-
winien odbywać się w warunkach szpitalnych, np. w warunkach powtarza-
nych hospitalizacji jednodniowych, po pełnej diagnostyce i rozpoznaniu rze-
czywistych przyczyn arytmii i określeniu zagrożenia (ryc. 3).
Rycina 3: Zaburzenia rytmu w zespole wypadania płatka zastawki mitralnej - leczenie
91

W każdym przypadku osoby z rozpoznawanym lub podejrzewanym wypa-
daniem płatka zastawki mitralnej obowiązuje indywidualna ocena proble-
mu. Należy zaplanować taki cykl diagnostyczny, który pozwoli na wyjaśnie-
nie przyczyn arytmii i ich optymalne leczenie, nie zapominając o innych
możliwych problemach klinicznych związanych z MVP, jak np. niedomykal-
ność zastawki mitralnej.
Zapamiętaj!
1. Zespół wypadania płatka zastawki mitralnej jest anomalią o zróżnicowa-
nym obrazie klinicznym; do dominujących objawów należą zaburzenia ryt-
mu serca.
2. Podstawą rozpoznania zespołu wypadania płatka zastawki mitralnej jest
dobrze zebrany wywiad i badanie kliniczne; badanie echokardiograficzne
jedynie służy potwierdzeniu rozpoznania.
3. Zaburzenia rytmu w zespole wypadania płatka zastawki mitralnej mają
różnoraki charakter – od pojedynczej arytmii nad- i komorowej, aż do zło-
żonych form z częstoskurczem komorowym włącznie.
4. Ryzyko groźnych zaburzeń rytmu serca i nagłego zatrzymania krążenia nie
jest w grupie osób z wypadaniem płatka zastawki mitralnej częstsze niż
w populacji osób zdrowych.
5. Do najważniejszych zaburzeń biochemiczno-humoralnych sprzyjających
arytmii należy zwiększona aktywność układu współczulnego oraz zaburze-
nia gospodarki jonowej, głównie magnezowej.
6. Postępowanie terapeutyczne powinniśmy zacząć od wyrównania zaburzeń
jonowych, w dalszej kolejności są leki beta-adrenolityczne, antagoniści ka-
nałów wapniowych.
Warto przeczytać:
J. Barlow et al.: The Significane of Late Systolic Murmurs. Am. Heart J.
1963, 66: 443-446.
M. Swartz et al.: Mitral Valve Prolapse. A Rewiew of Associated Arrhytmias
Amer. J. Med., 1977, 62: 377-383.
M. Dłużniewska i wsp.: Zaburzenia rytmu i przewodzenia u 107 chorych
z zespołem wypadania płatka zastawki mitralnej. Pol. Tyg. Lek. 1988, 41:
1320-1326.
92

W. Piwowarska, M. Kitliński: Objawowe i bezobjawowe wypadanie płatka
zastawki mitralnej. Diagnostyka i leczenie. BelCorp, Warszawa 1997.
M. Dłużniewski, M. Dłużniewska, W. Braksator: Zaburzenia rytmu w ze-
spole wypadania płatka zastawki mitralnej. Medipress Kardiologia 1997;
tom 3, 4: 12-17.
W. Braksator, W. Krzyżanowski, M. Dłużniewska: Zespół wypadania płatka
zastawki mitralnej. Ultrason. Pol. 1995, 5, 3: 32-38.
H. Boudoulas, Ch. Wooley: Wady zastawki dwudzielnej. ACCSAP 1998,
tom 7: 29-41.
L. Freed et al.: Prevalence and Clinical Outcome of Mitral Valve Prolapse.
N Engl J. Med. 1999, 1,341: 1-7
H. Boudoulas, Ch. Wooley: Floppy Mitral Valve, Mitral Valve Prolapse and
Mitral regurgitation. Curry Trat Options Cardiovasc Med. 2001; 3, 1: 15-24.
W. Braksator: Kryteria wypadania płatka zastawki mitralnej Sekcji Echokar-
diografii Polskiego Towarzystwa Kardiologicznego. Sprawozdanie z III Ogól-
nopolskiej Konferencji Sekcji Echokardiografii PTK, Kardiol. Pol. 2001, 10.
93

IX.
ZNACZENIE ZABURZEŃ RYTMU SERCA
W KARDIOMIOPATII PRZEROSTOWEJ
Włodzimierz Gierlak, Marek Kuch, Wojciech Braksator, Mirosław Dłużniewski
Kardiomiopatie samoistne to grupa pierwotnych chorób mięśnia sercowe-
go powstających wskutek innych przyczyn niż choroba niedokrwienna serca,
wrodzone lub nabyte wady serca, nadciśnienie tętnicze i płucne oraz zapale-
nie serca. Już sama definicja kardiomiopatii, oparta na wykluczeniu innych
chorób serca, wskazuje na brak znanego czynnika etiologicznego, a więc
brak możliwości leczenia przyczynowego. Do niedawna stan wiedzy medycz-
nej pozwalał określić kardiomiopatię jako pierwotną chorobę mięśnia ser-
cowego, leczenie zaś sprowadzało się jedynie do ograniczania objawów tej
choroby, wśród których najniebezpieczniejsze powikłanie stanowią komoro-
we zaburzenia rytmu.
Obecnie uznaje się genetyczne podłoże tej jednostki chorobowej, rodzin-
ne występowanie choroby wykazano bowiem aż u 20-30% badanych. Jak do-
wiedziono, kardiomiopatia przerostowa jest najczęściej spotykaną chorobą
układu sercowo-naczyniowego, która podlega dziedziczeniu jednogenowe-
mu, w sposób autosomalny, dominujący. Przeprowadzone badania wykaza-
ły, że za około 30% przypadków kardiomiopatii przerostowej odpowiada
występowanie mutacji łańcuchów ciężkich
β-miozyny. Drugą z kolei pod
względem częstości występowania jest mutacja, do której dochodzi w genie
kodującym łańcuch troponiny T. Mutacja ta decyduje o wystąpieniu 15%
spośród wszystkich przypadków kardiomiopatii przerostowej. Najrzadziej
spotykany rodzaj mutacji, który determinuje wystąpienie kardiomiopatii
przerostowej to mutacja w genie alfa-tropomiozyny. Dzięki badaniom gene-
tycznym pacjentów z kardiomiopatią przerostową wiadomo, że nawet
w grupie mutacji dotyczących kodowania genu łańcuchów ciężkich
β-miozy-
ny, pomimo porównywalnego stopnia przerostu mięśnia lewej komory, wy-
stępujące mutacje istotnie różnią się ryzykiem wystąpienia nagłego zgonu
sercowego. Udowodniono również, że mutacje w obrębie łańcucha troponi-
ny T, choć nie charakteryzują się istotnym przerostem mięśnia sercowego,
to ich występowanie związane jest z częstszym występowaniem nagłego zgo-
nu sercowego. Wyniki przedstawionych badań sugerują, że typ zaburzeń ge-
netycznych, bardziej niż stopień nasilenia przerostu mięśnia lewej komory
może decydować o rokowaniu pacjenta. Stąd tak istotne znaczenie ma wy-
konanie typowania genetycznego w przypadku pacjentów z kardiomiopatią
przerostową. Wiedza ta nie umożliwia nam jednak jeszcze podjęcia skutecz-
nego leczenia. Dlatego kardiomiopatia przerostowa jest nadal jedną z naj-
94

częstszych przyczyn występowania nagłego zgonu sercowego zarówno wśród
dzieci, jak i dorosłych.
Najczęstszą postacią kardiomiopatii pierwotnych jest kardiomiopatia roz-
strzeniowa. Kardiomiopatia przerostowa plasuje się statystycznie na drugim
miejscu, co do częstości występowania, jednak występuje wyraźnie zaniżona
rozpoznawalność tej jednostki u osób w starszym wieku. Kardiomiopatia
przerostowa charakteryzuje się istotnym dośrodkowym przerostem mięśnia
lewej komory, zwykle asymetrycznym, największym w obrębie przegrody
międzykomorowej. Występuje także zaburzony układ włókien mięśniowych
i miofibryli. Około 25% przypadków kardiomiopatii przerostowej przebiega
z zawężeniem drogi odpływu lewej komory lub z zawężeniem śródkomoro-
wym. Zaburzenia te powodują upośledzenie funkcji rozkurczowej lewej ko-
mory, co utrudnia napływ krwi do lewej komory. Wtórny przerost mięśnia
sercowego (kardiomiopatia wtórna), bez względu na czynnik etiologiczny,
może dawać takie same zaburzenia rytmu serca, a czasem również analo-
giczny obraz kliniczny jak przerost pierwotny, to jednak ten rozdział poświę-
cony jest pierwotnej kardiomiopatii przerostowej.
W badaniu histologicznym kardiomiopatię przerostową odróżnia od wtór-
nych przerostów mięśnia sercowego całkowicie zaburzony układ włókien
i miofibryli. Włókna są ułożone w różnych kierunkach, a przerośnięte, spiral-
nie skręcone komórki mięśniowe mają dziwaczne kształty z nieprawidłowym
układem miofibryli i miofilamentów. Charakterystyczna jest również pro-
porcjonalnie niewielka liczba organelli i skąpe łożysko naczyniowe w porów-
naniu do dużej masy mięśniowej. Taki układ włókien mięśniowych oraz defi-
cyt elementów metabolicznych w stosunku do potrzeb przerośniętego
mięśnia stanowi odpowiedź na pytanie, dlaczego w kardiomiopatii przero-
stowej gruby mięsień sercowy jest mniej wartościowy od cieńszego, „zdro-
wego” mięśnia, stanowiąc ponadto substrat do powstania groźnych zaburzeń
rytmu.
Istotą kardiomiopatii przerostowej jest samoistny przerost mięśnia serco-
wego powodujący stosunkowo wcześnie utrudnienie napełniania, odznacza-
jącej się małą podatnością rozkurczową i znacznym przerostem lewej komo-
ry. W przypadku kardiomiopatii z zawężeniem drogi odpływu lewej komory,
niesymetrycznie przerośnięta przegroda międzykomorowa zaburza geome-
trię komory, utrudniając odpływ krwi w fazie skurczu. W zależności od po-
staci kardiomiopatii mogą dominować objawy zależne od zawężenia drogi
odpływu lub przeszkody w napływie do lewej komory, wynikające z upośle-
dzonej podatności rozkurczowej przerośniętego mięśnia komory. Klinicznie
w obu przypadkach występują objawy małego rzutu serca, gdyż mimo pra-
95

widłowej frakcji wyrzutu, duża masa mięśnia w stosunku do małej objętości
jamy lewej komory powoduje zmniejszoną objętość wyrzutową i minutową.
Objawy kliniczne pojawiają się na ogół w młodym wieku, do 30 roku życia
i nasilają się wraz z wiekiem. Z objawów chorobowych dominuje duszność
wysiłkowa, zawroty głowy, bóle wieńcowe, omdlenia i uczucie kołatania ser-
ca. Nie one są jednak największym zagrożeniem dla pacjenta z kardiomiopa-
tią przerostową. Są nim groźne komorowe zaburzenia rytmu mogące być
przyczyną nagłego zgonu. Ponad dwie trzecie pacjentów z kardiomiopatią
przerostową umiera nagle, w tym u jednej trzeciej nagły zgon jest pierwszym
objawem choroby. Dramaturgia tych danych jest jeszcze większa, gdy doda-
my, że nagłe zgony dotyczą w większości osób młodych, w drugiej i trzeciej
dekadzie życia. Identyfikacja osób z kardiomiopatią przerostową zagrożo-
nych nagłym zgonem sercowym nie jest łatwa, tym niemniej poszukuje się
objawów prodromalnych nagłej śmierci. Do objawów najczęstszych zwiastu-
jących stan zagrożenia należą: wcześniej występujące napady migotania ko-
mór lub częstoskurczu komorowego, dysfunkcja skurczowa komory lewej,
groźne, złożone arytmie, zarejestrowane metodą Holtera, nawracające omdle-
nia niewyjaśnionego pochodzenia.
Nieinwazyjne metody diagnostyczne, takie jak echokardiografia i rezonans
magnetyczny, pozwalają z dużym prawdopodobieństwem rozpoznać choro-
bę u większości chorych z kardiomiopatią przerostową. Zwłaszcza echokar-
diografia, dzięki swojemu rozpowszechnieniu oraz właściwościom poznaw-
czym jest wartościową metodą diagnostyki. Badanie echokardiograficzne
pozwala nie tylko na precyzyjną ocenę morfologiczną serca (typu i lokaliza-
cji przerostu, wielkości jam), ale także na ocenę globalnej i odcinkowej
kurczliwości oraz dopplerowski pomiar gradientu skurczowego przez miej-
sce zawężenia. Możliwy jest również do uwidocznienia charakterystyczny dla
kardiomiopatii z zawężeniem drogi odpływu objaw nieprawidłowego wychy-
lenia skurczowego przedniego płatka zastawki dwudzielnej w kierunku prze-
grody międzykomorowej (systolic anterior motion, SAM). Jednak dla pełnej
oceny kardiomiopatii przerostowej, zwłaszcza zawężającej, konieczne może
być wykonanie badań inwazyjnych, cewnikowania serca z pomiarem gradien-
tów skurczowych ciśnień w sercu oraz badanie histologiczne mięśnia pobra-
nego drogą biopsji endokawitarnej. Badanie to jest metodą potwierdzenia
rozpoznania kardiomiopatii. O ile jednak postawienie rozpoznania kardio-
miopatii przerostowej przy obecnych metodach diagnostycznych nie nastrę-
cza na ogół trudności, o tyle zapobieganie nagłym zgonom spowodowanym
zaburzeniami rytmu serca jest trudne. Występowanie niemiarowości komo-
rowych jest bardzo częste w kardiomiopatiach przerostowych, należy do ob-
razu klinicznego tej jednostki chorobowej. Problem jednak polega na tym,
96

aby wychwycić te zaburzenia komorowe rytmu, które są potencjalnie obcią-
żone ryzykiem wystąpienia nagłej śmierci z przyczyn sercowych. W związku
z tym obecna strategia postępowania diagnostycznego w kardiomiopatii
przerostowej powinna obejmować oprócz postawienia rozpoznania, ocenę
hemodynamiczną choroby, jak również stratyfikację ryzyka wystąpienia na-
głego zgonu z przyczyn sercowych. Metodę, którą należy traktować jako
podstawową w ocenie zaburzeń rytmu jest monitorowanie elektrokardiogra-
ficzne metodą Holtera (24- lub 48-godzinne). Wykazano, że występowanie
lub brak w rejestracji dobowej rytmu częstoskurczów komorowych, pozwala
wyróżnić grupy o odmiennym rokowaniu. Drugą metodą diagnostyczną, któ-
ra również wydaje się być niezbędna w ocenie zaburzeń rytmu w kardiomio-
patii przerostowej jest test wysiłkowy z kontrolowanym wysiłkiem fizycznym.
Ma on ważną wartość prognostyczną w ocenie ryzyka nagłego zgonu serco-
wego. Pamiętać jednakże należy, że wysiłek powinien być kontrolowany,
a test wykonywany w pełnym zabezpieczeniu w oddziale kardiologicznym.
Przesłankę do przeprowadzenia testu wysiłkowego stanowią badania retro-
spektywne, w których stwierdzono, że najbardziej narażeni na wystąpienie
nagłego zgonu są ludzie młodzi, u których zgony wystąpiły po umiarkowa-
nym lub dużym wysiłku fizycznym. Również badania autopsyjne wykonane
u młodych wyczynowych sportowców, którzy zmarli nagle w czasie wykony-
wania ćwiczeń fizycznych lub bezpośrednio po nich, wskazały na kardiomio-
patię jako na najczęstszy powód nagłego zgonu w tej grupie. Grupa McKen-
ny z Londynu stwierdziła, że u około 1/3 chorych w czasie testu wysiłkowego
występuje znaczący spadek ciśnienia tętniczego krwi, związany ze zmniejsze-
niem oporu obwodowego, nieproporcjonalny do wzrostu rzutu minutowego.
Zjawisko to kojarzyło się ze zwiększonym wskaźnikiem zgonów rodzinnych.
Nie wszyscy autorzy jednak potwierdzają tak dużą częstość występowania tego
zjawiska w badanej grupie, ale ze względu na łatwość wykonania – metoda ta
zasługuje na rozpowszechnienie i dalsze badania. Niezależnym czynnikiem
ryzyka nagłego zgonu wśród młodych osób z kardiomiopatią przerostową
jest również rodzinne występowanie choroby. Należy podkreślić, że w kar-
diomiopatii przerostowej do zgonu prowadzą zapewne różne mechanizmy,
a ocena arytmii komorowych, chociaż nie wyczerpuje problemu zagrożenia,
jest w tej ocenie bardzo istotna. Ze względu na złożoność problemu arytmii,
są próby (Dąbrowski i wsp.) kompleksowego podejścia do chorych z kardio-
miopatią przerostową. Autorzy przypisali poszczególnym czynnikom predys-
ponującym do nagłego zgonu określone wartości liczbowe, a ich suma równa
lub większa niż 5 punktów kwalifikowała chorych do grupy wysokiego ryzy-
ka. Wartość takich skali punktowych wymaga prospektywnych obserwacji na
dużych grupach chorych.
97

Skoro nie mamy możliwości eliminowania mutacji genowych, prowadzą-
cych do wystąpienia kardiomiopatii przerostowej, to jak współcześnie mo-
żemy leczyć pacjentów dotkniętych tą jednostką chorobową? Czy do dyspo-
zycji mamy wyłącznie farmakoterapię antyarytmiczną?
Najważniejsza pozostaje nadal dokładna, indywidualna ocena każdego
chorego. Niewątpliwie antyarytmicznie powinni być leczeni pacjenci ze złożo-
nymi komorowymi zaburzeniami rytmu (grupy 4a i 4b wg klasyfikacji Low-
na), jak również pacjenci z zaburzeniami rytmu, ulegającymi ewidentnemu
nasileniu podczas wykonywania wysiłku fizycznego bądź też powodującymi
zaburzenia hemodynamiczne. Nadkomorowe zaburzenia rytmu (przede
wszystkim migotanie przedsionków) występują rzadko w kardiomiopatiach
przerostowych, pojawiając się zwłaszcza w zaawansowanych stadiach tej cho-
roby, powodując wtedy zawsze znaczne pogorszenie stanu ogólnego chore-
go. W leczeniu komorowych zaburzeń rytmu, podobnie jak w innych jed-
nostkach chorobowych, najbardziej wartościowe są leki antyarytmiczne
posiadające właściwości blokowania receptorów beta-adrenergicznych (leki
beta-adrenolityczne, amiodaron). Jako leki pierwszego rzutu powinny więc
być stosowane beta-adrenolityki. Jest to tym bardziej umotywowane w kar-
diomiopatii przerostowej, że leki blokujące receptory ß, obok działania anty-
arytmicznego, mają również wielokierunkowe działanie poprawiające wa-
runki hemodynamiczne. Leki blokujące receptory beta-adrenergiczne przy
długotrwałym leczeniu, zmniejszając siłę skurczu mięśnia sercowego, zmniej-
szają zapotrzebowanie na tlen, poprawiają podatność rozkurczową lewej ko-
mory, zwiększają objętość rozkurczową i normalizują podwyższone ciśnienie
końcoworozkurczowe, co w następstwie ułatwia napełnianie lewej komory.
W kardiomiopatiach z zawężeniem drogi odpływu, zmniejszając siłę skurczu
mięśnia sercowego, leki beta-adrenolityczne przeciwdziałają powstawaniu
lub zmniejszają już istniejący gradient ciśnienia skurczowego, co w rezultacie
eliminuje bóle dławicowe, omdlenia, duszności oraz zaburzenia rytmu. Leki
beta-adrenolityczne likwidują więc substrat dla powstawania zaburzeń rytmu,
jakim są zaburzenia hemodynamiczne, zabezpieczając również w tym me-
chanizmie przed nagłym zgonem.
Pojawiają się coraz częściej doniesienia o redukcji masy przerośniętego
mięśnia w kardiomiopatiach przerostowych, dzięki lekom beta-adrenolitycz-
nym. Jest to bardzo obiecujące działanie tej grupy leków; mimo że nie wpły-
wa na przyczynę, to likwiduje główny czynnik – przerost mięśnia, powodują-
cy zaburzenia rytmu serca. Wśród licznej grupy leków blokujących receptory
ß na oddzielne omówienie zasługuje sotalol. Lek ten, oceniając jego poten-
cjalne możliwości, może być szczególnie predysponowany do leczenia kar-
diomiopatii. Łączy w sobie działanie klasycznego leku beta-adrenolitycznego
98

z działaniem antyarytmicznym leków III grupy wg Vaughana-Williamsa.
W praktyce klinicznej sotalol ma więc szansę zastąpić konieczność stosowanego
dotychczas połączenia dwóch leków – klasycznego leku beta-adrenolitycz-
nego i innego leku antyarytmicznego. Dawkowanie leków beta-adrenoli-
tycznych powinno być u każdego pacjenta dobierane indywidualnie. Zaleca-
ne jest podawanie maksymalnych tolerowanych przez pacjenta dawek, gdyż
właśnie takie dawki mają mieć działanie redukujące masę przerośniętego
mięśnia lewej komory. Trzeba jednak podkreślić, że leczenie dużymi dawka-
mi leków blokujących receptory ß musi być bardzo dokładnie kontrolowa-
ne. Optymalne działanie lecznicze uzyskuje się stosując maksymalne dawki
leku, nie powodujące jednak zwolnienia średniej częstości rytmu serca poni-
żej 60/minutę, blokowania przewodzenia przedsionkowo-komorowego oraz
zahamowań zatokowych dłuższych niż 2 sekundy w wykonanych badaniach
elektrokardiograficznych metodą Holtera.
Drugą grupę leków o podobnej, dużej skuteczności w leczeniu kardiomio-
patii przerostowej są leki z grupy niedyhydropirydynowych antagonistów kana-
łów wapniowych (werapamil). Mają one podobne działanie do leków beta-
-adrenolitycznych na kardiomiopatyczny mięsień lewej komory, poprawiając
warunki hemodynamiczne pracy serca. Antagoniści kanałów wapniowych
działają głównie poprzez normalizację rozkurczu mięśnia sercowego, zwłasz-
cza fazy izowolumetrycznej, zmniejszenie ciśnienia napełniania lewej komo-
ry i zwiększenie podatności rozkurczowej lewej komory. Poprawa funkcji roz-
kurczowej wiąże się prawdopodobnie z bezpośrednim wpływem antagonistów
kanałów wapniowych na mięsień sercowy poprzez wybiórcze blokowanie tzw.
wolnego kanału wapniowego błony komórkowej i normalizację wewnątrzko-
mórkowej gospodarki wapniowej. Leki tej grupy wpływają również na czyn-
ność skurczową mięśnia sercowego, zwiększając objętość wyrzutową i zmniej-
szając objętość późnorozkurczową. Działanie to jest jednak wtórne do
zwiększenia podatności rozkurczowej komór, poprawy przepływu wieńcowego
i być może wpływu na opór obwodowy. Klinicznie werapamil zwiększa wy-
dolność wysiłkową organizmu. Bezdyskusyjny jest wpływ antyarytmiczny an-
tagonistów kanałów wapniowych poprzez poprawę warunków hemodyna-
micznych pracy serca. Natomiast rozbieżne są zdania badaczy, co do
bezpośredniego działania tych leków na komorowe zaburzenia rytmu. Obec-
nie kwestionuje się tę właściwość antagonistów kanałów wapniowych i nie
stosuje się samodzielnie tej grupy leków w leczeniu antyarytmicznym. Stra-
tegia leczenia antagonistami kanałów wapniowych jest bardzo zbliżona do le-
czenia lekami beta-adrenolitycznymi. Zalecane dawki werapamilu to 320-480
mg/dobę, gdyż podobnie do leków beta-adrenolitycznych podkreślane jest,
że zmniejszenie masy mięśnia sercowego obserwowane było po długotrwa-
99

łym podawaniu dużych dawek leku. Podobnie jak w przypadku blokady re-
ceptorów ß, konieczne jest dokładne monitorowanie elektrokardiograficzne.
Porównując działanie obu grup leków w kardiomiopatiach przerostowych,
należy stwierdzić, że przy podobnym wpływie na zaburzenia hemodynamicz-
ne serca, antagoniści kanałów wapniowych ustępują pod względem działania
antyarytmicznego lekom blokującym adrenergiczne receptory beta.
Jednak niestety w wielu przypadkach leki beta-adrenolityczne i leki blokują-
ce kanały wapniowe są niewystarczające w zwalczaniu groźnych komorowych
zaburzeń rytmu. U tych chorych potrzebne jest dołączenie do leku beta-adre-
nolitycznego lub leku blokującego kanały wapniowe innych leków o działaniu
antyarytmicznym. Najczęściej stosowane leki należą do III grupy wg Vaugha-
na-Williamsa (amiodaron i sotalol). Przedłużają one czas trwania potencjału
czynnościowego, posiadając również właściwości blokujące receptory beta-
-adrenergiczne. Szczególnie wysoko oceniana jest skuteczność amiodaronu,
który oprócz opisanych właściwości wykazuje również działanie na nadkomo-
rowe zaburzenia rytmu, w tym zapobiega migotaniu przedsionków. Szerokie-
mu zastosowaniu tego leku w przewlekłej terapii kardiomiopatii przerostowej
przeszkadzają proporcjonalnie liczne, chociaż w większości niegroźne efekty
uboczne leku. Groźne powikłania długotrwałej terapii amiodaronem, takie
jak częstoskurcz wielokształtny (torsade de pointes) degenerujący do migotania
komór występują rzadko. Dla ograniczenia ryzyka wystąpienia tego powikła-
nia konieczne jest kontrolowanie podczas leczenia amiodaronem zapisu elek-
trokardiograficznego z pomiarem odstępu QT oraz skorygowanego odstępu
QT (QTc). Niemniej ważnym parametrem, który powinien być kontrolowany
podczas leczenia nie tylko amiodaronem, ale wszystkimi lekami antyarytmicz-
nymi, jest pomiar stężenia leku w surowicy krwi, dający przybliżone pojęcie
o stężeniu tkankowym leku w mięśniu sercowym, gdyż nie mamy możliwości
pomiaru bezpośredniego. Pomiar stężenia leku z jednej strony zabezpiecza
przed przedawkowaniem leku, z drugiej zaś pokazuje, czy osiągnęliśmy po-
ziom terapeutyczny leku w organizmie. W przypadku amiodaronu jest to
szczególnie ważne, gdyż często nieskuteczność działania tego leku jest zwią-
zana ze złym wchłanianiem z przewodu pokarmowego. Nadal dyskutowany
jest najlepszy sposób podawania leku, aby osiągnąć odpowiednie stężenie
tkankowe w mięśniu sercowym. W warunkach szpitalnych leczenie amiodaro-
nem rozpocząć najlepiej od podawania leku dożylnie (nie przekraczając dawki
dobowej 1,2 g), choć możliwe jest także początkowe stosowanie formy doust-
nej. Ostatnio preferowany jest „nasycający” sposób podawania amiodaronu,
uważany za lepszy od klasycznego podawania dożylnego. Polega on na dożyl-
nych wlewach kroplowych, na przykład 4 razy dziennie, w dawkach po 300 mg
podawanych w 60- lub 90-minutowych wlewach dożylnych przez pompę infu-
100

zyjną, pod kontrolą monitorowania elektrokardiograficznego. Ten sposób po-
dawania leku jest uważany za najskuteczniejszy (lek najlepiej penetruje do
tkanki mięśniowej serca). W leczeniu komorowych zaburzeń rytmu serca
w przebiegu kardiomiopatii przerostowej mogą być również skuteczne inne
leki antyarytmiczne, na przykład grupy Ic lub Ia wg Vaughana-Williamsa. Do-
bór tych leków u chorych musi być jednak indywidualny i bardzo dokładnie
kontrolowany ze względu na efekt proarytmiczny. W związku z tym te grupy
leków antyarytmicznych powinny być traktowane jako leki trzeciego rzutu i je-
żeli to możliwe, łączone z beta-adrenolitykami.
Leczenie kardiomiopatii przerostowej rozpocząć należy od terapii farma-
kologicznej. Wskazaniem do leczenia operacyjnego jest dopiero nieskutecz-
ność lub zmniejszająca się skuteczność leczenia farmakologicznego. Wyją-
tek stanowiący bezwzględne wskazanie do wykonania zabiegu operacyjnego
to kardiomiopatia przerostowa z zawężeniem drogi odpływu lewej komory,
z gradientem skurczowym większym niż 60 mm Hg. Operacja polega na wy-
cięciu części mięśnia zawężającej drogę odpływu lewej komory. Zabieg ten,
chociaż także nie jest leczeniem przyczynowym, poprawia warunki hemody-
namiczne serca, co pośrednio jest również działaniem antyarytmicznym za-
pobiegającym nagłym zgonom.
Inną metodą terapeutyczną jest stymulacja dwujamowa resynchronizująca,
polegająca na wszczepieniu układu stymulującego serca typu DDD. Jest to
metoda szczególnie zalecana w kardiomiopatiach z uszkodzeniem układu
przewodzącego serca oraz u osób starszych, u których nie można zastoso-
wać żadnej ze wspomnianych uprzednio metod. Ponadto wszczepienie ukła-
du stymulującego serce pozwala na zastosowanie większych dawek leków
mogących mieć działanie depresyjne na układ przewodzący serca. Podstawą
teoretyczną zastosowania sekwencyjnej stymulacji przedsionkowo-komo-
rowej jest obniżenie gradientu w drodze odpływu lewej komory w kardio-
miopatii zawężającej pod wpływem skracania czasu sprzężenia przedsionko-
wo-komorowego lub poprzez preekscytację prawej komory, wywołując
asynchroniczność skurczu komór, przez co również prowadzi do zmniejsze-
nia stopnia zawężania drogi odpływu lewej komory. Niestety, przesłanki teo-
retycznie nie znalazły istotnego przełożenia na praktykę – przedstawiona
metoda lecznicza jest skuteczna tylko w niewielkim odsetku przypadków.
W ostatnich latach w leczeniu pacjentów z kardiomiopatią przerostową
znalazły zastosowanie kardiowertery-defibrylatory (implantable cardioverter-
-defibrillator, ICD), najskuteczniejsza obecnie metoda w zapobieganiu wy-
stępowania nagłego zgonu sercowego. Pacjenci z kardiomiopatią przerosto-
wą, którzy przebyli zatrzymanie krążenia, z wywołanymi utrwalonymi
101

częstoskurczami komorowymi w badaniu elektrofizjologicznym, z nieutrwa-
lonymi częstoskurczami komorowymi w badaniu holterowskim bądź z ma-
sywnym przerostem mięśnia lewej komory powyżej 30 mm – to grupa szcze-
gólnie narażona na wystąpienie nagłego zgonu sercowego. Wśród tych
pacjentów należy rozważyć wszczepienie ICD.
Inną nową metodą w leczeniu kardiomiopatii przerostowej jest nieinwazyj-
na redukcja przerostu przegrody międzykomorowej, poprzez spowodowanie
alkoholowej embolizacji tętnicy przegrodowej, z wytworzeniem ograniczone-
go zawału mięśnia sercowego w okolicy podstawnej części przegrody. W kon-
sekwencji procesów przebudowy pozawałowej dochodzi do ścieńczenia w ob-
szarze uszkodzenia, co w konsekwencji eliminuje zawężenie śródkomorowe
lub zawężanie w drodze odpływu lewej komory. Metoda ta jest w stanie zastą-
pić działania kardiochirurgiczne. Dostępne obecnie kilkuletnie obserwacje od-
ległe pacjentów poddanych leczeniu wyżej wymienioną metodą, wskazują na
istotne obniżenie gradientu w drodze odpływu lewej komory oraz poprawę to-
lerancji wysiłku. Występowanie bloku przedsionkowo-komorowego w 25%
wymaga wszczepienia układu stymulującego serce. Poprawa warunków hemo-
dynamicznych pracy serca osiągnięta tą metodą również wpływa na zmniej-
szenie ryzyka wystąpienia groźnych komorowych zaburzeń rytmu serca.
Opisując kardiomiopatię przerostową, należy wspomnieć również o coraz
częstszych doniesieniach dotyczących występowania tej choroby u osób star-
szych. Jakkolwiek nie wiadomo, czy jest to odmiana pierwotnej kardiomio-
patii przerostowej występującej w młodszym wieku, czy też inna jednostka
chorobowa, to kardiomiopatia przerostowa osób starszych ma na ogół od-
mienny przebieg kliniczny. Obraz serca uzyskiwany przy użyciu inwazyjnych
i nieinwazyjnych metod wizualizacji obrazowej jest identyczny bądź bardzo
zbliżony do obrazów serca w kardiomiopatiach osób młodych. Natomiast
w obrazie klinicznym dominują objawy niewydolności serca i bóle dławico-
we. Wydaje się, że jest to związane z naturalnym przebiegiem kardiomiopa-
tii przerostowej, ze zwłóknieniem lewej komory powodującym dalsze pogor-
szenie podatności rozkurczowej, a nawet w okresie schyłkowym choroby
– rozstrzenią lewej komory. Zmiany patofizjologiczne mają swoje implika-
cje kliniczne. Zmniejszeniu ulega ryzyko nagłego zgonu sercowego, nato-
miast częściej niż u osób młodych pojawiają się nadkomorowe tachyarytmie,
przede wszystkim migotanie przedsionków, znacznie pogarszające stan ogól-
ny chorego. Przesunięciu ulega również punkt ciężkości w leczeniu zaburzeń
rytmu. Większość osób starszych z kardiomiopatią przerostową nie toleruje
bądź źle toleruje nawet małe dawki leków blokujących receptory ß, jak rów-
nież blokujących kanały wapniowe. Lekiem z wyboru w leczeniu komoro-
wych zaburzeń rytmu staje się amiodaron, mający ponadto lepszą skutecz-
102

ność od leków beta-adrenolitycznych i antagonistów kanałów wapniowych
w prewencji wtórnej migotania przedsionków.
Reasumując, należy podkreślić, że mimo przeprowadzenia dużej liczby ba-
dań dotyczących kardiomiopatii przerostowej i wprowadzenia do leczenia sze-
rokiej gamy leków antyarytmicznych, zapobieganie nagłym zgonom z przyczyn
sercowych u osób młodych jest złe. W celu określenia zagrożenia wystąpie-
niem nagłego zgonu sercowego powinno wykonywać się obecnie badania ge-
netyczne, mające na celu określenie typu mutacji odpowiedzialnej za wystą-
pienie kardiomiopatii przerostowej. Pewną iskierkę nadziei na skuteczniejsze
leczenie kardiomiopatii i zmniejszenie tempa przerostu mięśnia lub nawet je-
go regresję dają leki blokujące receptory ß i leki blokujące kanały wapniowe.
Najbardziej obiecującym działaniem tych leków jest właśnie zmniejszanie ma-
sy przerośniętego mięśnia sercowego, niemniej jednak dotychczasowe korzyst-
ne wyniki muszą być potwierdzone w dalszych badaniach na większej liczbie
pacjentów. Podobnie wygląda sytuacja w leczeniu groźnych komorowych zabu-
rzeń rytmu u pacjentów z kardiomiopatią przerostową. Największe nadzieje
w zapobieganiu nagłym zgonom pokłada się w lekach grupy III wg Vaugha-
na-Williamsa, jednak na ostateczne wyniki musimy poczekać. Ulegają posze-
rzeniu wskazania do stosowania ICD w zapobieganiu wystąpienia nagłego
zgonu sercowego w grupie chorych z kardiomiopatią przerostową. Również
dynamicznie rozwijają się metody leczenia, mające na celu zmniejszenie gra-
dientu zawężania śródkomorowego czy w drodze odpływu lewej komory.
Niejednorodna ekspresja fenotypowa kardiomiopatii przerostowej, zróżnico-
wana patofizjologia oraz przebieg kliniczny stanowią przeszkodę w konstruowa-
niu badań dotyczących tej jednostki chorobowej. Dlatego trudno oczekiwać jed-
noznacznych rozstrzygnięć wytyczających strategię leczenia kardiomiopatii
przerostowej na podstawie wyników randomizowanych badań klinicznych.
Zapamiętaj!
1. Kardiomiopatia przerostowa jest najczęściej spotykaną chorobą serca dzie-
dziczoną jednogenowo, autosomalnie, dominująco.
2. Kardiomiopatia przerostowa jest jedną z najczęstszych przyczyn wystąpienia
nagłego zgonu sercowego zarówno u dzieci, jak i u dorosłych w mechani-
zmie złożonych komorowych zaburzeń rytmu serca.
3. Określenie rodzaju mutacji odpowiedzialnej za wystąpienie kardiomiopatii
przerostowej pozwala na stratyfikację ryzyka nagłego zgonu sercowego na
podstawie genotypu.
103

4. Podstawową praktyczną metodą rozpoznania jest echokardiografia. Zabu-
rzenia rytmu muszą być ocenione metodą Holtera.
5. Metody leczenia kardiomiopatii przerostowej:
• leczenie antyarytmiczne obejmuje stosowanie:
– amiodaronu,
– wszczepienie kardiowertera-defibrylatora (ICD);
• farmakoterapia kardiomiopatii przerostowej opiera się na stosowa-
niu leków beta-adrenolitycznych oraz niedihydropirydynowych anta-
gonistów kanałów wapniowych;
• metody inwazyjne zmniejszające gradient w drodze odpływu lewej
komory:
– embolizacja tętnicy przegrodowej z wytworzeniem kontrolo-
wanego zawału,
– wycięcie fragmentu przegrody międzykomorowej odpowia-
dającej za zawężanie,
– stymulacja resynchronizacyjna.
Warto przeczytać:
E. Braunwald: Hypertrophic cardiomyopathy – the benefits of a multidiscipli-
nary approach. N. Engl. J. Med. 2002; 347: 1306-1307.
S. Kruś: Patologia serca. J. Groniowski, S. Kruś: Podstawy patomorfologii.
PZWL Warszawa 1984, 359.
B.J. Maron, W.K. Shen, M.S. Link et al.: Efficacy of implantable cardiover-
ter-defibrillators for the prevention of sudden death in patients with hypertro-
phic cardiomyopathy. N. Engl. J. Med. 2000; 342: 365-373.
J.C. Moolman, V.A. Corfield, B. Posen et al.: Sudden death due to troponin
T mutations. J. Am. Coll. Cardiol. 1997; 29: 549-555.
P. Spirito, P. Bellone, K.M. Harris et al.: Magnitude of left ventricular hy-
pertrophy and risk of sudden death in hypertrophic cardiomyopathy. N. Engl.
J. Med. 2000; 342: 1778-1785.
P. Spirito et al.: The management of hypertrophic cardiomyopathy. N. Engl.
J. Med. 1997; 336: 775-785.
The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators.
A comparison of antiarrhythmic-drug therapy with implantable defibrillators
in patients resuscitated from near-fatal ventricular arrhythmias. N. Engl. J.
Med. 1997; 337: 1576-1583.
104

X.
NAGŁY ZGON SERCOWY U SPORTOWCÓW
Jerzy Kuch, Artur Mamcarz, Wojciech Braksator
Nagłe zgony sercowe wśród osób względnie młodych i uchodzących za
zdrowe zawsze bulwersują. Jeśli zdarzają się one wśród sportowców wyczy-
nowych, frustracja jest jeszcze większa. Tymczasem zaskakują nas od czasu
do czasu wiadomości o nagłych zgonach w wielkich imprezach sportowych
w USA czy w Europie. Zdarzają się również nagłe zgony wśród sportowców
i byłych sportowców także w Polsce.
Omawiając nagłe zgony sercowe wśród sportowców, nasuwają się nie-
odparte pytania; jakie są przyczyny nagłych zgonów, jaki jest ich mecha-
nizm i wreszcie, czy wiek i rodzaj uprawianej dyscypliny ma istotne zna-
czenie?
Na podstawie współczesnej wiedzy na ten temat wiadomo, że nagłe zgo-
ny sercowe w ponad 90% są spowodowane groźnymi arytmiami; badacze
z Bethesdy stwierdzili, że nagłe zgony wśród sportowców amerykańskich
były spowodowane zaburzeniami rytmu w 94% przypadków, także lekarze
z Mediolanu wykazali ten mechanizm nagłej śmierci u 92-98% osób upra-
wiających sport. Jakie są więc przyczyny groźnych zaburzeń rytmu serca,
które w wytrenowanych, sprawnych organizmach prowadzą do nagłej
śmierci?
W ocenie przyczyn śmiertelnych zaburzeń rytmu serca należy brać pod
uwagę wiek, który jest wielce różnicującym czynnikiem arytmii sercowych
wśród sportowców.
Świetnie udokumentowany materiał na ten temat przedstawili badacze
z Bethesdy – Maron i wsp. W grupie młodych sportowców (18-25 lat) wyka-
zali, że główną przyczyną groźnych zaburzeń rytmu i w następstwie nagłej
śmierci była kardiomiopatia przerostowa (48%). Należy podkreślić, że waga
serca w badaniu autopsyjnym była dość duża lub duża (400-600 g), ze znacz-
nym, często asymetrycznym przerostem przegrody międzykomorowej (po-
wyżej 15 mm). Dla wielu sportowców tej grupy nagły zgon był pierwszym ob-
jawem choroby serca. Znaczny odsetek zgonów (18%) stanowił samoistny
przerost lewej komory. Ta postać przerostu budzi nierzadko kontrowersje
wśród badaczy; jedni zaliczają tę patologię do kardiomiopatii przerostowej,
inni uważają, że nie spełnia ona określonych kryteriów klinicznych, echokar-
diograficznych i patomorfologicznych tej choroby. Istnieje bowiem szereg
czynników różnicujących samoistny przerost lewej komory od pierwotnej
kardiomiopatii przerostowej. Najważniejsze z nich to:
105

Należy jednak przyjąć, że przerost, niezależnie od jego pochodzenia stwa-
rza dogodne podłoże do powstawania groźnych dla życia zaburzeń rytmu.
Znaczna masa mięśniowa przy niezadowalającym unaczynieniu wieńcowym
prowadzić może do upośledzonej perfuzji pewnych obszarów mięśnia lewej
komory i powstawania ognisk ektopowych, generujących groźne zaburzenia
rytmu. Na szczególną uwagę zasługuje fakt, że choć kardiomiopatia przero-
stowa bierze swój początek we wczesnym dzieciństwie bądź od urodzenia,
objawy jej często nie pojawiają się w początkowym okresie aktywności spor-
towej. Dopiero dodatkowe obciążenia, takie jak infekcje, zaburzenia wod-
no-elektrolitowe i inne, prowadzą do jej ujawnienia, niestety często w for-
mie bardzo dramatycznej.
Warto zauważyć, że w materiale autorów włoskich istotną przyczyną na-
głych zgonów u sportowców wyczynowych była kardiomiopatia prawej ko-
mory (arytmogenna dysplazja prawej komory). Rzadziej spotykanymi przy-
czynami śmiertelnych zaburzeń rytmu serca wśród młodych sportowców są
nieprawidłowości anatomiczne naczyń wieńcowych, pęknięcie i rozwarstwie-
nie aorty czy choroba niedokrwienna serca.
Przyczyny nagłych zgonów wśród sportowców starszych (powyżej 35 lat)
różnią się dość istotnie od tych spotykanych wśród sportowców młodych.
Główną przyczyną jest choroba niedokrwienna serca (ChNS), stanowi ona
bowiem około 80% przyczyn wszystkich nagłych zgonów. Pozostałe 20%
obejmuje choroby spotykane nie częściej niż w populacji ogólnej, w tej sa-
mej grupie wiekowej, takie jak wady zastawkowe serca, kardiomiopatię
przerostową, samoistny przerost lewej komory i inne. Z dotychczasowych
statystyk wynika, że nagłe zgony w tej grupie występowały w czasie dużych
obciążeń lub bezpośrednio po nich u biegaczy długodystansowych, piłka-
rzy, tenisistów i graczy w squash. Badania patomorfologiczne wykazywały
zazwyczaj znaczne miażdżycowe zwężenia naczyń wieńcowych, które były
• przerost jest zawsze symetryczny;
• w badaniu histopatologicznym nie stwierdza się dezorganizacji
włókien mięśniowych;
• nie udaje się ustalić genetycznej transmisji wśród najbliższych
krewnych na podstawie wyników i badań dodatkowych
(echokardiografia, biopsja);
• w badaniach rutynowych przerost samoistny jest oceniany jako
nieznacznie przekraczający granicę „przerostu fizjologicznego”.
106

prawdopodobnie przyczyną śmiertelnych zaburzeń rytmu serca w mechani-
zmie niedokrwienia.
W opinii publicznej sportowcy uchodzą za najzdrowszą część społeczeń-
stwa, ludzi posiadających „serce sportowe”. Określenie to budzi często kon-
trowersje, także wśród lekarzy. Powszechnie przyjmuje się, że serce sporto-
we to serce o powiększonej sylwetce i umiarkowanie, a czasem znacząco
pogrubiałym mięśniu lewej komory. Część badaczy wyróżnia nawet dwa typy
morfologiczne serca sportowego:
Znaczna część badaczy uważa jednak, że zbyt duża tolerancja w zakresie
przerostu serca może prowadzić do groźnych zaburzeń rytmu i w konse-
kwencji do poważnych wydarzeń sercowych. Wielu badaczy z renomowanych
ośrodków medycyny sportowej z Włoch i Stanów Zjednoczonych wykazało,
że omawiane parametry morfologiczne serca u sportowców dyscyplin siło-
wych i wytrzymałościowych są podobne. Wyniki te są zbieżne z obserwacja-
mi naszej kliniki. Badania kontrolne, prowadzone u reprezentantów polskiej
sztangi i zapasów, nie wykazywały istotnych różnic w zakresie cech morfo-
logicznych i czynnościowych serc tych zawodników w porównaniu z wynika-
mi przedstawicieli dyscyplin wytrzymałościowych.
Niezależnie od opinii i zmieniających się w tym zakresie poglądów (Pelliccia
przedstawił np. interesujący materiał dotyczący różnic w wymiarach serca
u przedstawicieli różnych dyscyplin sportowych) należy przyjąć, że w ogrom-
nej większości przypadków sport wyczynowy nie prowadzi do przerostu pato-
logicznego.
Powstaje więc pytanie, jeśli nie rodzaj uprawianej dyscypliny, to jakie inne
przyczyny decydują o tym, że u pewnej części sportowców, w wyniku długo-
trwałego treningu, dochodzi do znacznego przerostu ścian lewej komory (po-
wyżej 15 mm), przy zwykle niepowiększonym istotnie wymiarze wewnętrz-
nym komory (przerost koncentryczny), natomiast u pozostałej większości
zawodników grubość ściany lewej komory może być umiarkowanie powięk-
szona i nie przekracza zazwyczaj 13-14 mm? W grupie tej, adekwatnie do
grubości ściany powiększony jest wewnętrzny wymiar komory i traktowany
jest jako zmiana adaptacyjna.
• przerost koncentryczny występuje u sportowców uprawiających
dyscypliny siłowe, np. podnoszenie ciężarów;
• przerost ekscentryczny spotykany u sportowców uprawiających
dyscypliny wytrzymałościowe, np. biegi długie.
107

Przyczyn tego zjawiska może być kilka, nie wszystkie są do końca poznane.
O dwóch z nich wiadomo wystarczająco dużo, aby uznać je za czynniki
sprawcze; są to związki anaboliczne i czynniki genetyczne.
Wiele badań na temat „serca sportowego” pochodzi z początku lat 90.,
kiedy to nastąpił nadzwyczajny rozwój dyscyplin siłowych, zwłaszcza podno-
szenia ciężarów. Jednocześnie w tym czasie notuje się bardzo dynamiczny
rozwój echokardiografii, metody podstawowej w diagnostyce przerostu.
Właśnie podnoszenie ciężarów stało się bardzo atrakcyjnym modelem do
badań nad właściwościami morfologicznymi i czynnościowymi „serca sporto-
wego”. Dziś wiemy na podstawie wywiadów i badań, że nadzwyczajne wyni-
ki sportowe w dyscyplinach siłowych uzyskiwano na skutek wielkiej pracy
treningowej, ale także intensywnego wspomagania anabolikami. Prowadziło
to do szybkiego przyrostu masy mięśni szkieletowych, a także patologiczne-
go, koncentrycznego przerostu mięśnia lewej komory. Była to kardiomiopa-
tia przerostowa, wtórna do zażywanych środków. Pod opieką ambulatoryjną
kliniki było kilku byłych i czynnych sportowców dyscyplin siłowych z kardio-
miopatią przerostową i groźnymi zaburzeniami rytmu serca. Przekonujące
badania na ten temat oparte na wiarygodnych wynikach przedstawiła grupa
badaczy włoskich na czele z De Piccoli.
W ostatnich kilkunastu latach zaprezentowano badania nad ewentualną
rolą czynników genetycznych w rozwoju przerostu lewej komory u osób bez
innych uwarunkowań do tego rodzaju patologii. Interesujące są wyniki badań
lekarzy angielskich z Uniwersytetu Londyńskiego, którymi objęto 1248 mło-
dych ochotników, przez okres 10 tygodni poddawanych codziennemu, inten-
sywnemu treningowi fizycznemu. Przed i po okresie treningu u wszystkich
wykonano badania echokardiograficzne oraz badania genetyczne w kierun-
ku polimorfizmu genu konwertazy angiotensyny. Badania te przemawiają za
hipotezą, że miejscowy układ renina-angiotensyna może regulować przyrost
masy mięśniowej lewej komory w odpowiedzi na intensywny trening fizycz-
ny. Wykazano, że osoby z genotypem DD dla konwertazy angiotensyny po
10-tygodniowym treningu miały średnio 3-krotnie większy przyrost masy
mięśniowej serca w porównaniu z osobami z genotypem II. Badania te wska-
zują, że uwarunkowania genetyczne mogą decydować o wystąpieniu przero-
stu lewej komory, wywołanego stałym, ciężkim wysiłkiem fizycznym. W ba-
danej grupie 1248 młodych ochotników genotyp DD stwierdzono u 27%
badanych. Odsetek ten wskazuje na możliwą częstość występowania kardio-
miopatii przerostowej.
Własne badania tego interesującego problemu prowadzimy od kilku lat,
wstępne wyniki 2-3-letniej obserwacji w grupach sportowców zawodowych
108

są niezwykle interesujące. U sportowców z genotypem DD parametry opisu-
jące przerost lewej komory są istotnie statystycznie większe niż u tych z ge-
notypem DI czy II i to właśnie ten rodzaj genotypu może decydować o nara-
staniu przerostu wraz z latami treningu.
Nasuwa się więc pytanie, jak zatem różnicować fizjologiczne pogrubienie
mięśnia lewej komory od przerostu – zmiany patologicznej. Pomocna w tym
przypadku może być powszechnie dostępna metoda – badanie echokardio-
graficzne. Jego dwa elementy wydają się być szczególnie istotne. Po pierwsze
– wyliczenie tzw. współczynnika RWT (Relative Wall Thickness), który jest
opisywany przez stosunek grubości ściany lewej komory do wielkości jej pro-
mienia. Zawodnicy ze współczynnikiem wyraźnie odbiegającym od wartości
granicznych (0,43-0,45) powinni być poddani przynajmniej raz w roku do-
kładnym badaniom kontrolnym, dla wykluczenia ewentualnej kardiomiopa-
tii przerostowej. Wskaźnik ten sprawdza się jednak głównie u sportowców
statycznych, gdy przerost jest koncentryczny, co nie zmienia oczywiście jego
przydatności. Po drugie – ocena funkcji rozkurczowej lewej komory, która
jest prawidłowa u sportowców ze zmianami adaptacyjnymi.
Oceniając możliwość wystąpienia i częstość występowania zaburzeń rytmu
serca u sportowców, należy pamiętać, że sportowcy wyczynowi podlegają tym
samym prawom i zagrożeniom biologicznym. Ponieważ współczesny sport
wyczynowy odbywa się często na granicy fizjologicznych możliwości ludz-
kich, które to granice dość łatwo przekroczyć, to fakt ten, o ile wymknie się
odpowiedniej kontroli, stanowić może dodatkowy czynnik zagrożenia.
W sercu sportowym, tak jak w sercach osób, które nie uprawiają sportu,
przyczynami patofizjologicznymi zaburzeń rytmu serca mogą być:
Na „serce sportowe” może być tylko inna skala oddziaływania tych czynni-
ków niż w populacji ogólnej. Najczęściej spotykanymi zaburzeniami rytmu
u sportowców są tzw. łagodne arytmie nadkomorowe i komorowe, które nie
stanowią istotnego zagrożenia dla zdrowia, a zagrożenie nagłym zgonem
• procesy zapalno-immunologiczne;
• zaburzenia endokrynne;
• miażdżyca;
• wady strukturalne i naczyniowe serca;
• czynniki zewnątrzpochodne (środki farmakologiczne);
• zaburzenia układu neuro-wegetatywnego;
• inne.
109

w tych przypadkach jest minimalne. Wystąpienie arytmii złożonych nakłada
na lekarza sportowego obowiązek przeprowadzenia precyzyjnej diagnosty-
ki – problem ten omówiono dokładnie w innym rozdziale.
To wycinkowe spojrzenie na sport wyczynowy wskazuje, że problemy kardio-
logiczne, a zwłaszcza ryzyko nagłego zgonu wśród sportowców jest sprawą du-
żej wagi w skali światowej. Zwłaszcza teraz, kiedy sport stał się wielkim bizne-
sem. Sprawa pełnej kontroli specjalistycznej nad zdrowiem uprawiających sport
przekracza często możliwości organizacyjne i finansowe wielu krajów. Tak jest
zapewne i u nas. Należy jednak przyjąć, że sport wielkich imprez masowych po-
winien być objęty pewnym planowym systemem opieki zdrowotnej. A sport wy-
czynowy powinien być poddany systematycznej, wysoko kwalifikowanej kon-
troli medycznej, w tym kardiologicznej. W ten sposób można by wyeliminować
pewną część nagłych incydentów sercowych wśród znanych sportowców.
Zapamiętaj!
1. Najczęstszą przyczyną nagłych zgonów u sportowców wyczynowych w mło-
dym wieku (18-25 lat) jest pierwotna kardiomiopatia przerostowa lub idio-
patyczny przerost lewej komory.
2. U sportowców starszych dominują przyczyny naczyniowe, przede wszystkim
miażdżyca naczyń wieńcowych (80%).
3. Rodzaj przerostu może być związany z uprawianą dyscypliną, choć wielu
badaczy w świetle współczesnej wiedzy uważa, że dominują uwarunkowa-
nia genetyczne (polimorfizm genów układu ACE z genotypem DD).
4. Zasadniczą rolę w ocenie przerostu odgrywa badanie echokardiograficzne,
które w sposób precyzyjny opisuje jego rodzaj, pozwala też śledzić dynami-
kę zmian w czasie (lata treningu).
5. Kompleksowa ocena kardiologiczna sportowców wyczynowych (wysoko kwa-
lifikowana) może ustrzec lub zmniejszyć ryzyko nagłego zgonu w tej grupie.
Warto przeczytać:
D. Corrado et al.: Sudden death in young competitive athletes: Clinicopato-
logic correlations in 22 cases. Am. J. Med. 1990; 898: 588.
B. De Piccoli et al.: Anabolic steroid use in body builders: an echocardio-
graphic study of left ventricle morphology and function. Int. J. Sports Med.
1991; 12: 408.
110

B. Maron et al.: Sudden death in young athletes. Circulation 1980; 62: 218.
J. Kuch: Nagłe zgony w sporcie wyczynowym. Medycyna Sportowa 2003, 19;
254-260.
B.J. Maron, C.G. Araujo, P.D. Thompson et al.: Recommendations for pre-
participation screening and the assessment of cardiovascular disease in ma-
ster athletes. Circulation 2001; 103: 327-334.
A. Pelliccia, B.J. Maron: Preparticipation cardiovascular evaluation of the
competitive athlete: perspectives from the 30 year Italian experience. Am. J.
Cardiol. 1995; 75: 827.
111

XI.
ZABURZENIA RYTMU SERCA U SPORTOWCÓW.
ZASADY DIAGNOSTYKI, LECZENIA I ORZEKANIA
Artur Mamcarz, Wojciech Braksator, Jerzy Kuch
Zaburzenia rytmu serca u sportowców stanowią niezwykle trudny problem
diagnostyczny, terapeutyczny i orzeczniczy. Dzieje się tak dlatego, że aryt-
mie stwierdzane u sportowców mogą mieć bardzo różny charakter, od ła-
godnych, sporadycznie występujących i skąpoobjawowych z jednej strony, do
ciężkich, groźnych dla życia i bogatosymptomatycznych z drugiej. Zasady
kardiologicznego badania sportowców są co prawda ujęte w pewne standar-
dy, ale diagnostyka zaburzeń rytmu jest trudna także z tego powodu, że
w trakcie badania klinicznego lub spoczynkowego badania EKG objawy mo-
gą nie występować. Wiadomo, że zasadniczym celem kardiologicznej oceny
sportowca jest poszukiwanie przyczyn i zmniejszanie ryzyka nagłego zgonu,
związanego przede wszystkim z groźną arytmią, co stawia przed badającym
bardzo wysokie wymagania – diagnostyka jest czasem trudna, mało dostęp-
na i kosztowna. W oddzielnym rozdziale przedstawiono rozważania na te-
mat przyczyn nagłych zgonów w sporcie wyczynowym i strategii postępowa-
nia w tym zakresie.
Problemem może być również to, że określona arytmia w małym stopniu
wpływa na wyniki i zagrożenie u sportowca uprawiającego grę w golfa, a w spo-
sób istotny może ograniczać możliwości kolarza czy biegacza długodystanso-
wego, zwiększając dodatkowo ryzyko istotnych powikłań.
Wytyczne, którymi posługujemy się w standardowym zakresie diagno-
styczno-orzeczniczym są związane z badaniami amerykańskimi i włoskimi,
publikowanymi w połowie lat 90. Niewiele się w tym zakresie zmieniło do
dziś, postaramy się wobec tego przedstawić podstawowe założenia kardio-
logicznej oceny sportowców z arytmią na podstawie tych opracowań, a na
koniec przedstawić zasady orzekania w kardiologii sportowej na świecie
i propozycję standardu, jakim się posługujemy w codziennej praktyce kli-
nicznej.
Dla jasności rozdziału, w tabeli pierwszej przedstawiono podział wybra-
nych dyscyplin na określone kategorie, w zależności od głównych kompo-
nent wysiłku (statycznej i dynamicznej). Pozwala to śledzić zasady orzeczni-
cze obowiązujące aktualnie w sporcie wyczynowym.
112

NADKOMOROWE ZABURZENIA RYTMU SERCA
Nadkomorowe zaburzenia rytmu serca spotykamy często w praktyce le-
karskiej. Są one z reguły traktowane jako niegroźne, często nie wymagają
leczenia, zdarza się jednak, że są przyczyną ciężkich objawów klinicznych,
także u sportowców wyczynowych (omdlenia, utraty przytomności, urazy).
Opisywano także nagłe zgony u chorych z arytmią nadkomorową, głównie
w przebiegu zespołu WPW (może to dotyczyć również sportowców) – pro-
blem ten opisano szerzej w innym rozdziale.
U sportowców ze sporadyczną arytmią nadkomorową, przy braku obja-
wów klinicznych sugerujących organiczną chorobę serca, możliwe jest upra-
wianie sportu w pełnym zakresie, a kontrola może się ograniczać do stan-
dardowego 12-odprowadzeniowego badania EKG.
Migotanie i trzepotanie przedsionków to arytmie, które w formie napado-
wej występują u sportowców z równą częstością jak w populacji generalnej
w podobnym wieku. Biffi ocenia ich częstość na 0,2% wśród 5000 młodych,
wyczynowych sportowców. Zasadniczym celem diagnostycznym jest wyklu-
Tabela 1: Klasyfikacja dyscyplin uwzględniająca dynamiczne i statyczne komponenty wysiłku
Dyscyplina
A.
Niskodynamiczna
B.
Średniodynamiczna
C.
Wysokodynamiczna
I.
Niskostatyczna
• bilard;
• kręgle;
• golf.
• baseball;
• tenis stołowy;
• tenis ziemny
(debel);
• piłka siatkowa.
• badminton;
• narciarstwo biegowe
(klasyczne);
• hokej ziemny;
• piłka nożna;
• tenis ziemny
(single);
• biegi
długodystansowe.
II.
Średniostatyczna
• nurkowanie;
• rajdy samochodowe;
• sporty motorowe.
• rugby;
• football
(amerykański);
• sprint;
• pływanie
synchroniczne.
• koszykówka;
• hokej na lodzie;
• biegi
średniodystansowe;
• pływanie;
• piłka ręczna.
III.
Wysokostatyczna
• gimnastyka;
• judo, karate;
• żeglarstwo;
• podnoszenie
ciężarów;
• windsurfing.
• wrestling;
• body building;
• narciarstwo (zjazd).
• boks;
• kajakarstwo,
wioślarstwo;
• kolarstwo.
113

czenie organicznej choroby serca (zapalenie, wada), choroby metabolicznej
(nadczynność tarczycy), a także zespołu WPW. Zalecenia komitetu eksper-
tów z Bethesdy mówią, że w przypadku trzepotania przedsionków kwalifi-
kacja do pełnego uprawiania sportu może się odbyć po 3-6 miesiącach bez
nawrotu arytmii, nawet u pacjenta bez uchwytnej, organicznej choroby serca,
do tego czasu możliwe są jedynie pozytywne orzeczenia w zakresie dyscyplin
klasy IA.
W przypadku migotania przedsionków, pozytywne orzeczenie po skutecz-
nym umiarowieniu (zasady podobne jak dla ogólnej populacji) i wyklucze-
niu choroby organicznej (EKG, ECHO, stymulacja) może być postawione
wcześniej. W przypadku konieczności przewlekłej terapii antyarytmicznej
(beta-adrenolityki, antagoniści kanałów wapniowych) lub konieczności le-
czenia przeciwzakrzepowego, orzekanie co do uprawiania większości dyscy-
plin jest niemożliwe. Związane to jest z jednej strony z zakazem stosowania
niektórych leków (beta-adrenolityki), z drugiej zaś z ryzykiem istotnych po-
wikłań krwotocznych w dyscyplinach o dużym ryzyku kontuzji.
Częstoskurcze nadkomorowe to różnego rodzaju nadkomorowe napadowe
tachykardie, które odpowiadają za większość symptomatycznych napadów
arytmii u sportowców. W dużym materiale autorów włoskich, którzy badali
wyczynowych sportowców w czasie stymulacji przezprzełykowej, u 50% wy-
zwolono ANVRT (atrio-ventricular nodal re-entry tachycardia), u 25% AF
(atrial fibrillation), u 12,5% AFL (atrial flutter), u 6,25% ORT (ortodromic
tachycardia) i u 6,25% AT (automatic atrial tachycardia).
W większości przypadków za arytmie te odpowiedzialne było wzmożone
napięcie układu współczulnego, nie zaś organiczne uszkodzenie serca, co
stwarza jednak duże trudności terapeutyczne, lekami z wyboru w tych sytu-
acjach powinny być bowiem leki beta-adrenolityczne, które u sportowców
wyczynowych są albo przeciwwskazane, albo pogarszają sprawność wysiłko-
wą. Zasady orzekania są podobne jak w przypadku napadów trzepotania
przedsionków (jeśli są symptomatyczne) i wymagają 3-6-miesięcznej prze-
rwy w startach (ocena nawrotowości arytmii).
Zaburzenia rytmu w przebiegu zespołu WPW są w grupie sportowców wy-
czynowych dużym wyzwaniem diagnostycznym i terapeutycznym. Obowiązu-
ją co prawda wytyczne dotyczące tej grupy, ale eksperci są zgodni, że niewy-
starczająco oszacowano ryzyko nagłego zgonu u sportowców z zespołem WPW.
Uważa się, że przypadkowo wykryte cechy zespołu preekscytacji (EKG)
u pacjenta asymptomatycznego nie stanowią wskazania do dalszej diagno-
styki elektrofizjologicznej. Konieczna jest jednak morfologiczna ocena ukła-
du krążenia w celu wykluczenia schorzeń towarzyszących. U chorych z wy-
114

wiadem zasłabnięć, utrat przytomności, kołatania serca, konieczne jest wy-
konanie badania elektrofizjologicznego i terapia zależna od jego wyniku.
Coraz więcej zwolenników ma metoda leczenia inwazyjnego (ablacja drogi
dodatkowej), należy jednak pamiętać, że jest to metoda mało dostępna,
kosztowna i obarczona ryzykiem powikłań. We własnych doświadczeniach
stosujemy algorytm diagnostyczny, który wszystkim pacjentom z WPW (tak-
że asymptomatycznym) proponuje pełną diagnostykę, także elektrofizjolo-
giczną. Na podstawie takiej oceny wybieramy sposób postępowania. W ob-
serwacji pozostaje dwóch pacjentów, u których występowały napady
częstoskurczów z bardzo szybką czynnością komór, u których wykonano
z dobrym efektem ablację. Problem WPW w sporcie nie jest do końca roz-
wiązany, a orzekanie w każdym przypadku musi być indywidualne. Można
tu przedstawić również kontrowersyjną w naszym rozumieniu opinię, że przy
udokumentowanych arytmiach nadkomorowych, gdzie częstość rytmu nie
przekracza 240 na minutę i nie ma wywiadu zasłabnięć – możemy dopuścić
sportowca do pełnego zakresu treningowego i startowego we wszystkich dys-
cyplinach, natomiast w sytuacji, gdy częstość ta jest większa niż 240/minutę
lub występują objawy kliniczne – jedynie do sportów klasy IA. Wydaje się
jednak, że takie podejście jest zdecydowanie teoretyczne i nie powinno zna-
leźć praktycznego zastosowania.
KOMOROWE ZABURZENIA RYTMU SERCA
Komorowe zaburzenia rytmu są jednym z najtrudniejszych problemów kli-
nicznych we współczesnej kardiologii, mogą one bowiem występować zarów-
no u osób zdrowych, jak i pacjentów z istotnymi patologiami w zakresie ukła-
du krążenia począwszy od osób z nadciśnieniem tętniczym czy zespołem
MVP poprzez chorobę niedokrwienną serca, niewydolność serca, czy też wadę
zastawkową, aż po kardiomiopatie pierwotne (także kardiomiopatia prawej
komory). Występować mogą również w licznych patologiach pozasercowych,
takich chociażby jak zaburzenia funkcji tarczycy czy zaburzenia elektrolitowe.
Diagnostyka arytmii komorowych i zasady orzekania u sportowców wyczy-
nowych są przedmiotem bardzo licznych opracowań. Fakt ten nikogo nie
dziwi, ponieważ to właśnie groźne komorowe zaburzenia rytmu są przyczyną
większości nagłych zgonów, także u sportowców – wyczerpująco omówiono
te kwestie w innym rozdziale. Diagnostyka obejmuje wiele różnych badań,
począwszy od standardowego, spoczynkowego badania EKG, a skończyw-
szy na rezonansie magnetycznym (w wybranych przypadkach).
Wzorem standardu orzekania w kardiologii sportowej może być raport
opublikowany w 1997 roku w Advances in Sports Cardiology, a dotyczący wła-
115
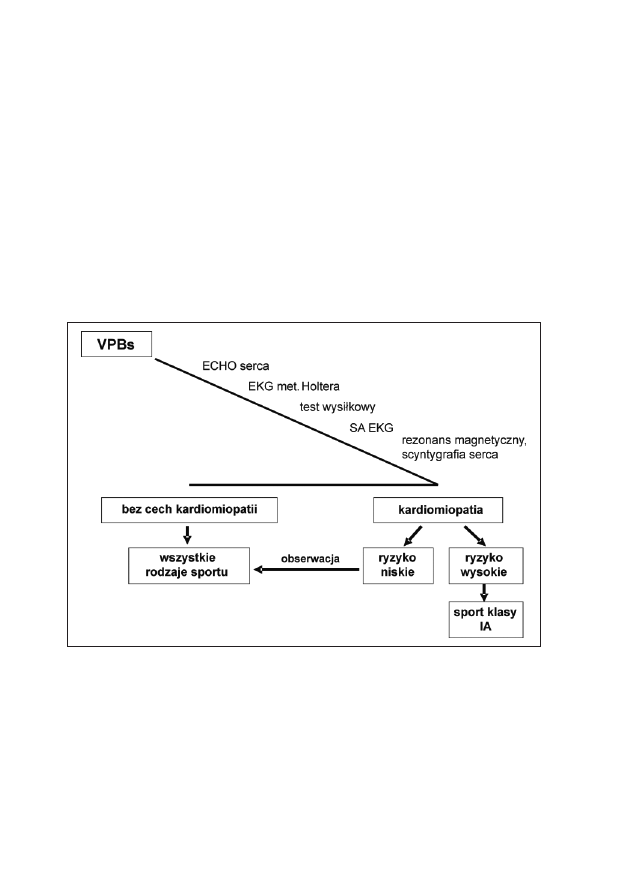
śnie problemu arytmii komorowych u sportowców. Przedstawiamy go sche-
matycznie na dwóch rycinach. Pierwsza z nich dotyczy zasad orzekania
u sportowców z pojedynczą arytmią komorową, druga zaś u pacjentów
z udokumentowanym wywiadem nieutrwalonego częstoskurczu komorowe-
go (ryc. 1, ryc. 2). Jak widać ze schematu, zasadniczym celem diagnostycz-
nym jest ocena morfologicznych nieprawidłowości dotyczących mięśnia ser-
cowego, określanych w pewnym uproszczeniu – kardiomiopatią. Należy
przez to pojęcie rozumieć w tym przypadku wszelkie nieprawidłowości struk-
turalne (przerost, kardiomiopatia przerostowa, dysplazja arytmogenna, wy-
padanie płatka zastawki mitralnej, wady serca, choroba niedokrwienna ser-
ca), które generują zaburzenia funkcji, a wtórnie – zaburzenia rytmu. Ich
identyfikacja pozwala odsunąć zawodnika od uprawiania sportu i zapobiec
groźnym powikłaniom.
W podsumowaniu tej części należy stwierdzić, że sportowcy bez organicz-
nej choroby serca, z prostą arytmią komorową mogą brać udział w rywaliza-
cji sportowej w pełnym zakresie. Jeśli wykryjemy kardiomiopatię o wysokim
ryzyku, możliwe są wtedy wyłącznie sporty klasy IA (ryc. 1). W przypadku
arytmii złożonej zakres badań diagnostycznych powinien być szerszy, a orze-
czenie o możliwości uprawiania sportu uzależnione od nawrotowości aryt-
mii, nawet wtedy, gdy nie stwierdzono cech kardiomiopatii. W przypadku jej
rozpoznania, nie ma kwalifikacji do wyczynowego uprawiania sportu (ryc. 2).
Rycina 1: Algorytm postępowania u sportowców ze sporadyczną ekstrasystolią komorową
116
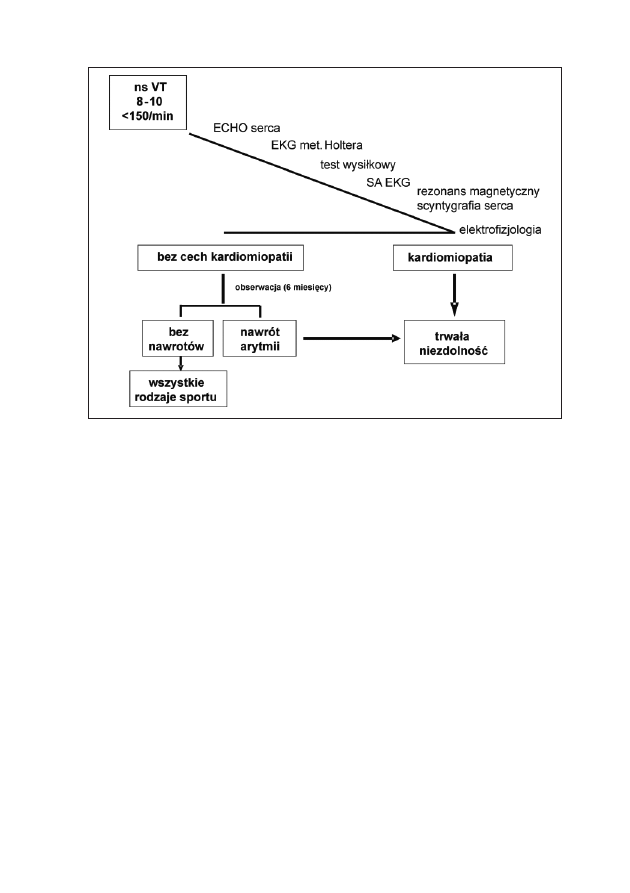
Mamy w obserwacji 16-letnią koszykarkę z kardiomiopatią prawej ko-
mory, u której stwierdzano nieutrwalony częstoskurcz komorowy z drogi
jej odpływu. Rozpoznanie postawiono na podstawie kompleksowej diagno-
styki (rozstrzygające było badanie rezonansem magnetycznym) i trwale od-
sunięto zawodniczkę od uprawiania sportu. Pozostaje ona od kilku lat
w obserwacji klinicznej, dobrano skuteczne leczenie antyarytmiczne sotalo-
lem.
U kolejnego 24-letniego sportowca wyczynowego, u którego rozpoznano
kardiomiopatię rozstrzeniową, pozapalną (rozstrzygające były badania echo-
kardiograficzne i histopatologiczne) cykl diagnostyczny rozpoczęto po stwier-
dzeniu w badaniu EKG bloku odnogi lewej i licznych komorowych pobu-
dzeń dodatkowych. I w tym przypadku decyzja, co do możliwości uprawiania
sportu, była negatywna.
Są to nieliczne przykłady orzeczeń negatywnych. W naszej praktyce wielo-
krotnie mieliśmy do czynienia z różnymi formami zaburzeń rytmu serca
(nadkomorowych i komorowych), a większość opinii (po wykonaniu precy-
zyjnej, często wnikliwej diagnostyki) pozwalała na orzeczenie o możliwości
dalszego uprawiania sportu.
Rycina 2: Algorytm postępowania u sportowców z nieutrwalonym częstoskurczem
komorowym
117

BRADYARYTMIE – ZABURZENIA PRZEWODZENIA
PRZEDSIONKOWO-KOMOROWEGO
Uprawianie sportu jest związane ze szczególną wielopłaszczyznową adap-
tacją układu krążenia do wysiłku. Jednym z elementów przewlekłej adapta-
cji jest modyfikacja funkcji autonomicznego układu nerwowego, która w wa-
runkach spoczynkowych pokazuje przewagę układu parasympatycznego.
Bradyarytmie są u sportowców spotykane częściej niż w populacji ogólnej.
Jeśli zwolnienie rytmu serca jest asymptomatyczne, a w badaniu klinicznym
nie ma cech organicznej choroby serca, to dalsze badania nie są wymagane
nawet wtedy, gdy częstość rytmu jest bardzo wolna, a w EKG rejestrujemy
pauzy do 3 sekund (EKG standardowe, badanie holterowskie). W naszych
doświadczeniach wielokrotnie widzieliśmy sportowców z zatokową brady-
kardią poniżej 30 na min, a rekordzista – zawodowy kolarz – miał w nocy
rytm zatokowy 18/min (ryc. 3).
Blok przedsionkowo-komorowy I stopnia występuje u sportowców znaczą-
co częściej niż w populacji ogólnej. Jeśli zespół komorowy (QRS) nie jest
poszerzony, a odstęp PQ nie przekracza 0,3 s, nie jest wymagana dalsza dia-
gnostyka, a uprawianie sportu możliwe jest w pełnym zakresie. Czasem
wskazane jest 24-godzinne monitorowanie EKG metodą Holtera (wykrywa-
nie bardziej zaawansowanych zaburzeń przewodzenia), badanie ECHO
(ocena morfologiczna), a rzadko badanie elektrofizjologiczne.
Podobne zalecenia obowiązują w przypadku wykrycia periodyki Wencke-
bacha, w tym przypadku jednak, w sytuacji wystąpienia objawów (zasłab-
nięcia, zawroty głowy), wskazane jest rozszerzenie diagnostyki o test wysił-
kowy, takie postępowanie pozwala bowiem ocenić narastanie stopnia bloku
przy wysiłku. Gdy taka sytuacja ma miejsce, możliwe jest orzeczenie upra-
wiania sportów o niskiej aktywności (klasa IA). Podobna strategia wystę-
puje w sytuacji krótkotrwałych (najczęściej w nocy) wstawek bloku typu
Mobitz. W większości przypadków możliwe jest uprawianie sportu w peł-
nym zakresie.
W przypadku bardziej zaawansowanych zaburzeń przewodzenia (utrwa-
lony blok II stopnia typu Mobitz lub blok całkowity) strategia postępowania
jest podobna. Diagnostyka obejmuje standardową ocenę (ECHO, badanie
holterowskie, test wysiłkowy, stymulacja), a zasady orzekania są następujące.
W przypadku braku organicznej choroby serca, wywiadu zasłabnięć, przy wą-
skich zespołach komorowych w EKG i częstości rytmu powyżej 40-50 na mi-
nutę, który przyspiesza się w czasie wysiłku, nie generując arytmii komoro-
wej – możliwa jest pełna rywalizacja sportowa. W sytuacjach, które nie
spełniają tych wymogów (pogorszenie tolerancji wysiłku, zasłabnięcia, aryt-
118

mia komorowa), należy rozważyć wszczepienie stymulatora (według ogólnie
obowiązujących wskazań). Autorytety amerykańskich towarzystw kardiolo-
gicznych i sportowych dopuszczają możliwość uprawiania sportu u osób ze
stymulatorem, unikając tych dyscyplin, w których występuje duże ryzyko ura-
zów (zwłaszcza w okolicy loży stymulatora).
Rycina 3: Bradykardia zatokowa 18-27/min
119

ZABURZENIA PRZEWODZENIA ŚRÓDKOMOROWEGO
Blok prawej odnogi pęczka Hisa (right bundle branch block, RBBB) wy-
maga oceny holterowskiej i echokardiograficznej, a w przypadku niestwier-
dzenia arytmii lub/i organicznej choroby serca, możliwe jest uprawianie
wszystkich dyscyplin.
W przypadku bloku odnogi lewej (left bundle branch block, LBBB), zwłasz-
cza u dzieci, diagnostyka powinna być szersza i obejmować także badanie
elektrofizjologiczne, szczególnie w przypadkach zasłabnięć, a postępowanie
uzależnione od wyniku tego badania. Na szczęście sytuacje takiej koniecz-
ności są bardzo rzadkie, LBBB bowiem występuje u młodych sportowców
sporadycznie, podkreślić trzeba jednak, że w każdym przypadku jego rozpo-
znania należy w sposób jednoznaczny wykluczyć przyczynę organiczną.
OGÓLNE ZASADY ORZEKANIA W KARDIOLOGII SPORTOWEJ
Nieraz będziemy mieć poważne wątpliwości, czy odsunąć zawodnika od
uprawiania sportu (czasowo, na stałe?), czy zezwolić mu na treningi i starty.
Nie jest to związane tylko z obecnością arytmii, choć musimy przyznać, że
to właśnie ten zakres problemów klinicznych jest najtrudniejszy. Czasem
problem dotyczy nadciśnienia tętniczego, zespołu wypadania płatka zastaw-
ki mitralnej czy wady serca. Niezależnie od zasadniczego problemu niezwy-
kłym ułatwieniem może być standard orzekania w kardiologii sportowej. Czy
taki standard istnieje? Już na tym etapie należy powiedzieć, że stworzenie
takiego powszechnie akceptowanego algorytmu jest niezwykle trudne, moż-
na wręcz stwierdzić, że niemożliwe. Ale mamy przecież zalecenia (rekomen-
dacje) tworzone przez grona ekspertów, głównie w Stanach Zjednoczonych,
we Włoszech, a ostatnio także w Hiszpanii. Mamy ambicje, aby podobne za-
lecenia tworzyć także dla potrzeb orzekania w naszym kraju.
Wydaje się, że warto w tym miejscu przytoczyć opinie na ten temat czoło-
wej grupy zajmującej się tym problemem, której przewodniczy amerykański
kardiolog Barry J. Maron. Na wiele niezwykle ważnych aspektów problemu
zwrócono uwagę w opracowaniach opublikowanych w Circulation w 1996
i 2001 roku, a także w 26 Raporcie z Bethesdy. Dotyczą one zarówno sportow-
ców wyczynowych, najczęściej młodych, jak i sportowców w starszym wieku,
często podejmujących lub kontynuujących aktywność sportową, nierzadko
na wysokim poziomie i z elementami rywalizacji. I choć zalecenia dotyczące
obu tych grup, różnią się pewnymi szczegółami, to w wielu aspektach są
wspólne. Różnice związane są przede wszystkim ze specyfiką zachorowań
związaną z wiekiem. Istotne ryzyko związane ze znacznymi obciążeniami wy-
siłkowymi (zaburzenia rytmu, nagła śmierć sercowa) u osób młodych jest
120

związane głównie z obecnością kardiomiopatii pierwotnych, u sportowców
starszych zaś z rozwojem zmian w naczyniach wieńcowych. Problem wypa-
dania płatka zastawki mitralnej (MVP), nadciśnienia tętniczego czy zapale-
nia mięśnia sercowego może być wspólny dla obu grup. Wady wrodzone ser-
ca to specyfika kardiologii wieku dziecięcego i zawodników młodych.
W niniejszym opracowaniu przedstawiamy pewne uogólnienia, wynikające
z publikowanych opracowań, zwracając szczególną uwagę na orzekanie
w sporcie wyczynowym.
W cytowanych raportach zwrócono uwagę, że tylko w USA problem orze-
kania dotyczy ogromnej rzeszy młodzieży uprawiającej sport (4,5 miliona)
i bliżej nieokreślonej, ale zapewne ogromnej liczby osób dorosłych. Z ekono-
micznego punktu widzenia trudno zaproponować w screeningu stosowanie
specjalistycznych, kosztownych metod diagnostycznych (test wysiłkowy, ba-
danie holterowskie, ECHO czy badanie elektrofizjologiczne) dla ustalenia
przeciwwskazań do aktywności sportowej. Metody te, z pewnością bardzo
przydatne, należy zarezerwować dla wybranych przypadków. Uznano, że na-
wet w przypadku podejrzenia klinicznego kardiomiopatii przerostowej,
echokardiograficzne rozpoznanie stawiane jest raz na 500 badań, co przy
jednostkowych kosztach specjalistycznego badania echokardiograficznego
u sportowca (400-2000 USD!) powoduje, że wykrycie jednego przypadku
„kosztuje” co najmniej 200 000 USD. Czy stać nas na to?
Eksperci uznają, że podstawową metodą godną szerokiego polecenia w prze-
siewowych badaniach sportowców jest kwalifikowane badanie podmiotowe
i przedmiotowe. Dopiero na podstawie precyzyjnie ustalonego wywiadu i ba-
dania fizykalnego można zaplanować wykonanie dokładniejszych badań
w przypadkach wątpliwych bądź trudnych diagnostycznie.
Przyjęto za AHA (American Heart Association), że obowiązywać powinien
dwunastopunktowy program screeningowy (tab. 2).
Jeśli na podstawie tak przeprowadzonej oceny istnieje podejrzenie choro-
by serca lub postawiono jej rozpoznanie, sportowiec powinien zostać skie-
rowany do ośrodka referencyjnego w celu zaplanowania dalszej diagnostyki
i podjęcia decyzji o jego dalszych losach. Eksperci proponują, aby tego ro-
dzaju oceny dokonywać co dwa lata.
Dysponujemy szerokim zakresem metod diagnostycznych wykorzystywa-
nych w nowoczesnej kardiologii – od spoczynkowego badania EKG poprzez
dynamiczną ocenę w czasie testu wysiłkowego, morfologiczną i czynnościo-
wą ocenę serca (ECHO), 24-godzinne badanie EKG metodą Holtera, aż po
badania wysoko specjalistyczne, takie jak rezonans magnetyczny (MRI),
scyntygrafię perfuzyjną czy badanie elektrofizjologiczne.
121

Elektrokardiogram spoczynkowy jest metodą wykorzystywaną najdłużej
i najczęściej. Ma z pewnością istotne walory ekonomiczne, choć i tu eksper-
ci nie są do końca zgodni, ma też istotne ograniczenia. Czułość i swoistość
metody nie jest wysoka. Chociaż uważa się, że nieprawidłowości w spoczyn-
kowym zapisie EKG rejestrowane są u 95% pacjentów z kardiomiopatią
przerostową, to z drugiej strony u osób z istotnymi zmianami w naczyniach
wieńcowych zapis EKG jest bardzo często prawidłowy. Nie bez znaczenia
jest możliwość wykrycia w badaniu zaburzeń rytmu serca, zespołu preekscy-
tacji (WPW) czy zespołu wydłużonego QT. Wiele drobnych nieprawidłowo-
ści elektrokardiogramu jest związanych z fizjologiczną adaptacją serca do
intensywnych obciążeń. Rozpoznawanie cech przerostu mięśnia za pomocą
tego badania nastręcza również wiele trudności, a trafność diagnostyczna
nie jest wysoka. Przedstawiliśmy niedawno własne obserwacje z tego zakre-
su. Istnieją wobec tego istotne wątpliwości, co do możliwości polecania sze-
rokiego użycia metody w badaniach populacyjnych, ponieważ generować to
może istotne koszty związane z koniecznością poszerzania diagnostyki
w przypadkach wątpliwych. Wydaje się jednak, że EKG powinno być u spor-
towców wysokiego wyczynu wykonywane rutynowo co najmniej raz na dwa
lata. Takie zasady obowiązują w ośrodku, gdzie są oni badani przez nasz ze-
spół kardiologiczny (Centralny Ośrodek Medycyny Sportowej w Warszawie
– COMS). Amerykanie zalecają rutynowe wykonywanie tego badania u osób
aktywnych sportowo powyżej 40. roku życia.
Tabela 2: Zalecenia AHA dotyczące badań screeningowych u sportowców
WYWIAD RODZINNY
• nagła śmierć w wywiadzie
rodzinnym;
• choroba serca w bliskiej rodzinie.
WYWIAD DOTYCZĄCY
PACJENTA
• szmer nad sercem;
• nadciśnienie tętnicze;
• męczliwość;
• zasłabnięcia;
• duszność wysiłkowa;
• wysiłkowe bóle w klatce piersiowej.
BADANIE PRZEDMIOTOWE
• szmer nad sercem;
• tętno na tętnicach udowych;
• cechy zespołu Marfana;
• pomiar ciśnienia tętniczego.
122

Test wysiłkowy jest kolejną szeroko wykorzystywaną metodą w diagnosty-
ce kardiologicznej. Jest podstawowym narzędziem w rozpoznawaniu i pro-
gnozowaniu w chorobie niedokrwiennej serca (ChNS). U sportowców nie
jest wykorzystywany jako metoda rutynowa. Raport amerykańskich eksper-
tów mówi o przydatności metody w diagnostyce sportowców starszych (po-
wyżej 35. roku życia) i z wywiadem rodzinnym przedwczesnej ChNS, choć
nawet w tych przypadkach nie zalecają go jako badania rutynowego. Z na-
szego doświadczenia wynika, że może być wykorzystywany w diagnostyce
arytmii czy zasłabnięć. Wykorzystujemy go jako rutynowe narzędzie diagno-
styczne u osób, które planują podjęcie lub zwiększenie intensywności wysił-
ków, a wywiad kardiologiczny jest pozytywny w szerokim rozumieniu tego
słowa. Może także służyć jako metoda kontrolowania skuteczności leczenia
hipotensyjnego.
Rejestracja EKG metodą Holtera jest metodą niezwykle przydatną w dia-
gnostyce zaburzeń rytmu serca, może także służyć ocenie skuteczności le-
czenia. Badanie to powinno być polecane u wszystkich sportowców, u któ-
rych wywiad lub spoczynkowe badanie EKG sugeruje obecność arytmii lub
zaburzeń przewodzenia. Jest niezwykle istotne w kompleksie diagnostycz-
nym, także w przypadkach zasłabnięć, zespole WPW, a u sportowców star-
szych w diagnostyce niedokrwienia. Powinno być również zalecane u spor-
towców ze stwierdzanymi w badaniu EKG zaburzeniami przewodzenia
(bloki przedsionkowo-komorowe). Zalecenia amerykańskie nie kwalifikują
tej metody jako badania rutynowego, ale w naszym doświadczeniu badanie
to wykorzystujemy dość często. Jest dostępne, nieinwazyjne, przynosi istotne
informacje kliniczne.
Badanie echokardiograficzne to dziś podstawowe badanie w ocenie kar-
diologicznej wielu patologii sercowych. Trudno wyobrazić sobie nowoczesną
kardiologię bez tej nieinwazyjnej precyzyjnej oceny budowy i funkcji mię-
śnia sercowego. Jak wcześniej wspomniano, na przeszkodzie szerokiego wy-
korzystywania metody w badaniach screeningowych w sporcie stoją względy
ekonomiczne (USA). Jest to natomiast podstawowe narzędzie badawcze
również w światowej kardiologii sportowej. W praktyce klinicznej przynosi
cenne informacje przy podejrzeniu wad serca, zarówno wrodzonych, jak i na-
bytych. Jest metodą z wyboru w diagnostyce kardiomiopatii przerostowej,
zespole wypadania płatka zastawki mitralnej, uzupełnia istotnie diagnostykę
arytmogennej dysplazji prawej komory (kardiomiopatia prawej komory). Ta
ostatnia jest rzadką, ale niezwykle groźną patologią prowadzącą do zagra-
żających życiu arytmii komorowych, a metodą z wyboru w diagnostyce jest
MRI. Badanie echokardiograficzne jest istotnym narzędziem w diagnosty-
ce ChNS (zwłaszcza u osób po zawale serca). U sportowców starszych jedną
123

z głównych przyczyn nagłych zgonów jest właśnie ChNS (patrz rozdział o na-
głym zgonie sercowym).
Jak wcześniej wspomniano, badanie echokardiograficzne jest ważnym na-
rzędziem badań naukowych w sporcie. Pozwala oceniać zmiany adaptacyj-
ne mięśnia sercowego do intensywnych wysiłków fizycznych (przerost, funk-
cja zastawek) i różnicować procesy fizjologiczne od patologicznych („serce
sportowca”). Dane na ten temat są przedmiotem licznych doniesień, mamy
w tym zakresie również własne doświadczenia.
Badanie elektrofizjologiczne jest badaniem wysoko specjalistycznym i nie
jest wymieniane w standardzie diagnostycznym. Jest polecane w diagnostyce
zespołu WPW, pozwala bowiem kwalifikować sportowców z tym zespołem
do nowoczesnego leczenia (ablacja), jest również metodą pomocną w róż-
nicowaniu rodzaju arytmii i w zaburzeniach przewodzenia (fizjologiczna pa-
rasympatykotonia, patologia?).
Dynamiczne metody obrazowe, takie jak echokardiografia obciążeniowa
czy scyntygrafia perfuzyjna nie są w kardiologii sportowej wykorzystywane
powszechnie. Można ich użyć do rozstrzygania poważnych wątpliwości,
w wybranych przypadkach, podobnie jak badania za pomocą rezonansu ma-
gnetycznego.
Od kilku lat śledzimy doniesienia dotyczące standardów orzekania i naj-
nowsze badania naukowe w zakresie kardiologii sportowej. W czasie naszej
pracy mieliśmy do czynienia z wieloma trudnymi problemami medycznymi,
czasami mieliśmy poważne wątpliwości. Dyskusja kliniczna pozwalała je roz-
strzygać, nierzadko na korzyść sportowca. Chcieliśmy przedstawić Państwu
propozycję standardu, jaki ciągle staramy się modyfikować:
• akceptacja dla wytycznych AHA – 12 punktów;
• EKG – zasada – 1 x 1-2 lata;
• ECHO – zasada 1 x 2 lata;
• test wysiłkowy – zasada – powyżej 35. roku życia, wywiad
rodzinny, czynniki ryzyka ChNS;
• diagnostyka nadciśnienia tętniczego wg standardów (biochemia,
dno oka, EKG, ECHO, rejestracja ciśnienia tętniczego metodą
Holtera itp.);
• zaburzenia rytmu serca – wg standardu kardiologicznego (patrz
rycina 1,2);
• choroba niedokrwienna serca (wg standardu kardiologicznego).
124

Propozycja ta jest kompromisem pomiędzy walorami merytorycznymi
a farmakoekonomicznymi. Zakłada, że podstawową metodą w przesiewo-
wych badaniach sportowców w kardiologii jest precyzyjne, wysoko kwalifi-
kowane badanie podmiotowe i przedmiotowe. Zakres badań dodatkowych
jest uzależniony od możliwości formalnych i finansowych. Badanie ECHO
w Polsce nie jest tak drogie jak w USA, inne procedury są również tańsze.
Populacja, która podlega ocenie jest również zdecydowanie mniej liczna.
Może więc warto szeroko korzystać z tych możliwości? Będziemy mieć coraz
więcej doświadczeń, będziemy mogli tworzyć polskie standardy, a także wpi-
sywać się w szeroki nurt naukowej kardiologii sportowej.
W podsumowaniu wielu raportów zwraca się uwagę na etyczne i prawne
aspekty orzekania w kardiologii sportowej. Należy tu powtórzyć za Maro-
nem, że „lekarz musi mieć na uwadze wyłącznie interes zdrowotny sportow-
ca”. Inne względy, choć ważne, są na drugim planie. Powinno się dołożyć
starań, aby organizacje zajmujące się sportem stwarzały warunki dla rzetel-
nej oceny medycznej u sportowców (organizacyjne, ekonomiczne). Ważne
jest tworzenie ośrodków referencyjnych, które skupiałyby wysokiej klasy spe-
cjalistów i pomagały rozstrzygać wątpliwości.
Zapamiętaj!
1. Zaburzenia rytmu serca to jedna z najczęściej spotykanych nieprawidłowo-
ści w badaniach lekarskich u sportowców.
2. Arytmie nadkomorowe są najczęściej niegroźne i w większości nie stano-
wią przeciwwskazania do wyczynowego uprawiania sportu, w wybranych
przypadkach jednak (zespół WPW) lub gdy są bogatoobjawowe (zasłabnię-
cia, urazy) wymagają precyzyjnej diagnostyki i specjalistycznego leczenia.
3. Arytmie nadkomorowe są najczęściej spowodowane wzmożonym napię-
ciem układu współczulnego, związanym z rywalizacją, nieprawidłowościa-
mi „elektrycznymi” lub przyczynami pozasercowymi (nadczynność tarczy-
cy), nie zaś nieprawidłowościami morfologicznymi.
4. Komorowe zaburzenia rytmu, które mogą być wyrazem istotnych morfolo-
gicznych nieprawidłowości z zakresu układu sercowo-naczyniowego zawsze
wymagają dokładnej, specjalistycznej diagnostyki, bowiem to właśnie one
są odpowiedzialne za nagłe zgony w sporcie wyczynowym.
5. Kardiomiopatie pierwotne, kardiomiopatia prawej komory, samoistny prze-
rost lewej komory, ciężkie nadciśnienie tętnicze, zapalenie mięśnia serco-
wego lub wady zastawkowe to przyczyny „groźnych” arytmii komorowych
u sportowców.
125

6. Decyzja co do możliwości wyczynowego uprawiania sportu powinna być
oparta na wnikliwej ocenie klinicznej, uwzględniającej szereg danych z wy-
wiadu, badania przedmiotowego, a czasem specjalistycznych badań dodat-
kowych (ECHO, test wysiłkowy, scyntygrafia perfuzyjna, MRI itd.).
7. Konieczne jest tworzenie ośrodków referencyjnych, wysoko specjalistycz-
nych dla potrzeb orzekania w kardiologii sportowej.
Warto przeczytać:
B.J. Maron, P.D. Thompson, J.C. Puffer et al.: Cardiovascular prepartici-
pation screening of competitive athletes. Circulation 1996; 94: 850-856.
B.J. Maron, C.G. Araujo, P.D. Thompson et al.: Recommendations for pre-
participation screening and the assessment of cardiovascular disease in ma-
ster athletes. Circulation 2001; 103: 327-334.
Bethesda Conference. Recommendations for determining eligibility for com-
petitions athletes with cardiovascular abnormalities. J. Am. Cardiol. 1994;
24: 845-908.
K. Sadkowska, A. Mamcarz, W. Braksator i wsp.: Wartość spoczynkowego
badania EKG w ocenie przerostu lewej komory u sportowców wyczynowych.
Medycyna Sportowa 2002; 18: 423-428.
W. Braksator, K. Wrzosek, A. Mamcarz i wsp.: Echokardiograficzne zmia-
ny w sercach sportowców w 24-miesięcznej obserwacji – kompensacja czy pa-
tologia? Medycyna Sportowa 2002; 18: 417-422.
R. Cappato: Radiofrequency ablation in the therapy of Wolff-Parkinson W-
hite syndrome. Advances in Sports Cardiology. A. Pelliccia, G. Caselli,
P. Bellotti (red.), Springer Verlag Milan 1997, 54-62.
G. Ansalone, A. Biffi, A. Auriti et al.: Prognostic evaluation of ventricular
arrhythmias in athletes. Advances in Sports Cardiology. A. Pelliccia, G. Ca-
selli, P. Bellotti (red.), Springer Verlag Milan 1997, 45-53.
J. Kuch: Groźne zaburzenia rytmu wśród sportowców. Zaburzenia rytmu
serca. M. Dłużniewski (red.), Fundacja „Dla Serca”, Warszawa 1997.
126

XII. NAGŁY ZGON SERCOWY
Andrzej Światowiec, Mirosław Dłużniewski
Nagły zgon sercowy, nazywany też nagłą śmiercią sercową (sudden cardiac
death, SCD), jest terminem używanym w piśmiennictwie od bardzo wielu lat.
W tym czasie wielokrotnie ulegała zmianie definicja SCD. Aktualna głosi,
że jest to śmierć z przyczyny kardiologicznej, występująca natychmiast lub
maksymalnie w ciągu 1 godziny od pojawienia się objawów choroby u osoby
z uprzednio znaną bądź nieznaną chorobą serca.
W około 80% przypadków bezpośrednią przyczyną zgonu jest migota-
nie komór (ventricular fibrillation, VF). Pozostałe przypadki to bradyaryt-
mie (bloki przedsionkowo-komorowe i asystolia) oraz rozkojarzenie
elektromechaniczne, a ich udział w ogólnej liczbie SCD wzrasta wraz
z zaawansowaniem niewydolności serca i pogłębianiem się dysfunkcji le-
wej komory.
Częstość występowania SCD w USA wynosi 400 000/rok. Z tej liczby 80%
to SCD w przebiegu ChNS, z czego 60% to SCD po zawale serca. W Polsce
w latach 1976-93 umieralność z powodu nagłego zgonu sercowego wzrosła
o 206% u mężczyzn i o 175% u kobiet. Aż 75% wszystkich SCD w Polsce
stanowią tak zwane zgony przedszpitalne.
Przeprowadzone w wielu krajach uprzemysłowionych badania populacyjne
wykazały, że czynniki ryzyka SCD w większości pokrywają się z czynnikami
ryzyka ChNS. Należą do nich podeszły wiek, płeć męska, wywiad rodzinny,
palenie papierosów, nadciśnienie tętnicze, podwyższony poziom LDL chole-
sterolu oraz cukrzyca.
• częstość występowania SCD w populacji ogólnej wynosi 0,1-0,2%
rocznie i wzrasta wraz z wiekiem oraz zaawansowaniem choroby
niedokrwiennej serca (ChNS);
• u osób z licznymi czynnikami ryzyka i rozpoznaną już ChNS
częstość występowania SCD wynosi 1-2% rocznie, a więc 10 razy
częściej;
• częstość występowania SCD u osób po zawale serca (ZS) wynosi
5% rocznie;
• u osób z częstoskurczem komorowym lub migotaniem komór
(VT/VF) przebytym w odległej fazie ZS częstość SCD wynosi aż
30% rocznie.
127

Spośród czynników nie będących czynnikami ryzyka ChNS, istotną rolę
w przewidywaniu zagrożenia SCD przypisuje się nadmiernemu spożywaniu
alkoholu oraz przyspieszonemu rytmowi serca. Inną dużą grupę czynników
ryzyka SCD stanowią wrodzone anomalie genetyczne, spośród których naj-
istotniejsze to:
Z powyższych rozważań wynika jeden praktyczny wniosek. Aby osiągnąć
redukcję ilości nagłych zgonów sercowych, należy opracować metody pre-
wencji VT/VF oraz wyodrębnić grupy pacjentów wysokiego ryzyka. Jedną
z najprostszych i najskuteczniejszych metod jest dokładne badanie podmio-
towe, w tym koniecznie wywiad rodzinny u osób, które przeżyły zatrzyma-
nie krążenia.
Do zmian elektrokardiograficznych zwiększających ryzyko SCD zalicza się:
Ostatnio dużą wagę przywiązuje się do aktywności współczulno-przywspół-
czulnej. Uważa się mianowicie, że dysfunkcja autonomicznego układu ner-
wowego, to znaczy spadek aktywności przywspółczulnej i wzrost aktywności
współczulnej, stanowi istotny czynnik ryzyka SCD. Podkreśla się tutaj rolę
testu wysiłkowego – zwolnienie czynności serca w pierwszej minucie po za-
przestaniu wysiłku <10/min jest odzwierciedleniem upośledzonej aktywno-
ści układu przywspółczulnego i jest silnym i niezależnym czynnikiem wzrostu
śmiertelności.
U podłoża destabilizacji elektrycznej prowadzącej do SCD leżą 3 grupy
czynników (tab. 1).
• cechy przerostu lewej komory;
• poszerzony zespół QRS ( >0,12 s);
• wydłużony zespół QT (skorygowany QTc >440 ms);
• obniżenie odcinka ST oraz ujemne załamki T.
• zespół wydłużonego QT;
• zespół Brugadów;
• kardiomiopatia przerostowa;
• arytmogenna kardiomiopatia prawej komory;
• wielokształtny częstoskurcz komorowy (VT) wyzwalany przez
katecholaminy.
128

Zazwyczaj, aby doszło do wyzwolenia VT/VF, konieczna jest koincydencja
kilku czynników. Czasem jednak wystarczają tylko dwa i to nawet z jednej
grupy, na przykład niedokrwienie i zaburzenia elektrolitowe.
Postępowanie wdrożone w celu zapobiegania SCD u chorych, u których
groźna dla życia arytmia jeszcze nie występowała, ale którzy mają wysokie
ryzyko wystąpienia takiej arytmii, określane jest jako profilaktyka pierwotna.
Jeżeli takie postępowanie wdrażamy u osób, które przeżyły już zatrzymanie
krążenia lub VT z utratą przytomności – jest to profilaktyka wtórna.
Największą grupę osób zagrożonych wystąpieniem SCD stanowią pacjen-
ci z ChNS, a w szczególności chorzy po zawale serca. Najważniejszym poje-
dynczym wskaźnikiem zagrożenia SCD u osób po zawale serca jest obniżona
frakcja wyrzutowa lewej komory (LVEF%). Ryzyko zgonu rośnie wraz ze
zmniejszaniem się jej wartości:
Znacznie obniżona frakcja wyrzutowa LK (<30%) jest jak dotąd jedynym
pojedynczym parametrem pozwalającym wyodrębnić pacjentów, którzy od-
• LVEF 31-40% – roczne ryzyko SCD ocenia się na 3,2%;
• LVEF 21-30% – roczne ryzyko SCD ocenia się na 7,7%;
• LVEF <20% – roczne ryzyko SCD ocenia się na 9,4%.
Tabela 1: Czynniki prowadzące do destabilizacji elektrycznej
CZYNNIKI
ANATOMICZNE
ZABURZENIA
CZYNNOŚCIOWE
CZYNNIKI
ELEKTRYCZNE
• miażdżyca tętnic
wieńcowych;
• aktywna blaszka
miażdżycowa;
• tętniak pozawałowy;
• zwłóknienie;
• przerost lewej
komory;
• rozstrzeń lewej
komory.
• niedokrwienie;
• zaburzenia
poreperfuzyjne;
• zaburzenia
elektrolitowe;
• kwasica
metaboliczna;
• hipoksja;
• zaburzenia
neurohormonalne;
• zaburzenia
równowagi
współczulno-
-przywspółczulnej.
• fale nawrotne
(re-entry);
• zaburzenia
przewodzenia;
• potencjały następcze;
• wzmożony
automatyzm;
• aktywność
wyzwolona.
129

niosą korzyść z profilaktycznego leczenia antyarytmicznego. Leczenie to po-
winno być oparte na stosowaniu preparatów pozbawionych działania elek-
trofizjologicznego, takich jak beta-adrenolityki, inhibitory konwertazy
(ACE-I), statyny. Spośród leków antyarytmicznych, u chorych po zawale ser-
ca szczególnie polecany jest amiodaron.
W dobie leczenia fibrynolitycznego oraz pierwotnej angioplastyki wieńco-
wej, salwy nieutrwalonego częstoskurczu komorowego (nsVT) nie są już po-
jedynczym i niezależnym markerem SCD. Niemniej nsVT skojarzony z ob-
niżoną frakcją wyrzutową LK (<40%) ułatwia już wyselekcjonowanie
pacjentów, u których wszczepienie kardiowertera-defibrylatora zmniejsza
ryzyko zgonu.
U tych wyselekcjonowanych już chorych, kolejnym krokiem diagnostycz-
nym powinna być programowana stymulacja komór (PSK) – badanie, które
w największym stopniu określa ryzyko wystąpienia VT/VF.
Badania diagnostyczne, takie jak ocena zmienności rytmu zatokowego
(HRV) w 24-godzinnym zapisie EKG, dyspersja QT, tj. różnica pomiędzy
najdłuższym i najkrótszym odstępem QT w standardowym EKG, będąca wy-
kładnikiem niehomogennej repolaryzacji czy też obecność późnych poten-
cjałów komorowych (late potentials, LP), w ostatnich latach tracą powoli na
znaczeniu. Szersze omówienie wartości badań w diagnostyce zaburzeń rytmu
przedstawiono w innych rozdziałach.
Z badaniami tymi przez wiele lat wiązano duże nadzieje, gdyż jako bada-
nia nieinwazyjne mogłyby być bardzo pomocne w selekcji chorych wysokie-
go ryzyka. Późne potencjały komorowe są wyrazem obecności stref zwolnio-
nego przewodzenia, a te z kolei substratem do powstawania fal nawrotnych
re-entry. W dobie leczenia fibrynolitycznego i pierwotnej angioplastyki wień-
cowej ich obecność ulega istotnej redukcji. Pozytywna wartość prognostycz-
na LP, innymi słowy obecność LP u osób z VT/VF jest aktualnie niewielka
i wynosi 11-17%, ale negatywna wartość prognostyczna wynosi aż 97% i jest
najwyższa wśród nieinwazyjnych markerów SCD.
Ogólna pozytywna wartość prognostyczna każdego z powyższych mar-
kerów VT/VF jest niska i nie przekracza 20%. W pracach oceniających
kilka nieinwazyjnych markerów łącznie, uzyskano maksymalnie 40% po-
zytywną wartość prognostyczną. Oznacza to, że po wdrożeniu leczenia an-
tyarytmicznego, jedynie u 4 na 10 chorych można spodziewać się korzy-
ści. Pozostali chorzy narażeni są tylko na potencjalnie niekorzystne
działania leków antyarytmicznych, takie jak wpływ inotropowo ujemny
lub/i proarytmia.
130
W celu wyodrębnienia pacjentów szczególnie zagrożonych SCD, należy
wykonać badania diagnostyczne wymienione w tabeli 3.
Zgodnie z obecnym stanem wiedzy i zaleceniami Europejskiego Towa-
rzystwa Kardiologicznego podstawą leczenia chorych po przebytym już za-
trzymaniu krążenia (prewencja wtórna) jest implantacja kardiowertera-de-
fibrylatora (implantable cardioverter-defibrillator, ICD). Zasada ta dotyczy
Tabela 3: Badania diagnostyczne w ocenie ryzyka SCD
Tabela 2: Wartość prognostyczna nieinwazyjnych markerów VT/VF u chorych po zawale
serca
BADANIE
POSZUKIWANY PARAMETR
ZNACZENIE
KLINICZNE
ECHO serca
• LVEF%
+++
Test wysiłkowy
• wielkość obciążenia (METs)
• obniżenie ST
++
24-godzinne
monitorowanie
EKG met. Holtera
• nsVT
• ekstrasystolia >10/min
• HRV
++
EKG spoczynkowe
• zespół QRS >0,12 s
• dyspersja QT
++
Uśredniony zapis
EKG
• obecność późnych potencjałów
komorowych (LP+)
+
PSK
• częstoskurcz komorowy (VT)
++
czułość
swoistość
pozytywna
wartość
prognostyczna
negatywna
wartość
prognostyczna
LP
63%
81%
17%
97%
HRV
92%
77%
17%
77%
VEB
54%
82%
16%
81%
nsVT
54%
81%
15%
97%
LVEF <40%
46%
75%
10%
75%
test wysiłkowy
50%
50%
6%
50%
131

pacjentów niezależnie od choroby podstawowej – wyjątek stanowią chorzy
z anomalią wieńcową (poddawani są leczeniu chirurgicznemu) oraz pa-
cjenci z zespołem WPW, u których rutynowo wykonuje się ablację dodat-
kowej drogi przewodzenia.
W latach 90. przeprowadzono ważne badania kliniczne (AVID, CASH,
MADIT) dowodzące, iż ICD przedłużają życie pacjentów zarówno w prewen-
cji wtórnej, jak i pierwotnej. Spowodowało to olbrzymi wzrost liczby implan-
tacji ICD przede wszystkim w USA (52 000 tylko w roku 2000). W Polsce
w 2001 roku wszczepiono 476 kardiowerterów-defibrylatorów. Szacunkowe
dane mówią, że liczba implantacji ICD w Polsce tylko u chorych po zatrzy-
maniu krążenia powinna wynosić 2000 rocznie.
W roku 2002 opublikowano wyniki badania MADIT II. Badanie to prze-
prowadzono w grupie 1232 chorych po zawale serca z LVEF <30%. Pod-
czas 20-miesięcznej obserwacji, śmiertelność ogólna wśród pacjentów leczo-
nych farmakologicznie wyniosła 19,8%, a wśród chorych z implantowanym
ICD – 14,2%. Uzyskano 31% redukcję ryzyka zgonu. Badanie to stworzyło
więc perspektywy dla poszerzenia wskazań do implantacji ICD – obecnie
trwają kolejne badania (DINAMIT, IRIS, BEST) poświęcone roli ICD
w prewencji pierwotnej. Niezwykle ciekawą obserwacją poczynioną przy ana-
lizie danych w badaniu MADIT II jest stwierdzenie, iż największą redukcję
ryzyka zgonu (aż 63%) dzięki implantacji ICD uzyskano u chorych z zespo-
łem QRS >0,12 s w standardowym zapisie EKG. Inne nieinwazyjne wskaź-
niki, takie jak HRV czy dyspersja QT nie wykazały takiego związku.
Leczenie za pomocą implantacji ICD pozostaje nadal procedurą kosztow-
ną, stąd właściwa kwalifikacja pacjentów ma tutaj zasadnicze znaczenie. Aktu-
alne zalecenia mówią, iż kandydatem do implantacji ICD jest pacjent:
Właściwa kwalifikacja pacjentów do implantacji ICD, poparta optymal-
nym leczeniem zachowawczym jest jednym z fundamentalnych zadań kar-
• z niską frakcją wyrzutową LK po zawale serca lub bez zawału
– np. w przebiegu pierwotnej kardiomiopatii;
• z udokumentowanym VF lub niestabilnym hemodynamicznie VT,
jeżeli VT/VF nie towarzyszyło ostremu zespołowi wieńcowemu;
• z nieusuwalną przyczyną arytmii, np. rozległym obszarem
akinetyczno-dyskinetycznym;
• z utrwalonym VT sprowokowanym podczas programowanej
stymulacji komór lub/i nieutrwalonym VT w badaniu EKG
metodą Holtera podczas optymalnego leczenia zachowawczego.
132
diologa, albowiem w warunkach pozaszpitalnych pierwszy epizod VT/VF
przeżywa tylko 3-5% chorych poddanych reanimacji.
Chociaż implantacja ICD wydaje się być najskuteczniejszym postępowa-
niem u pacjentów zagrożonych nagłym zgonem, nie jest jednak metodą po-
wszechną i długo nie będzie, chociażby ze względu na to, że jest metodą
kosztowną. W dalszym ciągu najpowszechniejszą metodą pozostaje leczenie
antyarytmiczne, a przede wszystkim skuteczna prewencja nagłego zgonu
(tab. 4).
Zapamiętaj!
1. Najczęstszą przyczyną nagłego zgonu sercowego jest zawał serca.
2. Najczęściej do nagłego zgonu sercowego dochodzi w mechanizmie migo-
tania komór.
Tabela 4: Zasady prewencji nagłego zgonu sercowego
Zasady dotyczące
wszystkich pacjentów
z ChNS
1) modyfikacja stylu życia (czynniki ryzyka):
• palenie tytoniu,
• spożycie alkoholu,
• hiperlipidemia,
• BMI,
• nadciśnienie tętnicze;
2) kwas acetylosalicylowy (tiklopidyna
lub klopidogrel, gdy istnieją
przeciwwskazania do aspiryny);
3) leki beta-adrenolityczne;
4) statyny;
Zasady dotyczące
pacjentów po zawale
serca
1 + 2 + 3 + 4 +
5) inhibitory konwertazy (ACE-I);
Zasady dotyczące
pacjentów z pozawałową
niewydolnością serca
1 + 2 + 3 + 4 + 5 +
6) spironolakton;
7) amiodaron;
Ostre zespoły wieńcowe
8) leczenie fibrynolityczne,
9) pierwotna angioplastyka tętnic
wieńcowych.
133

3. Migotanie komór w ostrej fazie zawału nie ma znaczenia prognostycznego.
4. Istotnym, wysoce niekorzystnym wskaźnikiem prognostycznym SCD jest ni-
ska frakcja wyrzutowa lewej komory.
5. Implantacja kardiowertera-defibrylatora jest metodą z wyboru we wtórnej
prewencji nagłego zgonu sercowego.
6. Czynniki ryzyka nagłego zgonu sercowego są niemal tożsame z czynnika-
mi ryzyka ChNS.
Warto przeczytać:
Nagła śmierć sercowa. Standardy postępowania. Biblioteka „Kardiologii
Polskiej” 2003.
R.J. Myerburg, A. Castellanos: Cardiac arrest and sudden cardiac death.
Hart Disease (E. Braunwald, P.D. Zipes, P. Libby); 6th edition, W.B. Saun-
ders Company, Philadelphia 2001: 890-931.
134

XIII. WSZCZEPIALNE
KARDIOWERTERY-DEFIBRYLATORY SERCA
Michał Moszczeński, Włodzimierz Mojkowski, Mirosław Dłużniewski
Odkąd w 1958 r. wszczepiono pierwszy stymulator serca dziedzina ta roz-
winęła się tak powszechnie, że dziś trudno sobie bez niej wyobrazić nowo-
czesną kardiologię, a pacjent z implantowanym rozrusznikiem nikogo nie
dziwi. Skoro więc z jednej strony wiadomo, że wewnątrzsercowa kardiower-
sja czy defibrylacja jest nie tylko możliwa, ale i bardzo skuteczna, przy tym
zabieg ten wymaga użycia wielokrotnie niższej energii, ponieważ nie musi
pokonywać oporu skóry i innych tkanek, które napotyka na swej drodze im-
puls z powierzchni ciała, a z drugiej strony dysponujemy techniką umożli-
wiającą implantację stymulatorów, to dlaczego nie połączyć obu technik
w jedną? Tak też się stało na początku lat 80. XX wieku. Twórcą metody
i człowiekiem, który przeprowadził pierwsze próby kliniczne z kardiowerte-
rami-defibrylatorami był profesor Mirowski. Dzięki pracom jego i następ-
ców kardiolodzy otrzymali nową broń w walce z groźnymi dla życia zaburze-
niami rytmu serca pod postacią wszczepialnego kardiowertera-defibrylatora
(implantable cardioverter-defibrillator, ICD).
Pierwsze kardiowertery-defibrylatory były masywnymi urządzeniami wiel-
kości mniej więcej dwóch paczek papierosów, mogących, oprócz defibrylacji,
zapewnić jednojamową stymulację typu SSI (do wyboru AAI lub VVI w za-
leżności od stymulowanej jamy serca). Ze względu na wielkość defibrylator
umieszczany był nie w klatce piersiowej, a w powłokach brzusznych. Zało-
żenie elektrod wymagało torakotomii i naszycia ich na osierdzie w operacji
kardiochirurgicznej (z możliwością wystąpienia wszystkich rodzajów powi-
kłań związanych z tak poważnym zabiegiem operacyjnym). Obecnie wszcze-
pienie ICD przypomina implantację stymulatora, elektrody wprowadzane
są przez żyły, a samo urządzenie jest niewiele większe od klasycznego roz-
rusznika dwujamowego. Dalsza miniaturyzacja ograniczana jest nie tyle wiel-
kością układów elektronicznych, co pojemnością zasilającego ogniwa. Dłu-
gość pracy ICD zależy od wielu zmiennych (ilość wyładowań, wielkość
energii poszczególnego wyładowania), jednak przeciętnie szacowana jest na
5-9 lat.
Jak zbudowany jest wszczepialny kardiowerter-defibrylator? Ogólnie
rzecz biorąc – podobnie do stymulatora, to znaczy z obwodów elektronicz-
nych, źródła zasilania oraz mikroprocesora analizującego otrzymywane in-
formacje i reagującego zgodnie z zaprogramowanym algorytmem. Ponadto
musi być wyposażony w transformator umożliwiający z jednej strony zapew-
135

nienie odpowiedniego napięcia do stałej stymulacji serca (nawet <1 V),
a z drugiej bardzo wysokiego – rzędu 750 V – przy defibrylacji. Ponadto ze
względu na możliwość dużej zmienności sygnału wewnątrzsercowego
(„przeskok” z ok. 20 mV normalnego skurczu komory do 0,5-1 mV przy mi-
gotaniu komór) odpowiedni obwód odbierający impulsy musi mieć – w od-
różnieniu od stymulatora – możliwość automatycznej zmiany zarówno czu-
łości, jak i regulacji poziomu sygnału (gain), na który będzie reagował lub
go ignorował (ustawienie a priori bardzo wysokiej czułości mogłoby spowo-
dować odbieranie całej gamy szumów, powodowanych np. aktywnością mię-
śni szkieletowych).
Antyarytmiczne działanie ICD jest kilkustopniowe. W zależności od ro-
dzaju arytmii, przed podtrzymywaniem której chcemy zabezpieczyć pa-
cjenta, podczas programowania urządzenia ustala się wiele zmiennych,
np. od jakiej częstości rytmu komór rozpoczyna się interwencja, jaki ro-
dzaj interwencji wchodzi w grę – z reguły nie jest to od razu wyładowanie
defibrylatora pełną energią, a różne rodzaje stymulacji antyarytmicznej
(antitachycardia pacing, ATP). Dopiero w przypadku nieskuteczności sty-
mulacji antyarytmicznej (o rosnącej agresywności) bądź rozpoznania
przez urządzenie groźniejszej formy arytmii, wyzwalany jest impuls defi-
brylatora, początkowo niższą, w razie potrzeby pełną energią (z reguły
rząd wielkości 30 J, przy urządzeniach o podwyższonej energii wyładowa-
nia jest to ok. 38 J). Przykładowy zapis interwencji ICD przedstawiono na
rycinie 1.
Rycina 1: Częstoskurcz komorowy (VT) prawidłowo rozpoznany przez urządzenie, próba
przerwania stymulacją antyarytmiczną (ATP), która doprowadza do migotania
komór (VF) i wyładowanie (shock) energią 20 J, które przerywa migotanie komór
136

Podczas implantacji urządzenia zasadą jest prowokowanie arytmii na
stole operacyjnym (pacjent jest w znieczuleniu ogólnym!), aby określić
minimalną energię przerywającą migotanie komór, jak również właściwy
dobór miejsca założenia elektrody defibrylującej. Ideałem jest jak naj-
większa różnica między energią przerywającą skutecznie migotanie ko-
mór a maksymalną energią, którą jest w stanie wyzwolić defibrylator.
Zazwyczaj przyjmuje się różnicę co najmniej 10 J. Najniższa energia li-
kwidująca migotanie komór nosi nazwę progu defibrylacji (defibrillation
treshold, DFT). Obecnie zdecydowana większość ICD używa do defibry-
lacji tzw. dwufazowego impulsu (jego kształt różni się w zależności od
producenta urządzenia), który jest znacznie skuteczniejszy od impulsu
jednofazowego.
W jakich przypadkach powinno się rozważać u pacjenta wszczepienie kar-
diowertera-defibrylatora? Standardy polskie zostały opracowane na podsta-
wie zaleceń ACC i AHA (American College of Cardiology, American Heart
Association) z roku 1998. Wskazania do wszczepienia ICD podzielono na
trzy grupy.
BEZWZGLĘDNE WSKAZANIA DO WSZCZEPIENIA
KARDIOWERTERA-DEFIBRYLATORA
• incydenty nagłego zatrzymania krążenia w mechanizmie VT lub
VF, a których przyczyna nie jest przemijająca lub odwracalna;
• VT źle tolerowany hemodynamicznie (utrata przytomności,
obrzęk płuc, wstrząs), zwłaszcza u chorych z frakcją wyrzutową
lewej komory <40%;
• utraty przytomności o nieustalonej etiologii u osób, u których
w czasie badania elektrofizjologicznego prowokuje się VT/VF,
a leki antyarytmiczne są nieskuteczne, źle tolerowane bądź
przeciwwskazane;
• nieutrwalony VT u chorych po zawale serca z dysfunkcją lewej
komory (frakcja wyrzutowa lewej komory <35%), u których
w trakcie badania elektrofizjologicznego wywołuje się źle
tolerowany lub utrwalony VT/VF, także po lekach
antyarytmicznych;
• VT utrwalony, przebiegający bez znaczących objawów
hemodynamicznych w razie nieskuteczności innych form leczenia
(leki antyarytmiczne, rewaskularyzacja, ablacja, chirurgia
antyarytmiczna).
137

Podsumowując powyższe, można stwierdzić, że kardiowerter-defibrylator
jest leczeniem z wyboru w przypadku nawracającego spadku rzutu serca (kli-
nicznie manifestującego się najczęściej utratą przytomności) w mechanizmie
migotania komór/częstoskurczów komorowych nie spowodowanych odwra-
calną (przez inne formy leczenia) przyczyną oraz w razie występowania u pa-
cjenta częstoskurczu komorowego z tendencją do samoczynnego podtrzy-
mywania arytmii. Wydaje się, że kilku słów wyjaśnienia wymaga problem
uporczywie nawracających VT/VF – dlaczego nie jest to wskazanie do wszcze-
pienia ICD, podczas gdy utrwalony VT znajduje się w grupie wskazań bez-
względnych? Problem polega na tym, że w przypadku uporczywej nawroto-
wości arytmii, defibrylacja niczego nie rozwiązuje – VT od razu powraca,
BEZ WSKAZAŃ DO WSZCZEPIENIA
KARDIOWERTERA-DEFIBRYLATORA
• VT lub VF spowodowane przyczynami przemijającymi bądź
odwracalnymi (zawał serca, zapalenie mięśnia sercowego,
toksyczne bądź metaboliczne uszkodzenie mięśnia sercowego,
zaburzenia elektrolitowe, proarytmiczne działanie leków);
• VT lub VF u chorych, u których możliwe jest wyeliminowanie
substratu arytmii poprzez leczenie chirurgiczne bądź ablację;
• uporczywie nawracające (incessant) VT lub VF;
• osoby, u których jest złe rokowanie, co do dłuższego przeżycia
(zaawansowanie choroby podstawowej, nowotwory);
• poważna choroba psychiczna, której przebieg może pogorszyć
wszczepienie ICD.
WZGLĘDNE WSKAZANIA DO WSZCZEPIENIA
KARDIOWERTERA-DEFIBRYLATORA
• utraty przytomności o nieustalonej etiologii (po wykluczeniu
innej przyczyny) u osób ze stwierdzoną chorobą serca, dysfunkcją
lewej komory, u których w czasie badania elektrofizjologicznego
wywołuje się utrwalony VT, źle tolerowany hemodynamicznie;
• osoby z rodzinnie występującą kardiomiopatią przerostową lub
zespołem wydłużonego QT, z utratami przytomności, incydentami
nieutrwalonego VT oraz nagłymi zgonami wśród najbliższej rodziny.
138

urządzenie rozpoznaje go prawidłowo, ponownie interweniuje itd. W ten
sposób można wyczerpać energię ICD w ciągu jednej doby. Ponadto we-
wnątrzsercowa kardiowersja lub defibrylacja, pomimo relatywnie niskiej
energii, nadal jest dla pacjenta bardzo bolesna (impuls defibrylujący powi-
nien być wyzwalany po utracie przytomności przez pacjenta). Należy pamię-
tać, że leczenie wszczepianym kardiowerterem-defibrylatorem wciąż pozo-
staje niejako ostatnim ogniwem terapii, po wyczerpaniu innych metod,
w tym inwazyjnych (ablacja przezżylna, operacja kardiochirurgiczna).
Wskazania do leczenia za pomocą wszczepianego kardiowertera-defibryla-
tora były (i są nadal) precyzowane na podstawie wieloośrodkowych badań
klinicznych, zarówno w prewencji pierwotnej u pacjentów zagrożonych nagłą
śmiercią sercową, jak i w prewencji wtórnej – u pacjentów, u których zareje-
strowano groźne zaburzenia rytmu serca. Prewencji pierwotnej dotyczyły np.
próby: MADIT (Multicenter Automatic Defibrillator Implantation Trial)
i MUSTT (Multicenter Unsustein Tachycardia Trial), wtórnej: AVID (The An-
tiarrhytmics Versus Implantable Defibrillators) czy CASH (Cardiac Arrest Stu-
dy – Hamburg). Wszystkie z wymienionych badań udowodniły znaczący
wzrost przeżywalności w grupach leczonych ICD w porównaniu do grup le-
czonych farmakologicznie. Dla przykładu w programie MADIT, kardiower-
ter-defibrylator zredukował śmiertelność ogólną o 54% w porównaniu z gru-
pą leczoną farmakologicznie. Warto jednocześnie nadmienić, że koszt
przedłużenia życia o jeden rok w grupie z ICD skalkulowano wg tego pro-
gramu na 16 900 $.
Również w Polsce wzrasta dostępność tej formy leczenia i ilość ośrodków
wszczepiających kardiowertery-defibrylatory, chociaż trudno na razie stwier-
dzić, że możliwości techniczne implantowania ICD w pełni pokrywają zapo-
trzebowanie.
Zapamiętaj!
1. Wszczepialny kardiowerter-defibrylator jest leczeniem z wyboru w przypad-
ku nawracającego spadku rzutu serca (klinicznie manifestującego się naj-
częściej utratą przytomności) w mechanizmie migotania komór/częstoskur-
czów komorowych nie spowodowanych odwracalną (przez inne formy
leczenia) przyczyną oraz w razie występowania u pacjenta częstoskurczu
komorowego z tendencją do samoczynnego podtrzymywania arytmii.
2. Wszczepienie kardiowertera-defibrylatora, pomimo coraz rozleglejszych
wskazań, nadal pozostaje ostatnim ogniwem terapii.
139

Warto przeczytać:
G. Świątecka, K. Bieganowska, W. Kargul, Z. Kornacewicz-Jach, A. Ku-
tarski, E. Lewicka-Nowak, A. Lubiński, W. Musiał, W. Piwowarska, F. Pro-
chaczek, Z. Sadowski, M. Trusz-Gluza, F. Walczak, D. Wojciechowski:
Standardy postępowania w elektroterapii serca. Folia Card. 1999; 1 (supl. 1):
52-58.
M. Trusz-Gluza, A. Dąbrowski, Z. Kornacewicz-Jach, P. Kułakowski,
M. Markiewicz, W. Musiał, G. Świątecka, G. Opolski, A. Torbicki, F. Wal-
czak, A. Wnuk-Wojnar: Komorowe zaburzenia rytmu serca. Kardiol. Pol.
1997; 46 (supl. 1): 34-50.
G. Gregoratos, M. Cheitlin, A. Conill et al.: ACC/AHA guidelines for im-
plantation of cardiac pacemakers and antiarrhythmia devices. A report of the
American College of Cardiology/American Heart Association Task Force on
Practice Guidelines (Committee on Pacemaker Implantation). J. Am. Coll.
Cardiol. 1998; 31: 1175-1209.
D. Hayes, D. Zipes: Cardiac Pacemakers and Cardioverter-Defibryllators.
Heart Disease; W. B. Saunders Company, 6th edition, Philadelphia 2001.
T. Lee: Guidelines: Use of Cardiac Pacemakers and Antiarrhythmia Devices.
Heart Disease; W. B. Saunders Company, 6th edition, Philadelphia 2001.
140

XIV. RESUSCYTACJA KRĄŻENIOWO-ODDECHOWA
Karol Wrzosek, Małgorzata Kalinowska, Artur Mamcarz
Nagłe zatrzymanie krążenia (NZK) spowodowane komorowymi zaburze-
niami rytmu czy też zaburzeniami przewodzenia bądź wytwarzania bodźców,
stanowi nieodłączny element towarzyszący pracy w oddziałach o profilu kar-
diologicznym, szczególnie w Oddziałach Intensywnej Opieki Kardiologicznej
(OIOK). W fazie przedszpitalnej, wikłając schorzenia kardiologiczne, jest
przyczyną tzw. nagłej śmierci sercowej i odpowiada za wysoką śmiertelność
chorych ze schorzeniami kardiologicznymi.
Nagłe zatrzymanie krążenia stanowi bezpośrednie zagrożenie życia i nie
leczone obarczone jest stuprocentową śmiertelnością.
Próby przywracania do życia podejmowane były już w starożytności, gdzie
w Egipcie metodą mającą przywracać życie była lewatywa z dymu tytoniowe-
go. Opisy przywracania do życia znajdujemy też w Biblii. Dopiero jednak w po-
łowie ubiegłego stulecia poznanie mechanizmów prowadzących do NZK oraz
poznanie natury umierania jako dynamicznego procesu, stworzyło podstawy
i możliwości skutecznego leczenia. Do 1960 roku skuteczna resuscytacja ogra-
niczona była do pacjentów z zatrzymanym oddechem, od momentu, gdy w 1950
roku Safar wprowadził wentylację usta-usta. W 1960 roku Kowenhoven zaob-
serwował, że rytmiczne uciskanie klatki piersiowej prowadzi do powstania fali
tętna w naczyniach. Połączenie tych dwóch elementów stworzyło podstawy
współczesnej resuscytacji – ich kombinacja tworzy technikę nazywaną BLS (ba-
sic life support). Prostota tej techniki – „wszystko, co potrzebuję to dwie ręce
i usta” – spowodowała jej szerokie rozpowszechnienie. W 1956 roku wykonano
defibrylację za pomocą zewnętrznych elektrod w celu przerwania złośliwej aryt-
mii komorowej. Ogromnym przełomem we współczesnym podejściu do resu-
scytacji był rozpoczęty w latach dziewięćdziesiątych ubiegłego stulecia program
publicznego dostępu do defibrylatora (public access defibrillation, PAD). Umiej-
scowienie defibrylatora w miejscach użyteczności publicznej (m.in. w kasynach,
na lotniskach), skrócenie czasu do wykonania defibrylacji oraz możliwość jej
wykonania przez osoby postronne, spowodowało zwiększenie przeżywalności
oraz zwrot włożonych nakładów. Wprowadzenie jak najwcześniejszej defibryla-
cji jest największym wydarzeniem w fazie leczenia przedszpitalnego od czasu
wprowadzenia CPR (cardiopulmonary resuscitation).
Najlepsze efekty uzyskuje się, niedopuszczając do nagłego zatrzymania
krążenia – stąd potrzeba rozpoznawania stanów mogących prowadzić do
NZK i optymalne leczenie i monitorowanie pacjentów zagrożonych. Sku-
teczność postępowania resuscytacyjnego zależy zaś od powiązania dwóch
procedur – podstawowych i zaawansowanych zabiegów ratujących życie.
141

ETIOPATOGENEZA NAGŁEGO ZATRZYMANIA KRĄŻENIA
Najczęstszą przyczyną nagłego zatrzymania krążenia jest migotanie komór
(72%), asystolia (około 8%) oraz rozkojarzenie elektryczno-mechaniczne
(4%). Inne rzadsze przyczyny obejmują częstoskurcz komorowy bez tętna
oraz bradykardię. Nagłe zatrzymanie krążenia, niezależnie od przyczyny
i mechanizmu, wywołuje utratę przytomności w ciągu 15 sekund, zaburzenia
rytmu oddychania w ciągu 30-60 sekund, bezdech oraz maksymalne rozszerze-
nie źrenic w ciągu 30-60 sekund. Do zatrzymania krążenia może dojść w prze-
biegu różnych chorób sercowo-naczyniowych, jak i pozasercowych (tab. 1).
OBJAWY I ROZPOZNANIE
Podstawowe objawy zatrzymania krążenia to:
Dodatkowe (mniej pewne) objawy zatrzymania krążenia:
Utrata przytomności
Każdą osobę nieprzytomną należy podejrzewać o NZK, choć utrata przy-
tomności nie musi wiązać się z zatrzymaniem krążenia. Może ona towarzy-
szyć zatruciom, występować w urazach czaszki, krwawieniach do ośrodko-
wegu układu nerwowego (OUN), w śpiączkach, w przebiegu chorób
metabolicznych czy w napadzie padaczkowym.
• sinica lub bladość skóry;
• brak tonów serca;
• rozszerzenie źrenic;
• drgawki toniczno-kloniczne;
• wiotkość mięśni;
• obraz EKG (u chorego monitorowanego).
• utrata przytomności – konieczna ocena stanu świadomości
(reakcja na głos, potrząśnięcie, reakcja na ból);
• bezdech lub patologiczny oddech;
• brak oznak krążenia (poruszania się, reakcje odruchowe, ocena
tętna na tętnicach szyjnych i udowych) jest tu tylko jednym
z elementów oceny.
142
Brak tętna
Pierwsze wytyczne postępowania w NZK opracowano w 1968 r. Od te-
go czasu idea badania tętna w rozpoznaniu zatrzymania krążenia straciła
Tabela 1: Stany, w których może dojść do nagłego zatrzymania krążenia
W PRZEBIEGU
CHORÓB SERCA
• choroba wieńcowa (ostry zawał serca, niestabilna
dusznica bolesna);
• ostra niewydolność lewokomorowa;
• kardiomiopatie (szczególnie przerostowa);
• wady zastawkowe serca;
• zespół małego rzutu;
• zatrzymanie krążenia w czasie badań diagnostycznych
(cewnikowanie serca z koronarografią, badanie
elektrofizjologiczne, test wysiłkowy);
• arytmie w przebiegu przedawkowania leków,
proarytmiczne działanie leków.
Z PRZYCZYN
POZASERCOWYCH
• zator płucny;
• ostra hipowolemia;
• zaburzenia gospodarki wodno-elektrolitowej
i równowagi kwasowo-zasadowej;
• urazy, szczególnie klatki piersiowej, uszkodzenie
rusztowania klatki piersiowej (mnogie złamania
żeber);
• zatrucia;
• reakcje alergiczne (wstrząs anafilaktyczny);
• wstrząs septyczny;
• porażenie prądem;
• uduszenie;
• utonięcie;
• schyłkowy okres nieuleczalnych chorób;
• niedrożność górnych dróg oddechowych spowodowana
zwiotczeniem mięśni dna jamy ustnej i języka;
• ciała obce w drogach oddechowych (protezy), krew,
treść żołądka;
• niedrożność dolnych dróg oddechowych (skurcz
oskrzeli, zablokowanie światła oskrzeli wydzieliną);
• nagłe wyłączenie jednego płuca z wentylacji (odma
opłucnowa);
• zaburzenia czynności ośrodkowego układu nerwowego,
nerwów obwodowych i płytki nerwowo-mięśniowej.
143

nieco na znaczeniu. Choć przez wiele lat uważana była za złoty standard,
to ostatnie badania wykazały jej ograniczenia. Badania przeprowadzone
wśród średniego personelu medycznego pokazały, że specyficzność tego
badania sięga ok. 90% (tj. zdolność do prawidłowego rozpoznania, że nie
ma tętna i jest zatrzymanie krążenia), czułość zaś jedynie 55% (zdolność
do prawidłowego rozpoznania, że jest tętno i nie ma zatrzymania krąże-
nia). Dla przypadkowych przechodniów dane te są jeszcze bardziej zani-
żone. Ustalono więc, że nie może być rekomendowane jako jedyne w roz-
poznaniu zatrzymania krążenia. Maksymalny czas oceny tętna nie
powinien przekraczać 10 sekund. Główny nacisk położono na oznaki obec-
ności krążenia, tj.:
Zatrzymanie oddechu
Pojawia się zwykle w ciągu kilku sekund po wystąpieniu zatrzymania krą-
żenia. W celu oceny oddechu, po udrożnieniu dróg oddechowych należy
przyłożyć ucho do ust lub nosa ofiary, by usłyszeć lub poczuć strumień wydy-
chanego powietrza, obserwując jednocześnie, czy są obecne ruchy oddecho-
we klatki piersiowej. Czynności te powinny trwać maksymalnie 10 sekund.
W ciągu pierwszych 60 s od utraty przytomności może występować patolo-
giczny, charczący oddech, po czym przez krótki czas mogą być jeszcze obec-
ne poronne, płytkie oddechy. Jeżeli nie jesteśmy pewni czy oddech jest wy-
dolny, rozpoczynamy oddech zastępczy.
Inne objawy kliniczne
Nie są pewne i nie mogą stanowić podstawy rozpoznania (np. brak tonów
serca, nieoznaczalne ciśnienie tętnicze, sinica lub bladość skóry, rozszerzenie
źrenic). Dlatego nie należy tracić czasu na ich poszukiwanie i ocenę.
Zapis EKG
U chorych monitorowanych zapis EKG może być bardzo przydatny do
rozpoznania NZK. Pamiętać należy o niewielkim stopniu ograniczenia tej
• obecność prawidłowego oddechu;
• ruchy oddechowe klatki piersiowej;
• poruszanie się;
• ocena tętna tylko jako jeden z elementów.
144

metody. Zapis podobny do migotania komór czy asystolii może być spowo-
dowany zewnętrznymi zakłóceniami lub odłączeniem się kabla. Asystolia
w zapisie EKG widoczna jest jako lekko falista linia izoelektryczna. W nie-
których przypadkach mogą być widoczne w krzywej EKG załamki P. Obraz
idealnie prostej linii izoelektrycznej w EKG nasuwa podejrzenie odłącze-
nia się elektrody. Prawdziwość asystolii w zapisie EKG można potwierdzić,
sprawdzając połączenie i przyleganie elektrod lub badając zapis w innym
odprowadzeniu. Drobnofaliste migotanie komór może dawać obraz przy-
pominający asystolię. W różnicowaniu pomaga zwiększenie amplitudy wy-
chyleń krzywej na monitorze lub też zmiana odprowadzeń EKG. Rozkoja-
rzenie elektryczno-mechaniczne to kliniczny obraz zatrzymania krążenia
przy zachowanej czynności elektrycznej (obecność zespołów komorowych
w EKG).
PODSTAWOWE CZYNNOŚCI PODTRZYMUJĄCE ŻYCIE (BLS)
Mogą być prowadzone zarówno przez osoby przeszkolone, jak i bez takie-
go przeszkolenia. Podtrzymanie podstawowych czynności życiowych ma na
celu zapewnienie perfuzji ważnych dla życia narządów (szczególnie OUN
i serca). Udrożnienie dróg oddechowych, zastosowanie sztucznej wentylacji
i uruchomienie krążenia krwi umożliwia podtrzymanie życia do momentu
wdrożenia zaawansowanych procedur.
Ważne dla przeżycia jest podjęcie akcji w ciągu pierwszych kilku minut
(3-5 min). Wcześnie rozpoczęta resuscytacja zapobiega wystąpieniu późnej
asystolii, która jest następstwem przedłużającego się migotania komór,
zwiększa szansę na skuteczną defibrylację, podtrzymuje funkcję serca i mó-
zgu oraz znacząco zwiększa przeżycie.
Elementy BLS
• rozpoznanie zatrzymania krążenia, zapewnienie bezpieczeństwa
własnej osobie w trakcie akcji ratowniczej, ocena urazów i stopnia
przytomności (przy podejrzeniu urazu kręgosłupa można
poruszać ofiarą tylko w absolutnej konieczności);
• wezwanie pomocy (podanie danych: lokalizacja, numer telefonu,
co się stało, liczba ofiar, stan ofiar, rodzaj potrzebnej pomocy,
inne pomocne informacje);
• rozpoczęcie czynności ABC i D.
145

BLS obejmuje powiadomienie odpowiednich służb odpowiedzialnych za
kolejny etap pomocy (advanced life suport, ALS). U osób dorosłych po roz-
poznaniu NZK konieczne jest jak najszybsze tzw. phone first powiadomienie
służb ratowniczych – główną przyczyną zatrzymania krążenia jest tu migo-
tanie komór, a jedyną skuteczną metodą leczenia jest defibrylacja elektrycz-
na. Przeżywalność w tej arytmii obniża się o 7-10% z każdą minutą, po 12
minutach sięgając już tylko 2-5%. Phone fast dotyczy dzieci do 8 r.ż. Tu naj-
częstszą pierwotną przyczyną jest zatrzymanie oddechu, a wtórnie do tego
zatrzymanie krążenia. U tych ofiar udrożnienie dróg oddechowych i pod-
trzymywanie oddechu powinno być wdrożone przed wezwaniem odpowied-
nich służb ratowniczych. Zaleca się ok. 1 min resuscytacji, a następnie we-
zwanie pomocy i powrót do czynności resuscytacyjnych. Zasady te oczywiście
nie wymagają zastosowania w przypadku, gdy telefon może wykonać drugi
ratownik lub zaangażowany przypadkowy przechodzień. Są oczywiście wy-
jątki:
ABC i D
Czynności ABC i D obejmują:
• A (airway) – udrożnienie dróg oddechowych
Najczęstszą przyczyną niedrożności jest zapadanie się podstawy języka.
Odpowiedni manewr żuchwą przesuwa jej podstawę udrażniając drogi od-
dechowe. W przypadku podejrzenia uszkodzenia kręgosłupa szyjnego nie
• usunięcie z jamy ustnej śluzu i ciał obcych (protez zębowych,
kęsów pokarmu, wymiocin itp.);
• odgięcie głowy do tyłu i przytrzymanie żuchwy do szczęki.
• utopienie i podtopienie w każdym wieku – phone fast;
• zatrzymanie krążenia lub oddechu związane z urazem
– phone fast;
• przedawkowanie leków – phone fast,
• u dzieci z wysokim prawdopodobieństwem arytmii serca jako
pierwotnej przyczyny NZK – phone first;
• ciało obce w drogach oddechowych u osoby przytomnej
– rękoczyn Heimlicha przed wykonaniem telefonu – phone fast.
146

należy odginać głowy do tyłu. Konieczny jest wówczas zabieg wyluksowania,
tj. uniesienia żuchwy i przyciśnięciu jej do szczęki, tak aby dolne zęby znala-
zły się przed górnymi. Drożność dróg oddechowych można utrzymać dzięki
zastosowaniu rurek ustno- czy nosowo-gardłowych. Najlepszym sposobem
utrzymania drożności dróg oddechowych jest intubacja dotchawicza, chro-
niąca drogi oddechowe przed zachłyśnięciem.
• B (breathing) – wentylacja płuc
Sztuczne oddychanie należy rozpocząć od dwóch wydechów, kontrolując
przy tym ruchomość klatki – brak unoszenia klatki piersiowej może wskazy-
wać na niedrożność dróg oddechowych lub nieszczelność w czasie wtłaczania
powietrza do ust.
1. Wentylacja powietrzem wydechowym osoby ratującej
Wydychane powietrze ratownika zawiera wystarczająco dużo tlenu, aby
przez jakiś czas zapewnić jego dopływ do tkanek pacjenta. Polecaną metodą
jest metoda usta-usta. Jeżeli nie jest możliwa wentylacja usta-usta (np.
uszkodzenie ust, szczękościsk), alternatywą może być wentylacja usta-nos.
Wydech wykonywać należy powoli przez około 2 sekundy. Zalecane są małe
objętości wtłaczanego powietrza – wystarczą takie, które powodują minimal-
ny ruch klatki piersiowej. Szybkie wtłaczanie oraz duże objętości powietrza
sprzyjają przedostawaniu się powietrza do żołądka, co upośledza wentylację,
unosząc kopułę przepony oraz grozi wymiotami i zachłyśnięciem. Kątem oka
należy obserwować ruchy klatki piersiowej w trakcie wtłaczania powietrza
i jej biernego opadania przy wydechu.
2. Wentylacja z użyciem worka samorozprężalnego z jednokierunkową
zastawką (np. typu AMBU)
Jeśli to możliwe, należy jak najszybciej podłączyć do worka dopływ 100%
tlenu. Wentylacja workiem może być wspomagana rękoczynem Sellicka
– uciśnięcie chrząstki pierścieniowatej zamyka światło przełyku, zapobiega-
jąc aspiracji treści żołądkowej do oskrzeli. Ten zabieg wymaga jednak po-
mocy trzeciego ratownika.
• sztuczny oddech usta-usta, usta-nos lub workiem AMBU;
• dwa wydechy i kontrola ruchu klatki piersiowej, a następnie
w schemacie wraz z masażem zewnętrznym serca.
147

• C (Circulation) – zewnętrzny masaż serca
Przepływ krwi w trakcie masażu pośredniego spowodowany jest przede
wszystkim zmianami ciśnień w trakcie kompresji klatki piersiowej, w mniej-
szym stopniu od bezpośredniego ucisku ścian serca. Masaż jest w stanie wy-
generować ciśnienie w tętnicach ok. 60-80 mm Hg, a rzut serca wynosi jedy-
nie 25% – jest to niezbędne minimum pozwalające na podtrzymanie przy
życiu ważnych dla życia narządów.
Aby skutecznie wykonać zewnętrzny masaż serca, chory musi spoczy-
wać na twardym podłożu. Dłonie ratownika nałożone jedna na drugą po-
winny spoczywać w 1/3 dolnej części mostka. Głębokość ucisku powinna
wynosić 4-5 cm. Rąk wyprostowanych w stawach łokciowych nie należy
odrywać od mostka w trakcie masażu. Częstotliwość ucisku powinna wy-
nosić 100/minutę, co biorąc pod uwagę przerwy na sztuczny oddech daje
realnie około 65 uciśnięć na minutę. Prowadzenie masażu powinno być
połączone ze sztuczną wentylacją w proporcji – 15 uciśnięć na 2 odde-
chy.
W ostatnich latach pojawiło się coraz więcej obaw przed wykonywa-
niem sztucznego oddechu u nieznajomych poszkodowanych. Niektóre
prace pokazują, że sama kompresja jest również skuteczna. Jeśli występu-
ją opory lub strach przed rozpoczęciem sztucznej wentylacji, należy zde-
cydować się na samą kompresję – alternatywą jest tylko śmierć poszkodo-
wanego.
• D (Defibrillation) – automatyczna zewnętrzna defibrylacja
Wczesna metoda automatycznej zewnętrznej defibrylacji skutecznie
uzupełnia procedury ABC, osiągając w pierwszej minucie zastosowania
90% skuteczność w przywracaniu prawidłowego rytmu w przypadku VT
oraz VF bez obecności tętna. W automatyczny zewnętrzny defibrylator
(automated external defibrillator, AED) wbudowany jest system analizują-
cy rytm oraz wyzwalający energię. Instrukcja użytkowania oraz głosowe
pouczenie o kolejności wykonywania poszczególnych czynności sprawia,
że AED może być użyty przez przypadkowych świadków zdarzenia – sam
nie wyzwala impulsu – „radzi” jedynie, aby tego dokonać przez wciśnię-
cie odpowiedniego przycisku. Zastosowanie impulsu dwufazowego umoż-
liwia zmniejszenie energii defibrylacji. Coraz więcej danych przemawia za
tym, by urządzenie to lokalizować również w oddziałach szpitalnych,
szczególnie w tych oddalonych od OIOM czy OIOK. Jeśli krążenie nie
powraca po 3 wstrząsach, konieczne jest wykonywanie procedur ABC
przez 1 min.
148

Błędy w czasie resustytacji
Potencjalne powikłania BLS
• Dla pacjenta
Jednak jedyną alternatywą dla wdrożenia szybkiej, efektywnej resuscytacji
krążeniowo oddechowej jest śmierć.
• Dla ratownika
ZAAWANSOWANE METODY RATUJĄCE ŻYCIE
Zastosowanie podstawowych czynności resuscytacyjnych pozwala na wdro-
żenie procedur specjalistycznych (advanced cardiac life suport, ACLS). Ma-
• transmisja zakażeń (od 1960-1998 tylko 15 doniesień, często
Helicobacter pylori, wirusy z grupy Herpes, minimalne ryzyko HIV,
HBV, HCV, CMV).
• wtłoczenie powietrza do żołądka z wtórnym do tego
zachłyśnięciem;
• w wyniku ucisku na klatkę piersiową może dojść do złamania
żeber, mostka, odmy śródpiersiowej, krwotoku opłucnej,
uszkodzenia płuca, wątroby, śledziony, zatoru tłuszczowego.
• zbyt długie przerwy w czynnościach resuscytacyjnych:
– dopuszczalna przerwa wynosi 5 s (wyjątek stanowi intubacja
i kaniulacja żył – do 30 s);
• zła technika masażu pośredniego serca:
– uciskanie mostka w jego górnej zamiast dolnej części,
– uciskanie zamiast mostka okolicy przedsercowej na lewo od
mostka,
– dotykanie palcami klatki piersiowej w trakcie masażu,
– odrywanie dłoni od klatki piersiowej,
– niewykonywanie masażu na twardym podłożu.
149

ją one na celu przywrócenie skutecznej czynności hemodynamicznej serca,
przywrócenia spontanicznego oddechu oraz zniesienie istniejącej hipoksji
i kwasicy tkankowej.
Zaawansowane metody ratujące życie obejmują:
Wentylacja
Tkankowa hipoksja w trakcie NZK spowodowana zmniejszonym rzutem
serca wiedzie do beztlenowych przemian oraz kwasicy metabolicznej, która
wpływa na skuteczność defibrylacji oraz podawanych leków. Z tego powo-
du 100% tlen jest zalecany w trakcie zabiegów resuscytacyjnych, a krótko-
trwała terapia jest bezpieczna i nietoksyczna. Do efektywnej tlenoterapii ko-
nieczne jest zastosowanie sprzętu do utrzymywania drożności dróg
oddechowych. Spośród wielu urządzeń do zapewnienia drożności dróg od-
dechowych najlepszą metodą jest intubacja dotchawicza, dodatkowo izolują-
ca drogi oddechowe od pokarmowych.
Pomimo różnych modyfikacji klasycznej metody kompresji klatki piersio-
wej nowe metody, takie jak aktywna kompresja/dekompresja, kompresja
z dużą częstotliwością, stosowanie równoczesne wentylacji i kompresji nie
poprawiło wyników resuscytacji, pomimo patofizjologicznych przesłanek
do ich zastosowania.
Nie ma obecnie dobrych kryteriów oceniających skuteczność zabiegów re-
suscytacyjnych. Puls obecny w trakcie masażu pośredniego nie jest wskaźni-
kiem przepływu i perfuzji. Wyczuwana fala tętna jest często spowodowana
wstecznym przepływem krwi w pozbawionych zastawek dużych żyłach krą-
żenia bądź przenoszeniem fali przez tkanki miękkie. Pomocą może być oce-
na gazów wydechowych – w szczególności CO
2
przy użyciu kapnometru.
Stosowanie leków podczas zatrzymania krążenia
Większość leków stosowanych w zatrzymaniu krążenia może być podawa-
na do rurki dotchawiczej – jest to droga z wyboru, jeśli nie ma wcześniejsze-
• defibrylację (jeśli takowa nie była wykonana wcześniej);
• przyrządową wentylację i podtrzymywanie krążenia;
• monitorowanie czynności elektrycznej serca;
• wykonanie 12-odprowadzeniowego zapisu EKG;
• zapewnienie dostępu do żyły;
• stosowanie odpowiednich leków.
150

go założonego dostępu żylnego. Pamiętać należy, aby dawka podawanego tą
drogą leku była 2 razy większa od dawki podawanej i.v. Jeśli żadna żyła nie
jest skaniulowana przed zatrzymaniem krążenia, jako pierwsze powinny być
wykorzystane żyły przedramienia lub szyjne zewnętrzne. Dostęp centralny
wymaga niestety przerwania kompresmasażu. Podanie leków do żył obwo-
dowych powinno być „popchnięte” bolusem płynu. Jeśli po reanimacji krąże-
nie powraca, należy wprowadzić cewnik do jednej z żył centralnych. Dostępu
takiego powinno unikać się u pacjentów, którzy są kandydatami do reperfu-
zji farmakologicznej.
• Leki optymalizujące rzut serca i ciśnienie krwi
Mechanizm działania tej grupy leków związany jest ze zwiększeniem na-
pięcia naczyń obwodowych oraz dodatnim chrono- i inotropizmie.
Epinefryna (adrenalina) – podstawowy lek w resuscytacji. Agonista recep-
tora alfa
1
, alfa
2
, beta
1
i beta
2
aktywuje cyklazę adenylową (receptor beta)
oraz układ ATP-ATP-aza (receptor alfa). Kurcząc naczynia przedwłosowate
skóry, błon śluzowych, nerek oraz naczynia żylne, silnie podwyższa ciśnienie
tętnicze krwi. Zwiększa siłę skurczu oraz przyśpiesza czynność serca. Po-
przez aktywację receptora beta powoduje rozszerzenie naczyń wieńcowych,
zwiększając tym samym przepływ kosztem jednak dużego zwiększenia zuży-
cia tlenu. W reanimacji wykorzystywane są głównie jej właściwości alfa-adre-
nergiczne zwiększające przepływ mózgowy oraz sercowy. Jest mało badań
pokazujących, że zastosowanie adrenaliny poprawia rokowanie u ludzi. Za-
lecaną dawką jest 0,045-0,2 mg/kg masy ciała, choć nadal rekomendowaną
dawką u dorosłych jest 1 mg. Próby zastosowania dużych dawek adrenaliny
zwiększały szanse powrotu spontanicznego krążenia, ale statystycznie nie
poprawiały wyników odległych oraz stanu neurologicznego. Być może jest
to wynikiem pogłębiania dysfunkcji mięśnia sercowego w wyniku zwiększe-
nia zużycia tlenu, a także toksycznego hiperadrenergicznego stanu w okresie
poresuscytacyjnym. Obecnie duże dawki nie są rekomendowane, ale można
rozważyć ich podanie w sytuacji, gdy dawka 1 mg jest nieskuteczna. Podanie
dosercowe zarezerwowane jest obecnie jedynie w przypadku bezpośrednie-
go masażu serca. Podawana drogą infuzji z dostępu centralnego jest także
używana jako wazopresor u pacjentów bez NZK (w stanach wstrząsowych).
Norepinefryna (noradrenalina) – naturalny wazokonstryktor znajduje za-
stosowanie w okresie poresuscytacyjnym pacjentów z hipotensją oraz z niskim
oporem obwodowym (wstrząs). Podobnie jak epinefryna zwiększa zapotrze-
bowanie mięśnia sercowego na tlen – jest jednak lekiem bezpieczniejszym,
głównie ze względu na mniejszą ilość objawów niepożądanych. Podawana
jest we wlewie dożylnym 0,5-1 g/min.
151

Dopamina – prekursor noradrenaliny oraz adrenaliny ma podobne do
nich działanie, ale stosunkowo słabsze. Dodatkowo działając na receptory
dopaminergiczne, rozszerza naczynia nerkowe, nasilając diurezę oraz wyda-
lanie sodu z moczem. Znajduje zastosowanie w okresie poresuscytacyjnym
u pacjentów w stanie wstrząsu oraz z niewydolnością serca. Działanie zależ-
ne jest od podanej dawki. Małe dawki 2-4 g/kg/min powodują głównie efekt
diuretyczny, wyższe – działają inotropowo dodatnio oraz kurczą naczynia.
Często stosowana łącznie z syntetyczną katecholaminą – dobutaminą w le-
czeniu wstrząsu poresuscytacyjnego.
Wazopresyna – w dawkach fizjologicznych jest hormonem antydiuretycz-
nym. W dawkach wielokrotnie przekraczających fizjologiczne, stymulując re-
ceptor V
1
mięśni gładkich działa jako nieadrenergiczny wazokonstryktor,
z bardzo małym wpływem na naczynia wieńcowe, nerkowe i mózgowe. W od-
różnieniu od adrenaliny nie powoduje rozszerzenia naczyń mięśni szkiele-
towych oraz nie zwiększa konsumpcji tlenu przez mięsień sercowy w trakcie
resuscytacji oraz w okresie poresuscytacyjnym. T
1
wynosi ok. 10-20 min
(działa dłużej niż epinefryna). Dzięki tym właściwościom obecnie rekomen-
dowana jest jako alternatywa dla epinefryny w leczeniu wstrząsu, migotania
komór, asystolii oraz rozkojarzenia elektryczno-mechanicznego. Może być
również skuteczna u pacjentów przy przedłużającym się NZK, wcześniej
otrzymujących epinefrynę. Zalecaną dawką jest 40 IU podawanych jedno-
razowo.
• Leki antyarytmiczne
Atropina – poprzez blokadę receptora muskarynowego przyspiesza czyn-
ność serca oraz zwiększa przewodzenie w układzie bodźcoprzewodzącym
serca. Wskazana w objawowych bradykardiach zatokowych, bloku przedsion-
kowo-komorowym, komorowej asystolii. Szczególnie wskazana w sytuacjach,
gdy do nagłego zatrzymania krążenia doszło w mechanizmie wzmożonej
czynności układu cholinergicznego (podrażnienie górnych dróg oddecho-
wych, ucisk na zatokę szyjną lub gałki oczne, zaburzeń w obrębie OUN).
Znosi wówczas zwolnienie i zatrzymanie czynności serca. W asystolii reko-
mendowana dawka 1 mg co 3-5 min do dawki maksymalnej 0,4 mg/kg m.c.
(dla 70 kg – 3 mg).
Amiodaron – lek antyarytmiczny z grupy III, działający na kanały Na, K,
Ca oraz mający właściwości alfa i beta blokady. U pacjentów z upośledzoną
czynnością lewej komory jest preferowany w arytmiach komorowych i nad-
komorowych przed innymi lekami. Rekomendowany po defibrylacji i epine-
frynie w zatrzymaniu akcji serca, przy nawracających migotaniach komór lub
152

częstoskurczach komorowych bez tętna. Podawany jest w dawce 150 mg co
10 min, a następnie we wlewie dożylnym 1 mg/kg m.c. Maksymalna dawka
dobowa wynosi 2 g.
Lidokaina (xylokaina) – lek grupy Ib wg Vaughana-Williamsa skraca czas
trwania potencjału czynnościowego, zmniejszając okres refrakcji. Przez wie-
le lat znajdowała zastosowanie w nawracających VT/VF. Obecnie jest lekiem
drugiego rzutu po amiodaronie. Akceptowalna dawka w nawracających
VT/VF 0,5-0,75 mg/kg, co 3-5 min w razie potrzeby. Kontynuowanie profi-
laktycznej infuzji po bolusie dożylnym jest kontrowersyjne.
Tosylan bretylium – używany w leczeniu opornych VT i niewrażliwych na
defibrylację i epinefrynę VF. Został wycofany z algorytmów ACLS ze wzglę-
du na dużą ilość objawów ubocznych.
Dwuwęglany – niewiele badań wskazują na to, że terapia buforami popra-
wia wyniki resuscytacji. Centralną rolę w kontroli gospodarki kwasowo-zasa-
dowej podczas NZK i po nim spełnia prawidłowa wentylacja pęcherzykowa
– hiperwentylacja koryguje obecną kwasicę oddechową poprzez usuwanie
CO
2
. Dożylne podanie dwuwęglanów może powodować paradoksalnie we-
wnątrzkomórkową kwasicę, zmieniać krzywą dysocjacji hemoglobiny, hamu-
jąc uwalnianie tlenu, powodować hiperosmolarność, a także zmniejszać od-
powiedź na podawane katecholaminy. Obecnie zalecane jest podawanie
dwuwęglanów w sytuacjach z udokumentowaną na podstawie gazometrii
metaboliczną kwasicą, hiperkaliemią, w zatruciu trójcyklicznymi lekami
przeciwdepresyjnymi. Prawdopodobnie są również korzystne przy przedłuża-
jących się resuscytacjach. Dawka: 1 mEq/kg m.c.
ALGORYTMY POSTĘPOWANIA W NZK
Wyniki końcowe zależą w głównej mierze od czasu, jaki upłynął od
NZK do momentu wprowadzenia podstawowych i zaawansowanych pro-
cedur. Jedna z podstawowych wytycznych podkreśla potrzebę ustawicz-
nego kształcenia i przypominania wiedzy – nawet w gronie ekspertów.
Centralną pozycję w większości algorytmów postępowania w NZK u do-
rosłych jest ocena rytmu serca i w zależności od niej podział na ofiary
z VT/VF bez pulsu oraz na ofiary bez VT/VF. Ta druga grupa obejmuje
takie przyczyny NZK, jak asystolię oraz rozkojarzenie elektryczno-me-
chaniczne.
Postępowaniem z wyboru w przypadku VT/VF jest defibrylacja elektrycz-
na najbardziej efektywna, niezależnie od wywołujących ją przyczyn, jeśli zo-
stanie zastosowana w ciągu dwóch pierwszych minut od zatrzymania krąże-
153

nia. Podawanie leków sprowadzono do roli drugoplanowej – tak naprawdę
nie udowodniono ich skuteczności. Stąd automatyczna zewnętrzna defibry-
lacja stanowi jeden z najważniejszych elementów postępowania przedszpi-
talnego i stanowi element łączący podstawowych i zaawansowanych proce-
dur ratujących życie. Energia wyzwolonego impulsu może być mniejsza
w przypadku użycia tzw. defibrylatorów dwufazowych.
Asystolia oraz rozkojarzenie elektryczno-mechaniczne leczone są podob-
nie. Asystolia obarczona jest najgorszym rokowaniem – przeżywalność sięga
jedynie 1-2%, głównie w sytuacjach, gdy istnieje odwracalna przyczyna NZK
(np. hiperkaliemia). Asystolia to raczej potwierdzenie śmierci niż rodzaj ryt-
mu, który można leczyć, stąd wynikające ważne pytanie, czy rozpoczynać ak-
cję reanimacyjną, czy nie? Przed podjęciem decyzji konieczne jest potwier-
dzenie asystolii poprzez sprawdzenie przylegania elektrod i połączeń,
potwierdzenie linii izoelektrycznej w innym odprowadzeniu. Przezskórna
stymulacja powinna być rozpoczęta jak najwcześniej, łącznie z zastosowa-
niem odpowiednich leków, takich jak atropina i adrenalina. Po uzyskaniu
skutecznej stymulacji konieczne jest zapewnienie dostępu do żył centralnych
i założenie elektrody endokawitarnej.
Rozkojarzenie elektromechaniczne – nieobecność pulsu przy obecności
różnego typu elektrycznej aktywności innej niż VT/VF, tradycyjnie nazywa-
ne jest rozkojarzeniem elektromechanicznym. Ze względu na obecność nie-
wielkiego rzutu serca, właściwsze wydaje się określenie: aktywność elek-
tryczna bez pulsu (pulsless electrical activity, PEA). Jakakolwiek czynność
elektryczna pojawiająca się na monitorze jest zjawiskiem bardziej korzyst-
nym niż asystolia. W tych przypadkach główny nacisk należy położyć na roz-
poznawanie odwracalnych przyczyn NZK. Chociaż PEA ma słabe rokowa-
nie – odwracalne przyczyny zawsze muszą być brane pod uwagę, leczone
i nigdy niepominięte. Gorsze rokowanie występuje przy rytmach wolnych
i z szerokimi zespołami QRS – najczęściej będące objawem uszkodzenia
miokardium, hiperkaliemii, hipotermii, hipoksji, kwasicy czy też przedaw-
kowania leków. Szybkie rytmy z wąskimi zespołami QRS świadczą o nor-
malnej odpowiedzi prawidłowego miokardium na czynniki uszkadzające,
takie jak zator tętnicy płucnej, tamponada, hipowolemia. W odróżnieniu
od VT/VF w asystolii, jak i w PEA wazopresyna nie jest lekiem rekomendo-
wanym.
Pytanie, kiedy zakończyć akcję resuscytacyjną w przypadku asystolii oraz
PEA jest trudne. Przed taką decyzją konieczna jest odpowiedź na pytanie,
czy były odpowiednio prowadzone czynności BLS i ALS – czy wykonano intu-
bację i stosowano odpowiednią wentylację, czy były podawane odpowiednie
154
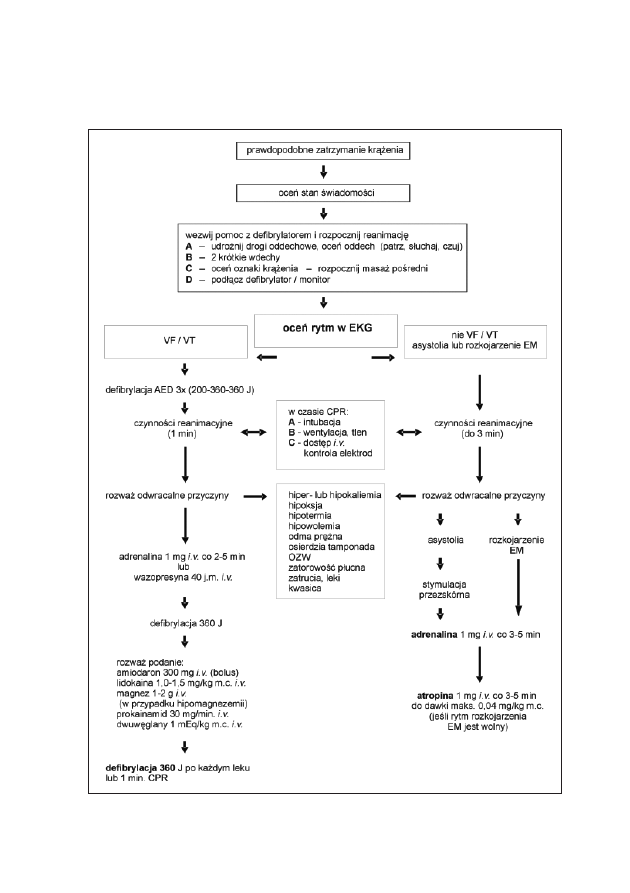
leki, czy były rozpoznawane i odpowiednio leczone potencjalnie odwracalne
przyczyny NZK oraz czy istnieje ciągła linia asystolii, pomimo prawidłowego
wykonywania czynności resuscytacyjnych >5-10min.
Rycina 1: Postępowanie w NZK u dorosłych (na podstawie ILCOR Universal oraz
Comprehensive ECC. Circulation 2000)
155

OPIEKA PORESUSCYTACYJNA
W niewielkim odsetku przypadków po skutecznej akcji reanimacyjnej
dochodzi do całkowitej normalizacji funkcji organizmu – powrotu świado-
mości oraz własnego wydolnego oddechu. Znacznie częściej po powrocie
spontanicznego krążenia organizm znajduje się w stanie wstrząsu hipowo-
lemicznego, kardiogennego lub związanego z zespołem uogólnionej reak-
cji zapalnej (SIRS). Połowa zgonów w okresie poresuscytacyjnym ma miej-
sce w ciągu 24 godzin od NZK. Choć funkcja układu krążenia normalizuje
się w ciągu 12-24 godzin, to jednak z powodu wieloogniskowej hipoksji do-
chodzi do dysfunkcji mikrokrążenia, prowadząc do zaburzeń metabolizmu
komórkowego i uwalniania enzymów komórkowych do krwi. Narastanie
zaburzeń w obrębie bariery jelitowej powoduje przenikanie związków tok-
sycznych ze światła jelita do krwi, prowadząc do stanu septycznego, szybko
pogarszającego stan pacjenta. Głównym celem leczenia w okresie poresu-
scytacyjnym jest ustabilizowanie funkcji organów i perfuzji tkankowej. Sta-
bilizacja rytmu, ciśnienia tętniczego oraz parametrów oddechowych sama
nie poprawia przeżycia – ważna jest resuscytacja narządowa. W tym okre-
sie konieczne jest również rozpoznawanie i leczenie powikłań poresuscyta-
cyjnych, takich jak złamania żeber, tamponady osierdzia, odmy opłucno-
wej itd. Sprawą podstawową jest optymalizacja leczenia choroby, która
doprowadziła do NZK.
ODWRACALNE PRZYCZYNY NAGŁEGO
ZATRZYMANIA KRĄŻENIA
• hiper- lub hipokaliemia;
• hipoksja;
• hipotermia;
• hipowolemia;
• odma prężna;
• tamponada osierdzia;
• ostre zespoły wieńcowe (OZW);
• zatorowość płucna;
• zatrucia lekami;
• kwasica.
156

Postępowanie w okresie poresuscytacyjnym obejmuje:
Podstawowe badania po NZK:
Występowanie zaburzeń jonowych, hipertermii, drgawek, hipotensji, oli-
gurii obliguje do agresywnego leczenia. Założenie sondy do żołądka, jak naj-
szybsze karmienie przez sondę, stosowanie blokerów receptora H
2
zapobie-
ga rozwijaniu się dysfunkcji bariery jelitowej oraz powstawaniu wrzodu
stresowego i krwawieniu z przewodu pokarmowego.
ZATRZYMANIE KRĄŻENIA W SZPITALU
Gdy NZK nastąpiło w obecności personelu:
• wezwać na pomoc zespół resuscytacyjny;
• uderzyć w okolicę przedsercową (tylko w sytuacji monitorowania
EKG);
• jeśli nie nastąpił powrót rytmu, widziany w zapisie EKG, wykonać
defibrylację;
• jeśli nie jest to możliwe, podjąć podstawowe zabiegi
reanimacyjne, rozpoczynając od masażu serca (C), a następnie:
– przywrócić drożność dróg oddechowych (A) oraz
– rozpocząć sztuczną wentylację workiem AMBU (B).
• 12-odprowadzeniowe EKG;
• zdjęcie RTG klatki piersiowej;
• gazometria;
• elektrolity (Na, K, Ca, Mg);
• glukoza;
• mocznik, kreatynina;
• inne – zależnie od sytuacji.
• monitorowanie EKG;
• tlenoterapię;
• infuzję płynów (0,9% NaCl);
• zmianę dostępu naczyniowego obwodowego na centralny;
• ocenę stanu hemodynamicznego, parametrów życiowych oraz diurezy.
157

W takich przypadkach kolejność podstawowych czynności resuscytacyj-
nych ulega zmianie (C, A, B). Można przypuszczać, że zatrzymanie odde-
chu nastąpiło w skutek migotania komór, a skuteczność defibrylacji zwiększa
się przy jak najszybszym jej wykonaniu.
ZATRZYMANIE KRĄŻENIA W SZCZEGÓLNYCH
OKOLICZNOŚCIACH
Pierwotne zatrzymanie oddechu
Występuje w przypadku podwyższonego ciśnienia śródczaszkowego (guzy
mózgu, krwawienie śródczaszkowe), w chorobach metabolicznych w następ-
stwie przedawkowania leków działających na układ oddechowy.
Utonięcie
Podstawowe znaczenie w postępowaniu ma bezzwłoczne podjęcie sztucz-
nej wentylacji. Istotne jest oczyszczenie górnych dróg oddechowych z ciał
obcych. Ponieważ utonięcie może współistnieć z urazem szyjnego odcinka
kręgosłupa, należy unikać odginania głowy osoby ratowanej do tyłu.
Hipotermia
Jest to obniżenie temperatury ciała poniżej 35°C. Akcja ratownicza u oso-
by w hipotermii powinna być skojarzona z zabiegami mającymi na celu pod-
noszenie temperatury ciała. Resuscytacji nie wolno przerywać poniżej 32°C.
Przy niskiej temperaturze ciała, zarówno leki, jak i defibrylacja są zazwyczaj
nieskuteczne (poniżej 30°C). W hipotermii do utraty przytomności docho-
dzi przy temperaturze ciała 30°C, bradykardia pojawia się przy 29°C, a za-
trzymanie krążenia przy 28°C. Pomiar temperatury należy wykonywać ter-
mometrem elektronicznym.
Zatrzymanie krążenia w zaawansowanej ciąży
Utrudnieniem jest ucisk ciężarnej macicy na aortę brzuszną i żyłę główną
dolną. Jeśli po 5 minutach akcji ratowniczej nie uzyskuje się przywrócenia
czynności życiowych, należy wykonać zabieg doraźnego cięcia cesarskiego,
dając szansę przeżycia matce i dziecku.
PODEJMOWANIE I ZAPRZESTANIE AKCJI REANIMACYJNEJ
Podstawową zasadą jest podejmowanie akcji reanimacyjnej w każdym
przypadku zatrzymania krążenia. Fakty dotyczące chorego należy ustalać
158
w trakcie lub po akcji. Nie wolno opóźniać ani przerywać akcji reanimacyjnej
w celu zasięgnięcia informacji o chorym.
Istotne fakty i dane dotyczące chorego w trakcie akcji:
W przypadku nieuleczalnej choroby, w okresie terminalnym, zespół
medyczny prowadzący chorego powinien podjąć wcześniej decyzję, co do
podejmowania resuscytacji. Decyzja dotycząca niepodejmowania reani-
macji, powinna być znana zarówno personelowi lekarskiemu, jak i pielę-
gniarskiemu oraz powinna być odnotowana w raportach i w historii cho-
roby.
Nieodwracalne zatrzymanie czynności serca można rozpoznać, gdy mimo
prawidłowo prowadzonej akcji ratowniczej, w zapisie EKG utrzymuje się ob-
raz asystolii przez ponad 30 min. Jeśli w obrazie EKG występują jakiekol-
wiek oznaki czynności elektrycznej serca, przywrócenie czynności serca mo-
że okazać się możliwe. Istnieją sytuacje, w których mimo długotrwałej akcji
reanimacyjnej nie dochodzi szybko do uszkodzenia mózgu w związku ze
zwolnieniem metabolizmu komórek nerwowych. Należą do nich zatrzymanie
krążenia w przebiegu zatrucia lekami działającymi depresyjnie na OUN (np.
barbiturany) oraz w hipotermii.
Wskazania do przedłużonej reanimacji
Decyzja o przerwaniu nieskutecznej akcji reanimacyjnej
Powinna być podjęta przez osobę kierującą akcją po konsultacji z pozo-
stałym zespołem.
Po powrocie oddechu układamy chorego w pozycji bocznej ustalonej.
W przypadku urazów nie można przewracać pacjenta do tej pozycji (wyjąt-
• zatrucie lekami wpływającymi depresyjnie na OUN (np. barbiturany);
• hipotermia (poniżej 32°C).
• wiek;
• dokładny czas trwania utraty przytomności;
• czas prowadzenia resuscytacji przez przygodnych świadków;
• czas prowadzenia resuscytacji przez personel karetki;
• choroby przebyte w ostatnim okresie;
• zażywane leki.
159

kowo, gdy sami musimy wezwać pomoc). Po 30 minutach zmieniamy stronę
ułożenia pacjenta.
Zapamiętaj!
1. Nagłe zatrzymanie krążenia nie leczone obarczone jest stuprocentową
śmiertelnością.
2. Badanie tętna to tylko jeden z elementów rozpoznania NZK.
3. Automatyczna zewnętrzna defibrylacja zastosowana odpowiednio wcześnie
zwiększa szansę przeżycia.
4. Przed zakończeniem akcji reanimacyjnej zawsze rozważ potencjalnie od-
wracalne przyczyny NZK.
Warto przeczytać:
Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardio-
vascular Care. Circulation 2000, 102.
160

XV. PROARYTMIA
Karol Wrzosek, Jarosław Król
Zwiększenie częstości występowania chorób układu krążenia, wydłużenie
średniej wieku oraz coraz lepsza dostępność nieinwazyjnych, jak i inwazyj-
nych badań w diagnostyce zaburzeń rytmu sprawiła, że coraz częściej staje-
my przed wyborem odpowiedniej terapii dla pacjenta z arytmią. Zaburzenia
rytmu serca towarzyszą wielu różnym chorobom serca, ale także wykrywa-
ne są u osób dotychczas pozostających w poczuciu zdrowia. Niemożność le-
czenia przyczynowego sprawia, że często decydujemy się na wybór leku anty-
arytmicznego. Nie zawsze pamiętamy, że działanie tych leków może nieść
również zagrożenie dla zdrowia i życia pacjentów, głównie za sprawą działa-
nia proarytmogennego. Powstanie nowej arytmii lub nasilenie dotychczaso-
wej jest głównym problemem leczenia antyarytmicznego, nierzadko o tra-
gicznych, jatrogennych konsekwencjach.
DEFINICJA
Działanie proarytmiczne w trakcie stosowania leków antyarytmicznych to:
Proarytmia jest stanem bezpośredniego zagrożenia życia.
TROCHĘ HISTORII
Szkodliwość leków antyarytmicznych opisywana była już dość dawno. Pod
koniec XVIII wieku zaobserwowano u pacjentów przyjmujących preparaty
naparstnicy zasłabnięcia, zwracając jednocześnie uwagę na zwolnienie czyn-
ności serca przy podawaniu dużych dawek tego leku. W latach sześćdziesią-
tych XX wieku opisano możliwość występowania migotania komór u pacjen-
tów leczonych chinidyną z powodu nadkomorowych zaburzeń rytmu serca.
Wtedy po raz pierwszy powiązano stosowanie leków antyarytmicznych z ich
działaniem proarytmicznym (arytmogennym). Jednak dopiero duże bada-
nia kliniczne pod koniec ubiegłego stulecia pokazały prawdziwy problem le-
czenia lekami antyarytmicznymi. Pierwszym takim badaniem było badanie
• wywołanie całkowicie nowej lub
• nasilenie uprzednio istniejącej arytmii, a także
• wystąpienie uprzednio nieobecnych zaburzeń automatyzmu i/lub
przewodzenia.
161

CAST (Cardiac Arrhytmia Supression Trial) w 1989 roku. Do badania byli
włączani pacjenci po przebytym zawale serca, z upośledzoną funkcją lewej
komory (EF <35%), u których występowały dodatkowe pobudzenia komo-
rowe. Przez okres 10 miesięcy podawano im leki o udokumentowanej sku-
teczności w wygaszaniu komorowych zaburzeń rytmu serca (flekainid i enka-
inid). Wyniki były zaskakujące – śmiertelność całkowita w grupie przyjmującej
lek antyarytmiczny sięgała 7,7% i była wyższa od śmiertelności w grupie pla-
cebo, która wynosiła 3%. Wnioski z badania były następujące: enkainid i fle-
kainid zwiększają ryzyko śmierci u pacjentów z asymptomatyczną arytmią
komorową, choć były one skuteczne w wygaszaniu tej arytmii. Kolejne dwa
badania CAST II z morycyzyną oraz SWORD (Survival With ORal D-sota-
lol) z sotalolem przerwano przedwcześnie w początkowych fazach badania
z powodu wzrostu całkowitej i sercowopochodnej śmiertelności w grupach
przyjmujących leki antyarytmiczne.
MECHANIZM DZIAŁANIA PROARYTMICZNEGO
Mechanizm arytmogennego działania leków antyarytmicznych nie jest do
końca jasny. Zależny jest on w dużej mierze od elektrofizjologicznego me-
chanizmu działania leku – wpływu na czas trwania potencjału czynnościo-
wego, zmianę szybkości przewodzenia impulsów, skrócenie czy też wydłuże-
nie okresu refrakcji. Najważniejsze mechanizmy wydają się być związane
z powstaniem nowych fal nawrotnych oraz wydłużeniem okresu repolaryza-
cji. Powstawanie fal nawrotnych w trakcie leczenia lekami antyarytmiczny-
mi wiąże się z pojawieniem jednokierunkowych bloków oraz zwolnieniem
przewodzenia w obszarach, w których istnieją już zaburzenia przewodzenia,
ale nie spełniają jeszcze warunków powstawania fali re-entry. Leki antyaryt-
miczne powodują duże zaburzenia równowagi pomiędzy okresem refrakcji,
a okresem przewodnictwa w „ognisku arytmogennym”. Może nim być frag-
ment niedokrwionego miokardium, pasma mięśniowe obecne w tkance łącz-
nej pozawałowej, zaburzenia jonowe, zaburzenia metabolizmu komórkowe-
go, procesy zapalne miokardium i inne mechanizmy patofizjologiczne
zaburzające rozchodzenie się bodźców w układzie bodźcoprzewodzącym
i komórkach roboczych mięśnia sercowego. Dodatkowym czynnikiem sprzy-
jającym może być fizjologiczna niejednorodność komórek miokardium oraz
różna amplituda rozchodzących się potencjałów czynnościowych.
Innym mechanizmem odpowiedzialnym za efekt proarytmiczny jest wy-
dłużenie okresu repolaryzacji, i powstanie wczesnych potencjałów podepola-
ryzacyjnych – najsilniej wyrażone w przypadku leków grupy Ia i III wg Vau-
ghana-Williamsa. W tym mechanizmie powstaje jedna z najczęstszych arytmii
162

– wielokształtny częstoskurcz komorowy (torsade de pointes). Proarytmicz-
ne działanie leków z grupy Ib, Ic oraz propafenonu manifestuje się najczęściej
wystąpieniem częstoskurczu komorowego oraz migotaniem komór.
U chorych z zaburzeniami czynności węzła zatokowo-przedsionkowego
może dojść do bradyarytmii po zastosowaniu leków beta-adrenolitycznych,
amiodaronu, flekainidu i propafenonu.
Każdy lek przeciwarytmiczny ma działanie kardiodepresyjne – nasilenie
stopnia niewydolności serca i towarzyszący temu wzrost jego obciążenia
zwiększa zapotrzebowanie na tlen, pogłębia niedokrwienie, co dodatkowo
sprzyja powstawaniu zaburzeń rytmu serca.
Ryzyko wystąpienia proarytmii wynosi średnio 5-10%. Większość znanych
przypadków proarytmii ujawnia się w pierwszych dniach rozpoczęcia lecze-
nia lub zmiany dawki leku i przyjmuje postać utrwalonego częstoskurczu
komorowego, wielokształtnego VT oraz nabytego jatrogennego zespołu wy-
dłużonego QT. Opisywane są również późne efekty proarytmiczne, związane,
jak się wydaje, z niejednorodnym gromadzeniem leku w obszarach uszko-
dzonych czy też niedokrwionych oraz zmianami szybkości przewodzenia
i powstawaniem fal nawrotnych w tych obszarach. Postęp choroby podsta-
wowej bądź też jej niestabilność również stanowi element zagrożenia pro-
arytmią.
Ryzyko proarytmii wzrasta w przypadku:
• choroby organicznej serca szczególnie z upośledzeniem funkcji lewej
komory (EF <35%);
• leczenia preparatami naparstnicy oraz diuretykami;
• występowania zaburzeń jonowych (głównie hipokaliemii i hipoma-
gnezemii);
• wydłużenia skorygowanego odstępu QT przed rozpoczęciem terapii;
• wcześniejszego wywiadu migotania komór lub częstoskurczu komo-
rowego;
• wystąpienia działania proarytmicznego po zastosowaniu leku innego
niż obecnie;
• szybkiego zwiększania dawek leku antyarytmicznego;
• współistniejących zaburzeń przewodzenia;
• upośledzenia wydolności nerek.
163
ROZPOZNANIE PROARYTMII
Rozpoznanie proarytmicznego działania leków opiera się głównie na 24-go-
dzinnym badaniu elektrokardiograficznym metodą Holtera. Kryteria rozpo-
znania działania proarytmicznego na podstawie badania holterowskiego
przedstawiono w tabeli 1. Spoczynkowe badanie EKG ma ograniczoną war-
tość, choć może wnieść pewne wskazówki, takie jak obecność zaburzeń prze-
wodzenia, złożonych arytmii czy też wydłużenia odstępu QT – mimo że nie
ma jednoznacznej zależności pomiędzy stopniem wydłużenia a ryzykiem
proarytmii.
Innym badaniem pozwalającym rozpoznać proarytmiczne działanie leków
jest badanie elektrofizjologiczne za pomocą programowanej stymulacji ko-
mór czy też tak zwanego mapowania elektrofizjologicznego.
ZAPOBIEGANIE
Zagrożenie proarytmią i ryzyko związane z jej wystąpieniem sprawia, że
leczenie chorych z zaburzeniami rytmu serca jest sztuką trudną. Podstawową
sprawą jest odpowiednia diagnostyka pokazująca przyczyny arytmii.
W pierwszej kolejności terapia powinna polegać na eliminacji czynników wy-
wołujących arytmię i optymalizacji leczenia choroby podstawowej. U cho-
rych, u których nie udaje się ustalić etiologii lub leczenie przyczynowe jest
niewystarczające, konieczne jest zastosowanie leczenia objawowego za po-
mocą leków antyarytmicznych. Decyzja o rozpoczęciu takiej terapii powinna
Tabela 1: Holterowskie kryteria rozpoznawania proarytmicznego działania leków
LICZBA VEB
PRZED LECZENIEM
ZMIANY NIEZBĘDNE DO
ROZPOZNANIA DZIAŁANIA
PROARYTMICZNEGO
10-50
>10 razy więcej
51-100
>5 razy więcej
101-300
>4 razy więcej
>300
>3 razy więcej
niezależnie
>10 razy więcej form zwielokrotnionych
(pary, salwy)
niezależnie
wystąpienie uprzednio nieobecnego VT lub VF
niezależnie
częstoskurcz komorowy o wyższej częstości,
innej morfologii, trudniejszy do przerwania
164

być poprzedzona określeniem czynników ryzyka wystąpienia proarytmii. Je-
śli są one obecne, rozpoczęcie leczenia należy podjąć w szpitalu. Najbez-
pieczniejszą i skuteczną grupą leków są leki beta-adrenolityczne. Uważa się
obecnie, że stosowanie ich jest niezbędne, gdy podajemy leki z grupy I wg
Vaughana-Williamsa. Niezbędna jest kontrola stężenia elektrolitów (szcze-
gólnie ważna przy leczeniu diuretykami) oraz monitorowanie EKG. Wydłu-
żenie odstępu QT z jednej strony wskazuje na skuteczność dawki leku, ale
gdy przekracza wartość wyjściową o 1/3 lub QTc wydłuża się ponad 0,5 s, mo-
że to wskazywać na ryzyko proarytmii. Wykonanie pod koniec pierwszego
tygodnia leczenia badania holterowskiego jest konieczne, gdyż pozwala roz-
poznać działanie proarytmiczne, a w przypadku skuteczności zastosowanego
leku pozwala przewidywać skuteczność odległą danego leku. Zwiększenie
dawek leku musi być rozłożone w czasie – uważa się, że powinno odbywać
się co 4-5 okresów półtrwania danego leku. Przy leczeniu przewlekłym ko-
nieczna jest okresowa kontrola kliniczna, biochemiczna oraz elektrokardio-
graficzna, a także, jeśli to możliwe, badanie stężenia leku we krwi.
LECZENIE ARYTMII WYZWOLONEJ LEKAMI
ANTYARYTMICZNYMI
Arytmia może być stanem bezpośredniego zagrożenia życia. Pacjent z ob-
jawami proarytmii (bądź też podejrzewany o nią), powinien być hospitalizo-
wany w Oddziale Intensywnej Opieki Kardiologicznej, gdzie istnieje możli-
wość ciągłego monitorowania zapisu EKG oraz szybkiego leczenia. Leczenie
proarytmii powinno być wieloetapowe – od leczenia doraźnego, poprzez sta-
łą obserwację, monitorowanie stężenia leku, aż do usunięcia czynników
sprzyjających oraz ewentualne zastosowanie w dalszej kolejności innego le-
ku przeciwarytmicznego.
Postępowanie doraźne
Postępowanie doraźne u chorego z objawami proarytmii zależne jest od
stanu chorego oraz rodzaju występujących zaburzeń. Lek, który podejrze-
wamy o działanie arytmogenne należy odstawić. Proarytmogenne działanie
leków może manifestować się nagłym zatrzymaniem krążenia – wówczas po-
stępowanie reanimacyjne nie odbiega od standardów. W stanach przebiega-
jących z niestabilnością hemodynamiczną postępowaniem z wyboru jest kar-
diowersja elektryczna.
Najczęściej proarytmia manifestuje się jako wielokształtny częstoskurcz
komorowy (torsade de pointes). Jego wystąpieniu sprzyjają wydłużenie od-
stępu QT, zaburzenia jonowe pod postacią hipokaliemii, hipomagnezemii,
165

hipokalcemii. Najczęściej jest formą ustępującą samoistnie – objawia się
wówczas głównie zasłabnięciami. Leczenie w takiej sytuacji ma na celu zapo-
bieganie kolejnym nawrotom oraz eliminacji czynnika sprawczego (np. dyse-
lektrolitemii). Lekiem z wyboru jest siarczan magnezu w dawce 1-2 g w cza-
sie 10-15 min, zaleca się także założenie elektrody endokawitarnej i czasowej
elektrostymulacji typu overdrive pacing do momentu wygaszenia arytmii.
W przypadku utrwalonego częstoskurczu komorowego leczenie nie odbie-
ga od rutynowego postępowania. Alternatywą może być podanie hiperto-
nicznego roztworu NaCl.
Inne metody leczenia doraźnego obejmują przyśpieszenie czynności ser-
ca przy użyciu stymulacji przedsionkowej typu overdrive pacing, bądź farma-
kologicznie przy użyciu isoproterenolu (2-8 g/min) lub atropiny.
Kolejnym krokiem jest usunięcie czynników sprzyjających proarytmii, ta-
kich jak bradykardia, niedokrwienie, niewydolność serca czy też zaburzenia
elektrolitowe. W dalszej kolejności rozważyć należy zastosowanie innego le-
ku przeciwarytmicznego (z innej grupy). Konieczny jest wówczas ścisły nad-
zór w okresie rozpoczęcia podawania. Występowanie proarytmii powinno
skłaniać w kierunku leczenia za pomocą metod niefarmakologicznych, ta-
kich jak ablacja prądem o częstotliwości radiowej, chirurgiczne zabiegi anty-
arytmiczne czy też wszczepienie kardiowertera-defibrylatora (implantable
cardioverter-defibrillator, ICD).
Zapamiętaj!
1. Proarytmia może być stanem bezpośredniego zagrożenia życia.
2. Każdy lek antyarytmiczny obarczony jest potencjalnym działaniem proaryt-
micznym.
3. Jeśli to możliwe, zaburzenia rytmu należy leczyć przyczynowo.
4. Przed rozpoczęciem podawania leku antyarytmicznego, należy rozważyć
korzyści i ryzyko związane z podawaniem leku.
Warto przeczytać:
L. Giec, Z.S. Herman: Farmakoterapia chorób układu sercowo-naczynio-
wego. PZWL, Warszawa 1995.
M. Dłużniewski (red.): Zaburzenia rytmu serca. Fundacja „Dla Serca”,
Warszawa 1997.
166

XVI. ARYTMOGENNA KARDIOMIOPATIA
PRAWEJ KOMORY
Witold Pikto-Pietkiewicz, Maciej Janiszewski, Marek Kuch
WSTĘP
Jedną z możliwych, choć rzadkich przyczyn komorowych zaburzeń rytmu
jest arytmogenna kardiomiopatia prawej komory (arrhythmogenic right ven-
tricular cardiomyopathy, ARVC).
Istotę choroby stanowi stopniowe zastępowanie mięśnia prawej komory
przez tkankę tłuszczową i włóknistą. Na obraz kliniczny ARVC składają się
tachyarytmie komorowe i specyficzny obraz histopatologiczny prawej komory
serca. Po raz pierwszy chorobę opisał w 1977 roku Fontaine, który zapropo-
nował stosowaną aktualnie nazwę arytmogenna kardiomiopatia prawoko-
morowa. Inne używane niegdyś nazwy tej jednostki chorobowej to „arytmo-
genna dysplazja prawej komory” i „arytmogenna choroba prawej komory”.
Niektóre przypadki klasyfikowane pod tymi nazwami nie odpowiadają w peł-
ni obecnie ustalonym kryteriom diagnostycznym. Najistotniejsze dla chorych
z ARVC jest rozpoznanie u nich tej choroby przed pojawieniem się pełnej
symptomatologii, gdyż często pierwszą manifestacją jest nagła śmierć serco-
wa. ARVC jest ważną przyczyną nagłych zgonów u osób w wieku poniżej
30. r.ż., może dotyczyć nawet 20% przypadków nagłych zgonów w młodym
wieku. Arytmogenna kardiomiopatia prawej komory jest najczęstszą przy-
czyną nagłego zgonu u młodych włoskich sportowców.
GENETYKA
Arytmogenna kardiomiopatia prawokomorowa jest chorobą w znacznym
stopniu uwarunkowaną genetycznie, jest dziedziczona autosomalnie, domi-
nująco, ze zmienną penetracją i ekspresją genu. Geny odpowiedzialne za
ARVC nie zostały w pełni zidentyfikowane, ale udało się ustalić ich lokaliza-
cję na chromosomie 14, 1, 2 i 10. Nie są też w pełni znane produkty pochod-
ne tych genów ze względu na ich niepełną penetrację i ekspresję, zależną
również od wieku. Jednym z takich produktów jest plakoglobina, która
uczestniczy w tworzeniu połączeń międzykomórkowych. Nieprawidłowe po-
łączenia pomiędzy kardiomiocytami mogą być przyczyną ich obumierania
i zastępowania przez tkankę włóknisto-tłuszczową. Innym defektem genetycz-
nym powiązanym z ARVC jest gen kodujący receptor rianodynowy. Recep-
tor ten jest odpowiedzialny za uwalnianie wapnia z retikulum sarkoplazma-
tycznego, a defekt sercowego receptora rianodynowego został powiązany
167

z występowaniem częstoskurczów komorowych indukowanymi katecholami-
nami. Innym potencjalnym genem odpowiedzialnym za ARVC jest gen ko-
dujący alfa-aktyninę, białko zbliżone strukturalnie do dystrofiny – innego
białka, którego defekt genetyczny jest udowodnioną przyczyną dystrofii mię-
śniowej typu Duchenne'a.
Pomimo tych danych, w dalszym ciągu określenie patogenezy ARVC jest
w znacznym stopniu hipotetyczne. Istnieje inna koncepcja rozwoju tej choro-
by, np. teoria płodowej malformacji prawej komory (teoria dysontogenetycz-
na). Uważa się również, że ARVC może być chorobą rozwijająca się pod
wpływem nieznanych czynników (zakaźnych? zapalnych?) na tle upośledze-
nia genetycznego.
Poczyniono obserwacje, że rozwój choroby postępuje szybciej u osób bar-
dziej podatnych na infekcje, w tym na zapalenie mięśnia sercowego (teoria
zapalna). Istnieją także inne poglądy na etiologię ARVC, np. teoria zwyrod-
nieniowa, apoptotyczna czy też teoria różnicowania kardiomiocytów. Teoria
apoptotyczna opiera się na stwierdzeniu w pewnej grupie chorych z ARVC
wysokich stężeń proteazy cysteinowej – enzymu istotnego w procesie apop-
tozy w mięśniu sercowym. Ostatnia z wymienionych koncepcji zakłada moż-
liwość przekształcania komórek sercowych w komórki tłuszczowe pod wpły-
wem nieznanych czynników.
HISTOPATOLOGIA
W badaniu autopsyjnym u chorych zmarłych w przebiegu ARVC stwier-
dza się przerost mięśnia sercowego oraz odcinkowe bądź globalne poszerze-
nie jamy prawej komory. W miejscach, gdzie występuje poszerzenie i znie-
kształcenie jamy, ściana komory ulega wyraźnemu ścieńczeniu. Najczęstsza
lokalizacja zmian dotyczy tzw. trójkąta dysplazji, czyli okolicy koniuszka,
stożka prawej komory i ściany tylno-podstawnej. Obecne mogą być też zmia-
ny o typie tętniaka i/lub uogólnione poszerzenie jamy prawej komory. Mię-
sień prawego serca zostaje w znacznym stopniu zastąpiony przez tkankę
tłuszczową, z rozrzuconymi pojedynczo fibrocytami i miocytami. W niektó-
rych przypadkach mięsień jest całkowicie zastąpiony tkanką tłuszczową lub
ulega znacznemu ścieńczeniu. Zwłóknienie wsierdzia i nacieczenie komór-
kami jednojądrzastymi bywa rzadsze i nie stwierdza się wówczas cech stanu
zapalnego w mikroskopie elektronowym. Kardiomiocyty na obrzeżu masyw-
nego nacieczenia tkanką tłuszczową są hipertroficzne i zdegenerowane, nie
stwierdza się jednak między nimi nacieku zapalnego. Duża ilość kropelek
tłuszczu rozrzucona jest również w sarkoplazmie, nie tylko miocytów, ale
i komórek endotelialnych. Większa ilość kropelek znajduje się w sarkopla-
168

zmie komórek występujących na obrzeżu zmian dysplastycznych niż komó-
rek od tych zmian odległych.
MANIFESTACJA KLINICZNA
Obraz kliniczny u poszczególnych chorych może być bardzo różnorodny
i niezależny od rozległości zmian morfologicznych. Choroba może przebie-
gać w postaci łagodnej (bezobjawowej) lub mieć ciężki przebieg. Około
4/5 przypadków rozpoznawane jest u osób poniżej 40. roku życia, głównie
mężczyzn. ARVC charakteryzują nawracające tachyarytmie komorowe, ob-
jawowy (z utratami przytomności), nieutrwalony lub utrwalony częstoskurcz
komorowy z obrazem bloku lewej odnogi pęczka Hisa i/lub manifestująca
się w różnym stopniu niewydolność krążenia.
Prawokomorowa niewydolność serca (bez nadciśnienia płucnego!) poja-
wia się najczęściej w 4-8 lat po wystąpieniu bloku prawej odnogi pęczka
Hisa (right bundle branch block, RBBB) w EKG.
U bezobjawowych chorych stwierdza się przypadkowo komorowe zabu-
rzenia rytmu w rutynowym badaniu EKG lub powiększoną sylwetkę serca
na zdjęciu przeglądowym klatki piersiowej. Często niestety, pierwszym ob-
jawem ARVD jest nagła śmierć sercowa. W Stanach Zjednoczonych szacu-
je się, że ARVC jest przyczyną około 5% nagłych zgonów. We Włoszech
ARVC jest rozpoznawana ze zwiększoną częstością, a w regionie Veneto jest
najczęstszą przyczyną nagłych zgonów arytmicznych u osób przed 35. r.ż.
W badaniach autopsyjnych cechy ARVC stwierdzono u 1/5 zmarłych poni-
żej 35. roku życia i aż u 1/4 dzieci i młodzieży zmarłych z powodów serco-
wo-naczyniowych. Należy podkreślić, że nagła śmierć sercowa występuje
często podczas wysiłku fizycznego. Mechanizmem zgonu jest w tym przy-
padku związana z wysiłkiem stymulacja adrenergiczna, indukowany przez
nią częstoskurcz komorowy (ventricular tachycardia, VT) degenerujący do
migotania komór (ventricular fibrillation, VF). Tachyarytmie nadkomorowe
występują znacznie rzadziej, stwierdza się je u około 24% chorych z ARVC.
ARVC powinna być brana pod uwagę w przypadku młodych osób z utra-
tami przytomności, epizodami częstoskurczu komorowego o morfologii blo-
ku lewej odnogi pęczka Hisa lub po epizodzie zatrzymania krążenia, także
u młodych dorosłych z objawami zastoinowej niewydolności serca.
Badanie przedmiotowe
W badaniu fizykalnym najczęściej nie obserwuje się żadnych istotnych od-
chyleń. Niekiedy można stwierdzić przesunięcie lewej granicy stłumienia ser-
cowego oraz obecność IV, rzadziej III tonu serca.
169
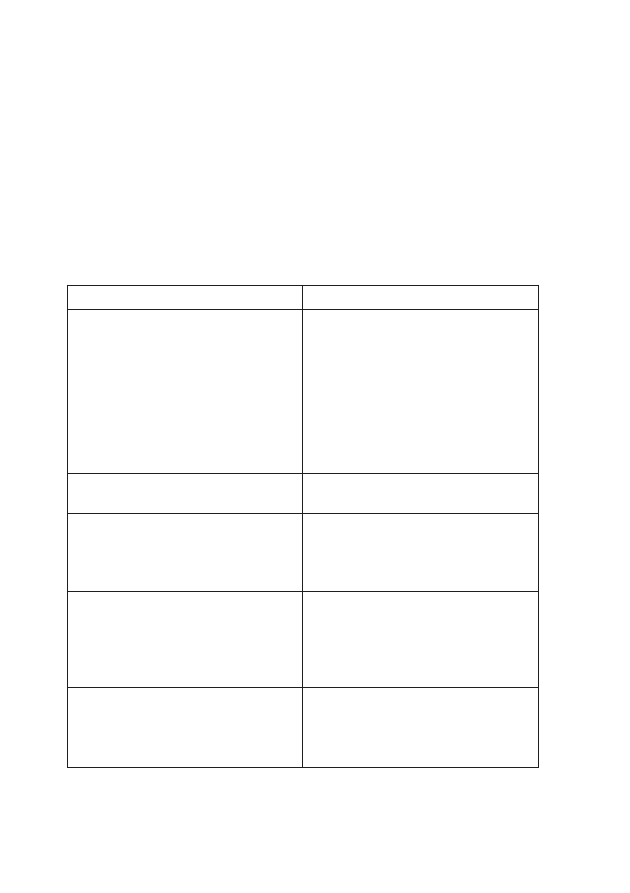
Radiologiczne zdjęcie przeglądowe klatki piersiowej
Powiększenie sylwetki serca stwierdza się u 72% pacjentów, sylwetka ser-
ca bywa najczęściej kulista.
Zapis EKG podczas rytmu zatokowego
Należy podkreślić, że w rutynowym badaniu elektrokardiograficznym moż-
liwe są do stwierdzenia cechy specyficzne dla ARVC. Cechy te zostały ujęte
w trzech kategoriach zmian, stanowiących kryteria rozpoznawcze kardiomio-
patii prawokomorowej (tab. 1).
LBBB - blok lewej odnogi pęczka Hisa, RBBB - blok prawej odnogi pęczka Hisa,
VT - częstoskurcz komorowy, VEB - dodatkowe pobudzenie komorowe,
EF - frakcja wyrzutowa, ARVC - arytmogenna kardiomiopatia prawej komory.
Tabela 1: Kryteria rozpoznawcze arytmogennej kardiomiopatii prawokomorowej
DUŻE
MAŁE
• znaczna rozstrzeń prawej komory,
upośledzenie jej kurczliwości,
spadek EF prawej komory – bez
upośledzenia (lub
z umiarkowanym) funkcji lewej
komory;
• tętniaki prawej komory;
• znaczne poszerzenie odcinkowe
jamy prawej komory;
• umiarkowane poszerzenie i/lub
redukcja EF prawej komory
z prawidłową lewą komorą;
• niewielkie odcinkowe
poszerzenie jamy prawej komory;
• łagodna odcinkowa hipokineza
PK;
• charakterystyczne zmiany
w biopsji mięśnia sercowego;
• poszerzenie QRS w V
1
-V
3
>110 ms lub obecność załamka
epsilon w V
1
-V
3
;
• obecność późnych potencjałów;
• zaburzenia repolaryzacji
(ujemne T) w V
1
-V
3
przy braku
cech RBBB u osób >12 r.ż.;
• VT (utrwalony lub nieutrwalony)
o morfologii LBBB;
• liczne VEB >1000/24 h;
• złożone komorowe zaburzenia
rytmu;
• występowanie rodzinne
(potwierdzone operacyjnie lub
autopsyjnie).
• występowanie rodzinne nagłego
zgonu <35 r.ż.;
• dodatni wywiad rodzinny
w kierunku ARVC.
170

Z powodu występowania obwodowego bloku przewodzenia wydłuża się
czas trwania zespołu QRS w odprowadzeniu V
1
powyżej 110 ms. Wybiórcze
wydłużenie QRS w odprowadzeniach V
1
-V
3
w porównaniu z odprowadze-
niem V6 jest dodatkowym dużym kryterium rozpoznawczym (QRS w V
1
-V
3
większe niż QRS w V
6
o 50 ms).
Kolejna zmiana EKG to obecność fali epsilon – niewielkiego, dodatniego
załamka za zespołem QRS (lub na jego ramieniu zstępującym), najczęściej
w odprowadzeniu V
1
. Zmiana ta, bardzo charakterystyczna dla ARVC, wy-
stępuje w około 30% przypadków i nie wykazuje związku ze stopniem po-
szerzenia jamy prawej komory. U połowy pacjentów z rozpoznaną ARVC
stwierdza się ujemny załamek T w odprowadzeniach przedsercowych, jed-
nak zmiana ta nie jest specyficzna dla choroby, szczególnie u osób w wieku
poniżej 12. roku życia.
Zapis EKG podczas częstoskurczu komorowego
Dla ARVC typowy jest częstoskurcz komorowy z drogi odpływu prawej
komory (right ventricular outflow track, RVOT). Częstoskurcz ma morfologię
bloku lewej odnogi pęczka Hisa z odchyleniem osi elektrycznej serca w pra-
wo. Za występowanie częstoskurczu odpowiedzialny jest mechanizm re-entry,
związany z powstawaniem obszarów zwolnionego przewodzenia.
Uśredniony zapis EKG
W zmienionej chorobowo ścianie PK obszary o zwolnionym przewodze-
niu są substratem arytmii komorowej. Zastąpione przez tkankę tłuszczową
miokardium staje się obszarem fragmentacji pobudzenia, co w konsekwencji
prowadzi do powstania zjawiska re-entry. Ocena tego zjawiska jest możliwa
dzięki uśrednionemu zapisowi EKG (signal averaged ECG, SAECG). W ba-
daniu tym stwierdzić można obecność późnych potencjałów komorowych
(late potentials, LP). U chorych z rozpoznanym ARVD występowanie LP jest
częste, ocenia się je na 50-70%. Istotną cechą LP jest czas ich trwania, wy-
raźnie dłuższy w przypadku ARVC, porównując do innych stanów chorobo-
wych z obecnością LP. Brak obecności LP nie wyklucza, ale zmniejsza praw-
dopodobieństwo rozpoznania ARVC. Późne potencjały w SAECG są
odpowiednikiem fali epsilon w powierzchniowym zapisie EKG.
Test wysiłkowy
U około połowy pacjentów z ARVD jest możliwe wywołanie/zaostrzenie
arytmii podczas testu wysiłkowego.
171

Niekiedy w diagnostyce arytmii bywa wykorzystywany test z izoprotereno-
lem. Izoproterenol imituje warunki, w jakich pracuje serce podczas wysiłku
fizycznego. Czułość testu z izoproterenolem jest wysoka i wynosi ponad 80%.
Metody obrazowe
• Badanie echokardiograficzne (ECHO serca)
W przypadku podejrzenia ARVC, w ECHO serca należy dokonać szcze-
gółowej oceny komory prawej (PK). Najbardziej istotne dla diagnostyki
ARVC parametry echokardiograficzne to: wymiar późnoskurczowy i późno-
rozkurczowy zarówno prawej, jak i lewej komory, pomiar frakcji wyrzutowej
oraz ocena kurczliwości i oznaczenie jej wskaźnika dla obu komór. Istotna
jest również szczegółowa ocena proporcji i kształtu prawej komory serca,
wolnej ściany PK oraz ocena jej czynności rozkurczowej. Znaczące diagno-
stycznie jest:
Jako echokardiograficzne wyróżniki ARVD traktuje się także umiarko-
wane poszerzenie PK, zdefiniowane co do miejsca – rozdęcie i uwypuklenie
ściany PK oraz dyskinezę dolnopodstawnej ściany PK ze zmniejszonym be-
leczkowaniem. Obecne mogą być także hiperechogeniczna i nieregularna
wiązka pośrednia, izolowane poszerzenie drogi odpływu i dyskineza ko-
niuszka PK oraz nierównomierne beleczkowanie mięśnia lewej komory
(LK).
• Radioizotopowa angiografia serca
W badaniu tym oceniana jest kurczliwość i ewentualne zniekształcenia
ścian PK oraz parametry hemodynamiczne PK i LK (EF).
• Tomografia komputerowa
Badanie to pozwala na ocenę morfologii i kurczliwości ścian PK i zlokali-
zowanie zmian dysplastycznych (tkanka tłuszczowa). Szczególnie przydatna
jest do tego celu tomografia komputerowa strumienia elektronów.
• iloraz wymiarów końcoworozkurczowych PK/LK >0,5;
• iloraz objętości późnorozkurczowych PK/LK >1,8;
• wskaźnik kurczliwości ścian prawej komory >1,0;
• stwierdzenie EF prawej komory <50%.
172

• Rezonans magnetyczny
W rozpoznawaniu ARVC konieczne jest stwierdzenie specyficznych zmian
strukturalnych za pomocą metod możliwie mało inwazyjnych. Metodą szcze-
gólnie wartościową jest obrazowanie serca za pomocą rezonansu magnetycz-
nego (magnetic resonance imaging, MRI). Zaletą MRI jest zdolność charakte-
ryzowania tkanek ocenianego narządu, a więc możliwość rozpoznania
typowego dla ARVC zastępowania prawidłowego miokardium przez tkankę
tłuszczową. Ważne jest wykonanie badania MRI wtedy, gdy może wnieść ono
informacje decydujące, szczególnie przy skąpoobjawowej formie ARVC. MRI
uwidacznia zmiany niemożliwe do wizualizacji w echokardiografii i angiografii.
Pewne ograniczenia tej metody związane są z trudnością precyzyjnej oce-
ny spektralnej cienkiej z natury ściany PK oraz trudności w różnicowaniu
obecności patologicznej, śródmięśniowej tkanki tłuszczowej od występują-
cej fizjologicznie niewielkiej ilości tłuszczu w części nasierdziowej.
• Angiografia (wentrykulografia) prawej komory
Mimo rozwoju nieinwazyjnych metod obrazowania, angiografia pozostaje
dotychczas metodą referencyjną dla oceny strukturalnej i funkcjonalnej pra-
wej komory. U chorych z ARVC jest to badanie szczególnie trudne technicz-
nie, bowiem może wyzwolić dodatkowe pobudzenia komorowe. Zalecana
jest angiografia w dwóch projekcjach (45° RAO i 45° LAO), co pozwala uwi-
docznić obszary najczęściej dotknięte dysplazją: infundibulum (stożek),
przednią, wolną ścianę, koniuszek i dolną ścianę PK – szczególnie w okolicy
podzastawkowej. Charakterystyczne są następujące zmiany: głębokie szcze-
liny pomiędzy przerośniętymi beleczkami mięśniowymi, uwypuklenia i roz-
dęcia wolnej ściany prawej komory. Wystąpienie obu tych cech daje tej me-
todzie swoistość 96% i czułość 87,5%. Często powiększona jest objętość
późnorozkurczowa PK.
Biopsja mięśnia sercowego
Jedyną, poza MRI, metodą diagnostyczną mogącą potwierdzić zastąpie-
nie prawidłowego miokardium tkanką tłuszczową jest biopsja mięśnia ser-
cowego i ocena histopatologiczna pobranego materiału. Tkanka tłuszczowa
zaczyna zwykle pojawiać się w warstwie podnasierdziowej lub śródściennie,
rozszerzając się w kierunku wsierdzia. Najczęstszym miejscem zmian dyspla-
stycznych jest tzw. trójkąt dysplazji, obejmujący okolicę koniuszka, infundi-
bulum i ścianę tylnopodstawną prawej komory. Zmiany nie ograniczają się
do PK i w 40-75% obecne są w miokardium lewej komory.
173
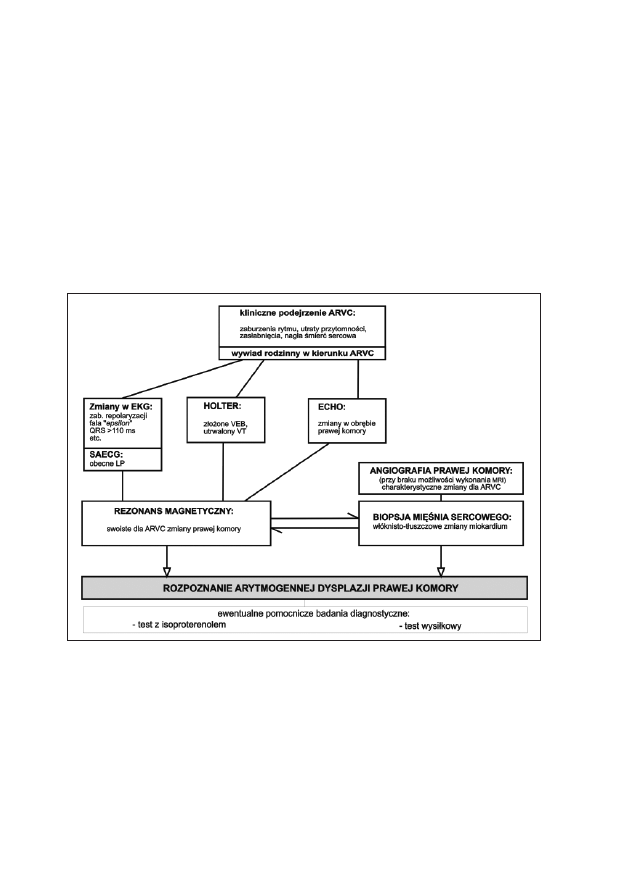
Biopsja ma swoje ograniczenia ze względu na to, że jest pobierana najczę-
ściej z okolicy przegrody międzykomorowej, stosunkowo rzadko dotkniętej
chorobą. Drugim ograniczeniem jest ogniskowy charakter zmian w ARVC.
Lekarz pobierający wycinek może po prostu nie trafić w zmieniony choro-
bowo mięsień. Problem stanowi także odróżnienie patologicznej tkanki
tłuszczowej i tkanki włóknistej od występującej fizjologicznie niewielkiej ilo-
ści śródmięśniowej tkanki tłuszczowej. Ilość tej tkanki może wzrastać wraz
z wiekiem. Angeline i wsp. sugerują, że obecność w bioptatach ponad 40%
tkanki tłuszczowej oraz ponad 3% tkanki włóknistej wyraźnie wskazuje na
ARVC. Wobec inwazyjności badania i wymienionych zastrzeżeń ważne jest,
by biopsja serca pozostała tak jak dotąd ważną, ale tylko jedną z wielu me-
tod w diagnostyce ARVC.
BADANIA ELEKTROFIZJOLOGICZNE
Przeprowadza się je u chorych z ARVC przede wszystkim dla ustalenia
sposobu leczenia (programowana stymulacja komór i mapping z powierzch-
ni ciała). Pozwala to na kwalifikację chorych do określonego sposobu lecze-
nia: chirurgicznego, ablacji, wszczepienia kardiowertera-defibrylatora lub
terapii farmakologicznej. W celu określenia sposobu i miejsca leczenia chirur-
gicznego czy ablacji wykonuje się przedoperacyjnie mapping nasierdziowy.
Rycina 1. Proponowany algorytm postępowania w przypadku podejrzenia ARVC
174

KRYTERIA ROZPOZNANIA ARYTMOGENNEJ DYSPLAZJI
PRAWEJ KOMORY
Przebieg kliniczny oraz niejednoznaczność licznych metod diagnostycz-
nych stosowanych w przypadku podejrzenia ARVC spowodowała koniecz-
ność ujednolicenia kryteriów rozpoznawczych. Zostały one sformułowane
przez grupę roboczą towarzystw kardiologicznych (Task Force of the Working
Group Myocardial and Pericardial Disease of the European Society of Cardio-
logy and of the Scientific Council on Cardiomyopathies of the International So-
ciety and Federation of Cardiology).
Rozpoznanie opiera się na stwierdzeniu dwóch dużych lub jednego duże-
go i dwóch małych bądź też czterech małych objawów klinicznych (każdy
z innej dziedziny diagnostycznej) (tab. 1).
LECZENIE
Terapia ma na celu przede wszystkim wygaszenie zaburzeń rytmu mogą-
cych być przyczyną nagłego zgonu w tej grupie chorych. Rokowanie u cho-
rych leczonych skutecznie antyarytmicznie wydaje się lepsze.
Leki beta-adrenolityczne stanowią racjonalną propozycję ze względu na
możliwość zmniejszenia charakterystycznej dla ARVC gotowości arytmicz-
nej związanej z pobudzeniem układu adrenergicznego.
W przypadku złożonych arytmii komorowych zalecane jest stosowanie le-
ków antyarytmicznych klasy III, głównie sotalolu, a w drugiej kolejności
amiodaronu, choć co do tego leku brak jest badań prospektywnych w gru-
pie chorych z ARVC. Bardzo małą skuteczność antyarytmiczną wykazują na-
tomiast leki antyarytmiczne z grupy I. Rozważać można zastosowanie wera-
pamilu.
Decyzje terapeutyczne mogą opierać się na wyniku programowanej sty-
mulacji komór lub badaniu holterowskim. W przypadkach opornych na far-
makoterapię należy rozważyć wykonanie ablacji RF lub implantację kardio-
wertera-defibrylatora (implantable cardioverter-defibrillator, ICD).
Kardiowerter-defibrylator (ICD)
Wydaje się, że optymalnym sposobem leczenia złożonych arytmii komoro-
wych w ARVC przy nieskuteczności leków beta-adrenolitycznych jest wszcze-
pienie defibrylatora z dodaniem leków antyarytmicznych w celu redukcji
liczby wyładowań ICD.
175
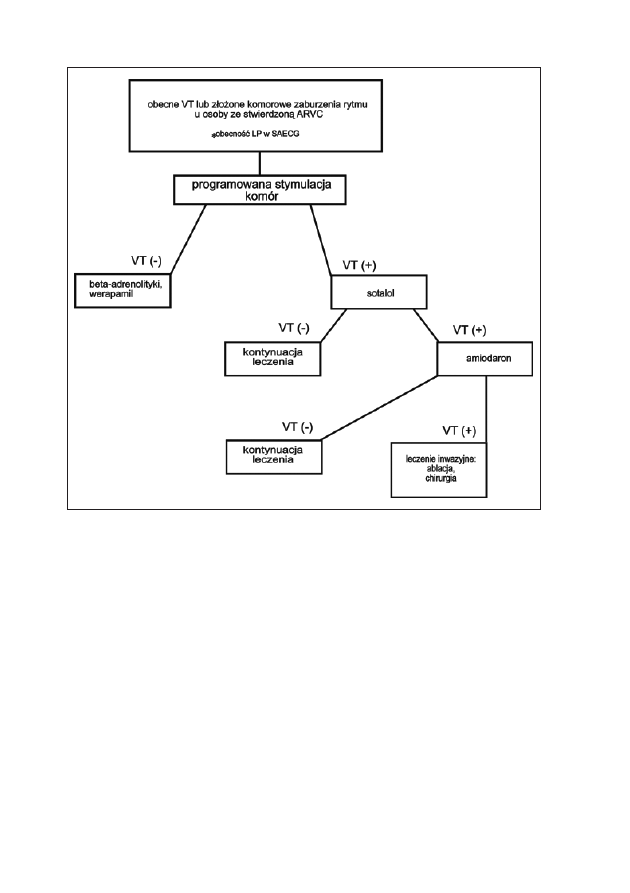
W chwili obecnej kandydatami do otrzymania ICD powinni być pacjenci
uznani za chorych wysokiego ryzyka nagłego zgonu sercowego (po przebytej
resuscytacji, z utratami przytomności, chorzy u których leczenie antyaryt-
miczne nie jest skuteczne).
Leczenie farmakologiczne niewydolności serca
Leczenie to nie odbiega istotnie od typowego postępowania, w przypad-
kach schyłkowej niewydolności należy rozważać przeszczep serca.
Zapamiętaj!
1. Charakterystyczną zmianą morfologiczną dla ARVC jest stopniowa zamia-
na mięśnia PK przez tkankę tłuszczową.
Rycina 2. Ustalenie sposobu leczenia
176

2. Typowym zaburzeniem rytmu dla ARVC są epizody utrwalonego lub nie-
utrwalonego częstoskurczu komorowego o morfologii bloku lewej odnogi
pęczka Hisa indukowane pobudzeniem adrenergicznym, np. wysiłkiem fi-
zycznym.
3. W przypadkach zaawansowanej niewydolności serca dominują objawy nie-
wydolności prawokomorowej bez cech nadciśnienia płucnego.
4. ARVC powinna być brana pod uwagę w przypadku młodych osób z utrata-
mi przytomności, epizodami częstoskurczu komorowego o morfologii blo-
ku lewej odnogi pęczka Hisa lub po epizodzie zatrzymania krążenia, a tak-
że u młodych dorosłych z objawami zastoinowej niewydolności serca.
5. Odpowiednio wczesne wykrycie choroby pozwala na wdrożenie skuteczne-
go leczenia antyarytmicznego, w którym kluczową rolę w wybranych przy-
padkach odgrywa wszczepienie kardiowertera-defibrylatora w połączeniu
z farmakoterapią.
Warto przeczytać:
G. Fontaine, G. Guiraudon, R. Frank et al.: Stimulation studies and epi-
cardial mapping in VT: Study of mechanisms and selection for surgery. H. E.
Kulbertus (red.): Reentrant Arrhythmias. Lancaster, PA MTP Publishers
1977, 334-350.
G. Fontaine, F. Fontaliran, T. Iwa et al.: Arrhythmogenic right ventricular
dysplasia. Definition and mechanism of sudden death. M. Akhtar, R. J. Myer-
burg, J. N. Ruskin (red.): Sudden Cardiac Death. Prevalence, Mechanisms
and Approaches to Diagnosis and Management. Malvern, Williams and
Wilkins 1994, 226-237.
F. I. Marcus, G. Fontaine: Arrhythmogenic Right Ventricular Dysplasia/Car-
diomyopathy: A Review. PACE 1995; 18: 1298-1314.
C. Germayel, A. Pellicia, P. D. Thompson: Arrhythmogenic Right Ventricular
Cardiomyopathy. J. Am. Coll. Cardiol. 2001; 38: 1773-81.
W. J. McKenna, G. Thiene, A. Nava et al.: Diagnosis of arrhythmogenic right
ventricular dysplasia/cardiomyopathy. Br. Heart J. 1994; 71: 215-218.
177

XVII. ZABURZENIA RYTMU SERCA U KOBIET
CIĘŻARNYCH
Edyta Kostarska-Srokosz, Ewa Burbicka, Mirosław Dłużniewski
ZMIANY W UKŁADZIE KRĄŻENIA U KOBIETY CIĘŻARNEJ
W czasie ciąży zachodzi wiele zmian adaptacyjnych w układzie krążenia
polegających na zwiększeniu objętości krwi krążącej, objętości wyrzutowej
i pojemności minutowej serca, a także przyspieszeniu czynności serca.
Już w 6. tygodniu ciąży zaczyna dochodzić do wzrostu objętości krwi krążą-
cej, tak aby przed porodem było jej o 40-50% więcej w stosunku do objęto-
ści wyjściowej krwi u kobiety przed ciążą. Ilość krwi krążącej jest proporcjo-
nalna do masy płodu, łożyska i samej ciężarnej. Należy zaznaczyć, że większy
przyrost objętości krwi obserwuje się u wieloródek oraz w przypadku ciąży
mnogiej. Proporcjonalnie większy przyrost objętości dotyczy bardziej oso-
cza krwi niż składników morfotycznych, co prowadzi do fizjologicznej nie-
dokrwistości u ciężarnych. Zwiększenie produkcji estrogenów, pobudzenie
układu renina-angiotensyna-aldosteron oraz wpływające na erytropoezę
i zwiększenie objętości erytrocytów hormony łożyskowe są przyczyną hiper-
wolemii u ciężarnych.
Od 5. tygodnia ciąży wzrasta pojemność minutowa serca. Początkowo zależy
ona głównie od zwiększającej się objętości wyrzutowej serca o 30-50%, a później
od wzrastającej częstości rytmu serca. Najszybszy przyrost zarówno pojemności
minutowej, jak i objętości wyrzutowej, przypada na 28-30 tydzień ciąży i wtedy
to obserwujemy najczęściej pojawienie się lub największe nasilenie zaburzeń ryt-
mu serca u ciężarnych. Spoczynkowa częstość rytmu serca u kobiety ciężarnej
zwiększa się średnio o 10-20 uderzeń na minutę. Jeżeli brak jest możliwości
zwiększenia objętości wyrzutowej, to pojawia się spoczynkowa tachykardia, co
jest objawem zmniejszonej rezerwy sercowo-naczyniowej. W tej sytuacji wysiłek
fizyczny może powodować jeszcze większe nasilenie zaburzeń rytmu serca.
W przebiegu zmian hormonalnych w czasie ciąży (między innymi zwiększenie
stężenia krążących prostaglandyn oraz wzrost wydzielania hormonu natriure-
tycznego) zmniejsza się opór naczyniowy, co może powodować nieznaczne ob-
niżenie ciśnienia tętniczego krwi, zwłaszcza rozkurczowego. Podwyższone stę-
żenie krążących we krwi estrogenów i progesteronu zwiększa wrażliwość serca
na działanie endogennych katecholamin, zwiększając pobudliwość serca i wpły-
wając na właściwości elektrofizjologiczne miocytów, do czego również może
przyczyniać się wzrost gęstości receprotów
α-adrenergicznych w tym okresie.
178
Dużą rolę w powstawaniu zaburzeń rytmu serca odgrywają również zabu-
rzania czynnościowe u ciężarnych, nasilają się lęki i obawy, powodując prze-
wagę układu adrenergicznego w tym stanie, co istotnie podwyższa gotowość
do powstawania nieprawidłowych pobudzeń. Należy również pamiętać o nie-
małej roli używek stosowanych w czasie ciąży. Palenie papierosów, przeby-
wanie w pomieszczeniach razem z osobami palącymi, kawa, mocna herbata
czy alkohol mogą być przyczyną występowania zaburzeń rytmu. Większość
z tych używek może dodatkowo powodować niedobory jonowe, potasowe
czy magnezowe.
Te wszystkie zmiany adaptacyjne układu krążenia pozwalają kobiecie cię-
żarnej przez dziewięć miesięcy utrzymać płód, ale jednocześnie istotnie
zmniejszają rezerwę sercowo-naczyniową, co może doprowadzić do ujaw-
nienia się choroby serca, a między innymi stać się przyczyną powstania no-
wych lub nasilenia już istniejących zaburzeń rytmu serca. Ciężkie zaburze-
nia rytmu serca z jednoczesnymi zaburzeniami hemodynamicznymi,
zarówno w krążeniu matki, jak i płodu, mogą stanowić zagrożenie życia dla
kobiety ciężarnej i jej dziecka, będąc przyczyną samoistnych poronień.
Dlatego tak istotne w tym okresie jest przeprowadzenie prawidłowej
i szybkiej diagnostyki i wdrożenie skutecznego, ale maksymalnie bezpiecz-
nego leczenia.
DIAGNOSTYKA ZABURZEŃ RYTMU SERCA U KOBIET
CIĘŻARNYCH
W badaniu przedmiotowym kobiety w ciąży możemy zaobserwować
wiele objawów, które są typowe dla tego okresu, nie występowały przed
zajściem w ciążę, a po porodzie samoistnie ustępują. Należy pamiętać
Tabela 1: Zmiany w układzie krążenia u kobiet ciężarnych
PARAMETR
RODZAJ ZMIANY
pojemność minutowa serca
↑ 30-50%
objętość wyrzutowa serca
↑
częstość rytmu serca
↑ 10-20 uderzeń/min
objętość krwi krążącej
↑ 40-50%
ciśnienie tętnicze krwi
↓
opór obwodowy
↓
179

o hiperwentylacji, występowaniu obrzęków podskórnych, poszerzeniu żył
szyjnych, krążeniu hiperkinetycznym, akcentowanym I tonie nad koniusz-
kiem serca i II tonie nad tętnicą płucną, występowanie III, a czasem IV
tonu serca. Często pojawia się również szmer śródskurczowy nad ko-
niuszkiem serca lub w punkcie Erba, nad tętnica płucną i tętnicami szyj-
nymi.
Na konsultacje do kardiologa zgłaszają się kobiety do tej pory uważane za
zdrowe, u których dotychczas nie rozpoznawano choroby serca. Ciężarne
z zaburzeniami rytmu serca stanowią dużą grupę pacjentek konsultowanych
kardiologicznie po raz pierwszy. Zdarza się, że u ciężarnych stawiane jest po
raz pierwszy rozpoznanie zespołu WPW, zespołu wydłużonego odstępu QT
czy całkowitego bloku przedsionkowo-komorowego III stopnia. Najczęściej
przyczyną skierowania na konsultacje są odczuwane przez ciężarną kołatania
serca, zasłabnięcia, łatwe męczenie czy obrzęki kończyn dolnych. Część
z tych dolegliwości w trakcie dalszej diagnostyki nie jest kojarzona z choro-
bą serca, a stanowi typowe objawy dla ciąży. I tak najczęstszą przyczyną zgła-
szanych przez ciężarne kołatań serca jest typowa dla ciąży tachykardia zato-
kowa. Opisywane są zmiany częstości rytmu serca, przyspieszenia zatokowe
u kobiet ciężarnych odczuwane jako nieprzyjemne zaburzenia rytmu. Aby
zróżnicować i prawidłowo zdiagnozować objawy opisywane przez ciężarne,
należy przeprowadzić niezbędne badania diagnostyczne. Nie należy zapo-
mnieć o:
Nie można zapomnieć o tym, że zachodzące zmiany adaptacyjne w ukła-
dzie krążenia oraz zmiany topografii narządów ciężarnej są również przy-
czyną powstawania zmian w zapisie EKG, które są typowe dla tego okresu
i nie stanowią patologii. Należy tu wymienić:
• dokładnym badaniu podmiotowym i przedmiotowym;
• wykonaniu badania EKG;
• w razie potrzeby wykonaniu 24-godzinnej ambulatoryjnej rejestracji
metodą Holtera, jeżeli podejrzewamy napadowy charakter zaburzeń
rytmu serca;
• badaniu echokardiograficznym, które pomoże wykluczyć organiczną
wadę serca i jest uważane za bezpieczne dla ciężarnych;
• oznaczeniu morfologii, stężenia jonów oraz hormonów tarczycy w su-
rowicy krwi.
180

W wyjątkowych sytuacjach, na przykład w celu zdiagnozowania napado-
wego częstoskurczu wywoływanego wysiłkiem, przydatna może się okazać
próba wysiłkowa. W celu wykonania diagnostyki różnicowej omdleń, wywo-
ływanych nie tylko przez zaburzenia rytmu serca, ale i upośledzone mecha-
nizmy wazowagalne, opisywane są przypadki wykorzystania testu pochyle-
niowego. Jednak ze względu na możliwość występowania przedłużającej się
asystolii czy częstoskurczu komorowego nie poleca się wykonywania tego
badania u ciężarnych.
Prawidłowo przeprowadzona diagnostyka pomoże nam nie tylko rozpo-
znać zaburzenia rytmu serca, ale także poprawnie je zakwalifikować pod
względem zaawansowania, tak aby we właściwych przypadkach zastosować
leczenie, które (o czym nie wolno nam zapomnieć) nigdy nie jest obojętne
dla matki, a tym bardziej dla płodu.
ZABURZENIA RYTMU SERCA U CIĘŻARNYCH
BEZ ORGANICZNEJ CHOROBY SERCA
U większości zdrowych kobiet zmiany fizjologiczne zachodzące w organi-
zmie w czasie ciąży nie powodują zazwyczaj zaburzeń rytmu serca. Jeżeli już
powstają, to należą zwykle do grupy łagodnych, niewymagających leczenia
farmakologicznego czy inwazyjnego. Często nie towarzyszą im żadne obja-
wy kliniczne i nie powodują zaburzeń hemodynamicznych, ale są diagnozo-
wane w wyniku wnikliwszej niż u kobiet nie ciężarnych diagnostyki. Jeśli już
opisywane są objawy kliniczne, to najczęściej są to kołatania serca, rzadko
zasłabnięcia, a jeszcze rzadziej omdlenia. Zazwyczaj dolegliwości te, tak sa-
mo jak i powodujące je zaburzenia rytmu serca ustępują wkrótce po poro-
dzie.
• zmianę osi elektrycznej serca spowodowaną bardziej poziomym
ułożeniem serca na podniesionej wysoko przeponie (odchylenie osi
elektrycznej zwykle w lewo);
• pojawienie się załamka Q i ujemnego załamka P w odprowadzeniu
III, zanikającego przy zapisie w trakcie wdechu;
• zmiany odcinka ST i załamka T, mogące pojawiać się okresowo;
• przyspieszony rytm zatokowy, możliwość wystąpienia niemiarowości
zatokowej, dodatkowe pobudzenia komorowe i nadkomorowe;
• zmiana stosunku załamków R do S w odprowadzeniach V
1
-V
2
spowodowana wzrostem amplitudy załamka R.
181

U kobiet ciężarnych bez organicznej choroby serca dominują nadkomo-
rowe zaburzenia rytmu, najczęściej przedwczesne pobudzenia i nierzadko
częstoskurcze. Niektórzy autorzy podają, że obserwują je nawet u około 50%
pacjentek. Jednak z badań tych wynika, że pierwszy napad częstoskurczu
nadkomorowego dopiero w ciąży pojawia się rzadko, zwykle obserwuje się
nasilenie zaburzeń rytmu już wcześniej występujących, ale nie zawsze za-
wczasu wykrytych. Występujące u ciężarnych napady migotania przedsion-
ków częściej wiązane są z zatruciem ciążowym lub nadczynnością tarczycy,
która może ujawniać się dopiero w tym okresie.
U ciężarnych bez organicznej choroby serca, oczywiście po przeprowadze-
niu badań diagnostycznych i jej wykluczeniu, ciężkie komorowe zaburzenia
rytmu wpływające niekorzystnie na hemodynamikę występują niezwykle
rzadko. Zwykle opisywane są pojedyncze przedwczesne pobudzenia komo-
rowe, a według niektórych autorów występują nawet u ponad 50% kobiet
bez zmian organicznych w sercu. Niezwykle rzadko u tych pacjentek poja-
wiają się częstoskurcze komorowe, zwykle wyzwalane przez intensywny wy-
siłek fizyczny lub duży stres psychiczny, kiedy do głosu dochodzi wysokie stę-
żenie katecholamin.
ZABURZENIA RYTMU SERCA U CIĘŻARNYCH Z ORGANICZNĄ
CHOROBĄ SERCA
Zaburzenia rytmu pojawiają się bądź istotnie nasilają w czasie ciąży u ko-
biet z organiczną chorobą serca. Występują one najczęściej u kobiet z wro-
dzonymi lub nabytymi wadami serca, mogą towarzyszyć wypadaniu płatka
zastawki mitralnej, przebytemu lub toczącemu się zapaleniu mięśnia serco-
wego, z także zespołowi Wolff-Parkinson-White (WPW), zespołowi wydłużo-
nego odstępu QT oraz chorobom węzła zatokowego, na przykład zespołowi
tachykardia-bradykardia. Czasami pojawiające się w okresie ciąży zaburze-
nia rytmu serca ujawniają niezdiagnozowaną dotychczas chorobę organicz-
ną, na przykład przez wiele lat bezobjawowy zespół WPW. Dlatego tak istot-
na jest wnikliwa diagnostyka kardiologiczna, nawet przy pojawieniu się
łagodnych zaburzeń rytmu.
W większości wrodzonych czy nabytych wad serca pojawia się zwiększone
ciśnienie lub objętość w prawym przedsionku lub komorze. Sprzyja to po-
wstawaniu zaburzeń rytmu serca, najczęściej pochodzenia nadkomorowego,
które w normalnych warunkach stwierdza się u 10-60% chorych z wadą. Cią-
ża jeszcze bardziej nasila te zmiany, co powoduje narastanie ilości zaburzeń
rytmu serca nawet do 80%. Przeciążenie objętościowe ma także dekompen-
sacyjny wpływ na układ krążenia u kobiet z kardiomiopatią i wówczas, przy
182
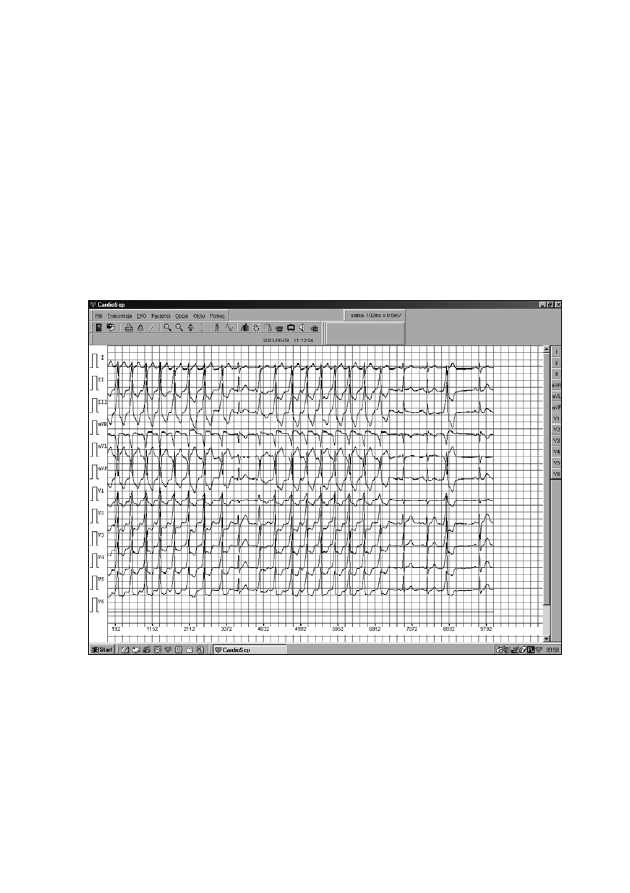
narastającej niewydolności serca, równie często pojawiają się lub nasilają za-
burzenia rytmu.
Nie można zapomnieć o dużym ryzyku wystąpienia ciężkich zaburzeń ryt-
mu serca u kobiet z chorobą wieńcową, po przebytym zawale serca. W ekstre-
malnych sytuacjach objawy te mogą wymagać interwencji inwazyjnej – bada-
nia hemodynamicznego z następową plastyką naczynia wieńcowego, a nawet
pomostowaniem aortalno-wieńcowym.
Nierzadko skutecznym leczeniem ciężkich zaburzeń rytmu serca u kobiet
w ciąży może okazać się jedynie usunięcie ich przyczyny – jak wykonanie pla-
styki naczyń wieńcowych, operacja wady czy ablacja dodatkowej drogi prze-
wodzenia.
LECZENIE ZABURZEŃ RYTMU SERCA U KOBIET CIĘŻARNYCH
Większość zaburzeń rytmu serca u kobiet w ciąży zaliczamy do łagodnych,
niepowodujących zmian hemodynamicznych, czyli niewymagających lecze-
nia. Takimi na pewno są pojedyncze nadkomorowe i komorowe pobudzenia
dodatkowe oraz napadowe częstoskurcze nadkomorowe, a nawet komorowe
Rycina 1. Częstoskurcz komorowy zarejestrowany przez ciężarną w 7. miesiącu ciąży
i przekazany telefonicznie do centrum monitorujacego
183
niepowodujące zaburzeń hemodynamicznych u kobiety ciężarnej czy spadku
przepływu krwi przez łożysko. W takich przypadkach często wystarczająca
może okazać się profilaktyka niefarmakologiczna – zwiększenie ilości snu,
odpoczynek, zaniechanie wysiłku fizycznego, zaprzestanie picia kawy czy pa-
lenia tytoniu. Czasami równie skuteczny w przerywaniu napadowych tachy-
arytmii nadkomorowych może okazać się prosty manewr Valsalvy, zwiększają-
cy napięcie nerwu błędnego.
Leczenie niebezpiecznych zaburzeń rytmu w ciąży jest zagadnieniem naj-
trudniejszym. Wszystkie zastrzeżenia dotyczące leków antyarytmicznych
obowiązują w odniesieniu do ciężarnych, a pamiętać należy, że podając jaki-
kolwiek lek przyszłej matce, podajemy go także rozwijającemu się dziecku.
Fizjologiczne zmiany u kobiet w ciąży są przyczyną zupełnie czasem odmien-
nej farmakokinetyki przyjmowanych leków, mają wpływ na ich wchłanianie,
efektywne stężenie w surowicy oraz wydalanie. Leki antyarytmiczne należy
stosować jedynie w terapii arytmii powodujących zaburzenia hemodynamicz-
ne i zagrażających życiu. Powinny być stosowane w minimalnych skutecz-
nych dawkach, a w I trymestrze ciąży jedynie ze wskazań życiowych.
Jest bardzo niewiele badań klinicznych oceniających bezpieczeństwo i sku-
teczność leków antyarytmicznych u kobiet w ciąży. FDA (Food and Drug Ad-
ministration, USA) podzieliło leki pod względem bezpieczeństwa stosowa-
nia ich u kobiet ciężarnych na cztery grupy A, B, C i D.
W tabeli 3 przedstawiono bezpieczeństwo stosowanych leków antyaryt-
micznych z poszczególnych klas. Żaden z nich nie został zakwalifikowany do
grupy A. Pamiętać należy, że nie możemy również traktować jednakowo róż-
Tabela 2: Klasyfikacja bezpieczeństwa leków stosowanych u kobiet ciężarnych wg FDA
Kategoria A
badania kontrolowane nie wykazują ryzyka
Kategoria B
nie ma dowodów ryzyka u kobiet ciężarnych
jedynie badania na zwierzętach wykazują ryzyko, ale nie
potwierdzają ryzyka badania na ludziach lub badania na
zwierzętach nie wykazują ryzyka, ale nie były
przeprowadzone równoważne badania na ludziach;
Kategoria C
brak badań wśród kobiet w ciąży
badania na zwierzętach wykazują ryzyko dla płodu lub
brak również badań na zwierzętach;
Kategoria D
udowodnione ryzyko dla płodu
doświadczenia lub dane kliniczne wskazują na duże
ryzyko dla płodu.
184

nych przedstawicieli jednej grupy lekowej, tak więc nie możemy mówić
o efekcie klasy w stosunku do leczenia zaburzeń rytmu u ciężarnych.
Tabela 3: Bezpieczeństwo leków antyarytmicznych w czasie ciąży
DIGOKSYNA
C
+
przedawkowanie może spowodować
śmierć płodu
ADENOZYNA
C
+
ograniczone dane
Kategoria
wg FDA
Stosowanie
w ciąży
Uwagi
KLASA IA
torsade de pointes w zespole
wydłużonego QT
• chinidyna
C
+
lek pierwszego rzutu z klasy IA
• prokainamid
C
+
(doraźnie)
zespół toczniopodobny przy
długotrwałym stosowaniu
• disopyramid
C
?
zbyt mało danych
KLASA IB
• lidokaina
B
+
KLASA IC
• flekainid
C
?
zbyt mało danych
• propafenon
C
?
zbyt mało danych
KLASA II
+
niewielkie zaburzenia wzrostu płodu
(rzadko)
• propranolol
C
• metoprolol
C
KLASA III
• sotalol
B
+
torsade de pointes w zespole
wydłużonego QT
• amiodaron
D
+ / -
ciężkie działania niepożądane
(używany tylko ze wskazań życiowych)
KLASA IV
• werapamil
C
+
lek pierwszego rzutu z klasy IV,
dożylnie podanie może działać
hipotensyjnie na płód i matkę
• diltiazem
C
-
ograniczone dane
185

Digoksyna
Lek ten ma najdłuższą karierę w bezpiecznym i skutecznym stosowaniu
w leczeniu zaburzeń rytmu serca u ciężarnych. Jest dobrym wyborem w do-
raźnym i przewlekłym leczeniu nadkomorowych zaburzeń rytmu serca, włą-
czając migotanie i trzepotanie przedsionków oraz częstoskurcz nadkomoro-
wy. Lek ten swobodnie przenika przez łożysko, a jego stężenia we krwi matki
i płodu są zbliżone. Digoksyna zaliczana jest do leków, które nie uszkadzają
płodu i nie powodują efektów ubocznych. Jednak bardzo istotna jest kontrola
dawki i stężenia leku we krwi, ponieważ zatrucie digoksyną może spowodo-
wać poronienie lub śmierć płodu. Należy jednak pamiętać, że jej stężenie przy
ogólnie przyjętym dawkowaniu może być obniżone we krwi matki nawet do
50% ze względu na zwiększony w czasie ciąży klirens nerkowy. Jednocześnie
zmniejszenia dawki może wymagać podawanie digoksyny z innymi lekami
wpływającymi na jej stężenie we krwi – chinidyną, werapamilem oraz oczywi-
ście w przypadku istnienia zaburzeń funkcji nerek. W III trymestrze ciąży we
krwi ciężarnej pojawiają się substancje, które podobne są swoją budową do
digoksyny i mogą fałszywie podwyższać wyniki pomiaru stężenia digoksyny.
Adenozyna
Adenozyna jest podawana jako lek pierwszego rzutu w przerywaniu często-
skurczu nadkomorowego, w którym węzeł przedsionkowo-komorowy jest czę-
ścią pętli re-entry, na przykład w zespole Wolff-Parkinson-White. Zaletą tego
leku jest wysoka skuteczność z jednoczesnym bardzo krótkim czasem półtrwa-
nia poniżej 10 sekund, wskutek czego adenozyna nie zdąży przekroczyć barie-
ry krew-łożysko i dociera do płodu w minimalnym stężeniu. Natomiast wadą
tego leku jest małe doświadczenie kliniczne w jego stosowaniu u kobiet w cią-
ży oraz przypisywane temu lekowi upośledzanie przepływu krwi przez łoży-
sko. Małe badania retrospektywne wskazują na bezpieczeństwo stosowania
adenozyny w II i III trymestrze ciąży bez teratogennego wpływu na płód, ale
ciągle brakuje badań w I trymestrze ciąży. Trzeba podkreślić, że w porównaniu
z powodującym spadki ciśnienia u płodu werapamilem (często stosowanym
do przerywania napadowych częstoskurczów nadkomorowych) adenozyna nie
powoduje upośledzenia hemodynamiki krążenia płodowego. Zauważono rów-
nież, że ze względu na zwiększoną objętość krwi, skuteczne stężenie adenozy-
ny musi być większe u kobiet w ciąży niż ogólnie przyjęte dawkowanie.
Kasa IA leków antyarytmicznych
Leki klasy IA – chinidyna, prokainamid i disopyramid – nie powodują
uszkodzenia płodu i mogą być stosowane w leczeniu nadkomorowych i ko-
186

morowych zaburzeń rytmu serca u kobiet ciężarnych. Ze względu na długo-
letnie doświadczenie w stosowaniu chinidyna jest lekiem pierwszego wyboru
z tej klasy. Bardzo rzadko powoduje łagodne skurcze macicy, poród przed-
wczesny, małopłytkowość u płodów, a w dużych dawkach uszkodzenie nerwu
VIII, dlatego też wskazana jest kontrola stężenia tego leku w surowicy krwi
matki. Prokainamid ma podobne do chinidyny bezpieczeństwo przy krótko-
trwałym stosowaniu, jednak przewlekle stosowany może wywołać zespół
toczniopodobny. Stosowanie disopyramidu w ciąży jest właściwie nie wystar-
czająco przebadane, opisywane są przypadki przedwczesnych skurczów ma-
cicy po jego podaniu. Należy pamiętać, że leki z tej klasy wydłużają odstęp
QT i mogą spowodować częstoskurcz typu torsade de pointes.
Klasa IB leków antyarytmicznych
Lidokaina uznawana jest za lek raczej bezpieczny, nie obserwowano uszko-
dzenia płodu po jej zastosowaniu. Używana do leczenia częstoskurczów ko-
morowych, najczęściej w przebiegu niedokrwienia mięśnia sercowego.
Klasa IC leków antyarytmicznych
Zastosowanie leków tej klasy nie zostało dokładnie przebadane u kobiet
ciężarnych. Do tej pory nie stwierdzano teratogennego wpływu na płód fle-
kainidu czy propafenonu.
Klasa II leków antyarytmicznych
Leki beta-adrenolityczne są dobrze przebadane i skuteczne w leczeniu
większości nadkomorowych tachyarytmii i częstoskurczów komorowych
u kobiet w ciąży. Są to leki o znikomym działaniu proarytmicznym. Jednak
rzadko mogą być przyczyną niskiej masy urodzeniowej u dzieci matek leczo-
nych przewlekle beta-adrenolitykiem w czasie ciąży, a zwłaszcza w I tryme-
strze. Nie są teratogenne, ale przenikając przez łożysko, mogą powodować
bradykardię, hipoglikemię i hiperbilirubinemię u płodów. Selektywne
β1-adre-
nolityki mają niewielki wpływ na pobudzanie czynności skurczowej macicy,
a leki beta-adrenolityczne z wewnętrzną aktywnością sympatykomimetycz-
ną (acebutolol) rzadziej są przyczyną zwolnienia czynności serca u płodu.
Mówiąc o zastosowaniu beta-adrenolityków u kobiet ciężarnych, nie może-
my powoływać się na efekt klasy. I tak na przykład metoprolol (kategoria C
wg FDA) czy acebutolol mogą tu być w miarę bezpiecznie stosowane, nato-
miast atenolol (kategoria D wg FDA) jest przeciwwskazany u ciężarnych.
Mimo to jest to grupa leków najczęściej stosowana w istotnych komorowych
zaburzeniach rytmu serca u kobiet ciężarnych bez zmian organicznych.
187

Klasa III leków antyarytmicznych
Amiodaron jest skuteczny w leczeniu wszelkich rodzajów arytmii komo-
rowej czy nadkomorowej, ale ze względu na liczne objawy uboczne zalecany
jest jedynie ze wskazań życiowych, w przypadkach gdy inne leczenie jest nie-
skuteczne i to w możliwie najniższej dawce. Ten lek zawierający w swym skła-
dzie jod, jest jednym z najsłabiej przenikających przez łożysko leków antyaryt-
micznych, w krążeniu płodu może stanowić 10-25% stężenia w porównaniu
do osocza matki, a mimo to przy przewlekłym stosowaniu może powodować
niedoczynność lub nadczynność tarczycy oraz rozwój wola u płodów. Jedno-
cześnie należy pamiętać o tym, że w porównaniu z innymi lekami antyaryt-
micznymi amiodaron wykazuje mniejsze działanie depresyjne na funkcję
skurczową lewej komory, co może okazać się korzystne u kobiet ciężarnych.
Drugim lekiem tej grupy jest sotalol również skutecznie stosowany w nad-
komorowych i komorowych zaburzeniach rytmu serca. Jednak nie ma wielu
badań nad zastosowaniem tego leku u kobiet w ciąży. Nie obserwowano te-
ratogennego działania na płód i do tej pory uważany jest za lek raczej bez-
pieczny. Jednak podobnie jak w przypadku innych beta-adrenolityków opisy-
wano zwolnienie czynności serca u płodów po jego zastosowaniu.
Pamiętajmy, że oba te leki powodują również wydłużenie odstępu QT
i rzadko mogą doprowadzić do częstoskurczu typu torsade de pointes.
Klasa IV leków antyarytmicznych
Werapamil jest lekiem często stosowanym w połączeniu z tokolizą, na
przykład fenoterolem, przy przedwczesnych skurczach macicy, jako lek prze-
ciwdziałający ubocznym objawom
β
2
-mimetyków między innymi zapobiega-
jąc częstym wówczas nadkomorowym zaburzeniom rytmu serca. Jest lekiem
często stosowanym do leczenia wszelkich typów tachyarytmii nadkomoro-
wych zarówno u matki, jak i u płodu. Na podstawie dotychczasowych do-
świadczeń uważa się, że werapamil jest lekiem bez działania teratogennego,
bezpiecznym oraz skutecznym w III trymestrze ciąży. Opisywane są jednak
przypadki bradykardii oraz bloków przedsionkowo-komorowych wywoływa-
nych przez ten lek u płodu, a także hipotonii u matki. W przypadku szybkie-
go podania dożylnego może działać silnie kardiodepresyjnie zarówno na
płód, jak i na matkę. Istotnym skutkiem ubocznym stosowania werapamilu
u kobiet w ciąży mogą okazać się uporczywe zaparcia.
Drugim lekiem z tej klasy jest diltiazem. Nie jest on polecany do leczenia
zaburzeń rytmu u ciężarnych. W badaniach na zwierzętach, w dużych daw-
kach powoduje uszkodzenia układu szkieletowego, obniża wagę płodów,
188

a w skrajnych przypadkach doprowadza do obumarcia ciąży. Może również
hamować skurcze macicy i powodować opóźnienie porodu.
Kardiowersja elektryczna
Kardiowersja elektryczna, zarówno planowa, jak i w stanach nagłych jest
uznana za bezpieczną metodę leczenia zaburzeń rytmu u kobiet ciężarnych
w każdym okresie ciąży. Stosowana jest zwłaszcza u tych kobiet w ciąży,
u których nawracające nadkomorowe zaburzenia rytmu serca, oporne na le-
czenie farmakologiczne, powodowały niewydolność serca lub spadek ciśnie-
nia tętniczego. Ryzyko wywołania wtórnych do kardiowersji zaburzeń rytmu
u płodu jest małe. Przede wszystkim energia dosięgająca płód jest niezwy-
kle mała, poza tym uważa się, że w życiu płodowym jest wysoki próg migota-
nia komór. Ponieważ jednak możliwy jest wpływ kardiowersji elektrycznej
matki na czynność serca płodu, zaleca się nadzorowanie tętna płodu pod-
czas tego zabiegu. Rytm zatokowy powinno się przywracać, rozpoczynając
od małych energii rzędu 50-100 J, natomiast potwierdzono bezpieczeństwo
nawet powtarzanych kardiowersji elektrycznych, nie przekraczających jed-
nak energii 400 J.
Wszczepienie układu stymulującego
Jest to leczenie z wyboru u kobiet ciężarnych z zespołem wydłużonego QT
i nawracającymi częstoskurczami komorowymi typu torsade de pointes, kiedy
zwykle wszczepiany jest kardiowerter-defibrylator. Innym wskazaniem do
stałej stymulacji niezależnie od okresu ciąży, są objawowe bradyarytmie.
Z drugiej strony zaś, już wcześniej wszczepiony stymulator czy kardiower-
ter-defibrylator nie stanowią przeciwwskazania do zajścia w ciążę.
Ablacja
Jest niewskazana u kobiet ciężarnych ze względu na konieczność narażenia
na promienie RTG. Zaleca się, aby u kobiet z zespołem WPW, nawet w przy-
padku rzadko występujących napadów arytmii, ablację wykonywać planowo
przed zajściem w ciążę. Przede wszystkim uchroni to pacjentki przed stosowa-
niem w czasie ciąży przewlekłego farmakologicznego leczenia antyarytmicz-
nego. Natomiast jeżeli u kobiety, która już jest w ciąży, pojawiły się napady
arytmii, ale są rzadko, trwają krótko i nie powodują istotnych zaburzeń hemo-
dynamicznych, ablację należy odłożyć na okres po porodzie. Opisywane są po-
jedyncze przypadki wykonywanej ablacji u kobiet ciężarnych, oczywiście ze
wskazań życiowych i przy ograniczonej ekspozycji na promienie RTG.
189

Inne zabiegi
Wśród innych metod niefarmakologicznych, przyczynowo leczących zabu-
rzenia rytmu serca, należy także wymienić zabiegi korygujące wady serca,
które wykonuje się czasem w trakcie trwania ciąży. Zabiegi te to coraz czę-
ściej stosowane różnego rodzaju manewry z użyciem cewników i balonów,
za pomocą których można rozszerzyć zwężone zastawki – mitralną lub aor-
talną oraz zamknąć ubytki w przegrodzie międzyprzedsionkowej.
Zapamiętaj!
1. W układzie krążenia kobiety ciężarnej zachodzi wiele zmian, które mogą
powodować lub potęgować już istniejące zaburzenia rytmu serca.
2. Łagodne nadkomorowe i komorowe zaburzenia rytmu serca, niepowodują-
ce zaburzeń hemodynamicznych, są opisywane u około połowy ciężarnych
i nie stanowią dla nich niebezpieczeństwa ani nie wymagają leczenia.
3. U kobiet ciężarnych należy przeprowadzić wnikliwą diagnostykę każdego
rodzaju zaburzeń rytmu serca, aby wykluczyć nie wykrytą dotąd chorobę
organiczną.
4. Leczenie farmakologiczne zaburzeń rytmu serca u kobiet w ciąży należy
stosować jedynie w przypadku umiarkowanych lub ciężkich zaburzeń rytmu
serca, z towarzyszącymi objawami hemodynamicznymi.
5. Większość leków antyarytmicznych w dużym stopniu przenika przez łożysko
do krążenia płodu.
Warto przeczytać:
B. Halawa: Leki antyarytmiczne stosowane u kobiet w ciąży. G. Świątecka:
Choroby serca u kobiet. Via Medica, Gdańsk 2000.
G. Świątecka: Zaburzenia rytmu serca i przewodzenia u kobiet w ciąży.
G. Świątecka: Choroby serca u kobiet. Via Medica, Gdańsk 2000.
ESC guidelines: Expert consensus document on managment of cardiovascu-
lar diseases during pregnancy. European Heart Journal 2003; 24: 761-781.
H.L. Tan, K.I. Lie: Treatment of tachyarrhythmias during pregnancy and lac-
tation. European Heart Journal 2001; 22: 458-464.
L.A. Saxon, J.K. Perloff: Arrhythmias and Conduction Disturbances Asso-
ciated with Pregnancy. P. J. Podrid, P. R. Kowey: Cardiac Arrhythmia. Me-
chanisms, Diagnosis, and Managment. Williams & Wilkins, Baltimore
1995.
190

XVIII. CHIRURGICZNE LECZENIE MIGOTANIA
PRZEDSIONKÓW
Piotr Suwalski, Franciszek Majstrak, Grzegorz Suwalski, Andrzej Kurowski,
Kazimierz B. Suwalski
WSTĘP
Operacyjne leczenie zaburzeń rytmu serca jest względnie nową metodą te-
rapeutyczną. Jest to dyscyplina wiedzy, która narodziła się w Klinice Uni-
wersyteckiej Duke w Północnej Karolinie w USA. Tam właśnie profesor Will
C. Sealy 28 maja 1968 r. w warunkach krążenia pozaustrojowego, wykorzy-
stując dostęp nasierdziowy, pomyślnie zlikwidował prawostronną dodatkową
drogę przewodzenia u chorego z zespołem preekscytacji.
Ta nowa dziedzina kardiochirurgii wyodrębniła się w samodzielny kieru-
nek – rytmologię kardiochirurgiczną.
Dzięki wdrożeniu do praktyki klinicznej elektrycznej stymulacji diagno-
stycznej serca oraz badania wsierdziowego i nasierdziowego rozprzestrze-
niania się pobudzeń w sercu rozwój tej dziedziny stał się bardzo dynamiczny.
Drugim nie mniej ważnym warunkiem pozwalającym na rozwiązanie wie-
lu problemów w chirurgicznej likwidacji zaburzeń rytmu było wdrożenie do
praktyki kardiochirurgicznej nowych metod niszczenia (ablacji) obszarów
arytmogennych i dodatkowych dróg przewodzenia, takich jak ultradźwięko-
we niszczenie tkanek, kriodestrukcja, fulguracja, fotokoagulacja laserowa,
ablacja za pomocą prądów wysokiej częstotliwości (radiofrequency), ablacja
chemiczna i inne.
Również postęp w zrozumieniu mechanizmów powstawania arytmii inspi-
rował szybki rozwój operacyjnych metod leczenia zaburzeń rytmu.
Dla całego burzliwego rozwoju duże znaczenie miała mała skuteczność
farmakoterapii, nie zawsze dobre wyniki leczenia za pomocą elektrostymu-
lacji i defibrylacji, liczne przypadki nagłej śmierci sercowej.
Nie bez znaczenia jest również aspekt ekonomiczny. Wieloletnie i coraz
częstsze napady zaburzeń rytmu serca stopniowo uzależniają często młodych
poza tym zdrowych ludzi od pomocy lekarza, powodując konieczność hospi-
talizacji i w rezultacie prowadzą do inwalidztwa. W przypadku radykalnego
wyleczenia prawidłowo funkcjonowaliby w społeczeństwie.
Wszystko to pozwala na zrozumienie, dlaczego tak znaczny wysiłek był po-
dejmowany w celu rozwoju radykalnych chirurgicznych metod leczenia.
191

Przez wiele lat w wielu krajach na całym świecie leczenie chirurgiczne ze-
społu WPW zyskało tak ważne miejsce, że chirurdzy uznali je za „chorobę
chirurgiczną”. Znaczenie WPW dla rozwoju chirurgii zaburzeń rytmu było
ogromne. Po raz pierwszy przyporządkowano konkretny substrat konkret-
nej arytmii i substrat ten był możliwy do zniszczenia.
Tymczasem z drugiej strony, obawa przed operacją na otwartym sercu sil-
nie stymulowała poszukiwania mniej obciążającej, a przy tym również sku-
tecznej metody. Przypadek sprawił, że w 1979 roku, w czasie inwazyjnego
badania elektrofizjologicznego, zwarcie elektrody defibrylatora z cewnikiem
umieszczonym we wnętrzu serca wywołało całkowity blok przedsionkowo-
-komorowy. To pechowe wyładowanie pokazało jednak, że można modyfi-
kować właściwości elektryczne fragmentów serca za pośrednictwem cewni-
ków umieszczonych w jego jamach pod kontrolą rentgenoskopii. Tak
narodziła się potężna konkurencja kardiochirurgii (w dziedzinie zaburzeń
rytmu) – przeznaczyniowa ablacja, która obecnie jest metodą bezpieczną,
skuteczną i umożliwia szybki powrót pacjentów do normalnego życia. Jed-
nakże do dzisiaj nie zostały do końca uściślone wskazania do stosowania po-
szczególnych chirurgicznych sposobów leczenia zaburzeń rytmu serca na
podstawie oceny odległych rezultatów leczenia.
Jeżeli chodzi o techniki ablacji przeznaczyniowej, to pomimo ich coraz
szerszego stosowania nie są znane wyniki odległe aplikacji prądów wysokich
częstotliwości oraz skutki długotrwałej ekspozycji na promieniowanie rent-
genowskie. Opracowanie prostych, optymalnych i jednocześnie mało urazo-
wych sposobów radykalnego leczenia zaburzeń rytmu serca stanowi nadal
problem. Dalsze badania pozwalają zmniejszyć liczbę niezadowalających wy-
ników i śmiertelność. Szersze wdrożenie tego postępowania do praktyki kli-
nicznej pozwoli na skuteczniejsze leczenie.
RYS HISTORYCZNY
Migotanie przedsionków (atrial fibrillation, AF) należy do pierwszej po-
znanej tachyarytmii i w związku z tym często zwane jest dziadkiem arytmii
serca. W XVIII wieku pojawiły się opisy nieregularnego pulsu u pacjentów,
a opisywany obraz kliniczny mógłby odpowiadać wadzie mitralnej. Używano
wtedy bardzo sugestywnie brzmiącej terminologii: pulsus irregularis perpetu-
us lub po prostu delirium cordis.
Pod koniec XIX wieku i na początku XX wieku dwaj badacze Wenckebach
i Mackenzi zajęli się problemem nieregularnego pulsu. Obaj naukowcy, nie-
zależnie od siebie uważali, że nieregularny puls jest objawem porażenia
192

przedsionków, a następnie uznano, że jest to wynik równoczesnego pobu-
dzenia przedsionków i komór, aż w końcu wreszcie przyjęto obserwowane
zjawisko jako rezultat migotania przedsionków.
Pierwsze opisy kliniczno-elektrokardiograficzne pochodzą od Rothberge-
ra, Winterberga i Lewisa, a datowane są na pierwsze lata XX wieku.
Szczególny hołd należy się temu ostatniemu, Lewis bowiem powiązał oscy-
lacje linii izoelektrycznej elektrokardiogramu zapisanego wcześniej przez
Einthovena z migotaniem przedsionków, przeprowadził eksperymenty na
zwierzętach wskazując na zaburzenia hemodynamiczne w wyniku migotania
przedsionków, był również pierwszym badaczem, który obejrzał „migoczą-
ce” przedsionki po otwarciu klatki piersiowej u konia, po wcześniejszym roz-
poznaniu klinicznym.
Spośród wielu współczesnych badaczy należy przede wszystkim wymienić
Pedro Brugadę, który przedstawił pierwsze prace w roku 1926, następnie
G. K. Moe, który w 1962 roku podał za obowiązującą do dzisiaj koncepcję
mechanizmu migotania przedsionków jako jednoczesnego wystąpienia kil-
ku ognisk re-entry szerzących aktywację w obrębie przedsionków.
EPIDEMIOLOGIA
Migotanie przedsionków jest powikłaniem wielu patologii organizmu ludz-
kiego i najczęstszą tachyarytmią przedsionkową oraz trzecią pod względem
częstości arytmią serca po przedwczesnych pobudzeniach nadkomorowych
i komorowych. Ponad 30% wszystkich chorych hospitalizowanych z powodu
zaburzeń rytmu serca stanowią chorzy z migotaniem przedsionków.
Ogólna częstość występowania w niewyselekcjonowanej populacji doro-
słych wynosi 0,5-2% i powiększa się z wiekiem. W przedziale wieku od 60 do
64 lat wynosi ok. 3% i aż do 12% po 75. roku życia. W innym badaniu obej-
mującym wyselekcjonowaną populację osób z chorobą niedokrwienną
występuje u 5% badanych w przedziale wieku 62-90 lat.
Częstość AF wzrasta wraz z wiekiem i występuje częściej u mężczyzn niż
u kobiet, wg Lake i wsp., u osób powyżej 75. roku wynosi 11,6%, dlatego też
często nazywane jest arytmią dziadków (arrhythmia of grandfathers). U cho-
rych z wadą mitralną AF występuje u 79%. W przeszłości choroba reuma-
tyczna stanowiła główną przyczynę migotania przedsionków.
Przyczyną tak częstego występowania tej arytmii są liczne patologie orga-
nizmu ludzkiego. Przyczyny dzielimy na sercowe i pozasercowe. Do tych
pierwszych zaliczamy chorobę niedokrwienną serca, nadciśnienie tętnicze,
193

niewydolność krążenia, kardiomiopatie, wady zastawkowe, ASD, zespół
WPW, chorobę węzła zatokowego, wypadanie płatka zastawki mitralnej. Do
przyczyn pozasercowych zaliczyć należy nadczynność tarczycy, choroby płuc,
spożywanie alkoholu, zaburzenia elektrolitowe, uraz, stres lub emocje.
Evans i Swann w 1954 roku wprowadzili termin „izolowanego” (samoist-
nego) migotania przedsionków (alone atrial fibrillation), w którym nie moż-
na znaleźć jego przyczyny.
Ze względu na swą „nieuporządkowaną” naturę i mnogość przyczyn, AF
stanowi poważny problem terapeutyczny dla współczesnej kardiologii.
OBJAWY I KONSEKWENCJE KLINICZNE
Migotanie przedsionków powoduje nieregularną czynność komór, która
odczuwana przez chorego w znacznym stopniu upośledza jego komfort ży-
cia. Objawy mogą być bardzo różne, od braku poczucia obecności arytmii
do bardzo przykrych objawów subiektywnych, związanych z przyśpieszonym
rytmem komór. Brak czynności skurczowej przedsionków oraz nieregular-
ność skurczów komór pogarsza hemodynamiczne warunki pracy serca.
Zmniejszenie objętości wyrzutowej i minutowej serca może prowadzić do
ujawnienia lub nasilenia niewydolności serca i zmniejszenia tolerancji wysił-
ku. Z kolei długotrwale utrzymująca się tachykardia może być przyczyną
kardiomiopatii rozstrzeniowej.
Budowa anatomiczna przedsionków w połączeniu ze zwolnionym przepły-
wem w trakcie napadu ich migotania, sprzyja powstawaniu skrzeplin, które
mogą być materiałem zatorowym, szczególnie w momencie powrotu rytmu
zatokowego. U osób z chorobą układu krążenia obecność migotania przed-
sionków jest związana z 2-krotnie większą śmiertelnością.
BUDOWA ANATOMICZNA
Anatomia czynnościowa przedsionków odgrywa rolę w fizjologii serca po-
przez modulację jego rytmu, napełnienia komór i kurczliwości mięśnia.
Przedsionki są to dwa zbiorniki na drodze pomiędzy spływem żylnym
a ujściem przedsionkowo-komorowym. Prawy przedsionek jest większy od
lewego (pojemność około 60 ml). Grubość jego ścian (około 2 mm) jest
mniejsza niż lewego (3 mm). Prawy przedsionek tworzą zatoka żylna oraz
korpus. Zatoka żylna stanowi wydłużoną część prawego przedsionka i jest
położona pomiędzy górną a dolną żyłą główną. Ma kształt cylindra, który
szeroko otwiera się do korpusu prawego przedsionka. Otwarcie to jest oto-
194

czone następującymi strukturami: pęczek mięśnia granicznego, mięśniowy
pęczek przedżylny leżący do przodu od żyły głównej dolnej, zastawka Eu-
stachiusza leżąca do przodu od ujścia żyły głównej dolnej oraz przez guz
Lowera. Przegrodową częścią zatoki żylnej jest dół owalny. Korpusem
przedsionka jest zbiornik oddzielający zatokę żylną od ujścia zastawki trój-
dzielnej. Ma on trzy zachyłki: uszko prawego przedsionka zachodzące od
góry na aortę oraz dwa uszka dolne. Ścianę boczną tworzy mięsień grze-
bieniasty. Ściana dolna otwiera się do zatoki wieńcowej oraz do dolnych
uszek. Przegrodowa część korpusu leży od przodu od guza Lowera. Przy-
krywa ona górną część lewej komory. Lewy przedsionek jest prostszym
i mniejszym zbiornikiem o grubszych ścianach. Napływ żylny otwiera się
bocznie i od góry. Wewnętrzna powierzchnia lewego przedsionka jest gład-
ka. Uszko prawego przedsionka jest prawdziwym zachyłkiem posiadają-
cym wąskie ujście.
Przegrodę międzyprzedsionkową tworzy właściwie dół owalny otoczony
brzegiem mięśniowym (limbus fossae ovalis).
W dnie przegrody leży węzeł przedsionkowo-komorowy.
FUNKCJA HEMODYNAMICZNA
Prawo Franka-Starlinga opisuje hemodynamiczne funkcje serca. Traktuje
ono o relacji zachodzącej pomiędzy objętością krwi w komorze w momencie
rozpoczęcia skurczu (objętość końcoworozkurczową) a ciśnieniem skurczo-
wym rozwijanym przez komorę. Relacja ta została po raz pierwszy opisana
przez Franka w 1895 roku, a następnie udokumentowana na sercu przez
Starlinga w 1914 roku.
Jeżeli siła skurczu mięśniówki komory zależna jest od jej wypełnienia,
zatem wszystkie czynniki wpływające na wypełnienie komory będę wpły-
wały także na objętość wyrzutową serca. Spośród wielu takich czynni-
ków, funkcja transportowa przedsionków zajmuje zdecydowanie czoło-
we miejsce. Rzut serca zależy od ciśnienia w prawym przedsionku.
Jednak u ludzi zdrowych ciśnienie w prawym przedsionku jest bardzo
niskie i trudno sobie uświadomić, jak niewielkie wahania ciśnienia
w prawym przedsionku mogą znacząco wpływać na zwiększanie bądź
zmniejszanie rzutu serca.
Funkcja hemodynamiczna przedsionków opiera się bowiem głównie na
ich funkcji transportowej. W omawianej przez nas patologii – migotaniu
przedsionków – funkcja ta ulega znaczącej redukcji. Brak efektywnego
skurczu przedsionków wpływa ujemnie na końcoworozkurczowe wypeł-
195

nienie komór serca, a co za tym idzie, napięcie ściany komory ulega
zmniejszeniu. Zatem zgodnie z prawem Franka-Starlinga rzut serca jest
mniejszy.
Prawo to odnosi się do modelu statycznego i nie uwzględnia interakcji kur-
czowo-rozkurczowej, dynamiki i obciążeń serca oraz mechaniki klatki pier-
siowej. Prawo Franka-Starlinga nie uwzględnia również wpływu szybkości
pracy serca na jego rzut. Powyższe rozważania nie wyczerpują wszystkich za-
gadnień mających wpływ na rzut serca. Omówiono pokrótce tylko te, które
związane są z funkcją przedsionków.
PRZEDSIONKI JAKO ROZRUSZNIK
Funkcja chronotropowa jest najważniejszym czynnikiem dostosowującym
rzut serca do potrzeb organizmu. Jest to niewątpliwie najważniejsza funkcja
przedsionków.
Funkcja hemodynamiczna przedsionków zależy w dużej mierze od ich syn-
chronizacji ze skurczem komór. Zostało to udokumentowane na podstawie
badań chorych z wydłużonym odcinkiem P-R po elektrofizjologicznym le-
czeniu częstoskurczu węzłowego. Brak synchronizacji utrudnia napływ żylny
i powoduje dolegliwości.
TWORZENIE SIĘ SKRZEPLIN
Skrzepliny w zdrowym sercu nie powstają. Krew jest w ciągłym ruchu,
a śródbłonek pełni swoją rolę. Nie ma zastoju krwi w jamach serca. Dotyczy
to również uszek, które napełniają się i opróżniają systematycznie. Ostatnie
badania dowodzą, że kurczliwość i wielkość przedsionków odgrywa decydu-
jącą rolę w tworzeniu się skrzeplin, przy czym większość z nich powstaje
w uszku lewego przedsionka.
MECHANIZMY MIGOTANIA PRZEDSIONKÓW
Elektrokardiograficznie migotanie przedsionków charakteryzuje się
chaotycznymi licznymi pobudzeniami. Garrey udowodnił, że do podtrzyma-
nia migotania przedsionków potrzebna jest odpowiednia masa ich miokar-
dium. Moe na podstawie komputerowego modelu migotania przedsion-
ków stwierdził, że jest ono związane z licznymi „falkami” elektrycznymi
rozchodzącymi się w różnych kierunkach. Pobudzenia te są różnej wiel-
kości, kształtu, mogą się rozdzielać, łączyć oraz wzajemnie wzmacniać
lub wygaszać.
196
Trwanie migotania przedsionków wymaga obecności tych pobudzeń w nie-
jednorodnej pod względem czasu refrakcji i szybkości przewodzenia tkance
przedsionków.
Migotanie przedsionków charakteryzuje się następującymi cechami elek-
trofizjologicznymi:
CEL CHIRURGICZNEGO LECZENIA
Cel chirurgicznego leczenia migotania przedsionków wynika bezpośred-
nio z fizjologii serca. Operacja ma na celu przywrócenie miarowej pracy
serca oraz transportowej funkcji przedsionków. Wykonanie licznych cięć
• pobudzenia są typu przedsionkowego – wędrujące po całym przed-
sionku;
• mogą powstawać pobudzenia krążące, np. wokół ujść żył płucnych;
• fronty pobudzenia mogą być szerokie lub wąskie;
• szybkość przewodzenia od 15 do 100 cm/s;
• krytyczna liczba fal – od 4 do 6;
• migotanie przedsionków jest podtrzymywane poprzez liczne pętle
macro-re-entry, które samopodtrzymują się w mięśniu przedsionków.
Rycina 1. Schemat powstawania migotania przedsionków
197

tworzących „labirynt” uniemożliwia zaistnienie fal re-entry, dla powstania
których konieczny jest określony obszar mięśnia przedsionka. Ma ona
również na celu zachowanie czynności węzła zatokowo-przedsionkowego,
jak i zsynchronizowanej czynności elektrycznej i hemodynamicznej przed-
sionków.
WSKAZANIA DO LECZENIA OPERACYJNEGO
Najważniejszym wskazaniem do leczenia operacyjnego jest nieskuteczność
leczenia farmakologicznego. Nietolerancja arytmii przez chorego jest rów-
nież jednym z ważniejszych wskazań do leczenia chirurgicznego. Z wielu po-
wodów, chorzy z napadowym migotaniem przedsionków mają więcej dolegli-
wości niż chorzy z utrwalonym migotaniem przedsionków. Trudniej jest im
zaakceptować fakt, iż muszą żyć z nawracającą chorobą, której nie mogą wy-
leczyć ani zapobiec jej nawrotom.
Lepiej zaadaptowani do nierównej pracy serca są chorzy z utrwalonym mi-
gotaniem przedsionków. Ale oni również skarżą się na uczucie szybkiego bi-
cia serca, kołatania serca, duszność, łatwe męczenie się. Boją się również po-
wikłań zatorowych.
Wskazaniem do leczenia operacyjnego jest również współistnienie chorób
serca, takich jak wady zastawkowe, wady wrodzone, choroba wieńcowa oraz
współistniejące migotanie przedsionków. Reasumując, wskazaniem do le-
czenia operacyjnego migotania przedsionków jest:
PRZECIWWSKAZANIA DO LECZENIA OPERACYJNEGO
Szereg badań i obserwacji klinicznych potwierdziło, iż chirurgiczne lecze-
nie migotania przedsionków jest metodą bezpieczną. Obecnie nie ma bez-
względnych przeciwwskazań dla zastosowania postępowania kardiochirur-
gicznego. Należy jednak brać pod uwagę czynniki zwiększające ryzyko
zabiegu operacyjnego oraz wpływające negatywnie na skuteczność leczenia
antyarytmicznego. Są to między innymi:
• nieskuteczność leczenia farmakologicznego;
• zła tolerancja leków antyarytmicznych;
• przebyte w przeszłości epizody zatorowe;
• współistnienie innych „chirurgicznych” chorób serca, wymagających
leczenia operacyjnego.
198

Chorzy operowani ze złą funkcją lewej komory należą do grupy wysokiego
ryzyka operacyjnego. Często przebieg pooperacyjny tych pacjentów wiąże
się z koniecznością zastosowania dużych dawek katecholamin, technik re-
dukujących pracę serca – kontrapulsacji wewnątrzaortalnej czy nawet syste-
mów mechanicznego wspomagania serca (sztuczne komory itp.). Chorzy zo-
perowani z chorobą węzła zatokowego wymagają natomiast od razu
wszczepienia układu stymulującego.
METODY LECZENIA
Ponieważ od dawna wiadomo, że leczenie farmakologiczne często jest nie-
skuteczne bądź też źle tolerowane przez chorego, opracowano chirurgiczne
metody przywrócenia rytmu zatokowego. Opierają się one na koncepcji wy-
tworzenia nowej drogi rozprzestrzeniania się impulsów elektrycznych. Prze-
cinając, a następnie zeszywając ścianę przedsionka nie zmienia się ich struk-
tury anatomicznej, natomiast tworzy się bariery elektryczne, ponieważ
impulsy elektryczne nie przewodzą się w obrębie blizny pooperacyjnej.
W miejscach szczególnych (ujścia zastawek mitralnej i trójdzielnej, okoli-
ce zatoki wieńcowej) stosujemy krioablację mięśniówki przedsionka. Obec-
nie stosuje się następujące metody leczenia AF:
IZOLACJA PRZEDSIONKÓW
Idea izolacji przedsionków opiera się na kilku założeniach. Po pierwsze,
należy odnotować, iż wyniki kolejnych badań coraz wyraźniej wskazują, że
zwiększone prawdopodobieństwo pojawienia się i nawrotów AF związane
• izolacja przedsionków;
• izolacja prawego przedsionka;
• izolacja lewego przedsionka;
• wytworzenie korytarza (corridor procedure);
• labirynt (MAZE);
• różne modyfikacje „labiryntu” z zastosowaniem nowych źródeł ener-
gii (niskie temperatury, mikrofale, laser, fale o częstości radiowej).
• zła funkcja lewej komory;
• choroba węzła zatokowego.
199

jest z powiększeniem się wymiarów przedsionków. Zjawiska te nasilane są
przez patologie, takie jak ASD (atrial septal defect) w przypadku prawego
przedsionka czy choroba mitralna, po stronie lewej. Kolejnym zaobserwo-
wanym zjawiskiem jest fakt korzystnego wpływu osiągnięcia rytmu zatokowego
choćby w jednym przedsionku na umiarowienie rytmu komór oraz poprawę
ich wypełnienia, dzięki częściowemu przywróceniu funkcji hemodynamicznej
przedsionków. Zachęcająca wreszcie jest możliwość powrotu funkcji węzła
zatokowo-przedsionkowego, nawet po wielu latach trwania utrwalonego mi-
gotania przedsionków. Izolacja przedsionków powinna obniżyć szansę na-
wrotów AF poprzez redukcję zaangażowanej w tę patologię ściany przed-
sionka.
IZOLACJA PRAWEGO PRZEDSIONKA
Technika ta ma na celu izolację powiększonego uszka prawego przedsion-
ka, jak ma to miejsce w przypadku przetrwałego otworu międzyprzedsion-
kowego. Procedura może być wykonywana jednoczasowo z zamknięciem
ASD, zarówno na „stojącym” sercu, jak i po zdjęciu klemu z aorty.
Prawy przedsionek zostaje otwarty przez cięcie zaczynające się na grzebie-
niu granicznym, około 2 cm od połączenia przedsionka z żyłą główną górną,
w celu uniknięcia uszkodzenia obszaru węzła zatokowo-przedsionkowego.
Ku tyłowi, kieruje się ono blisko tylnej części przegrody międzyprzedsion-
kowej, przechodzi na prawo od ujścia zatoki wieńcowej i kończy się 1 cm od
pierścienia zastawki trójdzielnej. Ku przodowi przebiega w stronę przyśrod-
kowej powierzchni uszka prawego przedsionka, a dalej w kierunku przed-
niej części pierścienia zastawki trójdzielnej, w bezpośrednim sąsiedztwie
przegrody błoniastej. Nie wykonuje się prób zachowania ewentualnych tęt-
nic zaopatrujących węzeł zatokowo-przedsionkowy. Kolejnym krokiem jest
wykonanie dwóch linii kriodestrukcji temperaturą -60°C, umiejscowionych
w odcinkach między pierścieniem zastawki trójdzielnej a cięciami prawego
przedsionka.
Wyżej opisaną operację wykonywano jednoczasowo z zamknięciem ASD
typu ostium primum, ostium secundum, a także plastyką zastawki trójdzielnej
bądź mitralnej.
IZOLACJA LEWEGO PRZEDSIONKA
W wadach zastawki mitralnej przerośnięty i rozszerzony lewy przedsionek
jest głównym anatomicznym obszarem powstawania pętli re-entry. Ideą izo-
lacji lewego przedsionka jest przerwanie elektrofizjologicznego przewodze-
200
nia między przedsionkami. Umożliwia to zawężenie obszaru migotania do
powiększonego lewego przedsionka, a co za tym idzie uchronienie prawego,
prawidłowego przedsionka przed wpływem tej arytmii. Ważną konsekwencją
zabiegu jest umożliwienie powrotu funkcji węzła zatokowo-przedsionkowe-
go i hemodynamicznej funkcji przedsionka.
W uproszczeniu technika izolacji lewego przedsionka polega na typowym
nacięciu okołoprzegrodowym, następnie przedłużonym ku przodowi do
uszka lewego przedsionka, ku tyłowi zaś – w stronę spoidła tylnego. W celu
przerwania przewodzenia w okolicy pierścienia zastawki, na przedłużeniu
obu końców cięcia stosuje się krioablację. Czas zaklemowania aorty może być
zredukowany dzięki zastosowaniu dwóch krioaplikatorów oraz jednoczesne-
mu wykonywaniu krioablacji z plastyką bądź wymianą zastawki mitralnej.
WYTWORZENIE KORYTARZA (CORRIDOR PROCEDURE)
W 1985 roku Guiraudon opisał operację metodą korytarza jako zabieg le-
czenia migotania przedsionków. Technika ta ma na celu chirurgiczną izolację
paska mięśniówki przedsionka łączącej węzeł zatokowo-przedsionkowy
z węzłem przedsionkowo-komorowym, a zatem umożliwienie progresji po-
budzenia przez tak wytworzony „korytarz” do komór. Zabieg operacyjny po-
legający na podkowiastym nacięciu kończącym się z obu stron odpowiednio
na zastawce mitralnej i trójdzielnej wykonuje się najpierw w ścianie lewego,
a następnie prawego przedsionka. Bezpośrednio w okolicy pierścieni zasta-
wek nóż chirurga zastępuje się krioaplikatorem, mrożąc tkankę w tempera-
turze -180° C przez 2 minuty.
Rycina 2. Wytworzony chirurgicznie korytarz (corridor) między węzłem
zatokowo-przedsionkowym i przedsionkowo-komorowym
201

Metoda korytarza jest skuteczna u około 85% leczonych w obserwacji 3-let-
niej, w zależności od doświadczenia ośrodka. W okresie od 2 do 4 lat po zabie-
gu u 20-35% operowanych rozwija się niewydolność węzła zatokowego, co
powoduje konieczność wszczepienia stymulatora.
Opisywana operacja usuwa tylko jeden z trzech podstawowych efektów
migotania przedsionków, jakimi są niemiarowość rytmu, upośledzona he-
modynamika i zagrożenie powikłaniami zakrzepowo-zatorowymi. Ponieważ
zarówno prawy, jak i lewy przedsionek nie kurczą się synchronicznie z ko-
morami, efekt hemodynamiczny w postaci „doładowania objętościowego ko-
mór” nie jest przywrócony. Z kolei pozostawienie swobodnie migoczących
przedsionków nie likwiduje ryzyka tworzenia się skrzeplin i wystąpienia zato-
rowości.
Tak więc, metoda korytarza nie przedstawia sobą rozwiązania bardziej ko-
rzystnego niż ablacja łącza przedsionkowo-komorowego wraz ze wszczepie-
niem stymulatora, przy czym ta ostatnia może być wykonana bez otwierania
klatki piersiowej. Co więcej, są dowody że technika ta uszkadza unaczynienie
węzła zatokowo-przedsionkowego, powodując jego niewydolność.
LABIRYNT (MAZE)
W toku przeprowadzanych badań eksperymentalnych i obserwacji klinicz-
nych okazało się, że jedyną drogą chirurgicznego leczenia migotania przed-
sionków jest wytworzenie pasma mięśniówki przedsionka, wzdłuż którego
następowałoby przewodzenie impulsów z węzła zatokowo-przedsionkowego
do węzła przedsionkowo-komorowego. Jednak to nie wszystko. Stało się
oczywiste, że aby wyeliminować problem powikłań zatorowo-zakrzepowych
oraz uzyskać prawidłową funkcję hemodynamiczną, konieczne jest pobudze-
nie całego mięśnia przedsionka przez węzeł zatokowo-przedsionkowy. Je-
dynym rozwiązaniem wydawało się chirurgiczne wytworzenie „ślepych zauł-
ków” przewodzących pobudzenie również do tych części przedsionka, które
leżały poza wspomnianym pasmem mięśniówki łączącym oba węzły. Stwo-
rzono teorię labiryntu dróg przewodzenia obejmującego swym obszarem ca-
łą powierzchnię przedsionków, do którego dostać się można było jedynie po-
przez węzeł zatokowo-przedsionkowy. Jak na prawdziwy labirynt przystało,
prowadziło z niego tylko jedno wyjście, a mianowicie węzeł przedsionkowo-
-komorowy. Wkrótce teorię udało się wcielić w życie i stworzono procedurę
chirurgiczną nazwaną „labiryntem” (MAZE procedure).
Zabieg „labiryntu” po raz pierwszy wykonał J. Cox w 1987 roku. W ciągu
kilku następnych lat procedura ta przeszła kilka modyfikacji dotyczących linii
cięć. Obecnie za ogólnie przyjętą uważa się modyfikację trzecią (MAZE III).
202
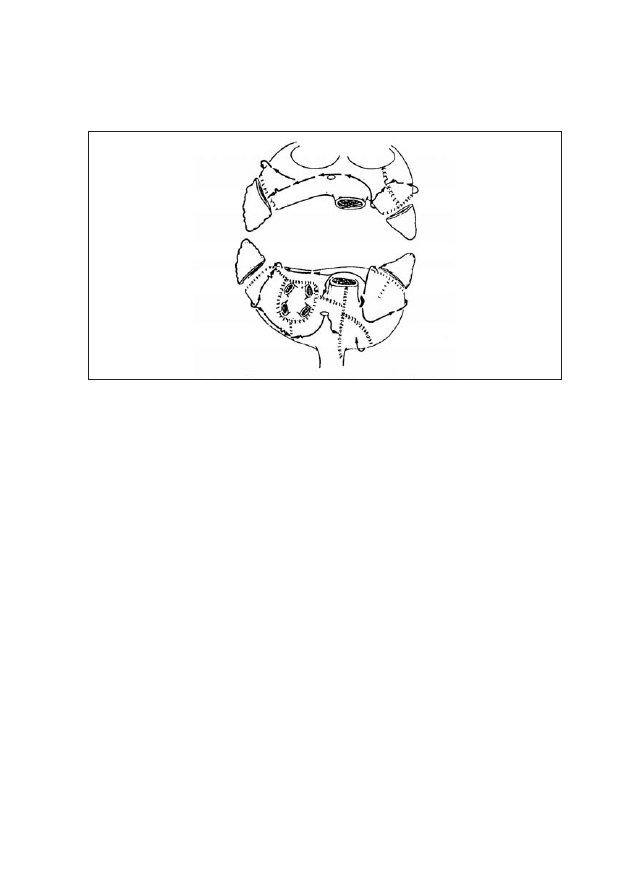
Polega ona na chirurgicznym wytworzeniu ślepo zakończonych pasm mię-
śniówki przedsionków, izolacji żył płucnych, amputacji obu uszek oraz ra-
dialnych nacięć wzdłuż żyły głównej górnej i żyły głównej dolnej.
Zatem procedura „labiryntu” umożliwia propagację fizjologicznego pobu-
dzenia z węzła zatokowo-przedsionkowego do węzła przedsionkowo-komo-
rowego, przy jednoczesnym pobudzeniu całej mięśniówki przedsionków
z wyłączeniem usuniętych uszek oraz odizolowanych żył płucnych. Co istot-
ne, niemożliwe jest powstawanie pętli macro-re-entry, ponieważ impulsy nie
mogą się nakładać na siebie ze względu na okres refrakcji właśnie zdepola-
ryzowanej tkanki. Tak więc, technika ta wyklucza powstanie i podtrzymywa-
nie migotania przedsionków bez względu na ilość pętli macro-re-entry odpo-
wiedzialnych za to zjawisko.
Dzięki wspomnianym modyfikacjom uniknięto częstego, jak się wydaje,
przecięcia tętnicy zaopatrującej węzeł zatokowo-przedsionkowy i uszkodze-
nia części tej struktury znajdującej się w okolicy ujścia żyły głównej górnej
do prawego przedsionka. Dzięki skróceniu czasu zaklemowania aorty „labi-
rynt” wykonywany jest obecnie w zasadzie tylko jako procedura towarzyszą-
ca innym zabiegom kardiochirurgicznym, wymianie lub plastyce zastawki mi-
tralnej czy trójdzielnej, plastyce ubytku przegrody międzyprzedsionkowej,
rewaskularyzacji mięśnia sercowego.
Mimo że operacja MAZE III została powszechnie zaaprobowana jako
standard w chirurgicznym leczeniu migotania przedsionków, ma ona swoje
ujemne strony, do których należy z pewnością zaliczyć wysoki stopień trud-
Rycina 3. Wytworzony chirurgicznie korytarz (MAZE). Linią przerywaną oznaczone cięcia
chirurgiczne
203

ności z punktu widzenia techniki, a co za tym idzie czasochłonność zabiegu.
Wciąż znaczna część pacjentów wymaga po operacji stałej stymulacji serca
(około 25% w zależności od autora). Ponadto skuteczność operacji jest sto-
sunkowo słabo poznana u osób z migotaniem przedsionków o charakterze
napadowym. Zwłaszcza wspomniany znacznie wydłużony czas zaklemowa-
nia aorty spędza sen z powiek zwolenników tej metody, będąc bardzo wy-
godnym argumentem w rękach jej przeciwników.
Intensywne poszukiwania podążają w kierunku zastosowania nowych źró-
deł energii, które pozwalałyby modelować elektrofizjologiczną całość przed-
sionków podobnie, jak w sposobie „klasycznym” robi to nóż chirurga, lecz
znacznie szybciej. Stąd też próby z aplikacją niskich temperatur, mikrofal
czy fal o częstotliwości radiowej oraz z wykorzystaniem lasera. Kolejnym kie-
runkiem prób jest zmiana kształtu linii nacięć w obrębie przedsionków. Mo-
że to odbywać się poprzez ograniczenie liczby cięć bądź też kreując ich zu-
pełnie nowy kształt. Na koniec należy wspomnieć, że zabiegowe leczenie
migotania przedsionków stało się również punktem zainteresowania kardio-
logii interwencyjnej.
NOWE STRATEGIE POSTĘPOWANIA
Ostatnia dekada to czas szybkiej ewolucji nowych metod kardiochirurgicz-
nych, które istotnie poprawiły wyniki zarówno wczesne, jak i odległe, ograni-
czyły uraz chirurgiczny i ryzyko operacyjne.
Podstawy nowych koncepcji czerpią z obserwacji nad patofizjologią migo-
tania przedsionków. Coraz silniej badacze skupiają się nad rolą tkanek żył
płucnych. Ablacja ujścia żył płucnych powoduje izolację elektryczną obsza-
rów o częstym występowaniu ognisk arytmogennych, odpowiedzialnych za
inicjację oraz perpetuację migotania przedsionków.
Ograniczenie linii ablacyjnych do lewego przedsionka ma swoje uzasad-
nienie w ostatnich badaniach klinicznych i eksperymentalnych. Najkrótsze
pętle migotania przedsionków znajdują się na tylnej ścianie lewego przed-
sionka, co potwierdzono w badaniach śródoperacyjnych. Również w leczeniu
przewlekłego migotania przedsionków ablacja w obrębie lewego przedsion-
ka jest skuteczna.
Niesłychanie dynamicznie prowadzone są obecnie prace nad możliwością
zastosowania różnych źródeł energii, którą kardiochirurdzy posługują się dla
wykonywania ablacji arytmogennych obszarów przedsionków. Możliwe jest
wykorzystanie niskich i wysokich temperatur generowanych szeregiem co-
raz to nowszych aparatur.
204
Szczególne miejsce zajmuje technika krioablacji z zastosowaniem ciekłego
azotu, jako źródła niskiej temperatury, oraz specjalnych krioaplikatorów
(ryc. 4). Na zdjęciu w rękach prof. Suwalskiego widoczne są krioaplikatory
różnych kształtów umożliwiające wykonanie precyzyjnych linii ablacyjnych.
Dzisiaj stosowaną metodą kilku ośrodków kardiochirurgicznych jest prze-
prowadzanie krioablacji endokardialnej, np. w trakcie plastyki lub wymiany
zastawek serca. Postępowanie to wymaga uprzedniego zastosowania krążenia
pozaustrojowego, zatrzymania akcji serca i otwarcia lewego przedsionka. Jed-
nak istnieje grupa chorych z migotaniem przedsionków i chorobą wieńcową,
zakwalifikowanych do operacyjnego pomostowania tętnic wieńcowych (coro-
nary artery bypass grafting, CABG). Dzięki postępowi kardiochirurgii ostatnich
lat duża część zabiegów CABG może być wykonana na bijącym sercu – bez
konieczności stosowania krążenia zewnątrzustrojowego (off-pump coronary ar-
tery bypass, OPCAB). Tym chorym możemy zaproponować leczenie migota-
nia przedsionków techniką krioablacji epikardialnej, uzyskując pełnościenną
izolację obszarów arytmogenych bez otwarcia serca, a charakter zmian histo-
logicznych wywołanych przez niską temperaturę jest szczególnie korzystny.
Kolejnym źródłem energii ablacji jest prąd wysokiej częstotliwości (radio-
frequency ablation, RF). Operację antyarytmiczną za pomocą RF wykonuje
się elektrodą, kreśląc linie izolacji na ścianie przedsionka (ryc. 5).
Rycina 4. Prof. Suwalski trzyma w ręku zestaw krioaplikatorów - zabieg chirurgicznego
leczenia migotania przedsionków z zastosowaniem niskich temperatur
205
Innymi energiami budzącymi szerokie zainteresowanie są mikrofale oraz
energia laserowa. Jednak precyzyjne wskazania do zastosowania wyżej wy-
mienionych metod wciąż są przedmiotem szeregu badań i dyskusji.
PODSUMOWANIE
Podsumowując, należy podkreślić, że migotanie przedsionków występuje
aż u 0,5-2% populacji. Niemiarowość, upośledzona funkcja hemodynamicz-
na serca, a przede wszystkim powikłania zakrzepowo-zatorowe stanowią bar-
dzo poważne ryzyko dla chorych. Niestety, metody zachowawcze, jeśli nawet
skuteczne, ukierunkowane są na zwalczanie tylko jednego z wymienionych
zagrożeń, a mianowicie odpowiedzi komór na migotanie przedsionków.
Z tego też powodu w ciągu ostatnich lat burzliwie rozwija się gałąź kardio-
chirurgii zajmująca się leczeniem tej arytmii. Wiele z wynalezionych metod,
Rycina 5. Ablacja prądem o częstotliwości radiowej (wg Medtronic)
206

jak na przykład izolacja lewego przedsionka czy wytworzenie korytarza od-
chodzi, a w ich miejsce pojawiają się nowe. W 1987 roku J. Cox ideą labi-
ryntu ukierunkował nowe spojrzenie na problem chirurgicznego leczenia mi-
gotania przedsionków. Metoda ta stała się „złotym standardem”, jednak
dostrzeżono i jej słabe strony, które dopingują kolejne pokolenia kardiochi-
rurgów do poszukiwania metody zarazem skutecznej i łatwo stosowanej.
Zapamiętaj!
1. Celem przeprowadzanych zabiegów chirurgicznego leczenia migotania
przedsionków jest powrót rytmu zatokowego oraz całkowite przywrócenie
funkcji hemodynamiczej przedsionków.
2. Współczesne techniki chirurgicznego leczenia migotania przedsionków
oparte są na teorii ognisk arytmogennych oraz pętli re-entry powstających
przede wszystkim w lewym przedsionku.
3. Kardiochirurgia dysponuje szeregiem opracowanych, skutecznych technik
przeprowadzania operacji antyarytmicznych.
4. Istotą zabiegu chirurgicznego leczenia migotania przedsionków jest wyko-
nanie szeregu linii ablacyjnych w obrębie lewego przedsionka, m.in. izolacja
elektryczna żył płucnych.
5. Obecnie kardiochirurdzy w celu ablacji lewego przedsionka wykorzystują
różne źródła energii, przede wszystkim: prąd częstotliwości radiowej (radio-
frequency), niskie temperatury (krioablacja), mikrofale, energia laserowa.
6. Możliwe jest wykonanie operacji antyarytmicznej z dostępu wewnątrzser-
cowego – metoda endokardialna, jak i bez konieczności otwierania jam
serca – metoda epikardialna.
7. W Polsce wykonano już pierwsze zabiegi jednoczasowego pomostowania
tętnic wieńcowych oraz izolacji żył płucnych bez krążenia pozaustrojowego.
Warto przeczytać:
S. Bharati, M. Lev: Histology of the normal and diseased atrium. Atrial Fi-
brillation. Mechanism and Management. R.H. Falk, P.J. Podrid (red.), Ra-
ven Press, New York 1992.
P. Coumel: Neutral aspects of paroxysmal atrial fibrillation. Atrial Fibrilla-
tion. Mechanism and Management. R.H. Falk, P J. Podrid (red.), Raven
Press, New York 1992.
207

J.L. Cox et al.: The surgical treatment of atrial fibrillation III. Development
of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991; 101: 569-
583.
J.L. Cox et al.: Evolving application of the maze procedure for atrial fibril-
lation. Ann Thorac Surg 1993; 55: 578-580.
K. Dorschler, G. Muller: The role of laser in cardiac surgery. Thorac Car-
diovasc Surg 1999; 47, Suppl. 3: 385-7.
I. Hiroshi et al.: Medium-term results after the modified Cox/Maze procedure
combined with other cardiac surgery. Eur JCardio-thorac Surg 2000; 17:
25-29.
A.H. Kitchin, J.S. Milne: Longitudinal survey of ischaemic heart disease in
randomly selected sample of older population. Br. Heart J. 1977; 39: 889-93.
F.R. Lake et al.: Atrial fibrillation and mortality in an elderly population.
Aust. N. Z. J. Med. 1989; 19: 321-6.
J. Melo et al.: Electrosurgical treatment of atrial fibrillation with a new in-
traoperative radiofrequency ablation catheter. Thorac Cardiovasc Surg 1999;
47 Suppl. 3: 370-2.
P. Suwalski, F. Majstrak, A. Kurowski i wsp.: Epikardialna izolacja żył płuc-
nych przy użyciu krioaplkacji u pacjentów z migotaniem przedsionków – do-
niesienie wstępne. Folia Cardiol. 2003; 10: 381-385.
208

XIX. CHIRURGIA TACHYARYTMII KOMOROWYCH
Piotr Suwalski, Franciszek Majstrak, Grzegorz Suwalski, Andrzej Kurowski,
Kazimierz B. Suwalski
WSTĘP
Niestabilność elektryczna serca to jedno z poważniejszych powikłań choro-
by wieńcowej. U części chorych prowadzić może do powstawania komoro-
wych zaburzeń rytmu, a do najgroźniejszych, stanowiących wysokie ryzyko
nagłej śmierci sercowej zaliczyć należy częstoskurcz komorowy (ventricular
tachycardia, VT). Liczne badania podają, iż śmiertelność jednoroczna po wy-
stąpieniu epizodu częstoskurczu komorowego sięga 40%. Arytmia ta dra-
matycznie pogarsza rokowanie u chorych po zawale mięśnia sercowego.
Z obserwacji Harrisona i wsp. wynika, iż wystąpienie częstoskurczu komoro-
wego w okresie 6 tygodni od zawału serca wiąże się ze zwiększeniem ryzyka
nagłego zgonu sercowego w ciągu roku i wynosi aż 85%.
Niestabilność elektryczna mięśniówki komór serca to objaw, którego przy-
czyn należy zawsze intensywnie poszukiwać. Oprócz etiologii niedokrwiennej
pod uwagę należy brać postępującą niewydolność serca ze zmniejszeniem
kurczliwości miokardium, nasilającą się rozstrzeń komór czy niedomykal-
ność mitralną. Optymalizacja leczenia farmakologicznego względem przy-
czyny wywołującej komorowe zaburzenia rytmu może redukować ilość epi-
zodów arytmii. Istnieje jednak grupa chorych, u których zastosowane leki
nie zapewniają dostatecznej kontroli arytmii. Pacjenci ci często kwalifikowa-
ni są do leczenia metodami przezskórnymi, takimi jak ablacja czy implanta-
cja kardiowertera-defibrylatora (implantable cardioverter-defibrillator, ICD).
Rozpowszechnienie tych technik terapeutycznych w latach dziewięćdziesią-
tych doprowadziło do znacznej redukcji liczby pacjentów kierowanych do le-
czenia chirurgicznego.
Jednak dla części chorych z VT postępowanie kardiochirurgiczne propo-
nuje kompleksowe leczenie – pomostowanie tętnic wieńcowych, naprawa
lub wymiana zastawek serca, plastyka geometrii komór czy resekcja tętniaka
serca z jednoczesnym chirurgicznym postępowaniem antyarytmicznym. Ta
grupa chorych wciąż kierowana jest do ośrodków kardiochirurgicznych.
HISTORIA CHIRURGICZNEGO LECZENIA CZĘSTOSKURCZÓW
KOMOROWYCH
Pierwszej próby chirurgicznego leczenia VT, poprzez wycięcie tętniaka le-
wej komory, podjął się Couch w 1959 roku. Wyniki operacyjnego leczenia
209

VT jedynie poprzez pomostowanie tętnic wieńcowych również okazały się
niezadowalające. Niepowodzenia te przyczyniły się do rozwoju badań mają-
cych na celu wyjaśnienie mechanizmów powstawania VT. Prace te precyzyj-
nie określiły grupę chorych, u których sama rewaskularyzacja daje dużą
szansę na redukcję lub całkowite ustąpienie epizodów ciężkich komorowych
zaburzeń rytmu.
Kolejne lata poszukiwań zaowocowały zastosowaniem mappingu śródo-
peracyjnego. Po raz pierwszy śródoperacyjne mapowanie elektrofizjologicz-
ne serca zastosowali w 1974 roku Fontaine i Guiraudon. Ich obserwacje po-
zwoliły ustalić, iż u pacjenta z chorobą niedokrwienną serca, VT wzbudzony
zostaje w mechanizmach re-entry lub wskutek zwiększonego automatyzmu
komórkowego – może być również wynikiem kombinacji tych mechanizmów.
Okazało się również, iż zjawisko re-entry powstaje w obrębie strefy upośle-
dzonej perfuzji miokardium, na obrzeżach blizny pozawałowej w jej pod-
wsierdziowej warstwie. Celem chirurgicznej interwencji stało się zatem prze-
rwanie pętli re-entry lub usunięcie arytmogennego ogniska ektopowego.
Dalsze prace badawcze skupiły się na poszukiwaniu technik mających na
celu jeszcze dokładniejszą lokalizację miejsca powstawania VT. I tak w 1974
roku Fontaine i Guiraudon zastosowali śródoperacyjny mapping zarówno
epikardialny, jak i endokardialny. Cztery lata późnej Guiraudon wprowadził
metodę tak zwanej okrężnej wentrikulotomii. Niestety zabiegi tego typu
obarczone były wysoką śmiertelnością – ponad 15% – najczęściej z powodu
małego rzutu serca lub krwawienia pooperacyjnego.
W 1980 roku Harken zaproponował zmniejszenie rozległości zabiegu i wy-
cięcie jedynie warstwy wsierdzia w rejonie odpowiedzialnym za wzbudzanie
VT. Technika ta znacznie ograniczyła śmiertelność do 8-10%.
Następne lata poświęcono na doskonalenie technik chirurgicznego niszcze-
nia substratu w obrębie tkanek serca. W 1982 roku Cox zastosował krioabla-
cję, a w 1986 roku Selle wykonał laserową fotoablację. Znaczącym sukcesem
wprowadzenia tych technik była dalsza redukcja powikłań okołooperacyj-
nych oraz wzrost skuteczność leczenia.
WSPÓŁCZESNE STRATEGIE TERAPEUTYCZNE
Leczenie przewlekłych tachyarytmii komorowych przez ablację chirurgicz-
ną z zastosowaniem mappingu ewoluowało przez ostatnie 20 lat od ekspery-
mentów do klinicznie użytecznej formy terapii. Komputeryzacja ogromnie
zwiększyła praktyczne zastosowanie technik mappingu do identyfikowania
stref arytmogennych. Techniki chirurgiczne rozwijały się gwałtownie i za-
pewniają obecnie, w grupie odpowiednio zakwalifikowanych pacjentów, po-
210
ziom wyleczeń VT sięgający 90%, ze śmiertelnością szpitalną poniżej 10%.
Najczęściej stosowane techniki to resekcje wsierdzia, krioablacja, cięcia izo-
lujące i chirurgiczne wycięcie mięśnia sercowego.
Znaczenie mappingu
Badania elektrofizjologiczne wykazały, że najczęściej VT powstają w gra-
nicznej strefie bliznowatego wsierdzia i zdrowej tkanki. Tłumaczy to niską
30-50% skuteczność „ślepej”, tzn. niepoprzedzonej mappingiem aneury-
zmektomii, w porównaniu z 80-90% skutecznością operacji wykonywanych
w oparciu na danych pochodzących z mappingu.
Celem mappingu jest konstrukcja dokładnej elektrofizjologicznej mapy
tkanek komór. Parametry opisujące zjawiska wzbudzania potencjałów elek-
trycznych w różnych częściach komór serca zbieraną są przez kilkadziesiąt
elektrod rozmieszczanych na sercu – w przypadku mappingu epikardialnego
lub wewnątrz serca – w czasie mappingu endokardialnego (ryc. 1).
Często konieczne jest wykonanie zarówno mappingu epi-, jak i endokar-
dialnego. Jest to skutkiem nieprzewidywalności propagacji depolaryzacji
przez chory mięsień sercowy i braku zapisów przegrodowych podczas zasto-
sowania jedynie elektrod epikardialnych (ryc. 2).
Rycina 1. Technika wykonania mappingu epikardialnego - system elektrod nasierdziowych
211
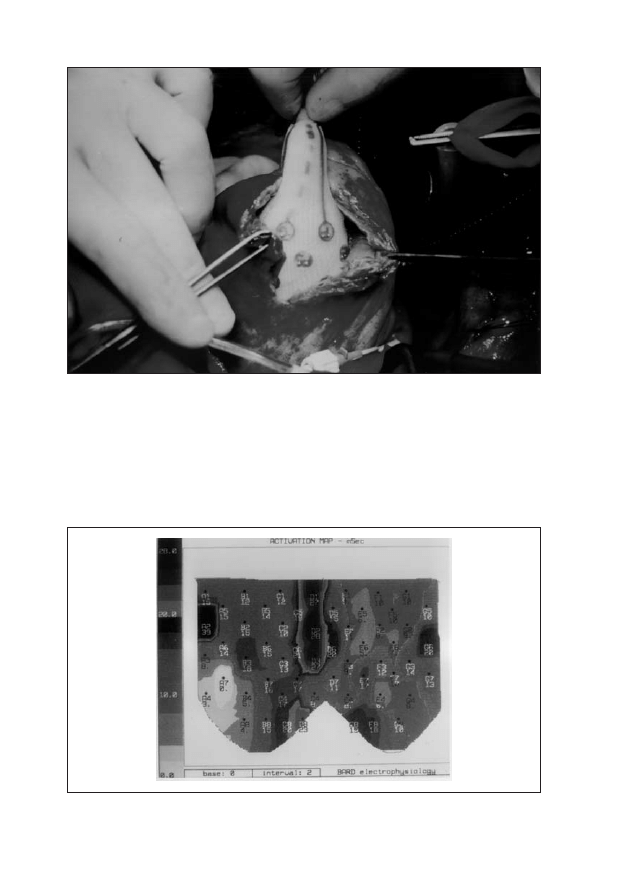
Analiza komputerowa zebranych sygnałów pozwala na wykreślenie precy-
zyjnej mapy elektrycznej pracy serca. Możliwa staje się dokładna lokaliza-
cja strefy, w której potencjał elektryczny powstaje wcześniej i nie poddaje
się prawom elektrofizjologii, stwarzając wysokie ryzyko powstania często-
skurczu komorowego (ryc. 3).
Rycina 3. Mapa elektrofizjologiczna serca. Jaśniejszym kolorem oznaczone miejsca
wczesnego powstawania potencjałów elektrycznych
Rycina 2. Układ elektrod endokardialnych - mapping wewnątrzkomorowy
212

Częstoskurcz komorowy jest zwykle wynikiem mechanizmu re-entry.
W chorobie niedokrwiennej serca występują obszary pomiędzy żywotnym
a całkowicie martwiczym mięśniem sercowym, w których małe, zniszczone
pęczki mięśniowe wykazują różnice w szybkości przewodzenia. Skutkuje to
wytworzeniem „wolnych i szybkich dróg” oraz „bloku funkcjonalnego”, jako
niezbędnych warunków do powstania tachykardii w mechanizmie re-entry.
Najczęściej obszary te lokalizują się w miejscu najwcześniej zapisywalnej ak-
tywności przedskurczowej w VT.
Dokładny mapping pozwala kardiochirurgowi zaplanować rozległość za-
biegu. Dysponując precyzyjną mapą, można uniknąć szczególnie dużej re-
sekcji tkanek, dzięki czemu nie dochodzi to istotnej redukcji światła komory.
Doświadczenie kliniczne umocniło pogląd, że odpowiedni przed- i śródope-
racyjny mapping jest ważnym czynnikiem zapewniającym sukces bezpośredniej
chirurgii VT. W pracach Lawrie i Swierdłow dowiedli istnienia bezpośred-
niej zależności między pełną informacją z mappingu a prawdopodobień-
stwem wyleczeń.
Techniki chirurgiczne
Celem chirurgii ablatywnej z użyciem mappingu jest eliminacja wszystkich
utrzymujących się monomorficznych VT możliwych do indukowania zarów-
no przed-, jak i śródoperacyjnie, ponieważ indukowalność jakiegokolwiek
utrzymującego się VT dowodzi istnienia anatomicznego substratu, który
choć nieaktywny przedoperacyjnie, może się ujawnić w każdym momencie
po operacji. Pewne dowody z innych prac (Rothberg i Winterberg w 1913 ro-
ku i DeBakker w 1988 roku) sugerują, że mnogie drogi wyjścia z tej samej
pętli re-entry mogą powodować u niektórych pacjentów mnogie, monomor-
ficzne VT, podczas gdy u innych – różnorodne VT.
W celu ablacji VT używanych było wiele technik. Najszerzej stosowano
wycięcie tkanek miokardium, resekcję endokardium i kriotermię.
• Wycięcie
Czasami wykonywane jest wycięcie całej grubości wolnej lub przegrodo-
wej części komór. Wycięcie samej blizny z pewną ilością zmienionego mio-
kardium wykonuje się rutynowo w przypadku resekcji tętniaka lewej komo-
ry (ryc. 4), jakkolwiek u pacjentów bez choroby niedokrwiennej wycięcie
miokardium często połączone jest z kriotermią. Ponadto w przypadku zloka-
lizowania wielu ognisk arytmogennych, np. w obrębie koniuszka serca w za-
kresie lewej i prawej komory, wykonywane jest wycięcie koniuszka wraz
z częścią przegrody międzykomorowej.
213
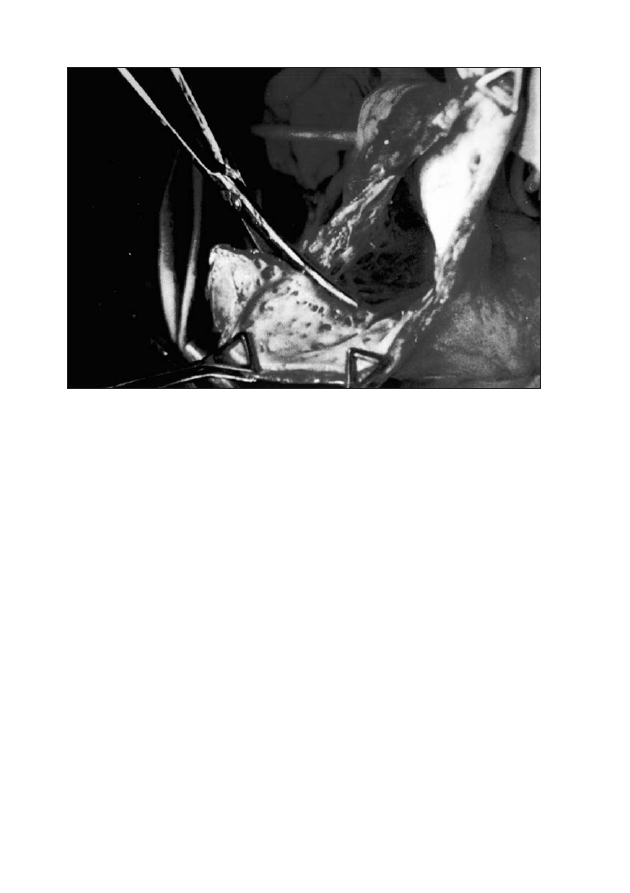
• Resekcja endokardium
Resekcja endokardium jest najlepiej udokumentowaną techniką leczenia
częstoskurczu komorowego w grupie pacjentów z chorobą niedokrwienną
serca. Technikę tę stosuje się w przypadku blizny endokardium o dużej po-
wierzchni – usunięcie powierzchni 35-40 cm
2
jest częste. Tak więc, technika
jest dobra, gdy obszar arytmogenny określony został tylko w przybliżeniu
w czasie mappingu przed- i śródperacyjnego lub uzyskanie tych danych jest
niemożliwe. Niektórzy autorzy rutynowo stosowali resekcję endokardium
bez mappingu, usuwając całą dostępną bliznę wsierdzia. Podejście ograni-
czające zastosowanie mappingu limituje wybór pacjentów do tych z dużym
prawdopodobieństwem lokalizacji blizny wsierdzia w pobliżu miejsca po-
wstawania VT. Podejście to również może prowadzić do wykonania nazbyt
rozległej resekcji wsierdzia niż byłoby to wystarczające dla wyleczenia VT,
a więc niepotrzebnego powiększenia operacji w grupie krytycznie chorych
pacjentów. Brak mappingu uniemożliwia również identyfikację i zniszczenie
ognisk VT w prawidłowo wyglądającym mięśniu lub prawej komorze.
Wykonuje się również operacje we wczesnym okresie po zawale serca,
gdzie komorowe zaburzenia rytmu są bezpośrednim powikłaniem martwicy
miokardium i drastycznie zmniejszają szanse chorego na przeżycie. W czasie
takiego zabiegu przeprowadza się infarktektomię i wycięcie nekrotycznego
Rycina 4. Resekcja zmienionego miokardium w obrębie tętniaka lewej komory
214
wsierdzia oraz tkanki podwsierdziowej. Niestety, postępowanie operacyjne
u tych chorych obarczone jest dużym ryzykiem. Jednakże w okresie jedne-
go miesiąca po zawale chirurgiczna resekcja wsierdzia jest równie bezpiecz-
na, jak w terminie jeszcze odleglejszym (ryc. 5).
Stosując tę metodę u chorych wcześnie po zawale, chirurg często napotyka
na szereg trudności związanych z brakiem dobrze widocznego odgraniczenia
powierzchni zawałowej, lokalizacją strefy arytmogennej w miokardium czy
rozsianym ułożeniem obszarów zmienionych martwiczo. Nie jest to również
idealna metoda w przypadku lokalizacji stref arytmogennych w obrębie mięśni
brodawkowatych, pierścieni zastawek czy w chirurgii prawej komory serca.
Istotnym powikłaniem techniki resekcji może być perforacja, szczególnie
w czasie zabiegu w obrębie przegrody międzykomorowej. Brodman doniósł
o 5 przypadkach konieczności zastosowania łaty po resekcji wsierdzia prze-
grody międzykomorowej. Zastosowanie osierdzia jako materiału na łatę dla
wzmocnienia przegrody rozpowszechnił Szentptery (1989 rok). Na podsta-
wie doświadczeń własnych uważamy, iż należy unikać rozległego resekowa-
nia wsierdzia przegrody międzykomorowej, na przykład poprzez zastosowa-
nie innej metody zniszczenia ognisk arytmogennych, takiej jak kriotermia
przegrodowa.
Rycina 5. Resekcja wsierdzia
215

• Kriotermia
Krioablację wykonuje się za pomocą krioaplikatora chłodzonego najczę-
ściej tlenkiem azotu. W przeciwieństwie do technik polegających na wycięciu
substratu odpowiedzialnego za VT, kriotermia zamienia obszary arytmogen-
ne heterogennego miokardium w jednolitą niearytmiczną tkankę – blizny.
Tkanka poddana krioablacji zachowuje swą wytrzymałość, gdyż kroablacja
niszczy miocyty, ale nie osłabia zrębu miokardium. Technice tej mogą być
poddane mięśnie brodawkowate bez spowodowania niedomykalności mi-
tralnej (Guiraudon, rok 1989).
Znane są efekty elektrofizjologiczne kriotermii. Z pomocą analiz zapisów
elektrokardiograficznych udało się dowieść, iż w rejonie miokardium pod-
danym działaniu niskiej temperatury ustają procesy elektrofizjologiczne, mo-
gące być źródłem zaburzeń rytmu serca, jednak tuż za ostrą granicą wymro-
żonego obszaru fizjologiczne, elektryczne zjawiska komórkowe pozostają
nienaruszone.
W czasie zabiegu kardiochirurgicznego kolejnymi przyłożeniami aplikato-
ra do wsierdzia zlokalizować można rejony, których ochłodzenie przerywa
wzbudzone VT. Następnie wszystkie te rejony są niszczone.
Kriotermia posiada szerokie zastosowanie zarówno w grupie chorych,
u których VT powstają w mechanizmie niedokrwiennym, jak i w grupie VT
o etiologii nieniedokrwiennej. Stosowana może być także w przypadku nie-
typowego położenia blizny pozawałowej, uniemożliwiającego skuteczne jej
resekowanie (ryc. 6).
Rycina 6. Krioablacja ogniska arytmogennego w obrębie lewej komory serca (dostęp
z powierzchni osierdziowej)
216
Jeśli wykonany mapping zlokalizuje źródło powstawania VT w obrębie
przegrody międzykomorowej lub lewej komory, a głębokość ogniska nie jest
znana, użyteczną techniką jest wykonanie krioablacji z powierzchni nasier-
dziowej i wsierdziowej (ryc. 7).
• Techniki łączone
U większości chorych stosuje się kombinację technik wycięcia, resekcji
wsierdzia i kriotermii. Uzupełnienie strategii usuwania tkanek arytmogennych
kriotermią pozwala zwiększyć skuteczność operacji antyarytmicznej, ale i czę-
sto oszczędzić miokardium, nie zaburzając geometrii komór serca (ryc. 8).
Rycina 8. Operacja z zastosowaniem technik łączonych - wycięcie tętniaka lewej komory,
resekcja wsierdzia oraz widoczna ablacja elektryczna
Rycina 7. Krioablacja z powierzchni nasierdziowej
217

Krioterapia stwarza ponadto możliwość przeprowadzenia ablacji przez
pierścień ujścia przedsionkowo-komorowego bez potrzeby wykonywania
wentrikulotomii.
WSKAZANIA DO CHIRURGICZNEGO LECZENIA
CZĘSTOSKURCZÓW KOMOROWYCH KIEROWANE
MAPPINGIEM
Głównym wskazaniem do chirurgicznego leczenia VT z użyciem mappin-
gu jest obecność jednego lub kilku utrzymujących się monomorficznych VT
opornych na leczenie lekami.
Bezpośrednia chirurgia VT opiera się na przekonaniu, iż u pacjentów
z monomorficznym utrwalonym VT znajduje się jeden bądź kilka ukrytych
anatomicznych obszarów arytmogennych, które mogą być zlokalizowane
i zniszczone w czasie operacji. Tak więc, nie uważa się, aby pacjenci z róż-
norodnymi, polimorficznymi VT, z pierwotnym migotaniem komór posiada-
li ustalone ukryte obszary arytmogenne. W świetle powyższego, pacjenci
z wymienionymi arytmiami nie są rozpatrywani jako kandydaci do bezpo-
średniej chirurgii VT i obecnie uważa się ich za potencjalnych kandydatów
do implantacji kariowertera-defibrylatora.
W miarę rozpowszechniania się chirurgii ciężkich komorowych zaburzeń
rytmu ta forma leczenia napotyka na problem wysokiego ryzyka okołoope-
racyjnego, jakkolwiek, w dużej analizie (Cox, rok 1983) 16 raportów obejmu-
jących łącznie 844 pacjentów śmiertelność okołooperacyjna wynosiła średnio
12,4% (od 0 do 24%). Znacząca różnica w wynikach jest miarą nabywania
coraz większego doświadczenia w tej dziedzinie przez poszczególne ośrodki.
Należy również pamiętać, iż metaanaliza Coxa łączy w sobie dwie odmienne
grupy chorych – pacjentów wyselekcjonowanych oraz przypadki nagłe.
W ciągu ostatnich lat sprecyzowano szereg czynników wpływających na
śmiertelność szpitalną chorych operowanych z powodu VT. Najsilniejsze
z nich to niska frakcja wyrzutowa lewej komory, brak możliwości wykonania
dokładnego, kompletnego mappingu z powodu niestabilności hemodyna-
micznej pacjenta czy czas zaklemowania aorty. Na podstawie tych danych
zmodyfikowano zasady kwalifikacji pacjentów do zabiegu oraz same techni-
ki kardiochirurgiczne.
Zapamiętaj!
1. Komorowe zaburzenia rytmu, w tym częstoskurcz komorowy, jest powikła-
niem choroby wieńcowej bezpośrednio zagrażającym życiu pacjenta.
218

2. Grupę chorych kierowanych do ośrodków kardiochirurgicznych tworzą
głównie pacjenci wymagający jednoczesnego wykonania pomostów tętnic
wieńcowych oraz chirurgicznego leczenia VT.
3. W rozwoju technik operacyjnego leczenia VT podstawową rolę odegrał map-
ping śródoperacyjny umożliwiający dokładną lokalizację stref arytmogennych.
4. Istnieje szereg opracowanych, skutecznych technik chirurgicznego leczenia
VT, między innymi: resekcja wsierdzia, kriotermia, wycięcie obszaru całej
grubości ściany.
Warto przeczytać:
G. Fontaine, R. Frank, G. Guiraudon: Surgical treatment of resistant reen-
trant ventricular tachycardia by ventriculotomy: A new application of epicar-
dial mapping. Circulation 1982; 50 (suppl II/III).
G. Guiraudon, G. Fontaine, R. Frank et al.: Encirkling endocardial ventri-
culotomy: A new surgical treatment for life-threating ventricular tachycardias
resistant to medical treatment following myocardial infarction. Ann Thorac
Surg 1978; 26: 438.
K. Suwalski: Leczenie zaburzeń rytmu serca nowoczesnymi metodami ope-
racyjnymi. Medical Science Review 1999; 2: 112-120.
A.H. Harken, L.N. Horowitz, M.E. Josephson: Comparison of standard
aneurysmectomy and aneurysmectomy with directed endocardial resection
for treatment of reccuent sustained ventricular tachycardia. J Thorac Car-
diovasc Surg 1980; 8: 527.
J.L.G. Cox, J.J. Gallagher, R.M. Ungerlaeider: Encirkling endocardial ven-
triculotomy for refractory ischemic ventricular tachycardia. Clinical indica-
tions surgical technique mechanism of action and results. J Thor Cardiova-
scular Surg 1982; 83: 856.
J.G. Selle, R.H. Swenson, W. C. Sealy et al.: Successful clinical laser abla-
tion for ventricular tachycardia a promising new therapeutic method. Ann
Thorac Surg 1986, 42: 380.
J. Cancers, P. Werner, M. Jazayeri: Efficacy of cryosurgery alone for refrac-
tory VT due to inferior wall infarction. J Am Coll Cardiol 1988, 11: 288.
J.W. Mason, E.B. Stinson, R.A. Winkle et al.: Surgery for ventricular tachycardia:
efficacy of left ventricular aneurysm resection compared with operation gu-
ided by electrical activation mapping. Circulation 1987; 57: 870.
K. Suwalski: Chirurgiczne leczenie zaburzeń rytmu serca. Zagrożenie nagłym
zgonem z przyczyn sercowych – diagnostyka, postępowanie. Medyczne Spotka-
nia Teatralne, Teatr Dramatyczny. Warszawa 26 listopada 1994: 167-180.
219



Wyszukiwarka
Podobne podstrony:
Kardiologia praktyczna 4 Zaburzenia rytmu serca (1)
Seminarium 10. - Zaburzenia rytmu serca i przewodnictwa, Medycyna, Pediatria, kardiologia
Komorowe zaburzenia rytmu serca- standardy, Kardiologia
Nadkomorowe zaburzenia rytmu serca- standardy, Kardiologia
ZABURZENIA RYTMU SERCA, fizjoterapia, fizjoterapia w kardiologii i chirurgii naczyniowej
Zaburzenia rytmu serca
Leki antyarytmiczne i leczenie zaburzeń rytmu serca
Komorowe i nadkomorowe zaburzenia rytmu serca
ZABURZENIA RYTMU SERCA I ZABURZENIA PRZEWODNICTWA MR
Zaburzenia rytmu serca[1], badania fizykalne
Zaburzenia rytmu serca wykład
Zaburzenia rytmu serca (2)
KOMOROWE ZABURZENIA RYTMU SERCA
Leczenie Zaburzeń rytmu serca
więcej podobnych podstron