
Biotransformacje w syntezie organicznej
Pierwsze udokumentowane zastosowanie procesów biotechnologicznych miało
miejsce 8000 lat temu, kiedy to na obszarach bliskiego wschodu produkowano piwo.
Jednakże świadome wykorzystanie procesów biotransformacyjnych datuje się dopiero od
początków XIX w. kiedy to uruchomiono przemysłową produkcję octu winnego, w której
biokatalizator stanowiły bakterie octowe.
Popularność jaką cieszą się metody biotechnologiczne w przemyśle chemicznym i
farmaceutycznym wyraźnie ilustruje skala w jakiej otrzymuje się produkty przy pomocy tych
metod (tabela 1).
Tabela 1. Produkcja przemysłowa wybranych związków
chemicznych przy udziale biokatalizatorów
biokatalizator
produkt
skala [tony/rok]
sukraza dekstranu
lipaza
cyklodekstryny
butanian glicydolu
10
fumaraza
aminoacylaza
b-tyrozynaza
lipaza
hydroksylaza
kwas (-)-jabłkowy
(-)-metionina, (-)-walina
(-)-fenyloalanina
(-)-dopa
(-)-karnityna
10
2
aspartaza
termolizyna
hydantoinaza
aldonolaktonaza
kwas (-)-asparaginowy
aspartam
(+)-fenyloglicyna
kwas (+)-pantotenowy
10
3
nitrylaza
lipaza
amidaza penicylanowa
akryloamid
masło kakaowe
kwas 6-aminopenicylowy
10
4
izomeraza glukozy
fruktoza
10
6
Metody „bio” posiadają szeregi istotnych zalet:
- wysoka stereo-, regio- i chemoselektywność,

- mała energochłonność, łagodne warunki reakcji, nietoskyczne lub tanie rozpuszczalniki,
unikanie niebezpiecznych i szkodliwych dla środowiska substratów (zielona chemia),
- zadowalająca wydajność,
- immobilizacja enzymów i mikroorganizmów na nośnikach, a przez to możliwość
prowadzenia procesów w trybie ciągłym z efektywnym wykorzystaniem biokatalizatorów.
Należy również wymienić szereg wad, którymi cechują się omawiane metody:
- często żmudna izolacja produktów z mieszaniny reakcyjnej,
- niska produktywność objętościowa (stosunek ilości produktu do objętości reaktora),
- często brak ogólnych reguł pozwalających na racjonalne zaprojektowanie warunków
procesu i idąca za tym konieczność optymalizacji metodą licznych prób.
Za procesy biotechnologiczne uważa się te, które polegają na wykorzystaniu
metabolizmu żywych organizmów, syntetyzujących z prostych związków pożądane produkty,
o bardziej złożonej budowie, przy czym synteza ta przebiega na drodze wielu etapów
przemian biochemicznych. Natomiast procesy biotransformacyjne definiujemy jako
pojedyncze reakcje chemiczne realizowane przy udziale enzymów (izolowanych lub
zawartych w komórkach).
Podział enzymów można przeprowadzić ze względu na rodzaj katalizowanej reakcji
(tabela 2).
Tabela 2. Podział enzymów na klasy
klasa
podklasa
typ katalizowanej reakcji
oksyreduktazy
dehydrogenazy, oksydazy, reduktazy,
peroksydazy, katalazy, oksygenazy,
hydroksylazy
reakcje utleniania i redukcji
transferazy
transaldolaza, transketolaza, transferazy,
kinazy, fosfomutazy
reakcje przenoszenia grup funkcyjnych z cząsteczki
donora do cząsteczki akceptora
hydrolazy
esterazy, peptydazy, tiolazy,
fosfolipazy, amidazy, dezamidazy,
glikozydazy
hydroliza i tworzenie wiązań w estrach, amidach
laktonach, laktamach, epoksydach, nitrylach,
bezwodnikach, glikozydach
liazy
dekarboksylazy, aldolazy, ketolazy,
hydratazy, dehydratazy, syntazy, liazy
reakcje addycji / eliminacji małych cząsteczek do
wiązań podwójnych
izomerazy
racemazy, epimerazy, mutazy
izomeryzacja
ligazy
syntetazy, karboksylazy
reakcje tworzenia lub rozpadu wiązań sprzężone z
rozerwaniem wiązania pirofosforanowego w ATP

Pożądane produkty procesów biotransformacyjnych stanowią cząsteczki optycznie
czynne, często o wielu centrach asymetrii. W przypadku jednego centrum chiralnego miarą
czystości produktu jest nadmiar enancjomeryczny, definiowany jako stosunek ilości jednego z
izomerów do ilości ich obu. Nadmiar enancjomeryczny produktu P, ee (ang. enantiomeric
excess) można wyrazić wzorem:
%
100
]
P
ent
[
]
P
[
]
P
ent
[
]
P
[
ee
⋅
−
+
−
−
=
gdzie:
[P] – stężenie produktu,
[ent-P] – stężenie jego enancjomeru.
Wartości [P] i [ent-P], a raczej ich stosunek, uzyskuje się w praktyce z eksperymentów NMR
(widma diastereoizomerycznych pochodnych) oraz drogą chromatografii na chiralnych fazach
stacjonarnych. W obu przypadkach
]
P
ent
[
]
P
[
−
odpowiada stosunkowi integracji odpowiednich
sygnałów. Inną metodą określenia czystości produktu jest pomiar jego skręcalności właściwej
[
α] i porównanie jej ze skręcalnością właściwą czystego enancjomeru [α]
abs
. Iloraz ten
definiuje czystość optyczną, op (ang. optical purity):
%
100
]
[
]
[
op
abs
⋅
α
α
=
.
O ile [
α]
abs
rzeczywiście odpowiada skręcalności właściwej czystego enancjomeru, to
czystość enancjomeryczna (ee) równa się czystości optycznej (op).
Jeżeli produkt stanowi mieszaninę diastereoizomerów, to w tym wypadku operuje się
terminem nadmiar diastereoizomeryczny, de (ang. diastereoisomeric excess):
%
100
]
D
[
]
D
[
]
D
[
]
D
[
ee
2
1
2
1
⋅
+
−
=
,
gdzie [D
1
] i [D
2
] określają stężenia diastereoizomerów.
1. Reakcje z użyciem drożdży piekarskich
Drożdże piekarskie, Saccharomyces cerevisiae (ang. baker yeasts) są niezwykle cennym
biokatalizatorem reakcji tworzenia wiązania C-C, hydrolizy estrów, asymetrycznej redukcji
grupy karbonylowej i wiązania C=C. Niska cena, łatwa dostępność i nieskomplikowane
warunki reakcji stanowią o dużej popularności tego katalizatora w syntezie chemicznej.
Asymetryczna kondensacja acyloinowa jest pierwszą opisaną syntezą z zastosowaniem
drożdży piekarskich (Neuberg, 1921) [2] i stanowi przykład formowania wiązania C-C.
Aktywnym enzymem jest tu dekarboksylaza pirogronianowa (rys 1).
O
+
CH
3
CHO
drożdże
piekarskie
O
OH
Rys. 1. Kondensacja acyloinowa przy użyciu drożdży piekarskich
Wkrótce po doniesieniu Neuberga rozpoczęto produkcję D-(-)-efedryny na skalę
przemysłową (1930).
CH
3
NH2
H
2
/ Pt
O
OH
NHCH
3
OH
D-(-)-efedryna
Rys. 2. Synteza D-(-)-efedryny
Innym przykładem zastosowania syntezy acyloinowej z udziałem drożdży piekarskich
może być synteza zredukowanej acyloiny i zredukowanego alkoholu furylowego, które
wykorzystuje się w syntezie
α-tokoferolu (witaminy E), rys. 3.
O
CHO
drożdże
piekarskie
O
OH
OH
O
OH
O
O
O
HO
O
HO
α-tokoferol
Rys. 3. Synteza
α-tokoferolu
Własności hydrolityczne drożdży piekarskich wynikają z obecności w ich komórkach
esteraz i lipaz. Hydroliza racemicznych estrów N-acetyloaminokwasów prowadzi do
powstania optycznie czynnych kwasów oraz nieprzereagowanych estrów o konfiguracji D [3]
(rys. 4).
OEt
O
R
NHAc
drożdże
piekarskie
OEt
O
R
NHAc
OH
O
R
NHAc
+
Rys. 4. Hydroliza wiązania estrowego w estrach etylowych N-acetyloaminokwasów
Duże zainteresowanie skierowane jest na zastosowanie drożdży piekarskich do
stereospecyficznej redukcji wiązania podwójnego C=C. Jest to doskonała droga
otrzymywania chiralnych substratów w syntezie asymetrycznej. Najwięcej danych
eksperymentalnych zgromadzono dla przypadku trójpodstawionego wiązania podwójnego [4]
(rys. 5).
H
R
3
R
1
R
2
drożdże
piekarskie
R
1
R
3
R
2
*
Rys. 5. Redukcja wiązania podwójnego C=C
Konfiguracja na powstałym centrum chiralnym zależy od rodzaju izomeru (Z / E) oraz od
właściwości podstawników R. Wydajności reakcji wahają się w granicach 30-65% i ee >
80%.
Na uwagę zasługuje katalizowana drożdżami redukcja aromatycznych związków
nitrowych. Przykładem może być otrzymywanie 1-amino-3-nitrobenzenu z 1,3-
dinitrobenzenu [5] (rys. 6).
NO
2
NO
2
drożdże piekarskie
NaOH
CH
3
OH / H
2
O
70-80
o
C, 2h
NH
2
NO
2
Rys. 6. Redukcja aromatycznych związków nitrowych
Najszerzej jednak eksploatowanym zastosowaniem drożdży piekarskich w
asymetrycznej katalizie jest redukcja grupy karbonylowej w ketonach, diketonach i
ketoestrach. Stwierdzono, że reakcję redukcji katalizują co najmniej dwie reduktazy obecne w
komórkach drożdży. Ich stereochemiczne preferencje mogą być różne. Zmiana
rozpuszczalnika i modyfikacje strukturalne substratu wpływają istotnie na ee produktu.
Atak jonu wodorkowego może nastąpić zarówno od lica re jak i si (rys. 7).
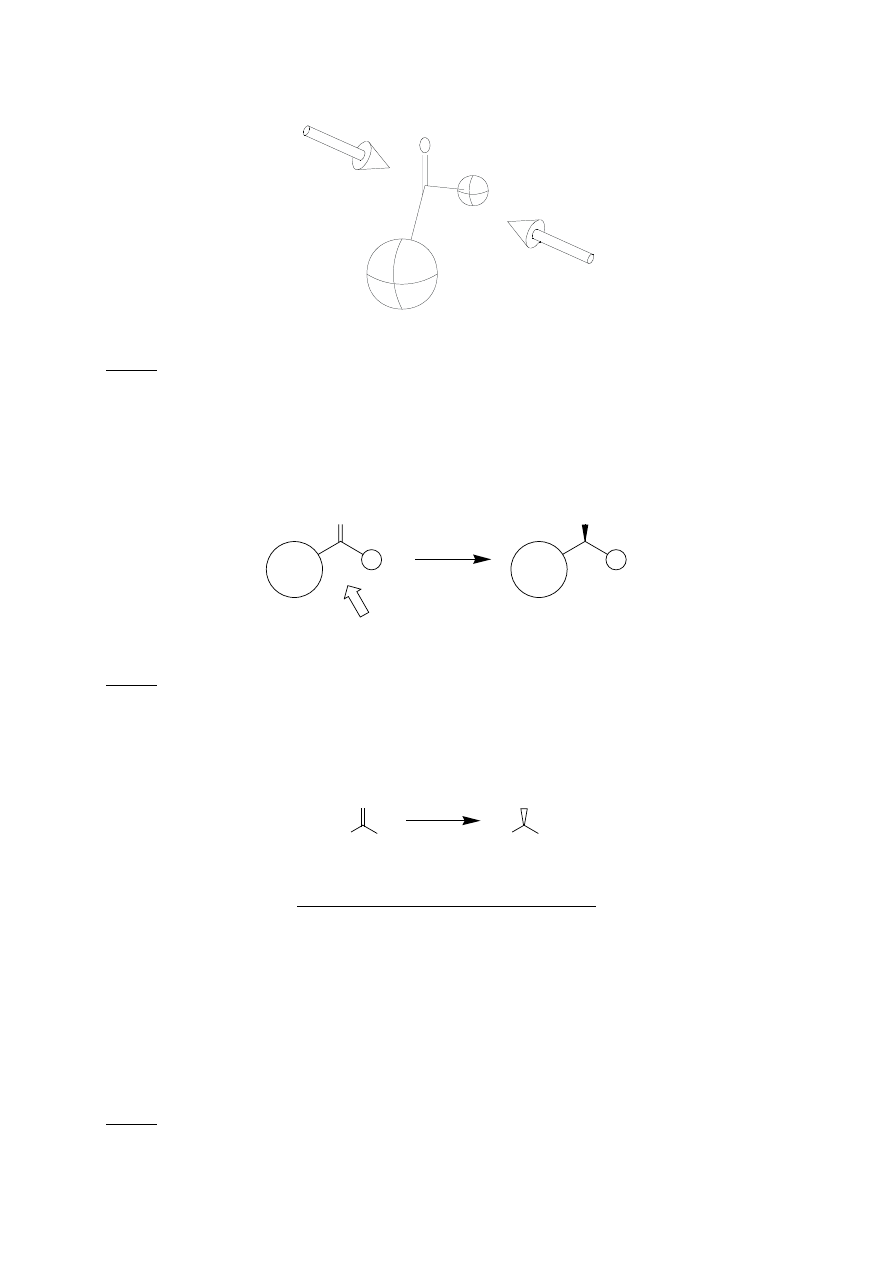
Si-face
Re-face
R
R
L
S
Rys. 7. Definicja lica re (re-face) i lica si (si-face) ugrupowania karbonylowego. R
L
oznacza
duży, R
S
mały objętościowo podstawnik
Stereochemia produktu reakcji określona jest regułą Preloga [1] (rys. 8).
O
R
L
R
S
H
-
atak od lica si
OH
R
L
R
S
Rys. 8. Ilustracja reguły Preloga
Na rys. 9 znajdują się przykłady stereospecyficznej redukcji ketonów [6].
O
R
1
R
2
OH
R
1
R
2
R
1
CH
3
CH
3
CH
3
CH
3
CF
3
CH
3
CH
3
CH
3
CH
3
R
2
C
2
H
5
n-C
4
H
9
Ph
CF
3
CH
2
Br
C(CH
3
)
2
NO
2
CH
2
OH
(CH
2
)
2
CH=C(CH
3
)
2
cyklo-C
6
H
11
ee [%]
67
82
89
>80
>80
>96
91
94
>95
Rys. 9. Redukcja ketonów za pomocą drożdży piekarskich
Produkty redukcji
β-ketoestrów stanowią niezwykle cenne chiralne bloki budulcowe.
Poniższy przykład pokazuje syntezę (R)-fluoksetyny, czynnego składnika popularnego leku
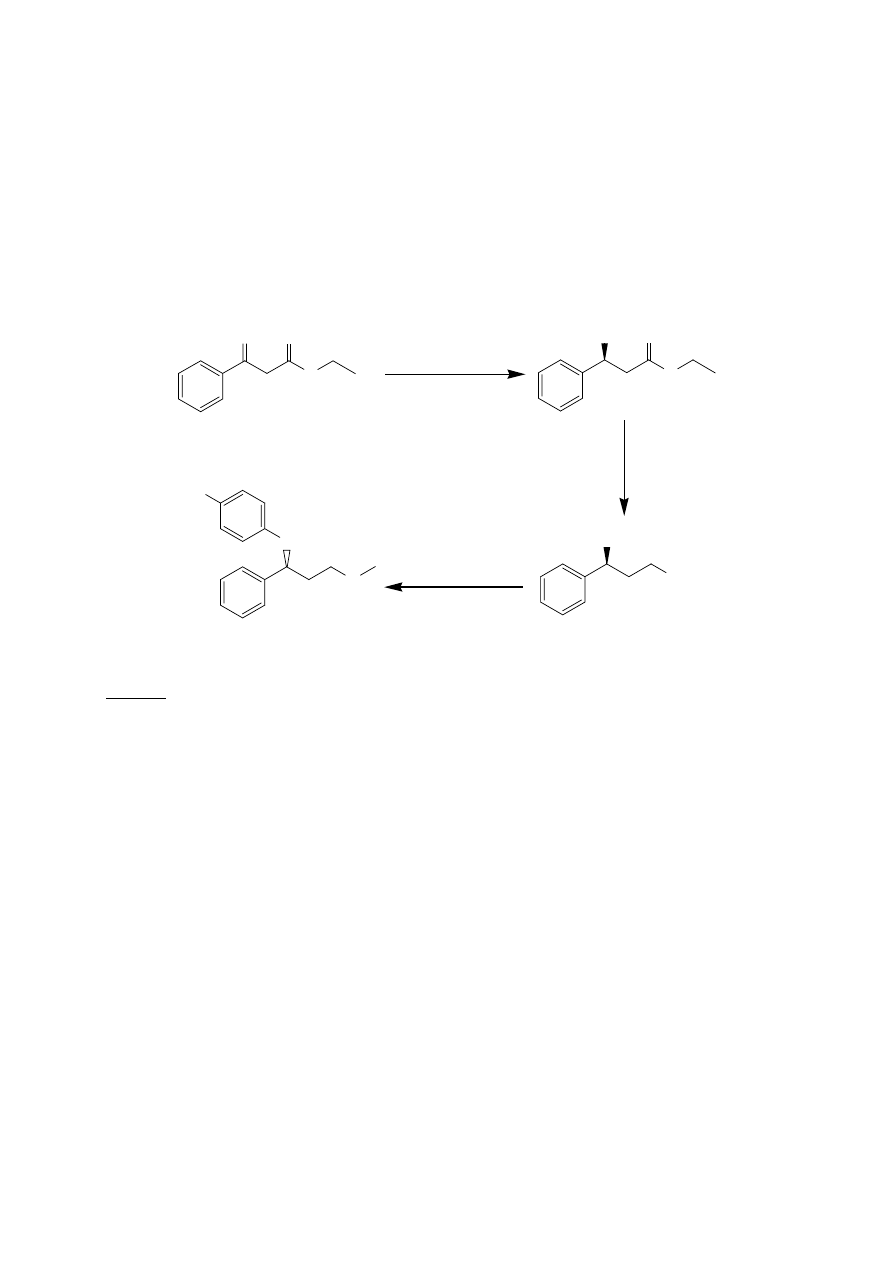
psychotropowego Prozac (koncern Eli Lilly). Pierwszy etap tej syntezy, stereospecyficzna
redukcja benzoilooctanu etylu do S-(-)-3-fenylo-3-hydroksypropionianu etylu jest tematem
jednego z ćwiczeń wykonywanych w naszej pracowni.
O
O
O
S. cerevisiae
OH
O
O
(i) LiAlH
4
(ii) MsCl
OH
OMs
O
N
H
F
3
C
x HCl
(i) F
3
CPhOH, Ph
3
P, DEAD
(ii) NaI, MeNH
2
(iii) HCl / Et
2
O
Rys. 10. Asymetryczna synteza popularnego leku psychotropowego (R)-fluoksetyny (Prozac)
Podobnie jak w przypadku reakcji redukcji ketonów, tu również na optyczną czystość
produktu ma wpływ rozpuszczalnik i rodzaj podstawników w cząsteczce. Ilustruje to poniższy
przykład.
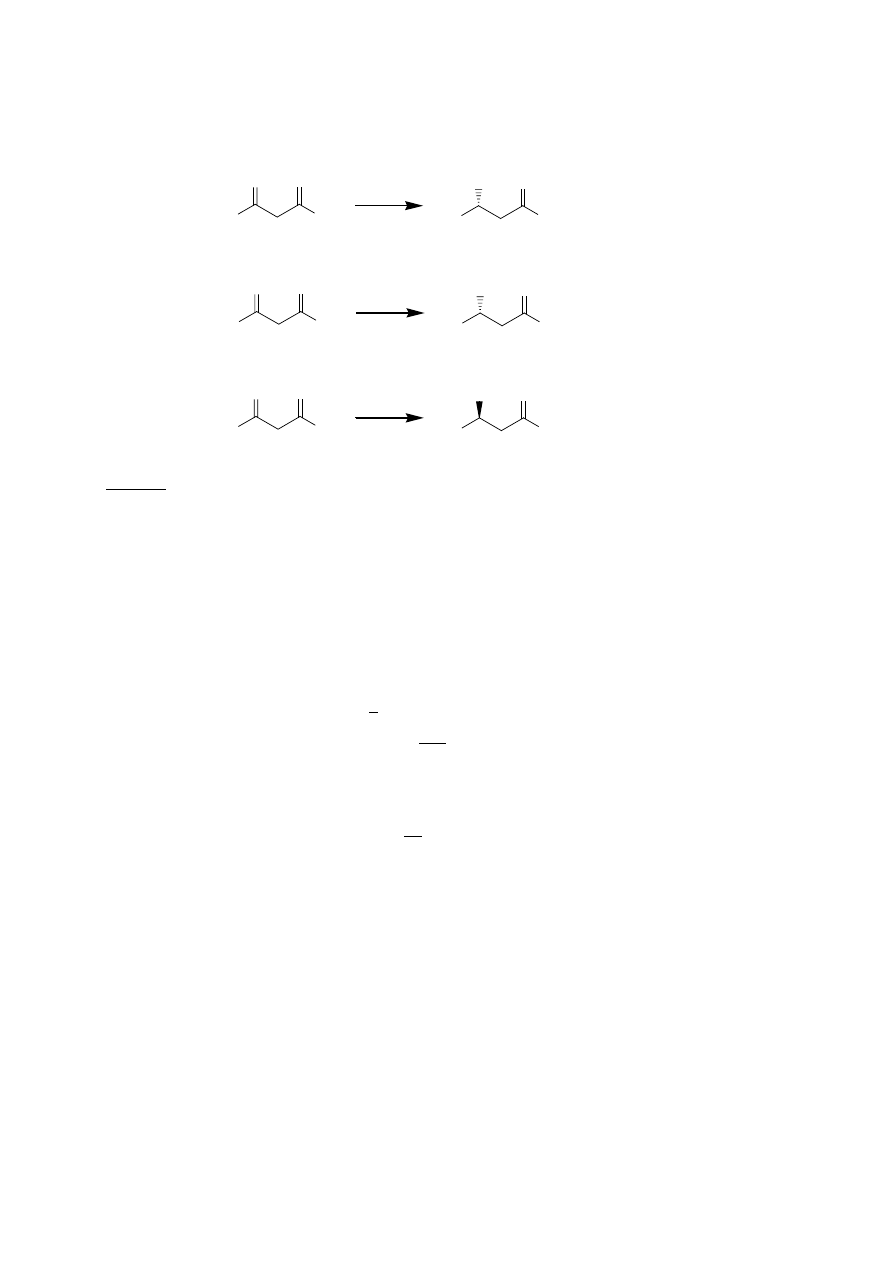
O
Me
OEt
O
OH
Me
OEt
O
S
O
Et
OEt
O
OH
Et
OEt
O
S
O
n-Pr
OEt
O
OH
n-Pr
OEt
O
R
H
2
O
Et
2
O
97
77
2
30
86
43
ee [%]
Rys. 11. Ilustracja wpływu wielkości podstawnika przy prochiralnym atomie węgla oraz
rozpuszczalnika na czystość optyczną produktu
Literatura
[1]
Prelog, V., Pure Appl. Chem., 9:119, (1964).
[2]
Neuberg, C., Hirsch, J., Biochem. Z., 115: 282, (1921).
[3]
Csuk, R., Glanzer, B.I., Chem. Rev., 91: 49-97, (1991).
[4]
Servi, S., Synthesis, 1-25, (1990).
[5]
Baik, J.L. et al., Tetrahedron Lett., 35: 3965, (1994).
[6]
Faber, K., Biotransformations in Organic Chemistry, Springer-Verlag, Berlin-
Heidelberg, (2004).
Wyszukiwarka
Podobne podstrony:
02 Metody syntezy organicznej VI s1id 3675
Mikrorganizmy w stereoselektywnej syntezie organicznej
(3) Zaburzenia biotransformacji leków w organizmie
Technologia lekkiej syntezy organicznej
07 Metody syntezy organicznej VI s1 2011 [tryb zgodnosci]id 6901
01 Metody syntezy organicznej VI s1 2011
04 Metody syntezy organicznej VI s1 2011id 5105
05 Metody syntezy organicznej VI s1 2011 [tryb zgodnosci]id 5753
02 Metody syntezy organicznej VI s1id 3675
Mikrorganizmy w stereoselektywnej syntezie organicznej
Synteza Zach Organizacyjne 2010
Syntezy alkenów i alkinów przykłady zadań, Chemia, Organiczna
chem org ćw 6 synteza aspiryny, chemia, organiczna, sprawozdania 2010
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,Wykorzystanie propyl
ROZDZIELANIE ORAZ SYNTEZA ZWIĄZKÓW ORGANICZNYCH
Synteza ATP w organizmie, Weterynaria Lublin, Weterynaria 1, Biochemia, Biochemia
chemia techniczna organiczna sprawozdania synteza oranżu metylowego[1]
więcej podobnych podstron