
LABORATORIUM INŻYNIERII MATERIAŁOWEJ W ENERGETYCE
Ćwiczenie 1
1
DIAGRAM FAZOWY UKŁADU Pb
–
Sn
Instrukcja zawiera:
1. Cel ćwiczenia
2. Wprowadzenie teoretyczne; definicje i wzory
3. Opis wykonania ćwiczenia
4. Sposób przygotowania sprawozdania
5. Lista pytań do kolokwium pisemnego
6. Literatura
1. Cel ćwiczenia
Celem ćwiczenia jest zapoznanie studentów z tzw. regułą faz Gibbsa oraz metodą
wyznaczania równowag fazowych ciało stałe – ciecz przy wykorzystaniu metody analizy
termicznej. W ramach ćwiczenia wykonywane są pomiary dla układu dwuskładnikowego Pb – Sn.
2. Wprowadzenie teoretyczne; definicje i wzory
Przedstawione poniżej definicje stanowią podstawę do zrozumienia zachowania układów
wieloskładnikowych i wielofazowych oraz są bazą dla tzw. reguły fazy Gibbsa, opisującej
równowagę termodynamiczną w tych układach.
Układ termodynamiczny – rodzaj układu fizycznego składający się z obiektów, które mogą
wymieniać energię i materię, oddzielony od otoczenia jednoznacznie zdefiniowaną granicą
(istniejąca w rzeczywistości lub określoną czysto myślowo) i będący przedmiotem badań
prowadzonych metodami termodynamicznymi. Stan układu jednoznacznie charakteryzują
parametry stanu i/lub wartości funkcji stanu, które są zależne jedynie od parametrów stanu.
Układ zamknięty nie wymienia z otoczeniem masy.
Parametr ekstensywny – parametr stanu opisujący układ termodynamiczny, proporcjonalny do
ilości materii w tym układzie. Przykładowo: masa, objętość.
Parametr intensywny – parametr stanu opisujący układ termodynamiczny, niezależny od ilości
materii w tym układzie. Przykładowo: temperatura, ciśnienie, ułamek molowy.
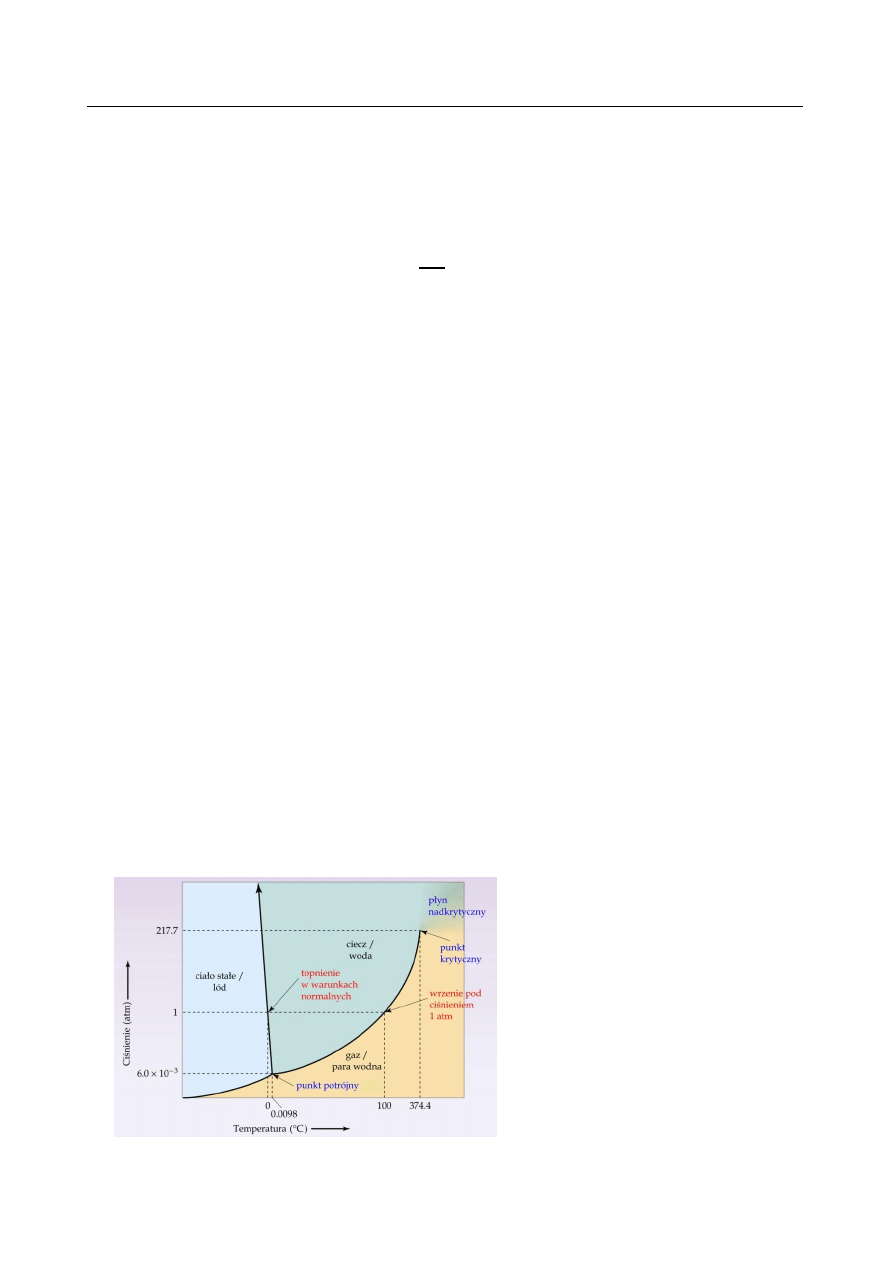
Diagram fazowy układu Pb-Sn
2
Potencjał chemiczny (składnika i) – cząstkowa molowa entalpia swobodna składnika i liczona
dla ustalonych wartości temperatury, ciśnienia i ilości moli pozostałych składników układu.
Potencjał chemiczny oznaczany jest symbolem μ
i
:
gdzie: G – entalpia swobodna, n
i
– ilość moli składnika i, T – temperatura, p – ciśnienie,
n
j
– pozostałe składniki układu.
Składniki niezależne – składniki budujące układ termodynamiczny, których liczbę określa się
odejmując od ilości wszystkich składników układu liczbę niezależnych równań chemicznych
wiążących te składniki.
Stopień swobody – parametr intensywny; liczba stopni swobody określa liczbę parametrów
intensywnych, których wartości można zmieniać dowolnie (choć w pewnym zakresie), przy
czym zmiana ta nie spowoduje zmiany ilości faz w układzie.
Faza – wydzielona część układu termodynamicznego, oddzielona od innych faz
powierzchniami międzyfazowymi, zwanymi granicami faz. Na granicy faz zachodzi skokowa
zmiana właściwości fizycznych i/lub chemicznych.
Układ skondensowany – układ termodynamiczny, w którym nie występują składniki w stanie
gazowym. W układach skondensowanych ciśnienie jest pomijane.
Diagram (wykres) fazowy – graficzne przedstawienie współistnienia faz w danym układzie,
które znajdują się w stanie równowagi termodynamicznej. Poniżej: a) diagram fazowy układu
jednoskładnikowego na przykładzie H
2
O, b) diagram układu dwuskładnikowego Pb – Sn.
a)
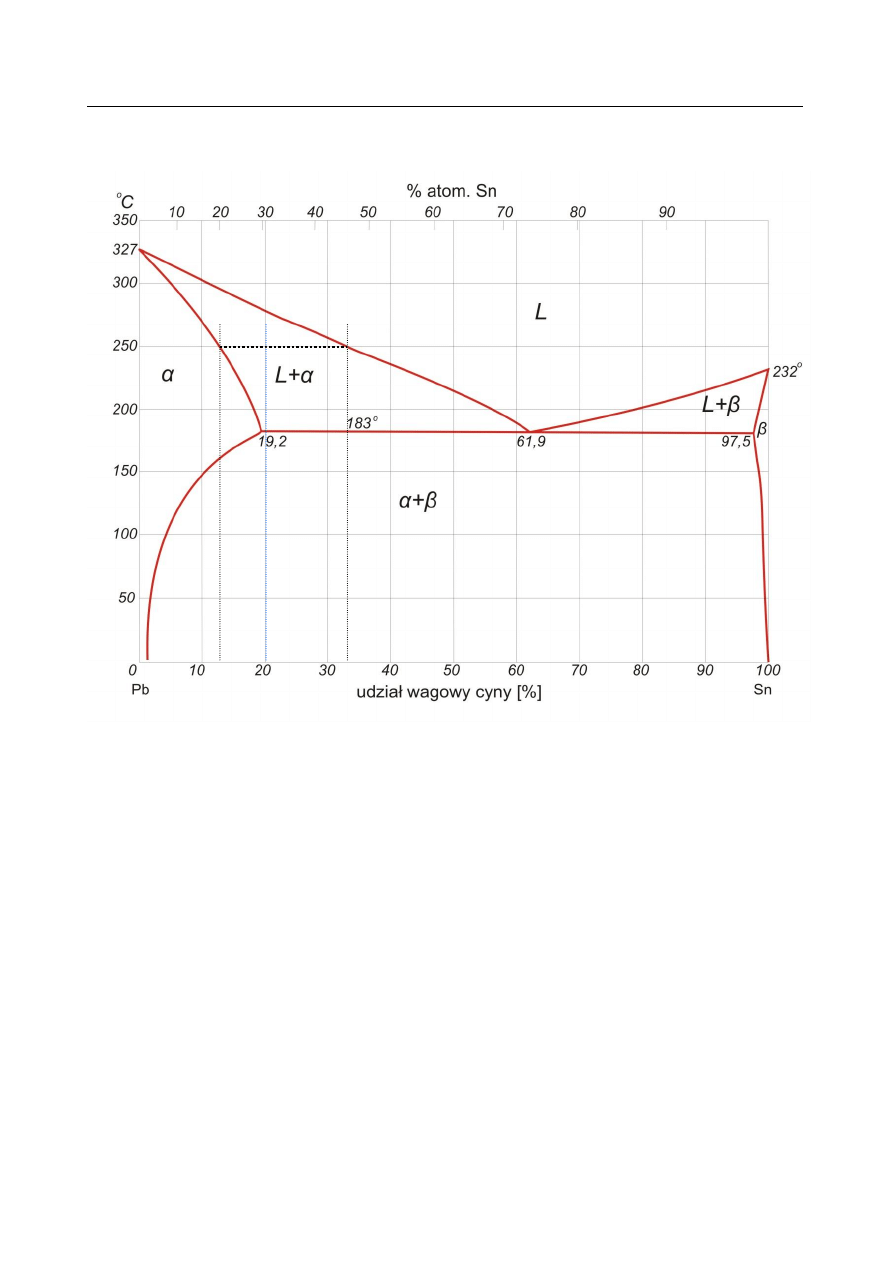
Diagram fazowy układu Pb-Sn
3
b)
α – faza stała α o strukturze ołowiu z częściowym podstawieniem atomami cyny, maksymalna
ilość podstawienia cyną zależy od temperatury
β – faza stała β o strukturze cyny z częściowym podstawieniem atomami ołowiu, maksymalna
ilość podstawienia ołowiem zależy od temperatury
L – faza ciekła
A – punkt krzepnięcia/topnienia ołowiu
B – punkt maksymalnej rozpuszczalności cyny w ołowiu
C – punkt maksymalnej rozpuszczalności ołowiu w cynie
D – punkt krzepnięcia/topnienia cyny
E – punkt eutektyczny
Eutektyka – mieszanina dwóch (lub więcej) faz krystalicznych o określonym składzie, która
wydziela się z roztworów ciekłych lub stopów w określonej temperaturze, zwanej temperaturą
eutektyczną. Temperatura ta jest na ogół znacznie niższa od temperatury krzepnięcia czystych
składników. Kryształy eutektyku są czystymi kryształami składników lub roztworami stałymi
o różnych składach. Punktowi eutektycznemu na powyższym rysunku odpowiada punkt E.
W przypadku układu Pb – Sn, skład w skład eutektyki wchodzą faza α oraz β.
E
A
B
C
D
c
α
c
c
L
x
y

Diagram fazowy układu Pb-Sn
4
Linia solidusu – linia na diagramie fazowym poniżej której znajdują się tylko fazy w stanie
stałym. Na diagramie powyżej linia ABCD.
Linia likwidusu – linia na diagramie fazowym powyżej której znajdują się tylko fazy w stanie
ciekłym. Na diagramie powyżej linia AED.
Reguła dźwigni – reguła umożliwiająca określenie ilości oraz składu faz na podstawie diagramu
fazowego. Przykład zademonstrowano na diagramie Pb – Sn powyżej: dla wyjściowego składu
o zawartości cyny równej c (20% wag.) w temperaturze 250°C w stanie równowagi
termodynamicznej znajdują się dwie fazy: stała α (o składzie c
α
, ok. 13% wag. Sn) oraz ciecz L
(o składzie c
L
, ok. 33% wag. Sn). Udział wagowy fazy α wynosi y/(x+y) a cieczy x/(x+y).
Wyprowadzenie reguły faz Gibbsa
Układ wieloskładnikowy i wielofazowy znajduje się w stanie równowagi termodynamicznej,
jeśli wartości potencjału chemicznego każdego składnika tego układu w każdej fazie obecnej
w układzie są sobie równe. Oznacza to, że jeśli układ zamknięty znajduje się w stanie równowagi,
to dla każdego składnika układu obecnego w fazie I, II, III, itd. musi być spełniony warunek
równości:
..........................................
..........................................
W sumie daje to n·(f – 1) równań. Aby całkowicie opisać układ potrzebne jest podanie n – 1 stężeń
w ilości f faz oraz podanie temperatury i ciśnienia. Sumarycznie daje to f·(n – 1) + 2 parametrów.
Wobec tego różnica pomiędzy:
f·(n – 1) + 2 – n·(f – 1) = –f + 2 + n = s
daje ilość stopni swobody układu. Prowadzi to do równania określającego regułę faz Gibbsa:
f + s = n + 2
n składników
f – 1 równań dla każdego składnika
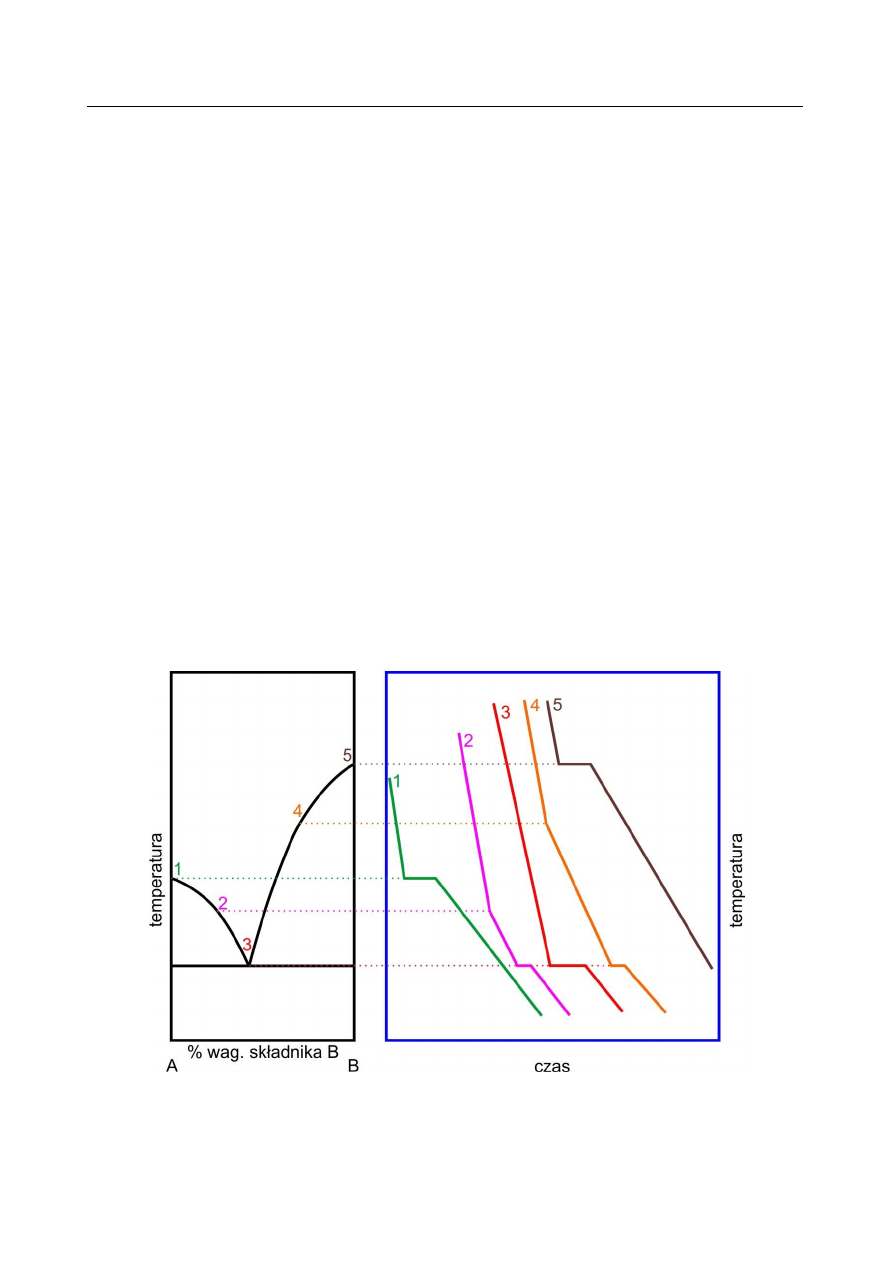
Diagram fazowy układu Pb-Sn
5
gdzie: f – ilość faz, s – ilość stopni swobody, n – ilość składników niezależnych.
Równanie opisujące regułę faz Gibbsa ulega modyfikacji dla układów skondensowanych
(składających się jedynie z faz stałych i ciekłych). W takim przypadku można przyjąć, że wpływ
ciśnienia na stan równowagi jest pomijalny, a reguła faz Gibbsa przybiera postać f + s = n + 1.
Największa liczba współistniejących w stanie równowagi termodynamicznej faz w układzie
dwuskładnikowym skondensowanym może wynieść trzy: f = n + 1 – s = 2 + 1 – 0 = 3 (przykładowo
punkt eutektyczny). Zachodzi to w przypadku zerowej liczby stopni swobody. Oczywiście,
najmniejsza liczba faz wynosi jeden i wtenczas ilość stopni swobody jest równa s = n + 1 – f = 2 +
1 – 1 = 2.
Metoda analizy termicznej w zastosowaniu do wyznaczania diagramów fazowych
Diagram fazowy można wyznaczyć metodą analizy termicznej, rejestrując zmiany
temperatury układu w funkcji czasu. Badany układ (np. dwuskładnikowy stop metali Pb – Sn,
będący przedmiotem ćwiczenia) ogrzewa się do określonej temperatury, a następnie chłodzi,
rejestrując jednocześnie jego temperaturę. Wykres zależności temperatury od czasu T = f(t) nosi
nazwę krzywej chłodzenia. Przykładowy przebieg krzywych chłodzenia przedstawia poniższy
rysunek, odpowiadający wyidealizowanemu układowi eutektycznemu.

Diagram fazowy układu Pb-Sn
6
Do opisu przebiegu krzywej chłodzenia dla czystych składników (krzywe 1 i 5 na
powyższym rysunku) przyjmijmy za punkt wyjścia stop w fazie ciekłej. W trakcie procesu
chłodzenia układ oddaje energię na sposób ciepła, co prowadzi do obniżenia średniej energii
kinetycznej drgań budujących go cząsteczek. Energia ta maleje w sposób ciągły do momentu,
w którym zaczyna się proces krystalizacji. W procesie krystalizacji następuje zmniejszenie
swobody ruchu atomów oraz obniżenie entropii układu. Energia potencjalna atomów maleje
skokowo i wydziela się w postaci tzw. ciepła krystalizacji. Jeśli proces chłodzenia wykonywany jest
dostatecznie wolno, to temperatura układu w trakcie krystalizacji pozostaje stała, gdyż efekt cieplny
związany z krystalizacją kompensuje straty ciepła wynikłe z chłodzenia. W takim przypadku na
krzywej chłodzenia obserwuje się tzw. przystanek). Gdy cała ciecz ulegnie przemianie w ciało stałe,
temperatura układu ponownie będzie obniżać się w sposób ciągły. Całkowite ciepło wydzielone
podczas chłodzenia czystego składnika A od temperatury T
1
do T
2
, dla którego w temperaturze T
p
następuje proces krystalizacji można zapisać zależnością:
gdzie: m – masa składnika, c
1
, c
2
– odpowiednie ciepła właściwe dla fazy ciekłej i stałej, q
p
– ciepło
właściwe przemiany (krystalizacji).
W przypadku krzywej chłodzenia dla składu eutektycznego (krzywa 3) obserwuje się jeden
przystanek, który odpowiada procesowi krzepnięcia układu z wydzieleniem eutektyki. Równanie
opisujące całkowite ciepło wydzielone w trakcie chłodzenia jest analogiczne do powyższego, przy
czym T
p
określa temperaturę eutektyczną. Dla krzywych chłodzenia 2 i 4 obserwuje się załamanie
nachylenia związane z częściową krystalizacją układu zachodzącą przy obniżeniu temperatury
poniżej temperatury likwidusu i zachodzącą do temperatury eutektycznej. Dla tych krzywych
obserwuje się również przystanek odpowiadający temperaturze eutektycznej.
3. Opis wykonania ćwiczenia
Ćwiczenie wykonuje się przy użyciu skomputeryzowanego układ do rejestracji krzywych
chłodzenia. Układ ten zawiera: 6 pieców grzewczych wyposażonych w wewnętrzne i zewnętrzne
termopary typu chromel-alumel, komputer do rejestracji danych, dedykowane oprogramowanie
rejestrujące krzywe chłodzenia, komplet tygli alundowych zawierających czyste metale Sn i Pb oraz
ich stopy.
Wykonanie ćwiczenia
1. Wskazane przez prowadzącego tygle zawierające stopy Pb – Sn (i/lub czyste metale Sn, Pb)
umieścić kolejno w piecach.

Diagram fazowy układu Pb-Sn
7
2. Na podstawie schematu diagramu fazowego układu Sn – Pb (rysunek w instrukcji) odczytać
odpowiednie temperatury topnienia, w przypadku czystych metali i stopu eutektycznego oraz
odpowiednie temperatury przejścia przez linię likwidusu dla pozostałych stopów.
3. Uruchomić komputer. Włączyć zasilanie pieców.
4. Uruchomić oprogramowanie "Diagram fazowy".
5. Na sterowaniu odpowiednich pieców ustawić temperatury o 20°C wyższe, niż odczytane
w punkcie 2 (instrukcja sterowania i obsługi pieców dostępna na stanowisku pomiarowym).
6. Zakryć otwory górne pieców zatyczkami izolacyjnymi, wprowadzić do rurek kwarcowych
końcówki termopar. Zamocować górną część rurek kwarcowych w odpowiednich uchwytach.
7. Włączyć grzanie pieców.
Upewnić się, że odczyt temperatury pieca jest z termopary
wewnętrznej pieca
.
8. Po osiągnięciu zadanej temperatury
przełączyć odczyt temperatury na termoparę zewnętrzną
(znajdującą się w kwarcowej rurce umieszczonej w stopie) i
wyłączyć grzanie danego pieca
.
Rejestracja wyników pomiarowych następuje dla wszystkich mierzonych próbek automatycznie.
4. Sposób przygotowania sprawozdania
1. Sporządzić wykresy zależności temperatury stopu od czasu T = f(t) (dla części pomiarowej
związanej z chłodzeniem).
2. Odczytać temperatury odpowiadające załamaniom i przystankom na krzywych chłodzenia dla
wszystkich mierzonych próbek. W tym celu przygotować wykresy: pierwszej pochodnej (dla
punktów przystankowych) oraz pierwszej i drugiej pochodnej (dla załamań na krzywych
chłodzenia) obliczone numerycznie.
3. Temperatury przystanków i załamań zestawić w tabeli oraz nanieść na diagram fazowy Sn – Pb.
4. Przeanalizować wyniki w kontekście zgodności z danymi literaturowymi, wskazać możliwe
źródła błędów.
5. Lista pytań do kolokwium pisemnego
1. Wyprowadzenie reguły faz Gibbsa ([1], str. 147-153)
2. Zastosowanie termicznej analizy różnicowej do wyznaczania diagramów fazowych ([1], str.
179-189)
3. Opis diagramu fazowego układu skondensowanego: linia solidusu, linia likwidusu, reguła
dźwigni do wyznaczania udziału wagowego i składu faz ([1], str. 179-189 oraz komentarz 3.4
str. 158, [2] rozdz. 8)
4. Procesy krzepnięcia i krystalizacji (odpowiednie hasła z Wikipedii).
5. Potencjał chemiczny, entalpia swobodna ([1], str. 36-38 oraz 45-47)
6. Równowaga termodynamiczna ([1], 47-49)

Diagram fazowy układu Pb-Sn
8
7. Budowa i zasada działania termopary (odpowiednie hasło z Wikipedii)
8. Obliczenia ilości faz i stopni swobody na podstawi reguły faz Gibbsa ([1], str. 179-189 oraz
w oparciu o przykład w instrukcji)
9. Temperatura i metody jej pomiaru ([2], str. 16-18, odpowiednie hasła z Wikipedii)
10. Znajomość definicji zawartych w instrukcji ([1], str. 3-4 i 179-189 oraz informacje zawarte
w instrukcji)
6. Literatura
1. K. Pigoń, Z. Ruziewicz, Chemia Fizyczna tom 1, PWN 2007
2. P.W. Atkins, Chemia Fizyczna tom, PWN 2000
Wyszukiwarka
Podobne podstrony:
AA diagram fazowy Sn Pb cz5 97
Diagram fazowy Sn Pb ostatni
diagram fazowy KasiaMajcher, Wyznaczanie diagramu fazowego ciecz-para dla układu dwuskładnikowego
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
05 Diagram fazowyid 5671 Nieznany (2)
Diagram fazowy nadprzewodników wysokotemperaturowych(1)
Diagram fazowy Gibbsa id 135431 Nieznany
Patomorfologia, Patologia układu chłonnego i szpiku - ćw., PATOMORFOLOGIA - PATOLOGIA UKŁADU CHŁONNE
Ćwiczenie 6 - diagram fazowy, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium, Chemia
tabela do cw 6 z lab, Studia Budownictwo PB, 5 semestr, laborki metal
ćw.24.Badanie układu napędowego ze sprzęgłem indukcyjnym, Elektrotechnika - notatki, sprawozdania, N
Dany jest silnik asynchroniczny trójfazowy, Dany jest silnik asynchroniczny trójfazowy ( 3 - fazowy
Instrukcja do ćw 02 Modernizacja układu sterowania
Diagram fazowy
Wykres diagram fazowy(3)
Stop Pb i Sn
więcej podobnych podstron