
1
LABORATORIUM Z ANALIZY
JAKOŚCIOWEJ

2
OBOWIĄZUJĄCY ZAKRES MATERIAŁU
I. Kolokwium
1. Własności kwasów i zasad. Dysocjacja elektrolityczna kwasów, zasad i soli. Stopień
dysocjacji. Mocne i słabe elektrolity. Hydroliza.
2. Charakterystyka kwasu siarkowego, azotowego, solnego oraz zasad: sodowej, potasowej i
amonowej.
3. Reakcje umożliwiające wykrycie kwasów: siarkowego, azotowego, solnego i octowego
oraz zasad: sodowej, potasowej i amonowej /równania reakcji, barwy i rozpuszczalność
osadów/.
4. Cel i metody analizy jakościowej.
5. Rodzaje odczynników w analizie .
II. Kolokwium
1. Podział kationów na grupy analityczne - odczynniki grupowe. Tioacetamid.
2. Reakcje charakterystyczne I, II, grupy kationów /równania reakcji, kolory osadów,
rozpuszczalność osadów/.
III. Kolokwium
1. III grupa kationów - odczynnik grupowy i reakcje charakterystyczne /równania reakcji,
barwy i rozpuszczalność osadów/.
2. Reakcja hydrolizy siarczku amonu i jej konsekwencje dla toku analizy.
IV. Kolokwium
1. IV i V grupa kationów - odczynnik grupowy i reakcje charakterystyczne /równania reakcji,
barwy i rozpuszczalność osadów
2. Reakcja hydrolizy węglanu amonowego i jej konsekwencje dla toku analizy.
V. Kolokwium
1. Podział anionów na grupy analityczne.
2. Reakcje charakterystyczne chlorków, siarczanów (VI), azotanów (V) i fosforanów (V).
Materiały do przygotowania
1. Instrukcje: „Laboratorium z chemii nieorganicznej”, kierunek: Inżynieria chemiczna.
2. B.Jankiewicz, I. Ludomirska, A.Korczyński - Analiza jakościowa. Skrypt Politechniki
Łódzkiej, Łódź 1994.
3. K.Badowska-Olenderek, J.Czyżewski, J.Naumczyk - Laboratorium podstaw chemii
analitycznej. Oficyna Wydawnicza Politechniki Warszawskiej, Warszawa 1997.

3
4. T.Lipiec, Z. S. Szmal - Chemia analityczne z elementami analizy instrumentalnej. PZWL,
Warszawa 1972.
5. W.N.Aleksiejew - Analiza Jakościowa. /IV wydanie/, PWN, Warszawa 1968.
6. J. Masłowska, R. Sołoniewicz – Schematy analizy jakościowej kationów /III wydanie/, .
Skrypt Politechniki Łódzkiej, Łódź 1994

4
JAKOŚCIOWA ANALIZA NIEORGANICZNA
Przedmiot chemii analitycznej. Cel i metody analizy jakościowej
Definicja chemii analitycznej:
Jest to nauka stosowana, zajmująca się odkrywaniem i formułowaniem praw,
kryteriów i metod umożliwiających ustalenie z określoną czułością, precyzją
i dokładnością jakościowego i ilościowego składu obiektów materialnych.
Chemia analityczna ma dwa cele:
• Cel praktyczny: ustalenie składu obiektów materialnych
• Cel podstawowy: badania nad opracowaniem nowych metod analitycznych
Cel praktyczny chemii analitycznej dokonuje się poprzez:
• Analizę chemiczną i
• Analizę instrumentalną.
Metody analizy chemicznej i instrumentalnej stosuje się do:
• identyfikacji składników badanej substancji (analiza jakościowa)
• określenie składu ilościowego badanej substancji (analiza ilościowa).
Metody analizy chemicznej zwane także klasycznymi wykorzystują odpowiednie reakcje
chemiczne, które pozwalają wykryć i oznaczyć ilościowo badany składnik.
Metody analizy instrumentalnej wykorzystują charakterystyczne właściwości fizyczne
lub fizykochemiczne substancji do jej identyfikacji i ilościowego oznaczenia. Do metod
instrumentalnych analizy należą metody spektroskopowe, elektrochemiczne,
chromatograficzne, radiometryczne i analizy termicznej.
Metody chemiczne są często pomocne w analizie instrumentalnej i tylko umiejętne
posługiwanie się metodami klasycznymi, jak i instrumentalnymi zapewnia prawidłowe
wykonanie zadań analitycznych.
Wśród chemicznych metod analizy jakościowej istnieje podział na:
• Analizę przeprowadzaną "na sucho", polegającą na badaniu substancji bez
przeprowadzania jej do roztworu (np. charakterystyczne barwienie płomienia, stapianie
z sodą, zachowanie podczas prażenia),
• Analizę przeprowadzaną "na mokro", w której badane składniki (jony) znajdują się
w toku analizy w roztworze.
W analizie "na mokro" wykorzystuje się reakcje chemiczne o czułości od 50 do
0,001
µg/⋅cm
3
. Przebiegają one między składnikami badanymi (jonami) a stosowanymi
odczynnikami.
Odczynniki można podzielić na:
• Specyficzne, dające w określonych warunkach reakcję tylko z danym jonem
(tzn. umożliwiające wykrycie go w obecności innych); jest ich bardzo niewiele,
• Selektywne, reagujące podobnie z pewną grupą jonów,

5
• Maskujące, wiążące w trwały związek jon uboczny (przeszkadzający) i wyłączające go
z udziału w roztworze,
• Grupowe, wykazujące zdolność wytrącania określonej kategorii jonów z roztworu w
pewnych warunkach i umożliwiające podział ich na tzw. grupy analityczne,
• Charakterystyczne, za pomocą, których dokonuje się identyfikacji jonów wewnątrz
grupy.
Podział analizy jakościowej na analizę kationów i anionów, a tych - na grupy
analityczne, stanowi duże ułatwienie w przebiegu analizy.

6
Ćwiczenie nr 1.
Identyfikacja i własności podstawowych kwasów i zasad.
Zagadnienia teoretyczne - własności kwasów i zasad, dysocjacja elektrolityczna
kwasów i zasad, stała i stopień dysocjacji, mocne i słabe kwasy i zasady.
Wiadomości ogólne
Za podstawę klasyfikacji różnych substancji chemicznych na kwasy i zasady oraz
takie które nie są kwasami ani zasadami początkowo przyjęto spostrzeżenia z badań
doświadczalnych. Badania substancji ujawniły wspólne charakterystyczne cechy kwasów i
zasad. Za typowe własności kwasowe przyjęto: kwaśny smak roztworów, zmiany
zabarwienia barwników roślinnych (np. lakmusu) oraz specyficzne działanie na metale i
alkalia połączone często z wydzieleniem gazowego wodoru. Także roztwory wodne
wodorotlenków posiadają typowe własności np. gorzki smak, są śliskie w dotyku i
zobojętniają kwasy.
Istnieje wiele substancji o własnościach podobnych do własności kwasów lub zasad,
które jednakże nimi nie są. Obecnie klasyfikacja substancji na kwasy i zasady opiera się na
powiązaniu własności kwasowo-zasadowych ze strukturą cząsteczkową i jonową. Istnieje
szereg teorii kwasów i zasad. Najstarszą z nich jest teoria Arrheniusa (1884) definiująca
kwasy jako substancje odszczepiające w roztworach wodnych jony wodorowe H
+
zaś zasady
odszczepiają jony wodorotlenowe OH
-
. Obecnie powszechną jest teoria Brönsteda -
Lowry’ego (1923) wg której kwasy określa się jako substancje zdolne do oddawania protonu
H
+
(donory protonu), natomiast zasady jako substancje zdolne do przyłączenia protonu
(akceptory protonu). Kwas HA odając proton H
+
staje się zasadą.
HA
⇔ H
+
+ A
-
kwas
zasada
W przemyśle chemicznym jak również w laboratorium chemicznym stosuje się wiele
różnych kwasów i zasad. Do najważniejszych z nich należą kwasy: siarkowy, solny i azotowy
oraz zasady: sodowa, potasowa i amonowa. Oczywiście w procesach przemysłowych nie
zawsze są potrzebne roztwory o wysokiej czystości, jaka jest wymagana dla odczynników
laboratoryjnych.

7
Krótka charakterystyka niektórych kwasów i zasad.
Kwas siarkowy H
2
SO
4
jest gęstą, oleistą cieczą o gęstości 1.84 g/cm
3
. W przemyśle
używany jest jako stężony kwas siarkowy 93.2 -% owy. Laboratoryjny czysty kwas jest
ok. 98- % owym roztworem. Bardziej stężony roztwór kwasu tj. 100 %- owy H
2
SO
4
istnieje
pod nazwą oleum i zawiera wolny trójtlenek siarki.
Wszelkie operacje z kwasem siarkowym należy wykonywać z dużą ostrożnością
z uwagi na jego silne właściwości żrące.
Stężony kwas siarkowy jest odczynnikiem utleniającym (zwłaszcza na gorąco)
i doskonałym środkiem odwadniającym.
Kwas solny HCl jest roztworem chlorowodoru w wodzie. Stężony kwas solny jest
38 %- owym roztworem o gęstości 1.19 g/cm
3
. Podczas ogrzewania stężenie kwasu obniża się
do ok. 20 % HCl, co odpowiada mieszaninie azeotropowej o temperaturze wrzenia 110
o
C.
Kwas solny jest kwasem nieutleniającym; rozpuszcza metale aktywne chemicznie
takie jak np.: Fe, Zn, Al, Mg.
Mieszanina stężonych kwasów solnego i azotowego (w stosunku objętościowym 3:1)
tzw. woda królewska jest silnym środkiem utleniającym.
Kwas solny tak silnie koroduje metale, że musi być przepompowywany przez rury
szklane lub plastikowe i w takich naczyniach należy go przechowywać. Handlowy kwas
solny jest zwykle zabarwiony na kolor żółtobrunatny wskutek obecności żelaza oraz innych
zanieczyszczeń.
Kwas azotowy HNO
3
stężony jest 68 %-owym roztworem HNO
3
w wodzie
o gęstości 1.4 g/cm
3
. Jest nietrwały, rozkłada się już w temperaturze pokojowej wydzielając
NO
2
. Tlenek ten nadaje roztworowi brunatno-żółte zabarwienie, które jest charakterystyczne
dla kwasu azotowego przechowywanego przez pewien okres czasu. Stężony kwas azotowy
ma silne własności utleniające i rozpuszcza m.in. Ag, As, Bi, Cu. Stężony kwas azotowy nie
rozpuszcza żelaza, glinu i chromu, ponieważ na powierzchni tych metali powstaje cienka
warstewka tlenku chroniąca metal przed działaniem kwasu (pasywacją).
Stężony kwas azotowy działa silnie żrąco na ciało ludzkie powodując trudno gojące
się oparzenia. Rozcieńczony reaguje z białkami skóry tworząc tzw. kwasy ksantoproteinowe
barwiące skórę na kolor żółtobrunatny. Natomiast tlenki azotu są silnie trujące i działają
drażniąco na przewód oddechowy.

8
Wodorotlenek sodowy NaOH jest dostarczany do laboratorium w postaci lasek lub
granulek. W obu postaciach chłonie wilgoć z powietrza i na jego powierzchni tworzy się
szybko nasycony roztwór wodorotlenku sodowego o własnościach silnie żrących.
Roztwór nasycony w wodzie o stężeniu 20 mol/dm
3
posiada gęstość 1.55 g/cm
3
.
Wodorotlenek sodowy nazywa się potocznie sodą żrącą, a jego roztwór ługiem sodowym.
Mają one wiele cennych zastosowań zarówno w laboratorium jak i w przemyśle
(np. do produkcji mydła i środków piorących, oczyszczania olejów roślinnych, w przemyśle
papierniczym).
Wodorotlenek potasowy KOH ze względu na stosunkowo wysoką cenę ma
mniejsze zastosowanie w przemyśle chemicznym, natomiast jest powszechnie używany
w laboratorium. Jest silnie higroskopijny i bardzo dobrze pochłania dwutlenek węgla.
Nasycony roztwór wodorotlenku potasowego w wodzie (ok. 52%-owy) posiada gęstość
1.53 g/cm
3
.
Zasada amonowa NH
4
OH jest wynikiem wychwytywania protonów przez amoniak
i tworzenia jonów amonowych wskutek czego w roztworze powstaje nadmiar jonów
wodorotlenowych.
NH
3
+ H
2
O
→ NH
4
+
+ OH
-
Amoniak jest wrzącym gazem w temperaturze - 33.4°C. Pod ciśnieniem ok. 10 atm.
skrapla się w temperaturze 25°C. Dobrze rozpuszcza się w wodzie. Stężony roztwór wodny
amoniaku zwany wodą amoniakalną (NH
3
·H
2
O) o gęstości 0.88 g/cm
3
zawiera ok. 34 %mas.
NH
3
co odpowiada stężeniu 17.7 mol/dm
3
.
Wykonanie ćwiczenia
Do probówki pobrać po kilka kropli roztworów rozcieńczonych kwasów HCl, HNO
3,
H
2
SO
4
i CH
3
COOH oraz zasad NaOH, KOH i NH
4
OH.
1) sprawdzić odczyn za pomocą wskaźnika pH (papierka wskaźnikowego)
2) przeprowadzić reakcje wg schematu (str.4) zapisując jednocześnie równania
zachodzących w roztworze reakcji wg załączonej tabeli.
Uwaga: Równania reakcji odpowiednich kationów (dla zasad) i anionów
(dla kwasów) są podane przy następnych ćwiczeniach.

9
Kwas lub
zasada
Odczynniki i czynności
Obserwacje i równanie reakcji
2 krople
2 M HCl
1) 2 krople r-ru AgNO
3
2) wytrącony osad rozpuścić w r-rze
NH
4
OH (ok. 6 kropli) i ponownie
wytrącić za pomocą 6 M. HNO
3
ok. (2 krople)
1) Cl
-
+ Ag
+
→ AgCl↓ biały osad
2) AgCl + 2 NH
4
OH →
[Ag(NH
3
)
2
]Cl
[Ag(NH
3
)
2
]Cl + 2 HNO
3
→
AgCl↓ + 2 NH
4
NO
3
1-2 krople
2 M H
2
SO
4
1-2 krople r-ru BaCl
2
SO
4
2-
+ Ba
2+
→ BaSO
4
↓
1-2 krople
(1:1) HNO
3
2 wiórki metalicznej miedzi
zwrócić uwagę na barwę roztworu i
zapach wydzielających się tlenków azotu
3 Cu + 2 NO
3
-
+ 8 H
+
→ 3 Cu
2+
+
2 NO + 4 H
2
O
2 NO + O
2
→ NO
2
3 krople
stęż
CH
3
COOH
1-3 krople stęż. H
2
SO
4
kwas siarkowy wypiera z roztworu
octanów wolny kwas octowy
zapach octu
3 M.NaOH
r-r NaOH wprowadzony na druciku
platynowym do płomienia palnika
gazowego
trwałe, intensywnie żółte
zabarwienie płomienia.
1-2 krople
6 M KOH
.
1) 1 kropla azotynokobaltanu
sodowego
2) próba na zabarwienie płomienia
analogicznie do próby na NaOH
1) żółty osad
reakcja str. 24
2) jasnofioletowy kolor płomienia
2 M NH
4
OH
1) 5-6 kropli NH
4
OH + 3 krople mocnej
zasady np. 6 M. KOH/
2) 1-2 krople azotynokobaltanu sodowego
+ 1-2 krople NH
4
OH
3) 2 krople NH
4
OH + 10 kropli wody + 2
krople odczynnika Nesslera/
1) zapach gazowego amoniaku
2) żółty osad
reakcja str.25
3) pomarańczowo-brunatny osad
rekcja str.25

10
2. Podział kationów na grupy analityczne
Podstawą klasyfikacji analitycznej kationów jest podział kationów na odpowiednie
grupy analityczne, który umożliwia systematyczny tok analizy kationów. Podstawą podziału
są reakcje tworzenia trudno rozpuszczalnych osadów oznaczanych kationów z
odczynnikami grupowymi takimi jak kwas solny, siarkowodór, siarczek amonu, węglan
amonu. Głównym celem stosowania tych odczynników jest dokładne oddzielenie
analitycznych grup kationów z mieszaniny kationów. Zastosowanie właściwego odczynnika
grupowego pozwala szybko wykazać obecność lub brak jonów danej grupy w badanej próbce
roztworu
Klasyczny podział 28 najczęściej występujących kationów, dokonany przez
C.R. Freseniusa, obejmuje pięć następujących grup analitycznych:
I grupa analityczna (grupa kwasu solnego).
Do tej grupy zaliczamy jony
Ag
+
, Pb
2+
, Hg
2
2+
, które w roztworze 2 M HCl tworzą trudno rozpuszczalne chlorki. Chlorki
są nierozpuszczalne w rozcieńczonych kwasach mineralnych z wyjątkiem PbCl
2
. Siarczki
tych kationów nie rozpuszczają się w rozcieńczonych kwasach.
II grupa analityczna (grupa siarkowodoru).
Do tej grupy należą kationy:
Hg
2+
, Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
, As(III), As(V), Sb(III), Sb(V), Sn(II) Sn(IV) strącane przez
H
2
S z kwaśnego roztworu (0.2-0.3 M HCl pH~0.5).
III grupa analityczna (grupa siarczku amonu).
Obejmuje kationy Al
3+
,
Cr
3+
, Fe
3+
, Co
2+
, Ni
2+
, Mn
2+
, Zn
2+
, których siarczki są trudno rozpuszczalne w wodzie, a
łatwo rozpuszczalne w rozcieńczonych kwasach. Wyjątek stanowią jony Al
3+
i Cr
3+
, które
pod wpływem odczynnika grupowego tworzą trudno rozpuszczalne wodorotlenki.
Odczynnikiem grupowym III grupy jest (NH
4
)
2
S, w środowisku alkalicznym, obecność
buforu amonowego (NH
4
OH + NH
4
Cl), który strąca odpowiednie siarczki lub wodorotlenki
Al(OH)
3
i Cr(OH)
3
.
IV grupa analityczna (grupa węglanu amonowego).
Występujące w tej
grupie jony: Ca
2+
, Sr
2+
, Ba
2+
są strącane przez (NH
4
)
2
CO
3
w obecności buforu amonowego
(NH
4
OH + NH
4
Cl) w postaci trudno rozpuszczalnych węglanów.
V grupa analityczna (brak odczynnika grupowego).
Do grupy zalicz
a
ne
są kationy: Na
+
, K
+
, NH
4
+
, Mg
2+
, które pozostają w roztworze po kolejnym oddzieleniu
kationów grup I-IV. Jony tej grupy nie mają odczynnika grupowego. Chlorki, siarczki i
weglany tej grupy są rozpuszczalne w wodzie. Wyjatek stanowi zasadowy węglan
dihydroksymagnezu Mg
2
(OH)
2
CO
3
, który jest trudno rozpuszczalny w wodzie, ale łatwo jest
rozpuszczalny w roztworach soli amonowych i nie ulega strąceniu, jeżeli do roztworu doda
się NH
4
Cl.
Szczegółowy podział kationów na grupy analityczne przedstawiono jest na poniższym
schemacie.
Obecnie tok analizy kationów oparty jest na stosowaniu 0.5 M wodnego roztworu
tioacetamidu zamiast siarkowodoru i siarczku amonu. Związki siarkodoru są szkodliwe dla
zdrowia, charakteryzują się wyjątkowo przykrym zapachem.
Tioacetamid hydrolizuje w środowisku kwaśnym lub alkalicznym, podczas
ogrzewania, z utworzeniem siarkowodoru, który w chwili powstania wytrąca osady
odpowiednich siarczków. Ten sposób wytrącania siarczków z roztworów homogenicznych
daje siarczki o zwartej, grubokrystalicznej strukturze, łatwe do sączenia i przemywania,
co ułatwia analizę.

11
H
3
C
C
S
NH
2
+
2 H
2
O
H
2
S
+ H
3
C
C
O
O
+
NH
4
tioacetamid
H
+
lub OH
-
Przy omawianiu reakcji charakterystycznych w poszczególnych grupach
analitycznych uwzględniono tylko niektóre kationy, a mianowicie: Ag
+
, Pb
2+
, Hg
2+
,Cu
2+
,
Cd
2+
, Ni
2+
, Cr
3+
, A1
3+
,Fe
3+
, Zn
2+
, Mn
2+
, Ca
2+
,Mg
2+
,K
+
,NH
4
+
.
Są to kationy najczęściej spotykane w środowisku jako jego składniki naturalne lub
zanieczyszczenia oraz występujące w odczynnikach chemicznych stosowanych w procesach
technologicznych inżynierii środowiska
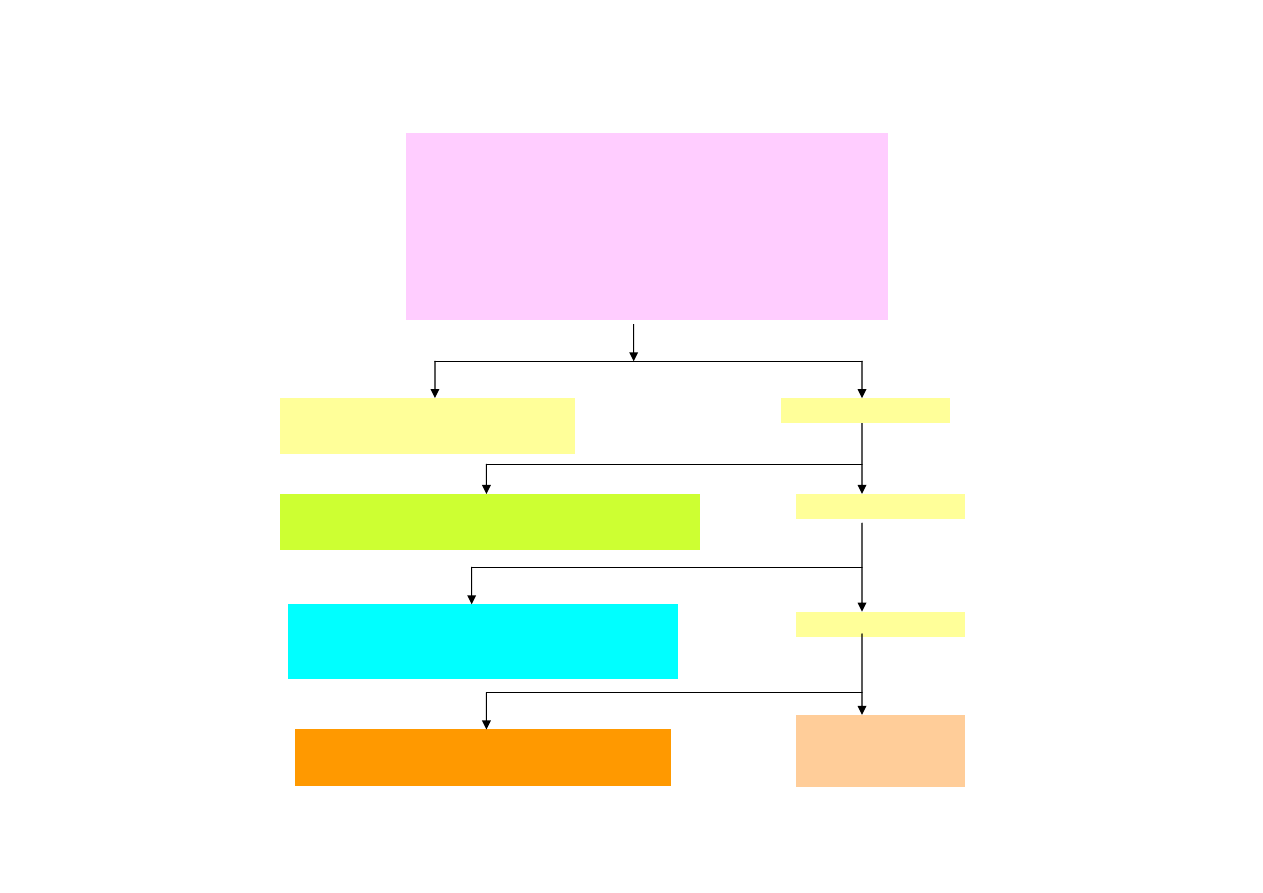
12
Kationy wszystkich grup:
Ag
+
, Pb
2+
, Hg
2
2+
- I grupa
Cu
2+
, Bi
3+
, Cd
2+
, Pb
2+
, Hg
2+
, As(III,V), Sb(III,V), Sn(II,IV) –II grupa
Al
3+
, Cr
3+
, Fe
2+
, Fe
3+
, Co
2+
, Ni
2+
, Zn
2+
, Mn
2+
-III grupa
Ca
2+
, Sr
2+
, Ba
2+
- IV grupa
NH
4
+
, Na
+
, K
+
, Mg
2+
- V grupa
Rozdział kationów na grupy analityczne wg
Grupa I – chlorki trudno rozp. w H
2
O
AgCl, PbCl
2
, Hg
2
Cl
2
Pozostałe kationy
(NH
4
)
2
S lub AKT + bufor amonowy
Pozostałe kationy
Grupa II– nierozpuszczalne w rozcień. kwasach siarczki
CuS, Bi
2
S
3
, CdS, PbS, HgS, As
2
S
3
, As
2
S
5
, Sb
2
S
3
, SnS
2
H
2
S lub AKT + 0.2 M
wytrącanie
Grupa III– rozpuszczalne w kwasach siarczki,
nierozpuszczalne w zasadach siarczki i wodorotlenki
Al(OH)
3
, Cr(OH)
3
, Fe(OH)
3
, ZnS, NiS, CoS, MnS
Grupa IV – nierozpuszczalne w H
2
O węglany
CaCO
3
, SrCO
3
, BaCO
3
Pozostałe kationy
Pozostałe kationy:
Grupa V:
NH
4
+
, Na
+
, K
+
, Mg
2+
(NH
4
)
2
CO
3
+ bufor amonowy
2 M HCl
wytrącanie
wytrącanie
wytrącanie

13
3. Reakcje charakterystyczne wybranych kationów I grupy
Reakcje jonu srebra Ag+
1. HCl wytrąca serowaty osad chlorku srebra AgC
l
Ag
+
+ Cl
-
→ AgCl↓
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 - 3 krople 2M HCl do wytrącenia osadu.
Jest to osad ciemniejący na świetle (fotochemiczny rozkład na srebro i chlor),
nierozpuszczalny w 2M HNO
3
, rozpuszczalny w amoniaku z utworzeniem
kompleksowego związku - chlorku diaminasrebra
AgCl + 2 NH
4
OH → [Ag(NH
3
)
2
]Cl + H
2
O
2. NaOH, KOH wytrącają nietrwały wodorotlenek srebra rozkładający się na tlenek
srebra i wodę
2 Ag
+
+ 2 NaOH → Ag
2
O↓ + H
2
O+ 2 Na
+
ciemnobrunatny
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 - 3 krople 3 M. NaOH do wytrącenia osadu.
3.NH
4
OH wytrąca biały, brunatniejący osad rozpuszczalny w nadmiarze odczynnika
z utworzeniem wodorotlenku diaminasrebra
2 Ag
+
+ 2 NH
4
OH → Ag
2
O↓ + H
2
O+ 2 NH
4
+
Ag
2
O + 4 NH
4
OH → 2 [Ag(NH
3
)
2
]OH + 3 H
2
O
Wykonanie: Próbę należy wykonać w suchej probówce. Do 3 kropli badanego roztworu dodaj 1 -2
krople NH
4
OH (do oznaczania Ag
+
) - widać zmętnienie /powstał osad AgCl/. Dodanie dalszych 2 - 3
kropli roztworu NH
4
OH powoduje rozpuszczenie osadu.
4. KJ wytrąca osad jodku srebra
Ag
+
+J
-
→ AgJ↓
żółtozielonkawy
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj kroplami KJ do wytrącenia osadu.
5. K
2
CrO
4
wytrąca osad chromianu(VI) srebra
2 Ag
+
+ CrO
4
2-
→ Ag
2
CrO
4
↓
czerwonobrunatny
Osad ten rozpuszcza się w rozcieńczonym HNO
3
i w NH
4
OH.
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople K
2
CrO
4
do wytrącenia osadu.
Reakcje jonu ołowiu (II) Pb
2+
1. HCl wytrąca osad chlorku ołowiu(II)
Pb
2+
+ 2 Cl
-
→ PbCl
2
↓
biały
Chlorek ołowiu (II) rozpuszcza się w gorącej wodzie, a po oziębieniu krystalizuje w
postaci drobnych blaszek.
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 2 M. HCl do wytrącenia osadu.
W celu rozpuszczenia osadu należy wstawić probówkę zawierająca roztwór z osadem do łaźni
z gorącą wodą. Następnie ochłodzić roztwór w zlewce z zimną wodą (wytrąci się osad).

14
2. NaOH, KOH wytrącają osad wodorotlenku ołowiu (II) o właściwościach
amfoterycznych, rozpuszczalny w nadmiarze odczynnika i w kwasach
Pb
2+
+ 2 OH
-
→ Pb(OH)
2
↓
biały
Pb(OH)
2
+ 2 NaOH → Na
2
PbO
2
+ 2 H
2
O
Pb(OH)
2
+ 2 HNO
3
→ Pb(NO
3
)
2
+ 2 H
2
O
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 3 M. NaOH do wytrącenia osadu.
3. NH
4
OH wytrąca osad wodorotlenku ołowiu (II) nierozpuszczalny w nadmiarze
odczynnika
Pb
2+
+ 2 NH
4
OH → Pb(OH)
2
↓ + 2 NH
4
+
biały
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 5 - 6 kropli 2 M. NH
4
OH do wytrącenia osadu.
4. KJ wytrąca osad jodku ołowiu (II)
Pb
2+
+ 2J
-
→ PbJ
2
↓
żółty
Jodek ołowiu (II) rozpuszcza się w gorącej wodzie, a po oziębieniu krystalizuje.
Wykonanie: Do 1 kropli badanego roztworu dodaj 1 kroplę roztworu KJ i 2 krople 2 M. roztworu
CH
3
COOH (wytrąci się żółty osad). Dodaj ok. 2 ml wody i ogrzewaj probówkę do rozpuszczenia
osadu na wrzącej łaźni wodnej. Po oziębieniu w zlewce z zimną wodą krystalizuje piękny,
błyszczący, żółty osad. Jest to jedna z najpiękniejszych reakcji analitycznych.
5. K
2
CrO
4
wytrąca osad chromianu (VI) ołowiu (II)
Pb
2+
+ CrO
4
2-
→ PbCrO
4
↓
żółty
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 2 M roztworu CH
3
COOH i 1 - 2
krople roztworu K
2
CrO
4
.
4. Reakcje charakterystyczne wybranych kationów II grupy
Reakcje jonu rtęci (II) Hg
2+
1. H
2
S wytrąca barwne osady soli podwójnych (np.HgCl
2
·2HgS), w których sole
rtęci (II)połączone są w różnych stosunkach. Barwa osadu zmienia się w miarę
dodawania odczynnika, od białej poprzez żółtobrunatną i brunatną do czarnej
Hg
2+
+ S
2-
→ HgS↓
czarny
Osad rozpuszcza się w wodzie królewskiej (1 obj. HNO
3
stęż. + 3 obj. HCl stęż.).
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 2 M roztworu HCl i 2 - 3 krople
roztworu AKT. Mieszaninę ogrzać na łaźni wodnej 8 - 10 min.
2. NaOH, KOH wytrącają osad tlenku rtęci (II)
Hg
2+
+ 2 OH
-
→ HgO↓ + H
2
O
żółty

15
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 3 M roztworu NaOH. Wytrąca się
czerwonobrązowy osad przechodzący w nadmiarze odczynnika strącającego w żółty.
3. NH
4
OH wytrąca osady soli amino- lub tlenoaminortęci (II)
HgCl
2
+ 2 NH
4
OH
→ HgNH
2
Cl↓ + NH
4
Cl + 2 H
2
O
biały
2 Hg(NO
3
)
2
+ 4 NH
4
OH
O
Hg
NH
2
NO
3
+ NH
4
NO
3
+ 3 H
2
O
Hg
biały
Wykonanie: Do 2 - 3 kropli badanego roztworu dodawaj 1 - 2 krople 3 M roztworu NH
4
OH aż do
uzyskania odczynu zasadowego i wytrącenia osadu.
4. KJ wytrąca osad jodku rtęci (II), rozpuszczalny w nadmiarze odczynnika z
utworzeniem związku kompleksowego - jodortęcianu (II) potasu
Hg
2+
+ 2 J
-
→ HgJ
2
↓
czerwony
HgJ
2
+ 2 KJ
→ K
2
[HgJ
4
]
bezbarwny
Wykonanie: Do 2 kropli badanego roztworu dodaj 1 kroplę 0.1 M. roztworu KJ (wytrąci się osad).
Następnie dodaj dalsze 1 - 2 krople roztworu KJ do rozpuszczenia osadu.
Reakcje jonu miedzi(II) Cu
2+
1. H
2
S wytrąca osad siarczku miedzi (II)
Cu
2+
+ S
2-
→ CuS↓
czarny
Siarczek miedzi (II) rozpuszcza się w gorącym 2 M HNO
3
.
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 - 2 krople 2 M roztworu HCl i 2 - 3 krople
roztworu AKT. Mieszaninę ogrzewać na łaźni wodnej 8 - 10 min.
2. NaOH, KOH wytrącają osad wodorotlenku miedzi (II), który przy podgrzaniu
przechodzi w tlenek
Cu
2+
+ 2 OH
-
→ Cu (OH)
2
↓
niebieskozielony
Cu(OH)
2
→ CuO↓ + H
2
O
brunatnoczerwony
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 1 kroplę 3 M roztworu NaOH.
3. NH
4
OH wytrąca osad wodorotlenku miedzi (II), rozpuszczalny w nadmiarze
amoniaku z utworzeniem związku kompleksowego wodorotlenku
tetraaminamiedzi (II)
Cu
2+
+ 2 NH
4
OH → Cu (OH)
2
↓ + 2 NH
4
+
niebieskozielony
Cu(OH)
2
+ 4 NH
4
OH → [Cu(NH
3
)
4
](OH)
2
+ 4 H
2
O
szafirowy
Wykonanie: Do 2 - 3 kropli badanego roztworu powoli dodawaj kroplami 0.5 M roztwór NH
4
OH aż
do wytrącenia osadu, i dalej aż do jego rozpuszczenia.

16
4. KJ wytrąca osad jodku miedzi (II), który rozkłada się na jodek miedzi (I) z
równoczesnym wydzieleniem jodu
2 Cu
2+
+ 4 J
-
→ 2 CuJ
2
↓
→ Cu
2
J
2
↓ + J
2
↑
czarny biały czerwonobrunatny
Wykonanie: Do 1 kropli badanego roztworu dodaj 1 kroplę roztworu KJ.
5. K
4
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu (II) miedzi (II)
2 Cu
2+
+ [Fe(CN)
6
]
4-
→
Cu
2
II
[Fe
II
(CN)
6
] ↓
czerwonobrunatny
Jest to reakcja bardzo czuła. W roztworach rozcieńczonych powstaje tylko
czerwonawe zabarwienie.
Wykonanie: Do 1 kropli badanego roztworu dodaj 1 - 2 krople roztworu K
4
[Fe(CN)
6
]
.
Reakcje jonu kadmu (II) Cd
2+
1. H
2
S wytrąca osad siarczku kadmu (II)
Cd
2+
+ S
2-
→ CdS↓
żółty
Wykonanie: Do 3 - 5 kropli badanego roztworu dodaj 1 kroplę 2 M. roztworu HCl i 2-3 krople
roztworu AKT. Mieszaninę należy ogrzać na łaźni z wrzącą wodą ok. 5 min.
2. NaOH, KOH wytrącają osad wodorotlenku kadmu (II)
Cd
2+
+ 2 OH
-
→ Cd(OH)
2
↓
biały
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 - 3 krople 3 M. roztworu NaOH.
3. NH
4
OH wytrąca osad wodorotlenku kadmu (II), rozpuszczalny w nadmiarze
amoniaku z utworzeniem związku kompleksowego- wodorotlenku tetra-
aminakadmu (II)
Cd
2+
+ 2 NH
4
OH → Cd(OH)
2
↓ + 2 NH
4
+
biały
Cd(OH)
2
+ 4 NH
4
OH → [Cd(NH
3
)](OH)
2
+ 4 H
2
O
bezbarwny
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 - 3 krople 3 M. roztworu
NH
4
OH do
zmętnienia (osad) i dalsze 4 - 5 kropli do rozpuszczenia osadu.
4. KJ nie daje osadu.

17
5. Reakcje charakterystyczne wybranych kationów III grupy
Odczynnikiem grupowym III grupy jest siarczek amonu (NH
4
)
2
S. Ponieważ jest to
sól w dość znacznym stopniu zdysocjowana, stężenie jonów siarczkowych S
2-
jest
wystarczające do przekroczenia iloczynów rozpuszczalności siarczków kationów III grupy i
wytrącenia osadów. Iloczyny rozpuszczalności tych siarczków są bowiem znacznie większe
od iloczynów rozpuszczalności siarczków II grupy (np. I
r CuS
= 8.0
⋅10
-36
; I
r MnS
= 1.0
⋅10
-11
).
Aby zapobiec hydrolizie siarczku amonowego, stosuje się dodatek NH
4
OH (przesunięcie
równowagi reakcji hydrolizy w lewo).
(NH
4
)
2
S + 2 H
2
O ↔2 NH
4
OH + H
2
S↑
Oprócz amoniaku należy dodać do roztworu kationów III grupy chlorku amonu,
NH
4
Cl. Z jednej strony zapobiega to strącaniu się wodorotlenku magnezu, Mg(OH)
2
pod
wpływem amoniaku, a z drugiej przeszkadza w powstawaniu koloidalnych roztworów
siarczków i wodorotlenków III grupy, pod warunkiem, że proces strącania prowadzony jest z
roztworu ogrzanego uprzednio do wrzenia.
Reakcje jonu niklu (II) Ni
2+
1. (NH
4
)
2
S wytrąca osad siarczku niklu(II)
Ni
2+
+ S
2-
→ NiS↓
czarny
Osad nie rozpuszcza się w rozcieńczonych kwasach.
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 4-5 kropli 2 M r-ru
NH
4
Cl i 1 kroplę 2 M r-ru
NH
4
OH do odczynu zasadowego (sprawdź odczyn roztworu papierkiem uniwersalnym). Do
przygotowanej mieszaniny dodać 3-4 krople AKT i całość ogrzewać na łaźni z wrzącą wodą 10-15
min.
2. NaOH, KOH wytrącają osad wodorotlenku niklu (II)
Ni
2+
+ 2 OH
-
→ Ni(OH)
2
↓
zielony
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 5-6 kropli roztworu
NaOH lub KOH i 4-5
kropli wody chlorowej. Mieszaninę ogrzać.
3.
NH
4
OH
wytrąca osad soli zasadowych, rozpuszczalny w nadmiarze odczynnika z
utworzeniem kompleksowego jonu heksaaminaniklu (II), np.
NiCl
2
+ NH
4
OH
→ Ni(OH)Cl↓ + NH
4
Cl
zielony
Ni(OH)Cl + 6 NH
4
OH → [Ni(NH
3
)
6
]
2+
+ OH
-
+ Cl
-
+ 6 H
2
O
szafirowofioletowy
Wykonanie: Do 2 - 3 kropli badanego roztworu dodawaj kroplami rozcieńczony roztwór
NH
4
OH.
5. Dimetyloglioksym wytrąca w środowisku obojętnym, octanowym lub
amoniakalnym osad wewnątrzkompleksowej soli niklu (II). Jest to najważniejszy,
specyficzny odczynnik na jony Ni
2+
.

18
Wykonanie: Do 1 2 kropli badanego roztworu dodać 1-2 krople 1% roztworu dimetyloglioksymu w
alkoholu metylowym. Powstaje różowy osad.
Reakcje jonu chromu (III) Cr
3+
1. (NH
4
)
2
S wytrąca osad wodorotlenku chromu (III)
2 Cr
3+
+ 3 S
2-
+ 6 H
2
O
→ 2 Cr(OH)
3
↓ + 3 H
2
S
szarozielony
Wykonanie: Do 2 - 3 kropli badanego roztworu dodać 3 - 4 krople AKT. Dodatek buforu
amonowego Mieszaninę ogrzewać na łaźni z wrzącą wodą 15 - 20 min.
2. NaOH, KOH wytrącają osad wodorotlenku chromu(III)
Cr
3+
+ 3 OH
-
→ Cr(OH)
3
↓
szarozielony
Wodorotlenek chromu(III) ma właściwości amfoteryczne, rozpuszcza się w
nadmiarze odczynnika i w kwasach.
Cr(OH)
3
+ NaOH → NaCrO
2
+ 2 H
2
O lub Cr(OH)
3
+ NaOH
-
→ Na[Cr(OH)
4
]
Cr(OH)
3
+ 3 HCl → CrCl
3
+ 3 H
2
O
Wykonanie: Do 2 - 3 kropli badanego roztworu dodać 3 - 4 krople NaOH lub KOH. Mieszaninę
ogrzewać przez ok.10 min.
na łaźni wodnej.
3.
NH
4
OH
wytrąca osad wodorotlenku chromu (III). Osad rozpuszcza się
nieznacznie w nadmiarze amoniaku, ale nie rozpuszcza się w solach amonowych.
Dlatego do wytrącenia można uzyć bufor amonowy (NH
4
OH + NH
4
Cl)
Cr
3+
+ 3 NH
4
OH → Cr(OH)
3
↓ + 3 NH
4
+
szarozielony
Wykonanie: Do 2 kropli badanego roztworu dodać 1 kroplę 3 M NH
4
OH. Powstaje zielonkawy osad.
4. H
2
O
2
w środowisku zasadowym utlenia jony Cr
3+
do CrO
4
2-
2 CrO
2
-
+ 2 OH
-
+ 3 H
2
O
2
→ 2 CrO
4
2-
+ 4 H
2
O
zielony żółty
Wykonanie: Do 2 kropli badanego roztworu dodać 2 krople 3 M roztworu NaOH i 2 krople 3%
roztworu H
2
O
2
. Powstające żółte zabarwienie roztworu jest specyficzne dla powstającego chromianu
(VI).
Nie wylewać otrzymanego roztworu!
5. Difenylokarbazyd w środowisku kwaśnym daje z jonami CrO
4
2-
(otrzymanymi w
poprzedniej reakcji) zabarwienie czerwonofioletowe.
Mechanizm tej reakcji jest prawdopodobnie następujący: chrom (VI) redukuje się do
chromu (III), utleniając przy tym difenylokarbazyd do difenylokarbazonu.
Difenylokarbazon tworzy z powstającymi (in statu nascendi) jonami Cr
3+
czerwonofioletowe zabarwienie (z jonami Cr
3+
reakcja nie zachodzi)
2CrO
4
2-
+ 2 H
+
⇔ Cr
2
O
7
2-
+ H
2
O
Reakcja jest czuła i stosowana w analizie wody do oznaczania chromu.
Wykonanie: Do 3 kropli roztworu (otrzymanego w reakcji 4) dodać 2 krople 2 M H
2
SO
4
i 2 - 3
krople 1 % alkoholowego roztworu difenylokarbazydu. Powstaje czerwonofioletowe zabarwienie.

19
Reakcje jonu glinu Al
3+
1. (NH
4
)
2
S wytrąca galaretowaty osad wodorotlenku glinu (III)
2 Al
3+
+ 3 S
2-
+ 6 H
2
O → 2 Al(OH)
3
↓ + 3 H
2
S
biały
Wykonanie: Do 2 - 3 kropli badanego roztworu dodać 5 - 6 kropli AKT. Dodatek buforu
amonowego Mieszaninę ogrzewać na łaźni z wrzącą wodą 25 - 30 min.
2. NaOH, KOH wytrącają galaretowaty osad wodorotlenku glinu
Al
3+
+ 3 OH
-
→ Al(OH)
3
↓
biały
Wodorotlenek glinu(III) jest amfoteryczny. Rozpuszcza się w nadmiarze odczynnika
i w kwasach
Al(OH)
3
+ NaOH → NaAlO
2
+ 2 H
2
O
Al(OH)
3
+ 3 HCl
→ A1C1
3
+ 3 H
2
O
Wykonanie: Do 2 kropli badanego roztworu dodać 1 kroplę 3 M. roztworu NaOH /wytrąci się osad/ i
następnie dalsze 2 -3 krople do rozpuszczenia powstałego osadu.
3.
NH
4
OH
wytrąca galaretowaty osad wodorotlenku glinu, rozpuszczalny w
nadmiarze odczynnika
Al
3+
+3 NH
4
OH → Al(OH)
3
↓ + 3 NH
4
+
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę 2 M. roztworu NH
4
OH /wytrąci się osad/
i następnie ok. 1 ml roztworu wodorotlenku amonu do rozpuszczenia powstałego osadu.
4. Aluminon - sól amonowa kwasu aurynotrikarboksylowego, tworzy z jonami A1
3+
w środowisku zbuforowanym octanem amonu (optymalne pH
5,3) związek
wewnątrzkompleksowy o różowoczerwonym zabarwieniu.
Jest to czuła reakcja, wykorzystywana w analizie wody do oznaczania glinu.
Wykonanie: Do 5 kropli badanego roztworu dodaj 1 krople roztworu aluminionu. Powstaje
pomarańczowo - czerwony kolor, który podczas ogrzewania przechodzi w intensywny kolor różowo-
czerwony.
Jeśli w badanym roztworze jest obecny jon Zn
2+
(a brak jonu Al
3+
)
to po dodaniu aluminonu
powstaje kompleks słabo różowy, ciemniejący po ogrzaniu.
Reakcje jonu żelaza(III) Fe
3+
1. (NH
4
)
2
S wytrąca osad siarczku żelaza(III)
2 Fe
3+
+ 3 S
2-
+ → Fe
2
S
3
↓
czarny
Osad łatwo rozpuszcza się w kwasach, np. 2 M HCl
Fe
2
S
3
+ 4 HCl → 2 FeCl
2
+ S↓ + 2 H
2
S↑
biały koloidalny osad siarki
Wykonanie: Do 2 kropli badanego roztworu dodać 1 kroplę 2 M. NH
4
OH ( do odczynu słabo
zasadowego) + NH
4
Cl i 2-3 krople AKT. Mieszaninę ogrzewać na łaźni z wrzącą wodą 5 -10 min.
2. NaOH, KOH wytrącają osad wodorotlenku żelaza(III)
Fe
3+
+ 3 OH
-
→ Fe(OH)
3
↓
brunatny

20
Osad ten rozpuszcza się w kwasach, np.
Fe(OH)
3
+ 3 HCl
→ FeCl
3
+ 3 H
2
O
Wykonanie: Do 1- 2 kropli badanego roztworu dodać 1 - 2 krople 3 M. roztworu NaOH aż do
wytrącenia się czerwonobrunatnego osadu.
3. NH
4
OH wytrąca osad wodorotlenku żelaza(III) jak w reakcji z NaOH.
4. K
3
[Fe(CN)
6
] tworzy rozpuszczalną sól - heksacyjanożelazian(III) żelaza(III)
Fe
III
[Fe
III
(CN)
6
] o zabarwieniu brunatnym
Wykonanie: Do 1- 2 kropli badanego roztworu dodać 1 - 2 krople K
3
[Fe(CN)
6
]
aż do wytrącenia
sięczerwonobrunatnego osadu.
5. K
4
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(II) żelaza(III), tzw. błękit pruski
4 Fe
3+
+ 3 [Fe(CN)
6
]
4-
→ Fe
4
III
[Fe
II
(CN)
6
]
3
↓
ciemnoniebieski
Wykonanie: Do 1 - 2 kropli badanego roztworu dodać 1 kroplę roztworu
K
4
[Fe(CN)
6
].
4. KSCN– tiocyjanian (rodanek) potasu, tworzy rozpuszczalne związki
kompleksowe o za
-
barwieniu krwistoczerwonym
Fe
3+
+ SCN
-
→ [Fe(SCN)]
2+
Fe
3+
+ 2 SCN
-
→ [Fe(SCN)
2
]
+
Fe
3+
+ 3 SCN
-
→Fe(SCN)
3
Dalszy nadmiar jonów rodankowych powoduje powstawanie kolejnych jonów
kompleksowych [Fe(SCN)
4
]
-
, [Fe(SCN)
5
]
2-
, [Fe(SCN)
6
]
3-
; zabarwienie roztworu
staje się bardziej intensywne. Reakcja ta jest bardzo czuła, stosowana w analizie
wody.
Wykonanie: Do 1 - 2 kropli badanego roztworu dodać 1 kroplę roztworu
KSCN lub NH
4
SCN.
Reakcje jonu cynku(II) Zn
2+
1. (NH
4
)
2
S wytrąca koloidalny osad siarczku cynku(II)
Zn
2+
+ S
2-
→ ZnS↓
biały
Wykonanie: Do 2 kropli badanego roztworu dodać 2 krople 2 M. NH
4
OH, 4 krople 0.5 M. NH
4
Cl i 3
krople AKT. Mieszaninę ogrzewać na łaźni z wrzącą wodą ok.5 min.
2. NaOH, KOH - wytrącają osad wodorotlenku cynku (II)
Zn
2+
+ 2 OH
-
→ Zn(OH)
2
↓
biały
Wodorotlenek cynku(II) jest amfoteryczny; rozpuszcza się w nadmiarze odczynnika
i w kwasach
Zn(OH)
2
+ 2 NaOH → Na
2
ZnO
2
+ 2 H
2
O lub Zn(OH)
2
+ 2 NaOH
-
→ Na
2
[Zn(OH)
4
]
Zn(OH)
2
+ 2 HCl → ZnCl
2
+ 2 H
2
O
Wykonanie: Do 3 kropli badanego roztworu dodać 1 kroplę (wstrząsając probówką) 3 M. roztworu
NaOH do wytrącenia osadu i następnie 1 kroplę w celu jego rozpuszczenia.

21
3. NH
4
OH wytrąca osad wodorotlenku cynku(II), rozpuszczalnego w nadmiarze
odczynnika na skutek tworzenia kompleksowych związków - wodorotlenków
tetraamina- i heksaaminacynku(II)
Zn
2+
+ 2 NH
4
OH
→ Zn(OH)
2
↓ + 2 NH
4
+
biały
Zn(OH)
2
+ 4 NH
4
OH
→[Zn(NH
3
)
4
](OH)
2
+ 4 H
2
O
Zn(OH)
2
+ 6 NH
4
OH
→[Zn(NH
3
)
6
](OH)
2
+ 6 H
2
O
Wykonanie: Identyczne jak przy reakcji z NaOH.
4. K
3
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(III) cynku(II)
3 Zn
2+
+ 2 K
3
Fe(CN)
6
→ Zn
3
[Fe(CN)
6
]
2
↓ + 6 K
+
żółtobrunatny
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
3
[Fe(CN)
6
].
5. K
4
[Fe(CN)]
6
wytrąca osad heksacyjanożelazianu(II) potasowo-cynkowego(II)
3 Zn
2+
+ 2 K
4
[Fe(CN)
6
]
→ K
2
Zn
3
[Fe(CN)
6
]
2
↓ + 6 K
+
biały
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
4
[Fe(CN)
6
].
6. Wykrywanie Zn
2+
z rodanortęcianem amonowym w obecności jonów Co
2+
Przygotowujemy odczynnik rodanortęcian amonowy (NH
4
)
2
[Hg(SCN)
4
], w tym celu do 2 kropli
HgCl
2
dodajemy nadmiar tiocyjanianu am0nowego (NH
4
)SCN.
Do próbówki z rodanortęcianem dodajemy kroplę rozcieńczonego roztworu soli Co
2+
. Pocieramy
ścianki próbówki bagietką – stwierdzamy, że nie powstaje niebieski osad. Do tej samej próbówki
dodajemy 2 krople soli Zn
2+
i pocieramy bagietką ścianki próbówki nie dłużej niż 30 sek. W trakcie
tego wytrąca się niebieski lub błekitny osad zawierający Co[Hg(SCN)
4
] i Zn[Hg(SCN)
4
] . Zachodzi
reakcja:
CoCl
2
+ (NH
4
)
2
[Hg(SCN)
4
] = Co[Hg(SCN)
4
]
↓
ZnCl
2
+ (NH
4
)
2
[Hg(SCN)
4
] = Zn[Hg(SCN)
4
]
↓
Tworzony przez jony cynku biały osad Zn[Hg(SCN)
4
] przyspiesza wytrącenie niebieskiego
Co[Hg(SCN)
4
], który w nieobecności Zn[Hg(SCN)
4
] może nie wytrącić się w przeciągu godziny.
Reakcje jonu manganu(II) Mn
2+
1. (NH
4
)
2
S wytrąca osad siarczku manganu(II)
Mn
2+
+ S
2-
→ MnS↓
cielisty
Osad ten łatwo rozpuszcza się w kwasach.
Wykonanie: Do 2 kropli badanego roztworu dodać 2 krople 2 M. NH
4
OH, 4 krople 0.5 M. NH
4
Cl i
3 krople AKT. Mieszaninę ogrzewać na łaźni z wrzącą wodą 5 - 10 min, aż do wytrącenia na dnie
probówki jasnoróżowo - cielistego osadu.
2. NaOH, KOH wytrącają osad wodorotlenku manganu(II)
Mn
2+
+ 2 OH
-
→ Mn(OH)
2
↓
Biały
Wodorotlenek manganu(II) utlenia się tlenem z powietrza do kwasu manga-
nowego(IV), a następnie manganianu(IV) manganu(II)
2 Mn(OH)
2
+ O
2
→2 H
2
MnO
3
H
2
MnO
3
+ Mn(OH)
2
→ MnMnO
3
↓+ 2H
2
O
brunatny
22
Wykonanie: Do 2 - 3 kropli badanego roztworu dodać 1 (!) kroplę 3 M. NaOH. Probówkę z osadem
energicznie wstrząsnąć. Wytrącony osad przez moment jest biały i natychmiast ciemnieje na
powietrzu.
3. NH
4
OH wytrąca osad wodorotlenku manganu(II) jak w reakcji z NaOH
Wykonanie: Do 2 - 3 kropli badanego roztworu dodać 1 (!) kroplę 2 M. NH
4
OH. Probówkę z
osadem energicznie wstrząsnąć. Wytrącony osad przez moment jest biały i natychmiast ciemnieje na
powietrzu.
4. K
3
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(III) manganu(II)
3 Mn
2+
+ [Fe(CN)
6
]
3-
→ Mn
3
[Fe(CN)
6
]
2
↓
brunatny
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
3
[Fe(CN)
6
].
5. K
4
[Fe(CN)
6
] wytrąca osad heksacyjanożelazianu(II) manganu(II)
2 Mn
2+
+ [Fe(CN)
6
]
4-
→ Mn
2
[Fe(CN)
6
]
↓
biały
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę K
4
[Fe(CN)
6
].
6. (NH
4
)
2
S
2
O
8
- nadsiarczan amonu wobec katalizatora AgNO
3
, w środowisku
kwaśnym, utlenia jony Mn
2+
do MnO
4
-
. Reakcja jest bardzo czuła, stosowana do
oznaczania śladowych ilości manganu w wodzie
katalizator Ag
2 Mn
2+
+ 5 S
2
O
8
2-
+ 8 H
2
O
→2 HMnO
4
+ 10 SO
4
2-
+ 14 H
+
jasnoróżowy ciemnofioletowy
Wykonanie: Do 1 kropli (nie więcej!) badanego roztworu dodać 50 kropli wody i wymieszać. Z tego
roztworu pobrać 1 ml i dodać do niego 2 krople stężonego HNO
3
i 10 kropli 1% roztworu AgNO
3
(pojawia się zmętnienie) oraz szczyptę (NH
4
)
2
S
2
O
8
i wymieszać. Mieszaninę ogrzewać na wrzącej
łaźni wodnej ok. 3 - 5 min. Probówkę z wytrąconym brązowo - brunatnym osadem wyjąć z łaźni i
energicznie wstrząsnąć - osad opada na dno probówki, a roztwór ma fioletowo - różowe zabarwienie.
Probówkę odstawić na chwilę - osad opadnie, a kolor będzie wyraźniejszy.
6. Reakcje charakterystyczne wybranego kationu IV grupy
Odczynnikiem grupowym IV grupy analitycznej kationów jest węglan amonu
(NH
4
)
2
CO
3
. Węglan amonu w roztworach wodnych dysocjuje następująco
(NH
4
)
2
CO
3
↔ 2 NH
4
+
+ CO
3
2-
Jako sól słabej zasady i słabego kwasu ulega on hydrolizie
(NH
4
)
2
CO
3
+ H
2
O
↔ NH
4
HCO
3
+ NH
4
OH
Powstający w tej reakcji kwaśny węglan amonu dysocjuje zgodnie z reakcją
NH
4
HCO
3
↔ NH
4
+
+ HCO
3
-
W roztworze wodnym węglanu amonu obok jonów CO
3
2-
są więc jony HCO
3
-
, które
z kationami Ca
2+
dają łatwo rozpuszczalne kwaśne węglany. Utrudnia to całkowite
wytrącenie i oddzielenie kationów IV grupy. W celu przeciwdziałania powstawaniu
kwaśnych węglanów dodaje się do roztworu węglanu amonu wodorotlenku amonu.
Cofa on reakcję hydrolizy węglanu amonu zgodnie z reakcją
NH
4
HCO
3
+ NH
4
OH
→ (NH
4
)
2
CO
3
+ H
2
O

23
Wodorotlenek amonu, w obecności węglanu amonu może powodować wytrącanie
jonu magnezu z grupy V w postaci Mg
2
(OH)
2
CO
3
. Z tego względu konieczny jest
dodatek NH
4
Cl, który cofa dysocjację dodanego poprzednio wodorotlenku amonu.
Reakcje jonu wapnia Ca
2+
1. (NH
4
)
2
CO
3
wytrąca osad węglanu wapnia
Ca
2+
+ CO
3
2-
→ CaCO
3
↓
biały
Węglan wapnia rozpuszcza się w rozcieńczonych kwasach z wydzieleniem
dwutlenku węgla
CaCO
3
+ 2 H
+
→ Ca
2+
+ H
2
O + CO
2
↑
Wykonanie: Do 2 kropli badanego roztworu dodaj 1 - 2 krople 2 M. roztworu (NH
4
)
2
CO
3
. Osad
rozpuszcza się w 4 - 5 kroplach 2 M. HCl.
2. NaOH, KOH wytrącają osad wodorotlenku ze stężonych roztworów soli wapnia
Ca
2+
+ 2 OH
-
→ Ca(OH)
2
↓
biały
Osad ten jest dość dobrze rozpuszczalny w wodzie ok. 1,2 g/dm
3
w temperaturze
pokojowej.
Wykonanie: Do 1 kropli badanego roztworu dodaj 1 - 2 krople 3 M. roztworu NaOH.
3. (NH
4
)
2
C
2
O
4
wytrąca osad szczawianu wapnia
Ca
2+
+ C
2
O
4
2-
→ Ca C
2
O
4
↓
biały
Szczawian wapnia rozpuszcza się w mocnych kwasach mineralnych, nie rozpuszcza
się w CH
3
COOH.
Wykonanie: Do 1 kropli badanego roztworu dodać 1 kroplę roztworu (NH
4
)
2
C
2
O
4
. Wytrąca się osad,
który rozpuszcza się w 5-6 kroplach 6 M HNO
3
.
4. Na
2
HPO
4
- wodorofosforan(V) sodu w obecności NH
4
OH wytrąca biały osad
fosforanu(V) wapnia
3 Ca
2+
+ HPO
4
2-
+ 2 NH
4
OH
→ Ca
3
(PO
4
)
2
↓ + 2 H
2
O + 2 NH
4
+
Wykonanie: Do 2 kropli badanego roztworu dodać 3 - 4 krople roztworu NH
4
Cl i 4 krople roztworu
Na
2
HPO
4
.
5. K
2
CrO
4
nie wytrąca osadu.
6. K
2
Cr
2
O
7
nie wytrąca osadu.
7. Zabarwienie płomienia - sole wapnia zabarwiają płomień na kolor ceglasto-
czerwony.
Wykonanie: Wprowadź badany roztwór na druciku platynowym do płomienia palnika gazowego.
Pojawiające się ceglasto - czerwone zabarwienie świadczy o obecności jonów wapnia.

24
7. Reakcje charakterystyczne wybranych kationów V grupy
Reakcje charakterystyczne jonu magnezu Mg
2+
l. NaOH, KOH wytrącają osad wodorotlenku magnezu
Mg
2+
+ 2 OH
-
→ Mg(OH)
2
↓
galaretowaty, biały
Wodorotlenek magnezu łatwo rozpuszcza się w rozcieńczonych kwasach i w solach
amonowych
Mg(OH)
2
+ 2 H
+
→ Mg
2+
+ 2 H
2
O
Mg(OH)
2
+ 2 NH
4
+
→ Mg
2+
+ 2 NH
4
OH
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 3 krople 3 M. NaOH.
2. NH
4
OH wytrąca z obojętnych roztworów, niezawierających soli amonowych,
osad wodorotlenku magnezu. Wytrącenie jest niecałkowite (powstaje nikły osad,
zmętnienie).
Mg
2+
+ 2 NH
4
OH
→ Mg(OH)
2
↓
+ 2 NH
4
+
galaretowaty, biały
Uwaga:
W obecności nadmiaru soli amonowych osad wodorotlenku magnezu może się w ogóle nie
wytrącić, gdyż zwiększenie stężenia kationów NH
4
+
powoduje zmniejszenie stężenia anionów OH
-
tak dalece, że może nie zostać przekroczony iloczyn rozpuszczalności wodorotlenku magnezu.
Wykonanie: Do 2-3 kropli badanego roztworu dodaj 2 krople 2 M. NH
4
OH.
3. Na
2
HPO
4
w obecności NH
4
OH i NH
4
Cl wytrąca osad soli podwójnej fosforanu
amonowo - magnezowego
Mg
2+
+ HPO
4
2-
+ NH
4
OH
→ Mg NH
4
PO
4
↓ + H
2
O
biały
Roztwory fosforanu amonowomagnezowego są podatne na osiąganie stanu
przesycenia, dlatego też w czasie przeprowadzania reakcji należy bagietką pocierać
ścianki probówki. MgNH
4
PO
4
dobrze rozpuszcza się w kwasach.
Mg NH
4
PO
4
+ H
+
→ Mg
2+
+ HPO
4
2-
+ NH
4
+
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 3 krople 0.5 M NH
4
Cl i 3-4 krople roztworu
Na
2
HPO
4
.
Reakcje charakterystyczne jonu potasu K
+
`
1. NaOH, KOH nie wytrącają osadu.
2. Na
3
[Co(NO
2
)
6
] - heksaazotynokobaltan(III) sodu wytrąca z roztworów
zakwaszonych kwasem octowym osad heksaazotynokobaltanu(III) sodowo -
potasowego
2 K
+
+ Na
+
+ [Co(NO
2
)
6
]
3-
→ K
2
Na[Co(NO
2
)
6
]
↓
żółty
Jest to najbardziej czuła reakcja na jon K
+
, prowadzona na „mokro”. Stosuje się ją do
oznaczania potasu w wodzie.
Wykonanie: Do 1 - 2 kropli badanego roztworu dodaj 1 kroplę roztworu Na
3
[Co(NO
2
)
6
]. Wstrząśnij i
odstaw probówkę.
25
3. Zabarwienie płomienia - sole potasu zabarwiają płomień na kolor jasno
fioletowy. Ta barwa może być tłumiona żółtą barwą jonów sodowych, które dają
zółtą barwę płomienia nawet w śladowych ilościach
Wykonanie: Wprowadź badany roztwór na druciku platynowym do płomienia palnika gazowego.
Pojawi się jasno fioletowe zabarwienie.
Reakcje jonu amonowego NH
4
+
1. NaOH, KOH wypierają z soli amonowych NH
4
OH, który przy ogrzewaniu
rozkłada się z wydzieleniem gazowego amoniaku, np.
NH
4
OH
→H
2
O + NH
3
↑
Wydzielający się amoniak można poznać po zapachu lub zmianie zabarwienia
wilgotnego, różowego papierka lakmusowego, umieszczonego u wylotu probówki z
mieszaniną reagującą, na kolor niebieski.
Wykonanie: Do 4
-
6 kropli badanego roztworu dodaj 4 - 6 kropli 6 M. KOH i umieść w probówce
uniwersalny papierek wskaźnikowy zawieszony na jej krawędzi. Podczas ogrzewania probówki w
łaźni wodnej papierek zmienia zabarwienie na zielone tzn. wskazuje na środowisko alkaliczne.
2. Na
3
[Co(NO
2
)
6
] wytrąca osad heksaazotynokobaltanu(III) sodowo-amonowego
2 NH
4
+
+ Na
+
+ [Co(NO
2
)
6
]
3-
→ (NH
4
)
2
Na[Co(NO
2
)
6
]↓
żółty
Wykonanie: Do 1 - 2 kropli badanego roztworu dodaj 1 kroplę roztworu Na
3
[Co(NO
2
)
6
].
3. Odczynnik Nesslera - alkaliczny roztwór jodortęcianu(II) potasu K
2
[HgJ
4
]
wytrąca osad tlenoaminortęci(II)
W przypadku bardzo małej liczby jonów NH
4
+
osad nie wydziela się, a jedynie
występuje żółte, pomarańczowe lub brązowe zabarwienie roztworu w zależności od
ich stężenia.
NH
4
Cl + 2 K
2
[HgI
4
] + 4 KOH
O
Hg
NH
2
I
Hg
żółtobrunatny
+ 7 KI + KCl + 3 H
2
O
Wykonanie: 1-2 krople badanego roztworu wkroplić do probówki i rozcieńczyć 8-10 kroplami wody
destylowanej. Dodać 1-2 krople odczynnika Nesslera.
26
Część praktyczna analizy kationów.
Identyfikacja pojedynczych kationów w roztworze polega na dodawaniu
odczynników charakterystycznych do małych porcji badanego roztworu. Na ogół zaczyna się
od stwierdzenia, do której grupy analitycznej należy zawarty w roztworze kation. W tym celu
do porcji roztworu dodaje się odczynnik grupowy I grupy kationów.
W przypadku powstania osadu i stwierdzenia, że badany kation należy do I grupy, do
kilku nowych porcji badanego roztworu dodaje się inne odczynniki charakterystyczne. Na
podstawie wyników tych reakcji (powstanie charakterystycznej barwy lub zapachu,
wytrącenie się osadu, jego barwa, rozpuszczalność) i dalszych reakcji z innymi odczynnikami
identyfikuje się badany kation.
Jeżeli po dodaniu odczynnika grupowego I grupy kationów osad nie wytrąca się, do
tej samej porcji roztworu dodaje się odczynnik grupowy II grupy. Brak reakcji wytrącania
oznacza brak kationu II grupy w badanym roztworze. Następnie dodaje się odczynnik
grupowy III grupy. Jeżeli i w tym przypadku nie powstanie osad, dodaje się odczynnik
grupowy IV grupy. Jeżeli osad nie powstanie, oznacza to, że badany kation należy do V
grupy lub w roztworze brak jest w ogóle kationów. Po stwierdzeniu, do której grupy
analitycznej należy kation, przeprowadza się opisane uprzednio reakcje charakterystyczne.
ĆWICZENIE 2. Identyfikacja kationów I, II, grupy w roztworach pojedynczych
soli.
Część I: Należy zapoznać się ze wszystkimi reakcjami kationów I, II, IV i V grupy
wykonując samodzielnie reakcje grupowe (dla zidentyfikowania grupy) i charakterystyczne
tych kationów. Potrzebne roztwory znajdują się na sali na półkach nad stołami
laboratoryjnymi, w koszyczkach na stołach oraz pod wyciągiem. Po zapoznaniu się z
reakcjami należy zgłosić się do asystenta po zadanie.
Część II: W 3 probówkach otrzymanych od asystenta (każda zawiera roztwór jednej
soli) należy zidentyfikować znajdujące się w nich kationy. Identyfikację należy
przeprowadzić wg opisanych zasad. Do probówek wlewać po kilka kropli badanego roztworu
i kroplami dodawać roztwory poszczególnych odczynników. Wyniki analizy przedstawić wg
podanego schematu:
Nr
probówki
Przebieg analizy
Obserwacje
Wnioski
Wynik
1
Próbka + HCl
Brak osadu
Kation nie należy do I
grupy
Próbka + AKT
Czarny osad
Kation II grupy
Próbka + NaOH
Niebieskozielony osad
Cu
2+
osad + NH
4
OH
Osad rozpuszcza się
Próbka + NH
4
OH Szafirowy
zabarwienie
roztworu
Cu
2+
Próbka + K
4
[Fe(CN)
6
] Czerwonobrunatny
osad
Cu
2+
Rekcje w toku analizy
Cu
2+
+ 2 S
-2
→ CuS↓
Cu
2+
+ 2 OH
-
→Cu(OH)
2
↓
Cu(OH)
2
+ 4 NH
4
OH → [Cu(NH
3
)
4
](OH)
2
+ H
2
O
2 Cu
2+
+ [Fe(CN)
6
]
4-
→Cu
2
[Fe(CN)
6
]↓ Cu
2+
2 itd
itd
itd

27
ĆWICZENIE 3. Identyfikacja kationów III grupy w roztworach pojedynczych
soli.
Część I: Należy zapoznać się ze wszystkimi reakcjami kationów tej grupy wykonując
samodzielnie reakcję grupową i reakcje charakterystyczne tych kationów. Potrzebne roztwory
znajdują się na sali na półkach nad stołami laboratoryjnymi, w koszyczkach na stołach oraz
pod wyciągiem. Po zapoznaniu się z reakcjami należy zgłosić się do asystenta po zadanie.
Część II: W 3 probówkach otrzymanych od asystenta (każda zawiera roztwór jednej
soli) należy zidentyfikować znajdujące się w nich kationy. Identyfikację należy
przeprowadzić wg opisanych zasad. Do probówek wlewać po kilka kropli badanego roztworu
i kroplami dodawać roztwory poszczególnych odczynników. Wyniki analizy przedstawić wg
podanego wyżej schematu ( tak jak w ćwiczeniu 2).
ĆWICZENIE 4. Identyfikacja kationów IV i V grupy w roztworach
pojedynczych soli
Przebieg i postępowanie analogiczne jak w przypadku ćwiczenia 2 i 3
Analiza wybranych anionów
Na podstawie systematyki Bunsena najczęściej występujące aniony podzielono na 7
grup analitycznych. Podział ten uwarunkowany jest różnicami w zachowaniu się
poszczególnych anionów względem azotanu(V) srebra i chlorku baru oraz różną
rozpuszczalnością powstających w tych reakcjach osadów w rozcieńczonym kwasie
azotowym(V) (tabela).
Program przewiduje opanowanie umiejętności identyfikowania anionów: Cl
-
, NO
3
-
i
SO
4
2-
, PO
4
3
-
.
28
Podział anionów na grupy analityczne wg Bunsena
Grupa
analityczna
Aniony
0.1 M AgNO
3
0.25M
BaCl
2
I Chlorkowy
Cl
-
Bromkowy Br
-
Jodkowy I
-
Cyjankowy CN
-
Tiocyjanianowy SCN
-
Chlorowy(I) ClO
-
Heksacyjanożelazianowy(III) [Fe(CN)
6
]
3-
Heksacyjanożelazianowy(II) [Fe(CN)
6
]
4-
Biały lub żółty osad
nierozpuszczalny
w 2 M HNO
3
Brak osadu
II Siarczkowy
S
2-
Azotanowy (IV)NO
2
-
Octanowy CH
3
COO
-
Czarny lub biały osad
rozpuszczalny w 2 M
HNO
3
(Ag
2
S na
gorąco)
Brak osadu
III Siarczanowy(IV)
SO
3
2-
Węglanowy CO
3
2-
Szczawianowy C
2
O
4
2-
Boranowy BO
2
-
Winianowy C
4
H
4
O
6
2-
Wodorofosforanowy(III) HPO
3
2-
Manganowy(VI) MnO
4
2-
Biały osad
rozpuszczalny w 2 M
HNO
3
Biały osad
rozpuszczalny
w 2 M HNO
3
IV Ditionianowy
S
2
O
3
2-
Chromianowy(VI) CrO
4
2-
Fosforanowy(V) PO
4
3-
Arsenianowy(V) AsO
4
3-
Arsenianowy(III) AsO
3
3-
Wanadynowy(V) V
2
O
7
4-
Barwny osad
rozpuszczalny w
2 M HNO
3
Biały osad
rozpuszczalny
w 2 M HNO
3
V Azotanowy(V)
NO
3
-
Chlorowy(V) ClO
3
-
Chlorowy(VII) ClO
4
-
Manganowy(VII) MnO
4
-
Manganowy(VI) MnO
4
2-
Brak osadu
Brak osadu
VI Fluorkowy
F
-
Siarczanowy(VI) SO
4
2-
Heksafluorokrzemianowy SiF
6
2-
Brak osadu
Biały osad
nierozpuszczaln
y w 2 M HNO
3
VII Krzemianowy
SiO
3
2-
,
Wolframianowi WO
4
2-
Żółty osad
rozpuszczalny
w 2 M HNO
3
Biały osad
rozpuszczalny
w 2 M HNO
3

29
Reakcje jonu chlorkowego Cl
-
1. AgNO
3
wytrąca serowaty osad chlorku srebra
Ag
+
+ CI
-
→ AgCl↓
biały
Osad ten ciemnieje na świetle dziennym (rozkład na srebro i chlor). Chlorek srebra
jest nierozpuszczalny w rozcieńczonych kwasach mineralnych, rozpuszczalny w
NH
4
OH.
AgCl + 2 NH
4
OH
→ [Ag(NH
3
)
2
]Cl + 2 H
2
O
chlorek diaminasrebra
Po zakwaszeniu otrzymanego roztworu wytrąca się ponownie osad AgCl
[Ag(NH
3
)
2
]Cl+ 2 HNO
3
→ AgCl↓ + 2 NH
4
NO
3
Wykonanie: Do 2 - 3 kropli badanego roztworu dodaj 2 - 3 krople 0.1 M. roztworu AgNO
3
.
2. BaCl
2
nie wytrąca osadu.
3. Pb(NO
3
)
2
wytrąca z niezbyt rozcieńczonych roztworów chlorków krystaliczny
osad chlorku ołowiu(II)
Pb
2+
+ 2 Cl
-
→ PbCl
2
↓
biały
Chlorek ołowiu(II) jest rozpuszczalny w gorącej wodzie.
Wykonanie: Próbę należy wykonać w suchej probówce. Do 2 kropli badanego roztworu dodaj 2
krople roztworu
Pb(NO
3
)
2
.
4. KMnO
4
zostaje w środowisku kwaśnym na gorąco odbarwiony przez jony
chlorku (słaby reduktor)
2 MnO
4
-
+ 10 Cl
-
+16H
+
→ 5Cl
2
↑+ 2 Mn
2+
+ 8H
2
O
Wykonanie: Do 4 kropli badanego roztworu dodaj kroplę stężonego KMnO
4
i 1kroplę stęż. H
2
SO
4
.
Mieszaninę należy ogrzać ok. 10
-
15 min. (pod wyciągiem!).
Reakcja jonu azotanowego(V) NO
3
-
1. AgNO
3
nie wytrąca osadu.
2. BaCl
2
nie wytrąca osadu.
3. FeSO
4
daje osad z azotanami(V), tzw. „reakcję „obrączkową”.
Polega ona na utlenieniu FeSO
4
do Fe
2
(SO
4
)
3
i na redukcji azotanów (V) do tlenku
azotu NO. Powstający tlenek tworzy z nadmiarem FeSO
4
siarczan nitrozowy
żelaza(II) o brunatnym zabarwieniu:
2 NaNO
3
+ 8 FeSO
4
+ 4 H
2
SO
4
→ 2 Fe(NO)SO
4
+ Na
2
SO
4
+ 3 Fe
2
(SO
4
)
3
+ 4 H
2
O
Wykonanie: Do probówki wprowadzić 2 krople roztworu zawierającego jony azotanowe i 4 krople
stęż. H
2
SO
4
. Następnie probówkę oziębić zimną wodą i ostrożnie dodać po ściance 4 krople
nasyconego roztworu FeSO
4
. Na granice zetknięcia obu roztworów powstaje brązowa obrączka.
30
Stosowane roztwory muszą być zimne, gdyż siarczan nitrozowy żelaza (II) w wyższej temperaturze
ulega rozkładowi wg reakcji:
Fe(NO)SO
4
→ FeSO
4
+ NO
4. Reakcja z Cu i kwasem siarkowym
Miedź redukuje rozcieńczony kwas azotowy do tlenku azotu NO
3 Cu + 8 H
+
+ 2 NO
3
-
→ 3 Cu
2+
+ 2 NO
↑ + 4 H
2
O
2 NO + O
2
→ 2 NO
2
↑ (tlen z powietrza)
Do roztworu azotanu dodajemy trochę stężonego kwasu H
2
SO
4
i metaliczną miedź.
Zawartość probówki ogrzewamy (pod wyciągiem). Wydziela się brunatny gaz,
najlepiej widoczny na tle białej kartki.
Wykonanie: Do 3 kropli badanego roztworu dodaj 3 - 4 wiórki Cu i 5 kropli stężonego H
2
SO
4
.
Wstrząsaj lekko probówką.
5. Difenyloamina (C
6
H
5
)
2
NH daje z jonami NO
3
-
w stężonym H
2
SO
4
niebieskie
zabarwienie, które powstaje na skutek utlenienia odczynnika przez powstający kwas
azotowy.
Wykonanie: Do probówki wkroplić 2 - 3 krople roztworu difenyloaminy i 1 kroplę badanego
roztworu. W obecności jonów NO
3
-
pojawi się ciemnoniebieskie zabarwienie.
Uwaga: Reakcja jest bardzo czuła ale niespecyficzna. Taki sam efekt daje użycie innych utleniaczy
np.: ClO
3
-
, AsO
4
-
, NO
2
-
.
Reakcja jonu siarczanowego (VI) SO
4
2-
1. AgNO
3
wytrąca osad tylko ze stężonych roztworów siarczanów(VI)
2 Ag
+
+ SO
4
2-
→ Ag
2
SO
4
↓
biały
2. BaCl
2
wytrąca krystaliczny osad
siarczanu(VI) baru, nierozpuszczalny w
rozcieńczonych kwasach mineralnych, rozpuszczalny w stężonym kwasie
siarkowym(VI) na gorąco
Ba
2+
+ SO
4
2-
→ BaSO
4
↓
biały
BaSO
4
+ H
2
SO
4
→ Ba(HSO
4
)
2
Wykonanie: Do 2 kropli badanego roztworu dodaj 2 krople roztworu BaCl
2
.
3. Pb(NO
3
)
2
wytrąca osad siarczanu(VI) ołowiu(II), rozpuszczalny w stężonych
ługach i w stężonym kwasie siarkowym(VI)
Pb
2+
+ SO
4
2-
→ PbSO
4
↓
biały
PbSO
4
+ 4 OH
-
→ PbO
2
2-
+ SO
4
2-
+ 2 H
2
O
PbSO
4
+ H
2
SO
4
→ Pb
2+
+ 2 HSO
4
-
Wykonanie: Do 2 kropli badanego roztworu dodaj 2 krople roztworu PbCl
2
.

31
Reakcje jonu fosforanowego (V) PO
4
3-
Jon fosforanowy PO
4
3-
jest anionem kwasu ortofosforowego H
3
PO
4
. Jest to kwas
średniej mocy i jako kwas trójzasadowy tworzy trzy rodzaje soli:
fosforany trójmetaliczne (obojętne): np. Na
3
PO
4
, Ca
3
(PO
4
)
2
fosforany dwumetaliczne (kwaśne): np. Na
2
HPO
4
, CaHPO
4
Fosforany jednometaliczne (kwaśne): np. NaH
2
PO
4
,Ca(H
2
PO
4
)
2
1. BaCl
2
wytrąca z roztworu Na
2
HPO
4
biały osad BaHPO
4
, rozpuszczalny w
kwasach (z wyjątkiem H
2
SO
4
):
Ba
2+
+ HPO
4
2-
→ BaHPO
4
↓
Jeśli te reakcję wykonujemy w obecności mocnych zasad lub NH
4
OH, jon HPO
4
2-
przechodzi w jon PO
4
3-
:
HPO
4
2-
+ OH
-
→ PO
4
3-
+ H
2
O
W tym przypadku strąca się osad Ba
3
(PO
4
)
2
:
3 Ba
2+
+ 2 PO
4
3-
→ Ba
3
(PO
4
)
2
↓
Osad ten rozpuszcza się w kwasach tak samo jak BaHPO
4
.
Wykonanie: Do 2 kropli badanego roztworu dodaj 1 kroplę 2 M. NH
4
OH i 2 krople roztworu BaCl
2
.
i wstrząśnij probówką. Wytrąca się biały osad rozpuszczalny w 6 M. HNO
3
.
2. Mieszanina magnezowa (MgCl
2
+NH
4
Cl + NH
4
OH) wytrąca biały, krystaliczny
osad MgNH
4
PO
4
:
HPO
4
2-
+ NH
4
OH + Mg
2+
→ MgNH
4
PO
4
↓ + H
2
O
Wykonanie: Do 2 kropli badanego roztworu dodaj 10 kropli mieszaniny magnezowej. Wytrąca się
biały osad.
3. Molibdenian amonowy. Roztwór (NH
4
)
2
MoO
4
w HNO
3
(1:1) wytrąca z
roztworów fosforanów charakterystyczny, żółty krystaliczny osad
fosforomolibdenianu amonowego o wzorze empirycznym (NH
4
)
3
H
4
[P.(Mo
2
O
7
)
6
].
Osad ten rozpuszcza się w nadmiarze fosforanów tworząc aniony zespolone i dlatego
odczynnik musi być użyty w dużym nadmiarze.
PO
4
3-
+ 3 NH
4
+
+ 12 MoO
4
2-
+ 24 H
+
→ (NH
4
)
3
H
4
[P(Mo
2
O
7
)
6
]↓ + 10 H
2
O
Wykonanie: Do 2 kropli badanego roztworu dodaj 10 - 15 kropli (!) roztworu molibdenianu amonu.
Powstaje żółte zabarwienie roztworu. Probówkę wstrząśnij energicznie i odstaw na chwilę. Wytrąca
się żółty krystaliczny osad.
32
Część praktyczna
ĆWICZENIE 4. Identyfikacja anionów w roztworach pojedynczych soli
sodowych
Część I: Należy zapoznać się ze wszystkimi reakcjami oznaczanych anionów
wykonując samodzielnie reakcje charakterystyczne. Potrzebne roztwory znajdują się na sali
na półkach nad stołami laboratoryjnymi, w koszyczkach na stołach oraz pod wyciągiem. Po
zapoznaniu się z reakcjami należy zgłosić się do asystenta po zadanie.
Część II: W 3 probówkach otrzymanych od asystenta (każda zawiera roztwór jednej
soli) należy zidentyfikować znajdujące się w nich aniony. Identyfikację należy przeprowadzić
wg opisanych zasad. Do probówek wlewać po kilka kropli badanego roztworu i kroplami
dodawać roztwory poszczególnych odczynników. Wyniki analizy przedstawić wg podanego
schematu
Nr
probówki
Przebieg analizy
Obserwacje
Wniosk
i
Wynik
1
Próbka + AgNO
3
Osad + HNO
3
Osad + NH
4
OH
Próbka + BaCl
2
Próbka + Pb(NO
3
)
2
Osad + gorąca H
2
O
Próbka + KMnO
4
, kwaśne
środowisko
Biały osad
Nie rozpuszcza się
Rozpuszcza się
Brak osadu
Biały osad
Rozpuszcza się
Odbarwienie roztworu
I grupa
Cl
-
Cl
-
Reakcje w toku
Ag
+
+ Cl
-
→ AgCl↓
AgCl + 2 NH
4
OH → [Ag(NH
3
)
2
]Cl + H
2
O
Pb
2+
+ 2 Cl
-
→ PbCl
2
↓
2 MnO
4
-
+ 10 Cl
-
+ 16 H
+
→ 5 Cl
2
+ 2 Mn
2+
+ 8 H
2
O
Cl
-
2
itd
Wyszukiwarka
Podobne podstrony:
02 Wykonywanie analiz jakosciow Nieznany (2)
Laboratorium analizy jakosciowe Nieznany
Nieorganiczna analiza jakosciow Nieznany
mechanika budowli II analiza ki Nieznany
Analiza jakościowa kationów i anionów, Analiza jakościowa
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE CHLORKÓW I SIARCZANÓW
26 Prowadzenie analiz wskazniko Nieznany (2)
Pojecie i istota kosztow jakosc Nieznany
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
Podstawy analizy fundamentalnej Nieznany
NST01 Repetytorium z analizy we Nieznany
graficzna analiza wynikow Nieznany
27 Kardas Prusak Gajek Analiza jakosci wyrobow
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
analiza jakościowa kationów
więcej podobnych podstron