
Barbara Wanik
Zakład Fizyki, Akademia Rolnicza
Kraków, 2003
Do użytku wewnętrznego
Ćwiczenie 22
A. Wyznaczanie wilgotności względnej powietrza metodą psychrometru Assmanna (lub
Augusta)
B. Wyznaczanie wilgotności bezwzględnej i względnej powietrza metodą punktu rosy
(higrometru Alluarda)
SPIS TREŚCI
I. CZĘŚĆ TEORETYCZNA ................................................................................................................................. 2
1.
W
STĘP
.................................................................................................................................................................. 2
2.
Z
ALEŻNOŚĆ PRĘŻNOŚCI PARY NASYCONEJ OD TEMPERATURY
. ............................................................................. 4
3.
P
UNKT POTRÓJNY
................................................................................................................................................. 5
4.
K
INETYKA PAROWANIA
.
S
ZYBKOŚĆ PAROWANIA
,
WPŁYW RÓŻNYCH CZYNNIKÓW NA SZYBKOŚĆ PAROWANIA
..... 7
5.
P
ARA NIENASYCONA I JEJ WŁAŚCIWOŚCI
,
RÓŻNICE MIĘDZY PARĄ NASYCONĄ A NIENASYCONĄ
.......................... 10
6.
W
ILGOTNOŚĆ BEZWZGLĘDNA I WZGLĘDNA POWIETRZA
...................................................................................... 15
II. CEL ĆWICZENIA ......................................................................................................................................... 17
III. WYKONANIE ĆWICZENIA ...................................................................................................................... 18
III.A.
W
YZNACZANIE WILGOTNOŚCI WZGLĘDNEJ POWIETRZA METODĄ PSYCHROMETRU
A
SSMANNA
(
LUB
A
UGUSTA
) .............................................................................................................................................................. 18
III.A.1. Zasada pomiaru .................................................................................................................................... 18
III.A.2. Wykonanie ćwiczenia ............................................................................................................................ 20
III.A.3. Opracowanie wyników, dyskusja błędów .............................................................................................. 21
III.B.
W
YZNACZANIE WILGOTNOŚCI BEZWZGLĘDNEJ I WZGLĘDNEJ POWIETRZA METODĄ PUNKTU ROSY
(
ZMODYFIKOWANEGO HIGROMETRU
A
LLUARDA
) ................................................................................................... 22
III.B.1. Zasada pomiaru .................................................................................................................................... 22
III.B.2. Wykonanie ćwiczenia ............................................................................................................................ 24
III.B.3. Opracowanie wyników, dyskusja błędów .............................................................................................. 25
IV. LITERATURA .............................................................................................................................................. 27
V. INDEKS ........................................................................................................................................................... 28

2
Zakres wymaganych wiadomości:
Parowanie powierzchniowe - wyjaśnienie w świetle teorii kinetyczno-molekularnej materii.
Właściwości pary nienasyconej i nasyconej (prężność i zależność od temperatury).
Temperatura wrzenia cieczy - związek z prężnością pary. Punkt potrójny, punkt potrójny
wody (diagram fazowy wody, ciśnienie i temperatura w punkcie potrójnym). Szybkość
parowania - wpływ różnych czynników na parowanie. Stosowalność praw gazowych do par.
Ciepło parowania. Jak parują roztwory doskonałe i rzeczywiste. Wilgotność bezwzględna,
względna powietrza. Budowa i zasada działania psychrometru Assmanna (lub Augusta) -
wyjaśnienie wzoru na prężność pary wodnej nienasyconej w powietrzu z zastosowaniem
wskazań termometrów suchego i wilgotnego.
Budowa i zasada działania higrometru Alluarda, punkt rosy
.
Spis rysunków
Ryc. 2.1. Prężność pary nasyconej kilku różnych cieczy w funkcji temperatury ................. 4
Ryc. 3.1. Wykres równowagi fazowej we współrzędnych (p,T)
a. Dla dwóch faz (1) i (2)
b. Dla trzech faz (1), (2) i (3), T - temperatura punktu potrójnego .......................... 5
Ryc. 3.2. Diagram fazowy dla wody, LW - krzywa równowagi lodu z wodą, WP - krzywa
równowagi wody z parą, PL - krzywa równowagi pary z lodem.
Temperaturę podano w skali Celsjusza ............................................................... 5
Ryc. 3.3. Diagram fazowy dla wody w zakresie wysokich ciśnień (ciśnienia podano w
kilobarach). Kółkami (o) oznaczono punkty potrójne. T - temperatura w skali
Kelvina ............................................................................................................... 6
Ryc. 3.4. Diagram fazowy dla dwutlenku węgla.
SC - krzywa równowagi fazy stałej z gazową, CG - krzywa równowagi fazy ciekłej
z gazową, SG - krzywa równowagi fazy stałej z gazową .................................... 7
Ryc. 5.1. Naczynie z ruchomym tłokiem ............................................................................ 11
Ryc. 5.2. Zależność ciśnienia od objętości przy izotermicznym sprężaniu pary nienasyconej,
kondensacji pary nasyconej i izotermicznego sprężania cieczy .......... 12
Ryc. 5.3. Zależność ciśnienia od objętości przy izotermicznym sprężaniu pary nienasyconej,
kondensacji pary nasyconej i izotermicznego sprężania cieczy dla różnych
temperatur ............................................................................................................ 13
Ryc. III.A.1. Psychrometr Assmanna .................................................................................. 19
Ryc. III.A.2. Psychrometr Augusta ..................................................................................... 19
Ryc. III.B.1. Higrometr Alluarda ........................................................................................ 23
Ryc. III.B.2. Zmodyfikowany higrometr Alluarda ............................................................... 24
I. CZĘŚĆ TEORETYCZNA
1. Wstęp
Właściwością cieczy jest zdolność do przechodzenia w stan pary. W dowolnej
temperaturze część cząsteczek z powierzchni cieczy przechodzi podczas wzmożonych ruchów
termicznych do fazy gazowej, co nazywamy parowaniem powierzchniowym. Tendencja do
parowania rośnie ze wzrostem temperatury cieczy. Zależy ona również od rodzaju cieczy (np.

3
eter, woda, oliwa). Eter, którego cząsteczki oddziałują na siebie stosunkowo słabymi siłami
paruje łatwiej niż woda, która z kolei paruje łatwiej niż oliwa czy rtęć.
Jeżeli parowanie cieczy odbywa się w przestrzeni zamkniętej, wypełnionej jedynie
częściowo cieczą parującą, to zostaje wkrótce osiągnięty stan nasycenia pary. Pomiędzy
cieczą i jej parą ustala się stan równowagi. Wielkością charakteryzującą parę w tym stanie jest
ciśnienie zwane też prężnością która zależna jest od temperatury cieczy parującej. Jest to para
nasycona - wypełnia ona przestrzeń nad cieczą.
Prężność pary nasyconej jest największa w tzw. punkcie krytycznym i równa prężności
krytycznej w tym punkcie. Jest to największa możliwa do osiągnięcia prężność pary nasyconej
(punkt krytyczny patrz rozdział 4).
Utrzymującą się stabilność fazy ciekłej i pary nasyconej można sobie wyobrazić z
kinetyczno-molekularnego punktu widzenia w następujący sposób: cząsteczki cieczy
podobnie jak cząsteczki fazy gazowej czyli pary nasyconej znajdują się w ciągłym ruchu.
Ruch ten jest ograniczony na skutek oddziaływania sił przyciągania międzycząsteczkowego.
Powierzchnię parującej cieczy mogą opuścić tylko te cząsteczki, których składowa prędkości
prostopadła do powierzchni jest znacznie większa od pewnej wartości średniej prędkości, a
więc cząsteczki o ściśle określonej energii. Równocześnie z parowaniem cieczy odbywa się
proces konkurencyjny: cząsteczki znajdujące się w fazie gazowej (w parze) nad cieczą
uderzają w powierzchnię cieczy i są przez nią wychwytywane. Liczba zderzeń z powierzchnią
cieczy jest wprost proporcjonalna do gęstości pary a więc do liczby cząsteczek w jednostce
objętości fazy gazowej, a także do ciśnienia pary (4).
Równowaga dwóch faz cieczy i pary zostaje osiągnięta gdy liczba cząsteczek cieczy
opuszczających jej powierzchnię zrówna się z liczbą cząsteczek powracających do cieczy z
fazy gazowej. Ciśnienie równowagowe zależy od liczby cząsteczek opuszczających określoną
powierzchnię cieczy w jednostce czasu. Ta liczba z kolei zależy od wielkości sił
oddziaływania międzycząsteczkowego, a zatem od rodzaju cieczy i od jej temperatury.
Obecność gazów obojętnych względem cieczy nad powierzchnią cieczy nie wpływa na
prężność pary tej cieczy. Przestrzeń zamknięta nad cieczą zostaje w każdym przypadku
nasycona parą tak jakby była całkiem pusta, co jest słuszne gdy prężność gazów jest
względnie mała. W przypadku wyższych ciśnień gaz obojętny wywiera określony wpływ na
prężność równowagową pary. Para nasycona nie stosuje się do praw gazu doskonałego.
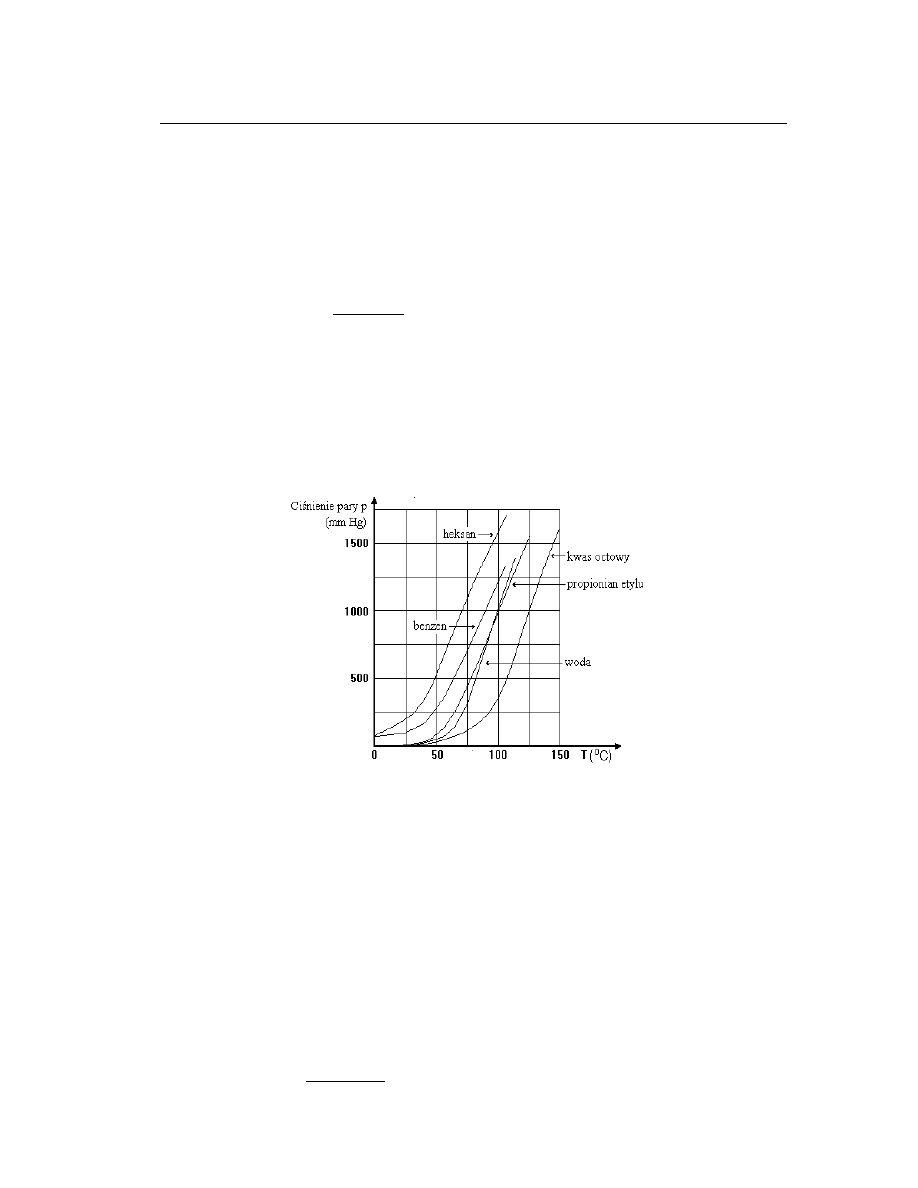
4
2. Zależność prężności pary nasyconej od temperatury.
Zależność prężności pary nasyconej od temperatury jest dla wszystkich cieczy podobna.
Najmniejsza prężność pary nasyconej występuje w temperaturze krzepnięcia. W miarę
podwyższania temperatury prężność pary rośnie wykładniczo i osiąga wartość maksymalną w
temperaturze krytycznej [wzór (2.1)]. Na ryc. 2.1 przedstawiono zależność prężności pary
nasyconej od temperatury dla kilku różnych cieczy.
Parowanie cieczy z powierzchni pęcherzyków pary powstających w sposób burzliwy
wewnątrz cieczy nazywamy wrzeniem. Mówimy krótko, że jest to parowanie zachodzące w
człej objętości cieczy. Pęcherzyki takie nie powstają samorzutnie. Zarodkiem albo inaczej
zaczątkiem nowej fazy (pary) jest pęcherzyk gazu, najczęściej powietrza, który jesy
rozpuszczony w cieczy. Podczas podgrzewania gaz wydziela się i osiada często na ściankach
naczynia, albo na powierzchni ciał stałych, które w cieczy się znajdują. Wydziela się również
w postaci pęcherzyków wędrujących ku powierzchni cieczy w miarę ogrzewania.
Ryc. 2.1. Prężność pary nasyconej kilku różnych cieczy w funkcji temperatury
W temperaturze wrzenia prężność pary nasyconej zawartej w pęcherzykach staje się
równa sumie ciśnień atmosferycznego nad powierzchnią cieczy i hydrostatycznego słupa
cieczy nad pęcherzykiem.Ten ostatni przyczynek do ciśnienia w praktyce się pomija.
Prężność pary nasyconej rośnie jak wiemy ze wzrostem temperatury. Jeżeli więc ciśnienie
atmosferyczne nad wrzącą cieczą wzrasta to temperatura wrzenia również wzrasta. Nie
zawsze jednak ciecz ogrzana do temperatury wrzenia wrze, nie zawsze widać tzw.
„bulgotanie” cieczy. Jeżeli ciecz jest odpowietrzona lub odgazowana efektu bulgotania nie
widać. Ciecz taką można ogrzać do temperatury wyższej niż temperatura wrzenia pod danym
ciśnieniem. Jest to ciecz przegrzana. Wystarczy lekki wstrząs mechaniczny, by ciecz
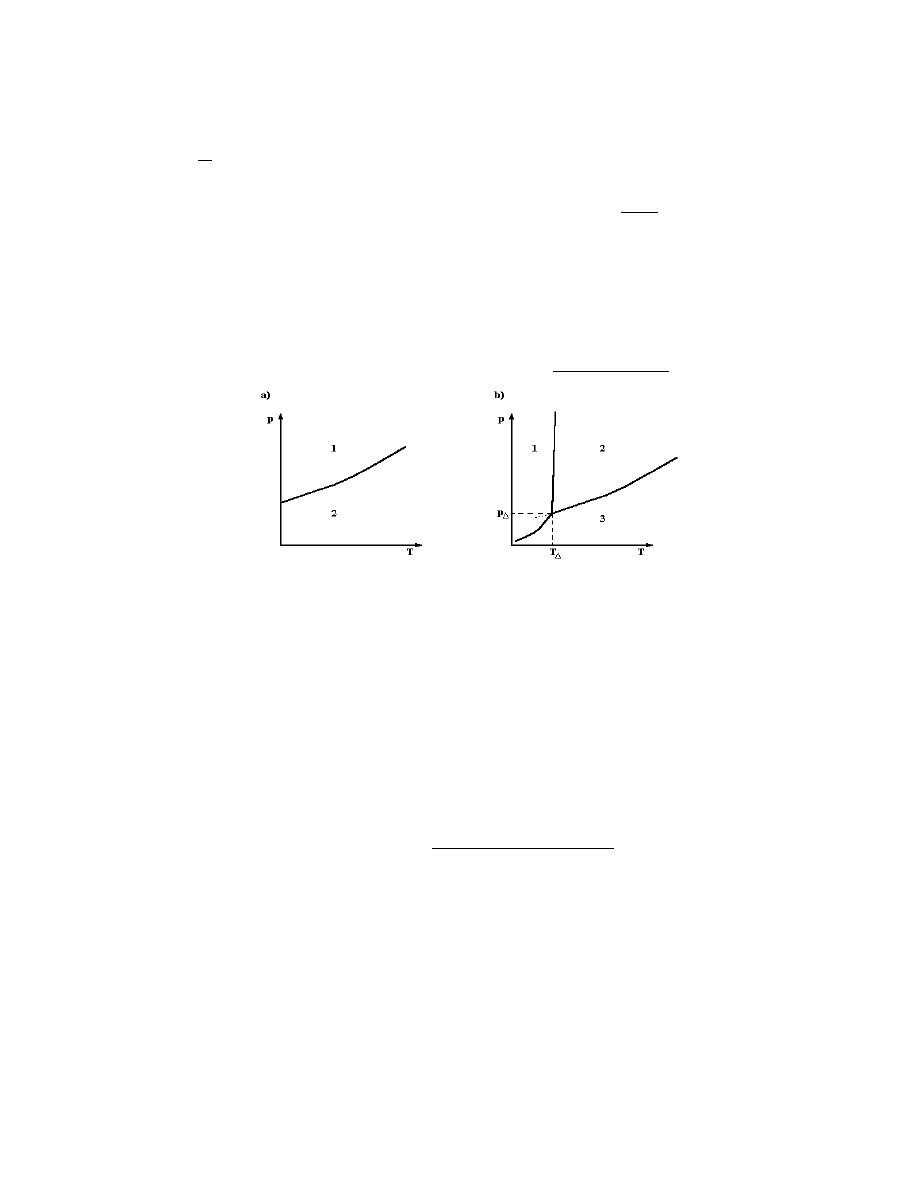
5
gwałtownie zaczęła wrzeć. Zależność prężności pary nasyconej p od temperatury wyraża się
za pomocą następującego równania empirycznego (równanie Augusta)
B
T
A
p
log
(2.1)
gdzie A, B, - stałe charakterystyczne dla cieczy, przy czym B zależy tylko od stosowanych
jednostek ciśnienia, T - temperatura w skali Kelvina. Równanie to można uzasadnić na drodze
rozważań termodynamicznych (3, 5 ,9).
3. Punkt potrójny
Krzywe prężności pary nasyconej przy ustalonej równowadze fazowej w zależności od
temperatury przedstawić można tak, jak na ryc. 3.1. Jest to diagram fazowy.
Ryc. 3.1. Wykres równowagi fazowej we współrzędnych (p i T)
a. Dla dwóch faz (1) i (2)
b. Dla trzech faz (1), (2) i (3), T
- temperatura punktu potrójnego
Krzywa na ryc. 3.1a dzieli powierzchnię wykresu na dwa obszary: obszar nad krzywą
odpowiadający warunkom istnienia tylko fazy (1) i obszar pod krzywą odpowiadający
warunkom istnienia tylko fazy (2). Punkty na krzywej odnoszą się do układu dwufazowego,
ich współrzędne podają warunki współistnienia faz (1) i (2). Podobnie na ryc. 3.1b dla
trzech faz.
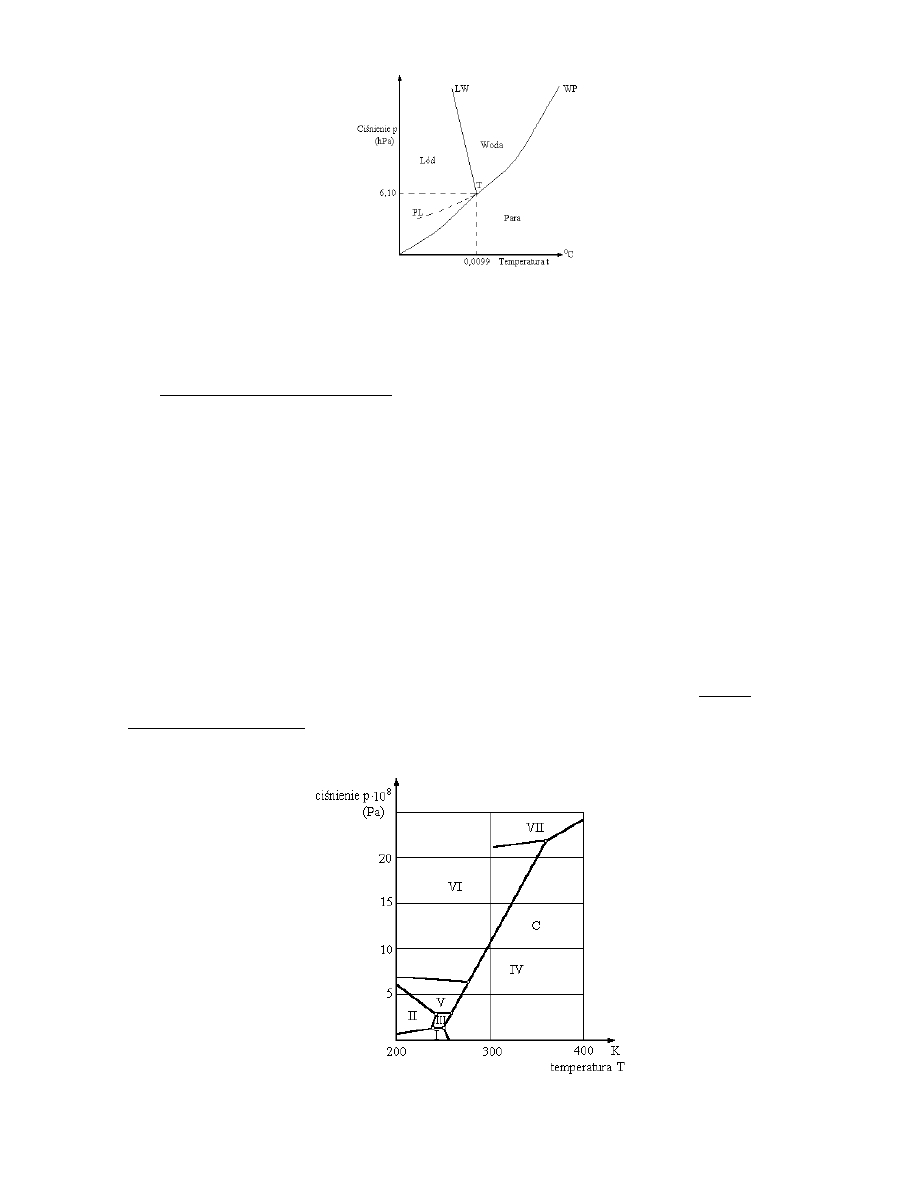
Na ryc. 3.2 przedstawiono diagram fazowy wody. Krzywe równowagowe dla wody
przecinają się w jednym punkcie zwanym punktem potrójnym wody. W punkcie tym ciało stałe
(lód) i ciecz (woda ciekła) mają parę o jednakowej prężności. W punkcie potrójnym molowa
entalpia sublimacji jest równa sumie molowej entalpii topnienia i molowej entalpii parowania
mol
par
mol
top
mol
sub
H
H
H
(3.1)
Jest tak, ponieważ ciało stałe przeprowadza się w parę poprzez fazę ciekłą.
6
Ryc. 3.2. Diagram fazowy dla wody, LW - krzywa równowagi lodu z wodą, WP - krzywa
równowagi wody z parą, PL - krzywa równowagi pary z lodem. Temperaturę
punktu potrójnego T podano w skali Celsjusza
Współrzędne punktu potrójnego wody są następujące:
p = 6,10 hPa, t = 0,0098oC (niekiedy podaje się wartość 0,0099oC). Jedynie w punkcie o
takich współrzędnych możliwe jest współistnienie trzech faz wody w równowadze. Lód jest
fazą stałą na lewo od krzywych LW i PL. Obszar między krzywymi LW i WP odpowiada
fazie wody ciekłej. Krzywa współistnienia wody ciekłej i pary wodnej kończy się w punkcie
krytycznym K, któremu odpowiadają parametry p
K
= 221,0
10
2
kPa, t
K
= 374,15
o
C).
Ryc. 3.2 przedstawia wykres fazowy wody dla niskich ciśnień zewnętrznych. Wykres
zawiera punkt potrójny T.
Przy wyższych ciśnieniach istnieje kilka dalszych punktów potrójnych, które odpowiadają
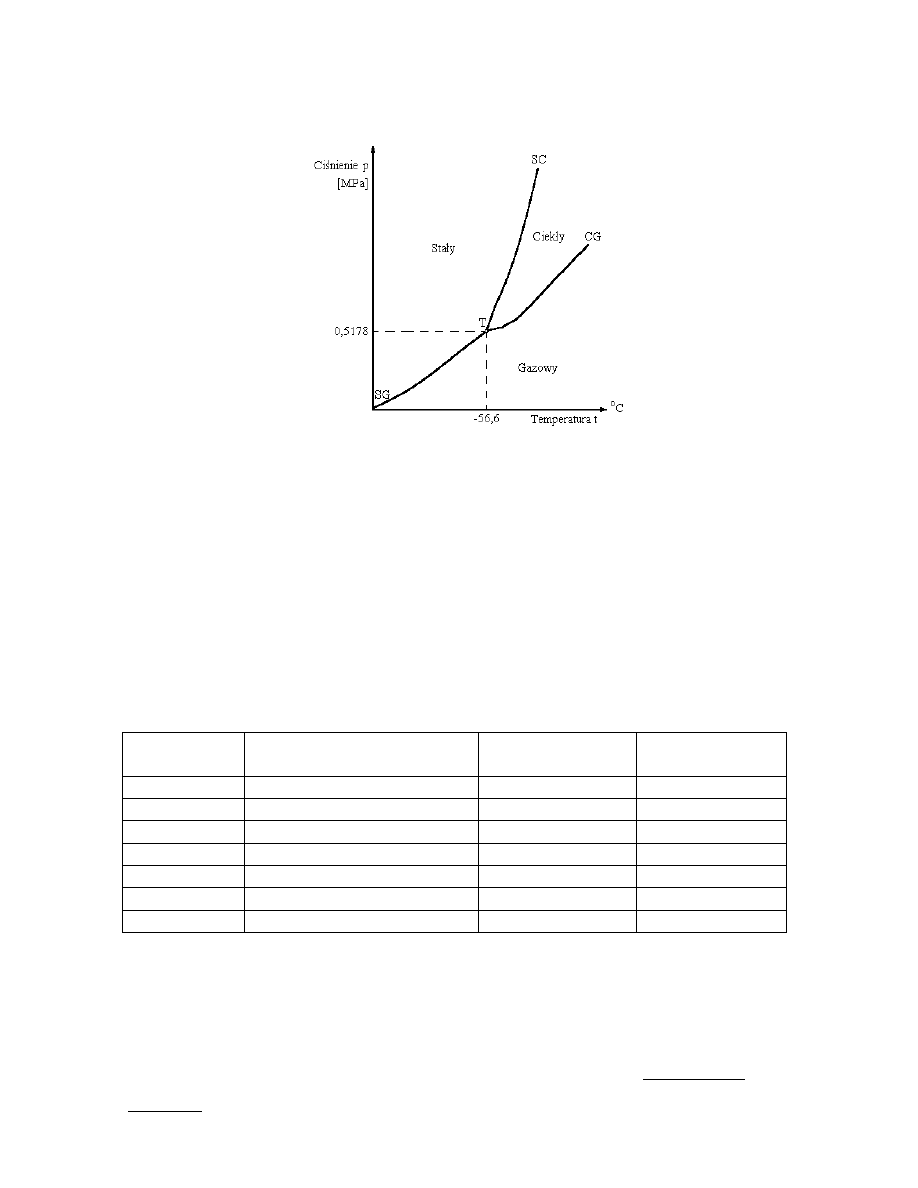
współistnieniu innych faz. Lód może w tych warunkach występować w postaci sześciu
odmian polimorficznych. Na ryc. 3.3 przedstawiono wykres fazowy wody w zakresie
wysokich ciśnień zewnętrznych.
7
Ryc. 3.3. Diagram fazowy dla wody w zakresie wysokich ciśnień. Kółkami (o) oznaczono
punkty potrójne. T - temperatura w skali Kelvina (1 kbar=10
2
MPa)
Ryc. 3.4. Diagram fazowy dla dwutlenku węgla. SC - krzywa równowagi fazy stałej z gazową,
CG - krzywa równowagi fazy ciekłej z gazową, SG - krzywa równowagi fazy stałej
z gazową
Na ryc. 3.4 przedstawiono dla porównania wykres fazowy dwutlenku węgla (CO
2
).
Zbadano siedem punktów potrójnych wody. W czterech spośród nich współistnieją ze sobą
różne odmiany lodu i ciekła woda, w dwóch - trzy różne odmiany polimorficzne lodu. Dane
punktów potrójnych wody zawiera tabela I.1.
Tabela I.1
Dane punktów potrójnych wody w funkcji ciśnienia (patrz ryc. 3.3)
Punkt potrójny Fazy pozostające ze sobą w
równowadze
Ciśnienie (MPa)
Temperatura (
o
C)
1
I, woda, para
0,00061
0,0098
2
I, III, woda
207,2
-22,0
3
I, II, III
212,8
-34,7
4
II, III, IV
344,5
-24,3
5
III, IV, woda
346,5
-17,0
6
IV, V, woda
625,7
0,16
7
V, VI, woda
2269,7
81,6
4. Kinetyka parowania. Szybkość parowania, wpływ różnych czynników na szybkość
parowania
Szybkość powierzchniowego parowania cieczy można zdefiniować korzystając z założeń
kinetyczno-molekularnej teorii budowy materii. Ograniczymy się tu do rozpatrywania
parowania zachodzącego w temperaturach niższych od temperatury wrzenia.
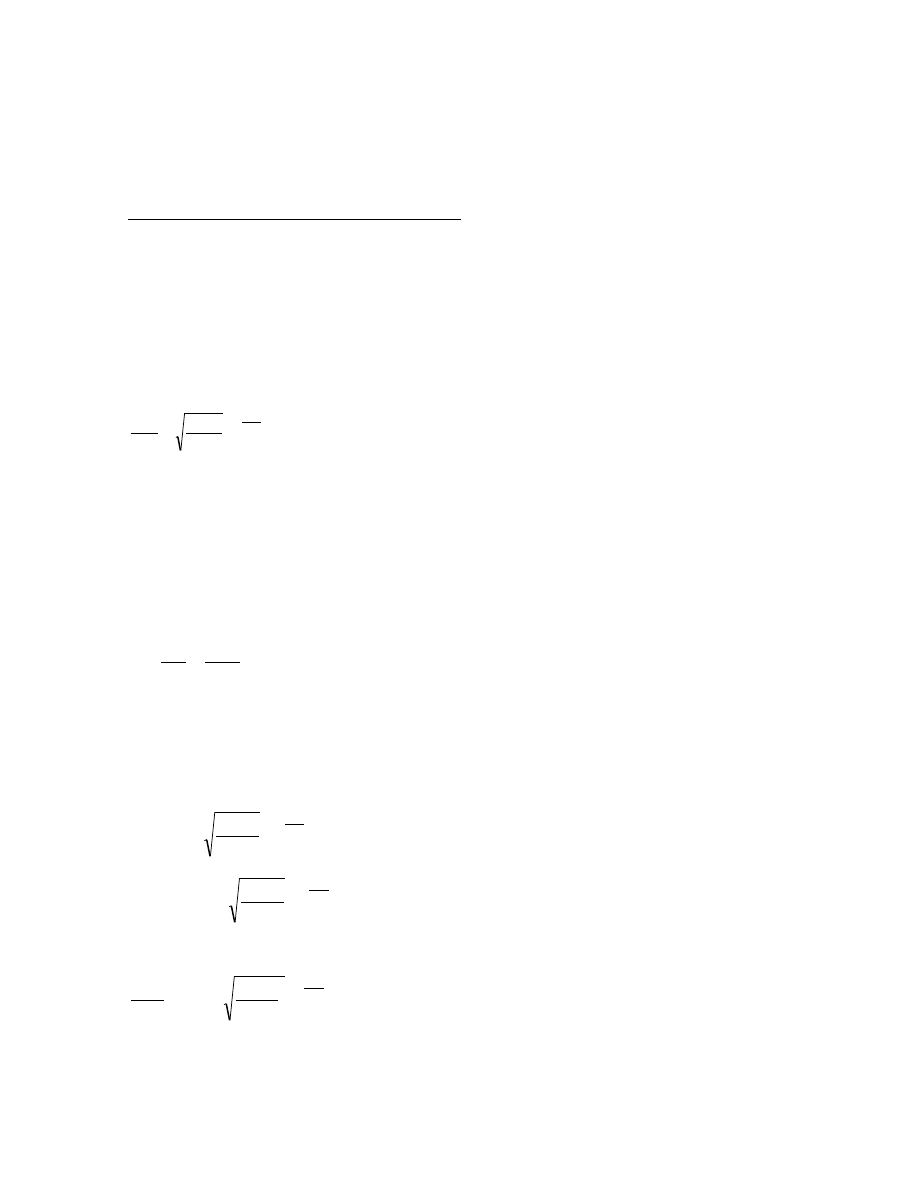
8
W tych temperaturach większość cząsteczek fazy ciekłej, które w wyniku ruchów
termicznych docierają do powierzchni cieczy nie ma wystarczająco dużej energii, koniecznej
do pokonania sił przyciągania występujących na powierzchni. W związku z czym nie mogą
one opuścić powierzchni cieczy i przejść do fazy gazowej. Do tej fazy przechodzi jedynie
niewielki ułamek całkowitej liczby cząsteczek. Wartość tego ułamka można podać
korzystając z prawa rozkładu Maxwella prędkości cząsteczek (5, 7). W ułamku tym mieści się
liczba tych cząsteczek, których składowa prędkości prostopadła do powierzchni cieczy v
x
jest
większa od pewnej, ściśle określonej wartości granicznej prędkości v
gr
.
Według rozkładu Maxwella w granicach prędkości v
x
do v
x
+dv
x
następujący ułamek
ogólnej liczby cząsteczk zawiera takie właśnie prędkości
dN
N
RT
e
d
x
x
2
v
2RT
x
x
2
v
(4.1)
gdzie
- masa cząsteczkowa, T - temperatura a skali Kelvina, R - stała Clapeyrona.
Przedstawmy to bardziej obrazowo. Jeżeli z cieczy "wytniemy" słup o głębokości v
x
t
(gdzie t - czas parowania) i o powierzchni przekroju poprzecznego S, to wszystkie cząsteczki
o prędkości v
x
, które znajdują się w objętości V = v
x
t S osiągną w czasie t powierzchnię
cieczy. Załóżmy, że w jednostce objętości cieczy jest C cząsteczek
C
N
V
N
tS
x
x
v
x
(4.2)
stąd
N
x
= C v
x
t S
(4.3)
Obliczmy z (4.1) dN
x
dN
N
RT
e
d
x
x
2
v
2RT
x
x
2
v
(4.4)
dN
C
tS
RT
e
d
x
x
v
v
v
2RT
x
x
2
2
(4.5)
Częstość zderzeń cząsteczek z powierzchnią będzie
dN
t
C
S
RT
e
d
x
x
v
v
v
2RT
x
x
2
2
(4.6)
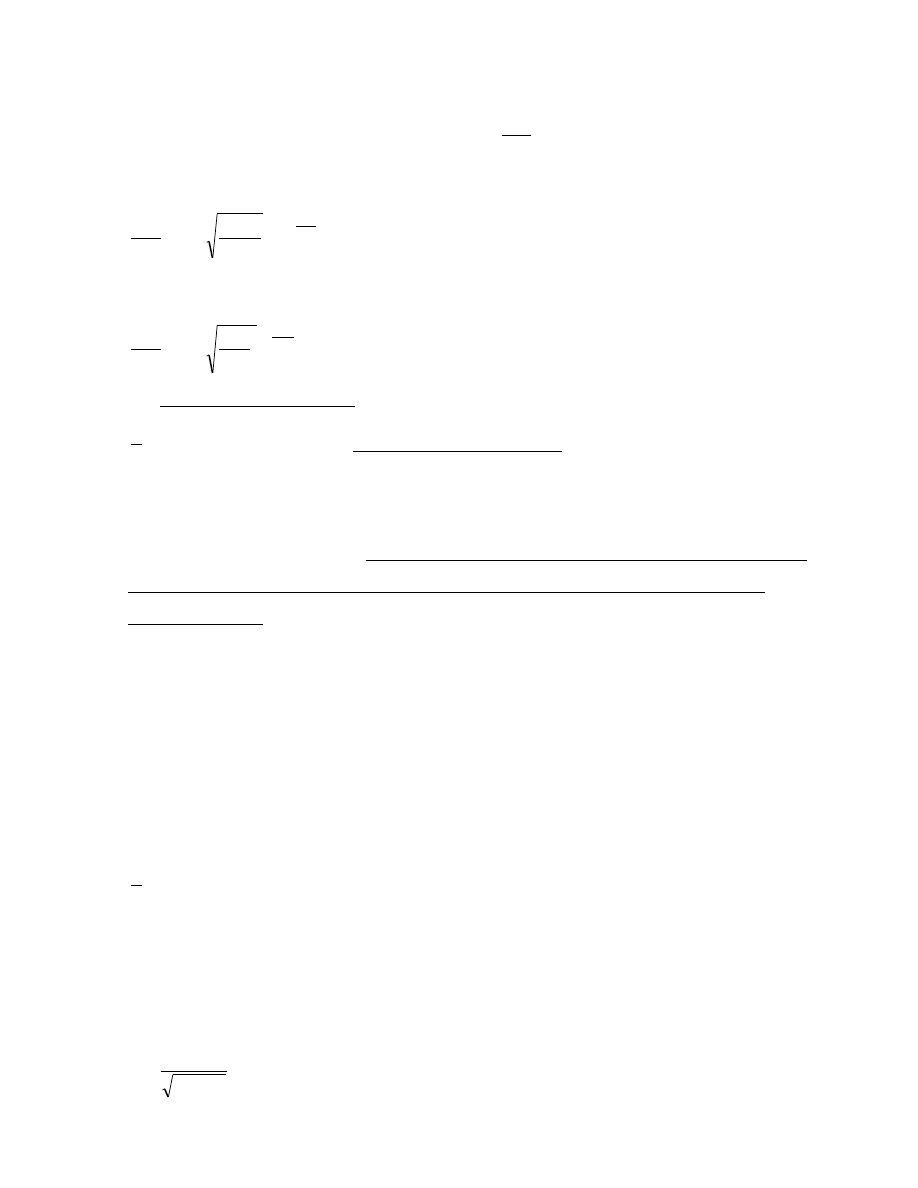
9
Jeżeli N
gr
jest graniczną liczbą cząsteczek uderzających o powierzchnię przy prędkości
granicznej v
gr
(określonej wyżej), częstość uderzeń
N
t
gr
cząsteczek o prędkości większej niż
v
gr
(a więc przechodzących do fazy gazowej) będzie równa
N
t
C S
RT
e
gr
2
v
2RT
x
x
v
x
2
gr
v dv
(4.7)
co daje wartość
N
t
C S
RT
e
gr
2
v
2RT
gr
2
(4.8)
Jest to szybkość parowania. Wyrażenie występujące w wykładniku potęgowym i równe
1
2
v
gr
2
odpowiada minimalnej molowej energii kinetycznej cząsteczek fazy ciekłej w
kierunku prostopadłym do powierzchni cieczy. Jest to najmniejsza energia konieczna do
przejścia cząsteczek z fazy ciekłej do fazy gazowej.
Z zależności (4.8) widać, że szybkość parowania rośnie liniowo ze wzrostem powierzchni
parującej cieczy S, zależy od rodzaju cieczy oraz rośnie ze wzrostem temperatury T (dla
wszystkich cieczy).
Również przepływ powietrza nad powierzchnią parującą zwiększa szybkość parowania -
poruszające się powietrze porywa cząsteczki fazy ciekłej i odprowadza je znad powierzchni
parującej obniżając nieco ciśnienie nad powierzchnią parującą, poprawiając w ten sposób
warunki parowania (możliwego w naczyniach otwartych z cieczą).
Energia ta (molowa, kinetyczna) powinna być równa molowej entalpii parowania.
Wytworzona para zwiększając swą objętość wykonuje pracę objętościową przy stałym
ciśnieniu. Będzie więc
1
2
v
gr
2
H
par
mol
(4.9)
W stanie równowagi szybkość parowania jest równa szybkości kondensacji pary (czyli
szybkości procesu odwrotnego do parowania, polegającego na przejściu fazy gazowej w fazę
ciekłą). Liczba cząsteczek fazy gazowej Z uderzających przy ciśnieniu p i temperaturze T o
powierzchnię S w czasie t w tym procesie jest równa
Z
NpSt
RT
2
(4.10)

10
Szybkość kondensacji przy założeniu, że każda cząsteczka fazy gazowej uderzająca o
powierzchnię pozostanie w niej, będzie więc
Z
t
NpS
RT
2
(4.11)
Ponieważ
Z
t
N
t
gr
(4.12)
mamy
p
C
N
RTe
H
RT
par
mol
(4.13)
albo po zlogarytmowaniu
ln
ln
p
H
RT
T
const
par
mol
(4.14)
co przypomina wzór (2.1), wyprowadzony również na podstawie przesłanek
termodynamicznych, przy założeniu, że zmiany ln T są porównywalne ze zmianami
1
T
i w
pierwszym przybliżeniu wielkości te można uznać za stałe (ln T
const).
5. Para nienasycona i jej właściwości, różnice między parą nasyconą a nienasyconą
Para jest nienasycona gdy w danej temperaturze posiada prężność niższą od maksymalnej
możliwej czyli od prężności pary nasyconej w tej temperaturze. Prężność pary nienasyconej
zależy od objętości którą para zajmuje - podczas gdy prężność pary nasyconej od zajmowanej
przez parę objętości nie zależy. Para nienasycona jest w stanie równowagi tylko wtedy, gdy
nie ma kontaktu z fazą skondensowaną tej samej substancji. W kontakcie z fazą
skondensowaną prężność pary nienasyconej wzrasta (w wyniku parowania lub sublimacji), aż
do chwili gdy para osiągnie stan nasycenia. Parę nienasyconą można przeprowadzić w stan
nasycenia również wtedy, gdy nie ma ona kontaktu z fazą skondensowaną.
Opis właściwości par nienasyconych jest trudny. Najlepiej opisuje te pary równanie gazu
rzeczywistego van der Waalsa. Mniej dokładnie opisuje pary nienasycone równanie
Clapeyrona w granicach stosowalności prężności, p<p
n
(T), gdzie p
n
(T) prężność pary
nasyconej w temperaturze T. Równanie to tym dokładniej opisuje parę nienasyconą im
większa jest różnica prężności pary nienasyconej w stosunku do prężności pary nasyconej w
temperaturze T. Odchylenia od prawa Clapeyrona są dla par nienasyconych większe niż dla
gazów rzeczywistych.

11
Wykorzystując równanie Clapeyrona możemy wyznaczyć masę pary wodnej, którą
zawiera 1 m
3
powietrza w temperaturze otoczenia, przy ciśnieniu atmosferycznym b (b -
ciśnienie barometryczne w paskalach). Zakładając, że V = 1 m
3
,
= 18 kg/kmol, T = 273,2 +
t, R = 8,314 kJ/kmol
K, t - temperatura otoczenia w skali Celsjusza otrzymujemy po
przekształceniach równania Clapeyrona następującą zależność
pV
m
RT
(5.1)
m
V
R
p
t
273
m
m
kg
kmol
kJ
kmol K
p
t
1
18
8 314
273
3
,
m
p
t
2 1650
273
,
m
p
t
kg
2 1650
273
,
(5.2)
Masę pary otrzymujemy w kilogramach jeżeli prężność pary wodnej nienasyconej p
podamy w kilopaskalach.
Kondensowanie par
Jeżeli substancja przechodzi ze stanu skupienia gazowego w stan bardziej
skondensowany ulega kondensacji. Pod tym pojęciem rozumiemy dwie przemiany:
przechodzenie pary w ciecz czyli skraplanie i przechodzenie pary w ciało stałe czyli
resublimację.
Skraplanie zachodzi w temperaturach wyższych od temperatury topnienia, resublimacja
zachodzi w temperaturach niższych od temperatury topnienia. Omówimy obecnie skraplanie
par. Weźmy pod uwagę masę m pary nasyconej o gęstości
n
w ustalonej temperaturze.
Objętość, którą para ta może zajmować, będąc parą nasyconą jest
V
m
n
. Niech para ta
(nasycona) zajmuje objętość V, którą wyznacza jej naczynie z ruchomym tłokiem jak na ryc.
5.1.
Ryc. 5.1. Naczynie z ruchomym tłokiem i parą o objętości V

12
W stanie równowagi objętość pod tłokiem jest wypełniona parą nasyconą całkowicie.
Utrzymujmy stałą temperaturę pary i powiększajmy objętość dostępną parze. Prężność pary
zmniejszy się i para przestaje być nasyconą - staje się parą nienasyconą. Przy zmniejszaniu
objętości zajmowanej przez parę nasyconą V, np. do objętości V
1
(V
1
<V), prężność pary
pozostaje stała natomiast pewna masa pary nasyconej ulega skropleniu. Jeżeli masa pary
skroplonej (czyli masa cieczy) jest równa v
1
c
, gdzie v
1
- objętość powstałej ze skroplenia
cieczy,
c
- gęstość cieczy, to można napisać następującą równość
m
V
V
n
n
c
1
v
v
1
1
(5.3)
skąd można obliczyć objętość skroplonej cieczy
v
1
n
c
n
V
V
1
Gdy cała para nasycona ulegnie skropleniu to znaczy gdy V
1
= 0 objętość powstałej
cieczy wyniesie
v =
n
c
V
(5.4)
Przy dalszym zmniejszaniu objętości (już nie ma pary, w naczyniu znajduje się tylko
ciecz) przy wzroście ciśnienia działającego na ciecz następuje niewielkie zmniejszanie
objętości cieczy - ciecz jest mało ściśliwa i dlatego uzyskuje się na wykresie zależności
ciśnienia i objętości odcinek niemal równoległy do osi ciśnień. Ryc. 5.1 przedstawia wyżej
omówione procesy poczynając od pary nienasyconej kończąc na cieczy, która nie zmienia
niemal swej objętości w czasie izotermicznego sprężania. Przedstawia to ryc. 5.2.
Ryc. 5.2. Zależność ciśnienia od objętości przy izotermicznym sprężaniu pary nienasyconej,
kondensacji pary nasyconej i izotermicznego sprężania cieczy
Ryc. 5.2 przedstawia jedną z izoterm złożoną z trzech fragmentów obrazujących opisane
wyżej procesy: zgęszczania izotermicznego pary nienasyconej (I), skraplania pary nasyconej
będącej w równowadze z cieczą (II) i sprężanie cieczy (III).
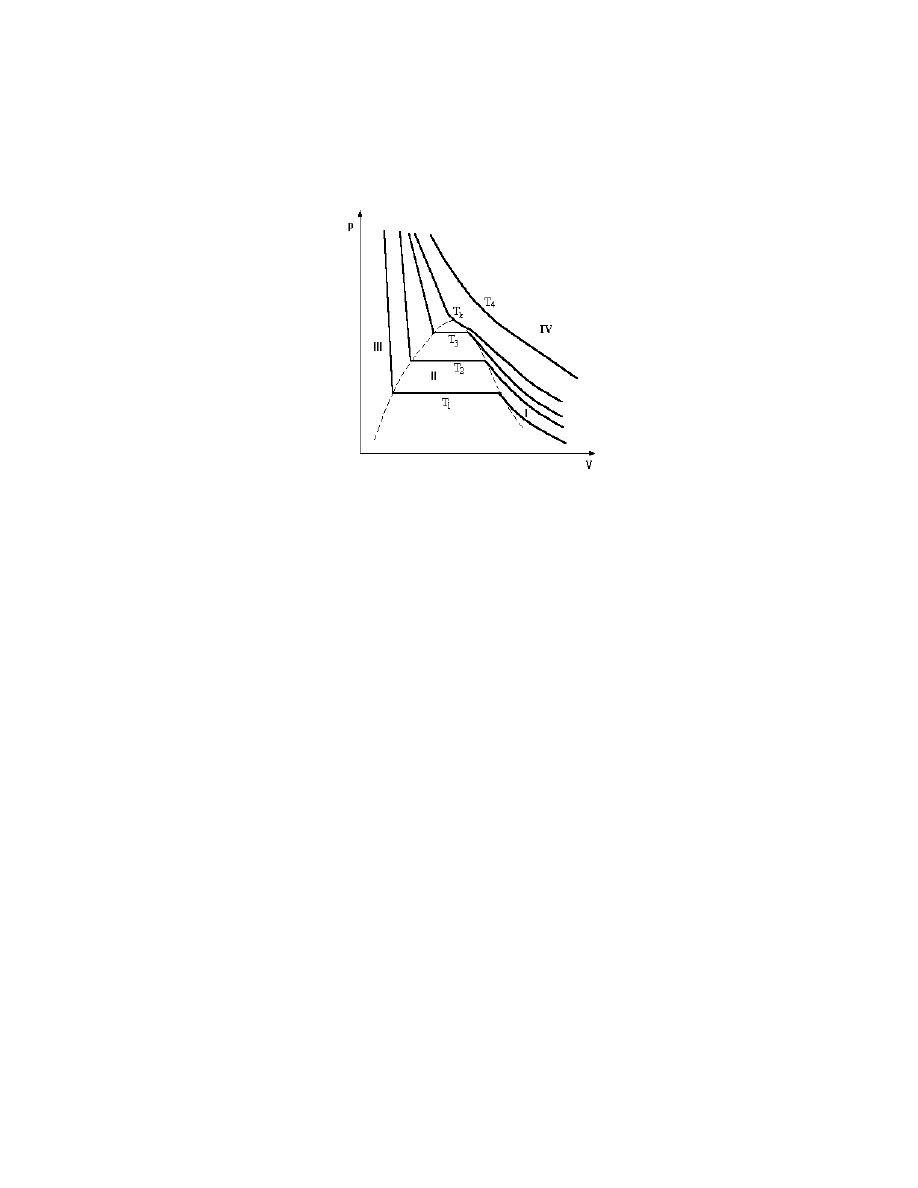
13
Na ryc 5.3 przedstawiamy izotermy obrazujące te same procesy ale przeprowadzone w
coraz wyższych temperaturach (T
3
>T
2
>T
1
). Im wyższa jest temperatura tym wyżej położona
jest izoterma. Ciśnienie pary nasyconej wzrasta a długość odcinka poziomego maleje - maleje
więc objętość pary nasyconej (rośnie objętość cieczy powstałej ze skroplenia pary nasyconej).
Ryc. 5.3. Zależność ciśnienia od objętości przy izotermicznym sprężaniu pary nienasyconej,
kondensacji pary nasyconej i izotermicznego sprężania cieczy dla różnych
temperatur
W pewnej temperaturze objętość i gęstość pary nasyconej staje się równa objętości i
gęstości cieczy. Odcinek poziomy izotermy redukuje się do punktu.
Temperatura w której to zachodzi jest to temperatura krytyczna T
k
. Jest to górna granica
zakresu temperatur, w których substancja może występować w stanie ciekłym. Ciśnienie pary
nasyconej w tej temperaturze nazywamy ciśnieniem krytycznym. Izoterma przechodząca
przez punkt krytyczny nazywa się izotermą krytyczną. W temperaturach wyższych od
krytycznej prężność fazy gazowej może być dowolnie duża (krzywa najwyższa na ryc. 5.3 jest
to izoterma sprężania fazy gazowej w temperaturze wyższej od T
k
i równej T
4
).
Jeżeli połączymy krzywą przerywaną końce odcinków poziomych poszczególnych
izoterm płaszczyzna wykresu zostanie podzielona na cztery obszary:
I - obszar istnienia pary nienasyconej (ograniczony od góry izotermą krytyczną),
II - obszar współistnienia pary nasyconej i cieczy,
III - obszar istnienia cieczy,
IV - obszar fazy lotnej (od izotermy krytycznej w górę).
W temperaturach niższych od temperatury krytycznej energia wewnętrzna cieczy
powstającej ze skroplenia pary jest niższa od energii wewnętrznej pary. Podczas skraplania
układ ciecz-para nasycona musi kontaktować się termicznie z otoczeniem, któremu nadmiar

14
energii przekazuje. Ilość ciepła oddanego przy skraplaniu jednostki masy pary nasyconej jest
to ciepło skraplania.
Ciepło skraplania (a również ciepło parowania) jest tym mniejsze im temperatura w
której zachodzi jest bliższa temperaturze krytycznej. W temperaturze krytycznej T
k
i pod
ciśnieniem krytycznym ciepło skraplania pary nasyconej i ciepło parowania cieczy są równe
zeru (energie wewnętrzne jednostki masy cieczy i pary są sobie równe). Na podstawie ryc. 5.3
możemy przedstawić sposoby przeprowadzenia pary nienasyconej w parę nasyconą.
Pierwszym sposobem przeprowadzenia pary nienasyconej w parę nasyconą jest obniżenie
temperatury pary nienasyconej przy zachowaniu stałej objętości pary czyli oziębianie pary w
stałej objętości. Ciśnienie pary nienasyconej zachowuje się w tym przypadku jak ciśnienie
gazu doskonałego.
Drugim sposobem - jest zmniejszenie objętości pary nienasyconej przy stałej
temperaturze. Ciśnienie pary nienasyconej wzrasta w tym przypadku odwrotnie
proporcjonalnie do objętości aż do osiągnięcia wartości p
n
(prężności pary nasyconej). Jest to
izotermiczne zgęszczanie pary nienasyconej.
Trzecim sposobem - jest obniżanie temperatury pary nienasyconej przy stałej prężności aż
do wartości przy której staje się równa prężności pary nasyconej p
n
. Jest to izobaryczne
oziębianie pary nienasyconej.
Stosując równanie Clapeyrona do pary nienasyconej możemy obliczyć jej prężność
pV
m
RT V
:
p
m
V
RT
1
p
RT
(5.5)
gdzie
- masa cząsteczkowa pary (dla wody
=18 g),
- gęstość pary. Jeżeli prężność pary
nienasyconej p w temperaturze T ma wartość graniczną i równą prężności pary nasyconej
p
n
(T) gęstość pary staje się równa
n
(T).
p T
T
RT
n
n
( )
( )
(5.6)
n
(T) jest graniczną wartością gęstości pary nienasyconej, równą gęstości pary nasyconej w
temperaturze T. Widzimy, że prężność par jest wprost proporcjonalna do ich gęstości, co
wykorzystamy przy wyznaczaniu wilgotności względnej.
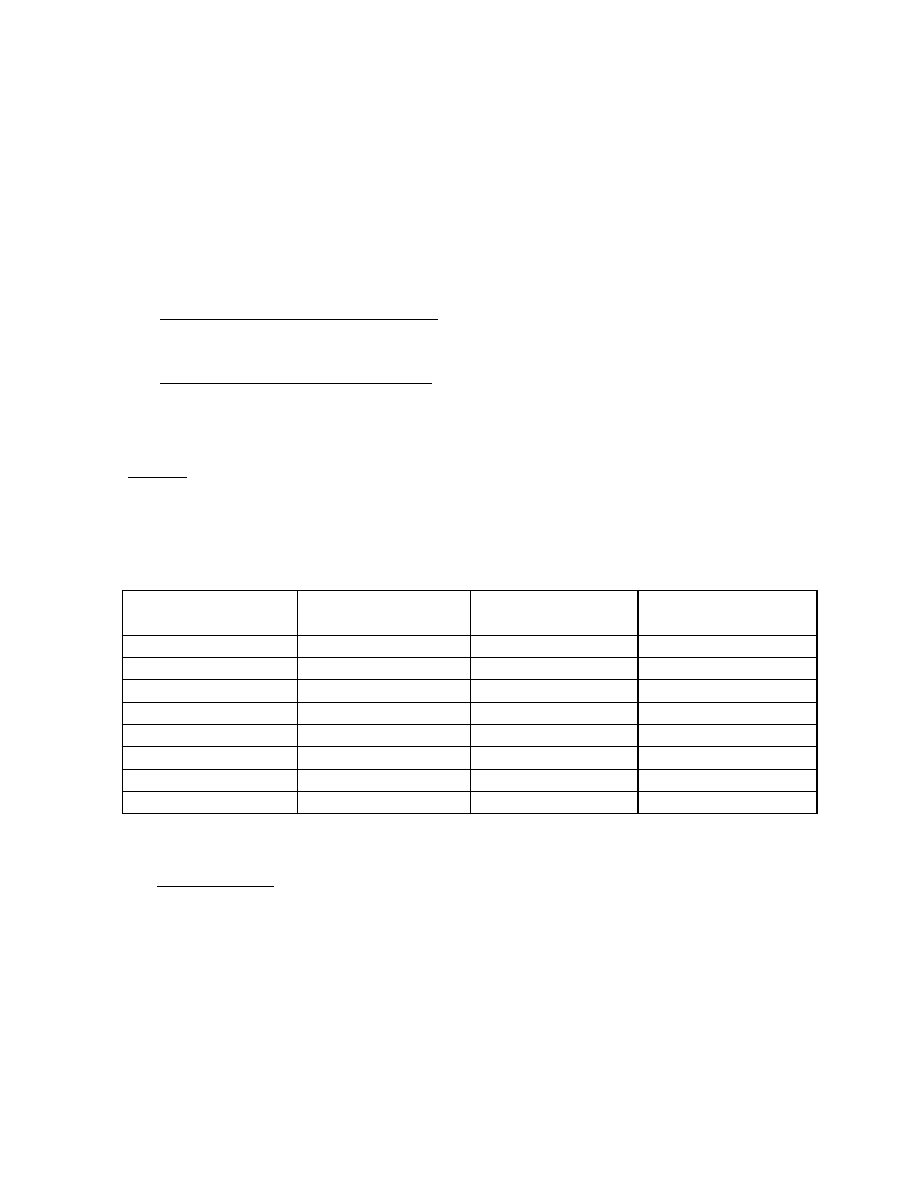
15
Para nasycona posiada swą gęstość - jest to masa pary zawartej w jednostce objętości i
wyrażamy ją w g/m
3
. Para nasycona ma gęstość największą, jaką para może osiągnąć w danej
temperaturze, zależy od rodzaju cieczy. Gęstość pary nasyconej rośnie ze wzrostem
temperatury, podczas gdy gęstość cieczy maleje ze wzrostem temperatury (z wyjątkiem wody,
która wykazuje anomalną rozszerzalność objętościową). Często zamiast gęstości pary
nasyconej podaje się tzw. objętość właściwą. Jest to objętość zajmowana przez jednostkę
masy pary nasyconej (np. 1 gram, 1 kilogram) w danej temperaturze.
Zmniejszenie objętości pary nasyconej w stałej temperaturze powoduje skroplenie tej
pary a stan równowagi faza ciekła-faza gazowa w dalszym ciągu się utrzymuje.
Zwiększenie objętości pary nasyconej powoduje wyparowanie pewnej objętości cieczy
bez obniżania ciśnienia pary nasyconej.
W tabeli 5.1 podano wartości ciepła parowania c
par
wody dla kilku temperatur.
Uwaga! Wartość ciepła parowania odczytywana z tabeli winna być pomnożona przez 10
3
(np.
dla 100
o
C ciepło parowania wynosi 2258
10
3
J/kg).
Tabela 5.1
Ciepło parowania wody w funkcji temperatury
Temperatura wody
(
o
C)
Ciepło parowania
10
-3
(J/kg)
Temperatura wody
(
o
C)
Ciepło parowania
10
-3
(J/kg)
0
2493
225
1838
20
2447
250
1717
40
2401
275
1574
100
2358
300
1404
125
2189
325
1190
150
2120
350
892
175
2043
374,2
0
200
1961
Analizując dane w tabeli 5.1 zauważamy, że ciepło parowania w temperaturze wrzenia
jest jedną z wartości, które ciepło parowania przyjmuje w każdej temperaturze i to wcale nie
największą.
W temperaturze wrzenia parowanie obejmuje nie tylko powierzchnię cieczy ale całą jej
objętość i odbywa się w sposób gwałtowny.
6. Wilgotność bezwzględna i względna powietrza
Powietrze w otoczeniu zawiera pewną ilość pary wodnej. Nie trudno wyjaśnić skąd się
ona bierze - parują wszelkie naturalne zbiorniki wodne, rzeki, jeziora, oceany, sztuczne
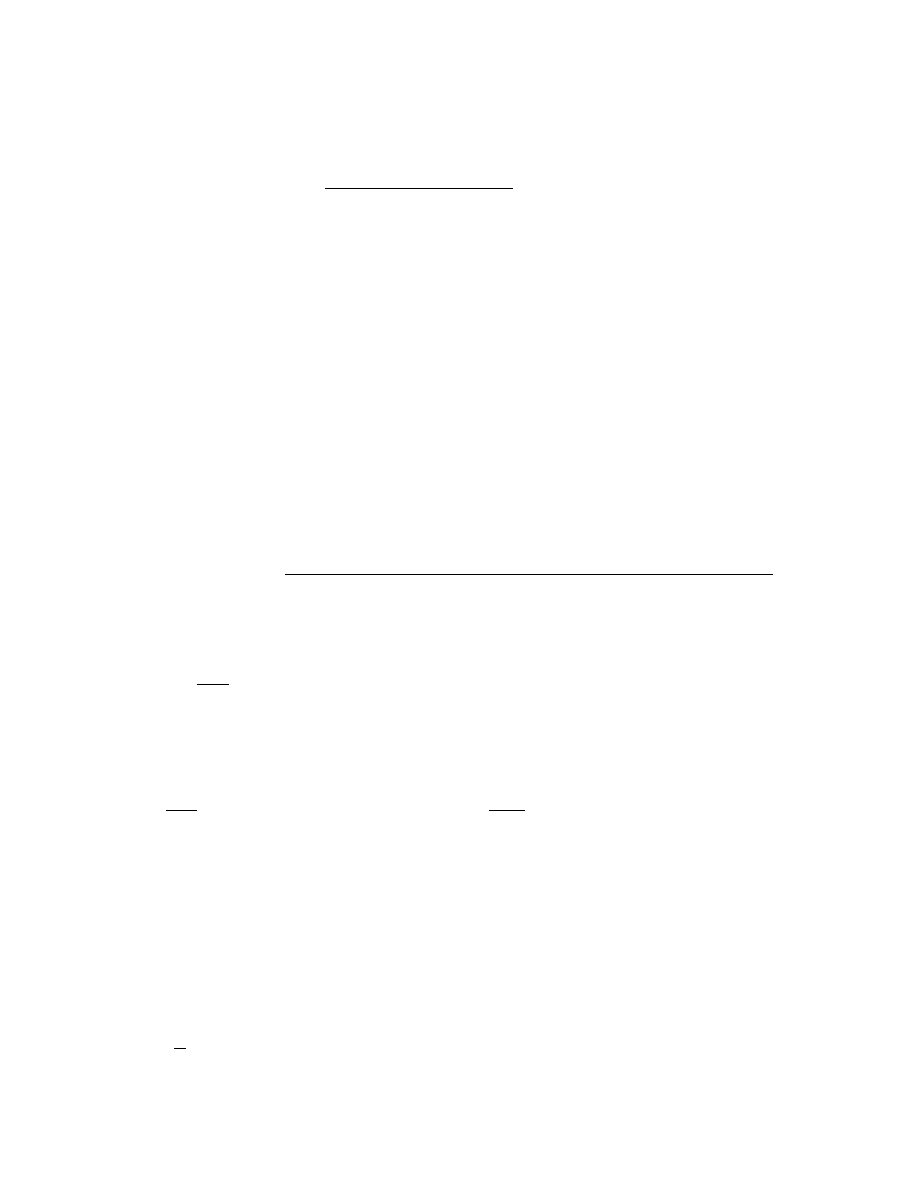
16
akweny. W przyrodzie zauważamy naturalny obieg wody, który także dostarcza lokalnie
wilgoci w postaci szronu, rosy, deszczu, gradu, śniegu.
W każdym metrze sześciennym powietrza atmosferycznego zawarta jest pewna masa pary
wodnej. Masa ta jest miarą wilgotności bezwzględnej. Odpowiada jej gęstość [
= m/V]
podawana w g/m
3
oraz prężność pary wodnej podawana w kPa. Powietrze atmosferyczne w
otoczeniu jest poza wilgotnością scharakteryzowane przez temperaturę T podawaną
najczęściej w skali Celsjusza (w Polsce) i ciśnienie powietrza, które podaje się również w
kPa. Charakteryzując warunki środowiska podajemy więc wilgotność, temperaturę powietrza,
ciśnienie powietrza.
Obecność pary wodnej w powietrzu czyni powietrze mniej nasyconym parą wodną (dzień
słoneczny, upalny) lub niemal nasyconym parą wodną (dzień pochmurny, deszczowy).
Oznacza to w przypadku pary wodnej nienasyconej, że w 1 m
3
powietrza może się jeszcze
zmieścić pewna masa pary wodnej i dopiero wtedy ten sam 1 m
3
powietrza będzie zawierał
parę nasyconą.
Wilgotność bezwzględna, aczkolwiek mówi o masie pary wodnej zawartej w powietrzu w
danej temperaturze T nie mówi o tym jak bardzo para ta różni się od stanu pary nasyconej, od
stanu nasycenia, co niekiedy jest bardzo ważne. O tej różnicy informuje wilgotność względna.
Wilgotność względna jest określona jako stosunek masy m pary wodnej znajdującej się w
danej objętości w powietrzu w danej temperaturze do masy m
nas
pary wodnej, która nasyca tę
objętość w tej samej temperaturze
%
100
nas
m
m
W
(6.0)
Ciśnienie (prężność) pary wodnej p jest proporcjonalna do masy pary, a temem
wilgotność względną można wyrazić jako
%
100
nas
p
p
W
bądź
%
100
nasn
W
(6.1)
p – ciśnienie pary wodnej znajdującej się w powietrzu w danej temperaturze
p
n
– ciśnienie pary nasyconej w danej temperaturze.
Wynika to z zastosowania równania Clapeyrona do pary wodnej nienasyconej o parametrach p
i
oraz do pary wodnej nienasyconej ale bardzo bliskiej stanu nasycenia o parametrach p
n
i
n
.
1.
p
RT
1

17
2.
p
RT
n
n
1
Dzieląc powyższe równości stronami otrzymuje się wzór na wilgotność względną
p
p
W
n
n
(6.3)
Istnieją tablice zestawiające gęstości i prężności pary wodnej nasyconej w funkcji
temperatury. Mając daną prężność p lub gęstość
pary wodnej, zawartej aktualnie w 1 m
3
otaczającego powietrza oraz odczytując z tablic prężność pary wodnej nasyconej p
n
lub
gęstość pary wodnej nasyconej
n
w tej samej temperaturze można obliczyć wilgotność
względną pary wodnej w temperaturze otoczenia.
Wilgotność względna ma duże znaczenie higieniczne dla człowieka. Normalne
(i prawidłowe) działanie skóry i płuc wymaga wilgotności względnej zawartej w granicach
40-70%. Powietrze suche wywołuje zbyt szybkie parowanie skóry i przez to gwałtowne
uczucie pragnienia. W powietrzu bardzo wilgotnym przeciwnie, parowanie odbywa się zbyt
wolno i odczuwa się duszące uczucie upału.
Aby człowiek mógł czuć się dobrze i aby mógł sprawnie pracować powinna być
zapewniona odpowiednia wilgotność pomieszczeń w których przebywa (mieszkanie, zakład
pracy). Zbytnie zawilgocenie pomieszczeń może być przyczyną chorób goścowych (lub
przeziębieniowych), które prowadzą do niebezpiecznych stanów przewlekłych w układzie
stawowo- ruchowym i oddechowym (nieżyty). Wilgotność powietrza ma istotny wpływ na
przebieg wielu reakcji chemicznych i procesów życiowych. Na wielu produktach
żywnościowych, wielu lekarstwach znajdujemy napisy „przechowywać w suchym i chłodnym
miejscu”. Oto dlaczego: duża zawartość pary wodnej w powietrzu sprzyja rozwojowi bakterii,
pleśni, przyspiesza reakcje utleniania, korozję metali. Zbyt mała wilgotność przyspiesza
parowanie - w wielu przypadkach niepożądane.
II. CEL ĆWICZENIA
Celem ćwiczenia jest wyznaczenie aktualnej wilgotności bezwzględnej i względnej
powietrza przy zastosowaniu psychrometru Assmanna lub higrometru Alluarda.
Wilgotność powietrza w temperaturze t (w skali Celsjusza) wyrazi się stosunkiem
prężności pary wodnej nienasyconej w powietrzu p w temperaturze otoczenia do prężności

18
pary wodnej nasyconej p
n
, która nasyciłaby to samo powietrze w tej samej temperaturze.
Skorzystamy więc ze wzoru (7.2)
%
100
n
p
p
W
III. WYKONANIE ĆWICZENIA
III.A. Wyznaczanie wilgotności względnej powietrza metodą psychrometru Assmanna
(lub Augusta)
III.A.1. Zasada pomiaru
W celu wyznaczenia prężności pary wodnej nienasyconej zawartej w powietrzu
wykorzystuje się psychrometr Assmanna (bardziej pierwotny to psychrometr Augusta).
Psychrometr jest układem dwóch identycznych termometrów rtęciowych, z których jeden
posiada zbiornik z rtęcią owinięty tkaniną, nasyconą wodą destylowaną. Drugi termometr jest
suchy. Uruchamiając wentylator (w pokrywie psychrometru Assmanna) zwiększa się
szybkość parowania wody z tkaniny termometru "wilgotnego" - parowanie wody odbywa się
przy pobieraniu ciepła z najbliższego otoczenia, a więc temperatura tkaniny parującej obniża
się i termometru również (termometr pokazuje zawsze własną temperaturę). Wskazania
termometrów po pewnym czasie ustalają się i w tym momencie można odczytać temperaturę
każdego z nich: suchego t
s
i wilgotnego t
w
.
Woda z tkaniny termometru wilgotnego paruje, ponieważ powietrze w otoczeniu nie jest
na ogół nasycone parą wodną. Nie znaczy to, że nie zachodzi wspomniane w części
teoretycznej, zjawisko odwrotne przechodzenia pary wodnej w stan cieczy. Termometr
wilgotny wskazuje temperaturę t
w
niższą od t
s
o pewną wartość, która zależy od wilgotności
otaczającego powietrza. Temperatura termometru wilgotnego t
w
obniża się tak długo, aż
zostanie osiągnięty stan równowagi cieplnej. Ilość ciepła dostarczonego przez otoczenie
(termometr, tkanina, otaczające powietrze) jest wtedy dokładnie równa ilości ciepła zużytego
na parowanie wody. Jeżeli przez p
w
oznaczyć prężność pary wodnej nasyconej w temperaturze
wskazywanej przez termometr wilgotny (odczytanej z tabeli), a przez p - prężność pary
19
wodnej nienasyconej znajdującej się aktualnie w powietrzu o temperaturze t
s
, ilość ciepła Q
1
zużytego na parowanie wody w jednostce czasu jest równa
b
p
p
c
Q
w
1
(III.A.1)
gdzie b - ciśnienie atmosferyczne, c - stała.
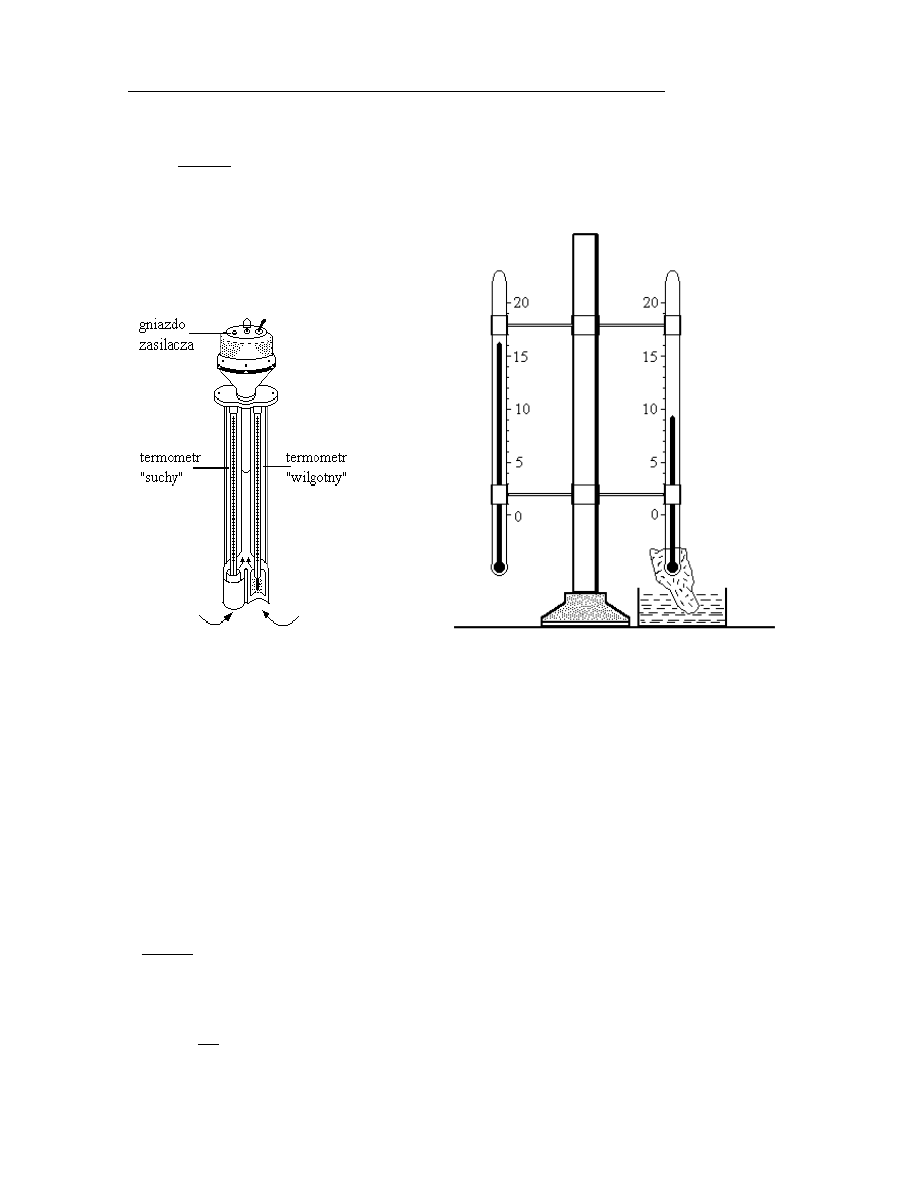
Ryc. III.A.1. Psychrometr Assmanna
Ryc.III.A.2. Psychrometr Augusta (stacjonarny)
(wentylacyjny lub aspiracyjny)
Ilość ciepła Q
1
' dopływającego z otoczenia w jednostce czasu zależna jest od różnicy
temperatur (t
s
- t
w
), i jest równa.
Q
A t
t
s
w
1
'
(III.A.2)
gdzie A - stała proporcjonalności
Dla stanu równowagi cieplnej ilości ciepła są sobie równe
Q
Q
1
1
'
(III.A.3)
c
p
p
b
A t
t
w
s
w
(III.A.4)
skąd
p
p
bA
c
t
t
w
s
w
(III.A.5)
lub

20
p = pw - k b (ts - tw)
(III.A.6)
gdzie k jest wartością zależną od typu psychrometru, zawierającą stałe c i A, w znacznym
stopniu zależną od prędkości powietrza opływającego zbiornik z rtęcią termometru
wilgotnego i różną dla różnych psychrometrów. Dla stosowanego psychrometru przyjmuje się
k = 0,0006 1/deg (deg - jest skrótem od łac. degrus - stopień).
Mając wyznaczone doświadczalnie t
s
i t
w
oraz ciśnienie atmosferyczne b wyrażone w
kilopaskalach można wyliczyć z podanego wzoru (III.A.6) prężność szukaną pary
nienasyconej p, a następnie obliczyć wilgotność względną według wzoru (6.2). Wartość
prężności pary wodnej nasyconej p
n
w temperaturze otoczenia t
s
odczytuje się z tabeli IV.A.1.
Analityczną zależność prężności pary nasyconej od temperatury dobrze przybliża
wielomian
p
n
(t) = at
3
+ bt
2
+ ct + d
(III.A.7)
Można się nim posłużyć do obliczenia prężności pary wodnej nasyconej p
n
(t) dla
temperatury z zakresu 0 - 30
o
C. Stałe występujące w wielomianie podane są pod tabelą
III.A.2.
III.A.2. Wykonanie ćwiczenia
1. Wyjąć psychrometr z pudła, ujmując go tylko za rączkę i zawiesić na statywie.
Probówkę z polietylenu znajdującą się w pudle napełnić wodą destylowaną i założyć na
zbiorniczek termometru (oznaczony kolorem niebieskim). Odczekać kilkanaście sekund.
Zbiorniczek z rtęcią termometru (zwanego tu wilgotnym) jest owinięty tkaniną, która
nasyci się wodą.
2. Zdjąć probówkę z wodą z termometru, podłączyć zasilacz wiatraczka psychrometru do sieci
prądu elektrycznego (zasilacz jest w pudle psychrometru). Uruchomić wiatraczek
włącznikiem znajdującym się na pokrywie psychrometru.
3. Przez kilka minut obserwować termometr wilgotny (z niebieską kropką) i odczytać
najniższą wskazaną temperaturę. Jest to temperatura t
w
, którą należy zapisać.
Tabela III.A.1
Wyniki pomiarów
l.p.
Temperatura na
termometrze suchym
Temperatura na
termometrze
Prężność pary wodnej w
temperaturze t
s
Wilgotność
względna
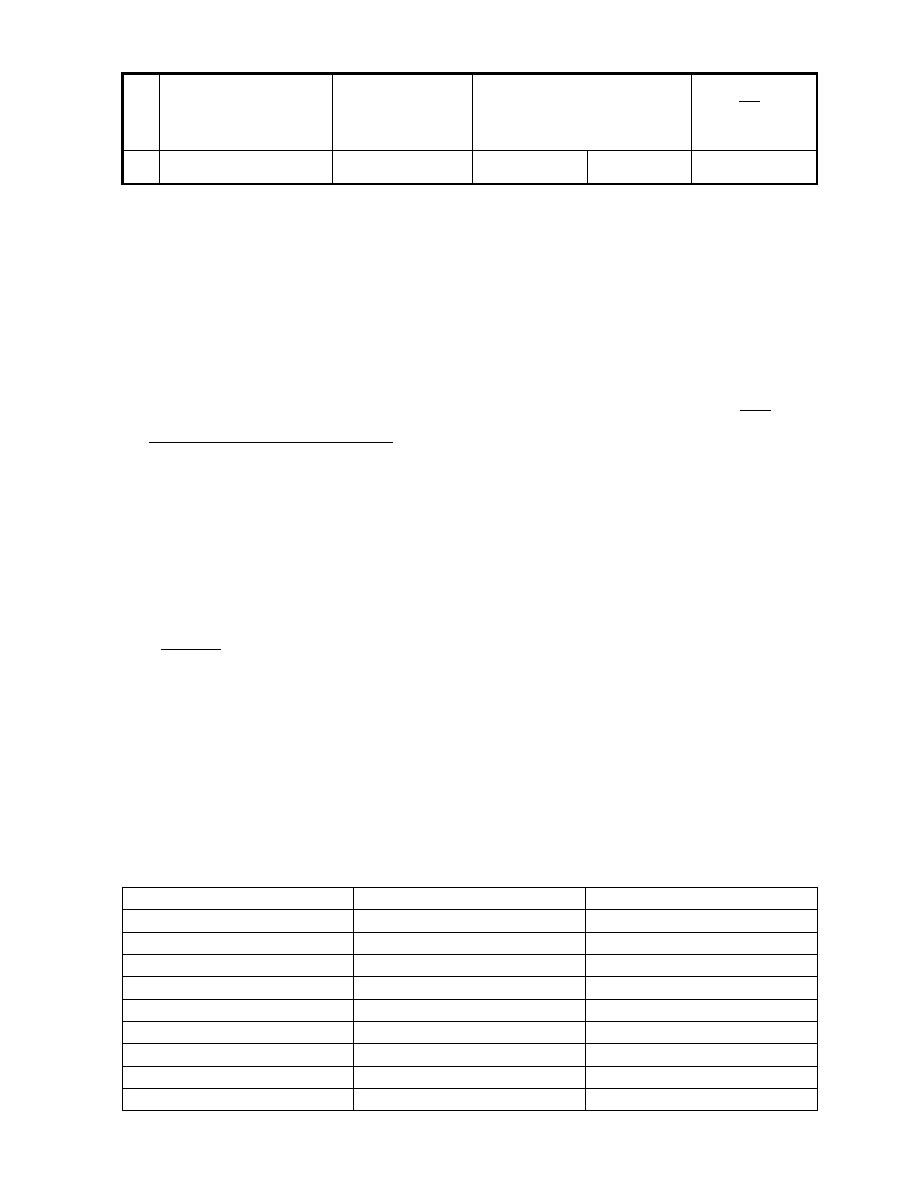
21
t
s
(
o
C)
wilgotnym t
w
(
o
C)
nasyconej nienasyconej
p
n
(kPa) p (kPa)
W
p
p
n
100%
4. Odczytać temperaturę wskazywaną przez termometr suchy t
s
. Zapisać ją.
5. Odczytać z barometru ciśnienie b. Zapisać je podając w kPa.
6. Wszystkie wyniki wpisać do tabeli III.A.1.
III.A.3. Opracowanie wyników, dyskusja błędów
1. Z tabeli III.A.2 znajdującej się pod opisem ćwiczenia odczytać wartości prężności pary
wodnej nasyconej w temperaturze t
s
i t
w
: p
n
i p
w
. Obliczyć p według wzoru (III.A.6).
2. Obliczyć prężności par nasyconych dla tych samych temperatur korzystając z wielomianu
(III.A.7). Porównać z danymi z tabeli III.A.1.
3. Obliczyć wilgotność względną i procentową według wzoru (6.2).
4. Obliczyć masę pary wodnej zawartą w 1 m
3
powietrza czyli wilgotność bezwzględną
według wzoru wyprowadzonego w rozdz. 5.
m
t
p
s
2165
273
(III.A.1)
Masa pary obliczona według powyższego wzoru jest równa gęstości pary w temperaturze
t
s
i wyrażona jest w g/m
3
, jeżeli prężność pary wodnej nienasyconej zawartej w powietrzu p
jest wyrażona w kPa.
5. Dyskusję błędów przeprowadzić metodą różniczki zupełnej.
Tabela III.A.2
Zależność ciśnienia pary wodnej nasyconej p
n
od temperatury t
t (
o
C) p
n
(kPa) t (
o
C) p
n
(kPa) t (
o
C) p
n
(kPa)
1 0,66
11 1,31
21 2,49
2 0,71
12 1,40
22 2,69
3 0,76
13 1,50
23 2,81
4 0,81
14 1,60
24 2,98
5 0,94
15 1,71
25 3,17
6 0,94
16 1,82
26 3,36
7 1,00
17 1,94
27 3,57
8 1,07
18 2,06
28 3,75
9 1,15
19 2,20
29 4,01

22
10 1,23
20 2,34
30 4,24
Dane liczbowe do wielomianu (III.A.7)
a = 0,0000508 kPa/deg
3
b = 0,000904 kPa/deg
2
(nie mylić z ciśnieniem atmosferycznym oznaczanym także przez b)
c = 0,0483 kPa/deg
d = 0,604 kPa
Po podstawieniu do (II.A.7) wielomian przyjmuje postać
p
n
(t) = 0,0000508 t
3
+ 0,000904 t
2
+ 0,0483 t + 0,604
Wielomian ten wykorzystujemy do dyskusji błędów o ile prężność par nasyconych
obliczana była przy jego zastosowaniu. Unikamy w ten sposób interpolacji liniowej, która jest
konieczna, gdy temperatura nie wyraża się liczbami całkowitymi jak w tabeli III.A.2 i gdy nie
korzystamy z danych tabeli III.A.2.
III.B. Wyznaczanie wilgotności bezwzględnej i względnej powietrza metodą punktu rosy
(zmodyfikowanego higrometru Alluarda)
III.B.1. Zasada pomiaru
Pomiar wilgotności powietrza tą metodą sprowadza się do wyznaczenia temperatury
punktu rosy, czyli temperatury, w której para wodna znajdująca się w otaczającym powietrzu
staje się parą nasyconą. Para ta nie jest parą nasyconą w temperaturze otoczenia, którą
odczytujemy z dowolnego termometru znajdującego się w otoczeniu nawet podczas ulewnego
deszczu. Zdajemy sobie sprawę z faktu, że parę wodną bliską stanu nasycenia mamy w
otoczeniu np. w czasie niepogody, gdy zbiera się na deszcz lub też w czasie, gdy deszcz pada.
Musimy więc w sposób niejako sztuczny obniżyć temperaturę przynajmniej jakiegoś
przedmiotu w otoczeniu do takiej temperatury, by para wodna zawarta w powietrzu mogła się
na nim skroplić (będąc w obniżonej temperaturze parą nasyconą). Stąd też mówimy o
"punkcie rosy". Jest to izobaryczne oziębianie (ciśnienie powietrza w otoczeniu jest stałe)
nienasyconej pary wodnej znajdującej się w powietrzu w bezpośrednim sąsiedztwie
ochładzanego przedmiotu. Do uzyskania rosy służy przyrząd zwany higrometrem.
Higrometr (ryc. III.B.1) jest to małe, płaskie naczynie metalowe w kształcie walca,
wykonane z wypolerowanej blachy z bardzo błyszczącą powierzchnią czołową, tworzącą
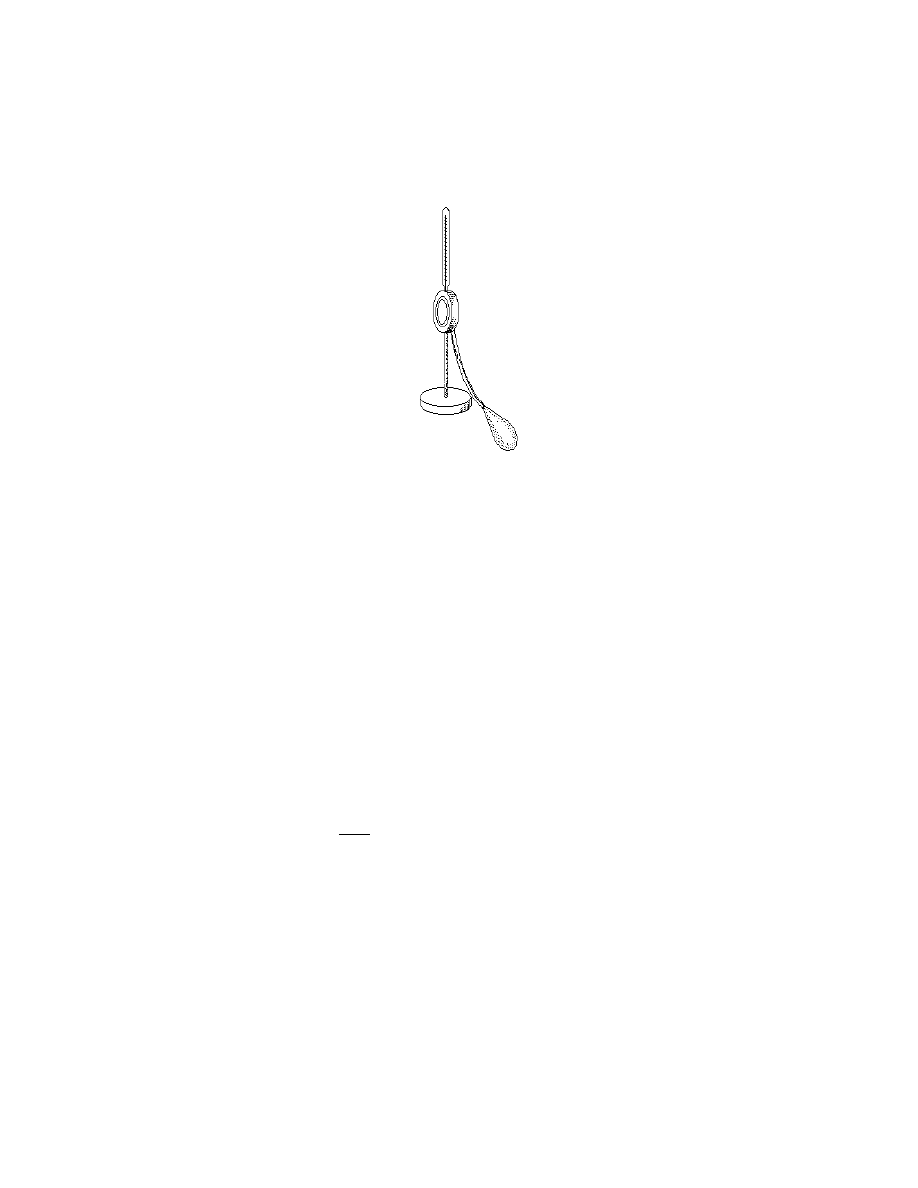
23
rodzaj lustra metalowego. Lustro to jest ochładzane w różny sposób i obserwowane uważnie
przez szybę umieszczoną przed higrometrem. W takiej temperaturze, w której ciśnienie pary
wodnej nasyconej p
n
(T) staje się równe ciśnieniu pary wodnej w powietrzu, lustro zaczyna
pokrywać się rosą.
Ryc. III.B.1. Higrometr Alluarda
Na ryc. III.B.2 przedstawiono zmodyfikowany higrometr Alluarda z układem
chłodzącym, wykorzystany w ćwiczeniu.
Higrometr połączony jest wężami gumowymi z pompką i kalorymetrem jak na rycinie.
Pompka służy do wymuszenia przepływu wody chłodzonej kawałkami lodu z kalorymetru do
higrometru. W ten sposób higrometr jest ochładzany coraz to nowymi porcjami wody, aż na
wypolerowanej powierzchni pojawi się rosa. Temperatura odpowiadająca punktowi rosy t
r
jest
wykorzystana do odczytania z tabeli III.A.1 prężności nasyconej pary wodnej w temperaturze
t
r
. Prężność ta jest równa prężności pary wodnej nienasyconej, znajdującej się aktualnie w
powietrzu p
r
. Odczytywana temperatura pojawiania się rosy t’ jest zwykle niższa od t
r
,
podobnie temperatura znikania rosy t’’. Temperaturę punktu rosy wyznaczamy więc jako
średnią arytmetyczną t’ i t’’:
t t
' ''
2
. Mając wartość prężności pary wodnej dla temperatury t
r
,
czyli p
r
dla punktu rosy [jest to według oznaczeń we wzorze (III.A.1) wartość p] możemy
przystąpić do obliczeń wilgotności W.
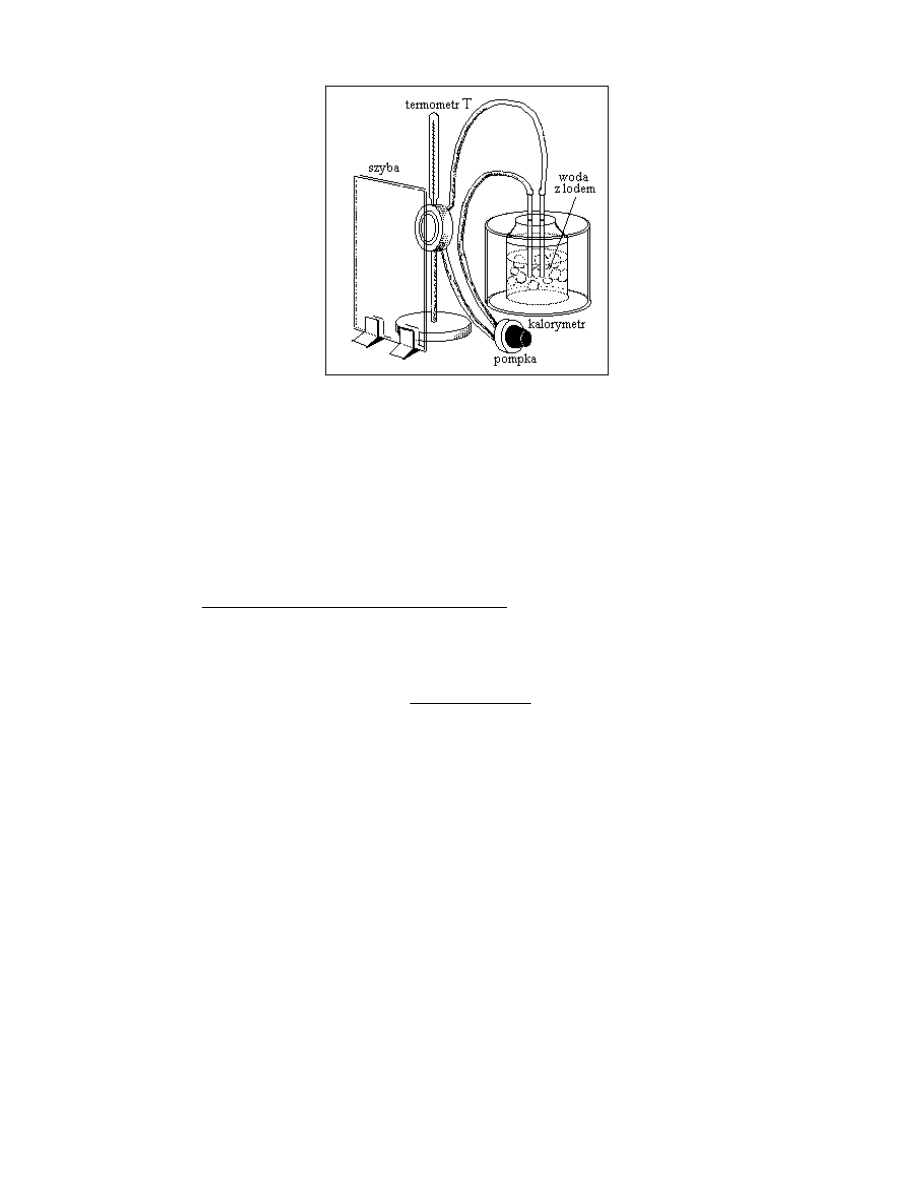
24
Ryc. III.B.2. Zmodyfikowany higrometr Alluarda
III.B.2. Wykonanie ćwiczenia
1. Wrzucić do kalorymetru kilka dużych kawałków lodu i zalać niewielką ilością wody
destylowanej tak jednak, by końce wężów doprowadzających były zanurzone w wodzie.
2. Ochładzać wolno higrometr naciskając systematycznie przeponę pompki.
3. Gdy na połowie powierzchni czołowej higrometru ukaże się wyraźny nalot skroplonej pary
wodnej (rosa) przerwać pompowanie
4. Obserwując wskazania termometru T (ryc. III.B.2) odczytać temperaturę t’’ przy której na
skutek ogrzania się higrometru rosa znika całkowicie z wypolerowanej powierzchni
czołowej higrometru. Jest to temperatura znikania rosy. Temperaturę wpisać do tabeli
III.B.1.
5. Odczekać aż temperatura higrometru wzrośnie o około 2 - 3
o
C powyżej punktu rosy i
ponownie wolno pompując ochłodzić higrometr. W momencie pojawienia się rosy
odczytać temperaturę t’. Temperaturę tę należy również wpisaćdo tabeli III.B.1.
25
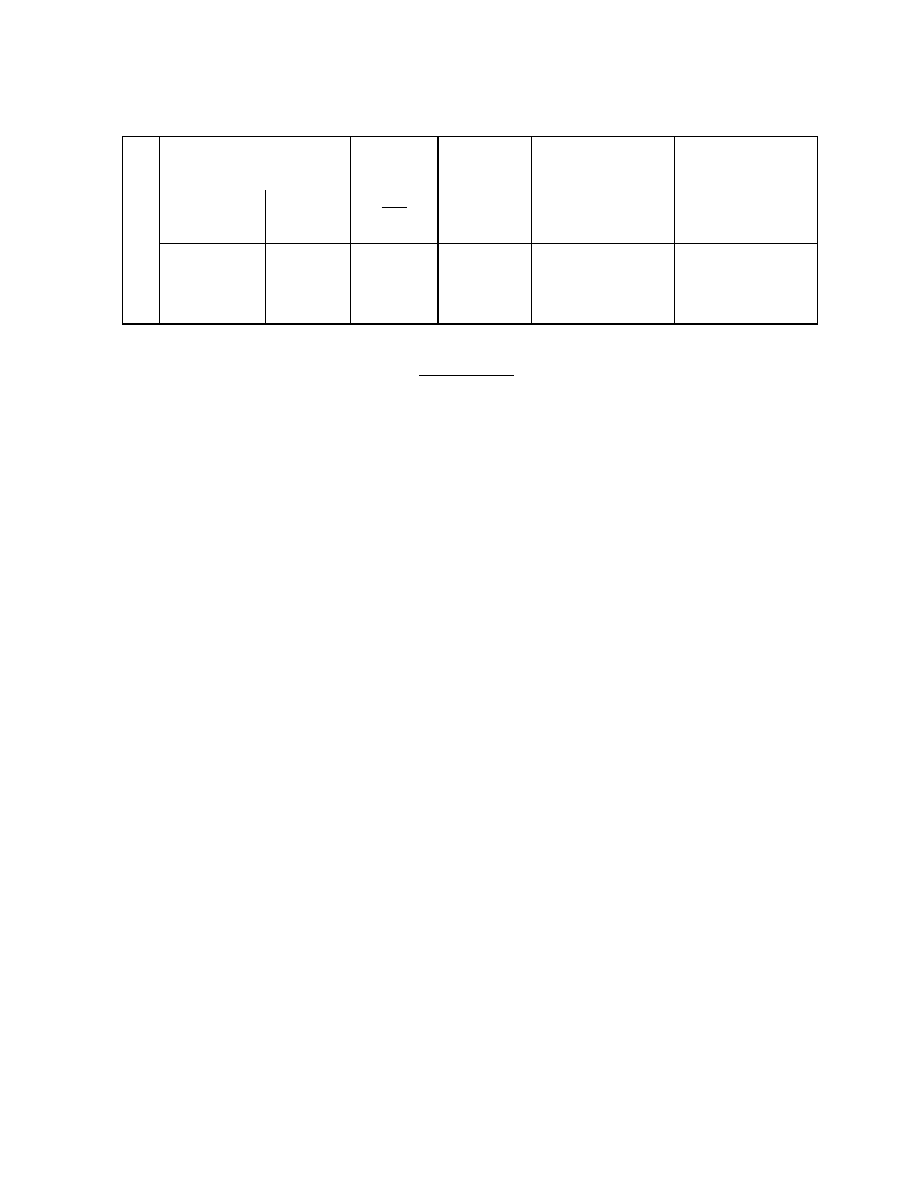
Tabela III.B.1
Wyniki pomiarów
L.p.
Temperatura
Punkt rosy
t
r
(
o
C)
Temperatura
powietrza
Prężność pary wodnej
nasyconej dla t
r
Prężność pary wodnej
nasyconej dla t
pojawiania się
rosy t’ (
o
C)
znikania
rosy t’’(
o
C)
t t
' ' '
2
t (
o
C)
(kPa)
(p)
(kPa)
(p
n
)
1
2
3
6. Powtórzyć czynności z punktów 4 i 5 przynajmniej trzykrotnie (sześć wyników pomiaru).
Wyniki pomiarów temperatury zapisać (można zapisać w skali Celsjusza).
7. Odczytać temperaturę otoczenia z termometru znajdującego się w najbliższym sąsiedztwie
higrometru t (
o
C)- zapisać ją.
8. Wszystkie wyniki pomiarów wpisać do tabeli III.B.1.
Uwagi:
1. Nie dotykać wypolerowanej powierzchni czołowej higrometru.
2. W trakcie pomiarów higrometr obserwować przez szybkę ustawioną przed higrometrem -
usuwa się w ten sposób częściowo wpływ pary wodnej wydychanej przez obserwatora.
III.B.3. Opracowanie wyników, dyskusja błędów
1. Znając temperaturę otoczenia t (
o
C) odczytać z tabeli III.A.2 prężność pary wodnej
nasyconej p
n
w tej temperaturze.
2. Obliczyć średnią wartość temperatury punktu rosy t
r
jako średnią arytmetyczną z danych t’
i t’’ (temperatura pojawiania się i znikania rosy).
3. Obliczyć według wzoru (III.A.7) prężność pary wodnej nasyconej w temperaturze punktu
rosy p
r
(lub odczytać jej wartość z tabeli III.A.2 stosując, jeżeli to jest konieczne, metodę
interpolacji liniowej).
4. Obliczyć wilgotność względną jako stosunek prężności pary wodnej p i p
n
i procentową ze
wzoru (6.2).
5. Dyskusję błędu przeprowadzić metodą pochodnej logarytmicznej, uwzględniając wzór
wielomianowy, jeżeli był wykorzystany.
26
Wskazówka do dyskusji błędu:
Przykład: po wykonaniu serii pomiarów otrzymano temperaturę powietrza w laboratorium
t = 21,7
o
C oraz temperaturę punktu rosy t = 6,6
o
C
0,75
o
C. Podstawiając te wartości do
wielomianu otrzymuje się następujące prężności pary wodnej nasyconej w tych
temperaturach, w kilopaskalach
dla temperatury t: a(21,7)
3
+ b(21,7)
2
+ c(21,7) + d = 2,60 kPa
dla temperatury tr: a(6,6)
3
+ b(6,6)
2
+ c(6,6) + d = 0,98 kPa
Wilgotność względna procentowa
%
% 38
100
n
r
p
p
W
Oszacowanie maksymalnego błędu tego wyniku wymaga obliczenia pochodnej
dt
dp
wielomianu (II.A.8). Obliczmy tę pochodną
c
bt
at
dt
dp
2
3
2
Podstawiając do powyższego wyrażenia odpowiednie wartości temperatur i błędów
pomiaru temperatury otrzymamy błędy
p
dp
dt
t
n
n
3a (21,7)
2
+2b (21,7) + c
1 deg = 0,16 kPa
p
dp
dt
t
r
n
r
3a (6,6)
2
+2b (6,6) + c
0,75 deg = 0,05 kPa
Stosując metodę pochodnej logarytmicznej obliczania błędu względnego wilgotności
względnej otrzymujemy
n
n
r
r
p
p
p
p
W
W
1
1
Po podstawieniu do tego wyrażenia wartości
p
r
i
p
n
, obliczonych wyżej otrzymujemy
błąd względny procentowy = 11%.

27
IV. LITERATURA
1. Adamczewski I., Ćwiczenia laboratoryjne z biofizyki i fizyki medycznej, PZWL,
Warszawa, 1968
2. Blinowski J., Trylski J., Fizyka, PWN, Warszawa, 1981
3. Buchowski H., Ufnalski W., Podstawy termodynamiki, WNT, Warszawa, 1994
4. Buchowski H., Ufnalski W., Gazy, ciecze, płyny, WNT, Warszawa, 1994
5. Buchowski H., Ufnalski W., Roztwory, WNT, Warszawa, 1995
6. Brdika R., Podstawy chemii fizycznej, PWN, Warszawa, 1970
7. Danek A., Chemia fizyczna cz. II., PWN, Warszawa, 1986
8. Elwell D., Pointon A.J., Termodynamika klasyczna, WNT, Warszawa, 1976
9. Erndt A., Podstawy chemii ogólnej i nieorganicznej, Wyd. AR, Kraków, 1993, wyd. trzecie
10. Pigoń K., Ruziewicz Z., Chemia fizyczna cz.I, PWN, Warszawa, 1986
11. Szczeniowski Sz., Fizyka doświadczalna, cz.II., PWN, Warszawa, 1982
12. Wanik B., Wykłady z Fizyki, t. 1, Wyd. AR Kraków, 1998

28
V. INDEKS
ciśnienie równowagowe (3)
diagram fazowy (4)
entalpia sublimacji (5)
higrometr Alluarda (23)
kinetyka parowania (7)
para
nasycona (2)
nienasycona (9)
psychrometr
Assmanna (18)
Augusta (18)
punkt
potrójny (4)
rosy (22)
równanie Augusta (4)
stan równowagi (2)
szybkość parowania (8)
temperatura wrzenia (4)
wielomian prężności pary (19)
wilgotność
bezwzględna (15)
powietrza (15)
względna (15)
wrzenie cieczy (4)
Wyszukiwarka
Podobne podstrony:
cwicz2a
cwicz2
cwicz2
embriologia cwicz2
cwicz25, L
cwicz2 4
Cwicz2, wisisz, wydzial informatyki, studia zaoczne inzynierskie, przetwarzanie obrazow, cwiczenia
CWICZ22, Barbara Wanik
cwicz2
Przebiegi cwiczeń cwicz2
BAL 2011 Cwicz2
cwicz2
Cwicz2 2013
cwicz21pl
cwicz22pl
2a cwicz2
cwicz2
A - Błędy graniczne narzędzi pomiarowych, CWICZ2
cwicz2
więcej podobnych podstron