
1
Literatura:
Minczewski J., Marczenko Z.: Chemia analityczna. T.1. Podstawy teoretyczne i analiza jakościowa.
Wyd. 10. PWN, Warszawa 2009
Kocjan R.: Chemia analityczna. Analiza jakościowa. Analiza klasyczna; tom 1, Wyd.1 PZWL,
Warszawa, 2000.
Skrypt do ćwiczeń z chemii ogólnej, nieorganicznej i analitycznej, Białystok 2010, pod redakcją E.
Skrzydlewskiej.
Szmal Z., Lipiec T.: Chemia analityczna z elementami analizy instrumentalnej. Wyd. VII poprawione i
unowocześnione PZWL, Warszawa, 1997.
Celem ćwiczenia
jest poznanie warunków strącania kationów grupy II oraz przeprowadzenie analizy
systematycznej mieszaniny kationów tej grupy.
Zakres materiału obowiązującego na ćwiczenie:
Znajomość warunków strącania osadów kationów grupy II z odczynnikiem grupowym. Umiejętność
zapisywania równań reakcji chemicznych charakterystycznych dla kationów grupy II i reakcji rozpuszczania
trudno rozpuszczalnych osadów powstałych w wyniku w/w reakcji w dobrze rozpuszczalne sole. Znajomość
poszczególnych etapów rozdzielania mieszaniny kationów grupy II wraz ze znajomością równań reakcji
chemicznych i efektów zachodzących reakcji. Znajomość podstawowych obliczeń chemicznych – pH
mocnych elektrolitów.
Zagadnienia z wykładów poprzedzających ćwiczenie.
I. Część wprowadzająca
Kationy II grupy: IIA: Hg
2+
, Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
IIB: As
3+
, As
5+
, Sb
3+
, Sb
5+
, Sn
2+
, Sn
4+
Sole kationów tej grupy, z wyjątkiem Cu
2+
– są bezbarwne.
Odczynnik grupowy
H
2
S lub AKT (tioacetamid) w środowisku kwaśnym (HCl)
Wytrącanie siarczków kationów grupy II prowadzi się w środowisku słabo kwaśnym. Większe
stężenie kwasu może spowodować niewytrącenie lub też niecałkowite wytrącenie siarczków łatwiej
rozpuszczalnych: CdS
, SnS
. Przy mniejszym natomiast stężeniu kwasu może się wytrącić z trzeciej grupy
ZnS
. Środowisko kwaśne może być wywołane tylko kwasem solnym, ponieważ kwas siarkowy wytrąciłby
osady siarczanów IV grupy, zaś kwas azotowy utleniłby siarkowodór do wolnej siarki. Jony wodorowe H
+
Ćwiczenie 4
Analiza jakościowa kationów II grupy analitycznej
oraz mieszaniny kationów II grupy analitycznej

2
powstałe z dysocjacji kwasu solnego cofają dysocjację siarkowodoru, obniżając w ten sposób stężenie jonów
siarczkowych w roztworze, jednak stężenie to jest wystarczające do osiągnięcia iloczynu rozpuszczalności
siarczków II grupy i wytrącenia osadu. Takie stężenie S
2–
nie wystarcza natomiast do osiągnięcia iloczynu
rozpuszczalności siarczków III grupy, które w tych warunkach się nie wytrącają.
Zamiast siarkowodoru do analizy kationów grup II i III można stosować roztwór amidu kwasu
tiooctowego (tioacetamid) – CH
3
CSNH
2
(AKT). Związek ten rozpuszcza się dobrze w wodzie i jest w
roztworze trwały; ogrzany natomiast w środowisku kwaśnym lub zasadowym hydrolizuje i rozkłada się z
wydzieleniem H
2
S
, który w chwili powstawania wytrąca charakterystyczne osady właściwych siarczków.
Reakcja hydrolizy przebiega następująco:
CH
3
CSNH
2
+ 2H
2
O
CH
3
COO
–
+ NH
4
+
+ H
2
S
CH
3
CSNH
2
wytrąca ze słabo kwaśnych roztworów kationów II grupy następujące siarczki:
HgS
, PbS
, CuS
osady czarne
Bi
2
S
3
, SnS
osady brunatne
Sb
2
S
3
, Sb
2
S
5
osady pomarańczowe
SnS
2
, CdS
, As
2
S
3
, As
2
S
5
osady żółte
Siarczki kationów II grupy analitycznej wykazują różny charakter kwasowo-zasadowy, dzięki temu można
rozdzielić je na podgrupy A i B.
Siarczki kationów podgrupy II A
HgS
, PbS
, CuS
, Bi
2
S
3
, CdS
Siarczki posiadają charakter zasadowy i nie rozpuszczają się w siarczku (NH
4
)
2
S i wielosiarczku
amonu [(NH
4
)
2
S
2
] oraz w zasadach, rozpuszczają się natomiast w HNO
3
, oprócz HgS, który rozpuszcza się w
wodzie królewskiej:
O
H
8
NO
4
S
3
]
HgCl
[
3
HNO
4
HCl
12
HgS
3
2
2
4
3
Siarczki kationów podgrupy II B
As
2
S
3
, As
2
S
5
, Sb
2
S
3
, Sb
2
S
5
, SnS
, SnS
2
Siarczki należące do podgrupy II B są amfoteryczne i rozpuszczają się w wielosiarczku amonu
(NH
4
)
2
S
2
i KOH z utworzeniem siarkosoli. SnS
nie rozpuszcza się w (NH
4
)
2
S i KOH.

3
II. Część doświadczalna
Grupa IIA
RTĘĆ (Hydrargyrum) Hg
najważniejsze właściwości rtęci metalicznej i jej związków na +1 stopniu utlenienia zostały omówione w I grupie analitycznej;
kation rtęci (II) – Hg
2+
należy do II grupy analitycznej; jego rozpuszczalne sole są bardzo słabo zdysocjowane, dlatego są one nazwane niekiedy
pseudosolami
Rozpuszczalność związków rtęci(II) (rtęciowych):
dobrze rozpuszczalne: octan – Hg(CH
3
COO)
2
, chlorek – HgCl
2
, azotan (V) – Hg(NO
3
)
2
, siarczan (VI) – HgSO
4
umiarkowanie rozpuszczalne: bromek – HgBr
2
trudno rozpuszczalne: chromian(VI) – HgCrO
4
, jodek – HgI
2
, szczawian – HgC
2
O
4
, tlenek – HgO, siarczek – HgS, tiocyjanian (rodanek) – Hg(SCN)
2
Przykłady kompleksów:
[HgCl
4
]
2–
(bezbarwny)
tetrachlorortęcian (II)
[HgBr
4
]
2–
(bezbarwny)
tetrabromortęcian (II)
[HgI
4
]
2–
(bezbarwny)
tetrajodortęcian (II)
[Hg(SCN)
4
]
2–
(bezbarwny)
tetracyjanianortęcian (II)
(tetrarodanortęcian (II))
Właściwości redoks:
sole rtęci (II) łatwo ulegają redukcji do soli rtęci (I) i niemal równie łatwo do rtęci metalicznej [Hg
0
] przez prawie wszystkie metale (łącznie z miedzią) oraz
związki Sn (II) i Fe (II); tworzenie się w środowisku jonów chlorkowych trudno rozpuszczalnego Hg
2
Cl
2
sprzyja zatrzymaniu się redukcji na +1 stopniu
utlenienia.
Właściwości kwasowo-zasadowe:
z soli rtęci (II) pod wpływem mocnych zasad tworzy się HgO (a nie wodorotlenek), który ma charakter zasadowy (w odróżnieniu od tlenków pierwiastków
należących do tej samej grupy układu okresowego: ZnO i CdO, które mają charakter amfoteryczny).
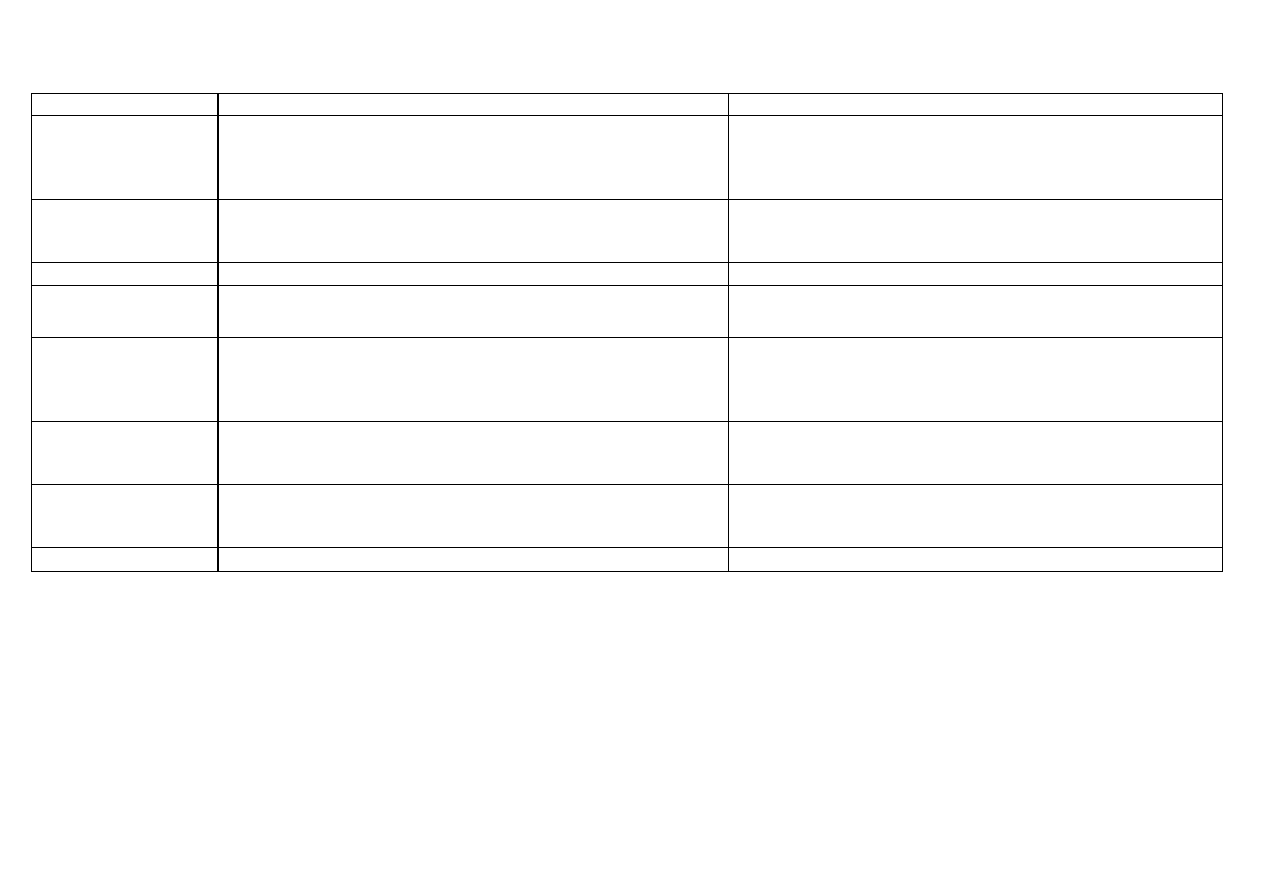
4
Reakcje charakterystyczne jonu Hg
2+
[0,1M HgCl
2
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*
(odczynnik grupowy)
+HCl
2M
woda królewska
Hg
2+
+ H
2
S
HgS
+ 2H
+
3HgS
+ 12Cl
–
+ 2NO
3
+ 8H
+
3[HgCl
4
]
2–
+ 2NO
+ 3S
+ 4H
2
O
czarny
osad siarczku rtęci (II) (jeden z najtrudniej
rozpuszczalnych
osadów);
nierozpuszczalny
w
HNO
3
,
rozcieńczonych H
2
SO
4
i HCl; rozpuszcza się w wodzie
królewskiej z wydzieleniem siarki (żółty, koloidalny osad)
NaOH 2M
HNO
3
2M
Hg
2+
+ 2OH
–
HgO
+ H
2
O
HgO
+ 2H
+
Hg
2+
+ H
2
O
żółtopomarańczowy osad tlenku rtęci (II), nierozpuszczalny w
nadmiarze zasady; łatwo rozpuszczalny w rozcieńczonych
kwasach
NH
3
aq. 2M Hg
2+
+ 2Cl
–
+ 2(NH
3
·
H
2
O)
HgNH
2
Cl
+ NH
4
+
+
Cl
–
+ 2H
2
O
biały osad chlorku amidortęci (II)
Hg(NO
3
)
2
0,1M
+NH
3
aq. 2M
2Hg
2+
+ NO
3
+ 4NH
3
·
H
2
O
[OHg
2
NH
2
]NO
3
+ 3NH
4
+ 3H
2
O
przy działaniu NH
3
·H
2
O na roztwór Hg(NO
3
)
2
powstaje biały
osad azotanu V amidortęci (II)
KI 0,1M Hg
2+
+ 2I
–
HgI
2
HgI
2
+ 2I
–
[HgI
4
]
2–
pomarańczowoczerwony osad jodku rtęci (II) rozpuszczalny w
nadmiarze jonów jodkowych z utworzeniem tetrajodortęcianu (II);
[tetrajodortęcian (II) potasu wchodzi w skład odczynnika
Nesslera stosowanego do wykrywania jonu amonowego]
SnCl
2
0,5M 2Hg
2+
+ Sn
2+
+ 8Cl
–
Hg
2
Cl
2
+ [SnCl
6
]
2–
Hg
2
Cl
2
+ Sn
2+
+ 4Cl
–
2Hg
+ [SnCl
6
]
2–
biały osad kalomelu (Hg
2
Cl
2
) powstający na skutek redukcji rtęci
(II) przy dalszym dodawaniu SnCl
2
przechodzi w szary na skutek
redukcji do rtęci metalicznej
Na
2
CO
3
1M 3Hg
2+
+ 3CO
3
2
(HgO)
2
· HgCO
3
+ 2CO
2
(HgO)
2
.
HgCO
3
3HgO
+ CO
2
czerwonobrunatny osad mieszaniny węglanu i tlenku rtęci (II),
który podczas gotowania rozkłada się z wydzieleniem żółtego
osadu tlenku rtęci (II)
K
4
[Fe(CN)
6
] 1%
2Hg
2+
+ [Fe(CN)
6
]
4–
Hg
2
[Fe(CN)
6
]
biały osad heksacyjanożelazianu(II)rtęci(II)
* odczynnik używa się tylko pod wyciągiem
* woda królewska: stęż. HCl + stęż. HNO
3
(3v:1v)
OŁÓW (Plumbum) Pb
Najważniejsze właściwości ołowiu metalicznego i jego związków na +2 stopniu utlenienia zostały omówione w I grupie analitycznej; kation Pb
2+
należy
również do II grupy analitycznej z uwagi na to, że PbCl
2
jest najlepiej rozpuszczalnym z chlorków kationów I grupy i strąca się z nimi jedynie wtedy, gdy
strącanie prowadzi się na zimno niewielkim nadmiarem HCl; gdy strącanie przeprowadza się na gorąco powstający PbCl
2
jest dobrze rozpuszczalny i
przechodzi do II grupy analitycznej.

5
MIEDŹ (Cuprum) Cu
żółtoczerwony metal, dość twardy i ciągliwy, najlepszy przewodnik ciepła
Reakcje metalicznej miedzi
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
nie roztwarza miedzi
kwas azotowy (V) (rozcieńczony) roztwarza miedź
3Cu + 8HNO
3
3Cu(NO
3
)
2
+ 2NO
+ 4H
2
O
kwas azotowy (V) (stężony) roztwarza miedź
Cu + 4HNO
3
Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O
kwas siarkowy (VI) (rozcieńczony) nie roztwarza miedzi
kwas siarkowy (VI) (stężony) roztwarza miedź
Cu + 2H
2
SO
4
CuSO
4
+ SO
2
+ 2H
2
O
woda królewska
(stęż. HCl + stęż. HNO
3
; 3v:1v)
roztwarza miedź
3Cu + 6HCl + 2HNO
3
3CuCl
2
+ 2NO
+ 4H
2
O
Związki miedzi
stopień utlenienia: +1 i +2; liczba koordynacyjna w związkach kompleksowych Cu (I): 2 i 4 oraz Cu (II): 4
Roztwory wodne miedzi (II) mają barwę bladoniebieską; jon Cu
+
nie występuje w roztworze, istnieje tylko w postaci kompleksów lub w związkach
trudno rozpuszczalnych.
Rozpuszczalność związków miedzi (II):
dobrze rozpuszczalne: octan – Cu(CH
3
COO)
2
, chlorek – CuCl
2
, azotan (V) – Cu(NO
3
)
2
, siarczan (VI) – CuSO
4
, bromek – CuBr
2
trudno rozpuszczalne: węglan–CuCO
3
, chromian (VI)– CuCrO
4
, heksacyjanożelazian (II)–Cu
2
[Fe(CN)
6
], heksacyjanożelazian (III)–Cu
3
[Fe(CN)
6
]
2
,
wodorotlenek – Cu(OH)
2
, szczawian – CuC
2
O
4
, tlenek – CuO, ortofosforan (V) – Cu
3
(PO
4
)
2
, siarczek – CuS
Przykłady kompleksów:
[Cu(NH
3
)
4
]
2+
(granatowy)
jon tertaaminamiedzi (II)
[CuCl
4
]
2–
(żółtozielony)
tetrachloromiedzian (II)
Właściwości redoks:
jon Cu
2+
jest utleniaczem słabszym od Ag
+
i Hg
2+
lecz mocniejszym od Bi
3+
, Pb
2+
i Cd
2+
; jest on redukowany do metalu przez wiele metali o niższym
potencjale standardowym (Al, Fe, Zn, Cd); jon Cu
2+
można utleniać do nierozpuszczalnych lub kompleksowych nietrwałych związków Cu (III) tylko bardzo
mocnymi utleniaczami; jon Cu
+
w roztworach wodnych ulega szybkiej reakcji dysproporcjonowania: 2Cu
+
Cu
+ Cu
2+
Właściwości kwasowo-zasadowe:
wodorotlenek miedzi jest trudno rozpuszczalny w wodzie i ma charakter słabo zasadowy, dlatego rozpuszczalne sole miedzi w roztworach wodnych
hydrolizują tworząc sole zasadowe i mają odczyn kwaśny (0,1M CuSO
4
ma pH = 4,4); w środowisku bardziej zasadowym tworzy się Cu(OH)
2
, który
praktycznie nie rozpuszcza się w nadmiarze NaOH.

6
Reakcje charakterystyczne jonu Cu
2+
[0,2M CuSO
4
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*
(odczynnik grupowy)
+HCl 2M
HNO
3
2M
Cu
2+
+ H
2
S
CuS
+ 2H
+
3CuS
+ 2NO
3
+ 8H
+
3S
+ 3Cu
2+
+ 2NO
+ 4H
2
O
brunatnoczarny osad siarczku miedzi (II);
rozpuszcza się na gorąco w 2M HNO
3
NaOH 2M
HCl 2M
Cu
2+
+ 2OH
–
Cu(OH)
2
CuO
+ H
2
O
Cu(OH)
2
+ 2H
+
Cu
2+
+ 2H
2
O
niebieski osad wodorotlenku miedzi (II), podczas
gotowania przechodzący w czarny osad CuO
; osad
wodorotlenku jest rozpuszczalny w 2M kwasie solnym i
amoniaku
NH
3
aq. 2M
2Cu
2+
+ SO
4
2
+ 2(NH
3
·
H
2
O)
Cu
2
(OH)
2
SO
4
+ 2NH
4
Cu
2
(OH)
2
SO
4
+8(NH
3
·
H
2
O)
2[Cu(NH
3
)
4
]
2+
+2OH
–
+SO
4
2
+ 8H
2
O
jasnoniebieski osad hydroksosoli, rozpuszczalny w
nadmiarze amoniaku z powstaniem jonu kompleksowego
aminamiedzi (II) (roztwór niebieskofioletowy)
KI 0,1M 2Cu
2+
+ 4I
–
2CuI
2
Cu
2
I
2
+ I
2
czarny nietrwały osad CuI
2
(widoczny tylko w stężonym
roztworze) rozkłada się na biały osad Cu
2
I
2
i wolny jod
(zabarwiający roztwór na kolor brunatny)
Na
2
CO
3
1M Cu
2+
+ CO
3
2
CuCO
3
CuCO
3
+ H
2
O
Cu(OH)
2
+ CO
2
CuCO
3
+ Cu(OH)
2
CuCO
3
· Cu(OH)
2
Cu
2
(OH)
2
·
CO
3
niebieskozielony osad węglan dihydroksomiedzi (II)
Cu
2
(OH)
2
·
CO
3
, rozpuszczalny w kwasach i amoniaku
K
4
[Fe(CN)
6
] 1% 2Cu
2+
+ [Fe(CN)
6
]
4–
Cu
2
[Fe(CN)
6
]
czerwonobrunatny
osad heksacyjanożelazianu (II)
miedzi (II), nierozpuszczalny w rozcieńczonych kwasach
mineralnych; rozpuszczalny w amoniaku (niebieski
roztwór);
reakcja bardzo czuła – w roztworach rozcieńczonych
powstaje czerwonawe zabarwienie
pręcik platynowy*
barwienie płomienia palnika na zielono
* odczynnik używa się tylko pod wyciągiem
* Przed wykonaniem próby pręcik platynowy należy oczyścić przez kilkakrotne zanurzenie w stężonym HCl i następnie wyżarzenie w płomieniu palnika.
Czysty drucik należy zanurzyć w roztworze badanej próbki i obserwować barwę płomienia w czasie jej spalania. Po przeprowadzonej próbie pręcik
platynowy należy ponownie oczyścić.
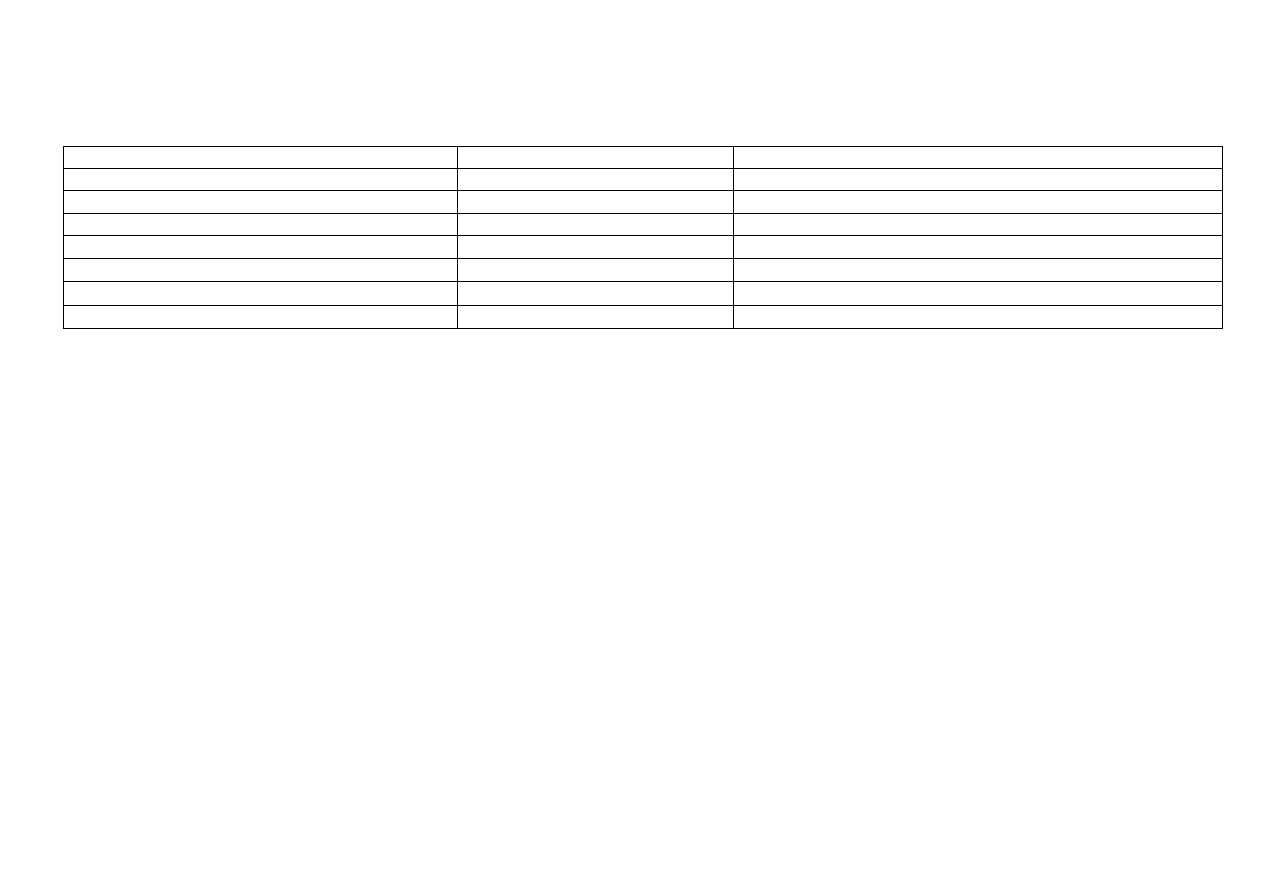
7
BIZMUT (Bismuthum) Bi
metal ciężki, srebrzysty o różowym odcieniu, nieco ciągliwy, kruchy, słaby przewodnik prądu
Reakcje metalicznego bizmutu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
nie roztwarza
kwas solny (na powietrzu) roztwarza bizmut powoli
4Bi + 12HCl + 3O
2
4BiCl
3
+ 6H
2
O
kwas siarkowy (VI) (zimny, rozcieńczony) nie roztwarza
kwas siarkowy (VI) (gorący, stężony) roztwarza bizmut
2Bi + 6H
2
SO
4
Bi
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
kwas azotowy (V) (rozcieńczony) roztwarza bizmut
Bi + 4HNO
3
Bi(NO
3
)
3
+ NO
+ 2H
2
O
kwas azotowy (V) (stężony) roztwarza bizmut
Bi + 6HNO
3
Bi(NO
3
)
3
+ 3NO
2
+ 3H
2
O
woda królewska (stęż. HCl + stęż.HNO
3
;3v:1v) roztwarza bizmut
Bi + 3HCl + HNO
3
BiCl
3
+ NO
+ 2H
2
O
Związki bizmutu
stopień utlenienia: +3 (rzadko +5); liczba koordynacyjna w związkach kompleksowych: 4
w roztworze występuje w formie jonów Bi
3+
i BiO
+
(bizmutylowych), oba jony są bezbarwne
Rozpuszczalność związków bizmutu:
rozpuszczalne: chlorek – BiCl
3
, bromek – BiBr
3
, azotan (V) – Bi(NO
3
)
3
, siarczan (VI) – Bi
2
(SO
4
)
3
trudno rozpuszczalne: ortofosforan (V) – BiPO
4
, wodorotlenek – Bi(OH)
3
, siarczek – Bi
2
S
3
, jodek – BiI
3
, chlorek tlenek bizmutu (III)
(chlorek bizmutylu) – BiOCl, jodek tlenek bizmutu (III) (jodek bizmutylu) – BiOI,
azotan tlenek bizmutu (III) (azotan bizmutylu) – BiONO
3
Przykłady kompleksów:
[BiCl
4
]
–
(bezbarwny)
tetrachlorobizmutan (III)
[BiI
4
]
–
(pomarańczowy)
tetrajodobizmutan (III)
bizmut (III) nie tworzy kompleksów z amoniakiem (odróżnienie od Ag
+
, Cu
2+
, Cd
2+
); ważne są jego kompleksy winianowe i cytrynianowe
Właściwości redoks:
jon Bi
3+
jest słabym utleniaczem (słabszym od Hg
2+
, Cu
2+
, Ag
+
, lecz silniejszym od Pb
2+
i Cd
2+
); nie jest on redukowany przez SnCl
2
w środowisku
kwaśnym (odróżnienie od Hg
2+
), ale w środowisku alkalicznym Bi(OH)
3
ulega szybkiej redukcji do metalu przez Na
2
[Sn(OH)
4
] (odróżnienie od Pb
2+
,
Cu
2+
i Cd
2+
); związki bizmutu (III) można utleniać w środowisku zasadowym do nierozpuszczalnego NaBiO
3
stosując bardzo silne utleniacze (Na
2
O
2
,
H
2
O
2
, chloran (I); Bi (V) w środowisku kwaśnym jest jednym z najsilniejszych utleniaczy.

8
Właściwości kwasowo-zasadowe:
proste jony Bi
3+
występują tylko w silnie kwaśnych roztworach wodnych (pH=0), w środowisku słabo kwaśnym hydrolizują do jonów bizmutylowych (Bi
3+
+ H
2
O
BiO
+
+ 2H
+
) a przy pH>7 powstaje trudno rozpuszczalny Bi(OH)
3
który ma charakter zasadowy; z powodu hydrolizy sole bizmutu (III) (chlorek,
bromek, azotan, siarczan) rozpuszczalne w wodzie dają mętne roztwory, zmętnienie to usuwa się przez dodatek do roztworu odpowiedniego kwasu, który
cofa hydrolizę
Reakcje charakterystyczne jonu Bi
3+
[0,5M Bi(NO
3
)
3
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*
(odczynnik grupowy)
+HCl 2M
HNO
3
2M
2Bi
3+
+ 3S
2–
Bi
2
S
3
Bi
2
S
3
+ 2
3
NO
+ 8H
+
2Bi
3+
+ 2NO
+ 3S
+ 4H
2
O
czarno-brunatny siarczek bizmutu (III); rozpuszczalny w
gorącym kwasie azotowym (V)
z wydzieleniem siarki (żółty
osad), stężonym kwasie solnym; nierozpuszczalny w KOH
NaOH 2M
Na
2
[Sn(OH)
4
]**
Bi
3+
+ 3OH
–
Bi(OH)
3
2Bi(OH)
3
+ 3[Sn(OH)
4
]
2–
2Bi
+ 3[Sn(OH)
6
]
2–
biały osad wodorotlenku bizmutu nierozpuszczalny w nadmiarze
zasady,
rozpuszczalny w cynianie z wydzielanie czarnego osadu
metalicznego bizmutu
NH
3
aq. 2M Bi
3+
+ 3OH
–
Bi(OH)
3
biały osad wodorotlenku bizmutu nierozpuszczalny w nadmiarze
zasady
KI 0,1M
Bi
3+
+ 3I
–
BiI
3
BiI
3
+ I
–
[BiI
4
]
–
[BiI
4
]
–
+ H
2
O
BiOI
+ 2H
+
+ 3I
–
BiI
3
+ H
2
O
BiOI
+ 2HI
BiOI
+ 3I
–
+2H
+
[BiI
4
]
–
+ H
2
O
brunatnoczarny osad jodku bizmutu (III)rozpuszczalny:
- w wodzie na gorąco - pomarańczowy osad jodku tlenku
bizmutu (III)
- w nadmiarze jodku z powstaniem tetrajodobizmutanu –
ciemnopomarańczowe zabarwienie roztworu; tetrajodobizmutan
rozcieńczony wodą hydrolizuje z powstaniem pomarańczowego
osadu jodku tlenku bizmutu (III), który rozpuszcza się w
nadmiarze jodku z utworzeniem pomarańczowego roztworu
NaCl 1M
HCl 2M
+H
2
O
Bi
3+
+ H
2
O + Cl
–
BiOCl
+ 2H
+
BiOCl
+ 2H
+
+ 2Cl
–
BiCl
3
+ H
2
O
biały osad chlorku tlenku bizmutu (III), nierozpuszczalny w 2M
zasadach (odróżnienie od soli Sb i Sn); rozpuszcza się w
rozcieńczonych kwasach nieorganicznych
jasnozielony osad heksacyjanożelazianu(II)bizmutu(III)
K
4
[Fe(CN)
6
] 1% 4Bi
3+
+ 3[Fe(CN)
6
]
4–
Bi
4
[Fe(CN)
6
]
3
* odczynnik używa się tylko pod wyciągiem
** przygotowanie roztworu Na
2
[Sn(OH)
4
]: 1 ml 0,5M SnCl
2
+ kroplami 2M NaOH do rozpuszczenia powstającego osadu (sprawdzić odczyn papierkiem
wskaźnikowym–powinien być zasadowy)

9
KADM (Cadmium) Cd
srebrzysty metal, twardszy od cynku, kowalny, dobry przewodnik prądu
Reakcje metalicznego kadmu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
(gorący, rozcieńczony) roztwarza kadm powoli
Cd + 2HCl
CdCl
2
+ H
2
kwas siarkowy (VI) (gorący, rozcieńczony) roztwarza kadm powoli
Cd + H
2
SO
4
CdSO
4
+ H
2
kwas azotowy (V) (rozcieńczony) roztwarza kadm szybko
3Cd + 8HNO
3
3Cd(NO
3
)
2
+ 2NO
+ 4H
2
O
zasada sodowa (roztwór stężony) nie roztwarza
Związki kadmu
stopień utlenienia: +2; liczba koordynacyjna w związkach kompleksowych: 4
w roztworach wodnych występuje w formie bezbarwnego jonu Cd
2+
Rozpuszczalność związków kadmu:
dobrze rozpuszczalne: octan – Cd(CH
3
COO)
2
, chlorek – CdCl
2
, jodek – CdI
2
, azotan (V) – Cd(NO
3
)
2
, siarczan (VI) – CdSO
4
, tiosiarczan – CdS
2
O
3
trudno rozpuszczalne: węglan – CdCO
3
, chromian (VI) – CdCrO
4
, heksacyjanożelazian (II) – Cd
2
[Fe(CN)
6
] wodorotlenek – Cd(OH)
2
,
szczawian – CdC
2
O
4
, tlenek – CdO, ortofosforan (V) – Cd
3
(PO
4
)
2
, siarczek – CdS
Przykłady kompleksów:
[Cd(NH
3
)
4
]
2+
(bezbarwny)
kation(jon) tetraaminakadmu (II)
[CdCl
4
]
2–
(bezbarwny)
tetrachlorokadmian (II)
[CdI
4
]
2–
(bezbarwny)
tetrajodokadmian (II)
jodek kadmu (II) tworzy tzw. autokompleksy CdI
2
+ CdI
2
Cd[CdI
4
] (podobnie, choć w mniejszym stopniu reaguje CdCl
2
)
Właściwości redoks:
jon Cd
2+
jest najsłabszym utleniaczem z kationów grupy IIA
Właściwości kwasowo-zasadowe:
Cd(OH)
2
, który strąca się z roztworów rozpuszczalnych soli kadmowych pod wpływem roztworu NaOH łatwo rozpuszcza się w kwasach, lecz nie ulega
rozpuszczeniu w roztworach zasad, co wskazuje wyraźnie na zasadowy jego charakter; w roztworach wodnych rozpuszczalne sole kadmowe ulegają
hydrolizie i mają odczyn słabo kwasowy

10
Reakcje charakterystyczne jonu Cd
2+
[0,1M CdSO
4
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT* (odczynnik grupowy)
+HCl 2M
HNO
3
2M
Cd
2+
+ H
2
S
CdS
+ 2H
+
3CdS
+ 2NO
3
+ 8H
+
3Cd
2+
+ 2NO
+ 4H
2
O
+ 3S
jasnożółty osad siarczku kadmu (II), nierozpuszczalny w
rozcieńczonych kwasach mineralnych na zimno, siarczku
amonu, w zasadach; rozpuszczalny w stężonych roztworach
chlorków, bromków i jodków metali alkalicznych;
rozpuszczalny w gorącym rozcieńczonym kwasie azotowym
(V)
NaOH 2M
NH
3
aq. stęż. M
Cd
2+
+ 2OH
–
Cd(OH)
2
Cd(OH)
2
+ 4(NH
3
·
H
2
O)
[Cd(NH
3
)
4
]
2+
+ 2OH
–
+ 4H
2
O
[Cd(NH
3
)
4
]
2+
+ 4CN
–
[Cd(CN)
4
]
2–
+ 4NH
3
**
[Cd(CN)
4
]
2–
+ S
2–
CdS
+ 4CN
–
**
biały bezpostaciowy osad nierozpuszczalny w nadmiarze
zasady; rozpuszczalny w amoniaku z utworzeniem jonu
kompleksowego tetraaminakadmu (II);
pod wpływem jonów cyjankowych przechodzący w kompleks
tetracyjanokadmu (II), który reaguje z jonami siarczkowymi z
powstaniem jasnożółtego osadu siarczku kadmu
NH
3
aq. 4M
Cd
2+
+ 2NH
3
· H
2
O
Cd(OH)
2
+ 2NH
4
biały osad wodorotlenku kadmu (II), rozpuszczalny w
nadmiarze amoniaku z powstaniem jonu kompleksowego
tetraaminakadmu (II) [odróżnienie od Pb(OH)
2
i Bi(OH)
3
]
K
4
[Fe(CN)
6
] 1%
2Cd
2+
+ [Fe(CN)
6
]
4–
Cd
2
[Fe(CN)
6
]
biały osad heksacyjanożelazianu (II) kadmu (II) rozpuszczalny
w rozcieńczonych kwasach mineralnych i amoniaku
*odczynnik używa się tylko pod wyciągiem
**z powodu toksyczność cyjanków reakcje nie są wykonywane w laboratorium

11
Grupa II B
ANTYMON (Stibium ) Sb
błyszczący, jasnosrebrzysty metal, twardy i kruchy; na powietrzu powoli się utlenia i pokrywa szarą warstwą tlenków
Reakcje metalicznego antymonu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny (rozcieńczony) nie roztwarza antymonu
kwas siarkowy (VI) (rozcieńczony) nie roztwarza antymonu
kwas siarkowy (VI) (gorący, stężony) roztwarza antymon
2Sb + 6H
2
SO
4
Sb
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
kwas azotowy (V) (stężony) utlenia Sb do Sb
5+
3Sb + 5HNO
3
+ 2H
2
O
3H
3
SbO
4
+ 5NO
kwas azotowy (V) (rozcieńczony +winian sodu)
roztwarza antymon z utworzeniem kompleksu
antymonylo-winianowego (emetyku)
2Sb + 3HNO
3
Sb
2
O
3
+ 2NO
+ H
2
O
Sb
2
O
3
+ 2NaC
4
H
5
O
6
2Na[SbO(C
4
H
4
O
6
] + H
2
O
woda królewska (nadmiar)
(stęż. HCl + stęż. HNO
3
; 3v:1v)
roztwarza antymon
3Sb + 18HCl + 5HNO
3
3H[SbCl
6
] + 5NO
+10 H
2
O
Związki antymonu
stopień utlenienia: +3, +4, +5; liczba koordynacyjna w związkach kompleksowych: 6
w roztworach wodnych w środowisku kwaśnym występuje w formie bezbarwnych jonów Sb
3+
, które hydrolizują już przy pH
1;
Antymon na +5 stopniu utlenienia może istnieć w roztworze tylko w postaci kompleksów.
Rozpuszczalność związków antymonu:
dobrze rozpuszczalne: chlorek – SbCl
3
(w roztworze HCl)
trudno rozpuszczalne: wodorotlenek antymonu (III) – Sb(OH)
3
, kwas metaantymonowy (V) – HSbO
3
i ortoantymonowy (V) – H
3
SbO
4
,
tlenki – Sb
2
O
3
, Sb
2
O
4
, Sb
2
O
5
, siarczki – Sb
2
S
3
, Sb
2
S
5
Przykłady kompleksów:
[Sb(OH)
4
]
–
(bezbarwny)
tetrahydroksoantymonian (III)
[SbCl
6
]
3–
(bezbarwny)
heksachloroantymonian (III)
[SbCl
6
]
–
(bezbarwny)
heksachloroantymonian (V)
[SbS
3
]
3–
(bezbarwny)
tritioantymonian (III)
[SbS
4
]
3–
(bezbarwny)
tetratioantymonian(V)
Właściwości redoks:
antymon należy do metali półszlachetnych; związki antymonu (III) są słabymi reduktorami zwłaszcza w środowisku kwaśnym obojętnym i zasadowym; w
środowisku kwaśnym zachodzi reakcja odwrotna; związki Sb (III) i Sb (V) są redukowane do antymonu metalicznego przez cynę lub żelazo

12
Właściwości kwasowo-zasadowe:
nierozpuszczalne w wodzie Sb
2
O
3
i Sb
2
O
5
mają charakter amfoteryczny, podobnie Sb(OH)
3
SbCl
3
+ 3H
2
O
3HCl
Sb(OH)
3
NaOH
Na[Sb(OH)
4
]
związki antymonu (V) mają charakter bardziej kwaśny; proste związki antymonu (III) i (V) ulegają bardzo łatwo hydrolizie do hydroksosoli i innych form
trudno rozpuszczalnych i dlatego ich roztwory muszą być mocno zakwaszone w celu zapobiegnięcia hydrolizie
Reakcje charakterystyczne jonu Sb
3+
[0,1M SbCl
3
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*(odczynnik
grupowy)+HCl 2M
HCl stężony
HNO
3
stężony
(NH
4
)
2
S*
(NH
4
)
2
S
2
*
NaOH 2M
HCl
2M
2Sb
3+
+ 3H
2
S
Sb
2
S
3
+ 6 H
+
Sb
2
S
3
+ 6H
+
2Sb
3+
+ 3H
2
S
3Sb
2
S
3
+ 10H
+
+ 10NO
3
6HSbO
3
+ 9S
+ 10NO
+2H
2
O
Sb
2
S
3
+ 3S
2–
2SbS
3
3
Sb
2
S
3
+ 3S
2
2
2SbS
4
3
+ S
0
Sb
2
S
3
+ 2OH
–
SbS
2
+ SbOS
–
+ H
2
O
SbS
2
+ SbOS
–
+ 2H
+
Sb
2
S
3
+ H
2
O
pomarańczowy osad siarczku antymonu (III); osad rozpuszcza
się:
w stężonym HCl i wydziela się siarkowodór,
w stężonym HNO
3
pomarańczowy osad przechodzi w biały
kwas metaantymonowy (V) i wydziela się brązowy gaz (NO)
w roztworze siarczku amonu (NH
4
)
2
S; powstaje żółty roztwór
tioantymonianu (III); w wielosiarczku amonowym (NH
4
)
2
S
2
;
powstaje roztwór tioantymonianu (V) i wydziela się siarka
w roztworze NaOH powstają roztwory bezbarwne zawierające
siarkosole
po zakwaszeniu 2M HCl ponownie strąca się pomarańczowy
osad siarczku antymonu (III)
H
2
O
HCl 2M
Sb
3+
+ Cl
–
+ H
2
O
SbOCl
+ 2H
+
4Sb
3+
+ 12Cl
–
+ 5H
2
O
Sb
4
O
5
Cl
2
+ 10H
+
+ 10Cl
–
woda powoduje hydrolizę niezbyt kwaśnych roztworów soli
antymonu (III) z wytrąceniem białego osadu tlenku chlorku
antymonu (III) rozpuszczalnego w kwasach mineralnych i w
kwasie winowym; dalsza hydroliza powoduje powstanie Sb
2
O
3
·
xH
2
O
NaOH 2M Sb
3+
+ 3OH
–
Sb(OH)
3
Sb(OH)
3
+ OH
–
[Sb(OH)
4
]
–
biały osad wodorotlenku antymonu (III) o właściwościach
amfoterycznych; rozpuszcza się w wodorotlenkach - roztwór
bezbarwny
AKT*
H
2
C
2
O
4
nasycony
2Sb
3+
+ 3H
2
S
Sb
2
S
3
+ 6H
+
pomarańczowy osad, dodatek kwasu szczawiowego nie
zabezpiecza przed strącaniem Sb
2
S
3
(odróżnienie od Sn (IV))
* odczynnik używa się tylko pod wyciągiem

13
CYNA (Stannum) Sn
miękki srebrzystobiały metal, dający się łatwo walcować; na powietrzu cyna traci połysk pokrywając się cienką warstewką tlenku
Reakcje metalicznej cyny
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny (zimny, rozcieńczony) roztwarza cynę powoli
Sn + 2HCl
SnCl
2
+ H
2
kwas solny (gorący stężony) roztwarza cynę szybko
Sn + 2HCl
SnCl
2
+ H
2
kwas siarkowy (VI) (rozcieńczony) roztwarza cynę powoli
Sn + H
2
SO
4
SnSO
4
+ H
2
kwas siarkowy (VI) (gorący stężony) roztwarza cynę szybko
Sn + 4H
2
SO
4
Sn(SO
4
)
2
+ 2SO
2
+ 4H
2
O
kwas azotowy (V) (rozcieńczony, stężony) roztwarza cynę tworząc nierozpuszczalny H
2
SnO
3
Sn + 4HNO
3
H
2
SnO
3
+ 4NO
2
+ H
2
O
woda królewska
(stęż. HCl + stęż. HNO
3
; 3v:1v)
roztwarza cynę
3Sn + 12HCl + 4HNO
3
3SnCl
4
*
+ 4NO
+ 8H
2
O
zasada sodowa (gorący roztwór) roztwarza cynę
Sn + 2OH
–
+ 4H
2
O
[Sn(OH)
6
]
2–
+ 2H
2
* przy nadmiarze HCl tworzy się H
2
[SnCl
6
]
Związki cyny
s
topień utlenienia: +2 i +4; liczba koordynacyjna w związkach kompleksowych: Sn
2+
– 3 i 4; Sn
4+
– 6
w roztworach wodnych w środowisku kwaśnym, występuje w formie bezbarwnych jonów Sn
2+
, które hydrolizują już przy pH=1,7; bezbarwny Sn
4+
jest trwały
(w środowiskach niekompleksujących) przy pH<0,5; przy wyższych pH strąca się Sn(OH)
4
, który rozpuszcza się w roztworach wodorotlenków alkalicznych
z utworzeniem bezbarwnego [Sn(OH)
6
]
2–
Rozpuszczalność związków cyny (II)
dobrze rozpuszczalne: chlorek – SnCl
2
, siarczan (VI) –SnSO
4
trudno rozpuszczalne: chromian – SnCrO
4
, heksacyjanożelazian (II) – Sn
2
[Fe(CN)
6
], heksacyjanożelazian (III) – Sn
3
[Fe(CN)
6
]
2
,
wodorotlenek – Sn(OH)
2
, szczawian – SnC
2
O
4
, tlenek– SnO, siarczek – SnS
Rozpuszczalność związków cyny (IV)
dobrze rozpuszczalne: octan – Sn(CH
3
COO)
4
, chlorek – SnCl
4
, jodek – SnI
4
, siarczan (VI) – Sn(SO
4
)
2
trudno rozpuszczalne: heksacyjanożelazian (II) – Sn[Fe(CN)
6
], tlenek – SnO
2
, siarczek – SnS
2
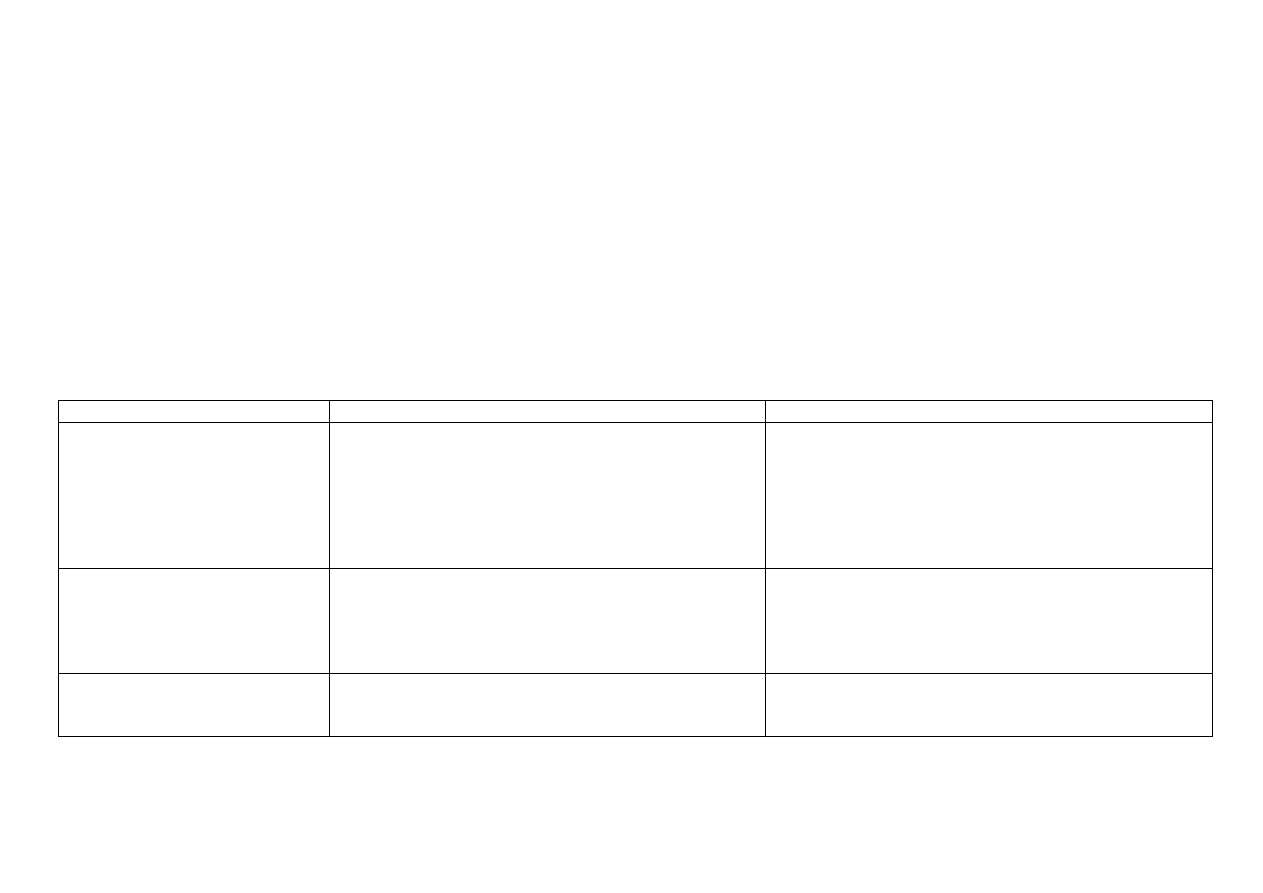
14
Przykłady kompleksów:
[Sn(OH)
4
]
2–
(bezbarwny)
tetrahydroksocynian (II)
[Sn(OH)
6
]
2–
(bezbarwny)
heksahydroksocynian (IV)
[SnCl
4
]
2–
(bezbarwny)
tetrachlorocynian (II)
[SnCl
6
]
2–
(bezbarwny)
heksachlorocynian (IV)
Właściwości redoks:
cyna należy do metali nieszlachetnych; związki cyny (II) (nietrwałe w powietrzu) są mocnymi reduktorami, a SnCl
2
stosowany jest często w laboratorium do identyfikacji
innych kationów (Hg
2+
, Hg
2
2
, Bi
3+
, As
3+
); związki cyny (IV) mają bardzo słabe właściwości utleniające
Właściwości kwasowo-zasadowe:
nierozpuszczalne w wodzie wodorotlenki: Sn(OH)
2
i Sn(OH)
4
mają charakter amfoteryczny: SnCl
2
+2H
2
O
HCl
2
Sn(OH)
2
2NaOH
Na
2
[Sn(OH)
4
]
SnCl
4
+4H
2
O
4HCl
Sn(OH)
4
2NaOH
Na
2
[Sn(OH)
6
]
związki Sn (IV) mają charakter bardziej kwasowy; proste związki Sn (II) i Sn (IV) ulegają łatwo hydrolizie do wodorotlenków i innych trudno rozpuszczalnych hydroksosoli
i dlatego ich roztwory muszą być mocno zakwaszone w celu zapobiegnięcia hydrolizie
Reakcje charakterystyczne jonu Sn
2+
[0,5M SnCl
2
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT* (odczynnik grupowy)
+HCl 2M
HCl stężony
(NH
4
)
2
S
2
*
HCl 2M
Sn
2+
+ H
2
S
SnS
+ 2H
+
SnS
+ 2H
+
Sn
2+
+ H
2
S
SnS
+
S
2
2
SnS
3
2
SnS
3
2
+ 2H
+
SnS
2
+ H
2
S
czarnobrunatny osad siarczku cyny (II); nie rozpuszcza się
w zasadzie sodowej i potasowej, siarczku amonu i
amoniaku, w odróżnieniu do siarczków antymonu oraz
SnS
2
; rozpuszczalny w stężonym kwasie solnym z
wydzieleniem H
2
S;
w wielosiarczku amonu; powstaje tritiocynian (IV) amonu
po zakwaszeniu kwasem solnym wytrąca się żółty SnS
2
NaOH
2M
HCl 2M
Sn
2+
+ 2OH
–
Sn(OH)
2
Sn(OH)
2
+ 2OH
–
[Sn(OH)
4
]
2–
Sn(OH)
2
+ 2H
+
Sn
2+
+ 2 H
2
O
wodorotlenki, amoniak i węglan sodu powodują wytrącanie
białego osadu wodorotlenku cyny (II) o właściwościach
amfoterycznych
osad rozpuszcza się zarówno w wodorotlenkach jak i
kwasach
HgCl
2
0,1M Sn
2+
+ 2Hg
2+
+ 8Cl
–
Hg
2
Cl
2
+ SnCl
6
2
Sn
2+
+ Hg
2
Cl
2
+ 4Cl
–
[SnCl
6
]
2–
+ 2Hg
0
biały osad kalomelu, który powoli szarzeje i przechodzi w
czarny osad metalicznej rtęci
* odczynnik używa się tylko pod wyciągiem
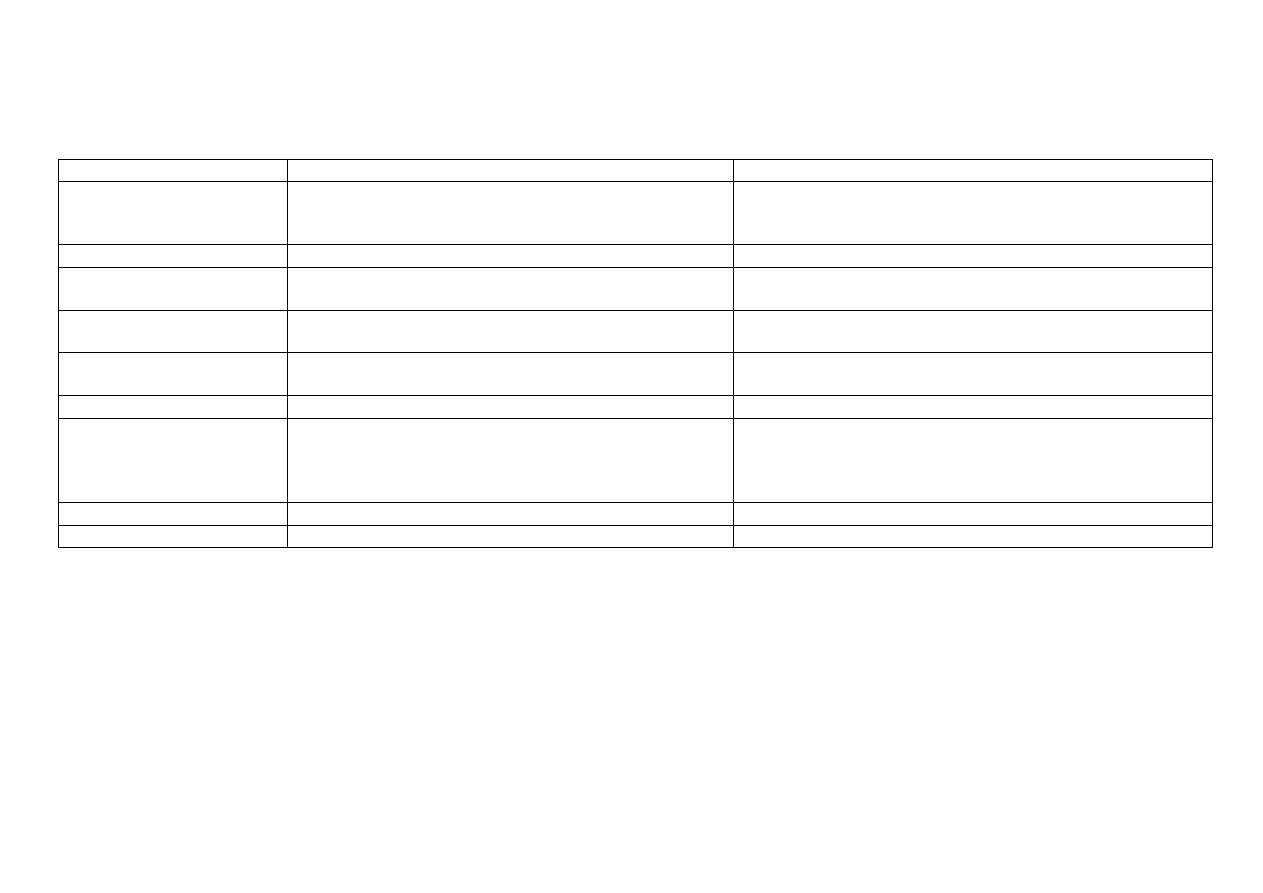
15
Reakcje charakterystyczne jonu Sn
4+
[0,5M SnCl
4
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*(odczynnik grupowy)
HCl 2M
[SnCl
6
]
2–
+ 2H
2
S
SnS
2
+ 4H
+
+ 6Cl
–
Sn
4+
występuje przeważnie w postaci jonu kompleksowego
[SnCl
6
]
2–
lub [Sn(OH)
6
]
2–
i wytrąca się w postaci żółtego osadu
siarczku cyny (IV)
(NH
4
)
2
S*
SnS
2
+ S
2–
[SnS
3
]
2–
osad rozpuszcza się w siarczku i wielosiarczku amonu
HCl 2M [SnS
3
]
2–
+ 2H
+
SnS
2
+ H
2
S
po zakwaszeniu roztworu zawierającego tiocyniany ponownie
strąca się żółty osad SnS
2
i wydziela się siarkowodór
HNO
3
stężony SnS
2
+ 4H
+
+ 4
3
NO
H
2
SnO
3
+ 2S
+ 4NO
2
+ H
2
O
rozpuszcza się w stężonym HNO
3
; żółty osad przechodzi w
biały, wydziela się brunatny gaz ditlenku azotu
HCl stężony SnS
2
+ 4H
+
+ 6Cl
–
2H
2
S
+ [SnCl
6
]
2–
rozpuszcza się w stężonym HCl z wydzieleniem H
2
S oraz w
NaOH
NaOH 2M 3SnS
2
+ 6OH
–
[Sn(OH)
6
]
2–
+ 2[SnS
3
]
2–
NaOH 2M [SnCl
6
]
2–
+ 4OH
–
Sn(OH)
4
+ 6Cl
–
Sn(OH)
4
+ 2OH
–
[Sn(OH)
6
]
2–
Roztwory zasad, amoniak i węglan sodu powodują wytrącanie
białego galaretowatego osadu wodorotlenku cyny (IV) o
właściwościach
amfoterycznych:
rozpuszczalnego
w
wodorotlenkach
HCl 2M Sn(OH)
4
+ 4H
+
+ 6Cl
–
[SnCl
6
]
2–
+ 4H
2
O
rozpuszczalnego w kwasach
barwienie płomienia
powstawanie palnego SnH
4
**
jasnobłękitne zabarwienie płomienia palnika
* odczynnik używa się tylko pod wyciągiem
** wykonanie: do badanej próby w porcelanowej parownicy dodaje się stężony HCl i miesza cienką probówką wypełnioną zimną wodą.; mokrą probówkę
wprowadza się do redukującej części nie świecącego płomienia palnika; powierzchnia probówki w zetknięciu z płomieniem świeci jasnoniebiesko, co
dowodzi obecności cyny.
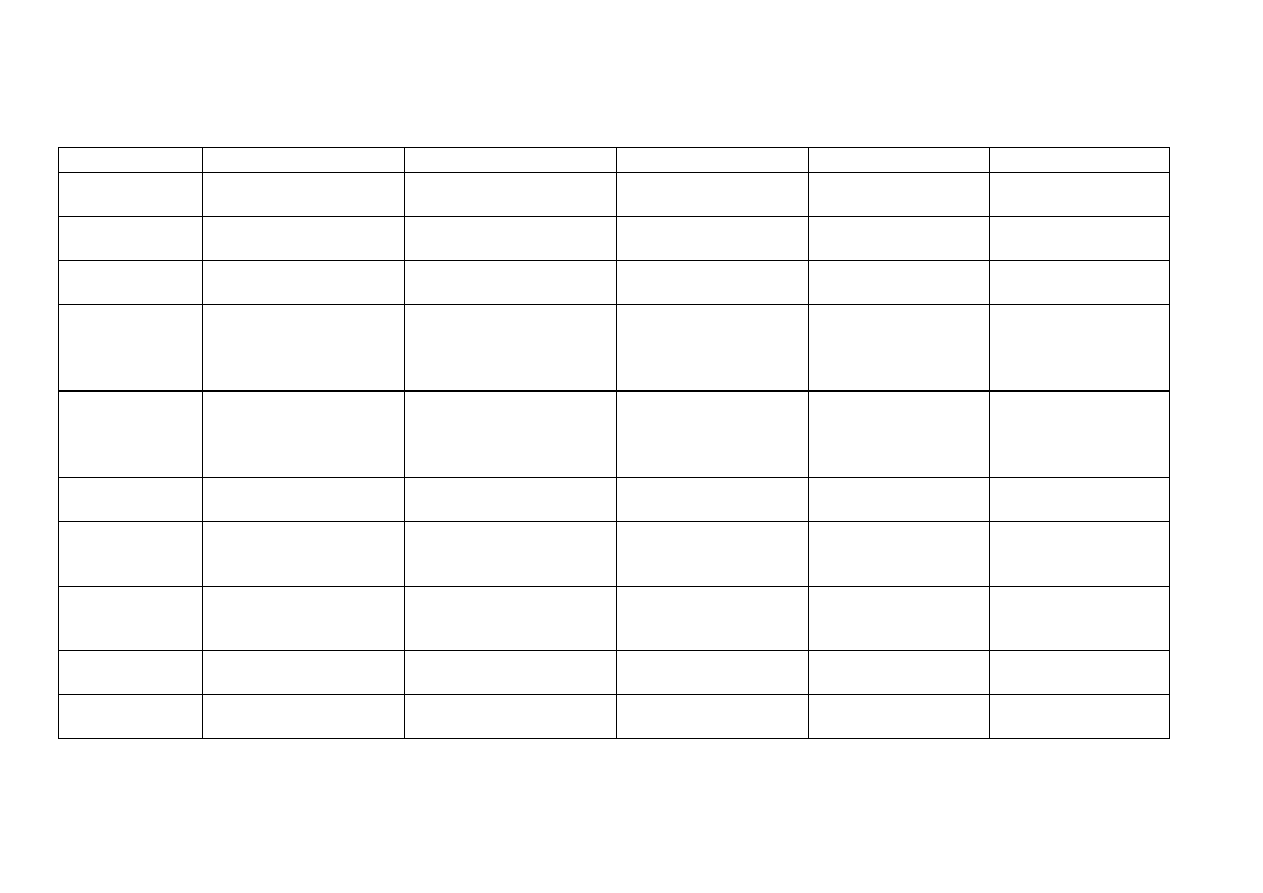
16
PORÓWNANIE PRODUKTÓW REAKCJI KATIONÓW GRUPY II A
Odczynnik
Hg
2+
Pb
2+
Cu
2+
Bi
3+
Cd
2+
AKT (H
2
S)
HgS
czarny
PbS
czarny
CuS
czarny
Bi
2
S
3
brązowo-czarny
CdS
żółty
NaOH
HgO
żółty
Pb(OH)
2
biały
Cu(OH)
2
niebieski
Bi(OH)
3
biały
Cd(OH)
2
biały
NaOH
(nadmiar)
HgO
żółty
Na
2
[Pb(OH)
4
]
bezbarwny
Cu(OH)
2
niebieski
Bi(OH)
3
biały
Cd(OH)
2
biały
NH
3
aq.
Hg(NH
2
)Cl
biały
[OHg
2
NH
2
]NO
3
biały
5PbO · Pb(NO
3
)
2
· H
2
O
biały
Cu
2
(OH)
2
SO
4
jasnoniebieski
Bi(OH)
3
biały
Cd(OH)
2
biały
NH
3
aq.
(nadmiar)
Hg(NH
2
)Cl
biały
[OHg
2
NH
2
]NO
3
biały
5PbO
· Pb(NO
3
)
2
· H
2
O
biały
[Cu(NH
3
)
4
]
2+
ciemnoniebieski
Bi(OH)
3
biały
[Cd(NH
3
)
4
]
2+
bezbarwny
H
2
SO
4
PbSO
4
biały
KI
HgI
2
pomarańczowoczerwony
PbI
2
żółty
Cu
2
I
2
+ I
2
biały osad + brązowy
roztwór
BiI
3
brunatny
KI
(nadmiar)
[HgI
4
]
2–
bezbarwny
PbI
2
żółty
Cu
2
I
2
+ I
2
biały osad + brązowy
roztwór
[BiI
4
]
–
pomarańczowy
SnCl
2
(nadmiar)
Hg
2
Cl
2
+ Hg
szary
PbCl
2
K
4
[Fe(CN)
6
]
Hg
2
[Fe(CN)
6
]
biały
Cu
2
[Fe(CN)
6
]
czerwonobrunatny
Bi
4
[Fe(CN)
6
]
3
jasnozielony
Cd
2
[Fe(CN)
6
]
biały
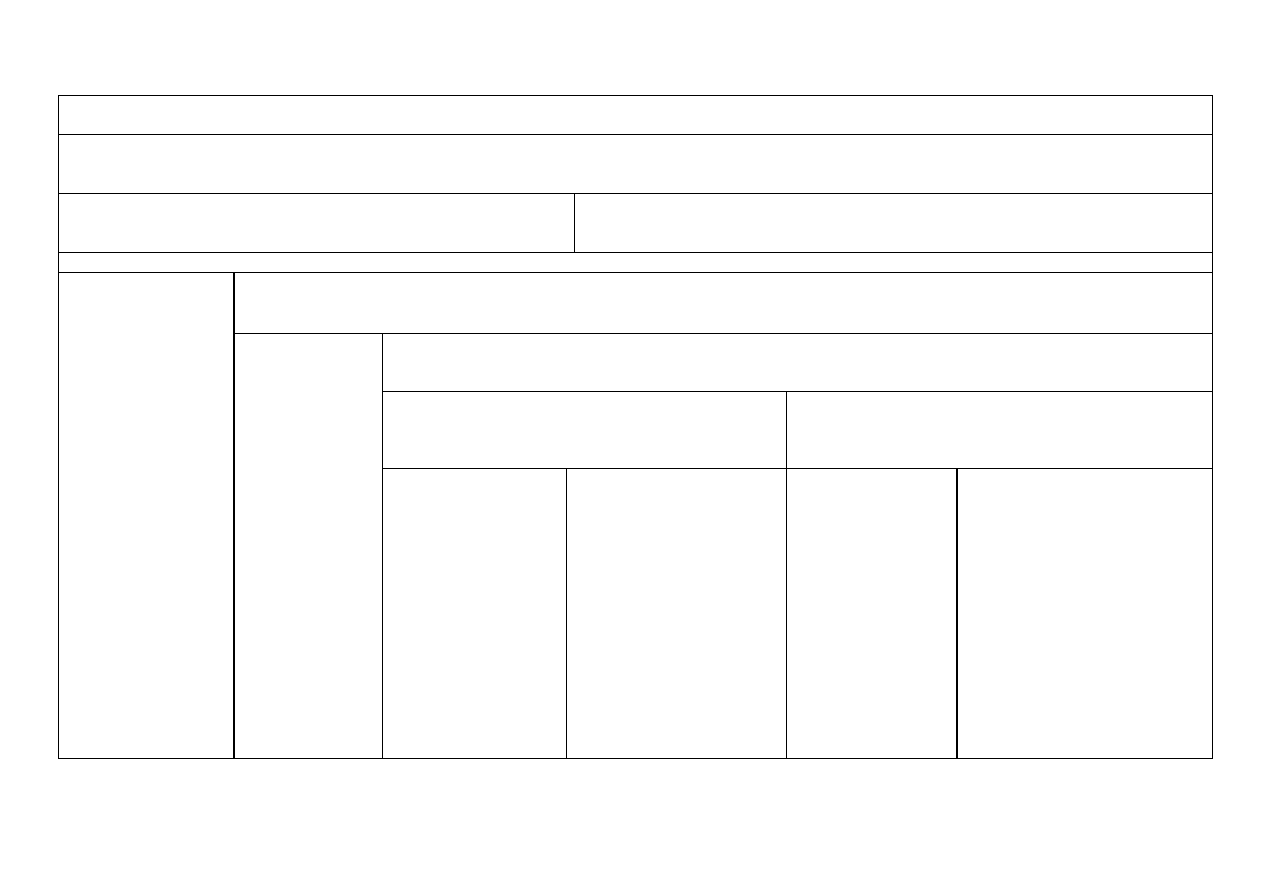
13
Analiza mieszaniny kationów II grupy analitycznej (Hg
2+
, Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
, Sb
3+
, Sn
2+
, Sn
4+
)
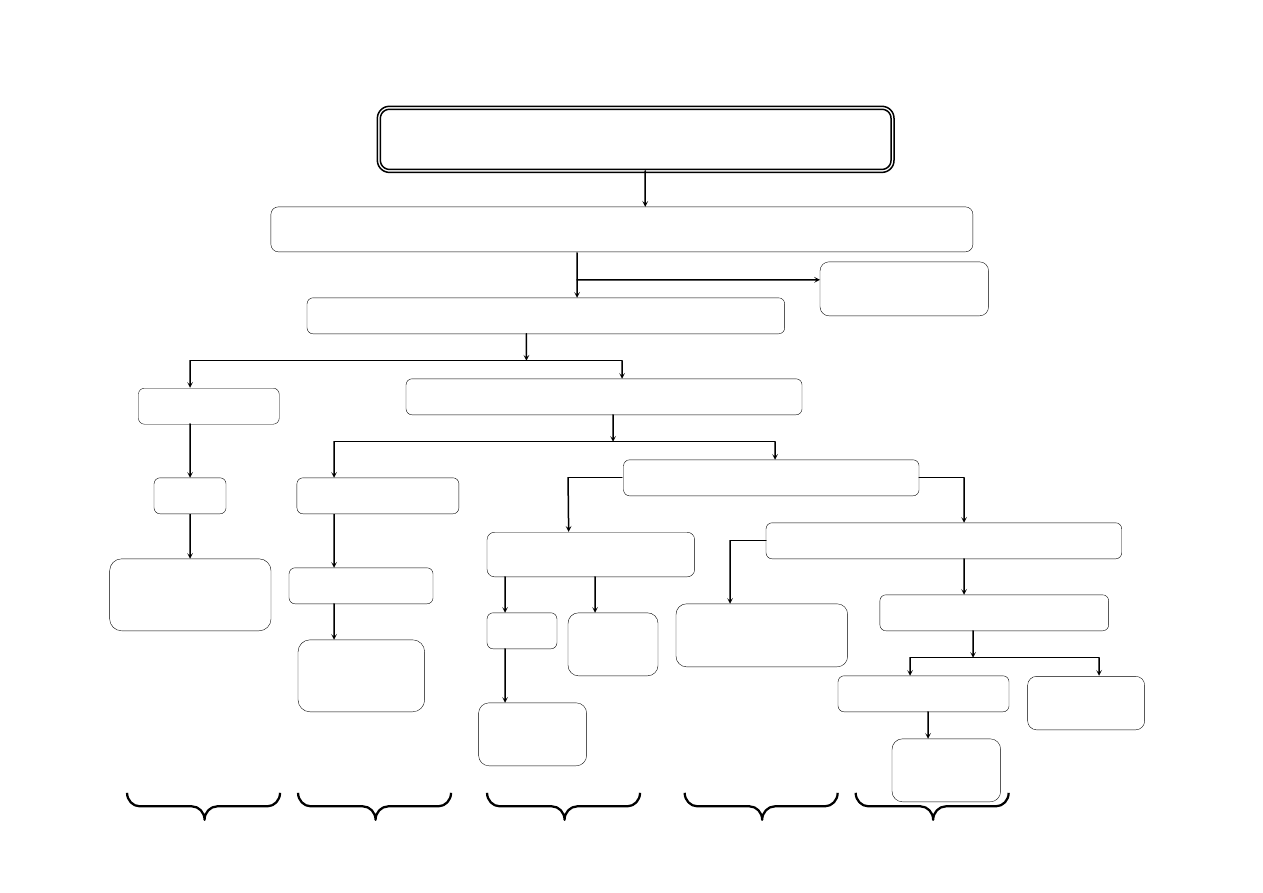
Do ok. 3 ml próby pierwotnej zakwaszonej kwasem solnym dodać ok. 15 kropel AKT (tioacetamid) i ogrzewać przez 15 min (nie krócej!!!). Powstały osad 1 odsączyć i po
stwierdzeniu całkowitego wytrącania kationów grupy IIA, powstały osad oddzielić od roztworu. Roztwór zawiera kationy grup III-V
Osad 1: HgS
, PbS
, CuS
, Bi
2
S
3
, CdS
, Sb
2
S
3
, SnS
, SnS
2
i S
. Osad 1 przemyć kilkoma kroplami ogrzanego do wrzenia roztworu zawierającego 2M NH
4
Cl i
AKT . Do osadu dodać ok. 1 ml 1M KOH* i 5 kropel 3% H
2
O
2
, wymieszać, ogrzewać 3 minuty. Oddzielić osad od roztworu. Osad 2-krotnie przemyć 6 kroplami wody i
wodę z przemycia dołączyć do roztworu.
Osad 2 - zawiera podgrupę IIA: HgS
, PbS
, CuS
, Bi
2
S
3
, CdS
. Do
osadu dodać ok. 1 ml 2M HNO
3
i gotować ok. 2 min., następnie oddzielić
osad od roztworu
Przesącz 2:
Zawiera kationy podgrupy II B
Analiza kationów grupy IIA
Osad 3: HgS
(brunatny) lub HgS ·
Hg(NO
3
)
2
(biały) + S
Przesącz 3 zawierający jony Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
w postaci azotanów zadać 1ml st. H
2
SO
4
, gotować do pojawienia się białych dymów SO
2
,
oziębić do temperatury pokojowej, ostrożnie rozcieńczyć 4 ml wody i odsączyć. Otrzymuje się osad 4 i przesącz 4
Przemyć 6 kroplami
wody, dodać 6 kropel
stężonego
Osad 4 zawierający
PbSO
4
przemyć 3
Przesącz 4 zawierający jony Cu
2+
, Bi
3+
, Cd
2+
w postaci siarczanów (VI) zobojętnić stężonym NH
3
aq., po czym dodać 1
ml nadmiaru tego odczynnika i odsączyć otrzymaną mieszaninę. Otrzymuje się osad 5 i przesącz 5
HCl
i
2
krople
stężonego
HNO
3
.
Ogrzać
do
rozpuszczenia się osadu.
ml gorącej wody,
roztworzyć w
mieszaninie 2 ml
Osad 5 zawierający Bi(OH)
3
przemyć 2 ml 2M NH
3
aq. i
podzielić na dwie części:
Przesącz 5 zawierający jony [Cu(NH
3
)
4
]
2+
i [Cd(NH
3
)
4
]
2+
(granatowe zabarwienie świadczy o obecności jonu Cu
2+
)
podzielić na dwie części.
Odparować
w
parowniczce prawie do
sucha,
dolać
kilka
kropel wody, oddzielić
od wydzielonej siarki,
odsączyć i dodać kilka
kropel 0,5M SnCl
2
.
Powstanie białego,
szarzejącego się osadu
Hg + Hg
2
Cl
2
wskazuje na obecność
Hg
2+
CH
3
COOH. Do
otrzymanego
roztworu dodać
kilka kropli 1M
roztworu K
2
CrO
4
.
Żółty osad
PbCrO
4
świadczy
o obecności
Pb
2+
1
Osad 5 zadać 2M H
2
SO
4
do rozpuszczenia i dodać
1 ml 0,1M KI.
Powstający
ciemnobrązowy osad
BiI
3
świadczy o
obecności
Bi
3+
2
Osad 5 zadać świeżo
przygotowanym roztworem
Na
2
[Sn(OH)
4
]**. Powstający
szybko czerniejący osad Bi
świadczy o obecności
Bi
3+
1
Przesącz 5 zobojętnić
2M CH
3
COOH, po
czym dodać 1ml
roztworu 1%
K
4
[Fe(CN)
6
].
Powstający wiśniowo-
brązowy osad
Cu
2
[Fe(CN)
6
]
świadczy o obecności
Cu
2+
2
Przesącz 5 Jeżeli jest niebieski,
zawiera
[Cu(NH
3
)
4
]
2+
i
ew.
[Cd(NH
3
)
4
]
2+
. Dodać kilka kropli
AKT, ogrzać. Przesączyć osad i do
osadu CuS
i CdS
dodać 6M HCl.
Odsączyć i pozostały osad CuS
odrzucić.
Przesącz 6 zawiera [CdCl
4
]
2–
Dodać stężony NH
3
aq. do odczynu
lekko zasadowego i kilka kropli
AKT, ogrzewać.
Żółtopomarańczowy osad CdS
świadczy o obecności jonu
Cd
2+
* rozdzielanie za pomocą KOH grupy II na podgrupy A i B polega na tworzeniu się rozpuszczalnych siarkosoli antymonu i cyny (IV); nie stosujemy do rozdzielania NaOH, ze
względu na możliwość wytrącania trudno rozpuszczalnego Na[Sb(OH)
6
]
** przygotowanie roztworu Na
2
[Sn(OH)
4
]: 1 ml 0,5M SnCl
2
+ nadmiar 2M NaOH do rozpuszczenia powstającego osadu (sprawdzić, czy odczyn jest zasadowy)
14
przesącz
kationy
podgrupy IIB
osad
HgS
, PbS
, CuS
, Bi
2
S
3
, CdS
1M KOH + 3% H
2
O
2
2M HNO
3
przesącz
Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
(azotany)
st.H
2
SO
4
przesącz
Bi
3+
, Cu
2+
, Cd
2+
(siarczany)
osad
HgS
st.HCl+st.HNO
3
(3:1,
v:v)
0,5M SnCl
2
Hg+Hg
2
Cl
2
szary
HgCl
2
st.NH
3
aq.
pH>7
Pb(CH
3
COO)
2
st.CH
3
COOH
30%CH
3
COONH
4
osad
PbSO
4
1M K
2
CrO
4
PbCrO
4
żółty
Na
2
[Sn(OH)
4
]
Bi
3+
BiI
3
brunatny
Bi
czarny
osad
Bi(OH)
3
2M H
2
SO
4
0,1M KI
przesącz
[Cu(NH
3
)
4
]
2+
, [Cd(NH
3
)
4
]
2+
Cu
2
[Fe(CN)
6
]
wiśniowo-brązowy
osad
CuS
, CdS
2M CH
3
COOH
1% K
4
[Fe(CN)
6
]
AKT
6M HCl
osad
CuS
czerwony
st.NH
3
aq.+AKT
przesącz
[CdCl
4
]
2-
CdS
żółty
Wynik: Bi
3+
Wynik: Pb
2+
Wynik: Hg
2+
Wynik: Cu
2+
Wynik: Cd
2+
SCHEMAT ROZDZIELENIA MIESZANINY KATIONÓW IIA GRUPY
ANALITYCZNEJ
Hg
2+
, Pb
2+
, Cu
2+
, Bi
3+
, Cd
2+
, Sb
3+
, Sn
2+
, Sn
4+
AKT + HCl
osad
HgS
, PbS
, CuS
, Bi
2
S
3
, CdS
, Sb
2
S
3
, SnS
, SnS
2
, S

15
Uwagi do rozdzielenia mieszaniny kationów IIA grupy analitycznej
1) W przypadku analizy mieszaniny kationów wyłącznie grupy IIA można strącanie ich siarczków
przeprowadzić roztworem AKT (po uprzednim zakwaszeniu próbki 2M HCl).
2) Bardzo pomocne w toku analizy kationów grupy IIA są wstępne próby identyfikacji niektórych
z nich:
a) identyfikację jonu Hg
2+
można przeprowadzić dwoma metodami:
kroplę badanej próbki nanieść na oczyszczoną powierzchnię blaszki miedzianej. Utworzona
srebrzysta warstewka świadczy o obecności jonu Hg
2+
w próbce. Zachodzi następująca
reakcja:
Hg
2+
+ Cu
Hg
+ Cu
2+
do 0,5 ml próbki dodać 2ml 0,5M roztworu SnCl
2
. Wydzielający się szary osad Hg
2
Cl
2
+
Hg
świadczy o obecności jonu Hg
2+
w próbce. Pozostałe kationy II A grupy nie
przeszkadzają tym reakcjom.
b) identyfikację jonu Pb
2+
przeprowadza się w następujący sposób:
do 1 ml próby pierwotnej dodać 2 ml 1M H
2
SO
4
, zagotować do wrzenia. Pojawiający się biały
osad PbSO
4
świadczy o obecności kationu Pb
2+
. Pozostałe kationy grupy II A nie dają
trudno rozpuszczalnych osadów w tych warunkach.
Stwierdzenie nieobecności jonu Hg
2+
w próbie wstępnej pozwala w przypadku kationów wyłącznie grupy
II A rozpocząć analizę od przesączu 2, który zawiera wszystkie pozostałe kationy tej grupy. W
przypadku niewykrycia jonu Pb
2+
można w toku analizy pominąć etap dodawania stęż. H
2
SO
4
i do
przesączu 2 dodawać od razu stężony NH
3
aq.
3) W przypadku powstania osadu w próbie na całkowite strącenie siarczków grupy II A, próbkę
należy rozcieńczyć wodą i dodać AKT. Otrzymane osady siarczków połączyć.
4) Użycie zbyt stężonego kwasu azotowego (V) do rozpuszczania siarczków grupy II może
spowodować częściowe utlenienie PbS
do nierozpuszczalnego PbSO
4
.
16
PORÓWNANIE PRODUKTÓW REAKCJI SIARCZKÓW
KATIONÓW GRUPY II B
Odczynnik
Sb
2
S
3
Sb
2
S
5
SnS
SnS
2
AKT
lub
(NH
4
)
2
S
SbS
3
3
SbS
4
3
SnS
SnS
3
2
(NH
4
)
2
S
2
SbS
4
3
SbS
4
3
SnS
3
2
SnS
3
2
NaOH
SbS
3
3
[Sb(OH)
4
]
-
SbS
4
3
SbO
3
S
3-
SnS
SnS
3
2
SnO
2
S
2-
NH
3
aq.
Sb
2
S
3
Sb
2
S
5
SnS
SnS
2
(NH
4
)
2
CO
3
Sb
2
S
3
Sb
2
S
5
SnS
SnS
2
stęż. HCl
[SbCl
6
]
3–
[SbCl
6
]
–
Sn
2+
[SnCl
6
]
2–
stęż. HNO
3
HSbO
3
H
3
SbO
4
H
2
SnO
3
H
2
SnO
3

17
PORÓWNANIE FORM WYSTĘPOWANIA KATIONÓW GRUPY IIB
W ZALEŻNOŚCI OD ŚRODOWISKA
Odczynnik/
środowisko
Sb
3+
Sb
5+
Sn
2+
Sn
4+
HCl + H
2
S
aq
Sb
2
S
3
pomarańczowy
Sb
2
S
5
pomarańczowy
SnS
brązowy
SnS
2
żółty
HCl
[SbCl
6
]
3–
[SbCl
6
]
–
Sn
2+
[SnCl
6
]
2–
NaOH
(nadmiar)
[Sb(OH)
4
]
–
Sb
2
O
5
.
H
2
O
biały
[Sn(OH)
4
]
2–
[Sn(OH)
6
]
2–
NH
3aq
Sb(OH)
3
biały
Sb
2
O
5
.
H
2
O
biały
Sn(OH)
2
biały
H
2
SnO
3
biały
NH
3
aq.
(nadmiar)
Sb(OH)
3
biały
Sb
2
O
5
.
H
2
O
biały
Sn(OH)
2
biały
H
2
SnO
3
biały
H
2
O
pH
7
(duże rozcieńczenie)
SbOCl
Sb
4
O
5
Cl
2
biały
Sb
2
O
5
.
H
2
O
biały
Sn
2
OCl
2
biały
H
2
SnO
3
biały
18
Analiza mieszaniny kationów grupy II B ( Sb
3+
, Sn
4+
)
Roztwór po oddzieleniu podgrupy A może zawierać jony:
SbOS
SbS
Sn OH
SnS
OH
;
;[
(
) ]
;
;
2
6
2
3
2
. Roztwór zakwasić 2M HCl wobec papierka lakmusowego,
dodać 5-10 kropel AKT, ogrzewać przez kilka minut i oddzielić osad 1.
Osad 1 zawierający Sb
2
S
3
, SnS
2
przemyć 2 razy 3 ml gorącej wody z dodatkiem kilku kropli HNO
3
, a następnie rozpuścić na gorąco w 3 ml stężonego
HCl i gotować jeszcze przez 2 minuty. Roztwór rozcieńczyć 3 ml wody, odsączyć. Otrzymuje się osad 2 i przesącz 2. Przesącz 2 podzielić na dwie części.
1
Przesącz 2 zawierający Sb
3+
i Sn
4+
zadać 5 ml nasyconego
H
2
C
2
O
4
* , ogrzać do wrzenia i dodać AKT.
Pomarańczowy osad Sb
2
S
3
świadczy o obecności
Sb
3+
2
Przesącz 2. Wykonać reakcje charakterystyczne na
obecność Sn
4+
, np. barwienie płomienia palnika na
jasnoniebiesko, wskutek powstawania palnego SnH
4
.
Do badanej próby w porcelanowej parownicy dodaje się st.
HCl i miesza cienką probówką wypełnioną zimną wodą.
Mokrą probówkę wprowadza się do redukującej części
płomienia palnika. Powierzchnia probówki w zetknięciu z
płomieniem świeci jasnoniebiesko, co świadczy o
obecności
Sn
4+
Osad 2 zawierający siarkę
S
odrzucić
*
W obecności nadmiaru jonów C O
2
4
2
powstaje trwały jon kompleksowy [Sn(C
2
O
4
)
4
(H
2
O)
2
]
4–
wskutek czego SnS
2
nie wytrąca się (w odróżnieniu od
Sb
3+
).
19
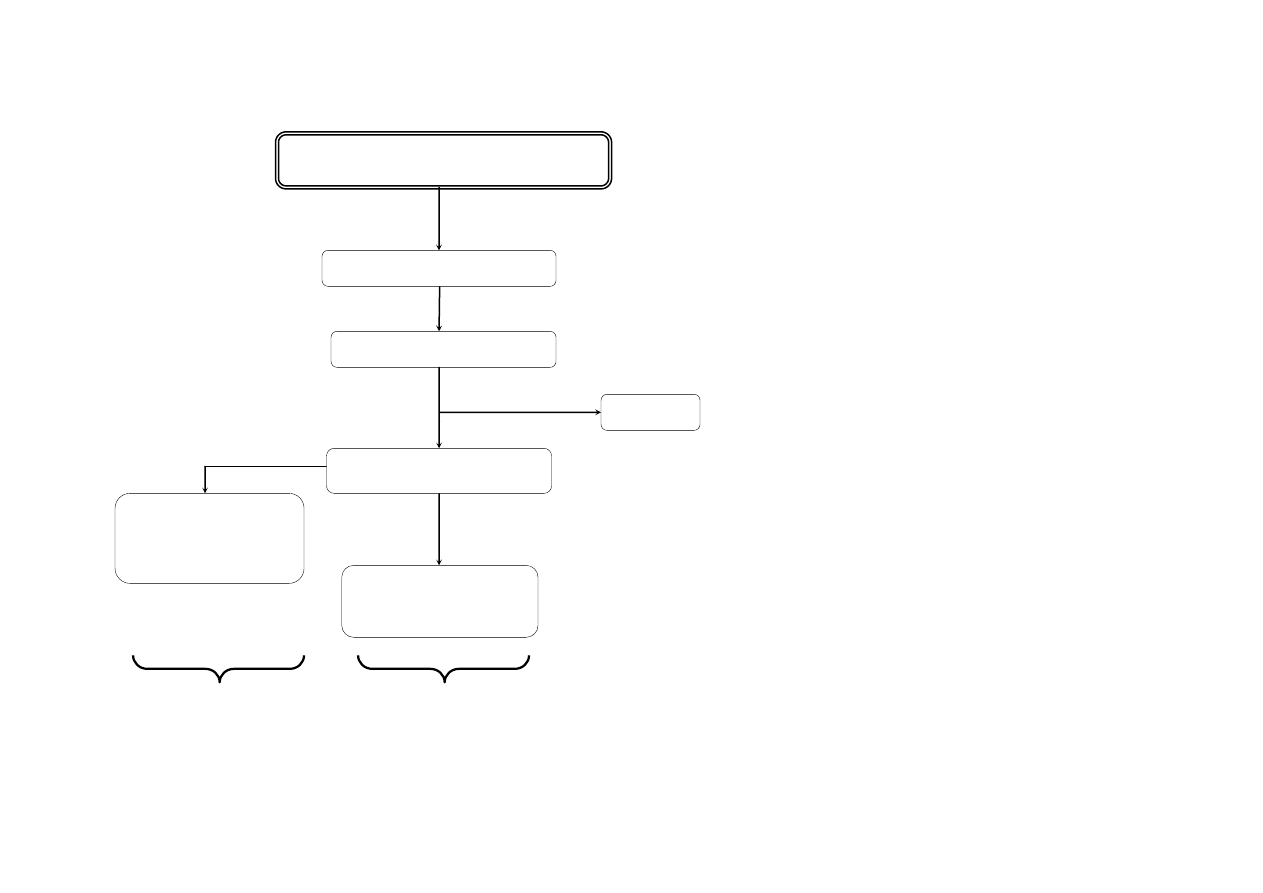
SCHEMAT ROZDZIELANIA MIESZANINY KATIONÓW GRUPY
IIB
osad
Sb
2
S
3
pomarańczowy
osad
S
przesącz
Sb
3+
,
Sn
4+
H
2
O
jasnoniebieskie
zabarwienie płomienia
SnH
4
H
2
C
2
O
4
nasycony + AKT
st. HCl
osad
Sb
2
S
3
, SnS
2
2M HCl + AKT
pH~1
SnS
,
,
SbS
,
SbOS
2
3
2
[Sn(OH)
6
]
2-
Wynik: Sn
4+
Wynik: Sb
3+
przesącz
Sb
3+
,
Sn
4+
Uwagi do rozdzielania mieszaniny
kationów grupy IIB
1) Po rozpuszczeniu siarczków
antymonu i cyny w kwasie solnym przez
gotowanie całkowicie usunąć z roztworu
wydzielający się siarkowodór, który
mógłby ponownie strącić siarczki tych
pierwiastków po rozcieńczeniu próbki
wodą.
2) Dodatek H
2
C
2
O
4
do przesączu 2
ma na celu przeprowadzenie cyny (IV) w
kompleks [Sn(C
2
O
4
)
4
(H
2
O)
2
]
4–
, z którego
AKT
(H
2
S
aq
)
nie
strąca
SnS
2
[maskowanie cyny (IV)].

Wyszukiwarka
Podobne podstrony:
analiza kationów III gr (2)
ANALIZA KATIONÓW I,II,III GRUPY ANALITYCZNEJ
ANALIZA KATIONÓW I i II GRUPY ANALITYCZNEJ
charakterystyka II gr kationów
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
analiza kationów gr IV i V
kationy I, II, III, IV, V gr
charakterystyka II gr kationów
Analiza czynnikowa II
Kationy I i II grupa, 5. - Pomoce Naukowe (PDFy , Doc itp)
Analiza żywności ćw 4 kwasowość, Tż, Analiza żywności II, Sprawozdania
Polarymetryczne oznaczanie zawartości skrobi, Tż, Analiza żywności II, Sprawozdania
analiza kationów I V (2)
Oznaczanie cukrow prostych metoda Antronowa, Tż, Analiza żywności II, Sprawozdania
Analiza kationow i anionow
Sprawozdanie analiza kationów
Ćwiczenie 11G, Tż, Analiza żywności II, Sprawozdania
Sprawozdanie ćw 18, Tż, Analiza żywności II, Sprawozdania
Oznaczanie zawartości laktozy w mleku metodą Bertranda 1, Tż, Analiza żywności II, Sprawozdania
więcej podobnych podstron