

CECHY
CHARAKTERYSTYCZNE TEJ
GRUPY TO:
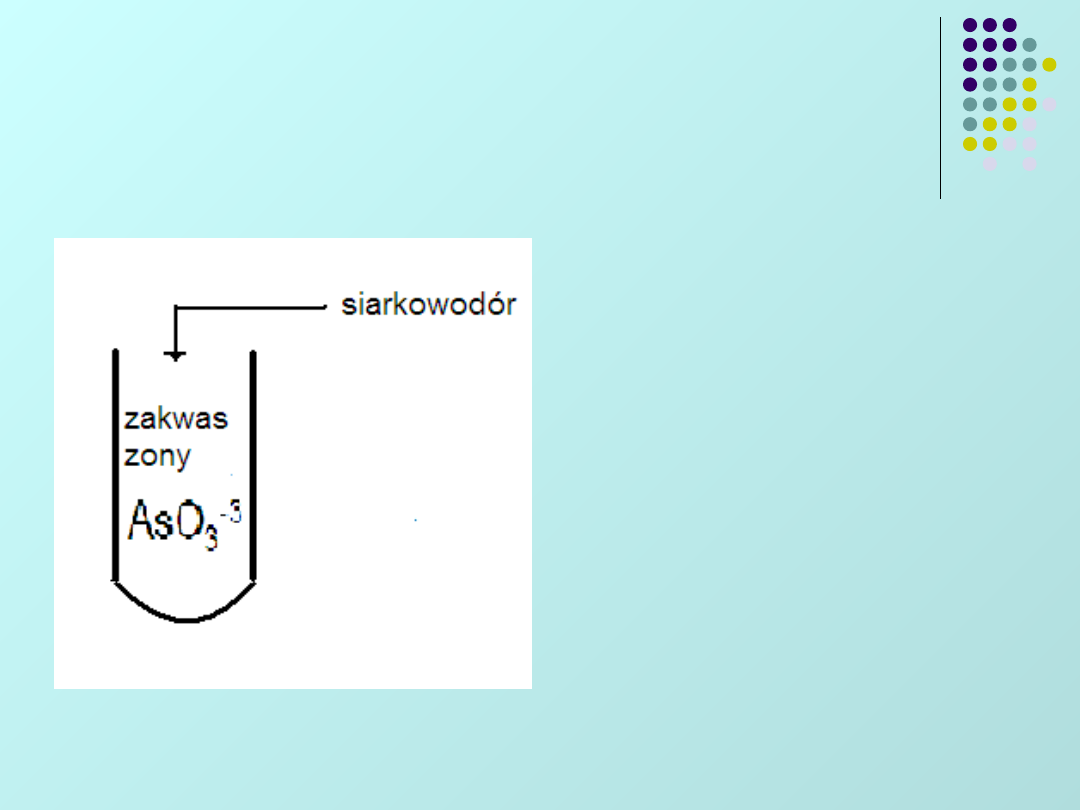
Odczynnikiem grupowym dla całej II grupy
kationów jest wodny roztwór siarkowodoru
H
2
S ( może też być AKT-jest to amid kwasu
tioctowego, który pod wpływem wody
i temperatury rozkłada się na:
CH
3
CSNH
2
+ 2H
2
O CH
3
COO
-
+NH
4+
+ H
2
S

•Strącanie siarczków tej grupy
należy przeprowadzać w
środowisku słabo kwaśnym: ok. 0,3
M HCl, pH≤0,5
Większe stężenie kwasu może
spowodować niewytrącenie, lub też
nie całkowite wytrącanie siarczków
łatwiej rozpuszczalnych, np. CdS
Natomiast przy mniejszym stężenie
kwasu może się wytrącić z trzeciej
grupy ZnS

II grupę kationów można
podzielić na dwie podgrupy:
II A
obejmuje następujące kationy:
Hg
+2
, Bi
+3
, Cu
+2
, Pb
+2
, Cd
+2
Siarczki tych kationów posiadają
właściwości ZASADOWE, tzn.
nie rozpuszczają się ani w
zasadach ani
w dwusiarczku amonu- (NH
4
)
2
S
2

II B
obejmuje następujące kationy:
As
+3
, As
+5
, Sb
+3
, Sb
+5
, Sn
+2
,
Sn
+4
Siarczki tych kationów wykazują
charakter AMFOTERYCZNY
z przewagą własności kwasowych
(gł. arsenian i arsenin). Rozpuszczają
się i w kwasach i w zasadach
i dwusiarczku amonu z utworzeniem
siarkosoli.

Metody oddzielenia
podgrupy
II A od II B:
1.
Strącić siarczki
II grupy
odczynnikiem
grupowym(H
2
S),
a następnie dodać
(NH
4
)
2
S
2
wtedy:
Osad: siarczki II A
Roztwór: tiosole II B
2.
Strącić siarczki II grupy
odczynnikiem
grupowym(H
2
S),
a następnie dodać
KOH+H
2
O
2
wtedy:
Osad: siarczki II A
Roztwór: tio i tlenosole II B

Wykrywanie jonu:
Hg
+2
Hg
+2
+ H
2
S
HgS + 2 H
+
czarny osad
3HgS + 12Cl
-
+ 2NO
3-
+ 8H
+
3HgCl
4-2
+ 2NO + 4H
2
O + 3S
o
HgS NIE rozpuszcza się w rozcieńczonym H
2
SO
4
, HCl,
gorącym HNO
3
oraz siarczku i wielosiarczku amonu.
Reakcja charakterystyczna z amoniakiem:
Hg
+2
+ 2Cl
-
+ 2(NH
3
*H
2
O) HgNH
2
Cl +
NH
4+
+ Cl
-
+ 2H
2
O
biały
osad
Z jodkiem potasu KI:
Hg
+2
+ 2I
-
HgI
2
czerwony osad
HgI
2
+ 2I
-
HgI
4-2
Wykrywanie jonu:
Cu
+2
Cu
+2
+ H
2
S
CuS + 2 H
+
czarny osad
3 CuS + 2NO
3-
+ 8H
+
3 Cu
+2
+ 3S
o
+
+ 2NO + 4H
2
O
CuS NIE rozpuszcza się zarówno w rozcieńczonych kwasach
mineralnych, jak i w siarczkach alkalicznych, lecz rozpuszcza się
w gorącym HNO
3.
Reakcje charakterystyczne z jodkiem potasu KI:
Cu
+2
+ 2I
-
CuI
2
czarny osad widoczny w stęż.
roztworach
2
CuI
2
Cu
2
I
2
+ I
2
biały
osad
+
brunatne
zabarwienie od jodu
Z cyjanożelazinem potasowym K
4
[Fe(CN
6
)]
2Cu
+2
+ Fe(CN
6
)
-4
Cu
2
[Fe(CN
6
)]
czerwonobrunatny osad

Wykrywanie jonu:
Bi
+3
2Bi
+3
+ H
2
S Bi
3
S
3
+ 6H
+
ciemnobrunatny
Bi
3
S
3
+2NO
3-
+ 8H
+
2Bi
+3
+ 3S
o
+
+ 2NO + 4H
2
O
Bi
3
S
3
NIE rozpuszcza się w rozcieńczonych kwasach na zimno,
w siarczkach amonu i metali alkalicznych. Natomiast rozpuszcza
się
w gorącym rozcieńczonym HNO
3
i w gorącym stężonym HCl
.
Reakcje charakterystyczne z
KOH, NaOH i NH
3
*H
2
O
:
Bi
+3
+ 3 OH
-
Bi(OH)
3
biały osad
Z cyninen sodowym Na[Sn(OH)
3
]:
2Bi
+3
+ 3Sn(OH)
33-
+ 9OH
-
2Bi
o
+ 3Sn(OH)
6-
czarny osad
Wykrywanie jonu:
Pb
+2
Pb
+2
+ S
-2
PbS
czarny osad
3 PbS + 2NO
3-
+ 8H
+
3 Pb
+2
+ 2NO
+ 4H
2
O + 3S
o
Reakcje charakterystyczne:
z kwasem siarkowym H
2
SO
4
:
Pb
+2
+ SO
4-2
PbSO
4
biały osad
Z chromianem i dichromianem potasowym
(K
2
CrO
4
, K
2
Cr
2
O
7
):
Pb
+2
+ CrO
4-2
PbCrO
4
żółty osad
2 Pb
+2
+
Cr
2
O
7-2
+ H
2
O PbCrO
4
+ 2H
+
cd. reakcji
charakterystycznych dla
ołowiu:
Z jodkiem potasu KI:
Pb
+2
+ 2I
-
PbI
2
żółty osad
, który jest rozpuszczalny
w nadmiarze odczynnika
PbI
2
+ 2I
-
PbI
4-2
Z wodorotlenkiem sodowym i potasowym KOH i NaOH:
Pb
+2
+ 2OH
-
Pb(OH)
2
biały osad
wodorotlenku ołowiawego (amfoterycznego
)
Pb(OH)
2
+ 2OH
-
Pb(OH)
4-2
Pb(OH)
2
+ 2H
+
Pb
+2
+ 2H
2
O

Wykrywanie jonu:
As
+3
(AsO
3
-3
)
As
2
O
3
+ 6 OH
-
2 AsO
3-3
+ 3 H
2
O
As
2
O
3
+ 6 HCl 2AsCl
3
+ 3H
2
O
•
2AsCl
3
+ 3S
-2
As
2
S
3
+ 6Cl
-
żółty osad
As
2
S
3
nie rozpuszcza się w stęż. gorącym kwasie solnym,
natomiast rozpuszcza się w:
•
W gorącym stężonym HNO
3
, przy czym powstaje
kwas arsenowy H
3
AsO
4
:
3As
2
S
3
+ 28 NO
3-
+ 4H
2
O + 4H
+
6
H
2
AsO
4-
+ 9 SO
4-2
+ 28 NO
•
W wodorotlenku potasowym i sodowym:
As
2
S
3
+ 6 OH
-
AsO
3-3
+ AsS
3-3
+ 3H
2
O
arseniny i siarkoarseniny

Reakcje charakterystyczne
wykrywania jonu jonów
arseninowych:
Z wodnym roztworem jodu:
AsO
3-3
+ I
2o
+ H
2
O AsO
4-3
+ 2I
-
+ 2H
+
odbarwienie roztworu
By zapobiec odwracalności reakcji dodaje się NaHCO
3
, który wiąże jony wodorowe
Z roztworem azotanu srebra AgNO
3
:
AsO
3-3
+ 3Ag
+
Ag
3
AsO
3
żółty osad

Wykrywanie jonu:
As
+5
(AsO
4
-3
)
2AsO
4-3
+ 5H
2
S + 6H
+
As
2
S
5
+ 8 H
2
O
jasnożółty
Rozpuszcza się w stęż. HNO
3
:
•
As
2
S
5
+ 40 NO
3-
+ 4H
2
O 6AsO
4-3
+15 SO
4-2
+ 8 H
+
+ 40 NO
Oraz w NaOH, KOH i NH
3
*H
2
O, przy czym tworzą się
siarkoarseniany i tlenosiarkoarseniany:
•
As
2
S
5
+ 6 OH
-
AsS
4-3
+ AsO
3
S
-3
+
3H
2
O

Reakcje charakterystyczne
wykrywania jonu jonów
arsenianowych:
Z azotanem srebra AgNO
3
:
AsO
4-3
+ 3Ag
+
Ag
3
AsO
4
czekoladowobrunatny
Z mieszaniną magnezową (MgCl2+NH
3
*H
2
O+NH
4
Cl):
AsO
4-3
+ Mg
+2
+ NH
4+
MgNH
4
AsO
4
biały osad
Z molibdenianem amonu (NH
4
)
2
MoO
4
:
AsO
4-3
+ 3 NH
4+
+ 12 MoO
4-2
(NH
4
)
3
As(Mo
3
O
10
)
4
+12 H
2
O
żółty osad
arsenomolibdenianu amonowego
(jony arseninowe nie dadzą tej reakcji)
Jakiego koloru siarczek
powstanie w reakcji:
a)
Żółty

Jak nazwiesz związki:
1.
MgNH
4
AsO
4
Arsenian amonowo magnezowy
2. (NH
4
)
3
As(Mo
3
O
10
)
4
Arsenomolibdenian amonowy
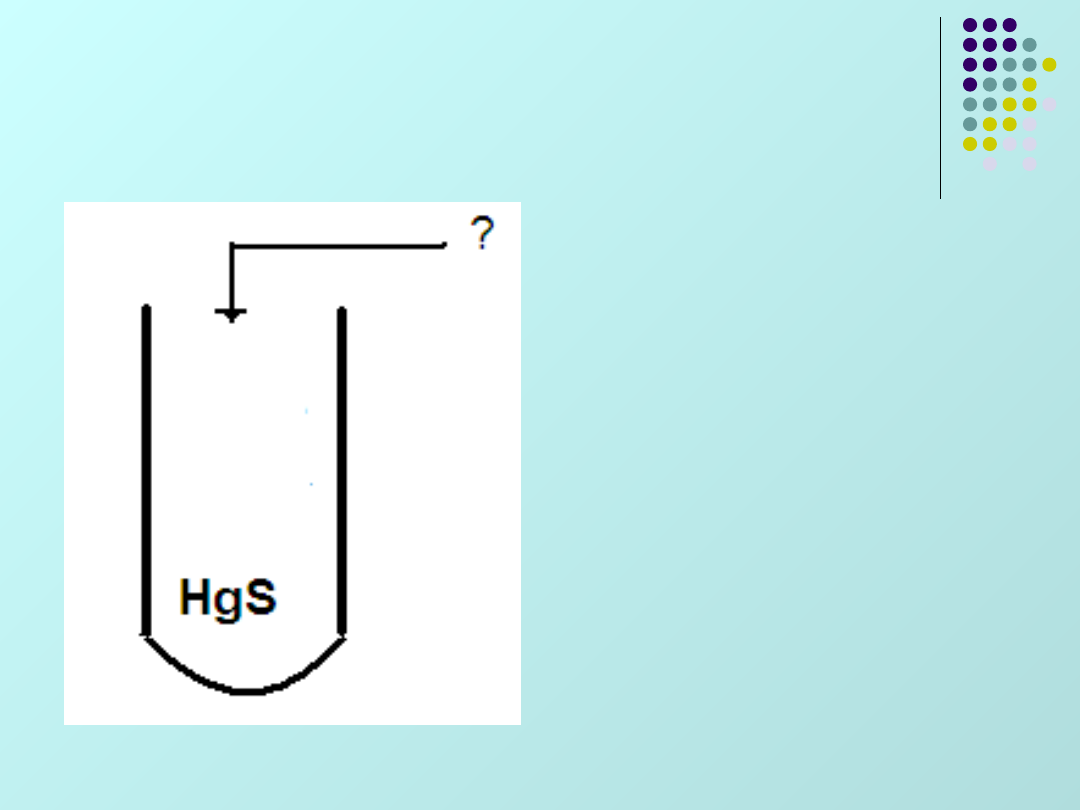
W czym rozpuści się
siarczek rtęci?
W wodzie
królewskiej

Czy siarczek bizmutu
rozpuści się w gorącym i
stężonym kwasie solnym ?
TAK
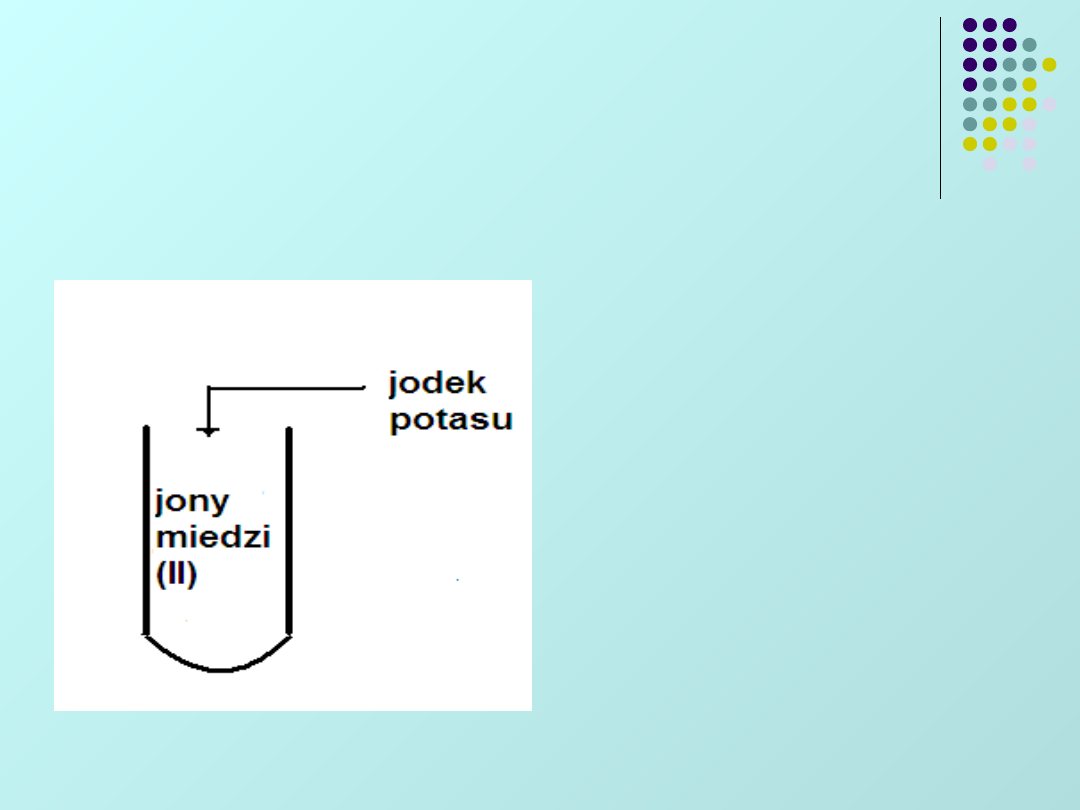
Jakie będą końcowe
produkty poniższej reakcji
(podaj pełne wzory, nazwy i
kolory):
Powstanie
biały osad
jodku
miedziawego:
Cu
2
I
2
oraz wydziela
się wolny jod: I
2
,
który zabarwia
roztwór na kolor
brunatny
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
analiza kationów II gr (2)
testy, s-u¬ba II gr.II, Test egzaminacyjny z prawa służby cywilnej
testy, s-u¬ba II gr.II, Test egzaminacyjny z prawa służby cywilnej
II gr wiekowa 2008
II gr wiekowa 2008id 26418
kolos II gr TP, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, materiały budowlan
Farmacja II gr I
II GRUPA KATIONÓW
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
Pytania na kolosa z II grupy kationów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, 2 grupa kati
II gr 06
Kolokwium 1 2012 13 (poprawa II, gr B)
chemia II gr
II gr 06id 25426
odp na pytanie 1 z II gr
odp na pytanie 1 z II gr
więcej podobnych podstron