
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 2
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
1
Ćwiczenie 2
Temat: WŁAŚCIWOŚCI FIZYKO-CHEMICZNE BIAŁEK. FRAKCJONOWANIE
BIAŁEK.
Część teoretyczna
Białka są to związki wysokocząsteczkowe, powstałe w wyniku połączenia szeregu amino-
kwasów wiązaniem peptydowym w długi łańcuch polipeptydowy. Ilość, rodzaj i kolejność amino-
kwasów w tym łańcuchu określane bywają mianem pierwotnej struktury białka (struktura I-
rzędowa). Termin wtórna struktura białka dotyczy sposobu i stopnia zwinięcia łańcucha polipepty-
dowego (struktura II-rzędowa) oraz kształtu przestrzennego cząsteczki białka, który utrwalony jest
przez szereg różnego typu wiązań (struktura III-rzędowa). Charakterystyczna dla niektórych białek
struktura IV- rzędowa określa stopień asocjacji lub polimeryzacji cząsteczek białka w większe
agregaty. Utrwalona jest ona przez wiązania dwusiarczkowe i inne.
Białka mają charakter koloidu hydrofilnego. Dzięki posiadanemu ładunkowi elektrycznemu
w roztworze wodnym ich cząsteczki otoczone są "płaszczem wodnym". Pod wpływem różnych
czynników (wysalanie, pozbawienie ładunku, zmiany struktury wtórnej) obecne w roztworze białka
mogą ulec wytrąceniu czyli koagulacji. Jest to częsty sposób usuwania czy wyosabniania białka.
Funkcjonalne właściwości białek, ważne w technologii żywności wynikają właśnie z oddziaływań z
wodą, a także z oddziaływań z jonami, innymi białkami, sacharydami oraz lipidami i odgrywają
szczególna rolę na granicach faz. Najważniejsze funkcjonalne cechy białek przejawiają się w zwil-
żaniu się, pęcznieniu, rehydratacji, utrzymywaniu wody, rozpuszczalności, lepkości, żelowaniu,
pienieniu się, tworzeniu włókien, błon i emulsji.
Proces denaturacji rozumiany jest jako zniszczenie wtórnej struktury białka. Następuje ono
pod wpływem podwyższonej temperatury, ekstremalnych wartości pH, soli metali ciężkich itp. De-
naturacji towarzyszą zmiany we właściwościach fizyko-chemicznych białka. Zmiany te są zwykle
nieodwracalne. Denaturacja cieplna na ogół zwiększa strawność białka. Ponadto ogrzewanie w od-
powiednich warunkach unieczynnia białkowe składniki przeciwżywieniowe wielu surowców, m. in.
inhibitory proteaz. Jednak nadmierne ogrzewanie produktów bogatych w białko może powodować
zmniejszenie biologicznej dostępności wielu aminokwasów, przede wszystkim wskutek utrudnienia
trawienia. Szczególnie wrażliwe na ogrzewanie są cysteina, lizyna, metionina, tryptofan, arginina i
leucyna.
Klasyfikację białek oprzeć można na różnych kryteriach, jak: obecność i rodzaj składnika
niebiałkowego, kształt cząsteczki, rozpuszczalność w wodzie i roztworach soli itp.
Szerzej potraktowane wiadomości na powyższe tematy można znaleźć w każdym akademic-
kim podręczniku biochemii i chemii żywności.
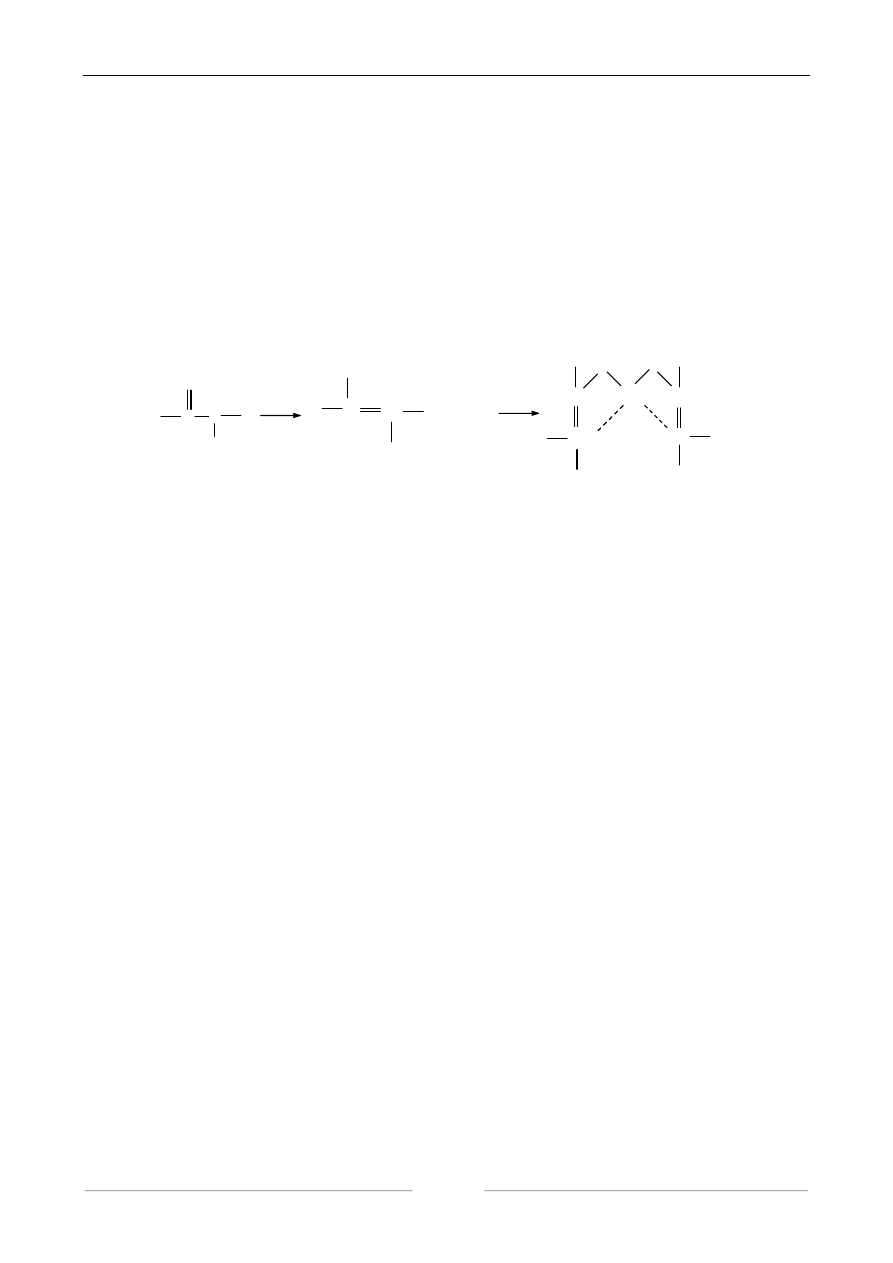
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 2
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
2
Część praktyczna
A) WŁAŚCIWOŚCI FIZYKO-CHEMICZNE BIAŁEK
1. WYKRYWANIE WIĄZANIA PEPTYDOWEGO - REAKCJA BIURETOWA
W środowisku zasadowym wiązanie peptydowe łatwo przechodzi w formę enolową. Jon Cu
++
łączy się w tych warunkach wiązaniami głównymi z grupami karboksylowymi, zaś wiązaniami ko-
ordynacyjnymi z azotem. Powstaje kompleks o barwie fioletowej. Nazwa tej reakcji pochodzi od
biuretu (produkt kondensacji dwóch cząsteczek mocznika), który posiada wiązanie -CO-NH- i two-
rzy również z miedzią fioletowy kompleks.
fioletowy kompleks
Wykonanie:
Do dwóch suchych probówek wsypać po ok. 0,2 g mocznika. Jedną probówkę ogrzać nad
palnikiem aż do momentu stopienia mocznika i wydzielenia amoniaku (powstaje biuret). Po ostu-
dzeniu do obu probówek dodać po 2 ml wody. Do trzeciej probówki odmierzyć 2 ml roztworu kaze-
iny.
Do wszystkich trzech probówek dodać 2 ml 10% NaOH i 3-4 krople 1% roztworu CuSO
4
. W
obecności wiązań peptydowych (peptydy, białka) pojawia się zabarwienie od różowego do fioleto-
wego.
2. WPŁYW pH NA ROZPUSZCZALNOŚĆ BIAŁKA - WYZNACZANIE PUNKTU
IZOELEKTRYCZNEGO KAZEINY.
Białka są jonami wielowartościowymi ze względu na obecność w nich licznych aminokwa-
sów zawierających dysocjujące grupy, nie biorące udziału w wiązaniach peptydowych. W zależno-
ści od rodzaju aminokwasów i pH środowiska, cząsteczka białka może być wielowartościowym ka-
tionem lub anionem, względnie przy jednakowej ilości ładunków dodatnich i ujemnych - elektrycz-
nie obojętna. Taka wartość pH przy której cząsteczka białka jest elektrycznie obojętna nazywa się
punktem izoelektrycznym. Ładunek elektryczny, którym obdarzone są cząsteczki białka, zapobiega
koagulacji. Jeżeli ładunek ten zostanie usunięty (co ma miejsce w punkcie izoelektrycznym) wów-
czas cząsteczki białka łączą się w większe skupiska (agregacja) i w konsekwencji mogą wypaść z
roztworu (koagulacja). Wpływ pH na rozpuszczalność białka wykorzystuje się w przemyśle spo-
żywczym, m.in. przy ekstrakcji białek z różnych surowców.
Wykonanie:
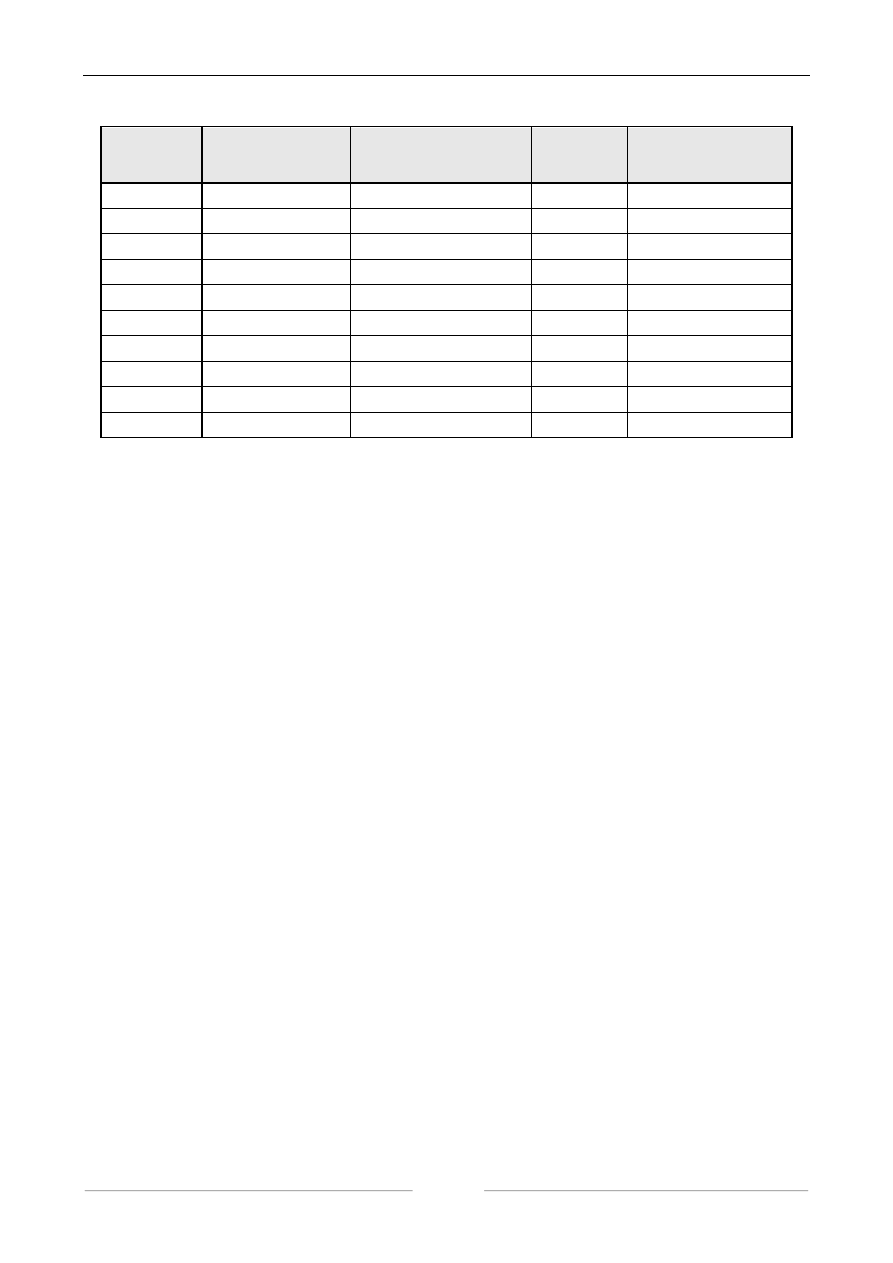
Przygotować 10 suchych probówek i sporządzić w nich roztwory o różnym pH, to znaczy roz-
lać 0,1 M kwas cytrynowy i 0,1 M cytrynian sodu zgodnie z poniższą tabelą i wymieszać. Do każ-
dej probówki dodać po 1 ml roztworu kazeiny (0,5% w 0,1 M cytrynianie sodu), wymieszać. Po 15
minutach obserwować stopień zmętnienia płynu w probówkach i ilość wytrąconego białka.
Wyniki zamieścić w tabeli (poniżej), wyciągnąć wnioski.
N
O
H
NaOH
N
C
+
O
_
H
C
+
Cu
++
C
N
H
+
O
C
N
+
H
O
Cu
2
2
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 2
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
3
nr.
probówki
ml
cytrynianu sodu
ml
kwasu cytrynowego
pH
zmętnienie / osad
1
0,6
4,4
3,6
2
1,0
4,0
3,8
3
1,3
3,7
4,0
4
1,5
3,5
4,2
5
1,7
3,3
4,4
6
1,9
3,1
4,6
7
2,2
2,8
4,8
8
2,5
2,5
5,0
9
2,7
2,3
5,2
10
3,0
2,0
5,4
3. WYTRĄCANIE BIAŁKA Z ROZTWORU I BADANIE JEGO AKTYWNOŚCI
BIOLOGICZNEJ.
Wytrącanie białka z roztworu może być spowodowane różnymi czynnikami chemicznymi lub
fizycznymi (podwyższona temperatura, zmiana pH, sole metali ciężkich, sole metali alkalicznych).
W zależności od rodzaju czynnika rozróżnia się wytrącanie związane z denaturacją i z wysalaniem.
Denaturację określa się jako przemianę związaną ze zniszczeniem wtórnej struktury białka, a więc
białko zdenaturowane traci swoją aktywność biologiczną. Denaturację powodują takie czynniki jak:
ogrzewanie, napromieniowanie, znaczne zmiany pH, duże stężenie soli metali ciężkich, długotrwałe
działanie alkoholem.
W przeciwieństwie do denaturacji, wysalanie jest procesem w pełni odwracalnym, gdyż doda-
tek odpowiedniej ilości wody powoduje ponowne rozpuszczenie wytrąconego białka. Wysalanie
przebiega pod działaniem wyższych stężeń soli metali alkalicznych lub soli amonowych. Białka
wytrącone tym sposobem zachowują w pełni swoje właściwości biologiczne.
Wykonanie:
Do 3 probówek wirówkowych odmierzyć po 1 ml roztworu białka enzymatycznego o aktyw-
ności amylolitycznej (Taka-diastaza), do pierwszej probówki dodać 4 ml 96% alkoholu, do drugiej
około 0,7 g (NH
4
)
2
SO
4
, do trzeciej kilka kropli AgNO
3
, zamieszać. Po 15 minutach osady odwiro-
wać, zlać supernatant, a osady dobrze rozpuścić w 1,5 ml wody. Osobno do 2 zwykłych probówek
odmierzyć po 1 ml Taka-diastazy, jedną z nich zagotować i po ostudzeniu do obu dodać po 1,5 ml
wody.
Przygotować 10 probówek z 2 ml I
2
w KI każda oraz 5 probówek z 5 ml roztworu skrobi. Do
pierwszej probówki ze skrobią dodać 1 ml białka enzymowego wytrącanego alkoholem (włączyć
stoper), do drugiej 1 ml białka wytrącanego (NH
4
)
2
SO
4
- 1 min., do trzeciej 1 ml białka wytrącane-
go AgNO
3
- 2 min., do czwartej 1 ml białka zagotowanego - 3 min., do piątej 1 ml białka nie pod-
danego wytrącaniu - 4 min. Po dodaniu białka probówki dobrze mieszać.
Po 5 min. od początku reakcji pobierać kolejno co 1 minutę z każdej probówki po 1 ml roz-
tworu skrobi i przenosić go do przygotowanych probówek z roztworem I
2
w KI (z pierwszej pro-
bówki w 5 i 15 min.). Obserwować zanik barwy z jodem, wyciągnąć wnioski.
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 2
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
4
B) FRAKCJONOWANIE BIAŁEK METODĄ ELEKTROFOREZY BIBUŁOWEJ.
Białka wykazują określony, wypadkowy ładunek elektryczny. Znak i wielkość tego ładunku
zależy od rodzaju i ilości dysocjujących grup w cząsteczce. Cząsteczki obdarzone ładunkiem mogą
wędrować w polu elektrycznym. Zjawisko to nosi nazwę elektroforezy. Elektroforeza jest bardzo
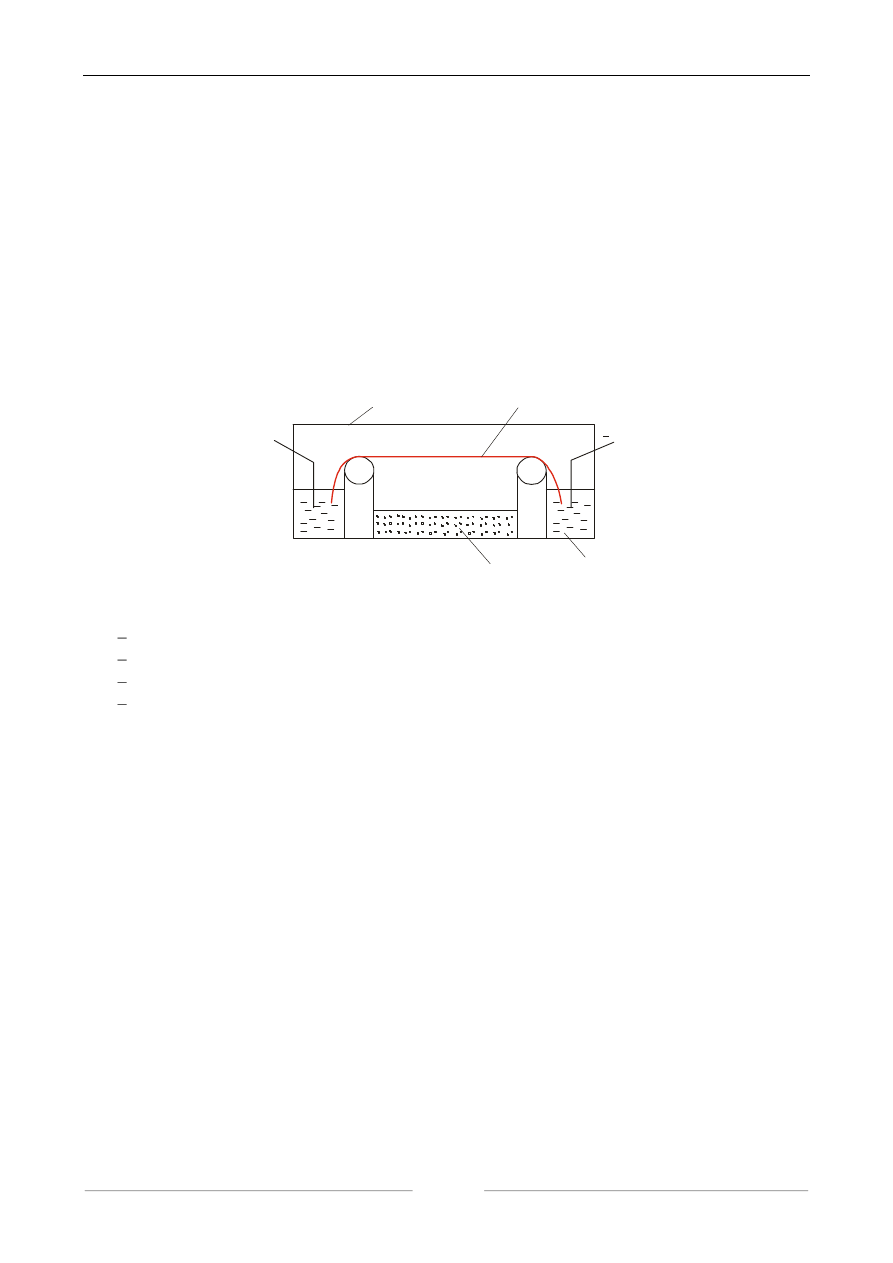
ważną i powszechnie stosowaną metodą rozdzielania i oczyszczania białek. W elektroforezie bibu-
łowej nośnikiem jest pasek bibuły chromatograficznej zwilżony odpowiednim buforem i zanurzony
dwoma końcami w wanienkach wypełnionych buforem i zaopatrzonych w elektrody. Naładowane
cząsteczki wędrują wzdłuż bibuły z prędkością zależną od ładunku, masy i kształtu cząsteczki, pH,
rodzaju buforu, napięcia i natężenia przepływającego prądu oraz innych czynników. Budowę apara-
tu do elektroforezy bibułowej przedstawia schematycznie poniższy rysunek.
+
komora
bibuła
katoda
anoda
woda
bufor
Odczynniki:
białko jaja rozcieńczone 1:3 buforem o pH 3,0 lub 3% roztwór albuminy w buforze o pH 3,0
bufor cytrynianowo-fosforanowy (Mc Ilvaine’a) 0,1 M o pH 3,0
0,1% roztwór błękitu bromofenolowego w metanolowym roztworze HgCl
2
0,5% kwas octowy
Wykonanie:
Z bibuły Whatman 1 wyciąć paski o wymiarach 33 x 4 cm, zaznaczyć linię środkową oraz
znaki "+" i "-" i założyć ciężarki na końcach pasków. Zwilżyć cały pasek buforem o pH 3,0 i umie-
ścić w aparacie do elektroforezy. Przy pomocy pręcików szklanych delikatnie ułożyć pasek bibuły
w prawidłowym położeniu tj. prostopadle do ramy podtrzymującej paski, przestrzegając, aby środ-
kowa linia na pasku była jednakowo odległa od poziomu buforu w obu komorach elektrodowych.
Przy pomocy mikropipetki nanieść na środek paska, pasmowo, niewielką ilość roztworu białka.
Zamknąć komorę i włączyć prąd (300 V). Po 2,5 godz. aparat wyłączyć, paski wyjąć, obsuszyć przy
pomocy arkusza bibuły i wywołać w roztworze błękitu bromofenolowego. Następnie przepłukać je
kilka razy w 0,5% kwasie octowym w celu odbarwienia miejsc wolnych od białek. Wysuszyć paski
i ewentualnie przeciągnąć nad stężonym NH
3
dla utrwalenia barwy. Określić charakter elektrokine-
tyczny rozdzielonych frakcji.
Ostatnie zmiany: 13.02.2013
Wyszukiwarka
Podobne podstrony:
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
Potwierdzenie właściwości fizycznych i chemicznych białek
Biochemia(ZCz)Cw5 Wlasciwosci f Nieznany
Właściwości fizykochemiczne białek
Chemia żywnosci Cwiczenie laboratoryjne nr 1 wyodrebnianie i badanie własciwosci fizykochemicznych b
Sprawozdanie Właściwości fizykochemiczne białek
Badanie właściwości chemicznych białek
Właściwości fizykochemiczne białek, Właściwości fizykochemiczne białek - opis do slajdów, Właściwośc
Właściwości fizykochemiczne białek
Budowa Chemiczna Białek
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
Wykład 1 WŁAŚCIWOŚCI FIZYKOCHEMICZNE SUBSTANCJI TOKSYCZNEJ
Badania wybranych właściwości fizycznych i chemicznych wapna palonego
więcej podobnych podstron