
TECHNOLOGIA NIEORGANICZNA
Przemysł azotowy
Synteza amoniaku
dr inż. Maria Pertkiewicz-Piszcz
telefon służbowy 0583471365
telefon komórkowy 501198252

Przemysł azotowy
przemysł azotowy jest jednym z najważniejszych działów przemysłu
chemicznego
główne produkty przemysłu azotowego : kwas azotowy, azotany
i mocznik otrzymuje się na drodze pośredniej przez syntezę amoniaku
przemysł azotowy jest głównie przemysłem nawozów azotowych
do najważniejszych związków azotowych stosowanych w technice należą
materiały wybuchowe oraz nitrozwiązki i azotany organiczne
światowa roczna produkcja amoniaku kształtuje się na poziomie
120 milionów ton (rok 2006)
największym producentem są Chiny (32 % światowej produkcji
amoniaku), następnie Indie (8,9 %), Rosja (8,2 %) i Stany Zjednoczone
(6,5 %)
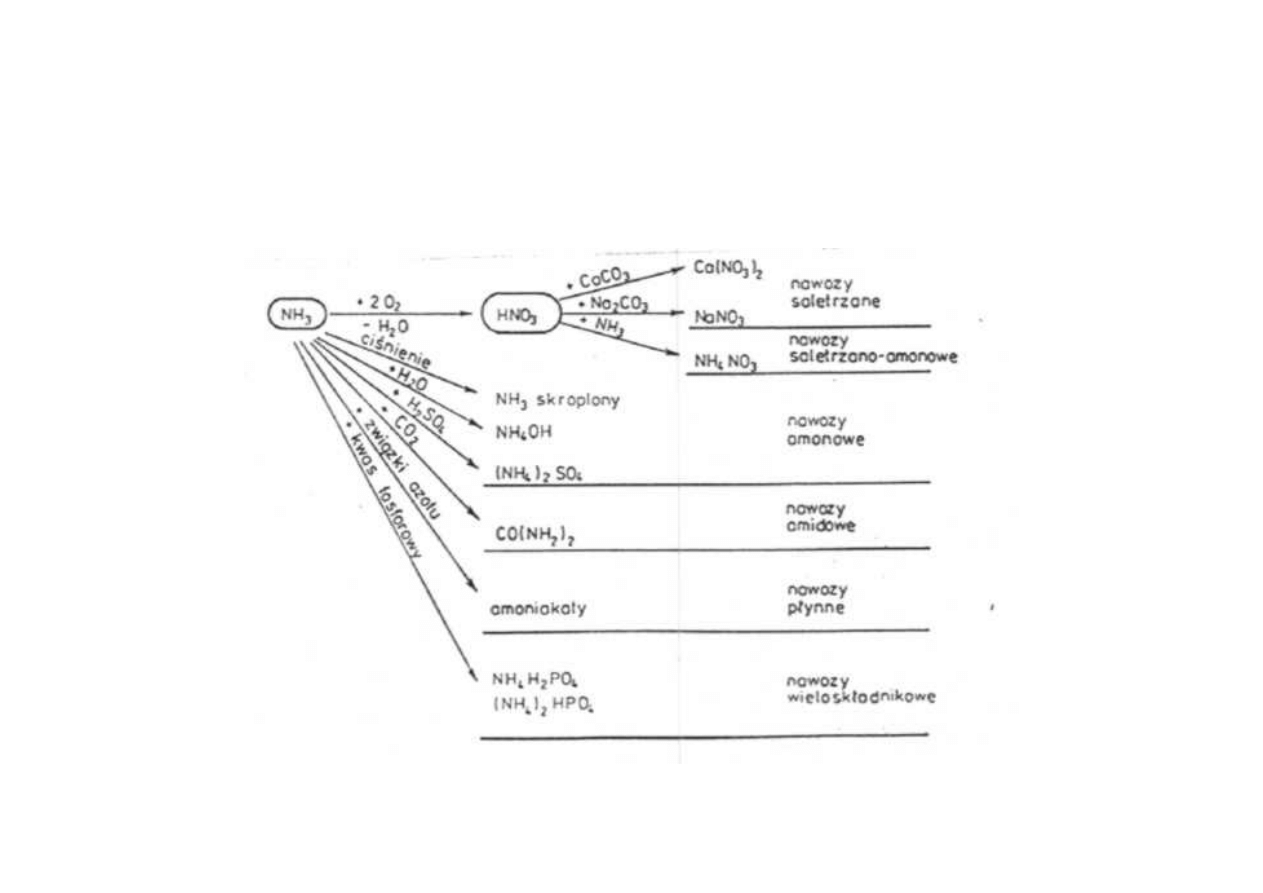
Produkcja związków azotowych z amoniaku

Synteza amoniaku
bezpośrednią syntezę amoniaku z pierwiastków zrealizowali
Haber i Bosch
pierwszą przemysłową instalację do syntezy amoniaku uruchomiono
w 1913 roku w zakładach BASF w Oppau (Niemcy)
instalacja ta miała zdolność produkcyjną 30 ton amoniaku na dobę;
obecnie nowoczesne reaktory mają zdolność produkcyjną 1000 – 2000
ton / dobę (np. w wytwórniach we Włocławku, Policach i Kędzierzynie)
wysokociśnieniowy konwertor do syntezy amoniaku ma średnicę
wewnętrzną 1100 mm i długość 20 m; może pomieścić ponad 4 m
3
katalizatora
blok stali (tzw. wlewek) do wykonania takiego naczynia ciśnieniowego
waży 100 ton, a gotowe naczynie – 50 ton
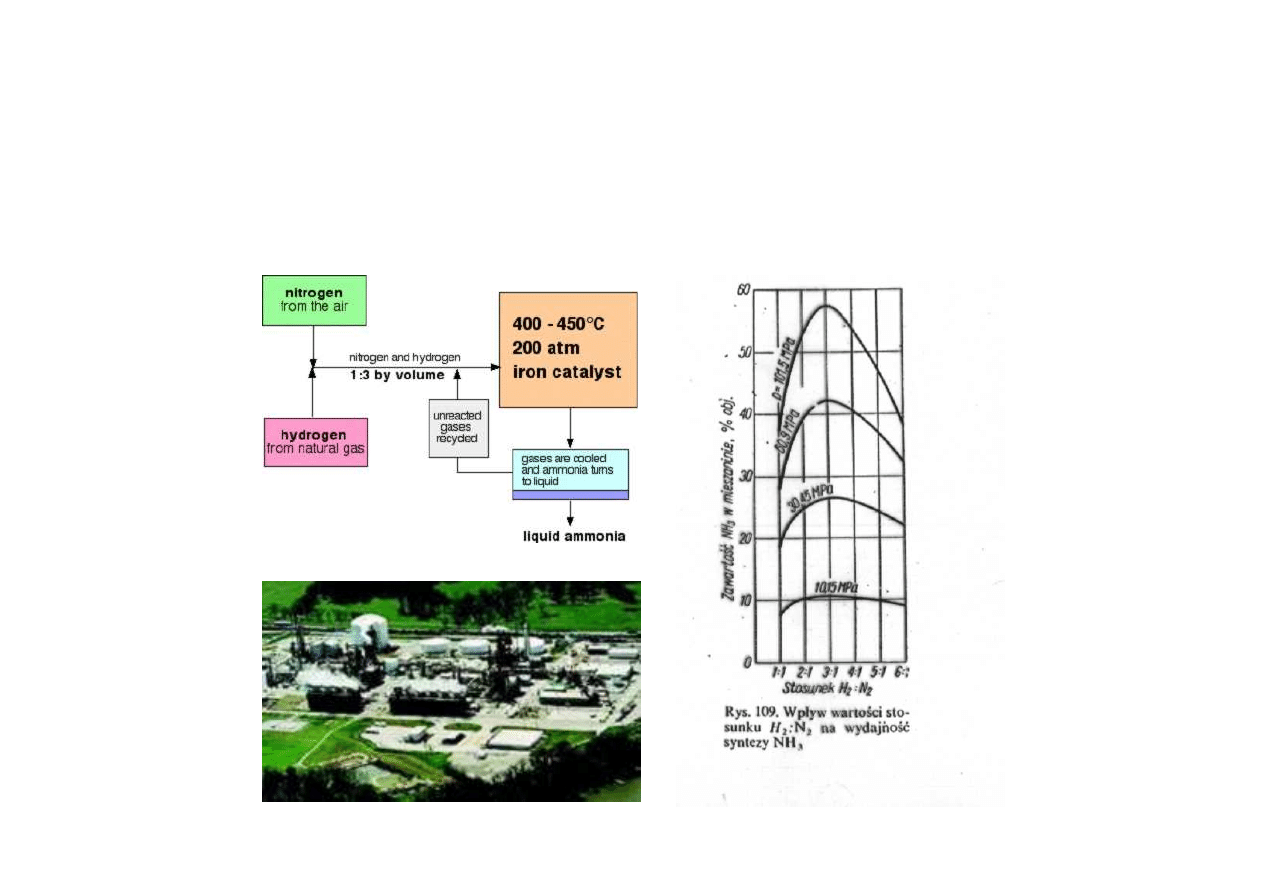
Synteza amoniaku
N
2
+ 3 H
2
↔ NH
3
∆ H = - 94 kJ/mol

Synteza amoniaku
reakcja syntezy amoniaku z pierwiastków jest reakcją egzotermiczną
przebiegającą ze zmniejszeniem objętości
wynika z tego , że niska temperatura i wysokie ciśnienie sprzyjają
przebiegowi reakcji w kierunku tworzenia amoniaku
reakcja syntezy amoniaku w zakresie stosowanych obecnie ciśnień
i temperatur biegnie jedynie w obecności katalizatorów
wartość stałej równowagi zależy nie tylko od temperatury, lecz również
od ciśnienia, co wynika z faktu, że wodór i azot pod wysokimi ciśnieniami
nie zachowują się jak gaz doskonały
w przypadku obliczeń procesów wysokociśnieniowych korzysta się
z empirycznych równań stanu gazowego lub ze zmodyfikowanego równania
stanu gazowego
pV = c RT
c – empiryczny współczynnik ściśliwości
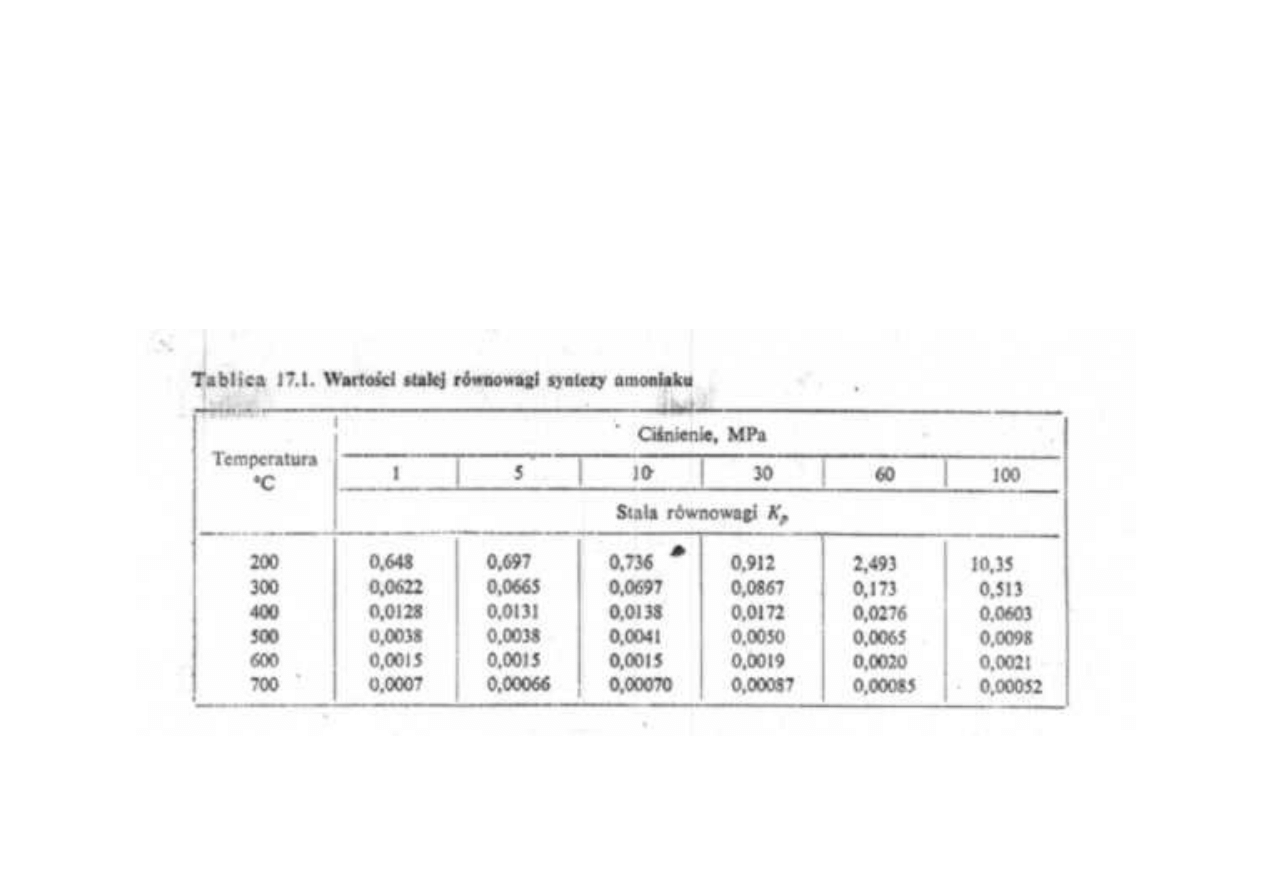
Synteza amoniaku
Wartości stałej równowagi syntezy amoniaku
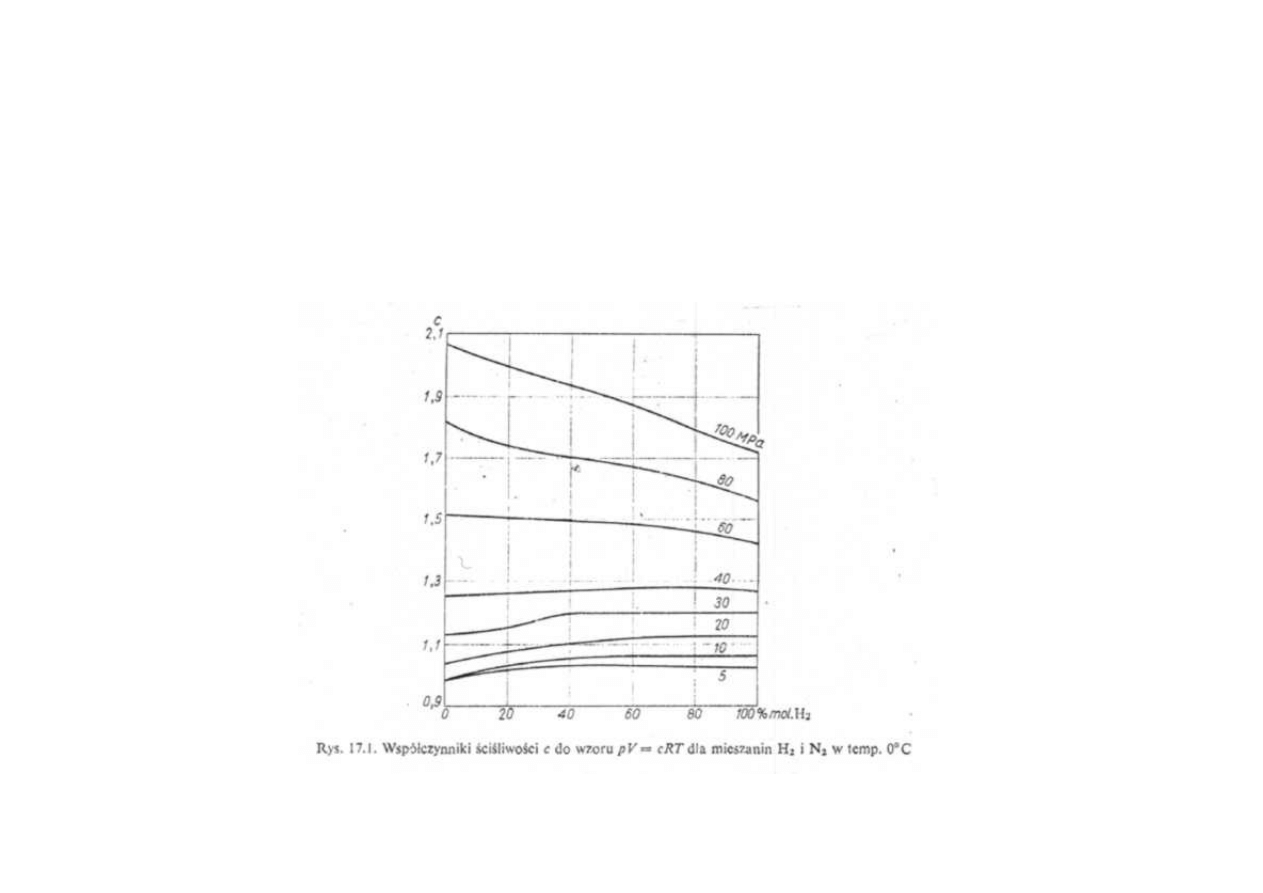
Synteza amoniaku
Współczynniki ściśliwości c do wzoru pV = c RT
dla mieszanin H
2i
i N
2
w temperaturze 0
o
C
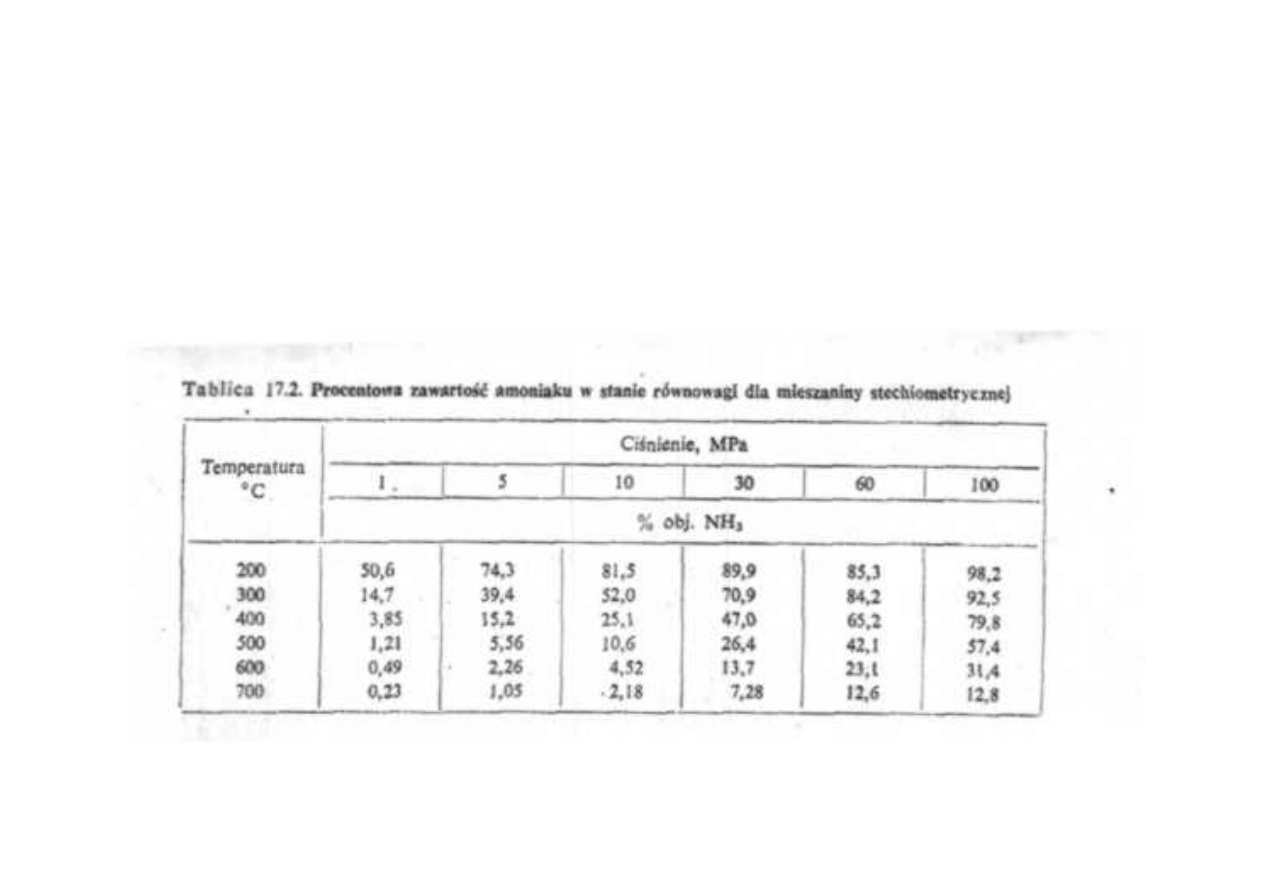
Synteza amoniaku
Procentowa zawartość amoniaku w stanie równowagi
dla mieszaniny stechiometrycznej
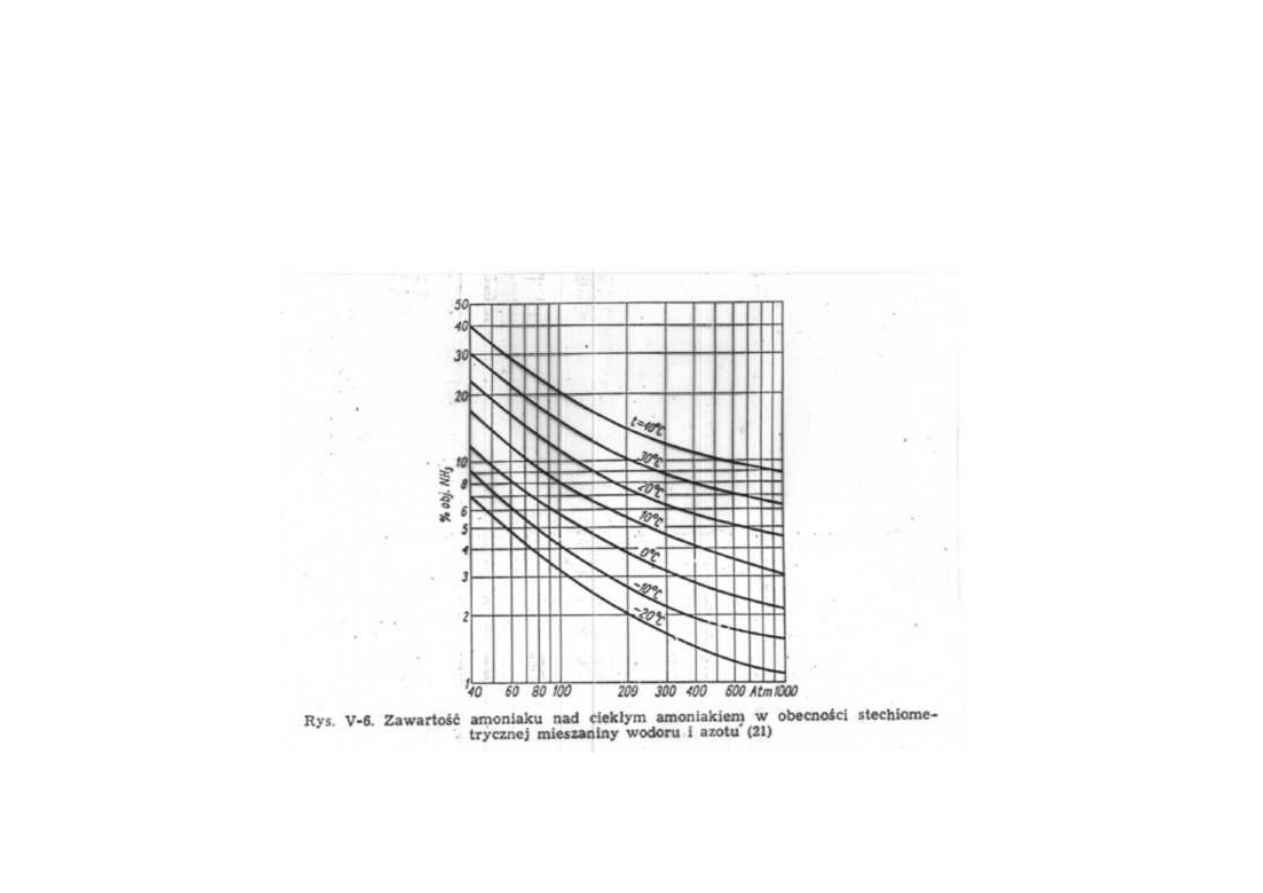
Synteza amoniaku
Zawartość amoniaku nad ciekłym amoniakiem
w obecności stechiometrycznej mieszaniny wodoru i azotu
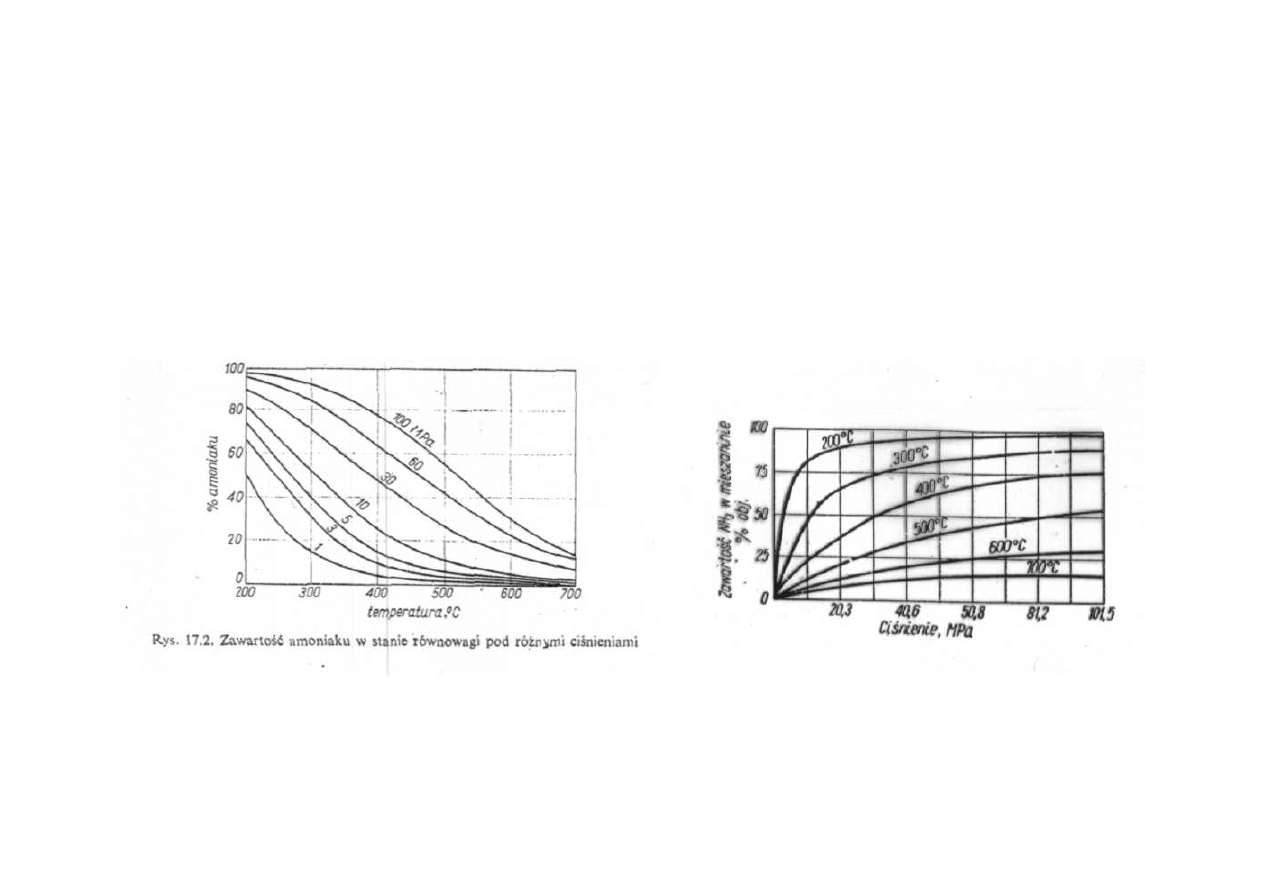
Synteza amoniaku
Zawartość amoniaku w stanie równowagi w różnych temperaturach
i pod różnymi ciśnieniami
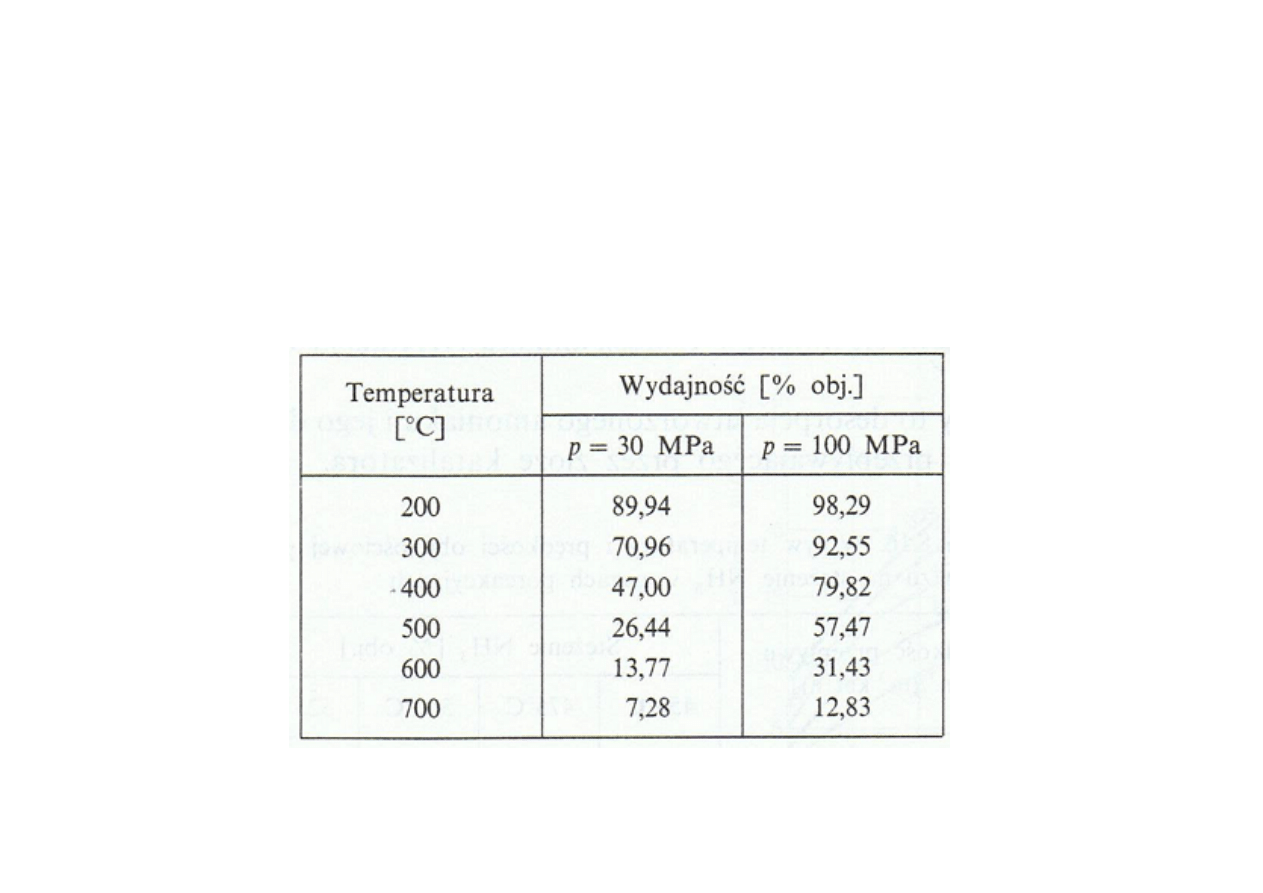
Synteza amoniaku
Wpływ temperatury i ciśnienia na wydajność reakcji syntezy NH
3

Synteza amoniaku
szybkość reakcji w danej temperaturze zależy od procesów dyfuzyjnych,
a te z kolei od prędkości przepływu gazu przez warstwę katalizatora
zwiększenie prędkości objętościowej pozwala zwiększyć ilość
uzyskiwanego amoniaku w jednostce czasu z jednostki objętości
katalizatora, a tym samym zwiększyć produkcyjność
zwiększenie prędkości przepływu zwiększa koszty transportu gazu
zmniejszenie stężenia amoniaku w jednostce objętości gazu zmniejsza ilość
ciepła wydzielonego na jednostkę objętości gazu w egzotermicznej reakcji
syntezy amoniaku
przy pewnej prędkości ciepło reakcji może nie wystarczyć do ogrzania
gazów kierowanych do reakcji i wówczas nie zostanie zachowany warunek
autotermiczności procesu
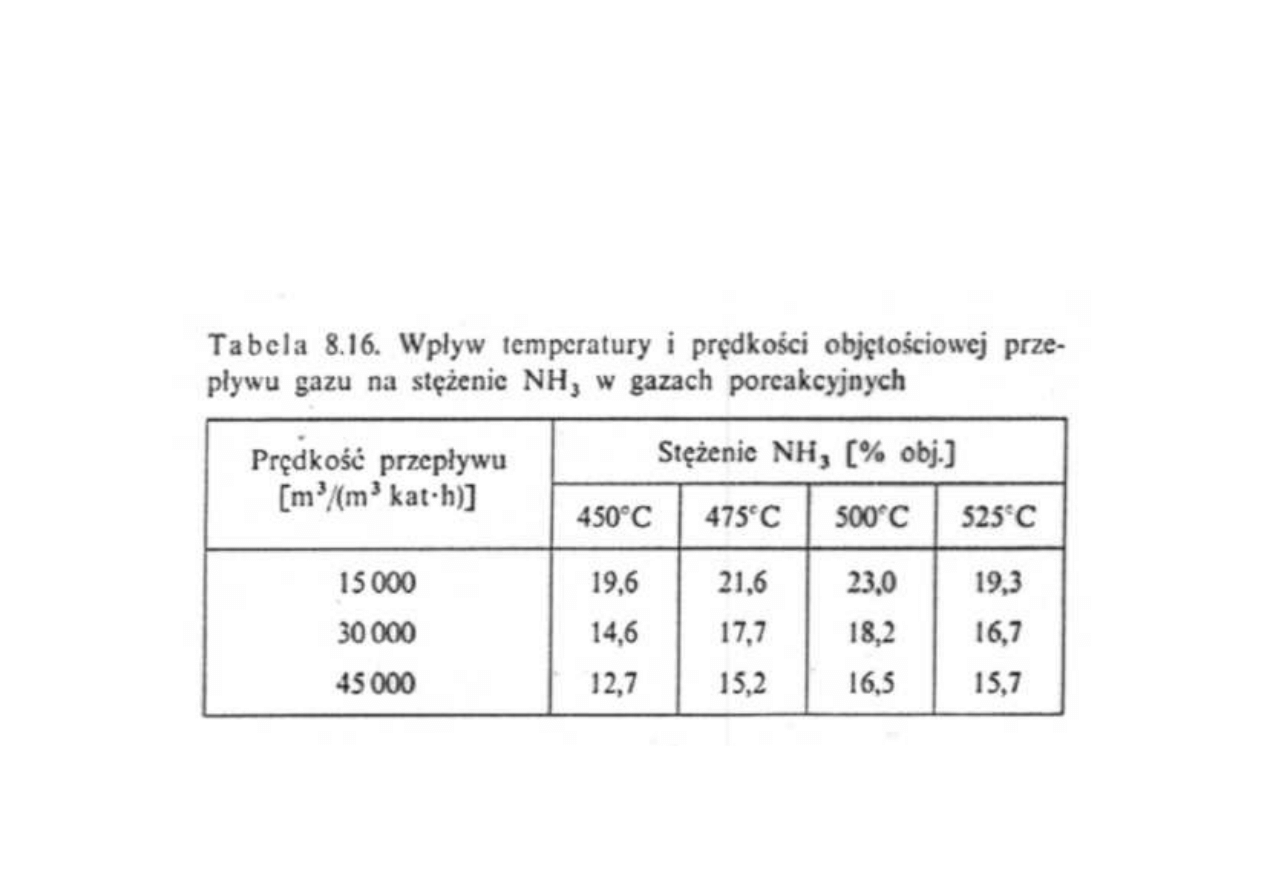
Synteza amoniaku
Wpływ temperatury i prędkości objętościowej przepływu gazu
na stężenie NH
3
w gazach poreakcyjnych
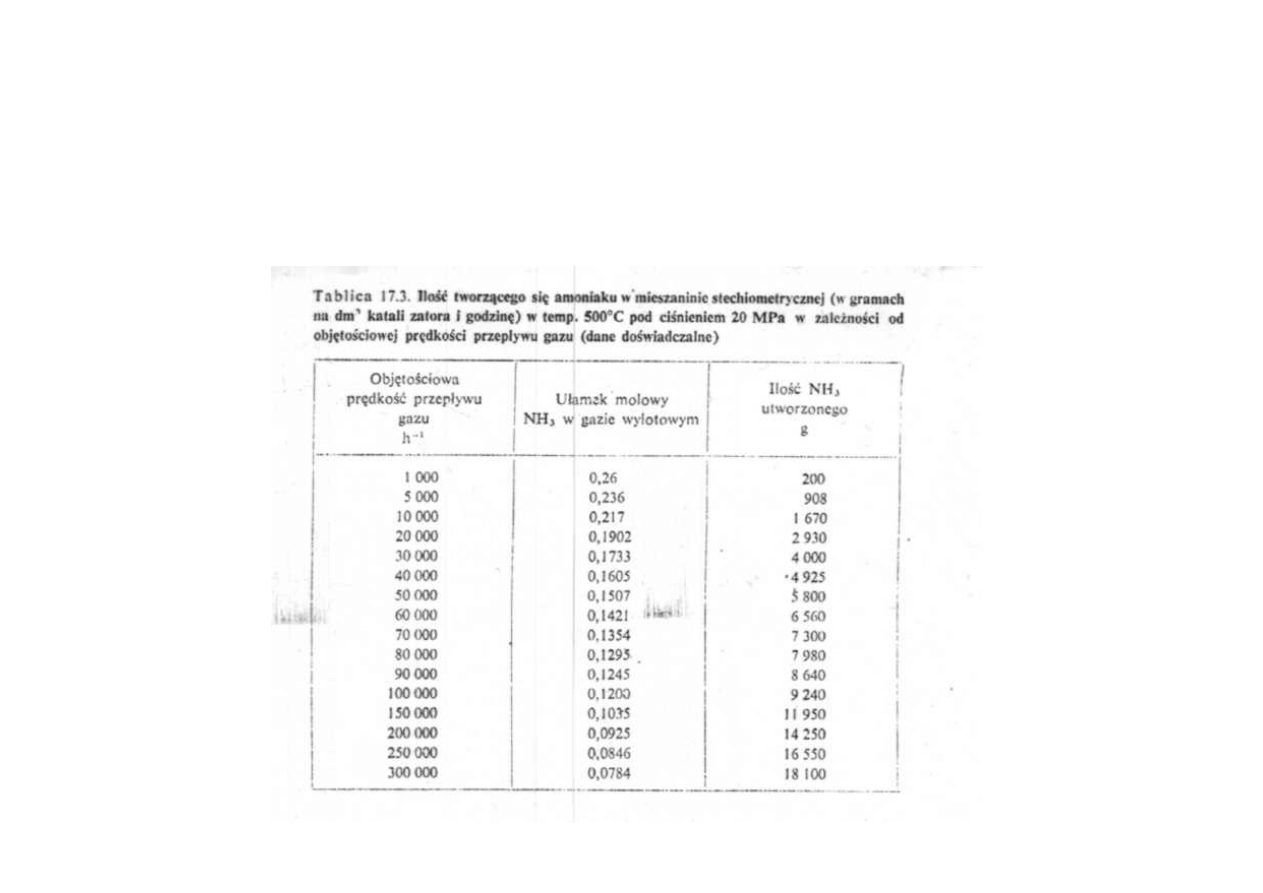
Synteza amoniaku
Ilość tworzącego się amoniaku w mieszaninie stechiometrycznej (w gramach
na dm
3
katalizatora i godzinę) w temperaturze 500
o
C pod ciśnieniem 20 MPa
w zależności od objętościowej prędkości przepływu gazu

Synteza amoniaku
każdej prędkości przepływu odpowiada optymalna temperatura ,
w której stężenie amoniaku w gazie osiąga największą wartość
utrzymanie optymalnych warunków przebiegu procesu wymaga obniżania
temperatury w miarę przebiegu reakcji
uzyskiwana wydajność jest tym bliższa wydajności równowagowej,
im wyższa jest temperatura i mniejsza prędkość przepływu gazu, czyli
im dłuższy jest czas zetknięcia reagujących gazów z katalizatorem
wzrost ciśnienia początkowo powoduje wyraźne zwiększenie ilości
otrzymanego amoniaku przy danej prędkości objętościowej przepływu
gazu, następnie wpływ ciśnienia jest coraz mniejszy, a coraz większe
odchylenia od wydajności równowagowej
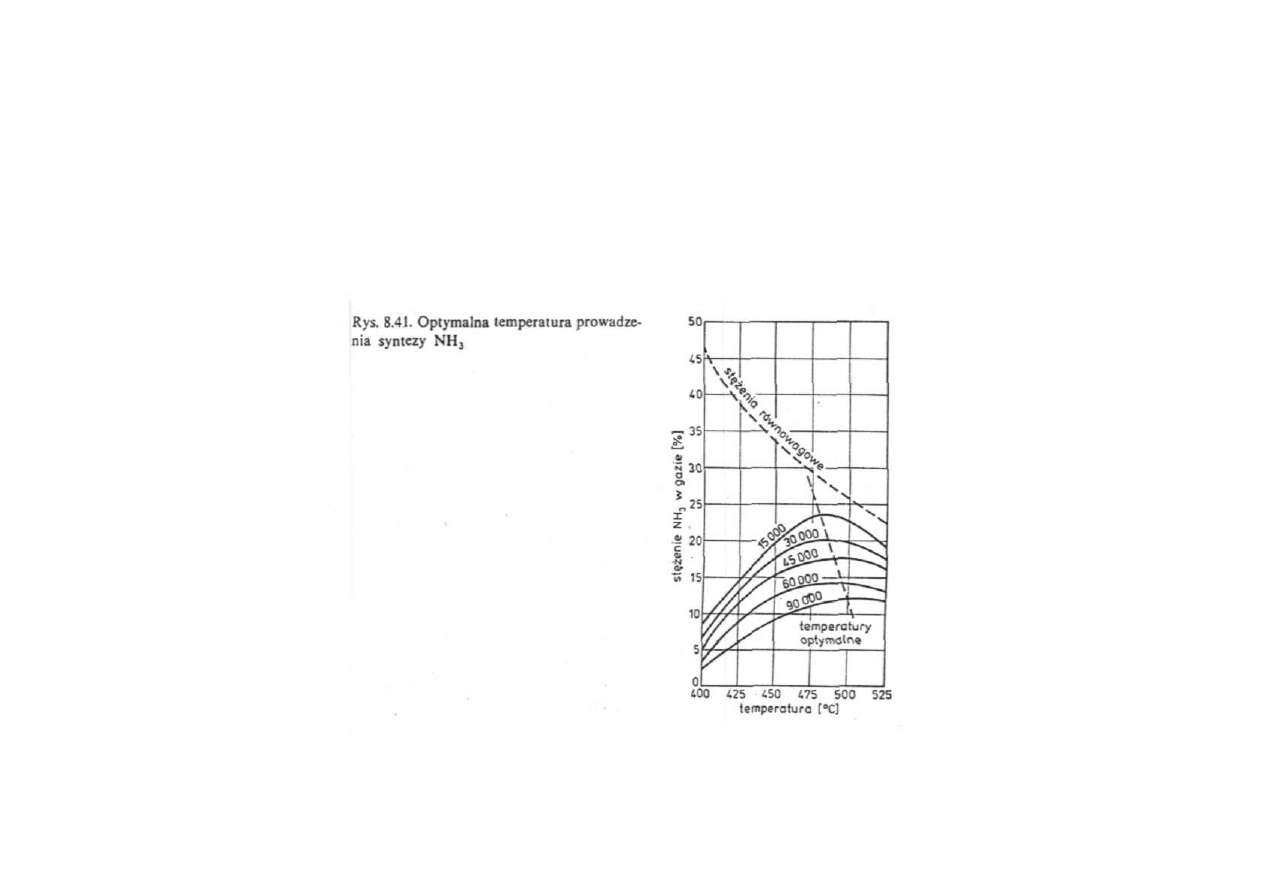
Synteza amoniaku
Optymalna temperatura prowadzenia syntezy NH
3
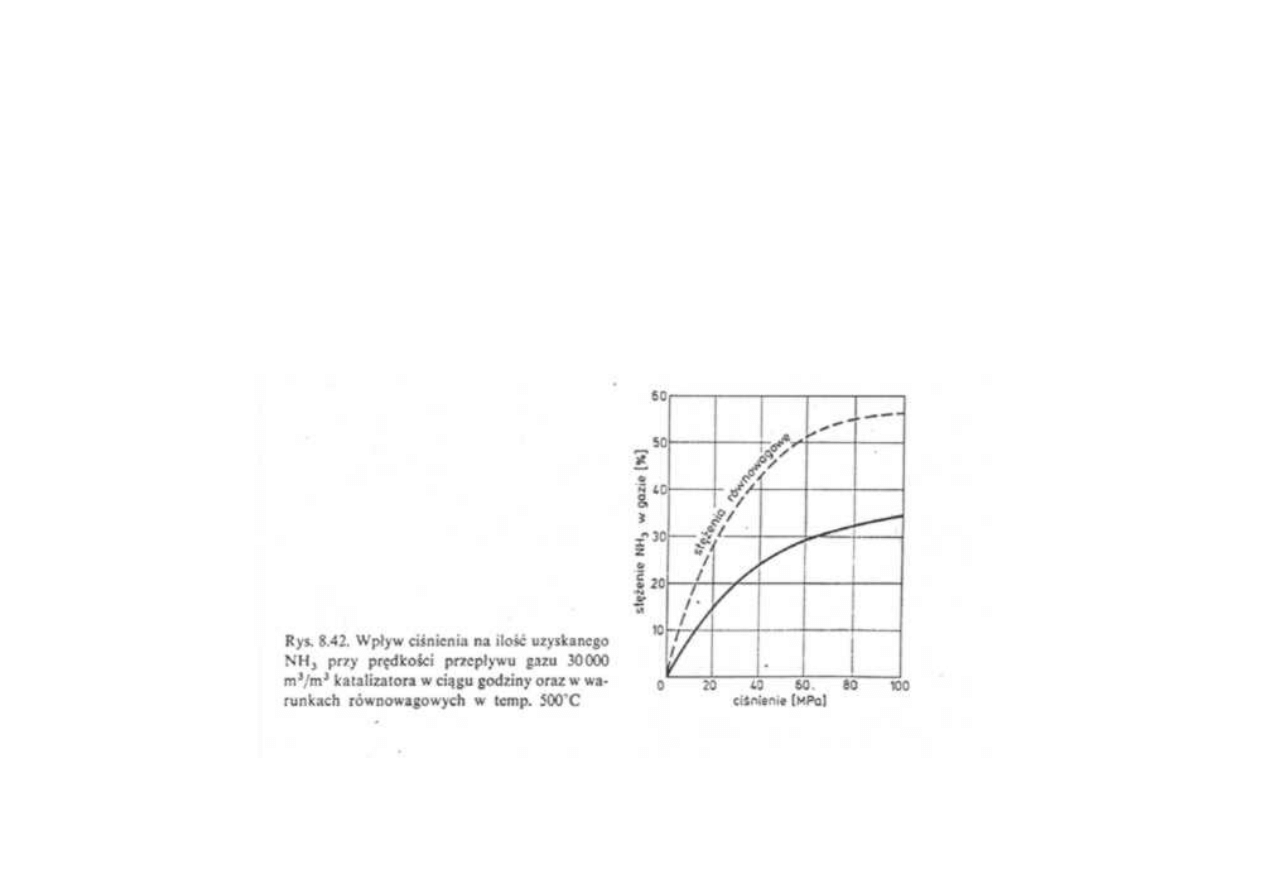
Synteza amoniaku
Wpływ ciśnienia na ilość uzyskanego NH
3
przy prędkości przepływu gazu 30 000 m
3
/m
3
katalizatora w ciągu godziny
oraz w warunkach równowagowych w temperaturze 500
o
C

Synteza amoniaku
przebieg procesu zależy również od wielkości ziaren katalizatora
oraz od jego aktywności
katalizator żelazowy do syntezy amoniaku nie jest kosztowny, gdyż
wytwarza się go z łatwo dostępnych składników, np. z naturalnej rudy
magnetytowej, jednak wytwarzanie katalizatora o dużej i trwałej
aktywności jest procesem trudnym i tylko kilku producentów w świecie
gwarantuje wysoką jakość i trwałość produktu (jednym z najlepszych
katalizatorów syntezy amoniaku jest produkowany w Zakładach
Azotowych w Tarnowie – Mościcach)
aktywność katalizatorów zależy nie tylko od ich składu chemicznego,
lecz także od mikro – i makrostruktury ziarna, jego porowatości,
wielkości powierzchni wewnętrznej, rozmiaru porów itd.

Synteza amoniaku
najlepszym katalizatorem syntezy amoniaku okazało się żelazo
katalizatory do syntezy amoniaku wytwarza się przez redukcję tlenków
żelaza; materiałem wyjściowym są naturalne lub sztuczne magnetyty
aktywność katalizatora zależy od stosunku ilości żelaza (II) do żelaza (III)
-najlepsze wyniki uzyskuje się przy stosunku równym 0,5
katalizatory żelazowe syntezy amoniaku zawierają promotory (3 - 7 %
tlenków innych metali)
katalizatory te mogą pracować w zakresie temperatur 380 – 550
o
C
katalizator jest wrażliwy na pewne zanieczyszczenia, które powodują
obniżenie aktywności (zatrucie) - odwracalne (tlen i związki tlenowe)
lub nieodwracalne (związki siarki, fosforu i chlorowce)
mechanizm syntezy tłumaczy się chemisorpcją substratów
na powierzchni katalizatora
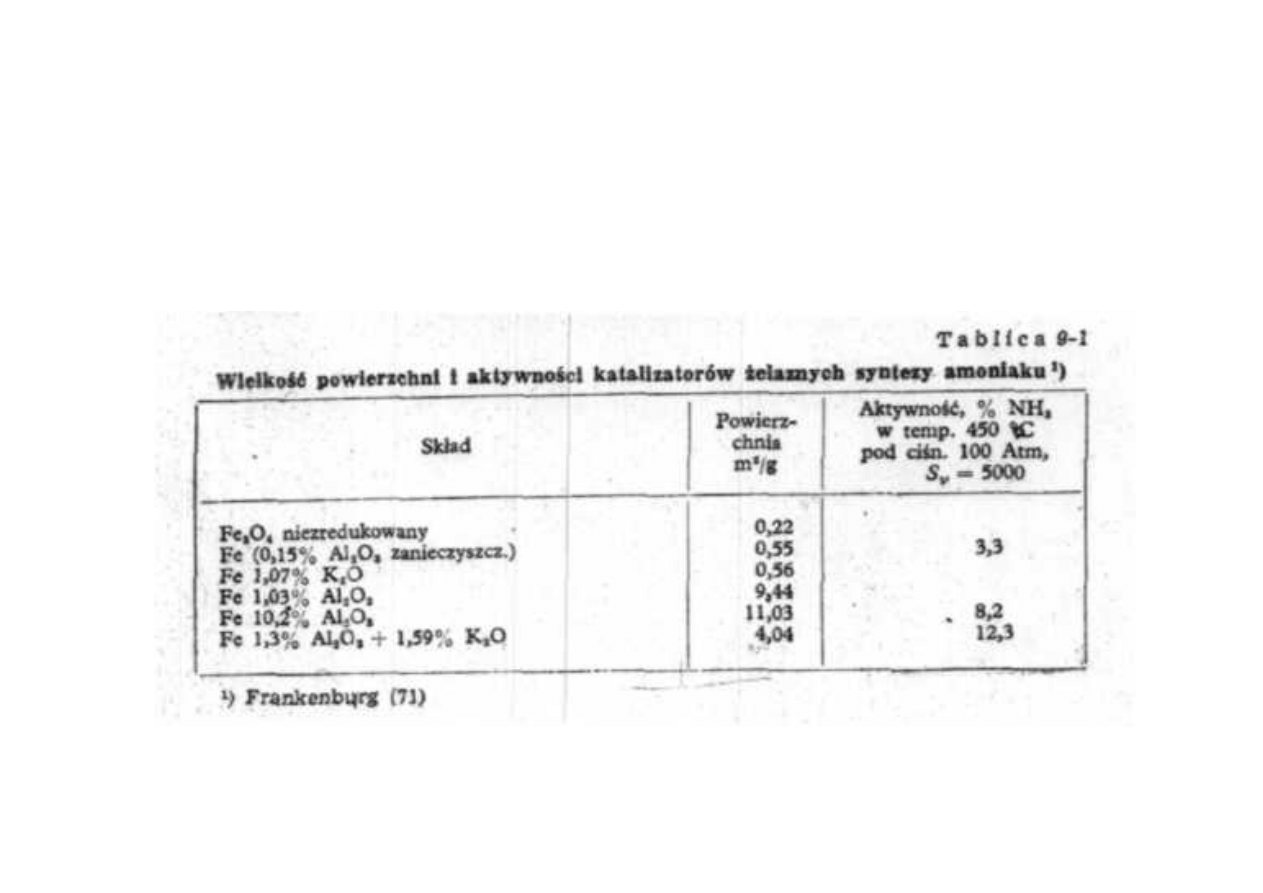
Synteza amoniaku
Wielkość powierzchni i aktywności
katalizatorów żelaznych syntezy amoniaku
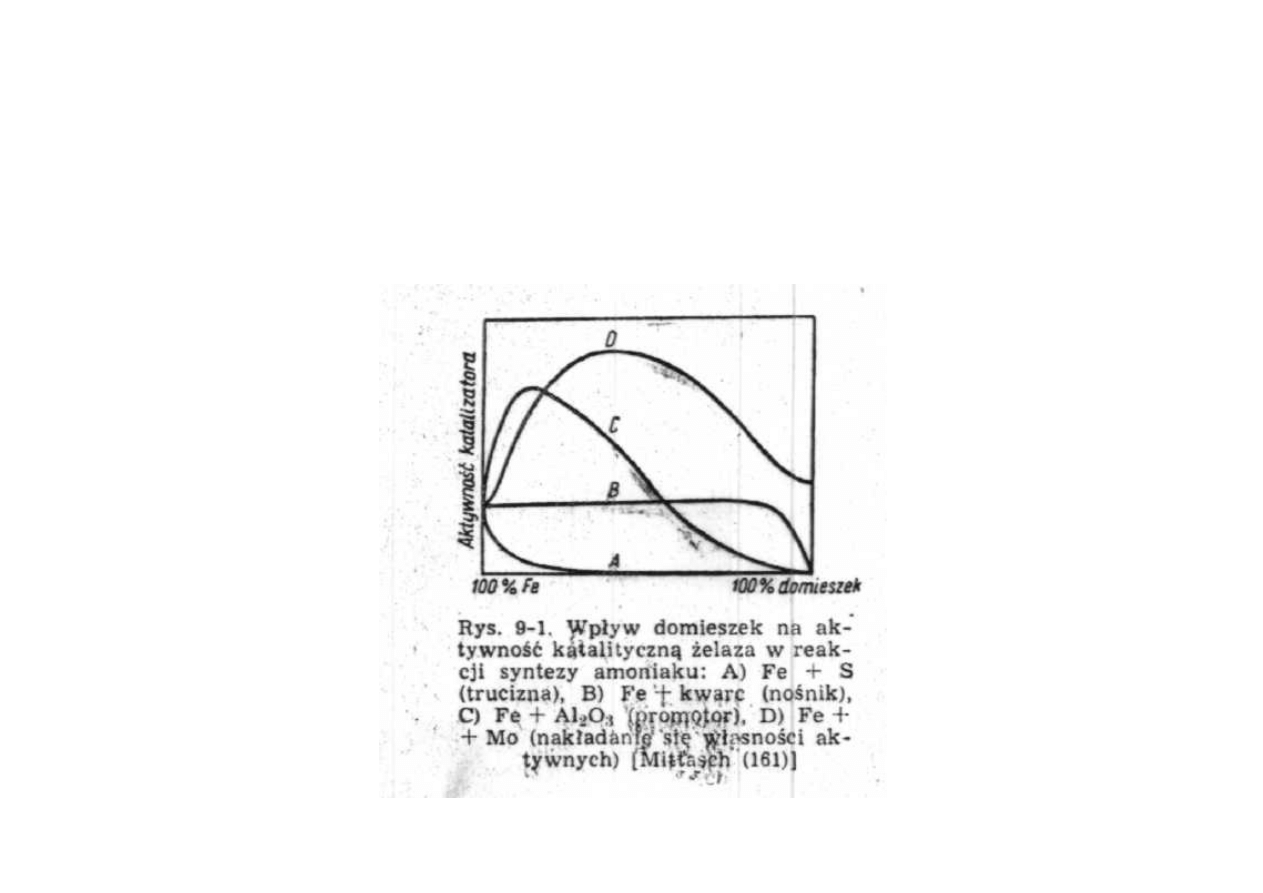
Synteza amoniaku
Wpływ domieszek na aktywność katalityczną żelaza
w reakcji syntezy amoniaku
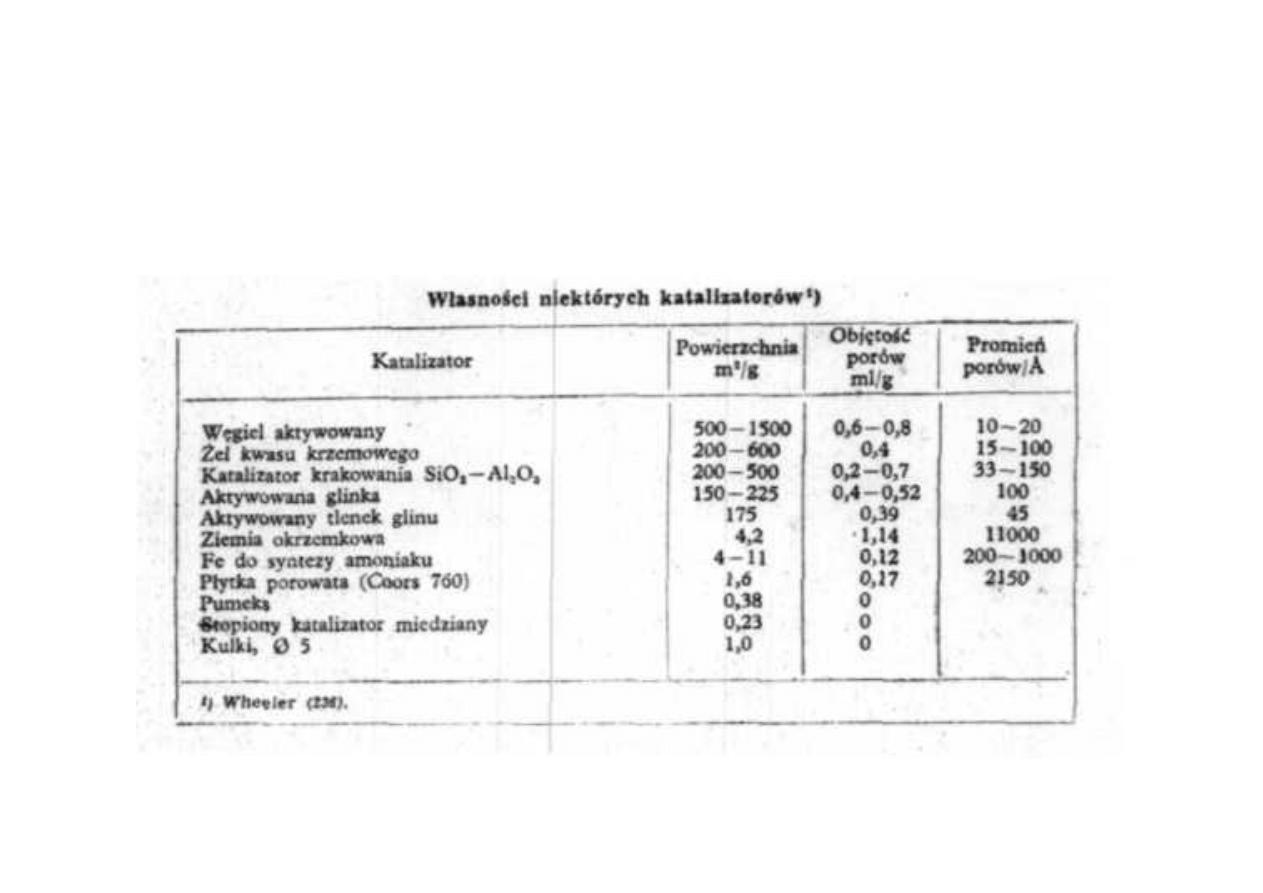
Synteza amoniaku
Właściwości niektórych katalizatorów
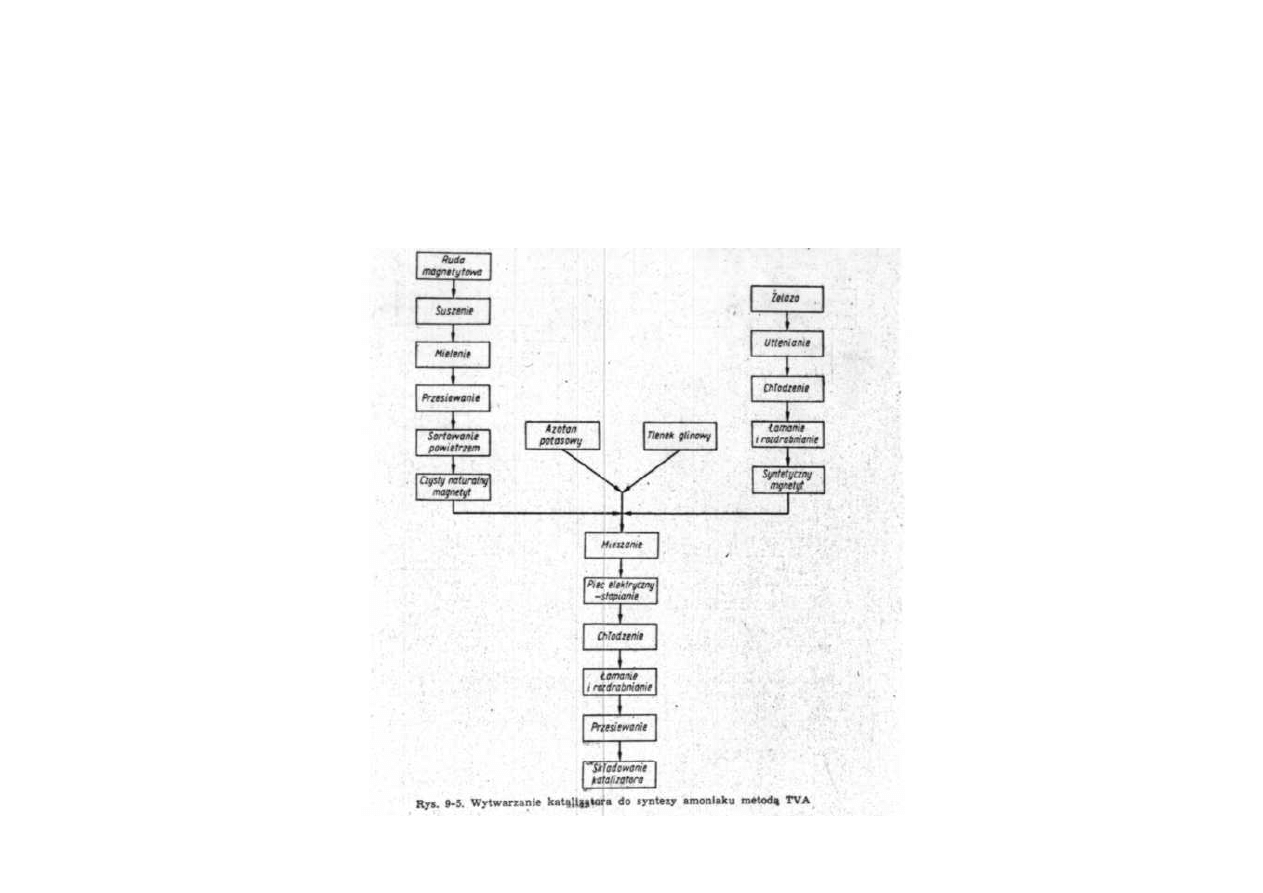
Synteza amoniaku
Wytwarzanie katalizatorów do syntezy amoniaku metodą TVA
Synteza amoniaku
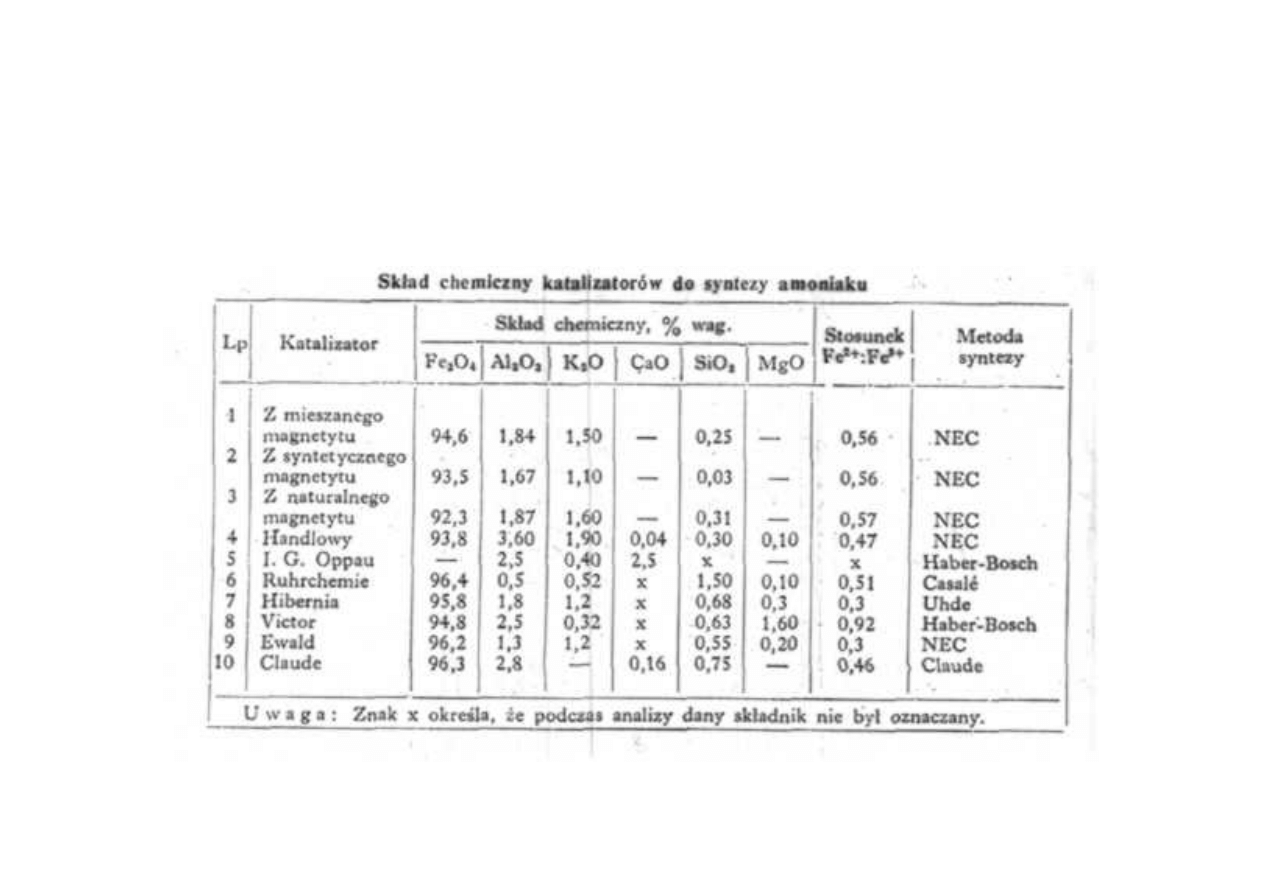
Skład chemiczny katalizatorów do syntezy amoniaku
Synteza amoniaku
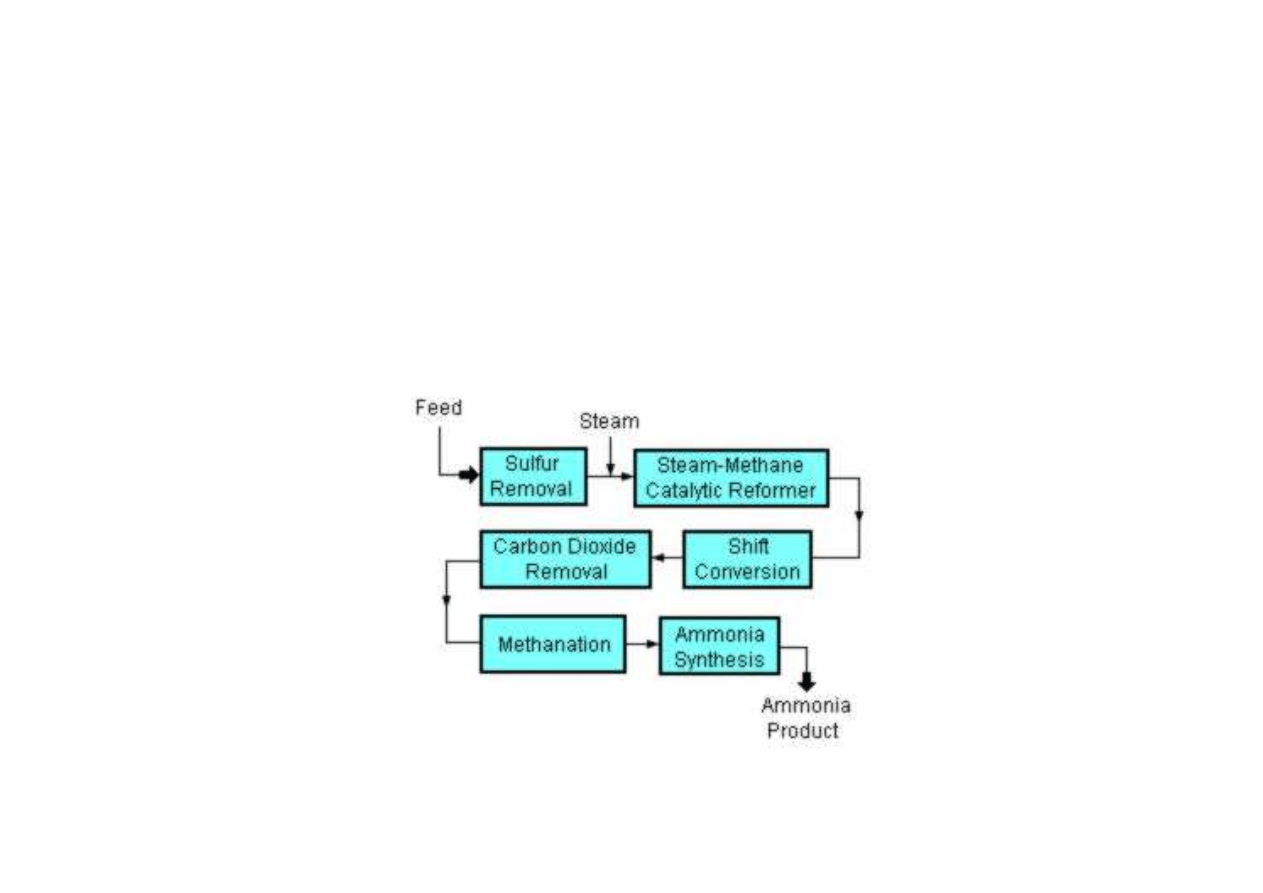
mieszaninę azotu i wodoru otrzymuje się w wyniku zgazowania
paliwa stałego, otrzymując gaz generatorowy, lub też w wyniku
przeprowadzenia konwersji i półspalania metanu
Synteza amoniaku
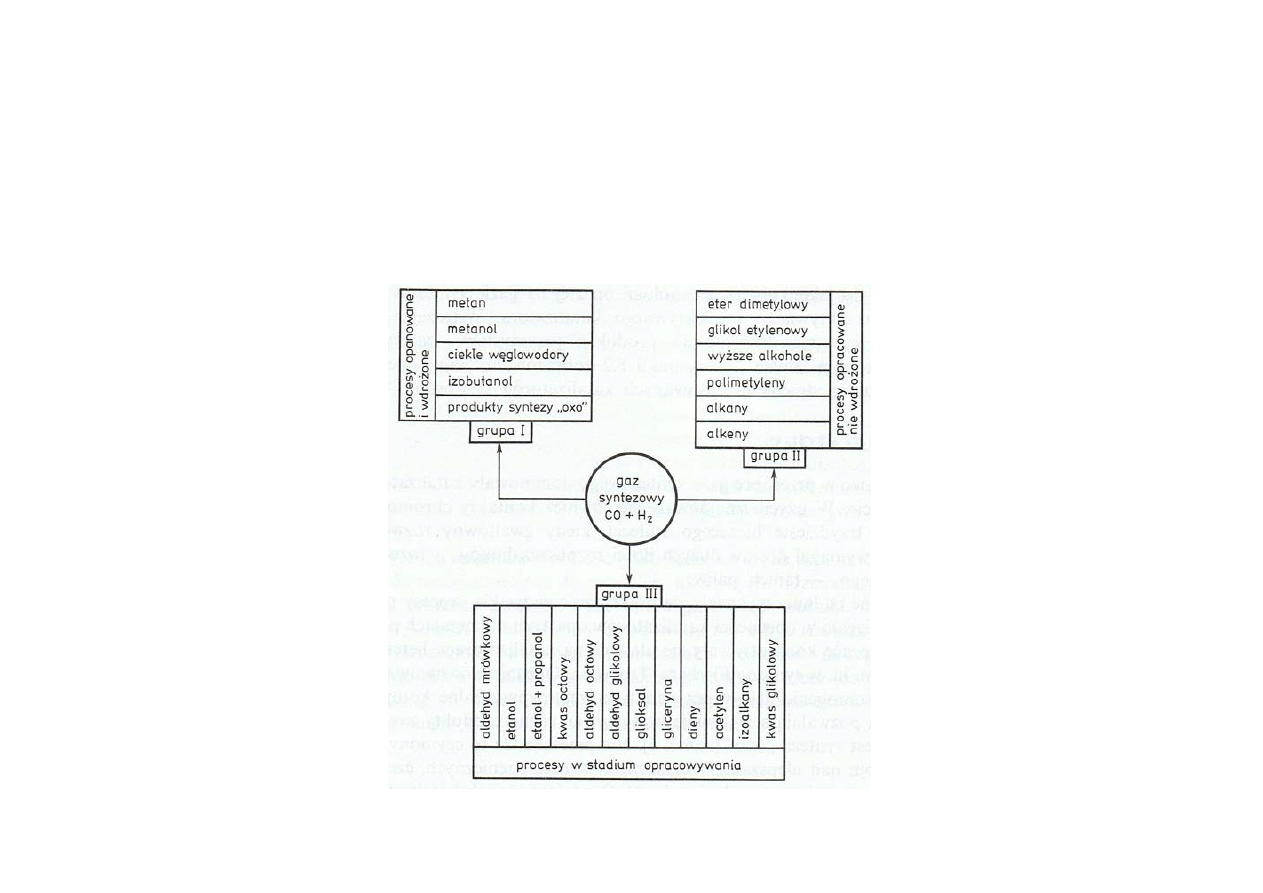
Podział procesów opartych na gazie syntezowym
Synteza amoniaku
Schemat przerobu gazu syntezowego
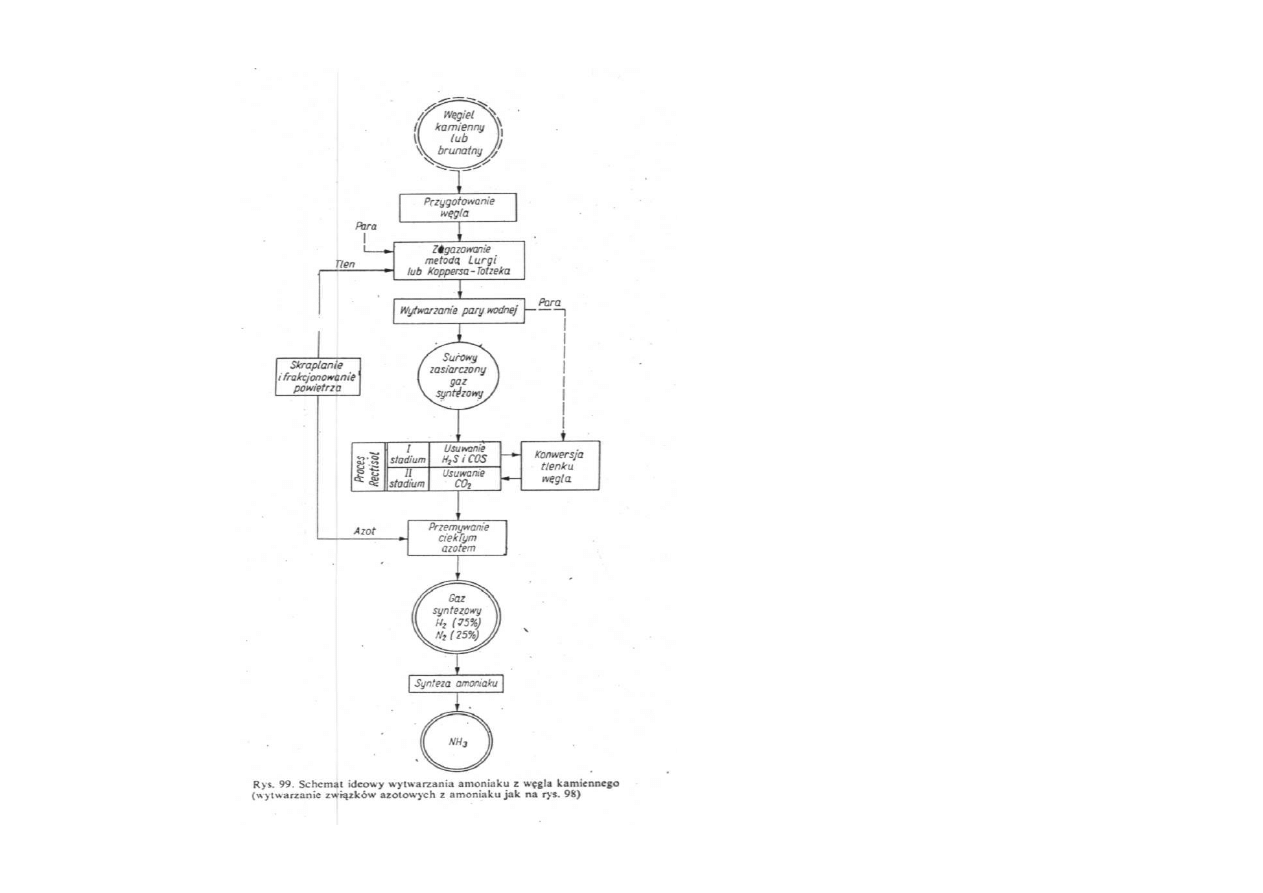
Schemat ideowy
wytwarzania amoniaku
z węgla kamiennego
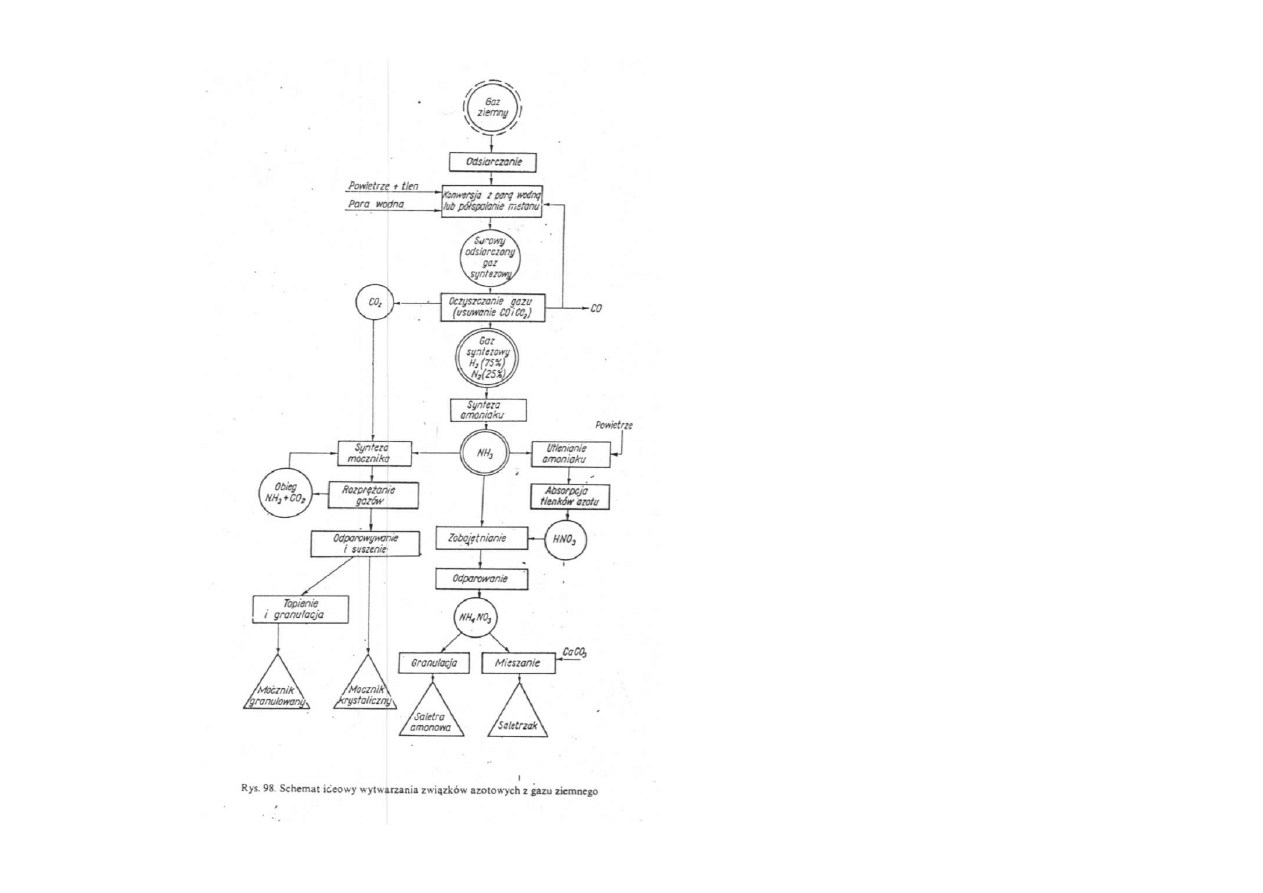
Schemat ideowy
wytwarzania
związków azotowych
z gazu ziemnego
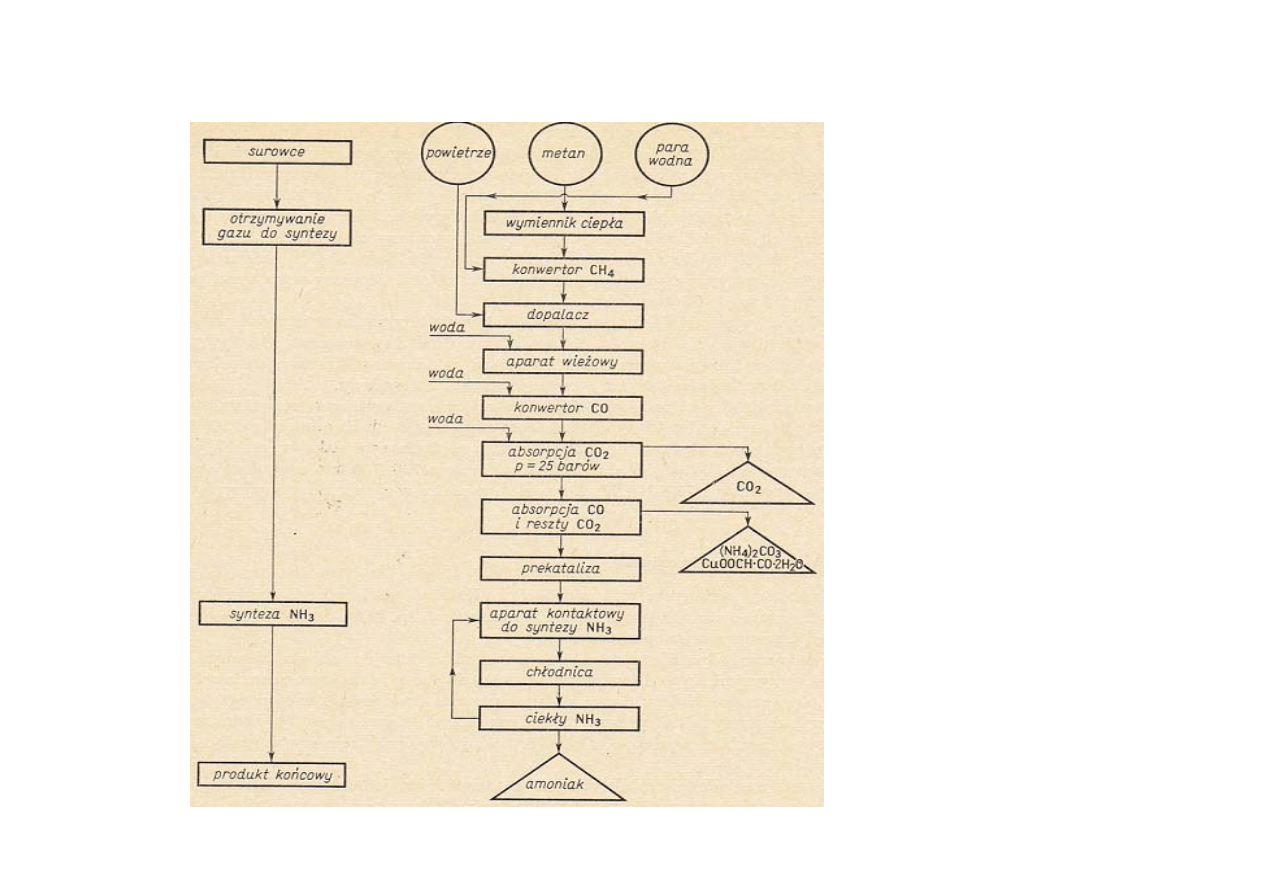
Schemat ideowy
otrzymywania
NH
3
z metanu
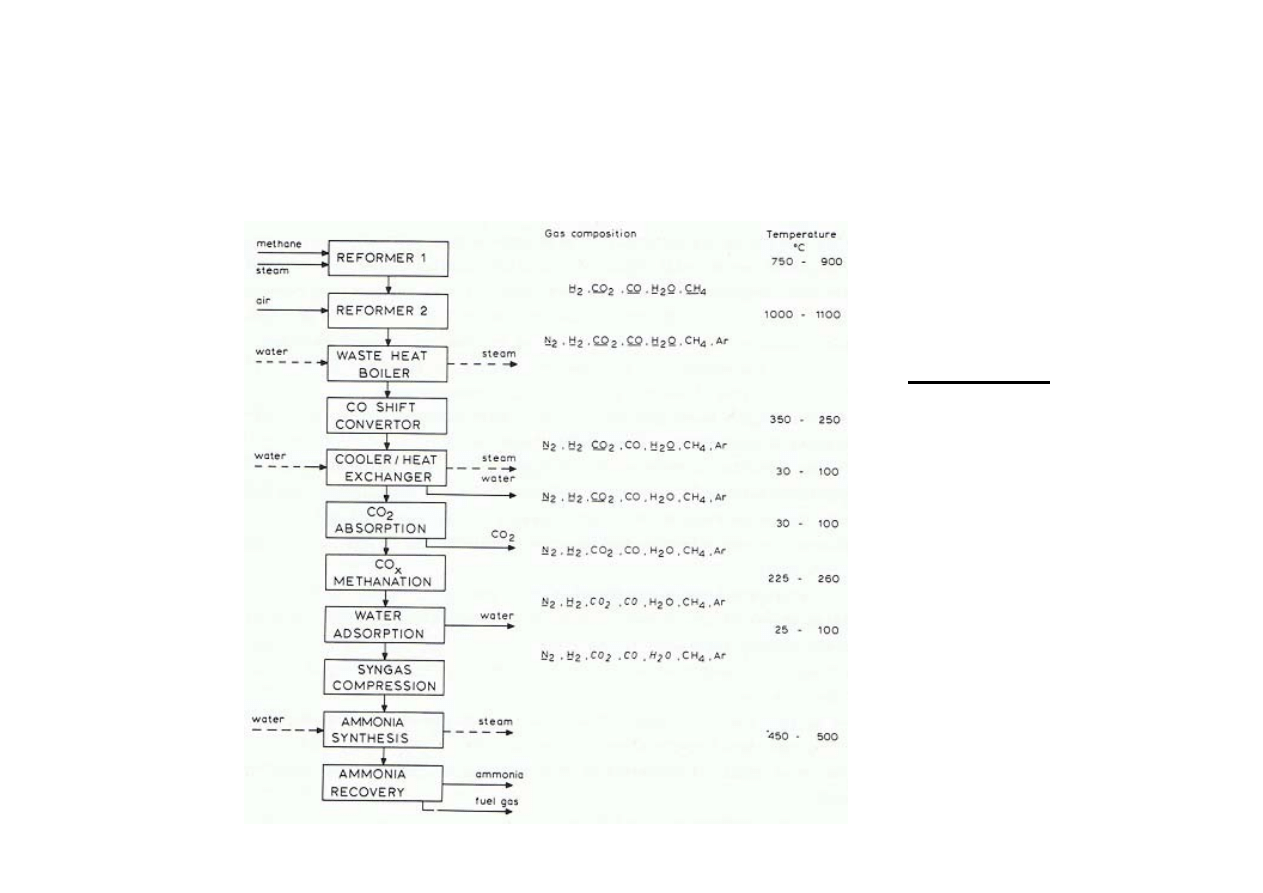
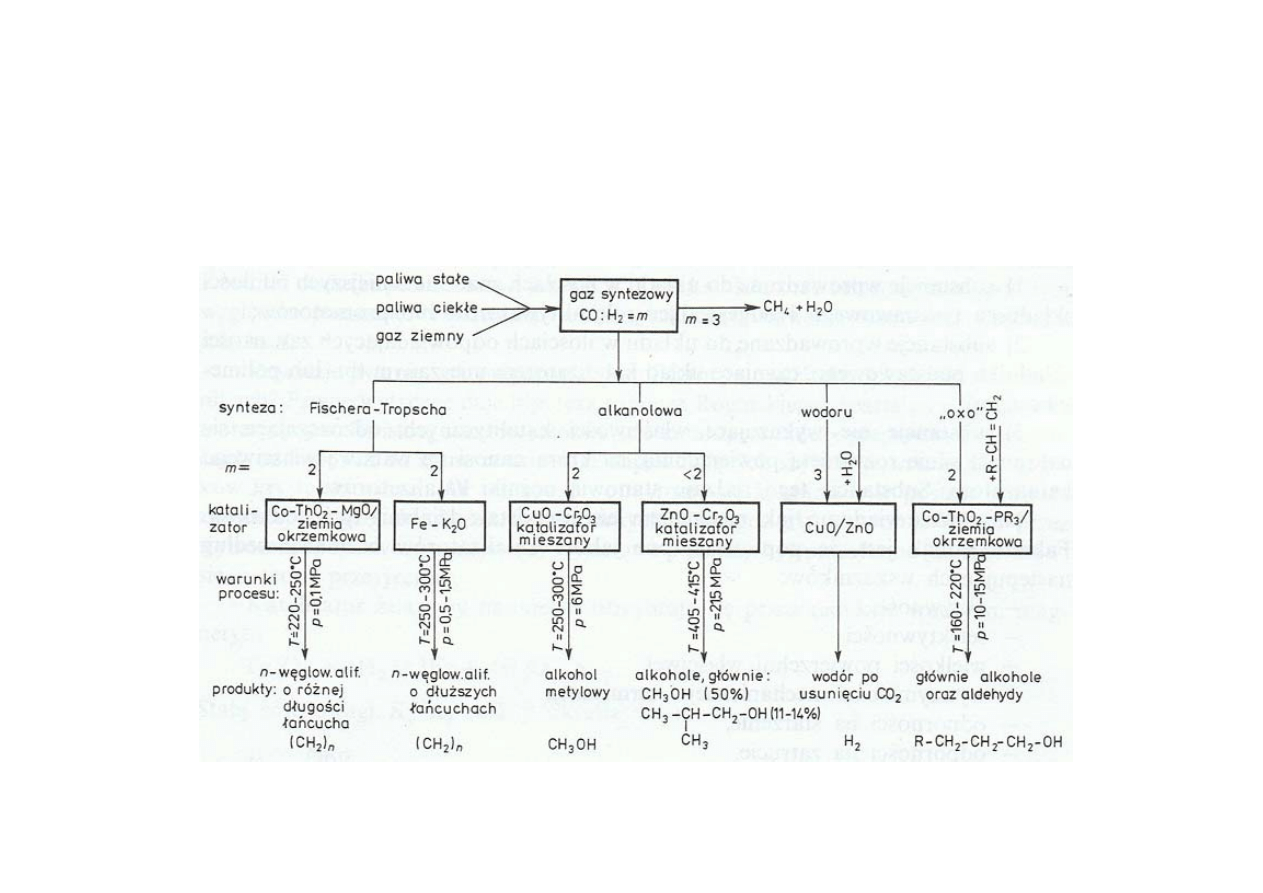
Synteza amoniaku
Schemat ideowy syntezy amoniaku z metanu
•
główne składniki
( > 1 % obj.) –
podkreślono
•
śladowe
komponenty
( 1 – 20 ppm) –
drukiem pochyłym
•
Ar –
wliczono również
inne gazy
szlachetne

Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
zgazowanie węgla
C + O
2
+ 3,76 N
2
→ CO
2
+ 3,76 N
2
∆ H = - 404 kJ/mol
2 C + O
2
+ 3,76 N
2
↔ 2 CO + 3,76 N
2
∆ H = - 218 kJ/mol
2 CO + O
2
+ 3,76 N
2
→ 2 CO
2
+ 3,76 N
2
∆ H = - 185 kJ/mol
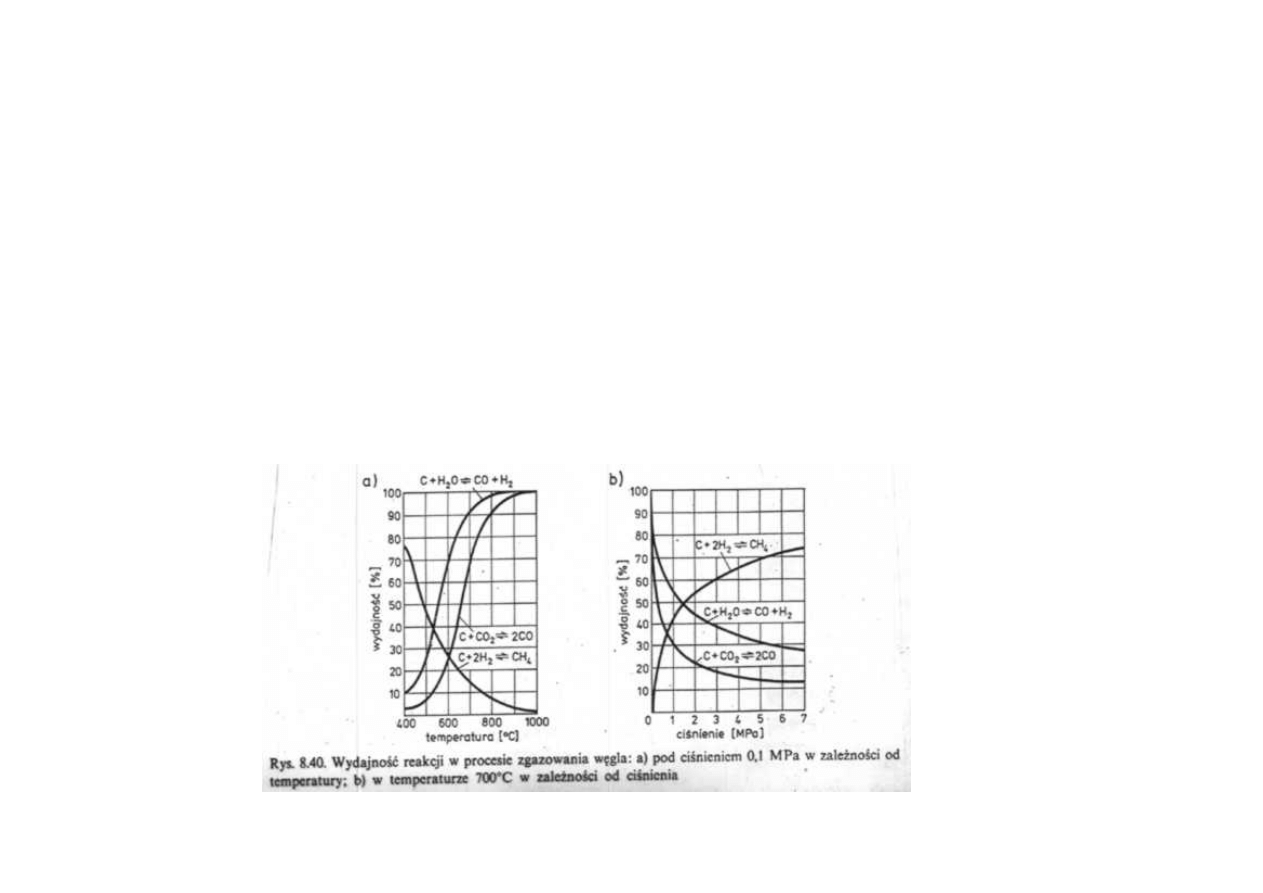
Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
C + CO
2
↔ 2 CO
∆ H = 176 kJ/mol
C + H
2
O↔ CO + H
2
∆ H = 130 kJ/mol
CO + H
2
O↔ CO
2
+ H
2
∆ H = - 42 kJ/mol
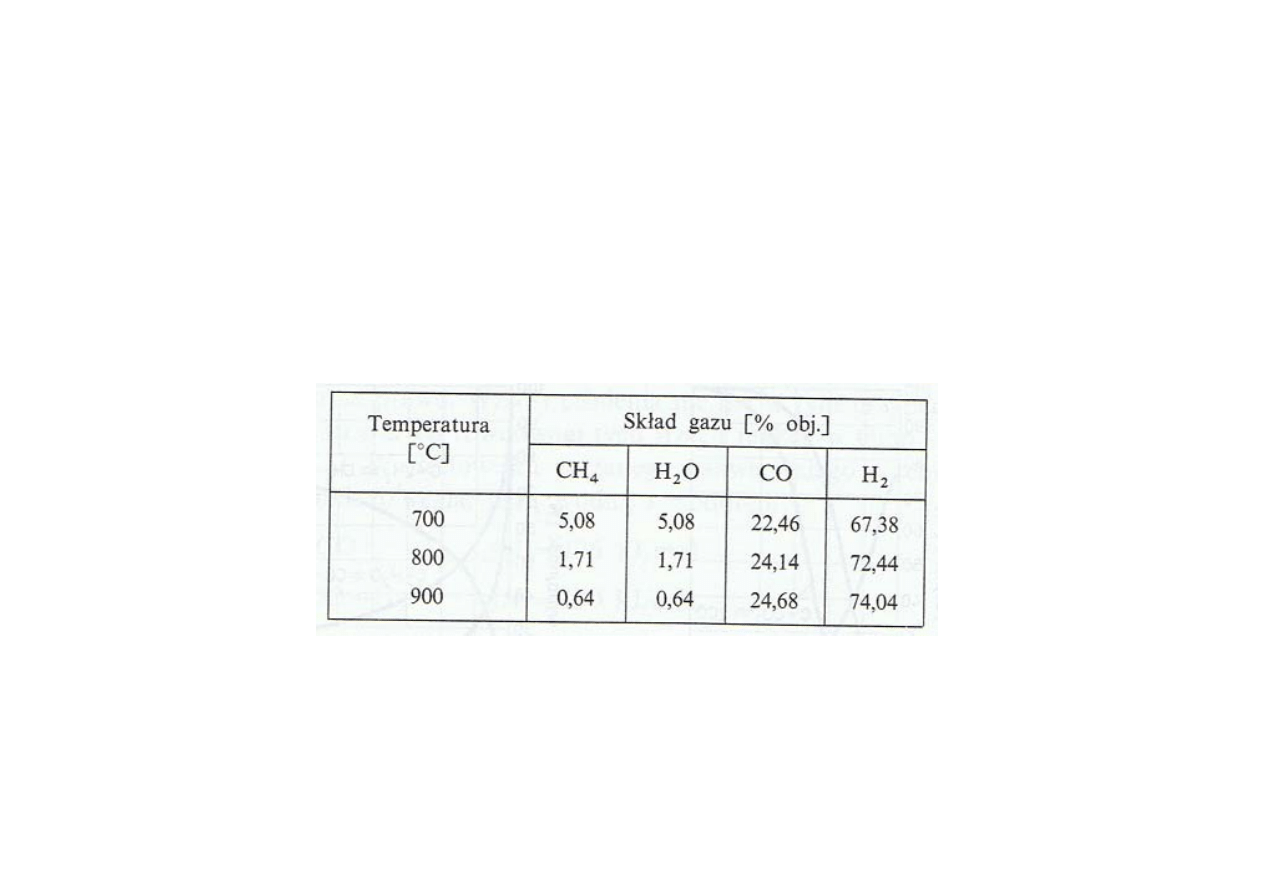
Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
reforming metanu
CH
4
+ H
2
O ↔ CO + 3 H
2
∆ H = - 207 kJ/mol
półspalanie metanu
CH
4
+ O
2
+ 3,76 N
2
↔ 2 CO + 4 H
2
+ 3,76 N
2
∆ H = - 35 kJ/mol

Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
oczyszczanie mieszaniny gazów przed wprowadzeniem do obiegu
instalacji syntezy amoniaku od domieszek stanowiących trucizny
katalizatora
suma zawartości zanieczyszczeń tlenowych w gazie nie powinna
przekraczać 0,002 – 0,003 %
•
konwersja tlenku węgla
•
wymywanie ditlenku węla
•
usuwanie resztek tlenków węgla
• absorpcja w amoniakalnych roztworach soli miedzi (I)
• przemywanie ciekłym azotem
• metanizacja lub prekataliza

Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
konwersja tlenku węgla
CO + H
2
O ↔ CO
2
+ H
2
∆ H = - 42 kJ/mol
konwersję tlenku węgla można prowadzić w zakresie temperatur 300- 500
o
C
jako tzw. konwersję normalnotemperaturową; katalizatorem są tlenki żelaza i
chromu dość odporne na zatrucie związkami siarki, nie ułatwiające
niepożądanej reakcji metanizacji
CO + 3 H
2
↔ CH
4
+ H
2
O
w gazach po konwersji normalnotemperaturowej pozostaje zwykle 2 –3 % CO
konwersja niskotemperaturowa zachodzi w temperaturze poniżej 200
o
C,
pozwala na obniżenie zawartości tlenku węgla poniżej 0,3 %; katalizatorami są
mieszaniny tlenków chromu i miedzi, które są wrażliwe na zatrucia siarką
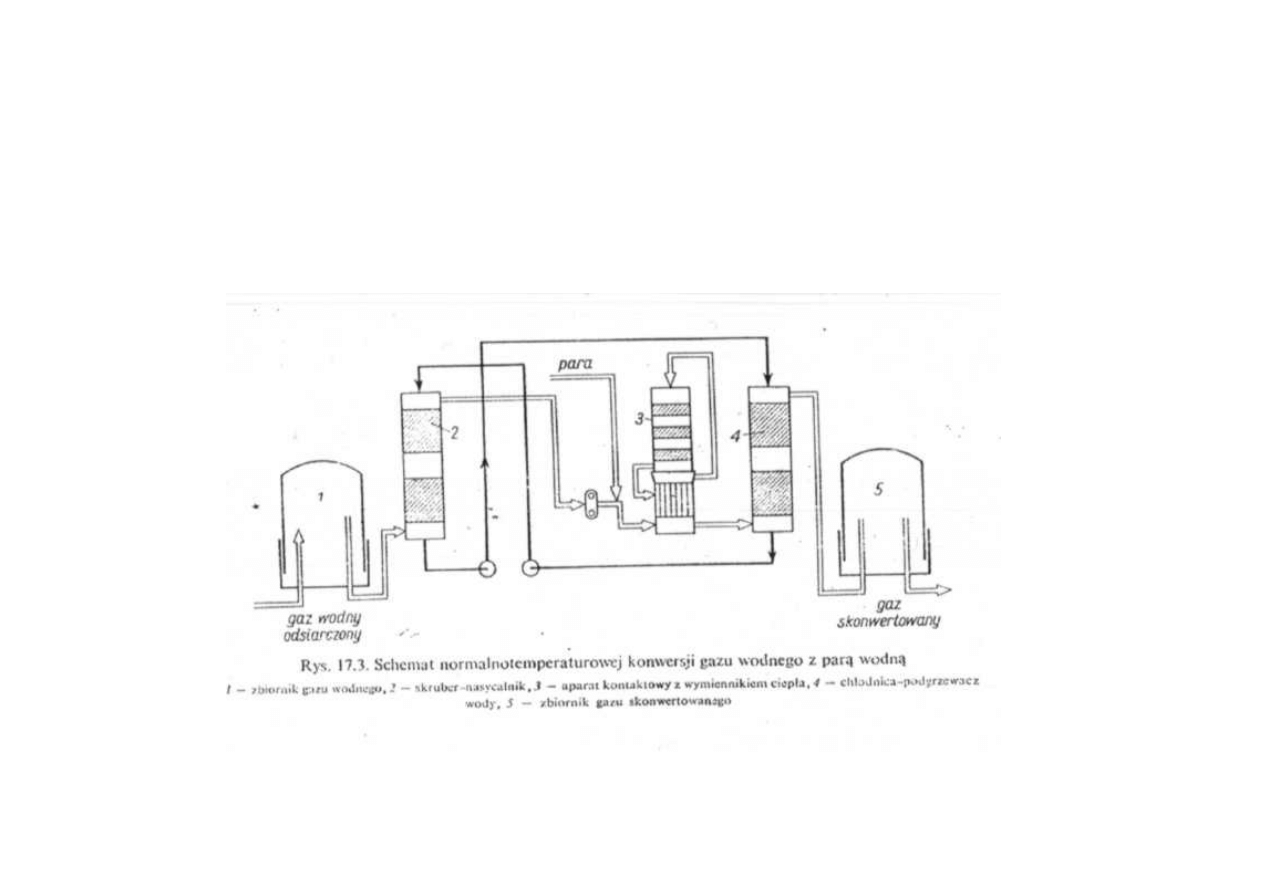
Synteza amoniaku
Schemat normalnotemperaturowej konwersji gazu wodnego z parą wodną

Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
usuwanie ditlenku węgla (dekarbonizacja)
•
absorpcja w wodzie pod ciśnieniem 1,6 – 2,5 MPa w aparatach
wieżowych
•
w gorącym około 30 % wodnym roztworze węglanu potasu z dodatkiem
aktywatora (3 % roztwór dietanoloaminy DEA)
K
2
CO
3
+ CO
2
+ H
2
O ↔ 2 KHCO
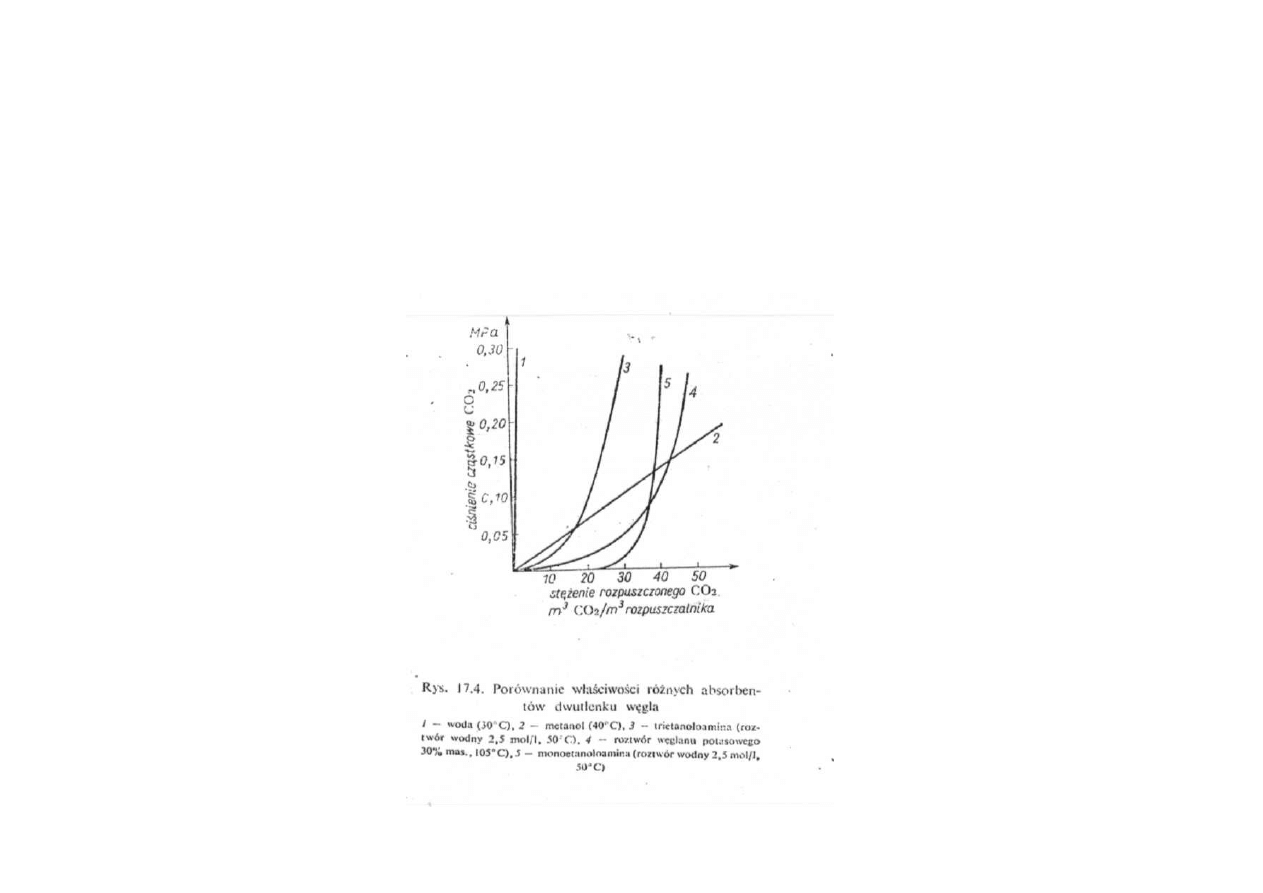
Synteza amoniaku
Porównanie właściwości różnych absorbentów CO
2
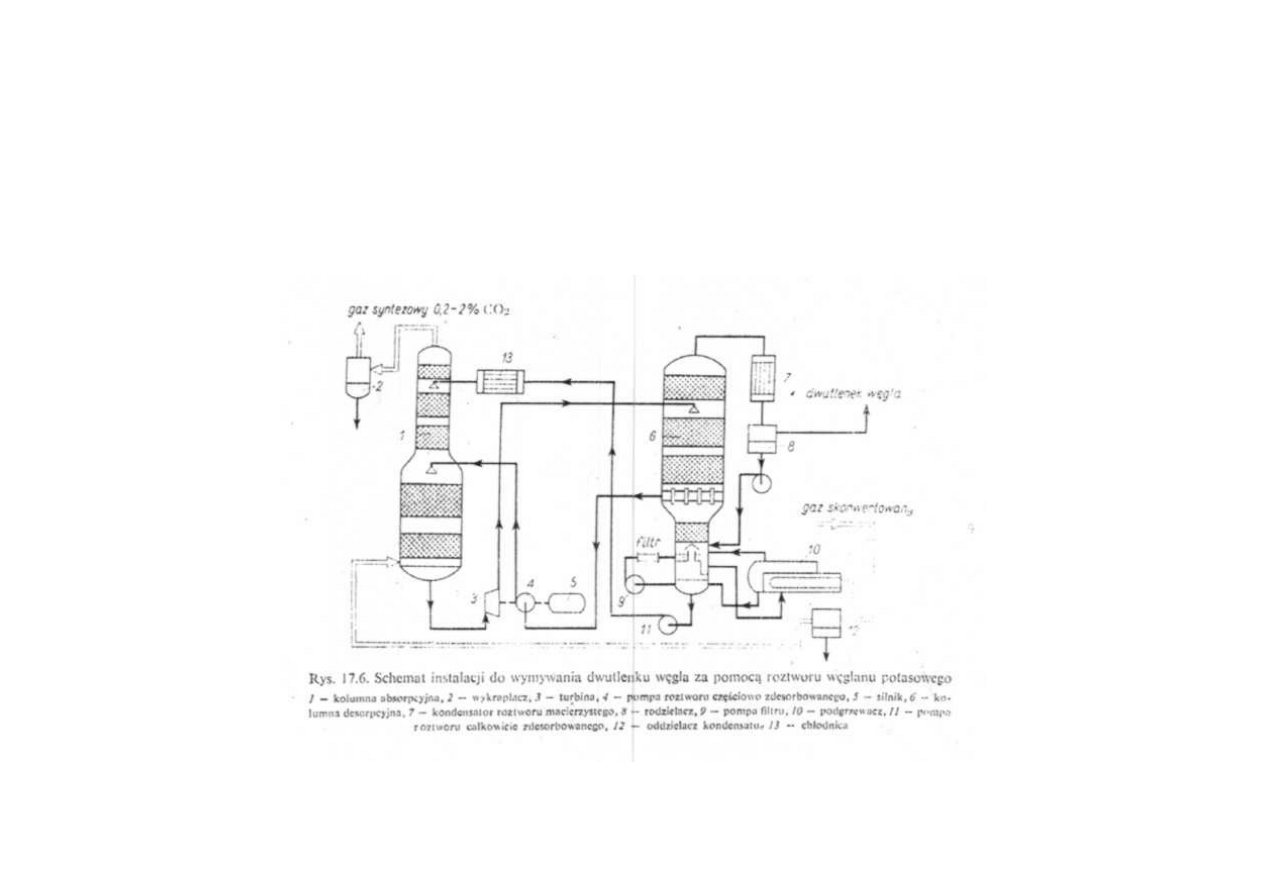
Synteza amoniaku
Schemat instalacji do wymywania ditlenku węgla
za pomocą roztworu węglanu potasu
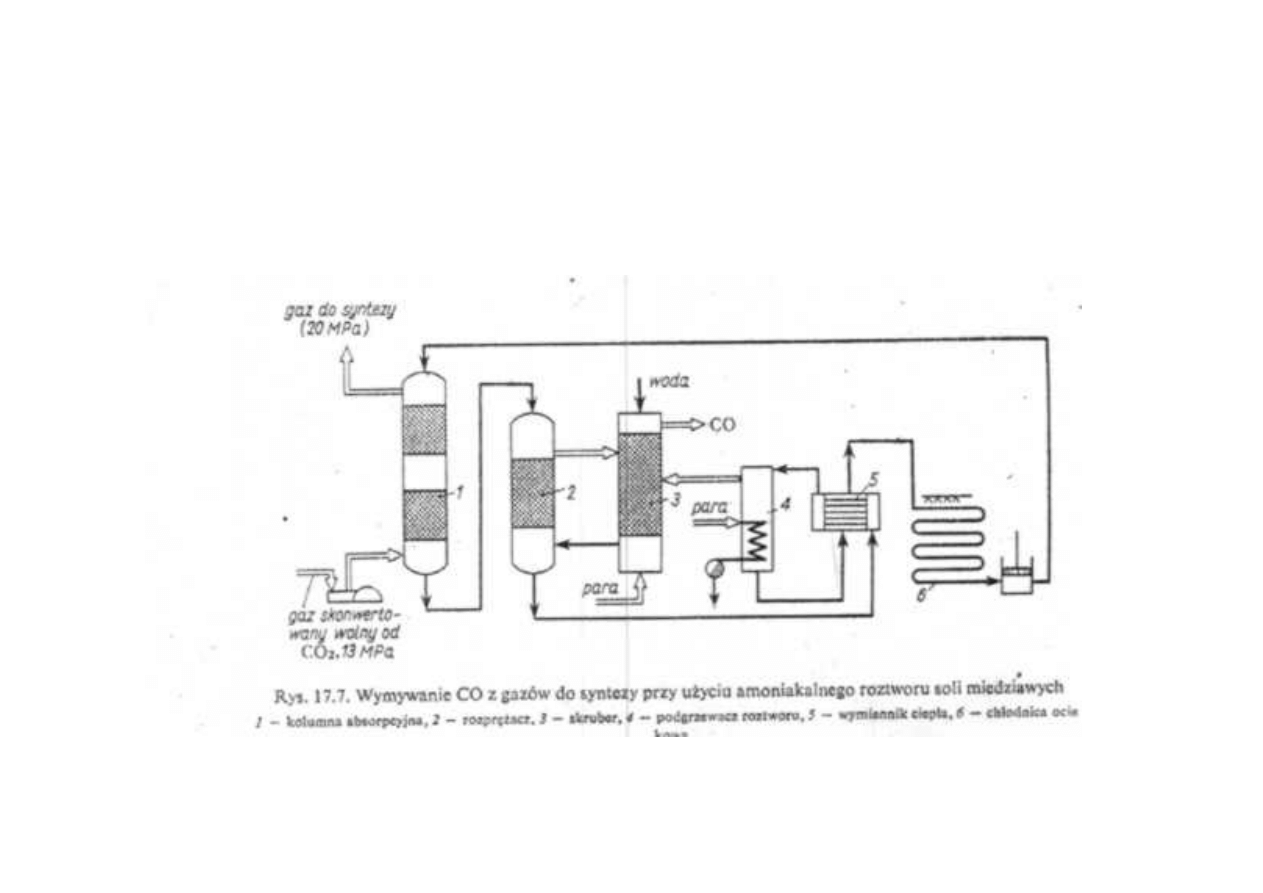
Synteza amoniaku
Wymywanie CO z gazów do syntezy amoniaku
przy użyciu amoniakalnego roztworu soli miedzi (I)

Synteza amoniaku
Otrzymywanie mieszaniny azotu i wodoru
metanizacja
CO + 3 H
2
→ CH
4
+ H
2
O
CO
2
+ 4 H
2
→ CH
4
+ 2 H
2
O
O
2
+ 2 H
2
→ 2 H
2
O
katalizatorem procesu metanizacji jest nikiel osadzony na tlenku glinu,
który pracuje w zakresie temperatur 300 – 400
o
C i ciśnień do 1000 at
metanizacja pozwala na obniżenie zawartości tlenku węgla do 0,001 %;
można ją stosować, jeżeli w wyniku konwersji tlenku węgla i wymywania
ditlenku węgla stężenie tych składników zastanie obniżone do całkowitej
zawartości około 0,5 %

Synteza amoniaku
ze względu na ograniczony zakres aktywności katalizatorów,
nawet w optymalnych warunkach, synteza amoniaku zachodzi
w temperaturze, w której równowagowy stopień przemiany jest
niewielki (mimo wysokiego ciśnienia, które stosuje się w tym procesie)
zadowalającą wydajność surowcową syntezy amoniaku uzyskano
dopiero wtedy, gdy opracowano specjalne, złożone układy
technologiczne :
– układ obiegu powrotnego czyli cyrkulacyjny Habera – Boscha
– oraz układ wielostopniowy Claude’a (w dawniejszych instalacjach)
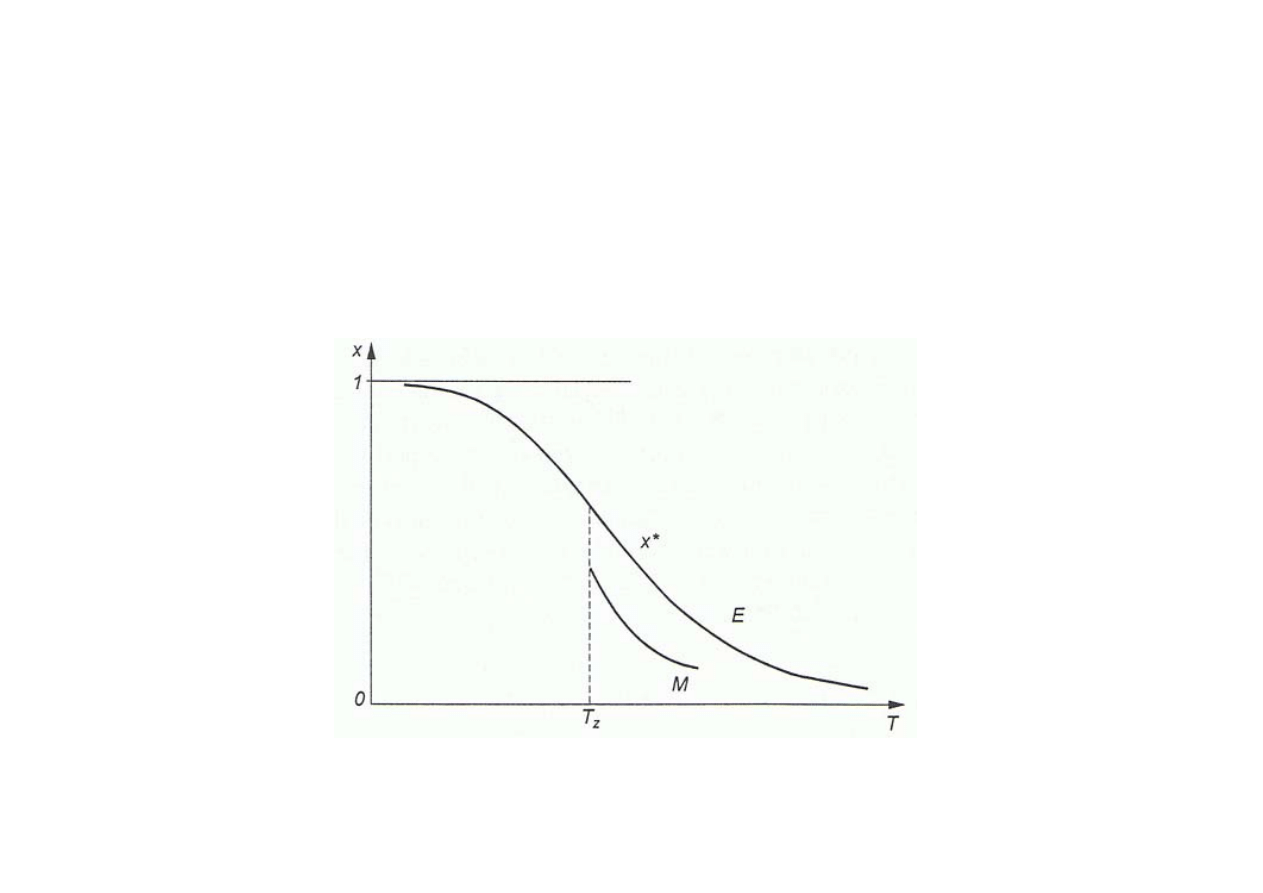
Synteza amoniaku
Równowagowy stopień przemiany wodoru w amoniak x”
i optymalna linia operacyjna M wyznaczona dla katalizatora żelazowego;
T
z
– temperatura zapłonu
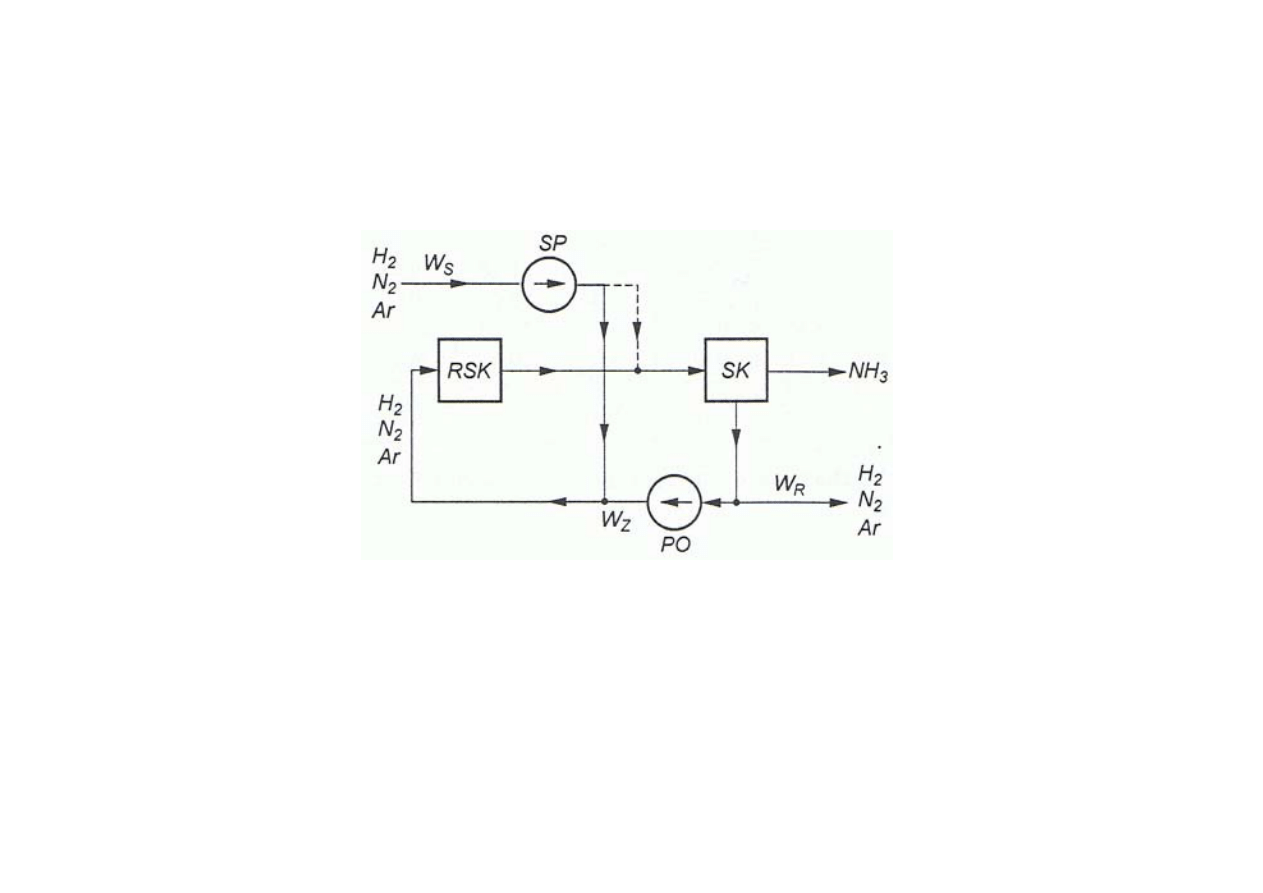
Synteza amoniaku
Uproszczony schemat układu technologicznego do syntezy amoniaku
(układ obiegu powrotnego według Habera i Boscha)
zaznaczono dwa sposoby doprowadzenia gazu syntezowego
•
przed reaktorem RSK (linia ciągła)
•
przed skraplaczem – separatorem SK (linia przerywana)
RSK –
reaktor
SK
–
skraplacz – separator
SP
–
sprężarka gazu syntezowego
PO
–
pompa (sprężarka ) gazu powrotnego
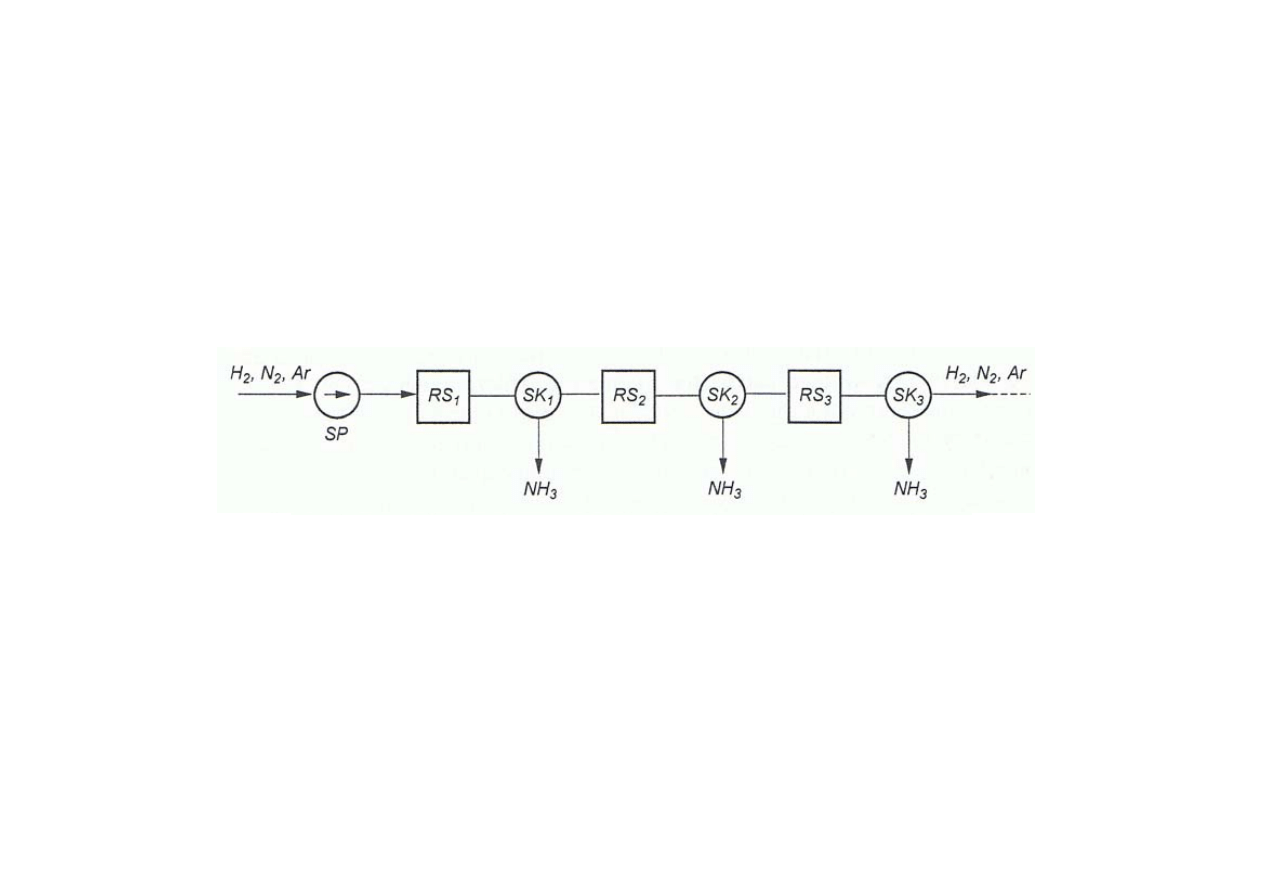
Synteza amoniaku
Uproszczony schemat układu technologicznego do syntezy amoniaku
(układ wielostopniowy Claude’a) - niestosowany
RS
–
reaktory
SK
–
skraplacze – separatory

Synteza amoniaku
cechy charakterystyczne instalacji do syntezy amoniaku :
•
stosowanie recyrkulacji mieszaniny azotowo - wodorowej,
która nie uległa przemianie na amoniak
•
wydzielanie amoniaku przez skroplenie
•
stosowanie wysokich ciśnień
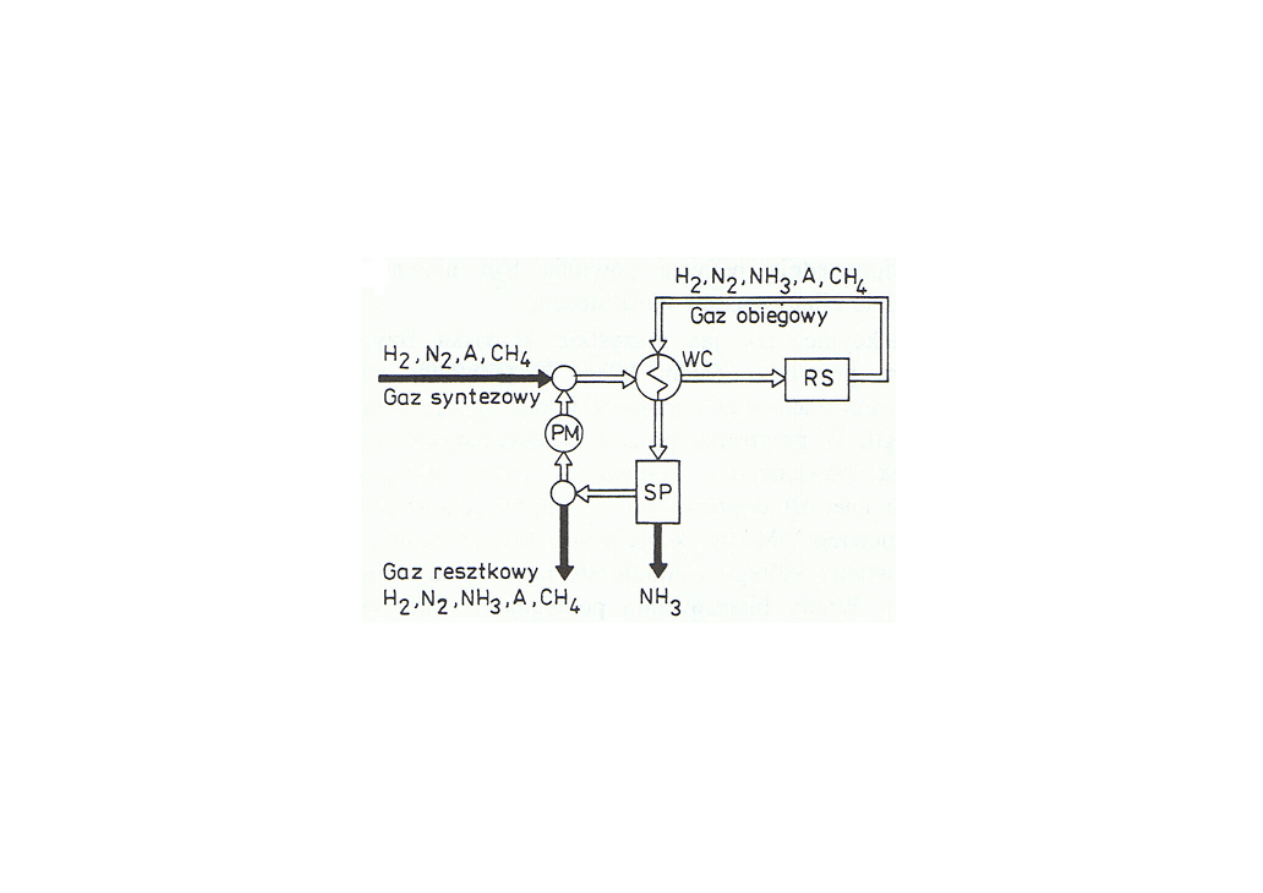
Synteza amoniaku
Schemat jednostki syntezy amoniaku w układzie obiegu zamkniętego
RS
–
reaktor syntezy
SP
–
skraplacz i separator amoniaku
PM –
pompa obiegu gazów
WC –
wymiennik ciepła
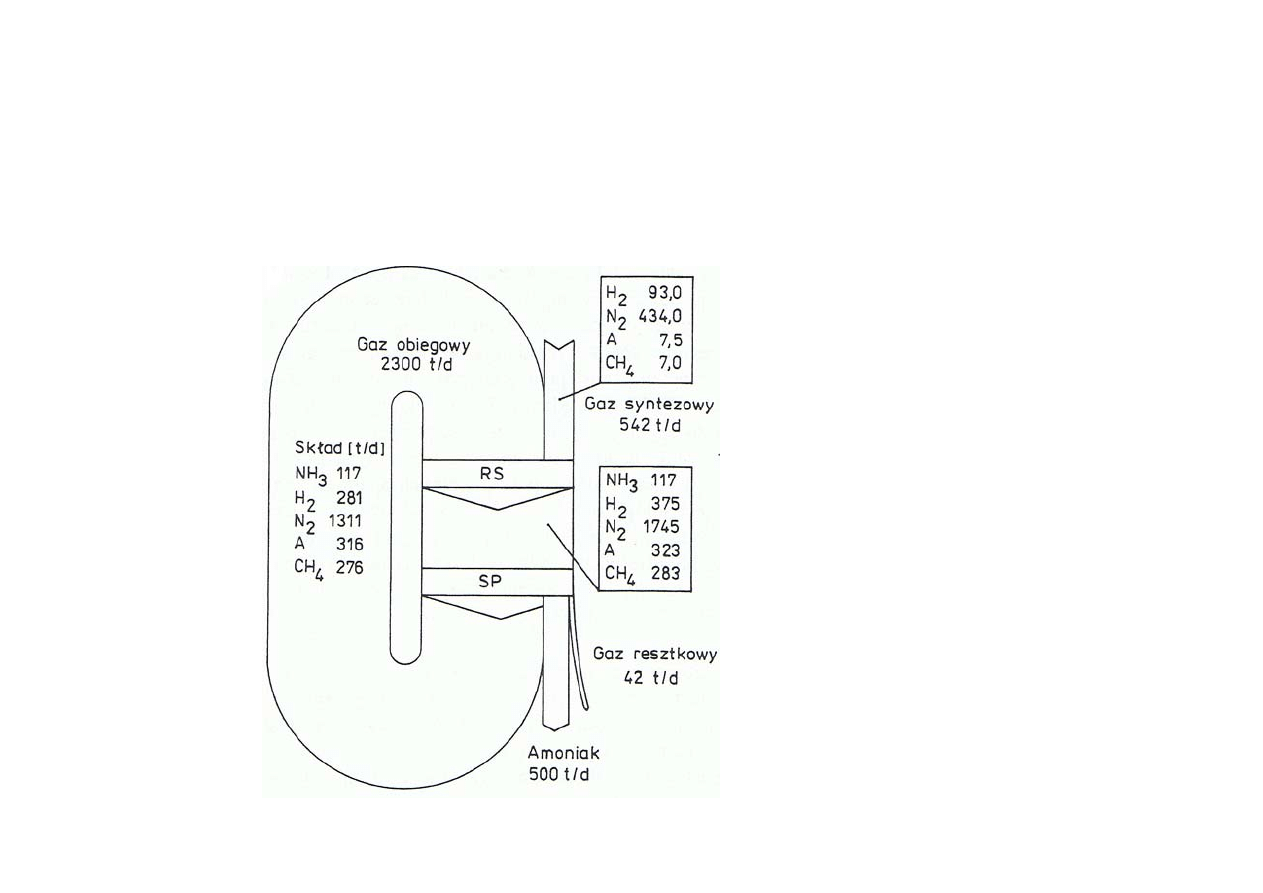
Synteza amoniaku
Wykres strumieniowy bilansu jednostki syntezy amoniaku
w układzie obiegu zamkniętego
RS
– reaktor syntezy
SP
– skraplacz i separator
amoniaku
PM – pompa obiegu gazów
WC – wymiennik ciepła
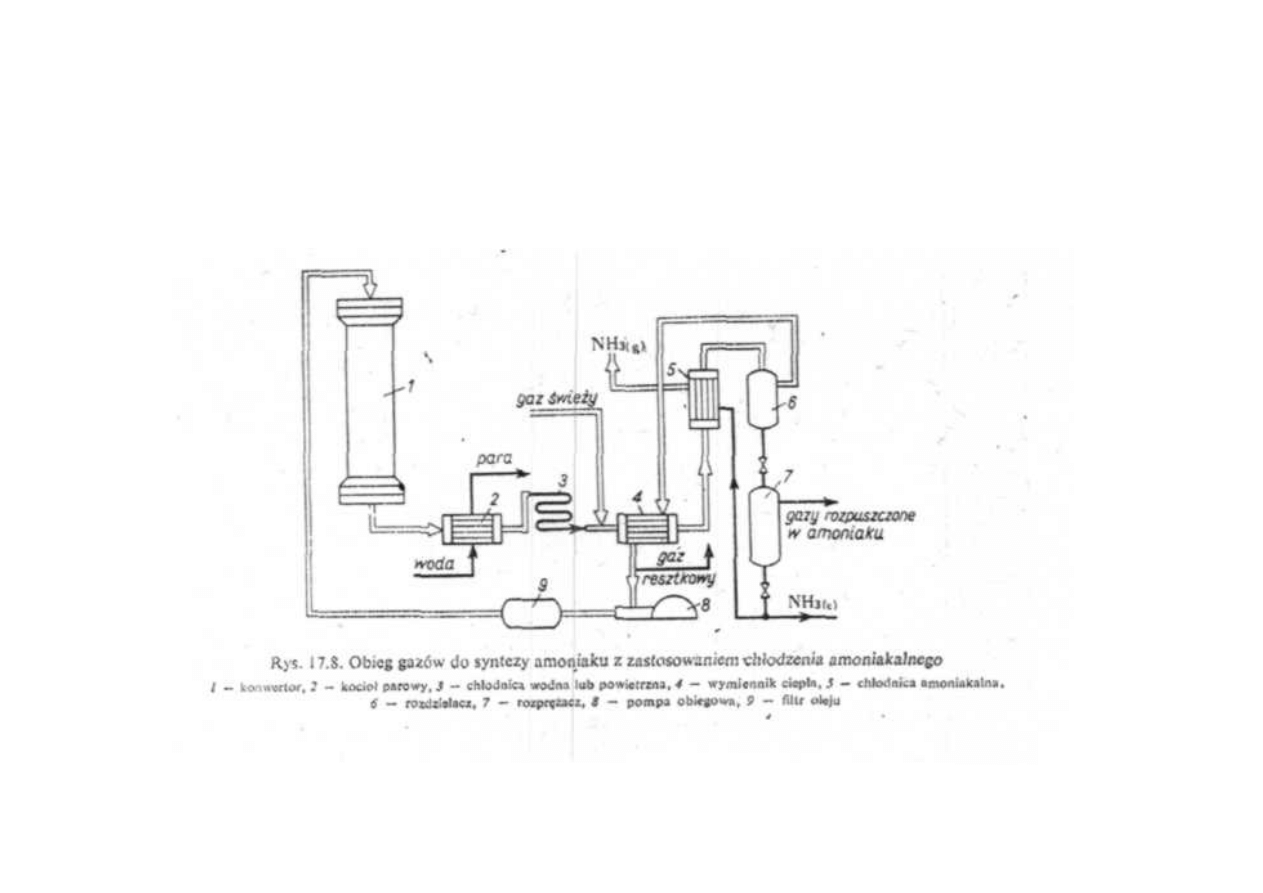
Synteza amoniaku
Obieg gazów do syntezy amoniaku
z zastosowaniem chłodzenia amoniakalnego
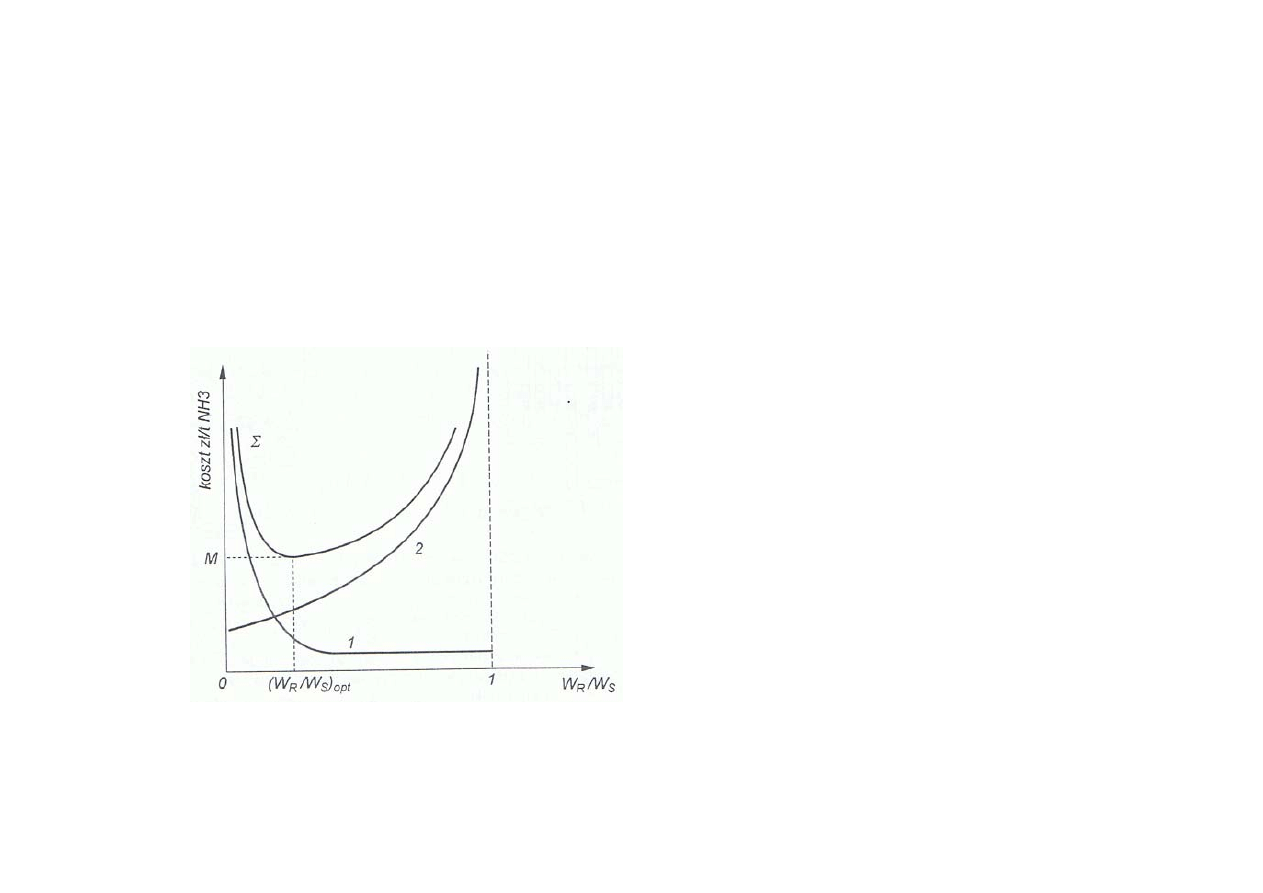
Synteza amoniaku
Wyznaczanie optymalnego strumienia gazu wydmuchowego
w układzie obiegu powrotnego
1 -
koszt amortyzacji reaktora
2 -
koszt surowca (gazu syntezowego)
Σ -
suma kosztów zmiennych (1 i 2),
które zależą od strumienia gazu
resztkowego
(W
R
/ W
S
)
opt
- optymalna wartość
stosunku natężeń
strumienia gazu wydmuchowego W
R
do strumienia gazu syntezowego W
S
doprowadzanego do układu
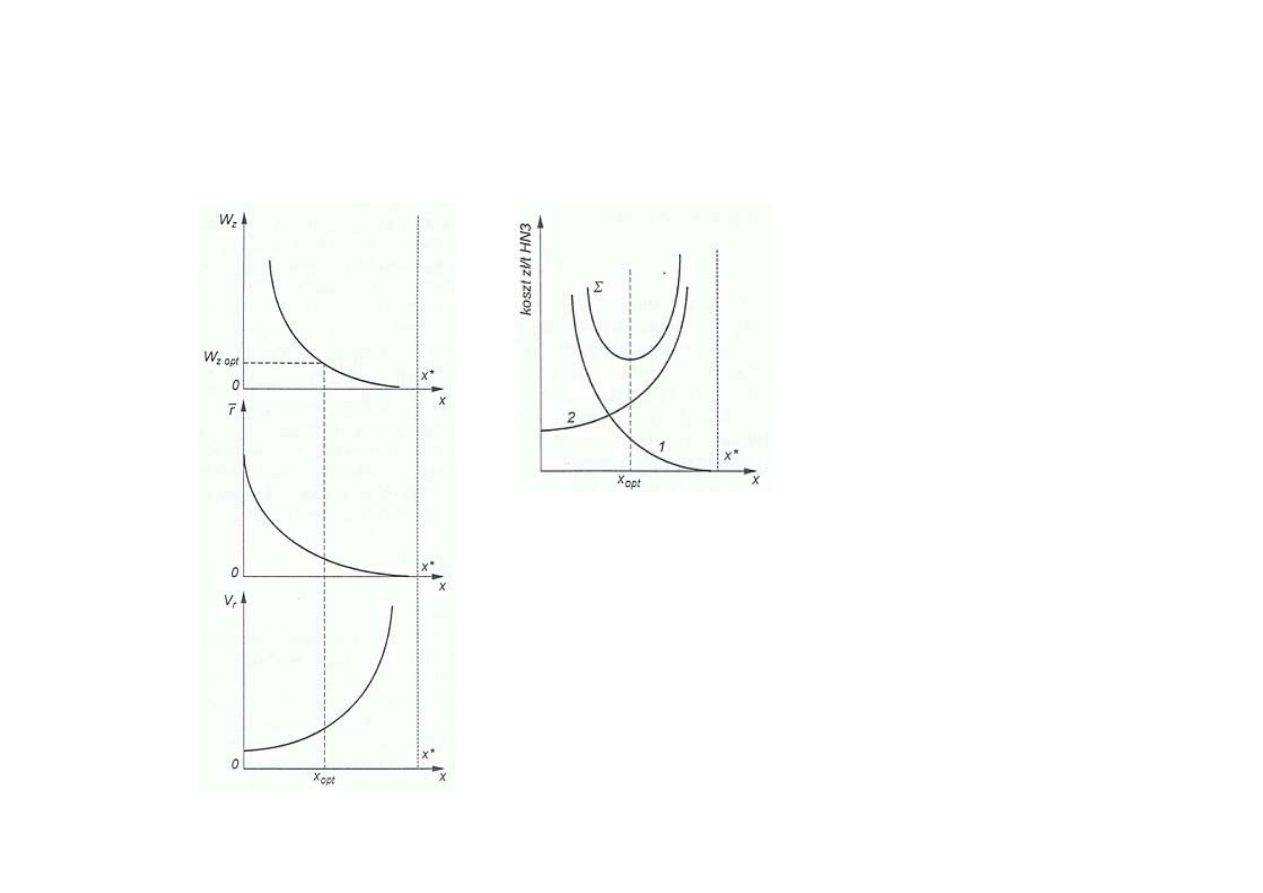
Synteza amoniaku
Wyznaczanie optymalnego stopnia przemiany x wodoru w amoniak
w układzie obiegu
powrotnego
x
*
-
równowagowy stopień przemiany
x
opt
- optymalny stopień przemiany
W
z opt
- optymalne natężenie powrotnego strumienia gazu W
z
r
- średnia szybkość reakcji
V
r
- objętość reaktora (złoża katalizatora)
1
- koszt przetłaczania gazu powrotnego (koszt energii,
amortyzacji pompy)
2
- koszt amortyzacji reaktora
Σ
-suma kosztów zmiennych (1 i 2)
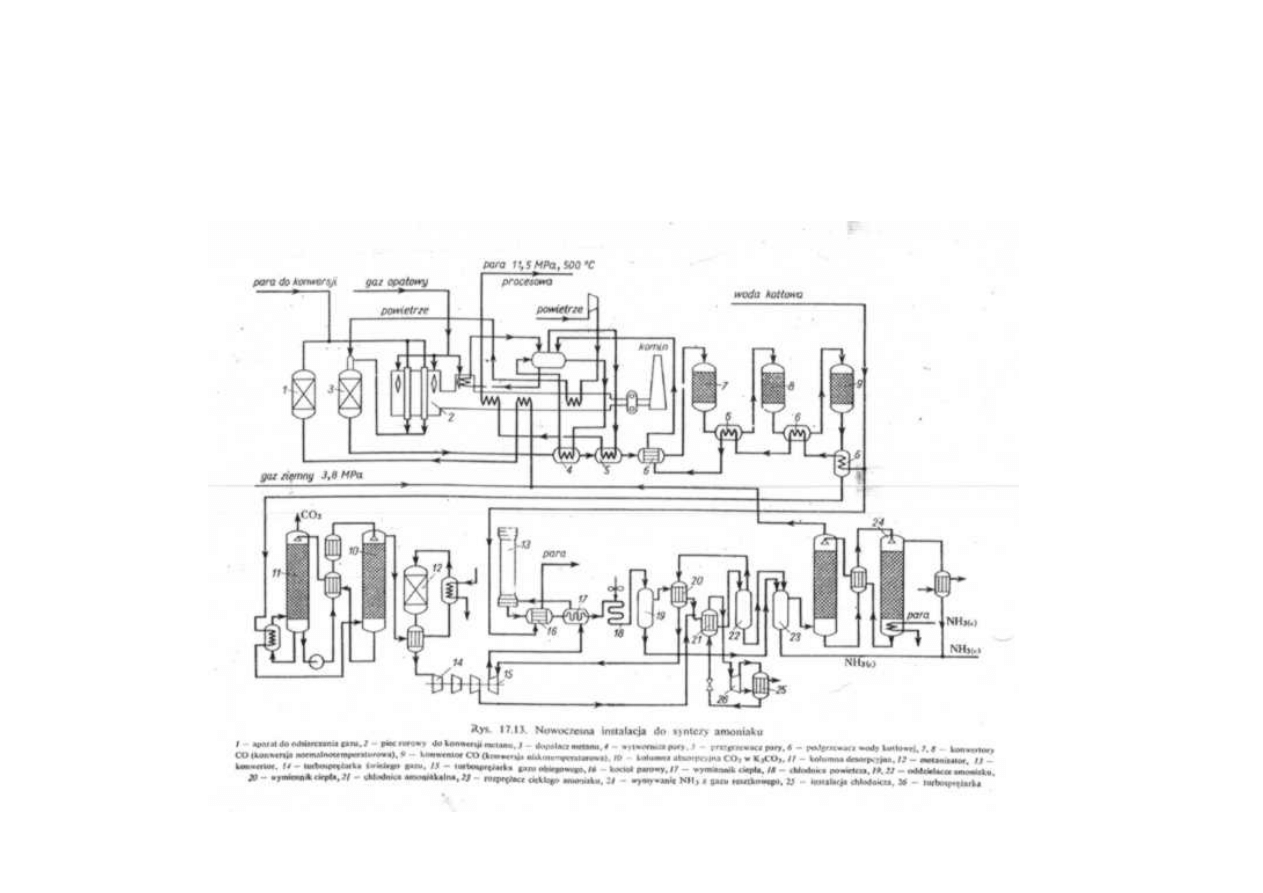
Synteza amoniaku
Instalacja do syntezy amoniaku

Synteza amoniaku
Schemat instalacji do syntezy amoniaku
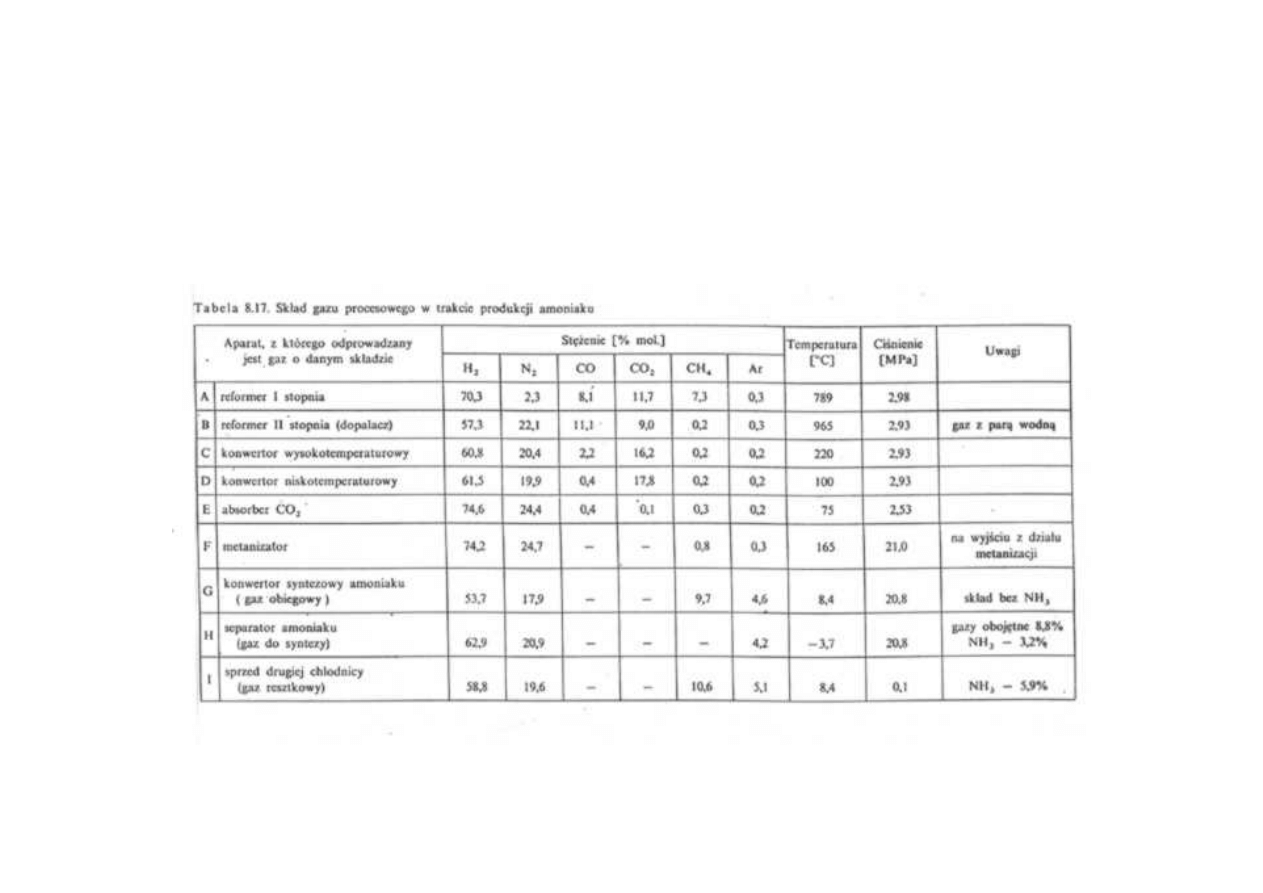
Synteza amoniaku
Skład gazu procesowego w trakcie produkcji amoniaku
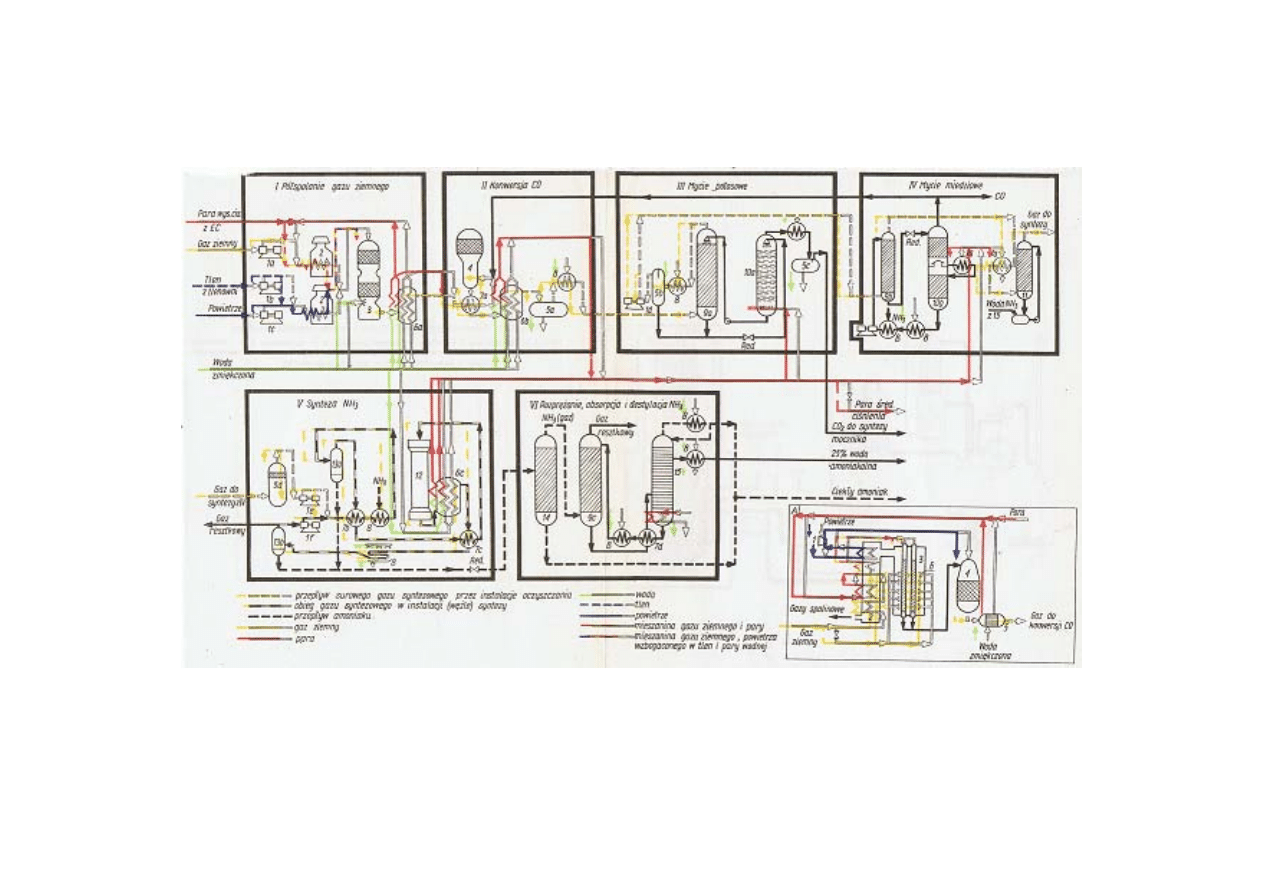
Schemat wytwórni amoniaku
a) schemat produkcji surowego gazu syntezowego
przez konwersję metanu z parą wodną (inny wariant węzła I)
1 – sprężarki, 2 – piece, 3 – reaktor półspalania, 4 – konwerter CO, 5 – oddzielacze, 6 – kotły
utylizery, 7 – wymienniki, 7a – podgrzewacze, 8 – chłodnica, 9 – kolumny absorpcyjne, 10 –
kolumny desorpcyjne, 11 – skruber, 12 – reaktor, 13 – separatory amoniaku, 14 – kolumna
rozprężająca, 15 – kolumna destylacyjna
a) 1 – turbosprężarka, 2 – komora spalin, 3 – piec rurowy, 4 – dopalacz, 5 – kocioł utylizer, 6 – palniki
opalane gazem ziemnym

Synteza amoniaku
konstrukcja reaktorów do syntezy amoniaku musi uwzględniać to, że
działają one pod wysokim ciśnieniem (10 – 30 MPa) w podwyższonej
temperaturze (400 – 500
0
C) oraz są narażone na korodujące działanie
czynników chemicznych (zjawisko tzw. korozji wodorowej)
dlatego do budowy reaktorów syntezy amoniaku stosuje się specjalne
stale stopowe odporne na korozję (18 % chromu, 8 % niklu, mniej niż
0,08 % węgla), a ściany naczynia ciśnieniowego chroni się przed
działaniem gazów o wysokiej temperaturze

Synteza amoniaku
należy stosować katalizatory o drobnym ziarnie, uzyskuje się wtedy
dużą szybkość reakcji, a objętość reaktora o określonej zdolności
produkcyjnej może być znacznie mniejsza niż przy użyciu grubego
ziarna
złoże katalizatora o drobnym ziarnie stwarza jednak duży opór
hydrauliczny - powstaje znaczna różnica ciśnień między wejściem i
wyjściem z reaktora, a konsekwencją tego jest znaczny wzrost energii
potrzebnej do przetłaczania strumienia gazu przez reaktor
reaktory, w których stosuje się drobne ziarno (1 – 3 mm) są tak
projektowane, aby ograniczyć opory hydrauliczne, jedną z takich
konstrukcji jest tzw. reaktor radialny, w którym długość drogi gazu
przez warstwę katalizatora została znacznie skrócona, a powierzchnia
przekroju złoża, przez który odbywa się ruch gazu jest wielokrotnie
większa niż w reaktorach o osiowym kierunku przepływu
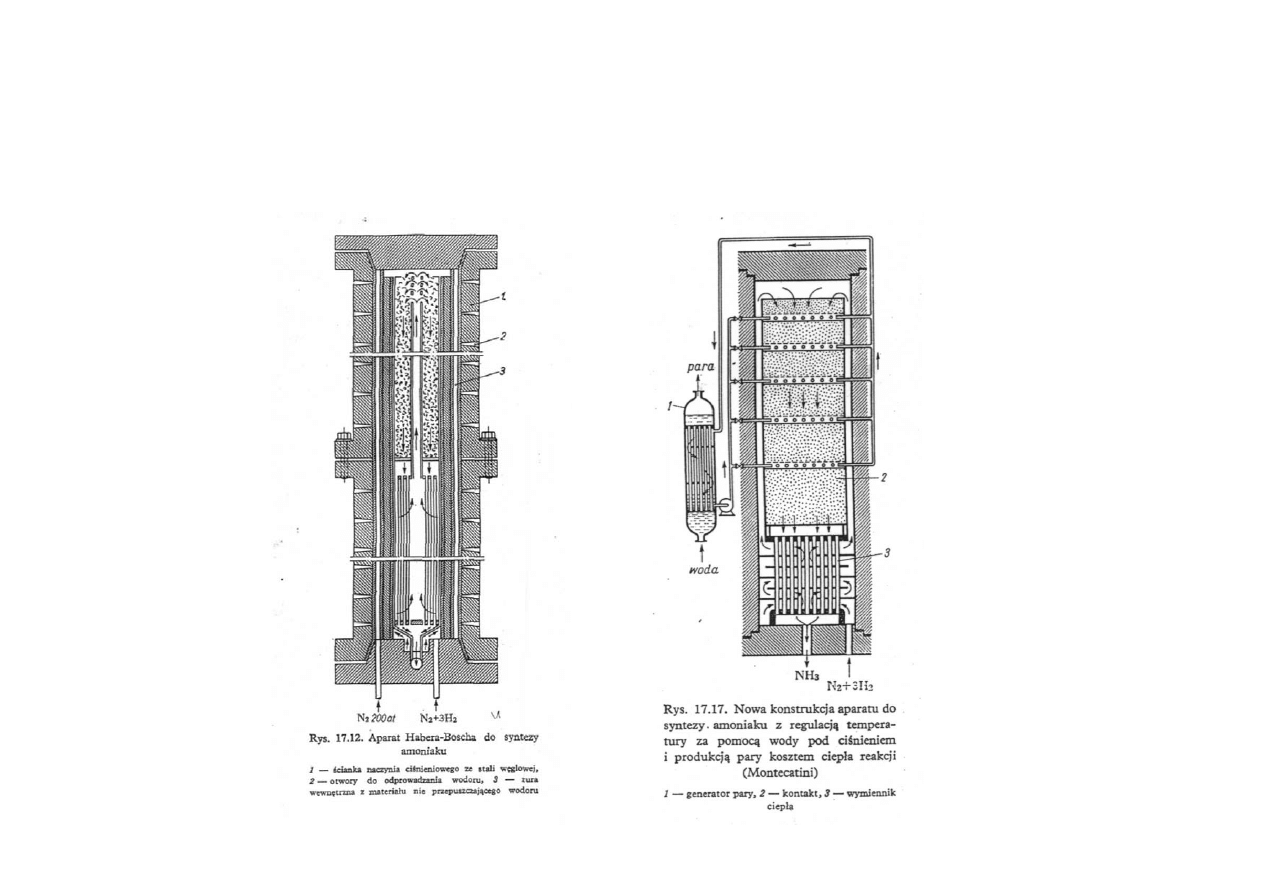
Synteza amoniaku
Aparaty do syntezy amoniaku
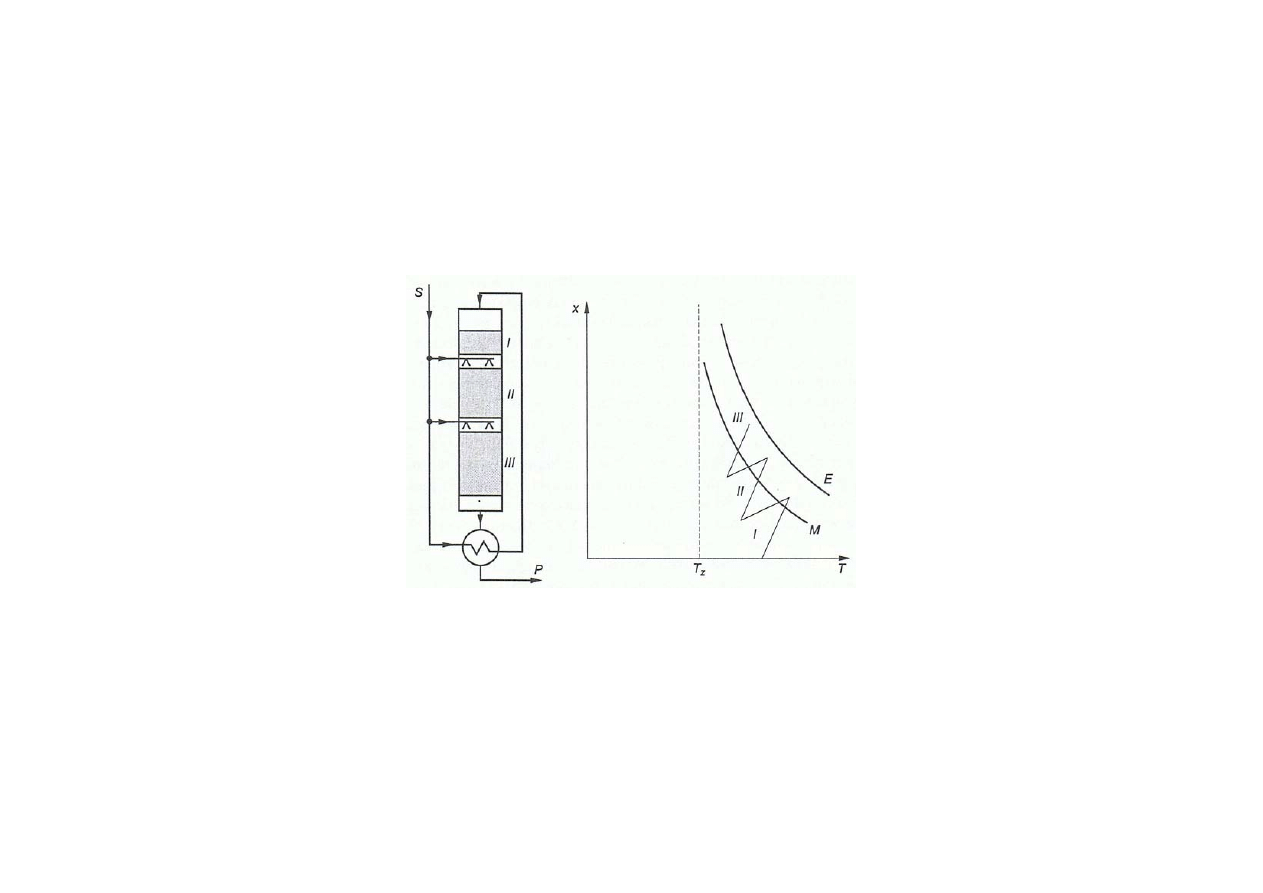
Synteza amoniaku
Zasada działania reaktora do syntezy amoniaku
o osiowym kierunku przepływu gazu z adiabatycznymi złożami katalizatora
i chłodzeniem za pomocą zimnego gazu syntezowego
zimny gaz syntezowy S wprowadzany przed złożem II i III
linia E równowagowego stopnia przemiany
optymalna linia operacyjna M
linie operacyjne I,II i III opisujące przebieg adiabatycznego procesu
w poszczególnych złożach katalizatora
T
z
– temperatura zapłonu
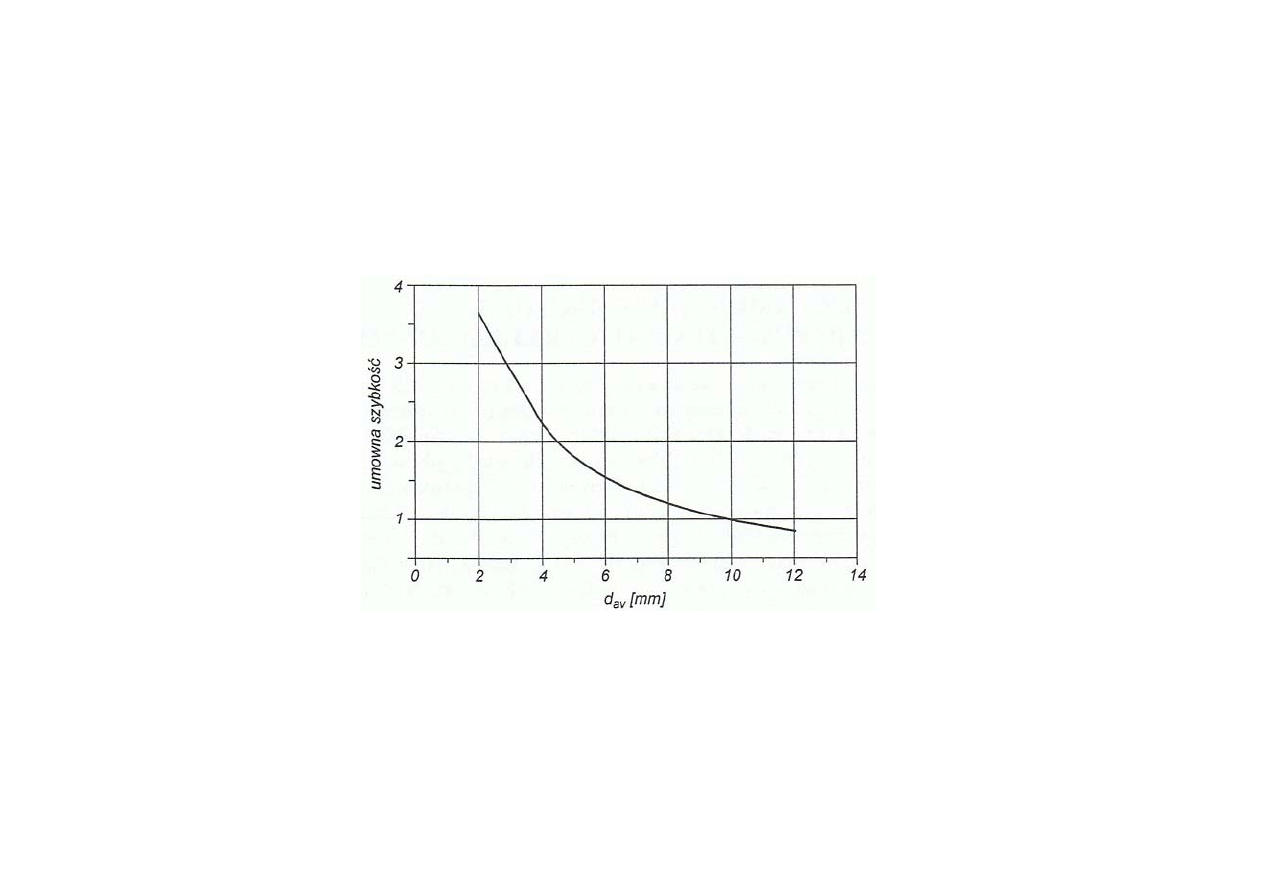
Synteza amoniaku
Zależność szybkości reakcji syntezy amoniaku w reaktorze przemysłowym
od przeciętnej średnicy d
av
ziarna katalizatora żelazowego
na osi pionowej odłożono względne wartości szybkości reakcji
w stosunku do szybkości przy d
av
= 10 mm)
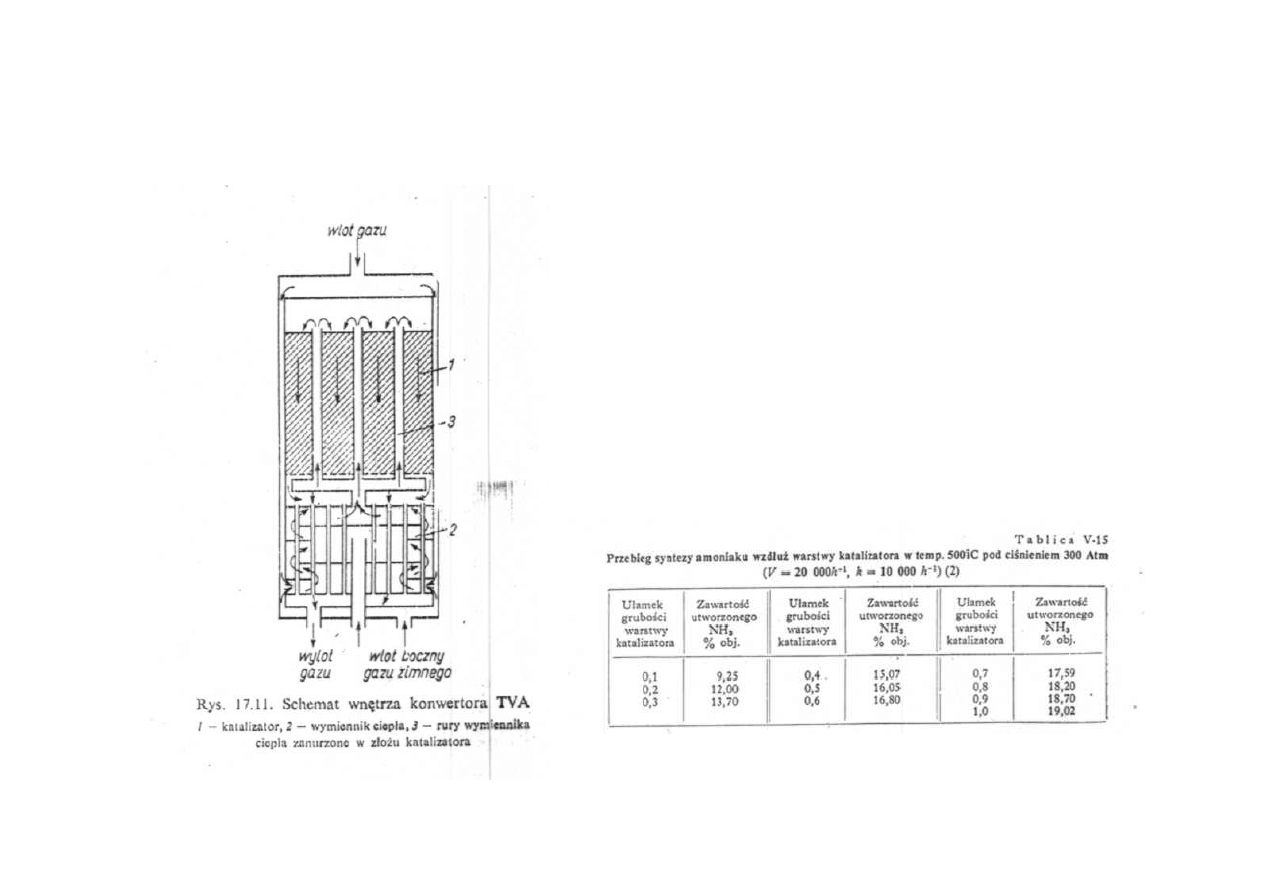
Synteza amoniaku
Schemat wnętrza konwertora TVA
Przebieg syntezy amoniaku
wzdłuż warstwy katalizatora
w temperaturze 500
o
C
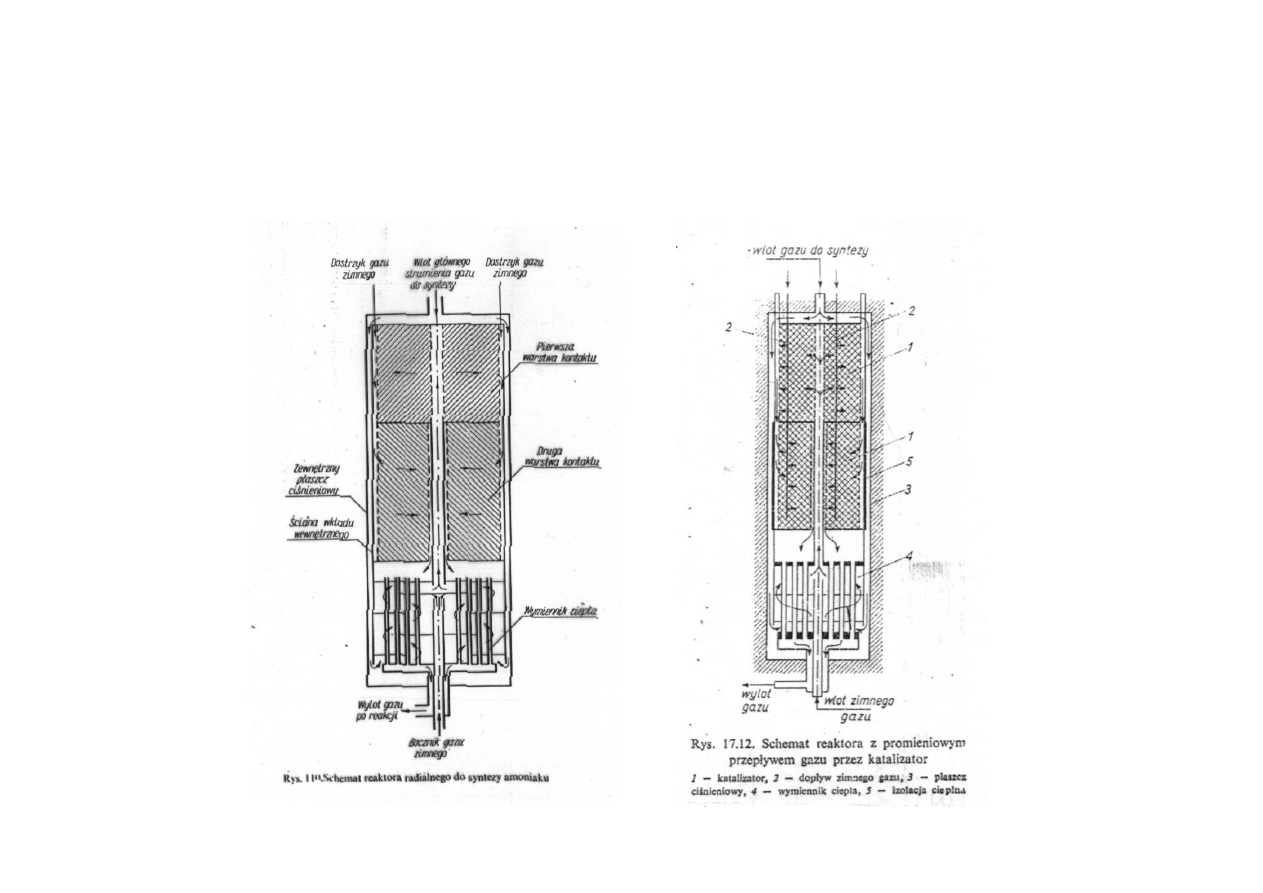
Synteza amoniaku
Reaktor do syntezy amoniaku
z promieniowym przepływem gazu przez katalizator

LITERATURA
•
Bortel E., Koneczny H. „Zarys technologii chemicznej” Wydawnictwo Naukowe
PWN Warszawa 1992
•
Kępiński J. „Technologia chemiczna nieorganiczna” Państwowe Wydawnictwo
Naukowe Warszawa 1984
•
Praca zbiorowa pod redakcją K. Schmidt-Szałowskiego „Podstawy technologii
chemicznej. Bilanse procesów technologicznych” Oficyna Wydawnicza
Politechniki Warszawskiej Warszawa 1997
•
K. Schmidt-Szałowski, J. Sentek „Podstawy technologii chemicznej. Organizacja
procesów produkcyjnych” Oficyna Wydawnicza Politechniki Warszawskiej
Warszawa 2001
•
Van den Berg P. J., de Jong W.A. „Introduction to Chemical Process
Technology” Delft University Press, D. Reidel Publishing Company, Delft 1980
•
Molenda J. „Technologia chemiczna” Wydawnictwa Szkolne i Pedagogiczne
Warszawa 1993
•
Koneczny H. „Podstawy technologii chemicznej” Państwowe Wydawnictwo
Naukowe Warszawa 1973
•
Praca zbiorowa „Technologia chemiczna nieorganiczna” Wydawnictwa
Naukowo – Techniczne Warszawa 1965
•
•
www.chemguide.co.uk
•
www.topsoe.com
Document Outline
- TECHNOLOGIA NIEORGANICZNA Przemysł azotowy Synteza amoniaku
- Przemysł azotowy
- Produkcja związków azotowych z amoniaku
- Synteza amoniaku
- Synteza amoniaku N2 + 3 H2 ↔ NH3 ∆ H = - 94 kJ/mol
- Synteza amoniaku
- Synteza amoniaku Wartości stałej równowagi syntezy amoniaku
- Synteza amoniaku Współczynniki ściśliwości c do wzoru pV = c RT dla mieszanin H2i i N2 w temperaturze 0 oC
- Synteza amoniaku Procentowa zawartość amoniaku w stanie równowagi dla mieszaniny stechiometrycznej
- Synteza amoniaku Zawartość amoniaku nad ciekłym amoniakiem w obecności stechiometrycznej mieszaniny wodoru i azotu
- Synteza amoniaku Zawartość amoniaku w stanie równowagi w różnych temperaturach i pod różnymi ciśnieniami
- Synteza amoniaku Wpływ temperatury i ciśnienia na wydajność reakcji syntezy NH3
- Synteza amoniaku
- Synteza amoniaku Wpływ temperatury i prędkości objętościowej przepływu gazu na stężenie NH3 w gazach poreakcyjnych
- Synteza amoniaku Ilość tworzącego się amoniaku w mieszaninie stechiometrycznej (w gramach na dm3 katalizatora i godzinę) w tem
- Synteza amoniaku
- Synteza amoniaku Optymalna temperatura prowadzenia syntezy NH3
- Synteza amoniaku Wpływ ciśnienia na ilość uzyskanego NH3 przy prędkości przepływu gazu 30 000 m3/m3 katalizatora w ciągu go
- Synteza amoniaku
- Synteza amoniaku
- Synteza amoniaku Wielkość powierzchni i aktywności katalizatorów żelaznych syntezy amoniaku
- Synteza amoniaku Wpływ domieszek na aktywność katalityczną żelaza w reakcji syntezy amoniaku
- Synteza amoniaku Właściwości niektórych katalizatorów
- Synteza amoniaku Wytwarzanie katalizatorów do syntezy amoniaku metodą TVA
- Synteza amoniaku Skład chemiczny katalizatorów do syntezy amoniaku
- Synteza amoniaku
- Synteza amoniaku Podział procesów opartych na gazie syntezowym
- Synteza amoniaku Schemat przerobu gazu syntezowego
- Synteza amoniaku Schemat ideowy syntezy amoniaku z metanu
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Schemat normalnotemperaturowej konwersji gazu wodnego z parą wodną
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku Porównanie właściwości różnych absorbentów CO2
- Synteza amoniaku Schemat instalacji do wymywania ditlenku węgla za pomocą roztworu węglanu potasu
- Synteza amoniaku Wymywanie CO z gazów do syntezy amoniaku przy użyciu amoniakalnego roztworu soli miedzi (I)
- Synteza amoniaku Otrzymywanie mieszaniny azotu i wodoru
- Synteza amoniaku
- Synteza amoniaku Równowagowy stopień przemiany wodoru w amoniak x” i optymalna linia operacyjna M wyznaczona dla katalizato
- Synteza amoniaku Uproszczony schemat układu technologicznego do syntezy amoniaku (układ obiegu powrotnego według Habera i Bo
- Synteza amoniaku Uproszczony schemat układu technologicznego do syntezy amoniaku (układ wielostopniowy Claude’a) - niestosow
- Synteza amoniaku
- Synteza amoniaku Schemat jednostki syntezy amoniaku w układzie obiegu zamkniętego
- Synteza amoniaku Wykres strumieniowy bilansu jednostki syntezy amoniaku w układzie obiegu zamkniętego
- Synteza amoniaku Obieg gazów do syntezy amoniaku z zastosowaniem chłodzenia amoniakalnego
- Synteza amoniaku Wyznaczanie optymalnego strumienia gazu wydmuchowego w układzie obiegu powrotnego
- Synteza amoniaku Wyznaczanie optymalnego stopnia przemiany x wodoru w amoniak w układzie obieg
- Synteza amoniaku Instalacja do syntezy amoniaku
- Synteza amoniaku Schemat instalacji do syntezy amoniaku
- Synteza amoniaku Skład gazu procesowego w trakcie produkcji amoniaku
- Schemat wytwórni amoniaku a) schemat produkcji surowego gazu syntezowego przez konwersję metanu z parą wodną (inny wariant w
- Synteza amoniaku
- Synteza amoniaku
- Synteza amoniaku Aparaty do syntezy amoniaku
- Synteza amoniaku Zasada działania reaktora do syntezy amoniaku o osiowym kierunku przepływu gazu z adiabatycznymi złożami ka
- Synteza amoniaku Zależność szybkości reakcji syntezy amoniaku w reaktorze przemysłowym od przeciętnej średnicy dav ziarna ka
- Synteza amoniaku
- Synteza amoniaku Reaktor do syntezy amoniaku z promieniowym przepływem gazu przez katalizator
- LITERATURA
Wyszukiwarka
Podobne podstrony:
Amoniaczki, Przepisy kulinarne
Amoniak można oznaczyć z krwi i moczu produkt rozkładu białek
35 Wytwarzanie amoniaku, kwasu Nieznany (2)
Synteza amoniaku
AMONIAK BEZWODNY
Amoniak, niezbędnik rolnika 2 lepszy, fizjologia zwierząt
AMONIAK2
Amoniaczki
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
Dezynfekcja za pomocą amoniaku ziarna zbóż przeznaczonego do fermentacji (ang )
amoniakalnych instalacji chłodniczych w zakładach przetwórstwa rolno spożywczego
1. Podział zwierząt za względu na mechanizm us uwania amoniaku, licencjat eksperyment
1-AMONIAK, Azot___N2
CIASTKA AMONIACZKI
PROCES PRODUKCJI AMONIAKU poprawiony, inż. BHP, V semestr
BEZPIECZEŃSTWA I HIGIENA PRACY PRZY INSTALACJACH AMONIAKALNYCH, Bezpieczeństwo i higiena pracy
Amoniak r r 9
AMONIAK BEZWODNY, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
bhp przy amoniakalnych instalacjach chłodniczych, 1 bhp w zakladach
więcej podobnych podstron