
Synteza amoniaku

Synteza amoniaku
Fritz Haber
(1868-1934)
Nagroda Nobla – 1918
(za opracowanie syntezy amoniaku z N
2
i H
2
)
Carl Bosch
(1874-1940)
Nagroda Nobla – 1931
(za rozwój technik wysokociśnieniowych w chemii)

Synteza amoniaku
H = -46.05 kJ/mol
3
2
2
NH
H
2
3
N
2
1
- Synteza amoniaku z pierwiastków opracowana przez Habera i
Boscha;
-
Pierwszą przemysłową instalację do produkcji amoniaku
uruchomiono w 1913 roku w zakładach BASF (Oppau,
Niemcy) o zdolności produkcyjnej 30 t/doba;
- Ponad 90% światowej produkcji amoniaku jest wykorzystywane
do produkcji nawozów sztucznych.

Synteza amoniaku - surowce
Wodór:
Uzyskiwany głównie z gazu syntezowego (H
2
+ CO). Tlenek węgla
usuwa się poprzez jego konwersję parą wodną:
CO + H
2
O CO
2
+ H
2
H = -41.2 kJ/mol
Stosuje się nadmiar pary wodnej ze względu na małą wartość stałej
równowagi. Pomimo, że ciśnienie nie wpływa na położenie równowagi
to stosuje się układy ciśnieniowe do 3 MPa (?)
konwersja normalnotemperaturowa (T = 300-
500°C):
- katalizatory tlenkowe: Fe
2
O
3
, Cr
2
O
3
promowane MgO lub/i CaO w celu
zwiększenia wytrzymałości mechanicznej;
-
katalizatory w formie pastylek, odporne na działanie związków siarki;
-
po konwersji gazu syntezowego pozostaje zwykle 2-3% CO.
konwersja niskotemperaturowa (T
200°C):
- katalizatory tlenkowe: Cr
2
O
3
-CuO;
-
Katalizatory wrażliwe na działanie na działanie związków siarki
(zatruwanie nieodwracalne);
-
po konwersji gazu syntezowego pozostaje zwykle poniżej 0.3% CO.

Synteza amoniaku - surowce
Wodór (cd):
Wymywanie CO
2
z gazu do syntezy:
CO
2
jest trucizną katalizatora do syntezy amoniaku;
CO
2
usuwa się metodą absorpcji fizycznej lub chemicznej z
zastosowaniem następujących absorbentów:
- woda, metanol (absorpcja fizyczna);
- roztwory etyloamin, woda amoniakalna, roztwory K
2
CO
3
(absorpcja
chemiczna).
K
2
CO
3
+ CO
2
+ H
2
O
2 KHCO
3
Absorpcję prowadzi się w wieżach z wypełnieniem. Regeneracja
absorbentów jest możliwa poprzez ich ogrzanie lub obniżenie
ciśnienia. Uzyskany w ten sposób dwutlenek węgla stosuje się do
produkcji suchego lodu, mocznika
lub sody.

Synteza amoniaku - surowce
Azot:
1)
Otrzymywany na drodze fizycznej – przez skraplanie i
rektyfikację powietrza;
2)
Otrzymywany na drodze chemicznej – przez związanie
tlenu w procesie wytwarzania gazu do syntezy.
Koszty otrzymania i przygotowania substratów do
syntezy amoniaku sięgają nawet 75% jego ceny.
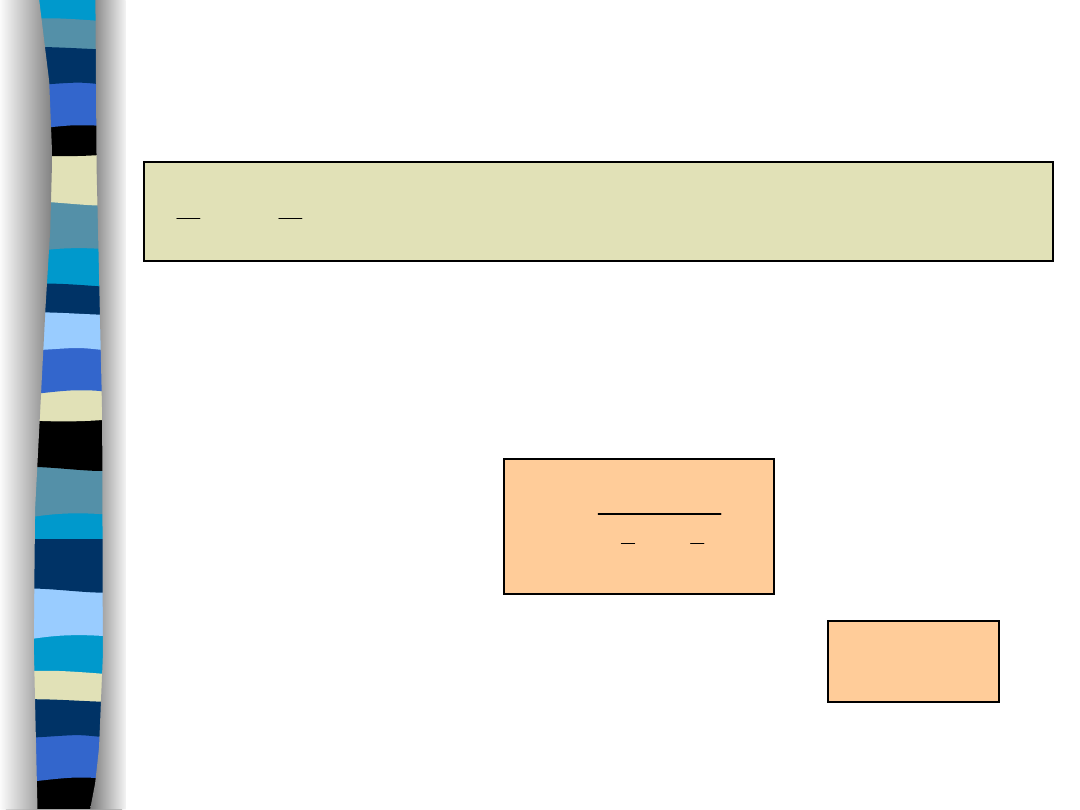
Synteza amoniaku – termodynamika
procesu
H = -46.05 kJ/mol
3
2
2
NH
H
2
3
N
2
1
-
Proces egzotermiczny -
uprzywilejowany w niskich
temperaturach
;
- Reakcja ze zmniejszeniem objętości –
uprzywilejowana przy
wysokich ciśnieniach
;
2
3
H
2
1
N
NH
p
2
2
3
p
p
p
K
Stała równowagi:
Zmodyfikowane równanie stanu gazowego:
pV
= cRT
c – współczynnik ściśliwości
1.0 (5 MPa) - 2.1 (100 MPa)
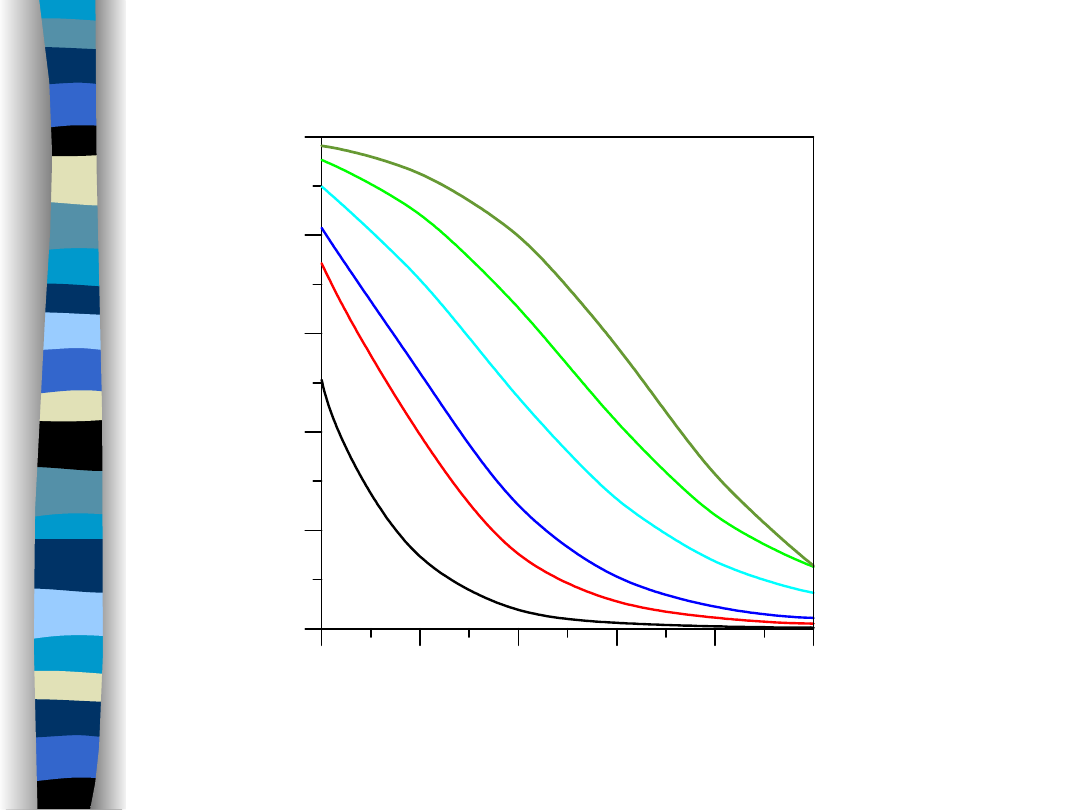
Synteza amoniaku – termodynamika
procesu
Procentowa zawartość amoniaku w stanie równowagi dla mieszaniny stechiometrycznej
2 0 0
3 0 0
4 0 0
5 0 0
6 0 0
7 0 0
T e m p e r a tu r a [° C ]
0
2 0
4 0
6 0
8 0
1 0 0
Z
aw
ar
to
ść
N
H
3
w
s
ta
ni
e
ró
w
no
w
ag
i [
%
]
1 M P a
5 M P a
1 0 M P a
3 0 M P a
6 0 M P a
1 0 0 M P a

Synteza amoniaku – parametry procesu
1) Instalacje niskociśnieniowe (8-10 MPa);
2) Instalacje średniociśnieniowe (20-30 MPa);
3) Instalacje wysokociśnieniowe (70-100 MPa):
T = 400-500°C
H
2
/N
2
~3
SV = 35000 h
-1
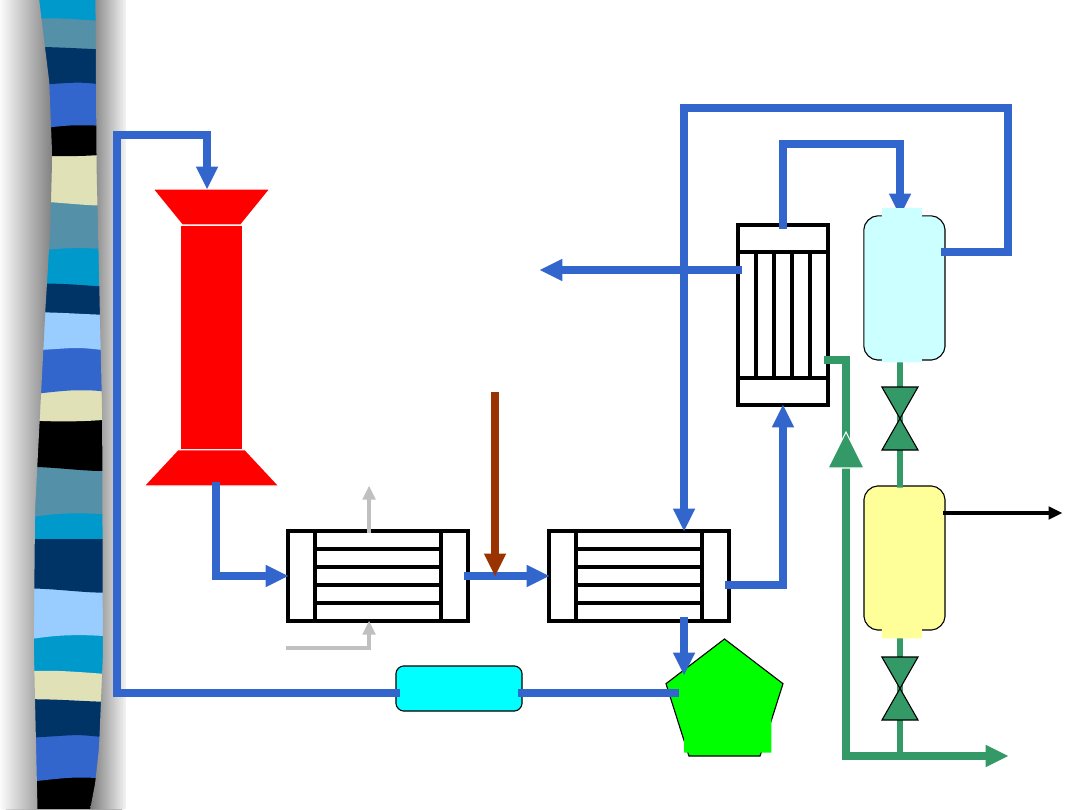
Synteza amoniaku - aparatura
woda
para wodna
gaz do syntezy
ro
zd
zie
la
cz
ro
zp
rę
ża
cz
pom
pa
filtr oleju
R
E
A
K
T
O
R
amoniak (c)
gazy
rozpuszczone
w
amoniaku
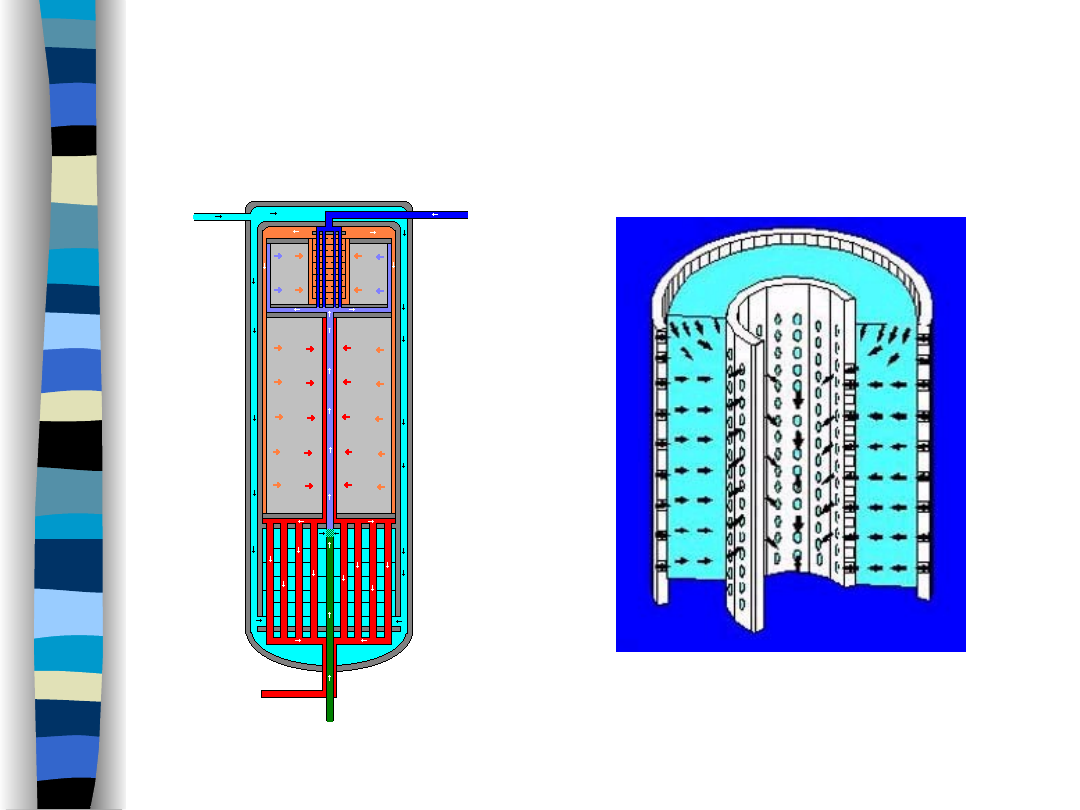
Synteza amoniaku – reaktory z radialnym
przepływem reagentów

Produkcja amoniaku: 1500
ton/dzień;
Wsad katalizatora: 250 ton
Konwerter amoniaku z radialnym przepływem reagentów
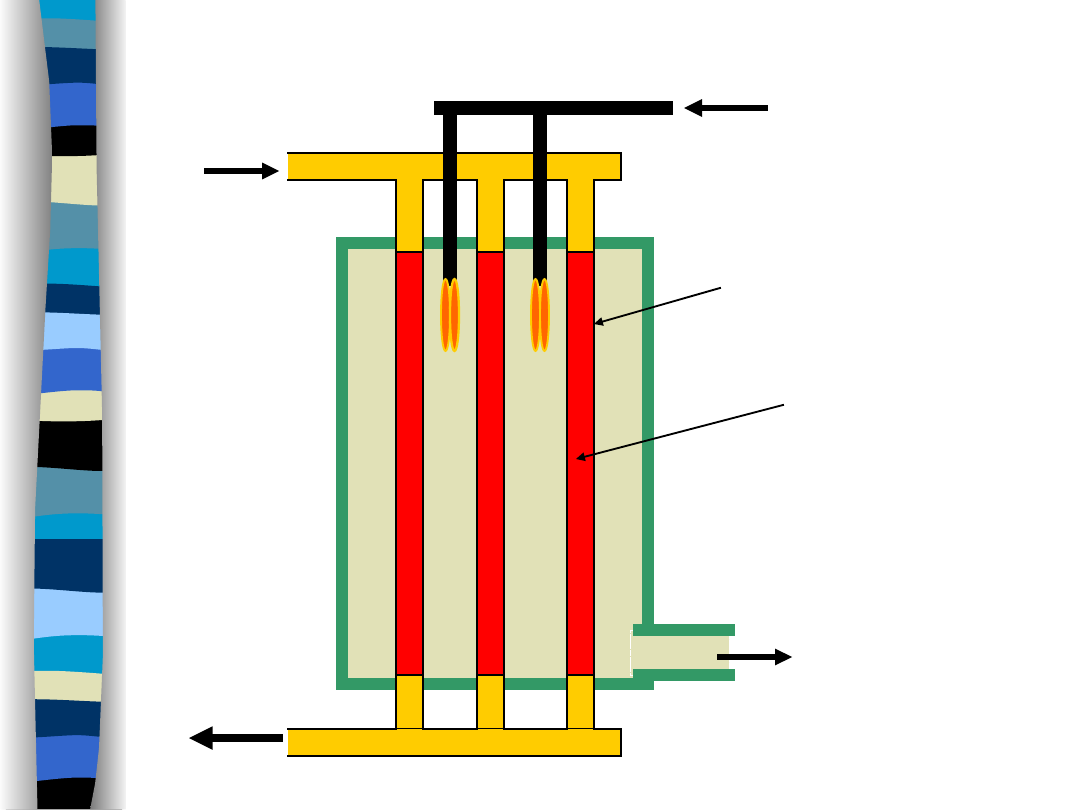
Synteza amoniaku- reaktory wielorurowe
Spaliny
do kotła
parowego
Gaz opałowy i powietrze
Katalizator
N
2
+ H
2
z wymiennika ciepła
NH
3
(+substraty)
do wymiennika ciepła
Konwerter 35MPa:
D~1 m
L~ 20 m
grubość ścianki = 75 mm

Synteza amoniaku- reaktory wielorurowe

Katalizatory procesu syntezy amoniaku -
wymagania
1. Wysoka aktywność w jak najniższej temperaturze (względy
termodynamiczne);
2. Duża odporność na zanieczyszczenia obecne z strumieniu
reagentów (O
2
, związki chloru etc.);
3. Długi czas „życia” katalizatora – wynikający ze znacznej
odporności termicznej oraz odporności na zatruwanie;
4. Duża wytrzymałość mechaniczna (proces wysokociśnieniowy);
5. Jak najtańsza synteza katalizatora oraz dostępność surowców
do jego preparatyki.
Katalizatory procesu syntezy amoniaku
Katalizator żelazowy (BASF)
wpływ przebadanych dodatków:
pozytywny:
Al, Ba, Be, Ca, Ce, Cr, Er, K, La, Li, Mg, Mn, Mo,
Na, Nb, Nd, Rb, Sm, Sr, Ta, Th, Ti, U, V, W, Y, Zr
negatywny:
As, B, Bi, Br, C, Cd, Cl, F, J, P, Pb, S, Sb, Sn, Te,
Tl, Zn

Skład katalizatorów komercyjnych
Typ
katalizatora
Fe
FeO
Fe
2
O
3
Al
2
O
3
Mg
O
SiO
2
CaO
K
2
O
inne
Rozmia
r ziaren
.% wag
mm
1
68.
6
36.07
57.85
3.3
0
0.0
9
0.7
5
2.13
1.13
–
2–4
2 normal
60.
0
32.91
60.18
2.9
0
0.3
7
0.3
5
2.80
0.54
–
4–10
2
68.
2
31.30
62.53
2.9
0
0.3
0
0.3
5
1.65
0.97
–
6–10
2 HT
66.
9
32.47
59.18
2.9
5
1.5
5
0.4
0
2.95
0.50
–
6–10
3
71.
3
39.22
58.2
1.8
0
0.1
8
0.2
7
1.43
0.89
–
2–4
4
66.
3
22.27
49.0
0.5
9
4.4
7
0.7
7
0.65
0.50
0.7 Cr
2
O
3
5
71.
5
33.0
65.5
2.9
6
1.5
5
–
0.20
0.01
–
6 (1964)
69.
5
23.85
3.1
5
0.2
6
0.4
0
1.85
1.10
–
3–9
8
68.
4
35.35
3.1
6
0.5
6
0.5
0
3.54
0.58
–
2–4
9
70.
0
32.14
3.1
7
0.2
8
0.1
0
2.40
0.32
–
2–4
10
70.
8
33.62
1.5
8
0.2
8
1.1
4
0.67
1.57
–
2–4
11 normal
(1964)
66.
7
35.95
56.97
3.2
7
0.6
7
0.5
5
3.00
0.65
–
11 (1966)
68.
2
38.70
54.60
2.4
2
0.3
5
0.6
4
2.85
0.58
–
11 (1966)
69.
5
38.20
56.70
2.3
4
0.3
5
0.5
7
1.85
0.57
–
11 HT
66.
3
38.22
52.38
2.9
4
3.5
6
0.3
0
2.66
0.63
–

Skład katalizatorów komercyjnych
Faza aktywna: Fe
3
O
4
(magnetyt)
Promotory strukturalne: Al
2
O
3
(wpływa na wzrost
powierzchni właściwej katalizatora oraz zwiększa jego
wytrzymałość termiczną);
Promotory elektronowe: tlenki metali alkalicznych –
zwiększają aktywność katalizatora (niestety obniżają
jego powierzchnię właściwą oraz stabilność termiczną).

Synteza amoniaku – preredukcja katalizatora
Redukcja mieszaniną H
2
/N
2
;
Woda powstająca w wyniku redukcji nie może reagować
z katalizatorem (rekrystalizacja) dlatego SV = 5000 –
15000 h
-1
;
Procesy nisko i średniociśnieniowe: T = 340-390°C, P =
7-12 MPa;
Procesy wysokociśnieniowe: T > 440°C, P = 25-30 MPa
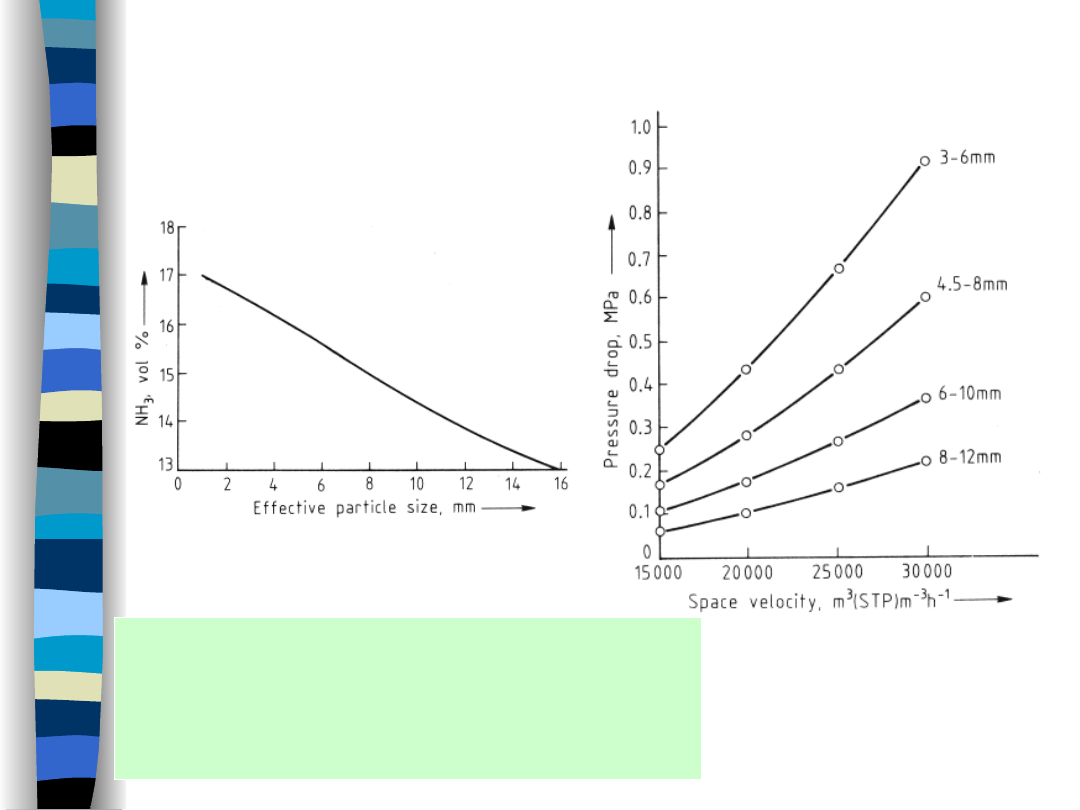
Synteza amoniaku- ziarna katalizatora
25 MPa; SV = 12 000 h
-1
(STP)
D=7 m; P=27.1 MPa; T= 450 °C
Dla ciśnień w zakresie 25 – 45 MPa (250 – 450 bar)
i SV w przedziale 8000 – 20 000 h
-1
(STP)
zwykle stosuje się ziarna katalizatora o średnicy 6 – 10 mm .

Mechanizm syntezy amoniaku
H
2
+* 2 H
ad
(1)
N
2
+* N
2,ad
(2)
N
2,ad
2 N
ad
(3)
N
ad
+H
ad
NH
ad
(4)
NH
ad
+H
ad
NH
2,ad
(5)
NH
2,ad
+H
ad
NH
3,ad
(6)
NH
3,ad
NH
3
+*
(7)

Synteza amoniaku
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
06 Podstawy syntezy polimerówid 6357 ppt
8a Syntezy prostych aminokwasów
Wykład VIII Synteza układów sekwencyjnych
02 Metody syntezy organicznej VI s1id 3675
Ćwiczenia usprawniające analizę i syntezę wzrokową oraz orientację przestrzenną(1), Ćwiczenia uspraw
Zastosowanie enzymow w syntezie- wyniki, PWR, III semestr
Amoniaczki, Przepisy kulinarne
Amoniak można oznaczyć z krwi i moczu produkt rozkładu białek
d4 synteza aztreonamu
Synteza jodku ołowiu sprawozdanie
kwasy i pochodne Synteza kwasu?etylosalicylowego1
NANOC W Nano Wyklad 05 Synteza Metodami Chemicznymi II (1)
Synteza Zach Organizacyjne 2010
Syntezy alkenów i alkinów przykłady zadań, Chemia, Organiczna
Prawo+cywilne+-+synteza, DSFIR 1 rok, prawo cywilne i handlowe
Budowa chemiczna i synteza lopo Nieznany
GAZ SYNTEZOWY 2009
więcej podobnych podstron