
Ćwiczenie nr 3
WPROWADZENIE DO CHEMII ANALITYCZNEJ.
PODSTAWY TEORETYCZNE ANALIZY JAKOŚCIOWEJ
I ILOŚCIOWEJ. PODZIAŁ METOD ANALITYCZNYCH.
ZAGADNIENIA OGÓLNOANALITYCZNE.
Zadania i rola chemii analitycznej
Chemia analityczna, w nowoczesnym ujęciu, jest nauką stosowaną, zajmującą się
odkrywaniem i formułowaniem praw, kryteriów i metod umożliwiających ustalenie z
określoną czułością, precyzją i dokładnością jakościowego i ilościowego składu obiektów
materialnych.
Z tej definicji wynika podwójny charakter chemii analitycznej, praktyczny — ustalenie
składu obiektów materialnych, i podstawowy—badania powiązane z opracowaniem nowych
metod i ich oceną.
Z koniecznością ustalenia składu różnych substancji spotykamy się przede wszystkim w
naukach przyrodniczych i technicznych, nie tylko w chemii, ale i geologii, budownictwie,
biologii, ochronie środowiska i medycynie. Z tego względu chemia analityczna, podobnie jak
niektóre inne dziedziny współczesnej nauki, ulegała gruntownym przeobrażeniom.
Początkowo była ona jedną z typowych nauk chemicznych pod względem badanych
obiektów, metod którymi się posługiwała, jak i celów którym służyła. Sytuacja ta uległa
zasadniczej zmianie w ciągu ostatnich lat i obecnie chemia analityczna ma charakter
interdyscyplinarny i bardzo duży zakres zastosowań.
Nowoczesne i dobrze pracujące laboratoria analityczne z właściwym zapleczem
naukowym są podstawą m.in. kontroli surowców i produktów w przemyśle, w rolnictwie oraz
produktów żywnościowych, oceny i poszukiwania surowców mineralnych, oceny zagrożenia
środowiska i przebiegu procesów technologicznych oraz diagnostyki medycznej.
Podział analizy chemicznej
Analiza jakościowa i ilościowa
Analizą chemiczną nazywa się zespół czynności prowadzący do ustalenia składu
chemicznego, jakościowego i ilościowego badanej substancji. Analiza chemiczna jest
więc pojęciem węższym od chemii analitycznej, ponieważ dotyczy tylko praktycznego jej
charakteru, tj. ustalania składu przez stosowanie odpowiednich metod analitycznych.
Analiza chemiczna dzieli się na dwa zasadnicze działy: analizę jakościową i analizę
ilościową.
Zadaniem analizy jakościowej jest ustalenie, z jakich pierwiastków lub związków
chemicznych składa się dana substancja. Odpowiada więc ona na pytania:
„co się znajduje w badanej próbce?„
lub
„czy w badanej próbce występuje składnik mający z pewnych względów istotne
znaczenie?".

Analiza jakościowa, polegająca na kolejnym oddzielaniu grup jonów za pomocą
odczynników grupowych i wykrywaniu poszczególnych jonów danej grupy po
oddzieleniu jonów przeszkadzających, ma duże znaczenie dydaktyczne, ponieważ uczy
poznawać właściwości związków nieorganicznych. Praktyczne jednak zastosowanie w
analizie jakościowej mają na ogól metody specyficzne, umożliwiające wykrycie
zanieczyszczeń bez konieczności oddzielania. Stosuje się do tego celu specyficzne,
bardzo czułe, reakcje analityczne z zastosowaniem przeważnie odczynników
organicznych, lub odpowiednie metody instrumentalne, umożliwiające nie tylko
wykrycie, lecz także orientacyjne (półilościowe) określenie ilości szukanego składnika.
Zadaniem analizy ilościowej jest ustalenie składu ilościowego substancji, tj.
zawartości (ilości) poszczególnych składników. Analiza ilościowa ma bez porównania
większe praktyczne znaczenie niż analiza jakościowa.
Analiza klasyczna i instrumentalna
Kryterium podziału na analizę klasyczną i instrumentalną jest rodzaj stosowanej
metody. Metody stosowane w analizie klasycznej to metody chemiczne, oparte na
reakcjach chemicznych, głównie analiza wagowa i miareczkowa. W metodach
stosowanych w analizie instrumentalnej są wykorzystywane zjawiska fizyczne lub
fizykochemiczne i odpowiednia aparatura pomiarowa. Podział na analizę klasyczną i
instrumentalną na obecnym etapie rozwoju analizy chemicznej nie jest właściwy,
ponieważ wyrabia u jej adeptów przekonanie, że istnieją dwa odrębne rodzaje analizy, a
nie jedna analiza ilościowa, stosująca w zależności od potrzeb metody chemiczne lub
instrumentalne, lub też połączenie tych metod. Właściwy jest więc podział na metody
chemiczne i instrumentalne, które wzajemnie się uzupełniają i przenikają. Podział na
analizę klasyczną i instrumentalną jest jednak w świadomości wielu chemików-
analityków utrwalony przez historię rozwoju współczesnej analizy. Należy podkreślić
nieprecyzyjność określenia „klasyczna", przez które rozumie się ogólnie metody
stosowane od dawna, np. polarografię zmiennoprądową zalicza się do nowych technik
polarograficznych, ale polarografię sinusoidalną do klasycznych, ponieważ jest najstarszą
odmianą polarografii zmiennoprądowej.
Podział metod analitycznych na chemiczne i instrumentalne
Metody chemiczne są to metody oparte na zjawiskach chemicznych, w których
sygnał analityczny uzyskuje się w wyniku reakcji chemicznej. Typowym sygnałem
analitycznym w metodzie wagowej jest masa otrzymanego osadu, a w analizie
miareczkowej objętość roztworu mianowanego zużytego do miareczkowania. Metody
instrumentalne są to metody oparte na zjawiskach fizycznych lub fizykochemicznych, w
których sygnał analityczny uzyskuje się za pomocą aparatury o różnym stopniu
złożoności. Do wykonania analizy metodą instrumentalną zawsze konieczny jest mniej
lub bardziej skomplikowany aparat i dlatego metody te nazywa się metodami
instrumentalnymi. Nie jest to ścisła podstawa podziału, ponieważ do wykonania analizy
metodą wagową lub do przygotowania płynów mianowanych w metodach
miareczkowych konieczna jest waga analityczna, będąca aparatem fizycznym. Na ogół
jednak w metodach chemicznych, poza wagą analityczną, aparatura nie jest używana,
dlatego pojęcie metod instrumentalnych odnosi się do takich metod, które wymagają
specjalnej aparatury. W metodach instrumentalnych wykorzystuje się zależność
mierzonych wielkości fizycznych lub fizykochemicznych od zawartości (stężenia)
oznaczanego składnika w badanej próbce. Na przykład wielkość absorpcji
promieniowania przez daną substancję zależy od stężenia tej substancji w roztworze.
Można więc na podstawie wielkości absorpcji wyznaczyć zawartość danego składnika.

Analiza nieorganiczna i organiczna
Zależnie od badanego materiału analizę dzieli się na nieorganiczną (wykrywanie i
oznaczanie składników nieorganicznych) i organiczną (wykrywanie i oznaczanie
składników organicznych). Analiza nieorganiczna ma zwykle charakter analizy
pierwiastkowej (wykrywanie lub oznaczanie pierwiastków wchodzących w skład próbki)
lub analizy związków (identyfikacja i oznaczenie określonych związków chemicznych).
Analiza organiczna także dotyczy pierwiastków, ale oprócz tego położony jest w niej
nacisk na identyfikację związków chemicznych. Na wykrywaniu i oznaczaniu
poszczególnych pierwiastków w związkach organicznych polega analiza elementarna.
Pierwiastkami najczęściej oznaczanymi w analizie elementarnej związków organicznych
są: węgiel, wodór, azot, siarka, tlen, fosfor i chlorowce. Oznaczenie węgla, wodoru, azotu
polega na spaleniu substancji organicznych w specjalnych piecach i obliczeniu na
podstawie ilości powstałego CO
2
i H
2
O procentowej zawartości węgla i wodoru w
badanym związku. Azot oznacza się osobno, zbierając wolny azot w eudiometrze i
mierząc jego objętość. Obecnie rozwija się analiza elementarna automatyczna, która w
przypadku jednoczesnego oznaczania węgla, wodoru i azotu polega na błyskawicznym
spaleniu próbki, rozdzieleniu gazowych produktów i oznaczeniu dwutlenku węgla, wody i
azotu termokonduktometrycznie. Analizę elementarną wykonuje się najczęściej metodą
miligramową (mikroanaliza). W analizie związków organicznych prowadzi się także
identyfikację i oznaczanie grup funkcyjnych (atom lub grupa atomów, które zastępują
atom wodoru przy atomie węgla i nadają związkowi organicznemu odpowiedni charakter,
zmieniając zasadniczo jego właściwości w porównaniu z właściwościami odpowiedniego
węglowodoru), np. —Cl, —OH, —CHO, —COOH, —SH itd.
Przemysłowa analiza chemiczna
Przemysłowa analiza chemiczna ma na celu kontrolę produkcji. Zajmuje się badaniem
surowców, półproduktów i gotowych produktów oraz materiałów pomocniczych i
odpadowych pod względem ich użyteczności i przydatności w przemyśle. Analiza
przemysłowa obejmuje wszystkie zagadnienia analityczne związane z danym procesem
technologicznym w całym jego przebiegu lub z daną branżą przemysłową. Analiza
przemysłowa obejmuje więcej zagadnień niż tradycyjna analiza techniczna, która
zajmowała się głównie analizą surowców i produktów przemysłowych. Nie można
wprowadzić merytorycznego podziału stosowanych metod analitycznych w zależności od
branż przemysłowych. Prawie w każdej dziedzinie przemysłu są stosowane różne metody
analityczne. Jednak dla niektórych gałęzi przemysłu są charakterystyczne pewne zadania
analityczne i stosowane metody, np. w przemyśle spożywczym — oznaczanie śladowych
ilości toksycznych składników, przemysł petrochemiczny — analiza mieszanin lekkich
węglowodorów przede wszystkim metodami chromatografii gazowej i spektrofotometrii
w podczerwieni .Z tego względu należałoby każdą branżę przemysłową omawiać
oddzielnie, z uwzględnieniem jej odrębności. W przemysłowej analizie chemicznej
występują jednak pewne ogólne zagadnienia wspólne różnym branżom przemysłowym.
Dotyczą one zadań i odpowiedzialności kontroli jakości, jej współpracy z innymi
jednostkami organizacyjnymi w zakładzie, roli i zadań laboratorium analitycznego w
zakładzie przemysłowym oraz jego projektowania i urządzenia. Do innych, ogólnych
zagadnień analitycznych można zaliczyć pobieranie próbek i kryteria wyboru metody
analitycznej.

Największą grupę laboratoriów analitycznych w przemyśle stanowią kontrolne
laboratoria zakładów przemysłowych, których główne zadania są następujące:
Ø ocena jakościowego i ilościowego składu surowców i półproduktów;
Ø kontrola międzyoperacyjna, umożliwiająca korygowanie przebiegu procesu
technologicznego i uzyskiwanie prawidłowych wydajności tego procesu;
Ø ocena produktów zakładu, która może jedynie gwarantować odpowiednią jakość
tych produktów i zgodność z obowiązującymi normami;
Ø ocena gazowych, ciekłych i stałych odpadów usuwanych z zakładu pod względem
strat ponoszonych przez zakład w wyniku niepełnego przerobu surowców;
Ø ocena ww. odpadów pod względem ich wpływu na zanieczyszczenie środowiska;
Ø ocena bezpieczeństwa i higieny pracy pracowników zakładu.
Ø Analitycy są niezbędni przy projektowaniu ciągłych systemów kontroli
analitycznej sprzęgniętych z ciągłymi procesami technologicznymi (analiza „on
line").
Ø Poprawa jakości produkcji przemysłowej, zwiększenie wydajności procesów
technologicznych, a także oszczędność materiałów zależą w przeważającej mierze
od dobrej międzyoperacjynej kontroli analitycznej.
Liczba analitycznych laboratoriów przemysłowych w Polsce jest oceniana na ok. 2000
Znajdują się one prawie we wszystkich zakładach produkcyjnych.
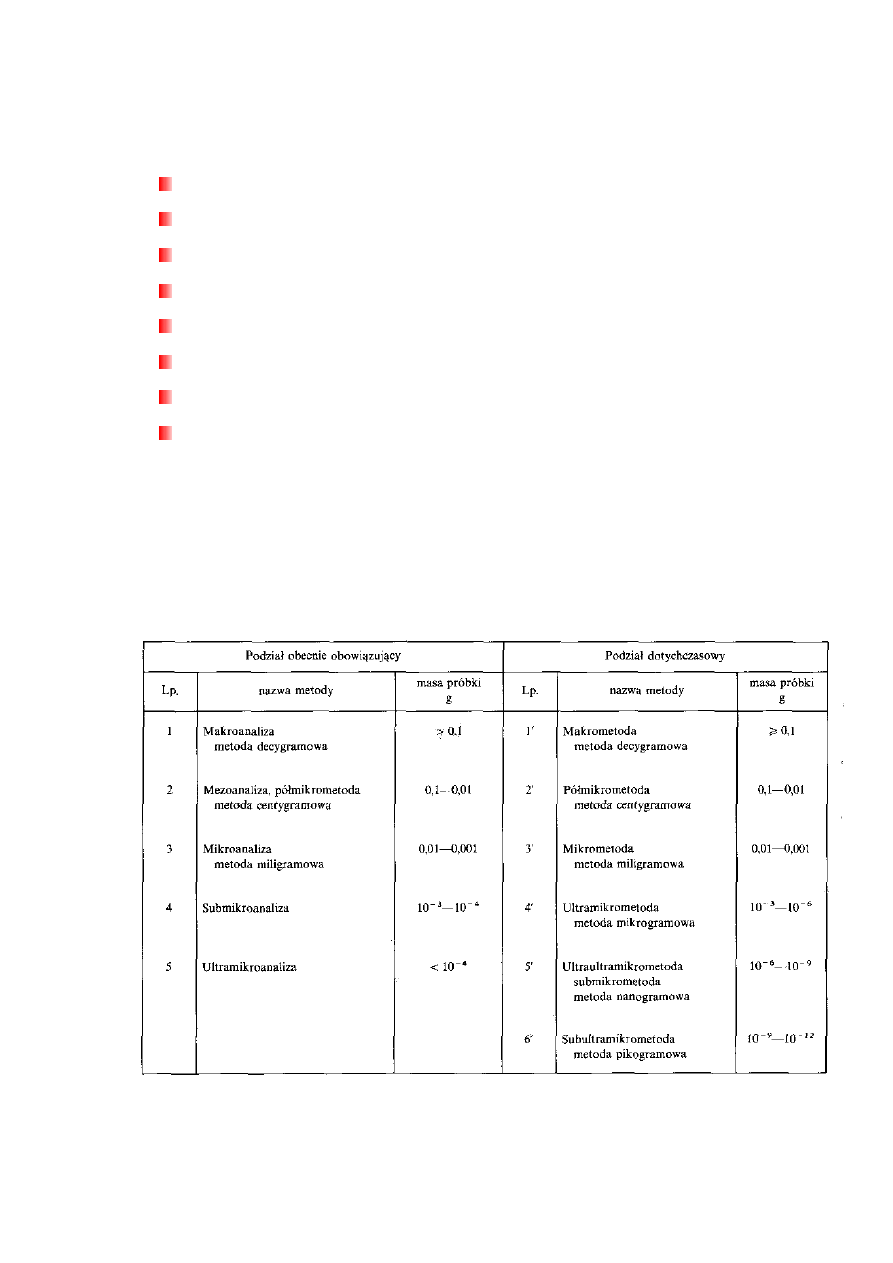
Podział metod analitycznych w zależności od wielkości próbki analitycznej
Masa próbki użytej do analizy (próbki analitycznej) jest podstawą podziału analizy,
zwanego skalą analizy lub skalą metod analitycznych. Jest to uporządkowany zbiór metod
według zmniejszającej się masy próbki. Określenie skala stosuje się również do
wyrażenia sposobu wykonania analizy, zależnego od wielkości próbki.
Podział metod:
Jeżeli masa próbki jest nieograniczona (zwykle od 0,1 do 1 g), to stosuje się
analizę w skali makro.
W przypadku próbek o masie 0,1—0,01 g mamy do czynienia z metodą pośrednią
między makroanalizą a mikroanalizą i dlatego nazwaną półmikrometodą
(mezoanalizą). Należy podkreślić, że stosowana dotychczas dla tej metody nazwa
semimikrometoda nie jest zalecana przez IUPAC, ponieważ nazwa sugeruje skalę
wyższą niż mikro.
Jeżeli wielkość próbki jest mniejsza od 0,01 g, to stosuje się odpowiednie
mikrometody.
Zgodnie z układem SI, dziesiętne podwielokrotności jednostek miar można wyrażać przez
dołączanie do nazw lub oznaczeń jednostek miar odpowiednich przedrostków.
Przedrostek decy oznacza 0,1 danej jednostki 1 dg = 0,1 g;
decy — 0,1
1 dg = 10
-1
g;
centy — 0,01
1 cg = 10
-2
g;
mili — 10
-3
1 mg = 10
-3
g;
mikro — 10
-6
1 μg = 10
-6
g;
nano — 10
-9
1 ng = 10
-9
g;
piko — 10
-12
1 pg =10
-12
g;
femto — 10
-15
1 fg =10
-15
g;
atto — 10
-18
1 ag = 10
-18
g;
Przedrostki femto i atto nie są na razie stosowane w nazwach metod mikroanalitycznych.
Podział metod analitycznych w zależności od wielkości próbki analitycznej
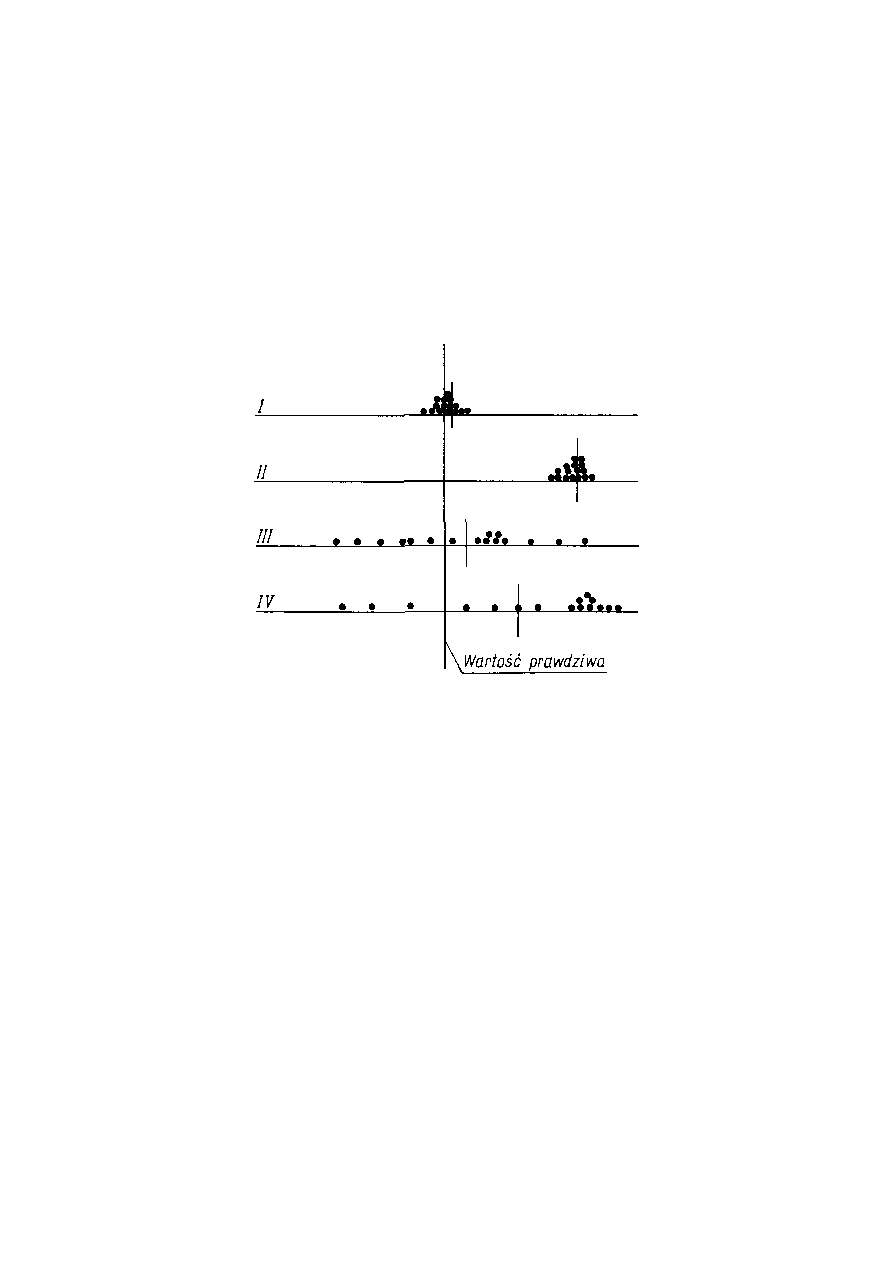
Dokładność i precyzja
W celu wyjaśnienia pojęć dokładności i precyzji oraz różnicy między nimi,
porównamy wyniki oznaczeń tego samego składnika w tej samej jednorodnej próbce,
otrzymane za pomocą czterech różnych metod analitycznych, przedstawione w postaci
diagramów przedstawionych na rysunku.
Kreska pionowa oznacza wartość rzeczywistą (prawdziwą) oznaczanej wielkości. Na
osiach poziomych są odłożone wyniki oznaczeń w postaci wypełnionych kółek. Krótkie
kreski pionowe oznaczają wartości średnie wyznaczane daną metodą. Należy zwrócić
uwagę na dwie istotne cechy charakteryzujące te wykresy, tj. odległość poszczególnych
wyników od wartości prawdziwej oraz rozrzut tych wyników, tzn. różnicę między
wynikiem największym i najmniejszym.
Ilustracja pojęcia dokładności i precyzji oznaczeń tego samego składnika czterema różnymi
metodami (Rokosz A.: Wprowadzenie do chemii analitycznej. Kraków, UJ. )
Pierwsza cecha charakteryzuje dokładność metody
Dokładność jest to stopień zgodności między wynikiem i wartością prawdziwą mierzonej
wielkości. Należy odróżnić pojęcie dokładności metody i dokładności pojedynczego
wyniku. Przez pojęcie dokładności metody rozumie się różnicę między otrzymaną
wartością średnią i wartością prawdziwą. Przez pojęcie dokładności pojedynczego
oznaczenia rozumie się różnicę między otrzymanym pojedynczym wynikiem oznaczenia i
prawdziwą wartością. Metoda dokładna jest to taka metoda, która daje wyniki bliskie
wartości prawdziwej. Cechę taką wykazują metody I i III , choć należy zwrócić uwagę, że
dokładność pojedynczego oznaczenia w metodzie III jest niekiedy niewielka, znacznie
mniejsza niż w metodzie I.
Druga cecha — wielkość rozrzutu wyników — charakteryzuje precyzję metody.
Precyzja metody jest to wielkość charakteryzująca rozrzut wyników przy wielokrotnym
oznaczaniu danego składnika tą samą metodą. Metoda jest tym bardziej precyzyjna, im
większa jest zgodność otrzymanych wyników, im mniejszy jest ich rozrzut. Mały rozrzut
wykazują metody I i II, jednak metoda II jest mało dokładna. Przy jej stosowaniu
otrzymuje się wyniki systematycznie za duże. Z przykładu tego widać, że nie zawsze
metody odznaczają się równocześnie dużą precyzją i dokładnością. Metoda IV
charakteryzuje się zarówno małą dokładnością, jak i małą precyzją.

Pojęcie precyzji obejmuje dwa bardziej szczegółowe pojęcia: powtarzalności i
odtwarzalności.
Powtarzalność jest to precyzja metody w przypadku jednego wykonawcy pomiarów
pracującego w danym laboratorium, otrzymującego kolejne wyniki podczas badania w
krótkich odstępach czasu identycznego produktu tą samą metodą i za pomocą tej samej
aparatury.
Odtwarzałność jest to precyzja metody, będąca miarą zgodności wyników osiąganych
przez różnych wykonawców pracujących w różnych laboratoriach lub w tym samym
laboratorium w różnych okresach, przy czym każdy z nich otrzymuje indywidualne
wyniki podczas badania identycznego produktu tą samą metodą.
Precyzja jest to liczbowo określana odchyleniem standardowym, względnym
odchyleniem standardowym, przedziałem ufności, rozstępem wyników.
Dokładność jest liczbowo określana wielkością błędu bezwzględnego lub względnego.
Reprezentatywność próbki analitycznej
Próbka analityczna jest z reguły bardzo małą częścią partii produktu, ale na podstawie
jej badania ocenia się całą partię. Stąd wypływa postulat reprezentatywności próbki.
Dlatego próbka musi być tak pobrana, aby była reprezentatywna dla badanego obiektu w
odniesieniu do danego zagadnienia.
Próbka reprezentatywna, tj. reprezentująca właściwości partii produktu, z którego
została pobrana, powinna mieć przeciętny skład i właściwości materiału badanego.
Właściwe pobranie próbki często nie jest łatwe. Bywa uważane za punkt newralgiczny
procesu analitycznego.
Należy jednak zdać sobie sprawę z tego, że nawet najstaranniej wykonana analiza
próbki niereprezentatywnej prowadzi do złej oceny partii produktu. Wytyczne pobierania
próbek i przygotowania średniej próbki laboratoryjnej produktów ciekłych, półciekłych,
mazistych, ciastowatych, sypkich i w kawałkach są przedmiotem odpowiednich
szczegółowych norm branżowych.
Rodzaje próbek
Próbka pierwotna — jest to część partii produktu pobrana jednorazowo z jednego
miejsca produktu nie opakowanego lub z jednego miejsca opakowania jednostkowego.
Opakowanie jednostkowe jest to każda postać opakowania bezpośredniego (np.
beczka, skrzynia, worek, pudełko, butelka, wagon), powtarzającego się jako części
partii.
Próbka jednostkowa — część partii produktu złożona ze wszystkich próbek
pierwotnych pobranych z jednego opakowania.
Próbka ogólna — część partii produktu złożona ze wszystkich próbek pierwotnych
pobranych z jednej partii.
Średnia próbka laboratoryjna — próbka przygotowana z próbki ogólnej,
reprezentująca właściwości partii produktu, przeznaczona do badań laboratoryjnych,
opakowana i przechowywana w sposób zapewniający jej identyczność. Badania
średniej próbki laboratoryjnej mają wykazać zgodność produktu z wymaganiami
normy i są wykonywane przez dostawcę lub odbiorcę albo przez obie strony. W
przypadku reklamacji badania są prowadzone w ramach analizy rozjemczej. W
związku z tym wielkość średniej próbki laboratoryjnej powinna być taka, aby można
było dokonać trzykrotnie wszystkich przewidzianych badań.
Próbka do badań — próbka przygotowana ze średniej próbki laboratoryjnej, np.
przez mielenie, z której pobiera się próbkę analityczną.
Próbka analityczna — część produktu wydzielona (pobrana) z próbki do badań lub
(jeżeli nie zachodzi potrzeba jej przygotowania) z próbki laboratoryjnej (średniej),
przeznaczona w całości do jednego oznaczenia lub wykorzystania bezpośrednio do
badania lub obserwacji.
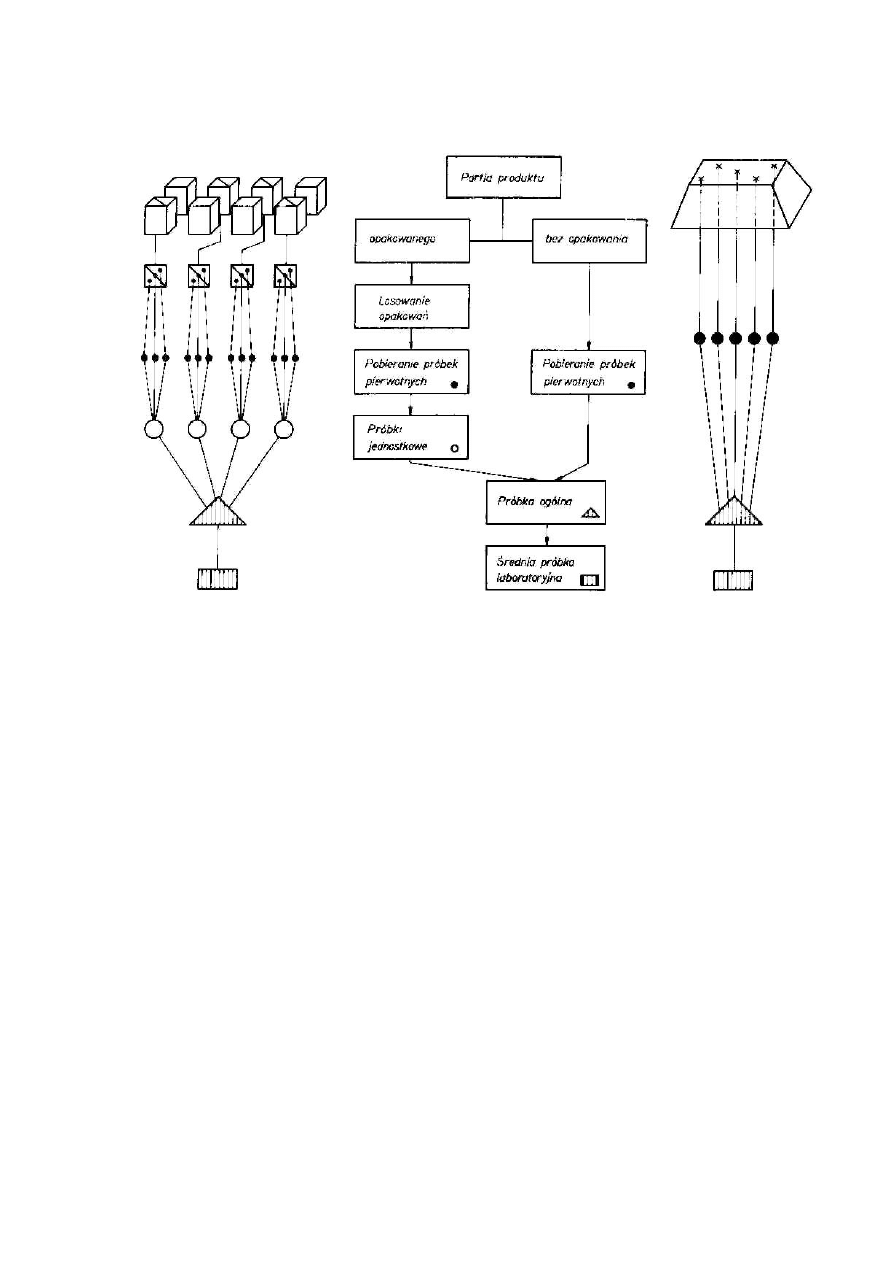
Schemat postępowania przy pobieraniu próbek
Przeprowadzanie próbki do roztworu
W metodach chemicznych analizy i w większości metod instrumentalnych konieczne
jest przeprowadzenie analizowanej próbki do roztworu. Dlatego następną czynnością
ogólną po pobraniu próbki jest jej rozpuszczenie. Najprostsze jest rozpuszczenie próbek w
wodzie. W wodzie rozpuszczają się często sole, kwasy i zasady. Rozpuszczanie ma
charakter procesu fizycznego. Najczęściej jednak trzeba stosować roztwarzanie próbki w
kwasach. Roztwarzanie jest to przeprowadzanie substancji do roztworu w wyniku
zachodzących reakcji chemicznych. Roztwarzanie jest często w literaturze określane
również jako rozpuszczanie.
Do roztwarzania najczęściej stosuje się kwasy. Najkorzystniejszy jest kwas solny,
potem azotowy i w końcu siarkowy. Kolejność ta wynika stąd, że kwas solny jest kwasem
nieutleniającym, a więc mniej przeszkadzającym w roztworze, a ponadto łatwo go usunąć
przez odparowanie. Większość chlorków jest rozpuszczalna w wodzie. Rozpuszczanie
próbek w kwasie solnym prowadzi się w naczyniach szklanych, naczynia platynowe
ulegają korozji. Kwas azotowy ma działanie utleniające, ale — w przeciwieństwie do
siarczanów — większość azotanów rozpuszcza się w wodzie. Rozcieńczony kwas
siarkowy nie ma właściwości utleniających i jest rozpuszczalnikiem podobnym do kwasu
solnego. Używa się go czasami zamiast solnego, gdy zachodzi obawa, że niektóre
pierwiastki mogą się ulotnić w postaci chlorków. Stężony, gorący kwas siarkowy działa
utleniająco i koroduje powoli naczynia platynowe. Podczas rozpuszczania najpierw
stosuje się kwasy rozcieńczone (2 M/l), a gdy są one nieskuteczne — kwasy stężone.
Ogrzewanie próbek ułatwia ich rozpuszczanie. Często zachodzi konieczność
długotrwałego ogrzewania, wówczas należy roztwory zabezpieczyć przed nadmiernym
odparowaniem. Jeżeli rozpuszczenie niektórych substancji wymaga użycia silniejszego

utleniacza niż stężony kwas azotowy, to stosuje się mieszaninę stężonego kwasu solnego i
stężonego kwasu azotowego w stosunku objętościowym 3:1 (woda królewska, aqua
regia). Woda królewska ma jednocześnie działanie utleniające i chlorujące. Do utlenienia
siarczków (np. pirytu) stosuje się mieszaninę stężonego kwasu solnego i stężonego kwasu
azotowego w stosunku 1:3 (mieszanina Leforta).
Mineralizacja próbek
Oznaczenie składników nieorganicznych w próbkach organicznych wymaga usunięcia
substancji organicznych, które utrudniają lub wręcz uniemożliwiają analizę. Proces
całkowitego usunięcia z próbki składników organicznych w celu oznaczenia składników
nieorganicznych nazywa się mineralizacją. W wyniku mineralizacji węgiel substancji
organicznej zostaje utleniony do CO
2
, wodór do H
2
O, a azot związany przechodzi w
wolny. Wszystkie składniki otrzymane w wyniku utleniania są lotne, można więc
mineralizację zaliczyć do metod wykorzystujących lotność substancji
Mineralizacja powinna przebiegać ilościowo, tzn. cała część organiczna badanej
próbki powinna ulec utlenieniu i ulotnieniu, cala część nieorganiczna natomiast powinna
pozostać jako pozostałość po mineralizacji. Przebieg procesu powinien też być szybki w
prostej, łatwo dostępnej aparaturze, co ma istotne znaczenie ze względu na masowy
charakter analiz. Rozróżnia się dwa zasadnicze rodzaje mineralizacji: mineralizację suchą
i mineralizację mokrą.
ANALIZA JAKOŚCIOWA
CEL I METODY ANALIZY JAKOŚCIOWEJ
Celem analizy jakościowej jest określenie składu badanej substancji. Rozróżnia się w
zasadzie dwie metody postępowania - mokrą i suchą. Metoda sucha polega na badaniu
substancji w stanie stałym bez przeprowadzania jej do roztworu np. barwienie płomienia
palnika, przez związki niektórych metali. Najłatwiej jest określić jakościowo substancje
na drodze mokrej to jest po uprzednim jej rozpuszczeniu w wodzie, w roztworach kwasów
lub zasad. W analizie prowadzonej na tej drodze wykrywamy jony (kationy lub aniony)
stosując tzw. reakcje charakterystyczne. Są to reakcje wyłącznie właściwe dla danego
składnika. Na podstawie wyników tych reakcji stwierdza się obecność odpowiednich
kationów lub anionów.
Celem ułatwienia analizy jakościowej podzielono tak kationy, jak i aniony na grupy
analityczne. Podział ten jest umowny, uwydatnia te cechy jonów, które pozwalają na
szybkie oraz jednoznaczne ich określenie.
Poniżej podano przykładowo jeden z podziałów kationów na grupy analityczne wraz z
odczynnikami grupowymi dla odpowiednich grup kationów. W tabelach przedstawiono
natomiast zestawienia odczynników i wyników reakcji z tymi odczynnikami
umożliwiającymi identyfikację poszczególnych kationów w obrębie danej grupy
analitycznej kationów.
PODZIAŁ KATIONÓW NA GRUPY ANALITYCZNE
Do poszczególnych grup analitycznych należą następujące kationy:
Grupa I: Odczynnik grupowy
2M HCl
Kationy:
srebrowy
Ag
+
ołowiawy Pb
2+
rtęciawy
Hg
2
2+

Grupa II: Odczynnik grupowy H
2
S w środowisku HCl
Kationy:
rtęciowy
Hg
2+
miedziowy Cu
2+
ołowiawy Pb
2+
kadmowy Cd
2+
bizmutawy Bi
3+
arsenawy
As
3+
arsenowy
As
5+
antymonawy Sb
3+
antymonowy Sb
5+
cynawy
Sn
2+
cynowy
Sn
4+
Grupa III: Odczynnik grupowy (NH
4
)
2
S w środowisku NH
4
OH i NH
4
Cl
Kationy:
kobaltawy Co
2+
niklawy
Ni
2+
Manganawy Mn
2+
cynkowy
Zn
2+
żelazawy
Fe
2+
żelazowy
Fe
3+
glinowy
Al
3+
chromowy Cr
3+
Grupa IV: Odczynnik grupowy (NH
4
)
2
CO
3
, w środowisku NH
4
OH i NH
4
Cl
Kationy:
wapniowy Ca
2+
strontowy Sr
2+
barowy Ba
2+
Grupa V: Odczynnika grupowego nie ma
Kationy:
magnezowy Mg
2+
sodowy
Na
+
potasowy
K
+
,
amonowy NH
4
+
Po rozpuszczeniu badanej próbki, możemy otrzymać roztwór nawet kilku różnych
jonów. Nie zawsze możliwa jest analiza takiej mieszaniny w oparciu o reakcje
charakterystyczne. W analizie jakościowej wykorzystano tę właściwość kationów, że z
pewnym odczynnikiem tylko niektóre tworzą związki trudnorozpuszczalne, pozostałe
kationy natomiast dają tego rodzaju połączenia z innymi odczynnikami.
W ten sposób stosując coraz to inne substancje strącające można rozdzielić mieszaninę
kationów na pewne frakcje zwane grupami analitycznymi kationów. Grup tych jest pięć
i każda z wyjątkiem V. ma swój odczynnik grupowy.
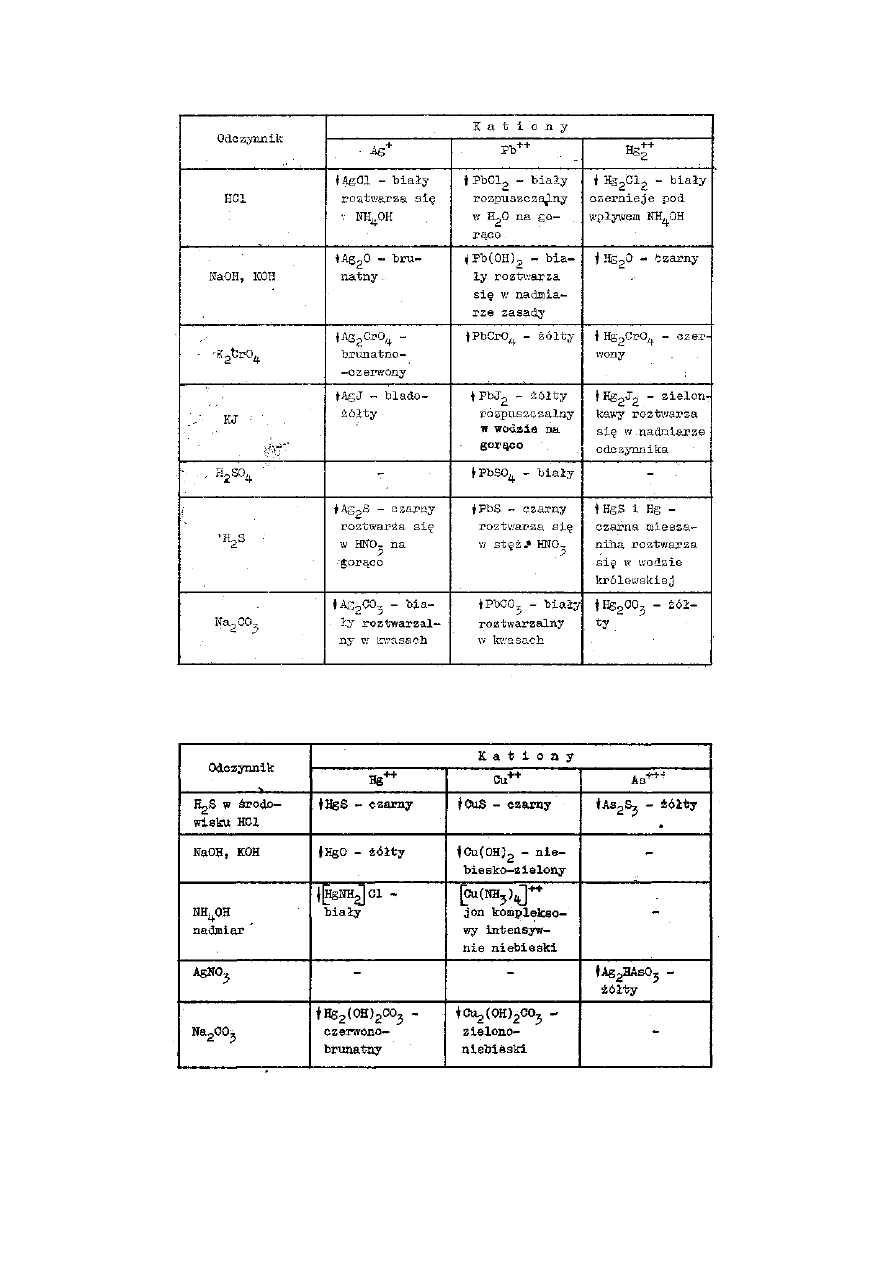
Przegląd wyników reakcji kationów I grupy
Przegląd wyników reakcji kationów II grupy
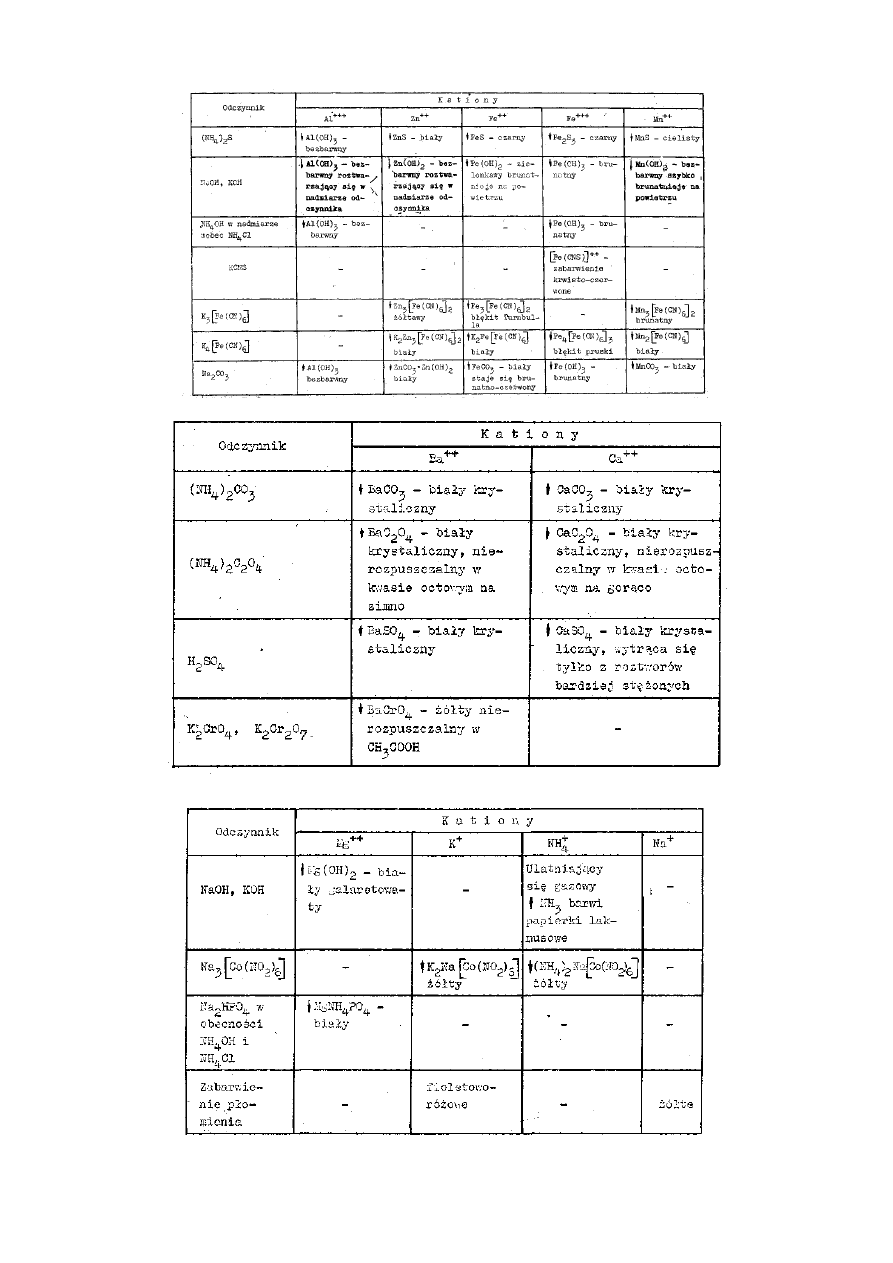
Przegląd wyników reakcji kationów III grupy
Przegląd wyników reakcji kationów IV grupy
Przegląd wyników reakcji kationów V grupy
Wyszukiwarka
Podobne podstrony:
ćwiczenie1 wprowadzenie do chemii lekow
ćwiczenie1 wprowadzenie do chemii lekow
Wprowadzenie do chemii organicznej
Ćwiczenie nr"03
Ćwiczenie 1 (WEiP-2009), WPROWADZENIE DO EKONOMETRII I PROGNOZOWANIA (2009).
Kształcenie ruchowe – ćwiczenia nr 3 (6 03 12r )
ĆWICZENIE NR 03 - Stopień zagęszczenia gruntów sypkich ID, Mechanika Gruntów
Zajęcia nr 2 uw, Wprowadzednie do psychologii
03 Wprowadzenie do badan jakosc Nieznany
Wprow. do Pracy z rodzina 03, wprowadzenie do pracy z rodziną
Ćwiczenie nr 03
Wprowadzenie do mechaniki analitycznej
Wprowadzenie do filozofii nr.01 - 03.10.07, Nauka, Psychologia
material obowiazujacy do kolokwiow z chemii analitycznej iiwf 2014
więcej podobnych podstron