
1
Wybrane niemetale
Wodór
glowce IVA: w giel i krzem
Azotowce VA:
azot i fosfor
Tlenowce VIA: tlen i siarka
Fluorowce VIIA

2
Azotowce
1.
Grupa VA (15)
– nas najbardziej b
interesowa N i P.
2. Konfiguracja elektronowa pow oki walencyjnej
s
2
p
3
, w po owie zape niona
podpow oka p.
3. Elektroujemno ci Paulinga:
N
3,0
,
P
2,2
, As
2,2
, Sb
2,1
, Bi
2,0
4. N i P - typowe niemetale
As i Sb - pó metale
Bi – metal
5. Wiele form alotropowych. N nie ma metalicznej formy alotropowej, P ma nietrwa
(fosfor czarny), As i Sb maj trwa e formy metaliczne a w przypadku Bi jedyn form
alotropow jest forma metaliczna.

3
Azotowce
6. Typ wi za i hybrydyzacja
Dla azotu i fosforu dominuj wi zania kowalencyjne. Dla pozosta ych azotowców
spory charakter jonowy wi za , zw aszcza dla Bi. Azot nie ma orbitali d w pow oce
walencyjnej, wi c ulega hybrydyzacji
sp
(np. liniowy jon NO
2
+
),
sp
2
(np. trójk tny jon
NO
3
-
) lub
sp
3
(np. tetraedryczne NH
3
i NH
4
+
), a wi c tworzy maksymalnie 4 wi zania
kowalencyjne za pomoc orbitali zhybrydyzowanych. Pozosta e pierwiastki mog
wykorzysta orbitale d i utworzy 5 wi za kowalencyjnych (hybrydyzacja
dsp
3
) lub
nawet 6 wi za kowalencyjnych (hybrydyzacja
d
2
sp
3
, z wyj tkiem Bi). W przypadku
tworzenia 3 wi za kowalencyjnych mamy dwie mo liwo ci:
- wi zania kowalencyjne s tworzone za po rednictwem 3 orbitali p a wolna para
elektronowa pozostaje na orbitalu s (Bi),
- wi zania kowalencyjne s tworzone za po rednictwem orbitali hybrydowych sp
3
,
wi c wolna para elektronowa jest na orbitalu hybrydowym (N, P).
As i Sb wykorzystuj obie te mo liwo ci. Trzeba zaznaczy , e te dwa sposoby
tworzenia 3 wi za kowalencyjnych ró ni si stereochemicznie (inne k ty mi dzy
wi zaniami).

4
Azotowce
7. Jony
Tylko najbardziej elektroujemny N przy cza 3 elektrony i tworzy N
3-
(w azotkach
metali alkalicznych w stanie sta ym). Kationy As
3+
, Sb
3+
i Bi
3+
(oddane 3 elektrony p)
trwa e w silnie kwa nych roztworach, przy podwy szeniu pH As
3+
reaguje z jonami
OH
-
do arsenianów (III)
As
3+
+ 3 OH
-
+ 3H
2
O
AsO
3
3-
+ 3 H
3
O
+
a kationy Sb
3+
i Bi
3+
hydrolizuj do kationów antymonylu SbO
+
i bizmutylu BiO
+
Bi
3+
+ 3 H
2
O
BiO
+
+ 2 H
3
O
+
Tak hydrolizuje np. roztwór 5•hydratu azotanu(V) bizmutu(III) t.j. Bi(NO
3
)
3
•5H
2
O,
zw aszcza po ogrzaniu, daj c nierozpuszczalny 1•hydrat azotanu(V) bizmutylu
BiONO
3
•H
2
O (stosowany dawniej w chorobach przewodu pokarmowego). Uwaga !
Dawne nazwy i zapisy chlorku antymonylu SbOCl i bizmutylu BiOCl nie s w
ciwe,
gdy zwi zki te nie zawieraj w kryszta ach kationów SbO
+
i BiO
+
. Obecna
prawid owa nomenklatura: chlorek tlenek antymonu(III) SbClO i chlorek tlenek
bizmutu(III) BiClO.

5
Azotowce
8. Najwa niejsze stopnie utlenienia i w
ciwo ci redoks:
-III
w
ciwo ci redukuj ce (NH
3
, PH
3
)
+V
w
ciwo ci utleniaj ce, typowe dla azotanów(V) i arsenianów(V)
+III
dzia anie redukuj ce lub utleniaj ce, typowe dla azotanów(III) i arsenianów(III)
Ze wzrostem liczby atomowej wzrasta trwa
stopnia utlenienia
+III
a maleje
trwa
stopnia utlenienia
+V
.
9. Aktywno
w stanie pierwiastkowym
Azot i fosfor czerwony s ma o aktywne. Fosfor bia y jest bardzo aktywny – zapala
si samoistnie w powietrzu. Pod wzgl dem w
ciwo ci chemicznych As, Sb i Bi
wykazuj wiele podobie stw. Ogrzewane w powietrzu lub w tlenie daj tlenki Y
2
O
3
.
cz si
atwo z fluorowcami. As, Sb i rozdrobniony Bi zapalaj si w chlorze.
St
ony HNO
3
utlenia As do H
3
AsO
4
, Sb do nierozpuszczalnego uwodnionego
pentatlenku, Sb
2
O
5
•aq., Bi pod wp ywem HNO
3
przechodzi w Bi(NO
3
)
3
. As, Sb i Bi
ulegaj tak e dzia aniu st
onego, gor cego kwasu siarkowego.

6
Azot
N
1. Wyst powanie
a) 33 miejsce pod wzgl dem zawarto ci w zewn trznych warstwach Ziemi
b) g ówny sk adnik atmosfery (N
2
stanowi 78% obj to ciowych powietrza)
c) minera y azotanowe - najwi cej saletry chilijskiej NaNO
3
d) bia ka zwierz ce i ro linne (obieg azotu w przyrodzie)
2. Otrzymywanie
a) techniczne - destylacja frakcyjna skroplonego powietrza
b)
laboratoryjne
ogrzewanie roztworu azotanu(III) amonu NH
4
NO
2
:
NH
4
NO
2
N
2
+ 2 H
2
O
reakcj przeprowadza si wkraplaj c roztwór NaNO
2
do roztworu NH
4
Cl lub (NH
4
)
2
SO
4
- tworzy si NH
4
NO
2
, który natychmiast si rozpada
utlenianie amoniaku za pomoc wapna chlorowanego
2 NH
3
+ 3 CaCl(OCl)
N
2
+ 3 H
2
O + 3 CaCl
2
termiczny rozk ad azydku sodu (najczystszy azot)
NaN
3
Na + 3/2 N
2
-III
+III
-III
0
0
-I
+I
-I
N
3
-
Na
+

7
Azot
N
5. Amoniak i jego pochodne
5.1. Otrzymywanie
Przemys owe: reakcja Habera-Boscha N
2
+ 3H
2
2NH
3
H = -92 kJ/mol
150-250 atm, 720-770 K, kat. magnetyt Fe
3
O
4
Laboratoryjne: sól amonowa + mocna zasada w podwy szonej temperaturze
NH
4
+
+ OH
-
NH
3
+ H
2
O
3. W
ciwo ci fizyczne azotu molekularnego
Gaz bezbarwny, bez smaku i zapachu, s abo rozpuszczalny w
H
2
O, t.w. = 77 K a t.t. = 63 K, pierwszy raz skroplony przez
Olszewskiego i Wróblewskiego w 1883 r.
4. W
ciwo ci chemiczne azotu molekularnego
Budowa N
2
by a omówiona poprzednio: wzór elektronowy Lewisa
|N N|
. Energia
wi zania b. du a (941 kJ/mol), wi c jest nieaktywny w temp. pokojowej. W
podwy szonej temperaturze z niektórymi metalami tworzy azotki, np. Mg
3
N
2
z
roz arzonym magnezem, reaguje z wodorem i tlenem (patrz dalej) oraz z w glikiem
wapnia (karbidem) daj c cyjanamid wapnia
Ca
2+
[
|N-C N|
]
2-
:
CaC
2
+ N
2
CaCN
2
+ C

8
Azot
N
5.2. W
ciwo ci
Bezbarwny, toksyczny gaz o charakterystycznym zapachu, l ejszy od powietrza, atwo
si skrapla (-33
o
C). Zasada Brønsteda i Lewisa.
Ciek y stanowi dobry rozpuszczalnik substancji polarnych. Autodysocjacja:
2NH
3
NH
4
+
+ NH
2
-
NH
4
+
- s aby kwas Brønsteda, NH
2
-
- mocna zasada Brønsteda
Dobra rozpuszczalno
w wodzie, gdy tworzy z ni wi zania wodorowe.Handlowy st
.
roztwór jest 25-procentowy. NH
3
mo na z niego odp dzi przez ogrzewanie. W wodzie
NH
3
jest s ab zasad . Dysocjacja w wodzie:
NH
3
+ H
2
O
NH
4
+
+ OH
-
pK
b
= 4,7,
czyli w 0,1 molowym roztworze tylko 1% cz steczek jest zdysocjowanych.
Spalanie w tlenie:
bez katalizatora
4NH
3
+ 3O
2
2N
2
+ 6H
2
O
H = -1260 kJ/mol
z katalizatorem
4NH
3
+ 5O
2
4NO + 6H
2
O
H = -907 kJ/mol (reakcja Ostwalda) Na
katalizator w postaci siatki platynowej (+10% Rh) wprowadza si
w 1170 K mieszanin
NH
3
z powietrzem pod ci ieniem 4-10 atm. NO jest produktem po rednim w produkcji
kwasu azotowego (V).
W wysokich temperaturach dzia a silnie redukuj co, co jest spowodowane przez wodór
cy produktem termicznego rozpadu NH
3
.

9
Azot
N
5.3. Pochodne
Sole amonowe
, kation NH
4
+
, dobrze rozpuszczalne w wodzie.
Amidki
, np. NH
2
Na – bia a, kryst. substancja
Otrzymywanie: 2NH
3
+ 2Na
2NH
2
Na + H
2
Hydroliza: NH
2
Na + H
2
O
NH
3
+ NaOH
Imidki
, np. NHLi
2
lub NHCa
Azotki
, np. Mg
3
N
2
Aminy
- atomy wodoru zast pione niemetalem, np. chlorowcem lub podstawnikiem
organicznym, np. grup metylow .
Hydroksyloamina
NH
2
OH: bia a, higroskopijna, nietrwa a (wybuchowa !) krystaliczna
substancja, w roztworach wodnych wykazuje w
ciwo ci zasadowe (podobnie jak NH
3
):
NH
2
OH + H
2
O
NH
3
OH
+
+ OH
-
Ma zarówno w
ciwo ci utleniajace, jak i redukuj ce (po redni stopie
utlenienia).
Tworzy sole, odpowiedniki amonowych, np. (NH
3
OH)
2
SO
4
siarczan(VI)
hydroksyloamoniowy, które s bardziej trwa e ni wolna hydroksyloamina.
Otrzymywanie na katodzie z Pb przez redukcj
elektrolityczn
HNO
3
(50% HNO
3
+ 50%
H
2
SO
4
): HNO
3
+ 6H
NH
2
OH + 2H
2
O
2NH
2
OH + H
2
SO
4
(NH
3
OH)
2
SO
4
500-600 K
-I
-I
+V
10
Azot
N
Hydrazyna
N
2
H
4
: bezbarwna, toksyczna, mierdz ca, g sta ciecz (asocjacja 3D poprzez
wi zania wodorowe), zwykle w handlu 60% roztwór wodny. Silny reduktor, u ywany w
paliwach rakietowych (+ utleniacz: st
. H
2
O
2
, ciek y O
2
lub dymi cy HNO
3
).
Otrzymywanie z chloraminy NH
2
Cl: NH
3
+ NaClO
NaOH + NH
2
Cl
NH
2
Cl + NH
3
N
2
H
4
+HCl
Tworzy sole, odpowiedniki amonowych, ma wi c w
ciwo ci zasadowe:
np. [NH
3
NH
3
]
2+
SO
4
2-
, zapis N
2
H
4
•H
2
SO
4
, nazwa: siarczan(VI) hydrazoniowy (2+)
[NH
3
NH
2
]
+
Cl
-
, zapis N
2
H
4
•HCl, nazwa: chlorek hydrazoniowy (1+)
Azydek wodoru (kwas azotowodorowy)
HN
3
: bezbarwna, toksyczna, mierdz ca, lotna i
wyj tkowo wybuchowa ciecz o w
ciwo ciach kwasowych, w rodowisku wodnym jest
kwasem o mocy zbli onej do octowego.
Otrzymywanie:
N
2
O +
stopiony
NaNH
2
NaN
3
+ H
2
O
NaN
3
+
rozcie czony
H
2
SO
4
HN
3
+ NaHSO
4
(ostro ne oddestylowanie HN
3
)
rod.
bezwodne
-II
Azydki s
bia ymi, wybuchowymi proszkami.
Zastosowanie: NaN
3
– poduszki powietrzne w
samochodach, Pb(N
3
)
2
– detonator.

11
Azot
N
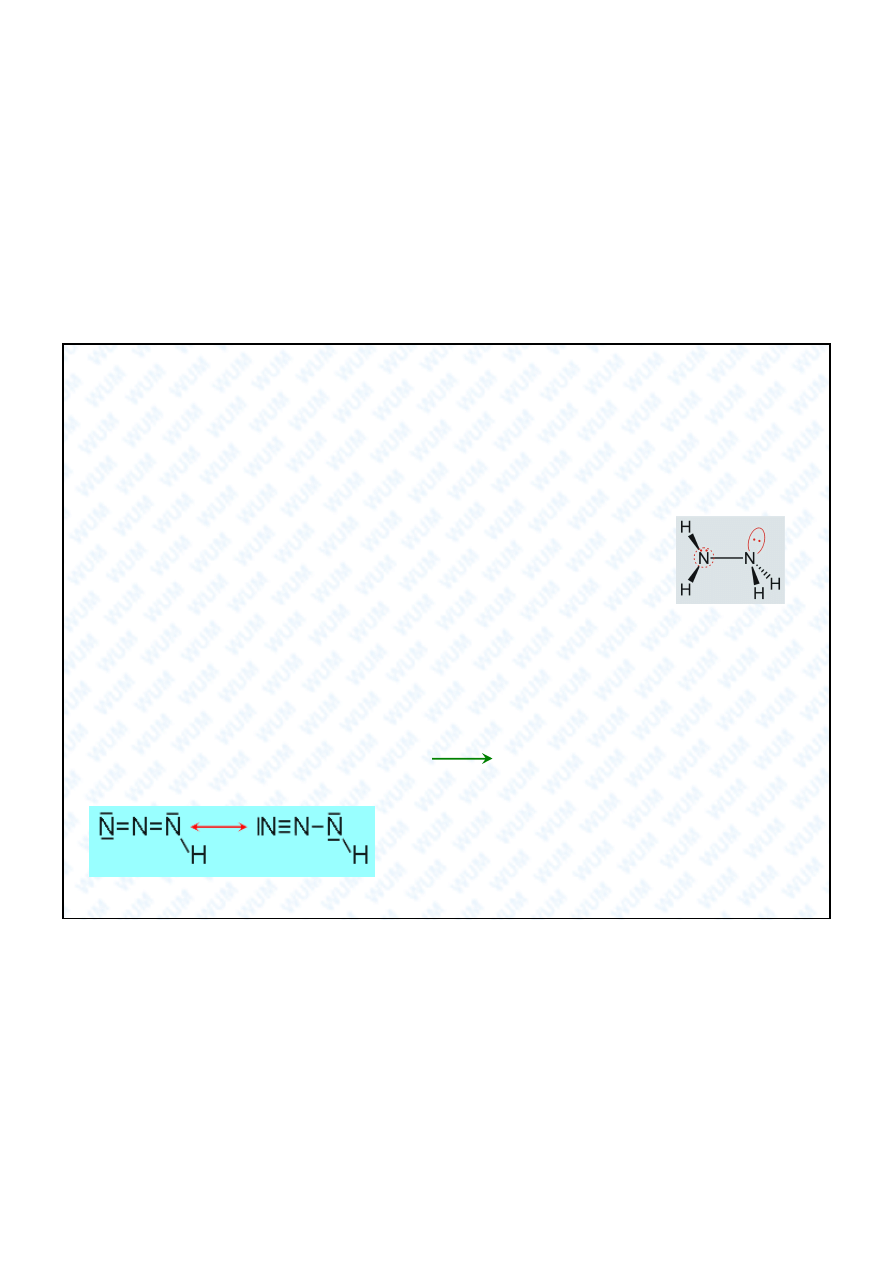
6. Tlenki azotu
- ogrzewanie
Otrzymywanie tlenków azotu:
12
Azot
N
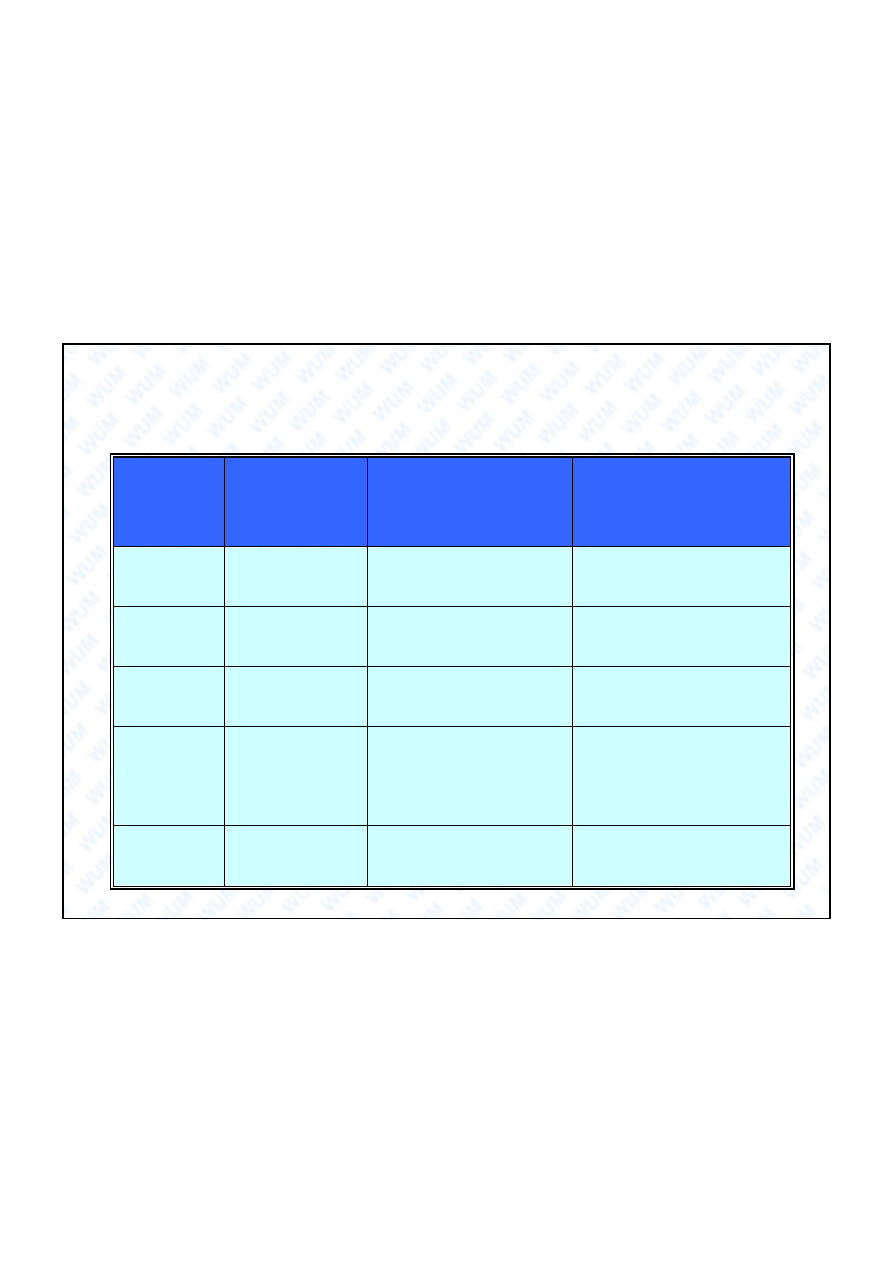
ciwosci tlenków azotu:
TLENEK
STOPIE
UTLENIENIA
STAN SKUPIENIA
KWAS
N
2
O
I
bezbarwny gaz
(rozweselaj cy)
H
2
N
2
O
2
diazotowy(I)
NO
II
bezbarwny gaz
nie jest bezwodnikiem
kwasowym
N
2
O
3
III
niebieska ciecz,
trwa a < 260 K
HNO
2
azotowy(III)
NO
2
N
2
O
4
IV
brunatne gazy
azotowy(III)
HNO
2
+
HNO
3
azotowy(V)
N
2
O
5
V
bezbarwne cia o sta e
HNO
3
azotowy(V)
13
Azot
N
7. Kwasy azotowe i azotany
7.1.
Kwas diazotowy(I)
Nie mo na go otrzyma bezpo rednio w reakcji N
2
O z H
2
O.
Najpierw otrzymuje si sól tego kwasu z organicznego estru RONO w reakcji:
RONO + NH
2
OH + 2EtONa
Na
2
N
2
O
2
+ ROH + 2 EtOH
Dodanie Ag
+
str ca Ag
2
N
2
O
2
.
Nast pnie dzia a si na Ag
2
N
2
O
2
bezwodnym HCl w suchym eterze etylowym:
Ag
2
N
2
O
2
+ 2HCl
H
2
N
2
O
2
+ 2AgCl
H
2
N
2
O
2
jest bia ym, krystalicznym cia em sta ym, bardzo wybuchowym, rozk ada si
wtedy na N
2
O i H
2
O. Rozpuszcza si w wodzie, jest s abym kwasem dwuprotonowym.
7.2.
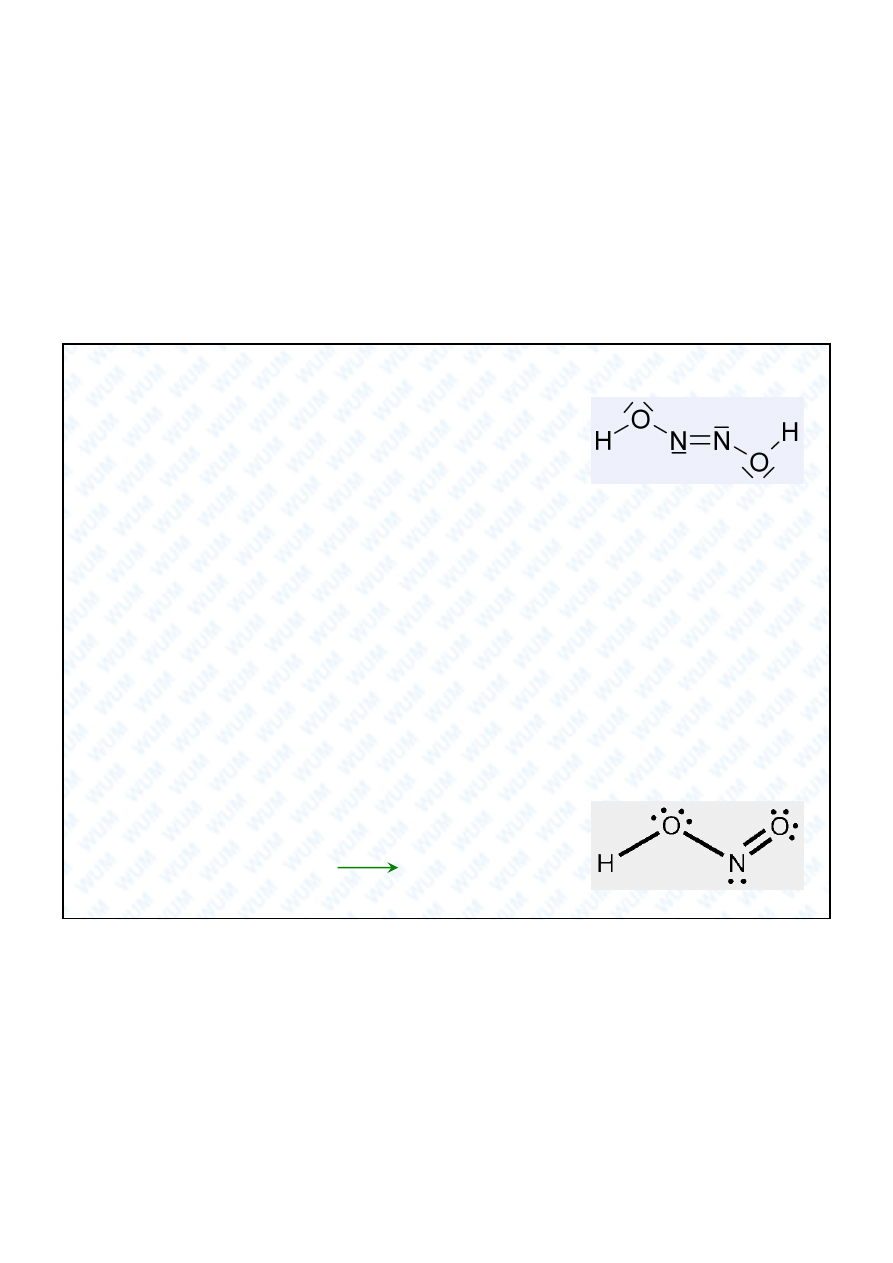
Kwas azotowy(III)
Przemys owo kwas HNO
2
otrzymywany jest poprzez wprowadzanie do wody
równocz steczkowej mieszaniny NO i NO
2
. W takiej mieszaninie zawsze obecne s
drobne ilo ci N
2
O
3
, który jest bezwodnikiem HNO
2
. W wyniku jego reakcji z wod
wg
równania
N
2
O
3
+ H
2
2 HNO
2
zaburzona (przesuni ta w prawo) zostaje równowaga
reakcji tlenków
NO + NO
2
N
2
O
3
i tworz
si
kolejne porcje N
2
O
3
, które nast pnie
reaguj z wod i tak dalej.
HNO
2
jest s abym kwasem, trwa ym tylko w rozcie czonych
roztworach wodnych:
3HNO
2
HNO
3
+ H
2
O + 2NO
W zale no ci od rodowiska mo e by zrówno utleniaczem, jak i reduktorem.
zat
anie
14
Azot
N
7.3.
Kwas azotowy(V)
Otrzymywanie:
1) Synteza NH
3
metod Habera-Boscha.
2) Spalanie NH
3
do NO metod Ostwalda.
3) Poch anianie NO i NO
2
w H
2
O w obecno ci powietrza:
2NO + O
2
2NO
2
2NO
2
+ H
2
O
HNO
3
+ HNO
2
3HNO
2
HNO
3
+ 2NO +H
2
O
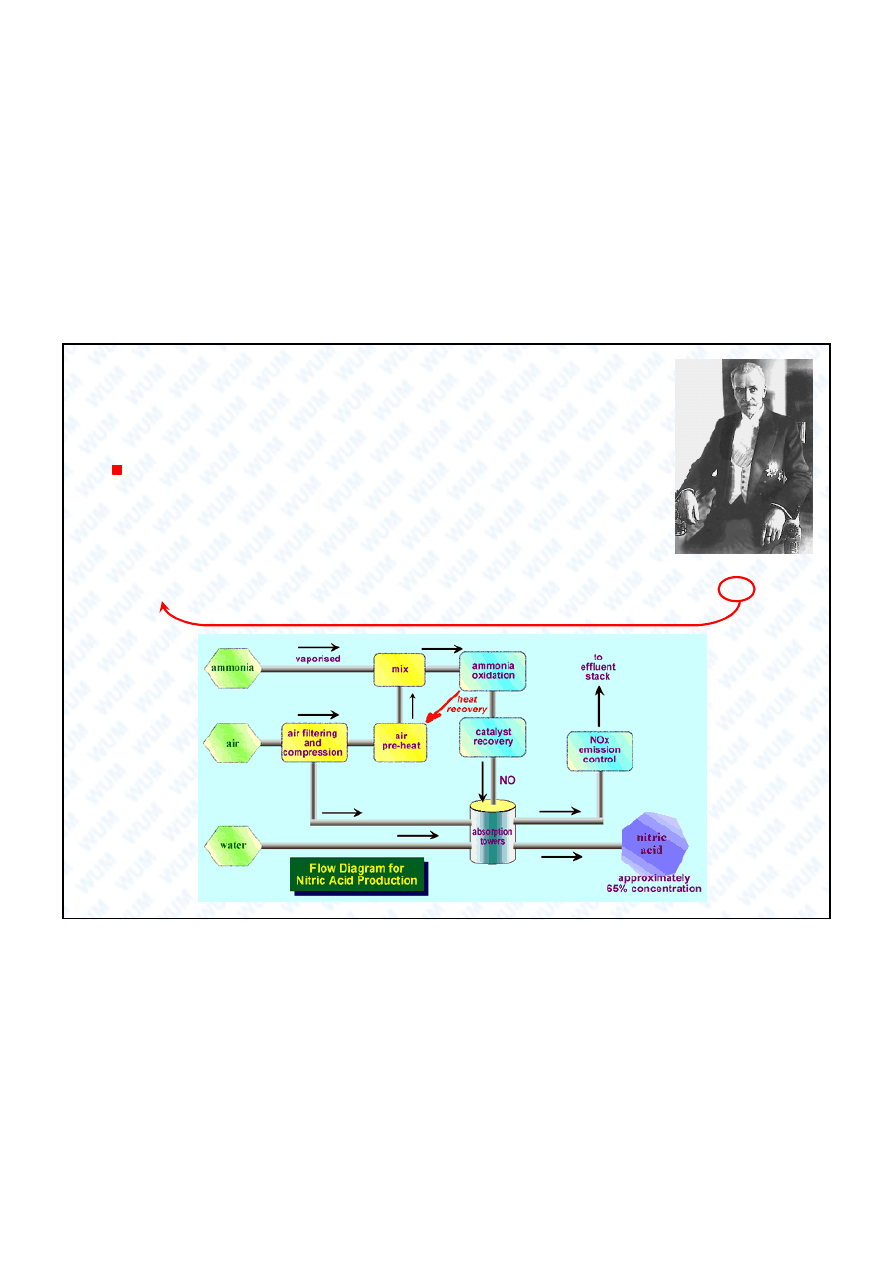
Ignacy Mo cicki
(1867-1946). Chemik,
naukowiec, polityk.
Prezydent RP w latach
1926-1939. Autor wielu
patentów dotycz cych
produkcji kwasu
azotowego i innych
zwi zków azotu.
15
Azot
N
Czysty, bezwodny jest bezbarwn ciecz . Na wietle ulega cz
ciowemu
rozk adowi, co nadaje mu
taw barw od rozpuszczonego w nim NO
2
:
4HNO
3
4NO
2
+ 2H
2
O + O
2
Roztwór wodny o st
. > 86% HNO
3
nazywany jest dymi cym kwasem azotowym.
Kwas azotowy(V) 98% otrzymuje si przez destylacj ze st
. H
2
SO
4
.
Bezwodny kwas ulega autodysocjacji:
2HNO
3
H
2
NO
3
+
+ NO
3
-
NO
2
+
+ H
2
O
NO
2
+
- jon nitroniowy
2HNO
3
NO
2
+
+ NO
3
-
+ H
2
O
Miesza si z wod we wszystkich proporcjach, podczas destylacji daje z wod 68%
azeotrop o temp. wrzenia 120,5
o
C.
W roztworze wodnym jest silnym kwasem:
HNO
3
+ H
2
O
H
3
O
+
+ NO
3
-
pK
a
= -1,4
Ma silne w
ciwo ci utleniaj ce:
Cu + 4HNO
3
(st
.)
Cu(NO
3
)
2
+ 2NO
2
+ 2H
2
O
3Cu + 8HNO
3
(rozcie cz.)
3Cu(NO
3
)
2
+ 2NO + 4H
2
O
Tak reaguj Cu, Ag, Hg.
wiat o
O
H
N
O
O

16
Azot
N
Cr, Fe i Al pasywuj
si
w st
. HNO
3
. Z zimnym rozcie czonym HNO
3
reaguj
z
wydzieleniem wodoru. W ten sposób reaguj jeszcze Mg, Mn i Ca.
Woda królewska (stosunek obj. st
. kwasów
HNO
3
: HCl = 1 : 3
) roztwarza Au i Pt:
Au + 3 NO
3
-
+ 6 H
+
Au
3+
+ 3 NO
2
+ 3 H
2
O
Au
3+
+ 4 Cl
-
AuCl
4
-
Tworzenie chloroz ocianów przesuwa równowag pierwszej reakcji w prawo.
Samoistny rozk ad wody królewskiej:
3HCl + HNO
3
2H
2
O + Cl
2
+ NOCl
2NOCl
2NO + Cl
2
Wod
królewsk
odkry
arabski alchemik
abir Ibn Hajjan zwany tak e Geberem
(721-815). Dzia
w Kufie (obecnie Irak).
Jest uwa any za twórc eksperymentalnego
nurtu alchemii. Wprowadzi takie operacje
chemiczne jak destylacja i krystalizacja.
Odkry tak e kwasy azotowy i solny oraz
cytrynowy, octowy i winowy.

17
Azot
N
HNO
3
utlenia niemetale (oprócz fluorowców i metaloidu Si):
S + 2HNO
3
H
2
SO
4
+ 2NO
(ew. do NO
2
)
3C + 4HNO
3
3CO
2
+ 4NO + 2H
2
O
(ew. do NO
2
)
P
4
+ 20HNO
3
4H
3
PO
4
+ 20NO
2
+ 4H
2
O
(ew. do NO)
7.4.
Azotany(V)
Azotany(V), bezbarwne lub bia e kryszta y dobrze rozpuszczalne w wodzie, w stanie
sta ym i w silnie zakwaszonych roztworach maj
ciwo ci utleniaj ce.
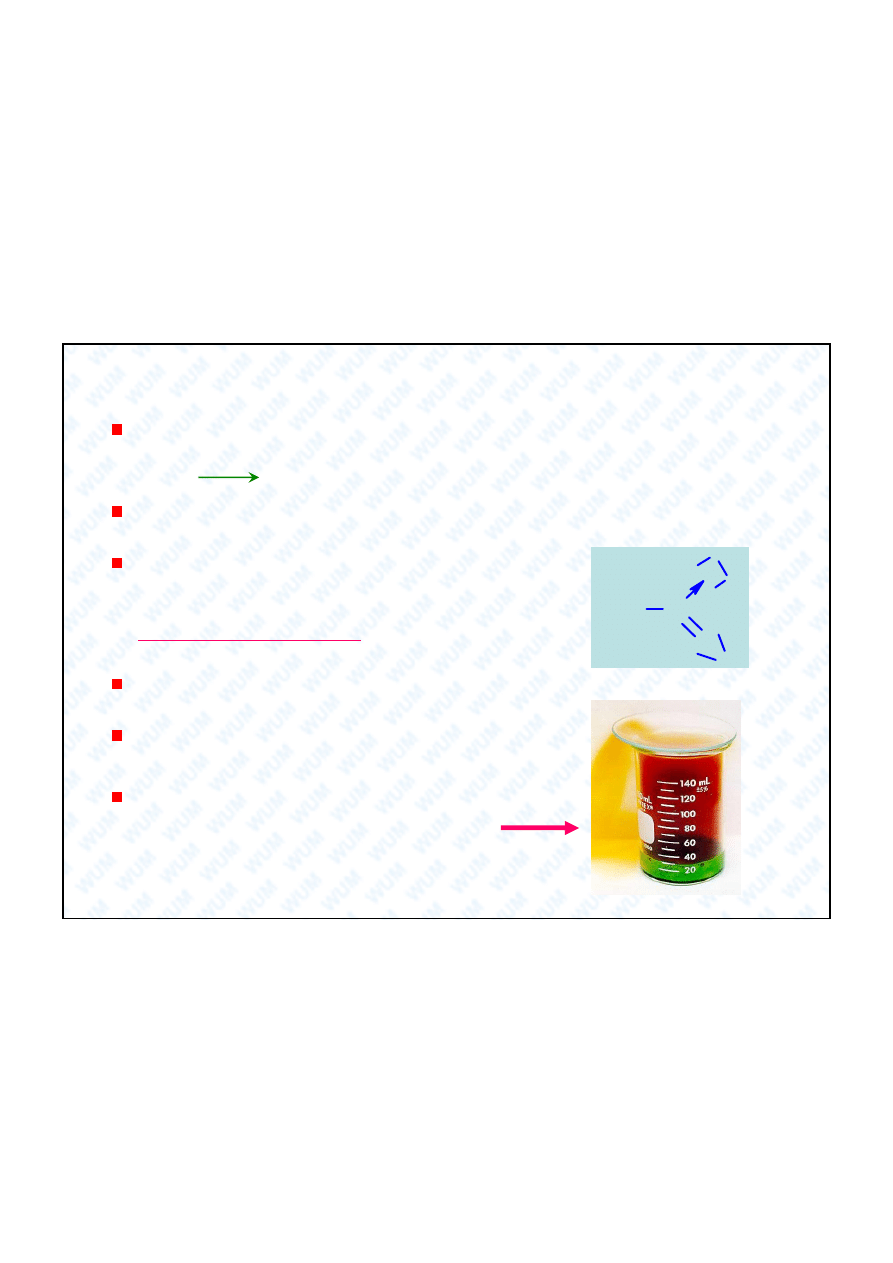
Próba z brunatn
obr czk :
W badanym roztworze rozpuszcza si
du
ilo
siarczanu elaza (II), a nast pnie ostro nie podwarstwia, to znaczy wprowadza na
dno st
ony kwas siarkowy. Roztwory nie mieszaj
si , wskutek ró nicy g sto ci.
Dodatni wynik próby, czyli brunatna obr czka wiadczy o obecno ci jonów NO
3
-
:
NO
3
-
+ 4 H
+
+ 3 Fe
2+
NO + 2 H
2
O + 3 Fe
3+
NO + Fe
2+
[Fe(NO)]
2+
Je li w roztworze wyst puj
jony NO
2
-
, nale y roztwór podgrza
najpierw z NH
4
Cl,
usuwaj c azotany(III): NO
2
-
+ NH
4
+
N
2
+ 2 H
2
O, które równie da yby t prób .
Zn i Al w roztworach alkalicznych redukuj azotany do wolnego N
2
lub do NH
3
:
4Zn + NO
3
-
+ 7OH
-
+ 6H
2
O
4[Zn(OH)
4
]
2-
+ NH
3
Rozk ad termiczny:
2KNO
3
2KNO
2
+ O
2
2Pb(NO
3
)
2
2PbO + 4NO
2
+ O
2
2AgNO
3
2Ag + 2NO
2
+ O
2
0
V
II
-III

18
Fosfor
P
1. Wyst powanie
a) 12-ty pierwiastek co do zawarto ci w zewn trznych warstwach Ziemi (0,11 % mas.)
b) minera y, przede wszystkim apatyty
Ca
10
X
2
(PO
4
)
6
(X = F, Cl, OH) i fosforyt
Ca
3
(PO
4
)
2
c) fosfor organiczny, sk adnik organizmów ywych
2. Otrzymywanie
Otrzymywanie techniczne polega na ogrzewaniu bez dost pu powietrza fosforytu z
piaskiem i koksem w piecu elektrycznym w temp. ok. 1600 K:
Ca
3
(PO
4
)
2
+ 3 SiO
2
+ 5 C
3 CaSiO
3
+ 5 CO + 1/2 P
4
Fosfor wydziela si w postaci pary, któr kondensuje si przepuszczaj c przez warstw
wody - powstaje fosfor bia y, który oczyszcza si przez destylacj .
3.
W
ciwo ci fizyczne i chemiczne fosforu pierwiastkowego
Dwie najwa niejsze odmiany alotropowe: fosfor bia y i czerwony.

19
Fosfor
P
Fosfor bia y
, krystaliczny, silnie toksyczny - bia a masa o zapachu czosnku, mi kka jak wosk,
ona z cz steczek P
4
(czworo cian foremny, w ka dym naro u atom P tworz cy z s siadami
3 wi zania). Energia wi zania P-P (201 kJ/mol) jest 4 razy mniejsza ni w cz steczce azotu,
wi c fosfor bia y jest bardzo reaktywny.
20
Fosfor
P
w temp. 30
o
C zapala si w powietrzu P
4
+ 5 O
2
P
4
O
10
(w zwi zku z tym przechowuje si
go pod wod i kroi si go te pod wod !) reakcja ta jest silnie egzotermiczna
rozpuszcza si w CS
2
a roztwór odparowany na kawa ku bibu y powoduje jej zapalenie
w temp. pok. utlenia si powoli, czemu towarzyszy chemiluminescencja
rozpuszcza si w gor cym ugu potasowym
P
4
+ 3KOH + 3 H
2
O
PH
3
+ 3KH
2
PO
2
(powstaj fosfan + fosfinian potasu, dawniej
nazywane fosforowodorem i podfosforynem
potasu; kwas fosfinowy
H
3
PO
2
jest kwasem
jednoprotonowym, wi c nie nale y nazywa
tej soli „kwa
”).
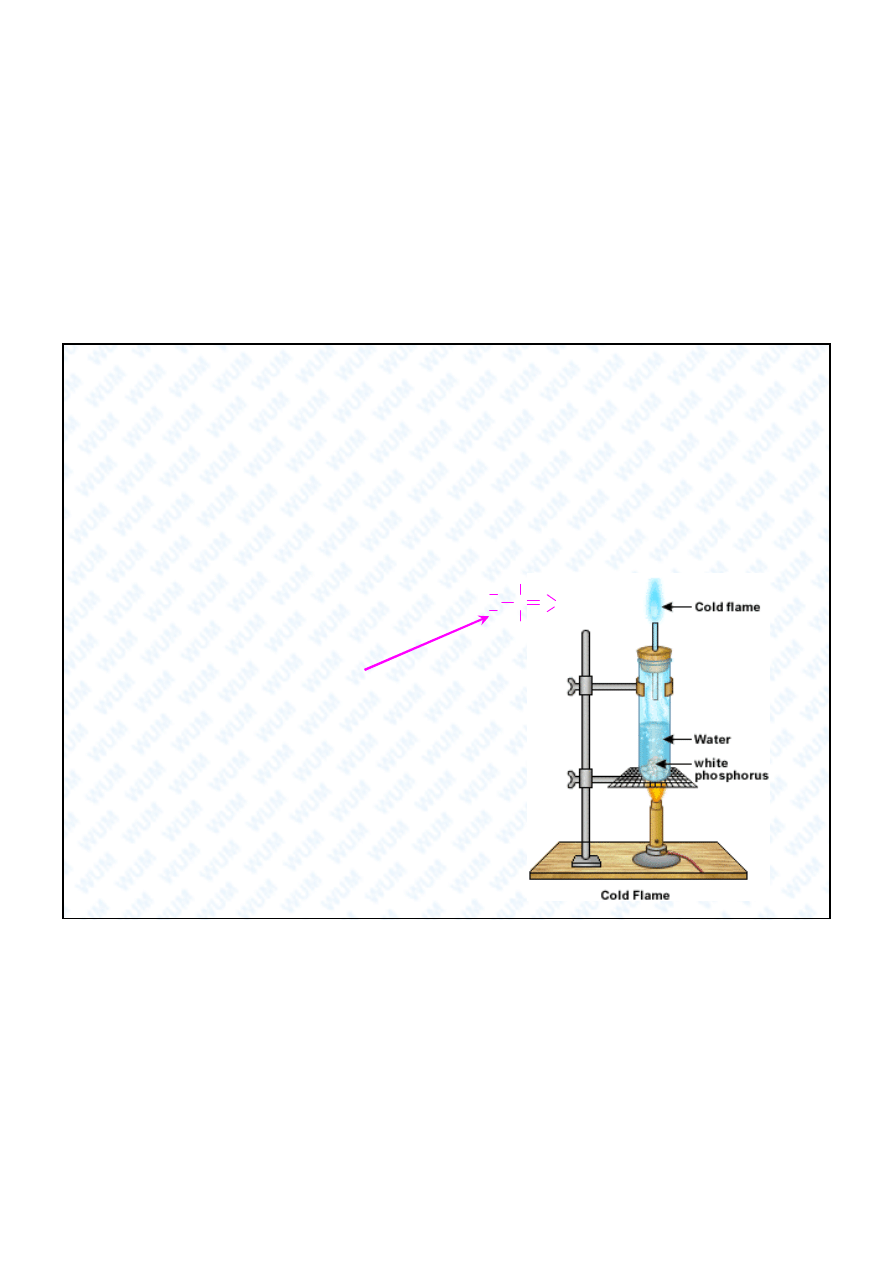
Bia y fosfor wykazuje niezwyk e zjawisko
„zimnego p omienia”. Trzymany pod wod
i
ogrzewany, bia y fosfor powoli odparowuje i
zaczyna si
arzy . Temperatura tego p omienia
jest niska i dlatego nazywa si
go „zimnym
omieniem”.
Fosfor bia y:
O
H
P
H
H
O
+I
bezbarwna lub
tawa ciecz

21
Fosfor
P
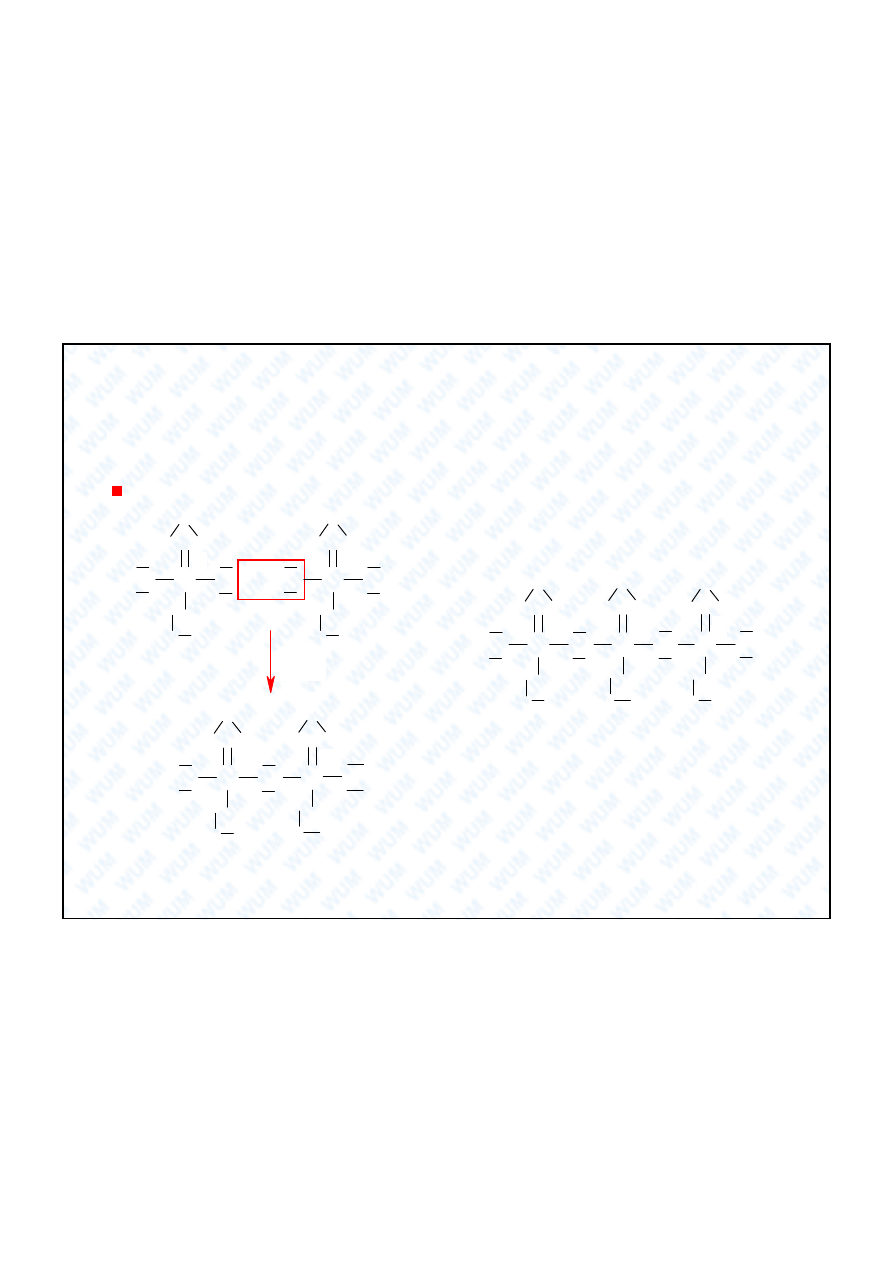
Fosfor czerwony
, amorficzny, otrzymuje si ogrzewaj c fosfor bia y w temp. 250
o
C bez
dost pu powietrza (katalizuj
lady jodu). Ciemnoczerwona, bezwonna, nietoksyczna
substancja, nierozpuszczalna w CS
2
i znacznie mniej reaktywna od fosforu bia ego. Jest
produktem polimeryzacji fosforu bia ego, w którym p kaj wi zania w cz steczkach P
4
i
tworz si
cuchy:
22
Fosfor
P
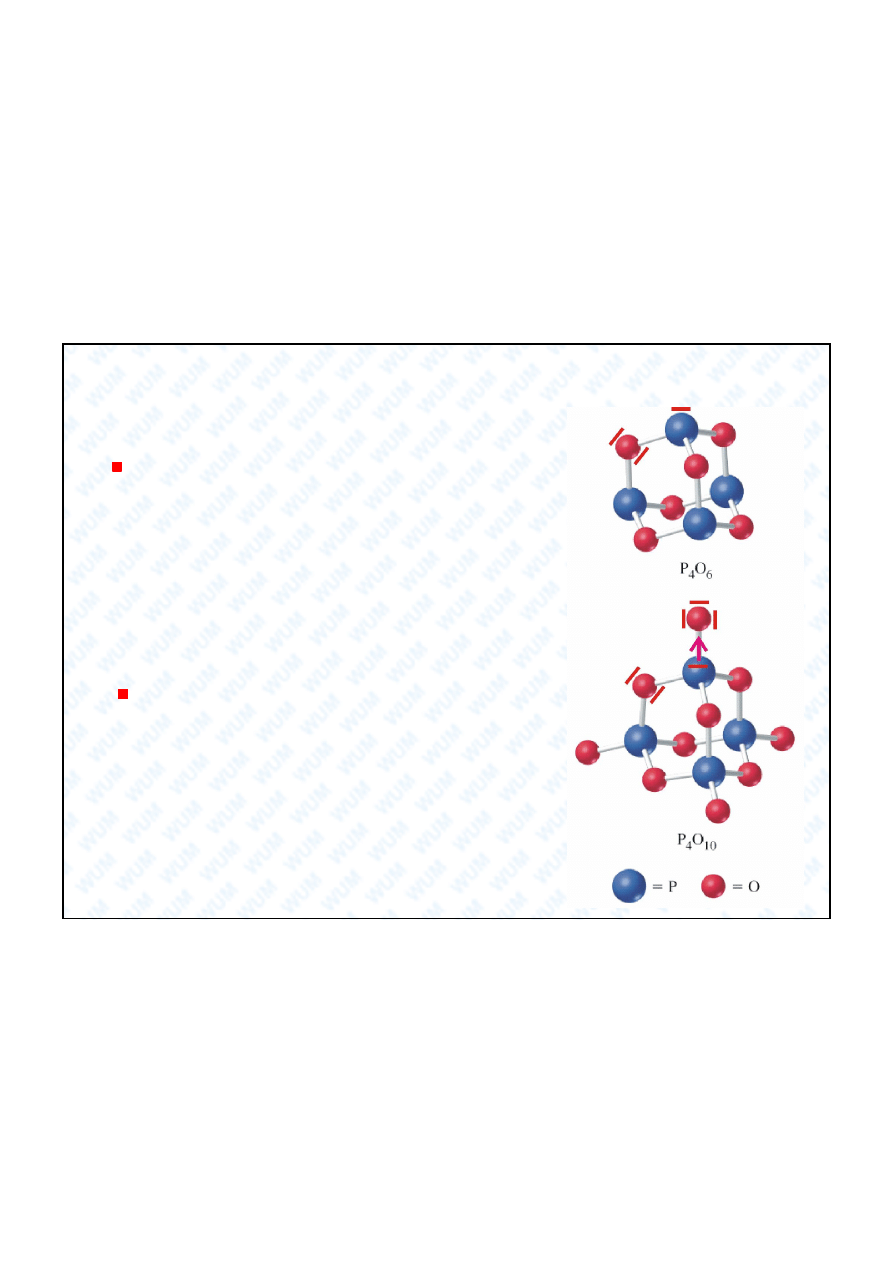
4. Tlenki fosforu
P
4
O
6
stopie utlenienia
+III heksatlenek terafosforu
Bia e, truj ce cia o sta e, bezwodnik kwasu
fosfonowego H
3
PO
3
:
P
4
O
6
+ 6H
2
O
4 H
3
PO
3
(na zimno),
z gor
wod
dysproporcjonuje si
do H
3
PO
4
, PH
3
i
czerwonego P
Otrzymywanie: spalanie P przy ograniczonym
dost pie powietrza.
P
4
O
10
stopie utlenienia
+V dekatlenek tetrafosforu
Bia e, bardzo higroskopijne cia o sta e ( rodek
odwadniajacy), bezwodnik kwasu ortofosforowego(V)
H
3
PO
4
:
P
4
O
10
+ 6H
2
O
4 H
3
PO
4
Otrzymywanie: spalanie P przy obfitym dost pie
powietrza.

23
Fosfor
P
4. Kwasy fosforu
4.1. Kwasy proste
O
H
P
H
OH
O
III
fosfonowy H
3
PO
3
(dawniej fosforawy)
Kwas dwuprotonowy
bia e cia o sta e
O
H
P
OH
OH
O
V
ortofosforowy(V)
H
3
PO
4
Kwas trójprotonowy o redniej mocy, bezbarwne,
przezroczyste kryszta y; w sprzeda y 85% roztwór
(bezbarwna, g sta, lepka ciecz)
Sole pierwszo-
(NaH
2
PO
4
), drugo-
(Na
2
HPO
4
)
i
trzeciorz dowe (Na
3
PO
4
). Pierwszorz dowe s
rozpuszczalne w wodzie. Drugo- i trzeciorz dowe – dobrze
rozpuszczalne w wodzie s tylko ortofosforany litowców.
Otrzymywanie H
3
PO
4
:
1. P
4
O
10
+ 6H
2
O
4H
3
PO
4
2. Ca
3
(PO
4
)
2
+ 3H
2
SO
4
3CaSO
4
+ 2H
3
PO
4
fosforyt
Odwadnianie H
3
PO
4
:
H
3
PO
4
HPO
3
+ H
2
O
Bia a szklista masa, mieszanina cyklicznych polikwasów
(skondensowane typu meta)
2H
3
PO
4
H
4
P
2
O
7
+ H
2
O
Bia a szklista masa, g ównie kwas ortodifosforowy(V),
czyli pirofosforowy wg dawnej nomenklatury.
590 K
500 K
24
Fosfor
P
4.2. Kwasy skondensowane:
cuchowe – przedrostek orto, cykliczne – przedrostek meta
Kwasy
cuchowe
O
H
P
OH
O P
OH
OH
O
O
O
H
P
OH
OH
O
O
H
P
OH
OH
O
-H
2
O
V
V
V
V
P
OH
OH
O
O
H
P
OH
O
P
OH
O
O
O
V
V
V
H
4
P
2
O
7
kwas ortodifosforowy(V), dawniej
pirofosforowy – szklista masa
H
5
P
3
O
10
kwas ortotrifosforowy(V)
- nie uda o si go wydzieli w
postaci czystej, znane s sole

25
Fosfor
P
Kwasy cykliczne – wzór ogólny (HPO
3
)
n
Pier cie sze ciocz onowy
H
3
P
3
O
9
kwas metatrifosforowy(V),
- nie uda o si go wydzieli w postaci czystej,
znane s sole
Pier cie
miocz onowy
H
4
P
4
O
12
kwas metatetrafosforowy(V)
- nie uda o si go wydzieli w
postaci czystej, znane s sole
O
H
P
OH
OH
O
O
H
P
OH
OH
O
OH
P
O
H
O
H
O
O
P
O
P
O
P
O
H
OH
OH
O
O
O
-3H
2
O
V
V
V
V
V
V
O
H
P
O P
OH
O
O
O
H
P
O P
OH
O
O
O
O
V
V
V
V
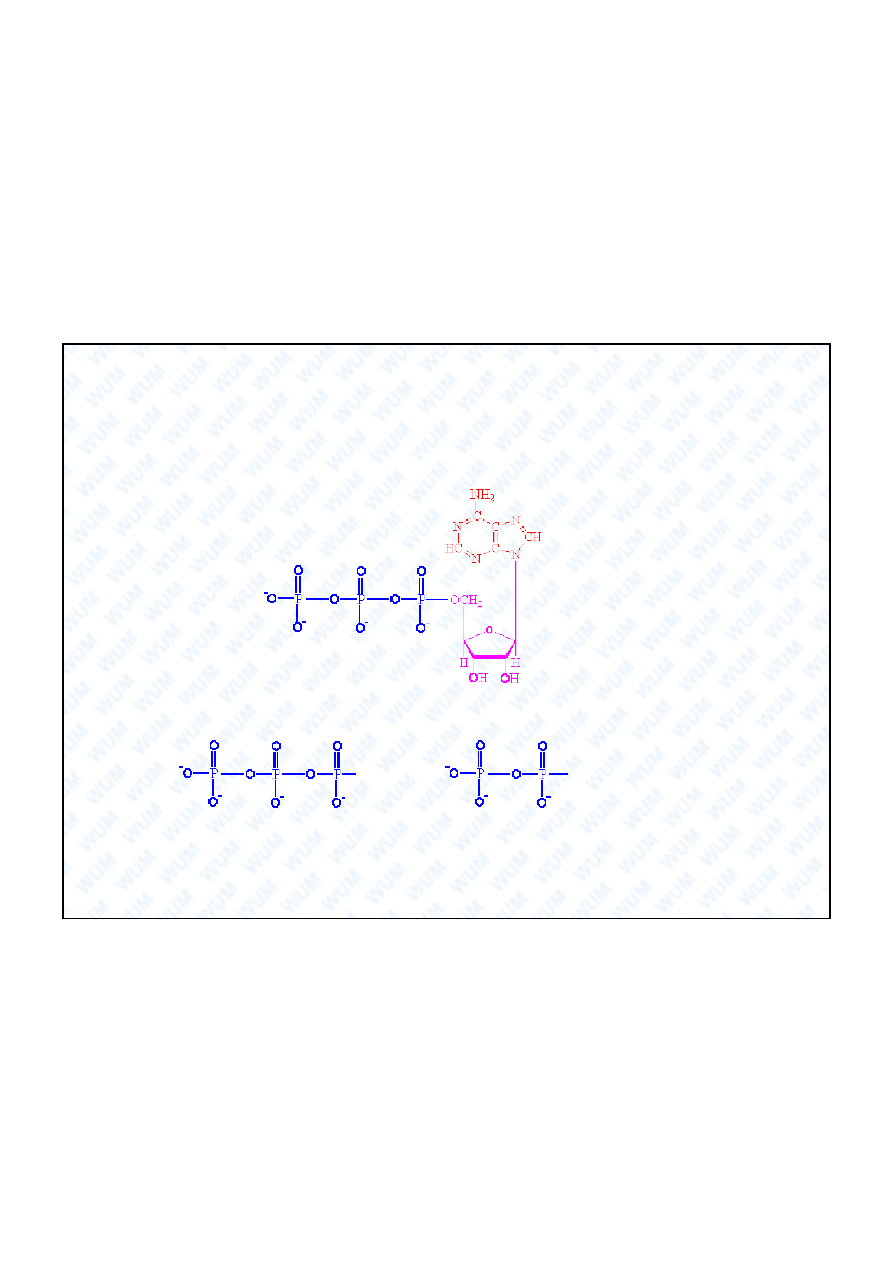
26
Fosfor
P
Najwa niejszym polifosforanem jest trifosforan adenozyny ATP,
wyst puj cy w ka dej ywej komórce:
Przemiana ATP w difosforan adenozyny ADP, w reakcji:
R
+ H
2
O
R
+ HPO
4
2-
+ H
+
(aq)
uwalnia du o energii, która jest niezb dna do przebiegu ró nych
procesów wewn trzkomórkowych.
adenina
ryboza
Wyszukiwarka
Podobne podstrony:
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 07 2010
Chemia ogolna i nieorg 12 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Ćw. 13 - rozdział przez ekstrakcję - sprawko, Chemia ogólna i nieorganiczna
Egzamin 2010 - 2011 - wymagania, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, ch
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron