
1
Wybrane niemetale
Wodór
glowce IVA: w giel i krzem
Azotowce VA:
azot i fosfor
Tlenowce VIA: tlen i siarka
Fluorowce VIIA

2
Fluorowce
I.
Charakterystyka ogólna
1.
Grupa VIIA (17)
– nas najbardziej interesuj F, Cl, Br i I.
2. Konfiguracja elektronowa pow oki walencyjnej:
s
2
p
5
(brakuje jednego elektronu do konfiguracji gazu szlachetnego)
3. Elektroujemno ci Paulinga:
F
4.0
, Cl
3.2
, Br
3.0
, I
2.7
, At
2.2
W okresach fluorowce maj najwi ksze elektroujemno ci.
F jest najbardziej elektroujemnym pierwiastkiem.
4. Typowe niemetale (At jest klasyfikowany jako niemetal albo pó metal), w stanie
pierwiastkowym wyst puj
w cz steczkach dwuatomowych
X
2
, jedna forma
alotropowa.
5. Wi zania: g ównie pojedyncze a je li hybrydyzacja, to przede wszystkim
sp
3
(ale IF
3
, IF
5
i IF
7
!); jonowe z metalami, kowalencyjne (ew. spolaryzowane) z
niemetalami.
6. Jony: ze wzgl du na znacze powinowactwo elektronowe, silna tendencja do tworzenia
jonów
X
-
; wysokie potencja y jonizacji sprawiaj , e utworzenie jonu X
+
wymaga
znacznego nak adu energii.
7. G ówne stopnie utlenienia: dla Cl, Br i I najtrwalszym stopniem utlenienia jest
–I
; w
przypadku F jest to jedyny stopie utlenienia; pozosta e pierwiastki mog mie dodatnie
stopnie utlenienia, z których najbardziej popularne s
+I
,
+III
,
+V
i najwy szy stopie
utlenienia
+VII
, równy numerowi grupy.

3
Fluorowce
8. W
ciwo ci redoks: w stanie pierwiastkowym nale
do najsilniejszych utleniaczy;
F jest najsilniejszym utleniaczem spo ród wszystkich pierwiastków
F
2
|2F
-
+2,87 V
; silne
utleniacze na dodatnich stopniach utlenienia, szczególnie w roztworach kwa nych.
ciwo ci utleniaj ce:
F
2
> Cl
2
> Br
2
> I
2
ciwo ci redukcyjne:
F
-
< Cl
-
< Br
-
< I
-
9. Aktywno
w stanie pierwiastkowym: najbardziej aktywna grupa pierwiastków; w temp.
pokojowej cz
si
z wieloma pierwiastkami i reaguj
z wieloma zwi zkami chem.;
du a aktywno
wynika z ma ej energii wi zania X-X i du ej elektroujemno ci;
aktywno
w grupie maleje od F
2
do I
2
; F
2
jest najbardziej aktywnym niemetalem;
fluorowce s
ce i toksyczne.
F
2
> Cl
2
> Br
2
> I
2
Reaktyw-
no
2.7
3.0
3.2
4.0
(Pauling)
151
193
243
158
H dla
X-X w
kJ/mol
I
Br
Cl
F
Br
-
Cl
2
Cl
2
+ 2Br
-
Br
2
+ 2Cl
-

4
Fluorowce
II. Wyst powanie i otrzymywanie
1. Ze wzgl du na du
aktywno
wyst puj
tylko w zwi zkach chemicznych; popularne
minera y to fluoryt CaF
2
, kriolit Na
3
AlF
6
i sól kamienna (halit) NaCl, NaIO
3
towarzyszy
saletrze chilijskiej NaNO
3
; Cl jest najbardziej rozpowszechniony z fluorowców, 11-te
miejsce co do zawartosci w ród wszystkich pierwiastków (0,19 % mas.) – 2% mas.
wody morskiej stanowi Cl w postaci Cl
-
; na drugim miejscu w ród fluorowców jest F,
którego jest prawie 4 razy mniej ni Cl; At jest promieniotwórczy, powstaje z
235
U i
238
U
– pierwiastek o najmniejszej naturalnej zawarto ci na Ziemi (ok. 30 g).
2. Otrzymywanie fluoru: elektroliza stopionej mieszaniny
KF + HF (1:2) w temp. 380 K
A(+) 2F
-
F
2
+2e
-
(anoda w glowa)
K(-)
2H
+
+ 2e
-
H
2
Uwaga ! rodowisko musi by bezwodne,
gdy F
2
rozk ada wod .
3. Otrzymywanie chloru:
Laboratoryjne: st
. kwas solny + KMnO
4
lub MnO
2
2
MnO
4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O
5
2Cl
-
Cl
2
+ 2e
-
2MnO
4
-
+ 10Cl
-
+16H
+
2Mn
2+
+ 5Cl
2
+ 8H
2
O
Przemys owe: elektroliza wodnego roztworu NaCl lub stopionego NaCl.
Morze Martwe
rednie zasolenie 27,6 % !

5
Fluorowce
3.
Otrzymywanie bromu: wypieranie chlorem z zakwaszonej wody morskiej
2Br
-
+ Cl
2
Br
2
+ 2Cl
-
pH = 3,5
4.
Otrzymywanie jodu: redukcja jodanów (V)
2IO
3
-
+ 12H
+
+ 10e
-
I
2
+ 6H
2
O
5
HSO
3
-
+ H
2
O
SO
4
2-
+ 3H
+
+ 2e
-
2IO
3
-
+ 5 HSO
3
-
I
2
+ 5 SO
4
2-
+ 3H
+
+ H
2
O
III. W
ciwo ci fizyczne
1.
Stan skupienia
F
2
– blado
ty gaz
Cl
2
tozielony gaz
Br
2
– czerwonobrunatna ciecz, czerwonobr zowe pary
I
2
– niebieskoczarne kryszta y o po ysku metalicznym,
atwo sublimuje, fioletowe pary
V
0
IV
VI
brom
chlor
jod
fluor
Fluorowce s
jedyn
grup
uk adu okresowego, w której w
temp. pokojowej wyst puj
pierwiastki we wszystkich
stanach skupienia.

6
Fluorowce
2. Rozpuszczalno
Fluor gwa townie rozk ada wod .
Pozosta e fluorowce rozpuszczaj si w wodzie (rozpuszczanie fizyczne) oraz powoli z ni
reaguj
(ustala si
równowaga chemiczna). Chlor i brom rozpuszczaj
si
w wodzie
umiarkowanie jak na gazy, daj c bezbarwn
wod chlorow (ok. 1 % mas. Cl
2
) i brunatn
wod
bromow
(ok. 3,5 % mas. Br
2
). Podczas krzepni cia tych roztworów wydzielaj
si
hydraty: Cl
2
8H
2
O oraz Br
2
10H
2
O.
Jod s abo rozpuszcza si
w wodzie i z ni
nie reaguje. Jego rozpuszczalno
w wodzie
zwi ksza si w obecno ci jonów jodkowych:
I
2
+ I
-
I
3
-
(p yn Lugola, barwa brunatna)
Brom i jod rozpuszczaj
si
w niektórych rozpuszczalnikach organicznych lepiej ni
w
wodzie. Jod tworzy barwne kompleksy EDA z rozpuszczalnikami aromatycznymi, np. nie
tworzy kompleksu z CCl
4
(barwa fioletowa) a tworzy kompleks z C
6
H
6
(barwa brunatna).
IV. W
ciwo ci chemiczne w stanie pierwiastkowym
1. Reakcja z wod
Fluor utlenia tlen wody !
F
2
+ H
2
O
2HF + ½O
2
Chlor i brom ulegaj dysproporcjonacji:
X
2
+ H
2
O
X
-
+ HOX + H
+
po czym na wietle
HOX H
+
+ X
-
+ [O]
(dzia anie utleniajace, biel ce i
dezynfekujace)
wiat o
-II
0
0
-I
0
-I
+I
+I
-I
0

7
Fluorowce
2. Reakcja z alkaliami
W roztworach alkalicznych rozpuszczalno
chloru, bromu i jodu znacznie wzrasta, gdy
zachodzi reakcja dysproporcjonacji:
X
2
+ 2OH
-
X
-
+ XO
-
+ H
2
O
Powy sza reakcja zachodzi dla roztworów rozcie czonych zasad na zimno ! W st
onych
roztworach zasad na gor co:
3X
2
+ 6OH
-
5X
-
+ XO
3
-
+ 3H
2
O
3. Reaktywno
poszczególnych pierwiastków
Ka dy fluorowiec wypiera pierwiastki tej grupy o wy szej liczbie atomowej z roztworów
wodnych ich jonów X
-
; reaktywno
w grupie maleje od F
2
do I
2
.
Fluor jest najbardziej reaktywnym pierwiastkiem spo ród wszystkich pierwiastków. Nie
reaguje bezpo rednio tylko z tlenem, helem i neonem. Reakcje z pozosta ymi pierwiastkami
silnie egzotermiczne, cz sto wybuchowe. Jest tak silnym utleniaczem, e powstaj
zwi zki zawieraj ce pierwiastki na nietypowo wysokich stopniach utlenienia, np. OF
2
, AgF
2
,
PtF
6
i IF
7
. W obecno ci wilgoci (pary wodnej) dzia a na szk o z wydzieleniem SiF
4
i O
2
.
Fluor przechowuje si w naczyniach teflonowych i miedzianych (ochronna warstwa CuF
2
).
Chlor jest mniej reaktywny od fluoru ale reaguje bezpo rednio z wi kszo ci
pierwiastków. W chlorze spalaj si S (do S
2
Cl
2
), P (do PCl
3
i PCl
5
) i Na oraz inne metale
metale, zw aszcza sproszkowane lub po podgrzaniu. Po czenia z O, N i C otrzymuje si
jednak w sposób po redni. Dzia anie wybielaj ce i dezynfekuj ce (poprzednie prze rocze).
Fotochemiczna, rodnikowa, gwa towna reakcja chloru z wodorem.
+I
0
-I
+V
0
-I

8
Fluorowce
Reakcja rodnikowa z w glowodorami:
C
x
H
y
+ ½yCl
2
xC + yHCl
Zapalona wieczka wprowadzona do chloru pali si
dalej czerwonawym p omieniem, przy
czym wydziela si du o sadzy.
Reakcja z NH
3
w fazie gazowej
Nadmiar NH
3
:
2NH
3
+ 3Cl
2
N
2
+ 6HCl
NH
3
+ HCl
NH
4
Cl
Nadmiar Cl
2
:
NH
3
+ 3Cl
2
NCl
3
+ 3HCl
NCl
3
– oleista, wybuchowa ciecz
Reakcja z H
2
S w fazie gazowej:
H
2
S + Cl
2
2HCl + S
Brom reaguje podobnie jak chlor, lecz mniej gwa townie.
Jod jest najmniej aktywny spo ród fluorowców.
czy si bezpo rednio tylko z P, F i Cl.
Fioletowe zabarwienie skrobi
zwi zek addycyjny amylozy i I
3
-
.
yn
Lugola
I
3
-
9
V. Zwi zki chemiczne fluorowców
1.
Zwi zki z wodorem
Otrzymywanie
CaF
2
+ H
2
SO
4
CaSO
4
+ 2HF
NaCl + H
2
SO
4
NaHSO
4
+ 2HCl
Wkraplanie Br
2
do mieszaniny czerwonego P i H
2
O:
2P + 3Br
2
2PBr
3
PBr
3
+ 3H
2
O
H
3
PO
3
+ 3HBr
Wkraplanie wody do mieszaniny czerwonego P i I
2
(reakcje jak wy ej):
2P + 3I
2
2PI
3
PI
3
+ 3H
2
O
H
3
PO
3
+ 3HI
ciwo ci fluorowcowodorów
Stan skupienia i w
ciwo ci kwasowe:
Fluorowce
-10
-9
-7
3.2
pK
a
(H
2
O)
-35
-67
-85
20
t.w./
o
C
HI
HBr
HCl
HF
Moc kwasów: HF < HCl < HBr < HI
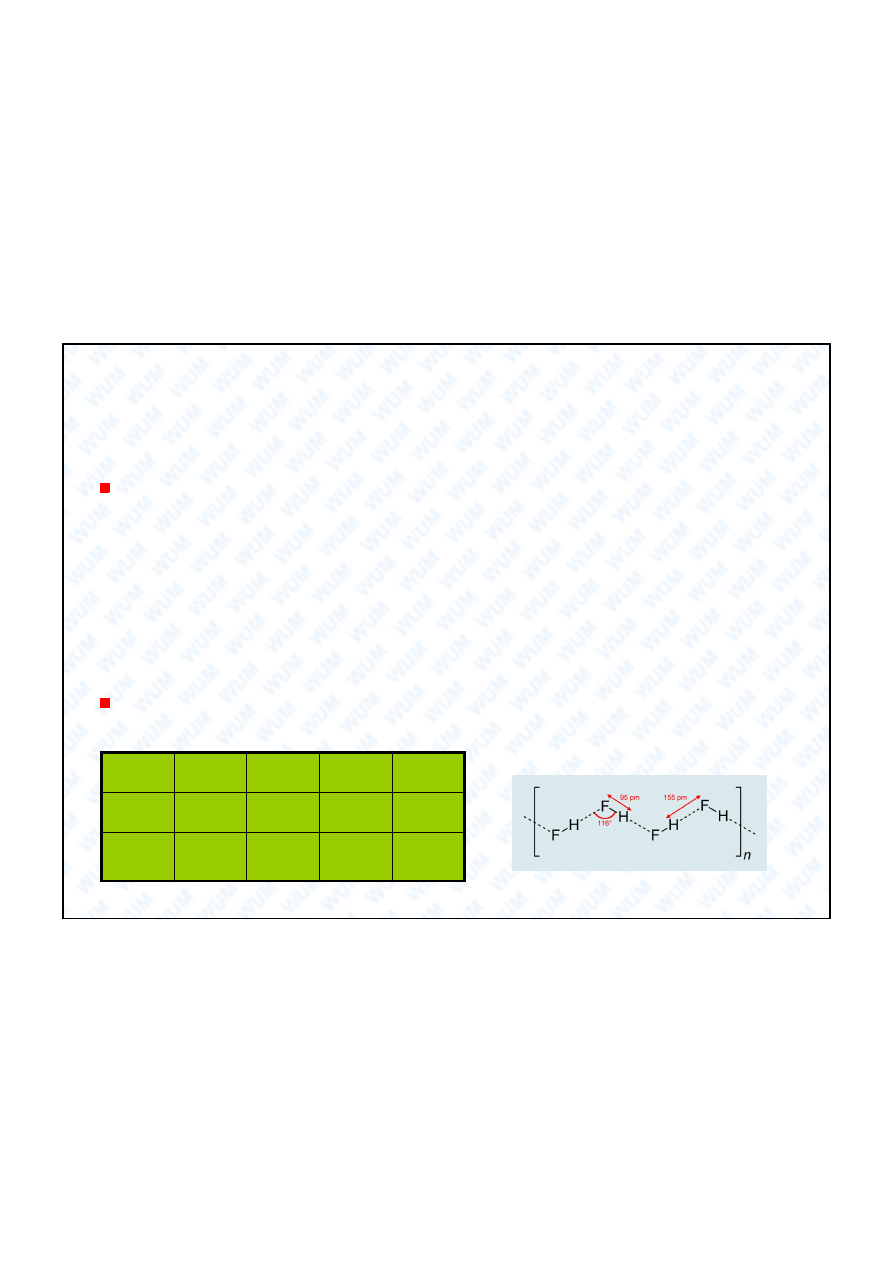
Wysoka temp. wrzenia HF jest
spowodowana asocjacj
jego
cz steczek za pomoc
wi za
wodorowych.

10
Fluorowce
ciwo ci redoks:
HI jest do
skutecznym reduktorem. HCl daje si
utleni mocnymi utleniaczami (KMnO
4
,
KClO
3
i st
. HNO
3
). HF nie ma w
ciwosci redukcyjnych.
Kwas fluorowodorowy
W niezbyt st
onym roztworze wodnym jest s abym kwasem. W st
onym roztworze moc
kwasu ro nie z powodu reakcji:
F
-
+ HF
HF
2
-
Ciek y HF jest bardzo mocnym kwasem i dobrym rozpuszczalnikiem (
= 84).
Autodysocjacja:
2 HF
H
2
F
+
+ F
-
3HF
H
2
F
+
+ HF
2
-
Trawienie szk a:
SiO
2
+ 4HF
SiF
4
(gaz) + 2H
2
O
Kwas solny
Najcz
ciej u ywany kwas HX. HCl znajduje si
w
dku. Wodny roztwór HCl jest
bezbarwny. Mocny kwas. W handlu st
. dymi cy 38% o d = 1,19 g/ml. Chlorki s
dobrze
rozpuszczalne w wodzie z wyj tkiem PbCl
2
, AgCl, Hg
2
Cl
2
i TlCl.
2. Zwi zki z tlenem
Fluorki tlenu (F jest bardziej elektroujemy ni O !)
OF
2
difluorek tlenu – bezbarwny, toksyczny gaz o bardzo silnych w
ciwo ciach
utleniaj cych. Geometria cz steczki podobna do H
2
O.
2F
2
+ 2NaOH (rozcie cz.)
2NaF + H
2
O + OF
2
Tlen zostaje utleniony !!!
W reakcji tej jeden atom tlenu O(
–II
) oddaje 4 elektrony czterem atomom F(
0
).
0
-II
-I
+II -I
+II

11
Fluorowce
O
2
F
2
difluorek ditlenu –
te, b. nietrwa e cia o sta e (szczególnie po stopieniu,
t.t. – 154
o
C), o bardzo silnych w
ciwo ciach utleniaj cych. Geometria cz steczki
podobna do H
2
O
2
. Otrzymywanie: O
2
+ F
2
(1:1), niskie ci nienie 1-3 kPa, temp. ok.
-190
o
C, silne wy adowania elektryczne.
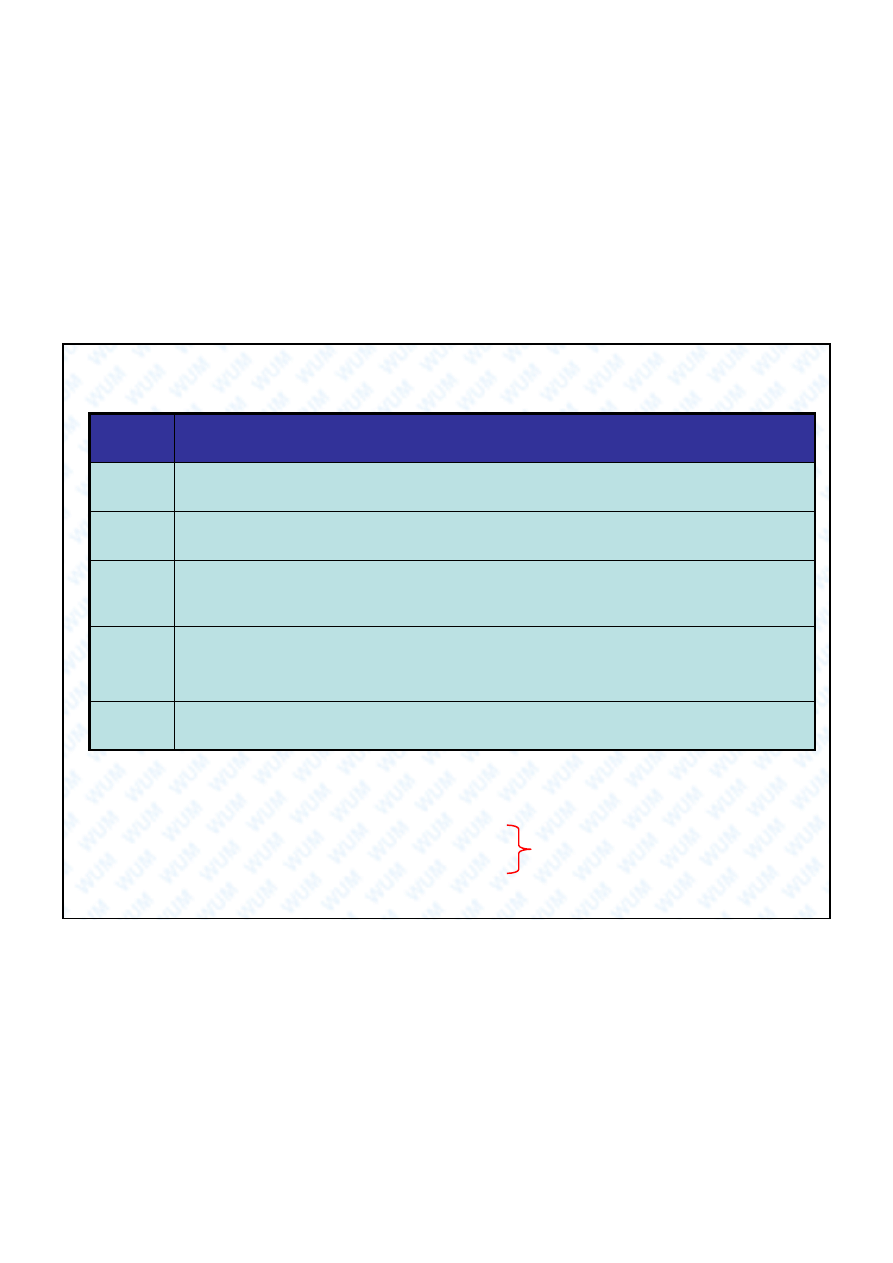
Tlenki chloru
Wszystkie rozk adaj
si
wybuchowo, s
bezwodnikami kwasowymi i maj
silne
ciwo ci utleniajace. ClO
2
jest paramagnetyczny.
+I
bezbarwna oleista ciecz
heptatlenek dichloru
+VII
Cl
2
O
7
ciemnoczerwona ciecz
heksatlenek dichloru
+VI
Cl
2
O
6
tozielony gaz
ditlenek chloru
tetratlenek dichloru
+IV
ClO
2
Cl
2
O
4
ciemnobrunatne cia o sta e
tritlenek dichloru
+III
Cl
2
O
3
tobrunatny gaz
tlenek dichloru
+I
Cl
2
O
Barwa i stan skupienia
Nazwa tlenku
Stopie
utlenienia
chloru
Wzór
12
Fluorowce
Odwodnienie HClO
4
za pomoc P
4
O
10
Cl
2
O
7
2ClO
2
+ 2O
3
Cl
2
O
6
+ 2O
2
2Cl(+IV)
z ClO
2
+ 2O(0)
z O
3
2Cl(+VI)
z Cl
2
O
6
+ 2O(-II)
z Cl
2
O
6
Cl
2
O
6
KClO
3
+ H
2
SO
4
HClO
3
+ KHSO
4
3HClO
3
2ClO
2
+ [H
3
O
+
][ClO
4
-
]
2ClO
2
Cl
2
O
4
ClO
2
Cl
2
O
4
Fotoliza ClO
2
w temp. -78
o
C
Cl
2
O
3
2Cl
2
+ HgO
HgCl
2
+ Cl
2
O
Cl
2
O
Otrzymywanie
Wzór
273 K
0
-I
+I
+V
+IV
+VII
Reakcje z zasadami:
Cl
2
O + 2NaOH
2NaClO + H
2
O
(Cl
2
O
4
) 2ClO
2
+ 2NaOH
NaClO
2
+ NaClO
3
+ H
2
O
Cl
2
O
6
+ 2NaOH
NaClO
3
+ NaClO
4
+ H
2
O
Cl
2
O
7
+ 2NaOH
2NaClO
4
+ H
2
O
dysproporcjonacja
+IV
+III
+V
+VI
+V
+VII

13
Fluorowce
Pentatlenek dijodu
I
2
O
5
zas uguje na uwag ze wzgl du na swoje zastosowania analityczne. Otrzymuje si go
utleniaj c I
2
kwasem azotowym(V). Bia e cia o sta e. U ywa si go do oznaczania CO:
I
2
O
5
+ 5CO
5 CO
2
+ I
2
3. Tlenowe kwasy fluorowców
Kwasy tlenowe chloru
(struktura elektronowa by a omówiona wcze niej przy wi zaniach chemicznych)
Trwa
i moc rosn ze stopniem utlenienia chlorowca. Wszystkie s silnymi utleniaczami.
Analogicznie jest dla innych chlorowców. Aniony s bardziej trwa e od kwasów.
kwas nadchlorowy
kwas chlorowy(VII)
HClO
4
kwas chlorowy
kwas chlorowy(V)
HClO
3
kwas chlorawy
kwas chlorowy(III)
HClO
2
kwas podchlorawy
kwas chlorowy(I)
HClO
Dawna nazwa
Nazwa systematyczna
Wzór
Tylko kwas chlorowy(VII) daje si
wydzieli w postaci wolnej (czystej). Jest bezbarwn ,
oleist , higroskopijn (dymi
) ciecz , atwo wybucha. Jeden z najsilniejszych kwasów
(pK
a
= -7) i utleniaczy. Miesza si z wod w ka dym stosunku. W sprzeda y 70% HClO
4
.

14
Fluorowce
Chlorany:
chlorany(I)
rodki biel ce i dezynfekujace: CaCl(OCl), czyli wapno chlorowane
i podchloryn sodu NaClO
Otrzymywanie:
Ca(OH)
2
(sta y) + Cl
2
CaCl(OCl) + H
2
O
NaClO powstaje podczas elektrolizy NaCl/H
2
O, gdy miesza si
roztwór katodowy i anodowy.
Rozk ad:
CaCl(OCl) + 2HCl
CaCl
2
+ H
2
O + Cl
2
CaCl(OCl)
CaCl
2
+ ½O
2
otrzymywanie chloranów(V) i chloranów(VII)
Przepuszczanie chloru przez roztwory st
onych zasad na gor co:
3Cl
2
+ 6OH
-
5Cl
-
+ ClO
3
-
+ 3H
2
O
Chlorany(VII) otrzymuje si przez elektrolityczne utlenianie chloranów(V):
ClO
3
-
+ H
2
O
ClO
4
-
+ 2H
+
+ 2e
-
reakcje dysproporcjonacji podczas ogrzewania
3NaClO (sta y)
NaClO
3
+ 2NaCl
4KClO
3
(sta y)
3KClO
4
+ KCl bez katalizatora
ale
2KClO
3
(sta y)
2KCl + 3O
2
kat. MnO
2
, 600 K
+I
-I
+V
+V
-I
+VII
+V
-I
-II
0
[Cl] i [O] in statu
nascendi
+V
0
-I

15
Fluorowce
wybuchowo
nadchloranów
(w obecno ci ladów substancji organicznych, w roztworach i w stanie sta ym, szczególnie
przy ogrzewaniu w obecno ci kationów o du ej g sto ci adunku)
Kwasy tlenowe pozosta ych chlorowców
HIO kwas jodowy(I)
aby kwas
HIO
2
kwas jodowy(III)
nie istnieje
HIO
3
kwas jodowy(V)
mocny kwas
HIO
4
kwas metajodowy(VII)
mocny kwas
H
5
IO
6
kwas ortojodowy(VII)
aby kwas
Podobnie jest dla bromu ale jest tylko jeden kwas na stopniu utlenienia +VII, tj. HBrO
4
.
Fluor ma tylko nietrwa y HOF, w którym tlen jest na stopniu utlenienia 0 !!!
VI. Niektóre zastosowania i aspekty biologiczne
1. Jodometria
Sn
2+
+ I
2
Sn
4+
+ 2I
-
S
2
O
3
2-
+ I
2
S
4
O
6
2-
+ 2I
-
tiosiarczan
tetrationian
Ró ni si wod
konstytucyjn .
Przyk ad: roztwór Sn
4+
traktuje si
nadmiarem
roztworu jodu, dodaje si
skrobi jako wska nika a
pó niej nadmiarowy jod
odmiareczkowuje si
roztworem tiosiarczanu.
16
Fluorowce
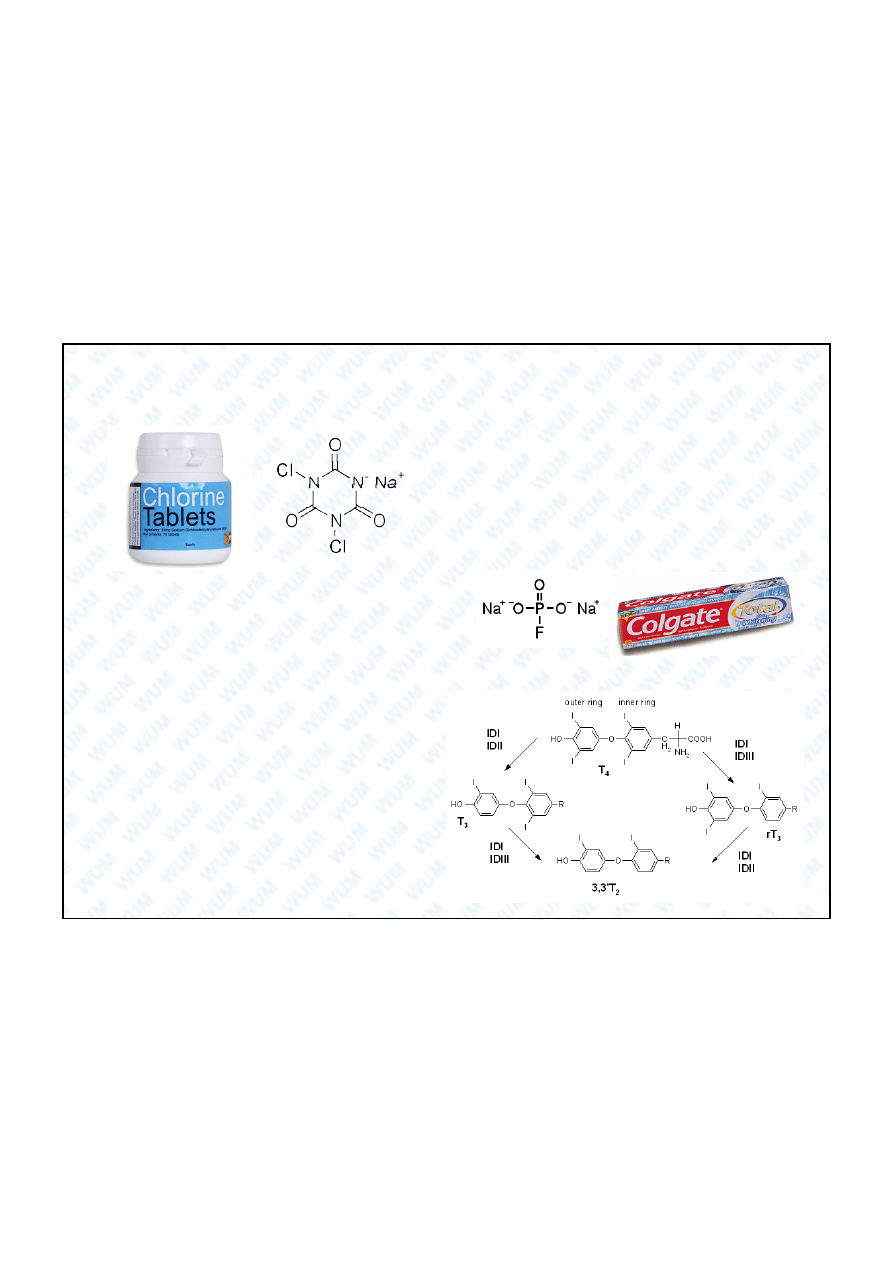
2. rodki dezynfekuj ce i odka aj ce wod
Dihydrat soli sodowej kwasu
dichloroizocyjanurowego (NaDCC) - bia e
cia o sta e, reaguje z wod
daj c HClO
(ustala si
raczej skomplikowana
równowaga chemiczna).
3. Monofluorofosforan sodu Na
2
PO
3
F (MFP)
Sk adnik past do z bów – dzia anie fluoruj ce:
OH
-
+ PO
3
F
2-
PO
4
3-
+ H
+
+ F
-
Jony fluorkowe zast puj jony hydroksylowe w apatycie szkliwa: Ca
10
(PO
4
)
6
(OH)
2
4. Hormony tarczycy
Hormony tarczycy reguluj
przemian
materii. G ównym hormonem jest tyroksyna
T
4
(3,5,3’,5’-tetrajodotyronina) ale najbardziej
aktywna jest 3,5,3’-trijodotyronina T
3
. Formy
T
2
, T
3
i T
4
przekszta cane w reakcjach
enzymatycznych przez ró ne jodotyroninowe
dejodynazy (IDI, IDII i IDIII).
17
Fluorowce
5. Polichlorodibenzo-p-dioksyny (PCDD)
Atomy chloru PCDD mog by podsawione w pozycjach 1-4 i 6-9.
Od liczby i rozmieszczenia atomów chloru zale y toksyczno
zwi zku. Powstaj
jako zanieczyszczenia w ró nych
przemys owych procesach chemicznych oraz gdy w obecno ci
chloru lub jego zwi zków spalane s
substancje organiczne.
Rozpuszczalne w t uszczach, zanieczyszczaj
przede wszystkim
ywno
. Kumuluj
si
w organizmie. Maj
silne dzia anie
rakotwórcze. Najbardziej toksyczna jest 2,3,7,8-
tetrachlorodibenzo-p-dioksyna (TCDD).
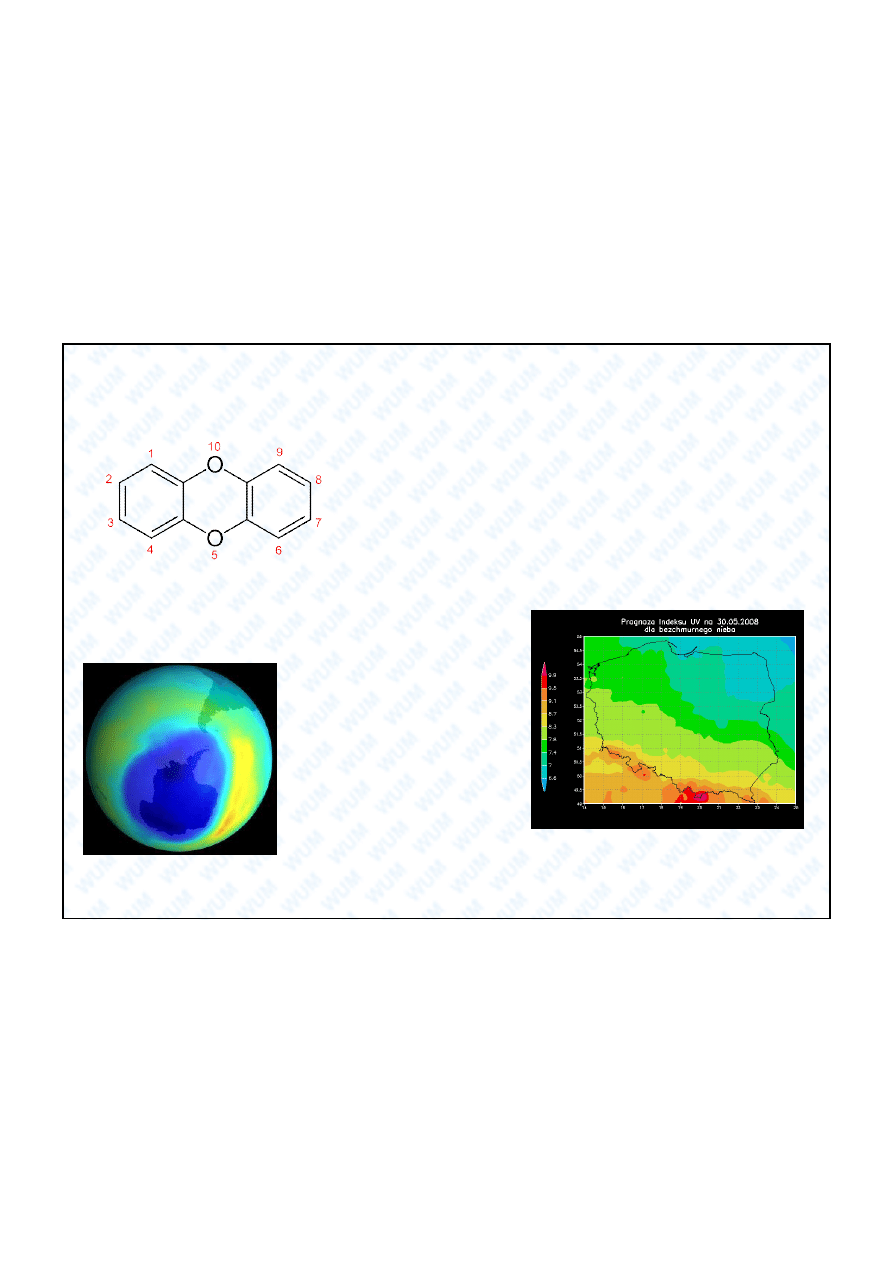
6. Dziura ozonowa
Dziura ozonowa nad Antarktyd .
Ozon stratosferyczny poch ania
promieniowanie UV-C (200-280
nm) i redukuje promieniowanie
UV-B (280-320 nm), których
ród em jest S
ce.
Promieniowanie UV-C i UV-B jest
szkodliwe dla organizmów
ywych. Freony s
chloro-
fluorow glowodorami, np. CCl
2
F
2
.
W ozonosferze rozpadaj
si pod
wp ywem promieniowania UV na
pierwiastki, a problem polega na
tym e chlor katalizuje przemian
ozonu w tlen molekularny. W
rezultacie ochronna warstwa
ozonu ulega degradacji.
Typowy redni indeks UV dla Polski w okresie
letnim wynosi ok. 8. Map indeksu UV mo na
znale
na stronie internetowej:
http://www.imgw.pl/internet/zz/pogoda/uv.html
Instytut Meteorologii i Gospodarki Wodnej
Wyszukiwarka
Podobne podstrony:
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 07 2010
Chemia ogolna i nieorg 12 2010
Chemia ogolna i nieorg 14 2010
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 14 2010
Egzamin 2010 - 2011 - wymagania, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, ch
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron