
Enzymologia
1
Ćwiczenia
Enzymologia

Enzymologia
2
Ćwiczenie I
Oznaczanie aktywności enzymów lipolitycznych
Część teoretyczna
Enzymy lipolityczne
Specyficzność niektórych enzymów polega na tym, że działają w
substracie na określony rodzaj wiązania chemicznego. Do tej grupy należą
enzymy lipolityczne – np. lipaza wydzielana przez trzustkę hydrolizuje
wiązanie estrowe występujące pomiędzy glicerolem i kwasami tłuszczowymi
w obrębie różnorodnej grupy lipidów. Lipaza należy do klasy hydrolaz, do
podgrupy esteraz, przy czym efektywne działanie tego enzymu jest
uzależnione od ściśle określonych warunków przebiegu reakcji.
L i p a z a
Lipazy są szeroko rozpowszechnione w przyrodzie: występują zarówno
w organizmach ludzi i zwierząt ( w trzustce, wątrobie, ścianie żołądka i jelit),
jak również w nasionach i organach wegetatywnych wielu roślin oraz w
niektórych mikroorganizmach.
Lipazy katalizują hydrolizę nierozpuszczalnych w wodzie triacylogliceroli
(TAG). Reakcja ta (rys.1) zachodzi na granicy międzyfazowej wody, (czyli fazy,
w której rozpuszczone są lipazy) z lipidami, (czyli fazy substratu) i prowadzi
do
powstania
kwasów
tłuszczowych,
diacylogliceroli
(DAG),
monoacylogliceroli (MAG) oraz glicerolu. Lipazy katalizują również hydrolizę
rozpuszczalnych
w
wodzie,
krótkołańcuchowych
estrów
kwasów
karboksylowych, która zachodzi jednak bardzo powoli.
C
H
2
C
H
C
H
2
O
O
OH
R1
R2
C
C
O
O
C
H
2
C
H
C
H
2
O
O
O
C
R1
R2
R3
C
C
O
O
O
O
C
R3
O
H
LIPAZA
+ H
2
O
- H
2
O
+
TRIACYLOGLICEROL
(TAG)
DIACYLOGLICEROL
(DAG)
WOLNY KWAS
TŁUSZCZOWY
C
H
2
C
H
C
H
2
O
O
OH
R1
R2
C
C
O
O
C
H
2
C
H
C
H
2
O
OH
OH
R1
C
O
O
C
R2
O
H
LIPAZA
+ H
2
O
- H
2
O
+
DIACYLOGLICEROL
(DAG)
WOLNY KWAS
TŁUSZCZOWY
MONOACYLOGLICEROL
(MAG)
LIPAZA
+ H
2
O
- H
2
O
+
C
H
2
C
H
C
H
2
O
OH
OH
R1
C
O
C
H
2
C
H
C
H
2
OH
OH
OH
O
C
R1
O
H
WOLNY KWAS
TŁUSZCZOWY
MONOACYLOGLICEROL
(MAG)
GLICEROL
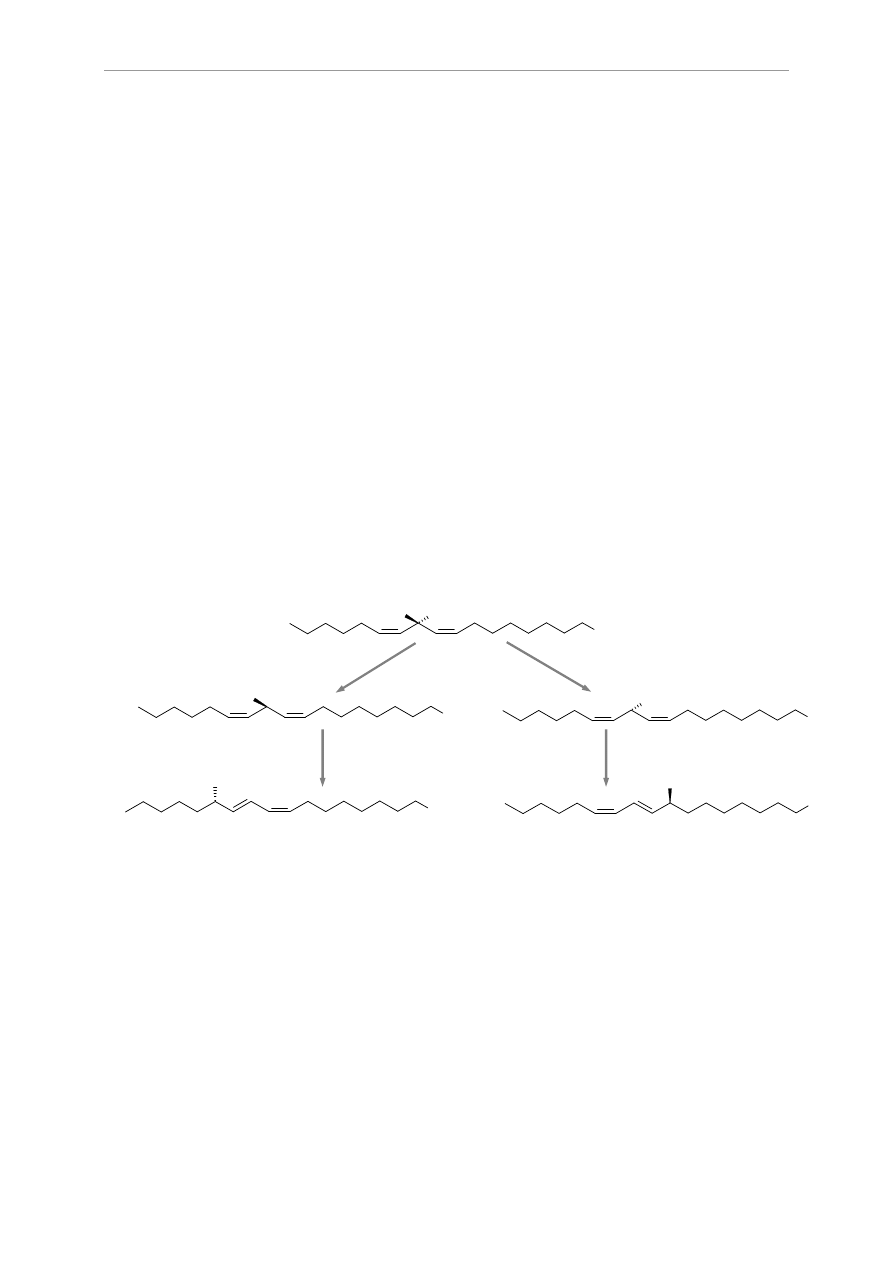
Rys. 1 Hydroliza triacyloglicerolu z udziałem lipazy

Enzymologia
3
Hydroliza triacylogliceroli jest reakcją odwracalną ze względu na
niewielką różnicę w zmianie energii swobodnej w kierunku hydroliza-synteza.
Kierunek reakcji jest zdeterminowany środowiskiem, przy czym nadmiar H
2
O
wywołuje hydrolizę, natomiast niska zawartość H
2
O reakcję odwrotną -
estryfikację glicerolu. Szybkość hydrolizy triacylogliceroli wzrasta z liczbą
reszt kwasów tłuszczowych, długością łańcucha oraz stopniem nienasycenia
kwasów tłuszczowych.
Katalizowanie reakcji przez lipazy w środowisku o kontrolowanej zawartości
H
2
O (współczynnik aktywności wodnej) możliwe jest w środowisku
rozpuszczalników organicznych, roztworów buforowych.
Lipazy katalizują trzy typy reakcji:
1. Hydrolizę – w środowisku wodnym, gdzie jest jej nadmiar.
2. Estryfikację – w środowisku o niskiej aktywności wody lub w
rozpuszczalnikach prawie bezwodnych.
3. Transestryfikację – polega na wymianie kwasów tłuszczowych w TAG:
a. Acydoliza – grupy acylowe pochodzą od wolnych kwasów
b. Interestryfikacja – wymiana grup acylowych pomiędzy
estrami
c. Alkoholiza – reakcja między alkoholem a estrem w wyniku
której po wymianie reszt alkoholowych między tymi
związkami powstaje nowy alkohol i nowy ester.
Optimum pH reakcji dla lipaz pochodzenia zwierzęcego wynosi 7,0 – 8,0, a
dla lipaz roślinnych w granicach pH 4,7-5,0, natomiast temperatura
efektywnego działania mieści się między 35 a 37°C.
Aktywność lipaz można badać, określając ilość uwolnionych kwasów
tłuszczowych, w czasie działania enzymu w optymalnych warunkach
doświadczalnych. Ilość uwolnionych kwasów tłuszczowych w próbkach
badanego substratu tłuszczowego, pobieranych w kolejnych odstępach
czasu, oznacza się przez miareczkowanie mianowanym roztworem
wodorotlenku potasowego.
Natomiast proces utleniania lipidów zachodzi w wyniku działania dwóch
enzymów - lipazy i lipooksygenazy, według poniższego schematu
tłuszczowce
↓ lipaza
kwasy tłuszczowe + glicerol
↓ lipooksygenaza
wodoronadtlenki kwasów tłuszczowych
↓
aldehydy i ketony
(
związki o charakterystycznym, nieprzyjemnym zapachu i smaku)
Proces ten zaczyna się od działania lipazy uwalniającej z cząsteczek
triacylogliceroli kwasy tłuszczowe, z których następnie powstają produkty
utlenienia. Rozkład tłuszczu następuje szybko np. podczas przemiału
pszenicy ( może być rozłożony w tych warunkach nawet w 2/3 całkowitej

Enzymologia
4
ilości), wtedy mąka charakteryzuje się gorzkim smakiem. Wysoką aktywność
lipolityczną mają zarodki pszenne, a znaczna część całkowitej ilości lipazy
zawarta jest w otrębach.
Aktualnie
wykorzystywane
lipazy
głównie
są
pochodzenia
mikrobiologicznego.
Spośród
drobnoustrojów
znaczne
ich
ilości
syntetyzowane są przez różne szczepy drożdży, pleśni czy bakterii (Candida
antarctica, Candida rugosa, Candida cylindracea, Rhizomucor miehei,
Aspergillus niger, Pseudomonas pseudomalle, Bacillus fluorescens, Bacillus
piocyaneum). Zastosowanie mają w przemyśle spożywczym do produkcji
wielu komercyjnie ważnych niskocząsteczkowych estrów o określonych
walorach zapachowo-smakowych. Nadają one odpowiedni aromat i smak , a
stosowane są najczęściej do napojów, soków, nektarów oraz wielu różnych
produktów spożywczych jak np. budynie, kisiele, dżemy, ciastka itp..
Niektóre związki posiadają charakterystyczny smak – np. bananowy (octan
izoamylu), ananasowy (maślanian metylu), owocowy (propionian metylu) lub
aromat - miodowy (estry tolilu), różany (octan cytronellylu), owocowy (octan
terpinylu). Wybrane lipazy pochodzenia mikrobiologicznego hydrolizując np.
tłuszcz mleka krowiego, uwalniają głównie lotne kwasy tłuszczowe
(krótkołańcuchowe), których zawartość wynosi 8-10% ogólnej ilości
związanych w tłuszczu kwasów; inne odszczepiają przede wszystkim kwasy o
długich łańcuchach. Stosowane szeroko w przemyśle mleczarskim powodują
intensyfikację cech organoleptycznych, w tym przede wszystkim serów
twardych, którym uwolnione kwasy krótkołańcuchowe nadają pikantny
smak.
Ostatnio lipazy wykorzystywane są do syntezy estrów kwasów
tłuszczowych np. z kwasem askorbinowym (wit. C) oraz witaminą A. Te
związki mają charakter przeciwutleniaczy ale posiadają zmienione
właściwości hydrofobowo-hydrofilowe (kwas askorbinowy w formie estru
kwasu tłuszczowego rozpuszczalny jest w olejach) i mogą mieć szerokie
zastosowanie w przemyśle tłuszczowym lub kosmetycznym.
W trawieniu lipidów pożywienia w organizmach ludzi i zwierząt największe
znaczenie mają lipazy – trzustkowa (najbardziej efektywna), wątrobowa i
jelitowa. W produktach enzymatycznego rozkładu tłuszczu występują
równocześnie obok uwolnionych kwasów tłuszczowych i glicerolu, także
mono- i diacyloglicerole. Lipaza trzustkowa wykazuje swoistość działania w
stosunku
do
wiązań
estrowych
utworzonych
w
reakcji
kwasów
karboksylowych z pierwszorzędowymi grupami hydroksylowymi; odszczepia
więc wyłącznie kwasy tłuszczowe w pozycjach α i α
’
w cząsteczce
triacylogliceroli. Natomiast lipaza ze ściany jelita działa również na wiązania
estrowe w położeniu β, które powstają w reakcji kwasów tłuszczowych z
drugorzędową grupą alkoholową glicerolu. W warunkach fizjologicznych
równowaga reakcji jest przesunięta na korzyść produktów rozkładu i
biosynteza estrów pod wpływem lipaz praktycznie nie zachodzi.

Enzymologia
5
Wiele gałęzi przemysłu w tym nie tylko spożywczego, w produkcji swoich
wyrobów stosuje lipazy, zarówno pochodzenia zwierzęcego jak i
mikrobiologicznego:
• Przemysł mleczarski - serowarstwo – lipazy (pochodzenia zwierzęcego
lub pleśniowego) wykorzystywane są do produkcji serów typu
roquefort, cheddar oraz serów włoskich; enzym hydrolizuje częściowo
tłuszcz, powoduje to poprawę właściwości organoleptycznych serów
(aromatu, smaku), a także skraca czas ich dojrzewania
• Przemysł cukierniczy – stosowanie lipazy do hydrolizy pozostałości
tłuszczu w suchej albuminie jaj, ponieważ obecność tłuszczu obniża
zdolność białka do tworzenia piany; stosuje się traktowanie lipazą
masy jajecznej przed suszeniem przez co wzrasta organoleptyczna
jakość gotowego produktu, przy produkcji czekolady mlecznej – lipaza
powoduje powstawanie kwasów tłuszczowych, które poprawiają jej
smak i aromat
• Przemysł tłuszczowy – przy produkcji tłuszczów roślinnych - w
procesie modyfikowania tłuszczów, natomiast w transporcie i
przechowywaniu
nasion
roślin
oleistych
mogą
oddziaływać
niekorzystnie. Przy zbyt wysokiej zawartości wody znacznie wzrasta
kwasowość nasion, która jest nie korzystna z uwagi na zachodzącą
pod wpływem lipazy hydrolizę acylogliceroli i uwalnianie kwasów
tłuszczowych
• Przemysł skórzany – działanie lipazy na pozostałości tłuszczu w
surowcach i półproduktach skórzanych - odtłuszczanie skór, wełny,
szczeciny
• Przemysł tekstylny - produkcja jedwabiu – w skład głównego włókna
jedwabiu wchodzi ok. 0,7% tłuszczu, natomiast we włóknach
surowych zanieczyszczonych poczwarkami jedwabnika zawartość
tłuszczu wynosi 3-4%, dlatego stosuje się preparaty lipolityczne w celu
ich odtłuszczenia
• Przemysł chemiczny – jako składnik detergentów, bioemulgatorów
(zawierających enzymy lipolityczne) do produkcji środków piorących,
preparatów usuwających w szczególności tłuste plamy z odzieży, obić
meblowych, dywanów
• Przemysł farmaceutyczny - otrzymywanie preparatów leczniczych,
określonych leków np. wspomagających działanie trzustki i wątroby
Enzymologia
6
L i p o o k s y g e n a z a
Lipooksygenaza jest enzymem z klasy oksydoreduktaz, występujących
powszechnie we wszystkich organizmach roślinnych i zwierzęcych.
Lipooksygenazy należą do podklasy dioksygenaz zawierających żelazo,
katalizują reakcję utleniania wolnych lub zestryfikowanych polienowych
kwasów tłuszczowych do wodoronadtlenków. Lipooksygenaza katalizuje
utlenianie kwasów tłuszczowych, w których wiązania podwójne przedzielone
są grupami metylenowymi. Również niezbędnym elementem strukturalnym
jest konfiguracja cis-cis. Białka lipooksygenaz roślinnych składają się z
pojedynczego łańcucha o masie molekularnej około 75-100 kDa.
Proces katalizowany przez lipooksygenazy przebiega w trzech zasadniczych
etapach:
1. stereospecyficzne oderwanie wodoru od grupy metylenowej
położonej pomiędzy podwójnymi wiązaniami i utworzenie
rodnika kwasu tłuszczowego,
2. rekombinacja
wiązań
podwójnych
w
cząsteczce
kwasów
tłuszczowych w skoniugowane dieny,
3. stereospecyficzne przyłączenie cząsteczki tlenu i utworzenie
rodników nadtlenkowych.
Generowane przez lipooksygenazę wodoronadtlenki stanowią substraty
działania
kolejnych
enzymów,
takich
jak:
liazy,
izomerazy
wodoronadtlenkowe, peroksydazy, tlenowe syntetazy allenylowe. Początkowe
produkty działania lipooksygenazy mogą być degradowane do różnych
związków, włączając aldehydy, ketony (charakterystyczne związki zapachowe)
i alkohole.
Pośrednie produkty powstałe w wyniku działania lipooksygenazy mogą
ulegać cyklizacji w wyniku działania cyklooksygenazy allenylowej i ten szlak
COOH
OOH
•
COOH
H
COOH
H
H
COOH
H
COOH
OOH
•
13-HPODE
9-HPODE
Rys. 2. Utlenianie kwasu linolowego do 9- i 13-wodoronadtlenków po wpływem
katalitycznego oddziaływania lipooksygenazy.

Enzymologia
7
przemian prowadzi do powstania w roślinach kwasu jasmonowego i jego
pochodnych, pełniących funkcję hormonów roślinnych.
Lipooksygenazy biorą udział w utlenianiu przeciwutleniaczy takich jak
witamina C i E, natomiast adrenalina, noradrenalina czy N-acetylodopamina
przekształcane są przy współudziale tych enzymów w odpowiednie barwniki
melaninowe.
Powstawanie
wolnych
rodników
w
wyniku
działania
lipooksygenaz na polienowe kwasy tłuszczowe są jednym z istotnych
powodów zainteresowania tymi enzymami ze strony technologów żywności z
uwagi na fakt, że reagują one z innymi składnikami żywności – witaminami,
pigmentami, białkami czy polifenolami, obniżając jakość artykułów
spożywczych. Z drugiej strony wywierają korzystne działanie ze względu na
rolę, jaką odgrywają w procesie powstawania lotnych związków o
charakterystycznym zapachu i smaku w żywności, zarówno świeżej, jak i
przetworzonej, włączając grzyby, pomidory, ogórki, melony, banany, świeże i
mrożone warzywa oraz produkty otrzymywane z nasion roślin strączkowych.
Lipooksygenaza podobnie jak lipaza wywiera ujemny wpływ w trakcie
przechowywania
wielu
produktów
zbożowych.
Podczas
utleniania
polienowych kwasów tłuszczowych acylogliceroli zawartych np. w mące lub
kaszach powstają wodoronadtlenki, które następnie utleniają inne
składniki, w tym głównie tłuszcze, nadając tym produktom nieprzyjemny
zapach i smak.
Reakcja katalizowana przez lipooksygenazę:
R……CH
2
–CH=CH-CH
2
-CH=CH-CH
2
……COOH
↓ O
2
R……CH
2
–CH=CH-CH=CH-CH-……COOH
|
OOH
Proces ten powoduje jełczenie mąki i innych wyrobów zbożowych. W
początkowym
okresie
przechowywania
mąki
pszennej
działanie
lipooksygenazy
jest
korzystne
dla
jakości,
dopiero
długotrwałe
magazynowanie doprowadza do jełczenia mąki pod wpływem tego enzymu.
Korzystne działanie lipoksygenazy na wartość wypiekową mąki przejawia się
tym,
że
niewielkie
ilości
wodoronadtlenków
kwasów
tłuszczowych
„umacniają” gluten mąki, poprawiają jego właściwości fizyczne. Do mąki
pszennej dodaje się niewielkie ilości mąki sojowej jako szczególnie bogatej w
lipooksygenazę i niewielką ilości oleju roślinnego. Obserwuje się znaczne
zwiększenie objętości chleba - nawet do 50% (polepszenie właściwości
reologicznych ciasta chlebowego w trakcie pieczenia, prawdopodobnie
poprzez możliwość utleniania grup tiolowych białek pszenicy), a także
znaczne wybielenie miękiszu chleba. Działanie lipooksygenazy ma także duże
znaczenie przy produkcji makaronu. Aktywność lipooksygenazy w mące
makaronowej (produkowanej z pszenicy twardej Triticum durum) wywiera
duży wpływ na barwę gotowych makaronów. Pożądana żółta barwa
makaronu związana jest z obecnością karotenoidów, zwłaszcza luteiny - w
semolinie pszenicy twardej, ale pod wpływem działania endogennych
oksydaz, w tym lipooksygenaz, następują straty tego barwnika w trakcie
procesu technologicznego.

Enzymologia
8
Część doświadczalna
1. HYDROLIZA LIPIDÓW MLEKA ZA POMOCĄ LIPAZY TRZUSTKOWEJ
Zasada metody
Aktywność lipazy określa się na podstawie ilości uwolnionych kwasów
tłuszczowych, w czasie działania enzymu w optymalnych warunkach w
substracie zawierającym tłuszcz. Ilość uwolnionych kwasów tłuszczowych w
próbkach badanego substratu, pobieranych w kolejnych odstępach czasu,
oznacza się przez miareczkowanie mianowanym roztworem wodorotlenku
potasowego wobec fenoloftaleiny jako wskaźnika.
Część analityczna
Materiały i odczynniki:
Kolba (250-500cm
3
) – 1szt
Kolba stożkowa (100cm
3
) – 7szt
Kolba stożkowa (300-400 cm
3
) – 2szt
Cylinder (100cm
3
)
Pipety (5cm
3
; 2x10cm
3
; 25cm
3
)
Lejek
Łaźnia wodna (38°C)
Zestaw do miareczkowania
Homogenizator
0,05 M roztwór KOH
1% roztwór fenoloftaleiny
Metanol
Badany produkt
Trzustka wieprzowa
Uniwersalne papierki wskaźnikowe
Sączki
Gaza
Postępowanie
Otrzymanie wyciągu lipazy z trzustki
Zhomogenizować 200 g świeżej, pokrojonej trzustki wieprzowej z 300
cm
3
wody destylowanej. Zawiesinę przesączyć przez gazę. Otrzymany
przesącz, stanowiący roztwór enzymu, zobojętnić do pH 7 przy użyciu 0,1 M
roztworu KOH wobec papierka wskaźnikowego.
Oznaczenie
Do kolby stożkowej o pojemności 250 cm
3
odmierzyć 100 cm
3
mleka
lub śmietanki, a następnie kolbę umieścić w łaźni wodnej w temperaturze
38°C. Przygotować sześć ponumerowanych kolb stożkowych o pojemności
100 cm
3
i do każdej z nich odmierzyć po 25 cm
3
metanolu. Po upływie 10
minut od momentu wstawienia kolby z mlekiem do łaźni, dodać do mleka 30
cm
3
przygotowanego wstępnie wyciągu enzymatycznego z trzustki i dokładnie
wymieszać. Kolbę pozostawić w łaźni wodnej i co kilka minut powtarzać
mieszanie. Po upływie 15 minut od dodania wyciągu enzymatycznego pobrać
z mieszaniny reakcyjnej 10 cm
3
roztworu do kolby stożkowej o pojemności
100 cm
3
(próba nr 1). W analogiczny sposób pobrać kolejne próby w ciągu 90
min., w odstępach 15-minutowych (łącznie sześć prób). Poszczególne próbki
miareczkować 0,05 M roztworem KOH wobec fenoloftaleiny, do pojawienia się
lekko różowego zabarwienia.
Próba zerowa
Przenieść 50 cm
3
uzyskanego na wstępie wyciągu enzymatycznego do kolby
stożkowej o pojemności 100 cm
3
i ogrzewać do wrzenia w celu inaktywacji

Enzymologia
9
enzymu. Po oziębieniu gotowanego roztworu ewentualny wytrącony osad
odsączyć. Następnie do kolby stożkowej o pojemności 100 cm
3
(nr 0)
odpipetować 10 cm
3
mleka lub smietanki, 3 cm
3
przesączu z ogrzewanego
wyciągu enzymatycznego oraz 25 cm
3
metanolu. Próbę miareczkować
analogicznie jak próby badane 0,05 M roztworem KOH wobec fenoloftaleiny.
Wyniki zebrać i przedstawić w postaci tabel i wykresów w protokóle z ćwiczeń
(na końcu opracowania)
• Uzyskane wyniki z miareczkowania zestawić w tabeli.
Nr
próby
Czas
(min.)
Ilość cm
3
0,05 M KOH zużytego do
miareczkowania próby:
0
0
1
15
2
30
3
45
4
60
5
75
6
90
• Obliczyć mikroekwiwalenty uwolnionych kwasów tłuszczowych z
równania:
(
)
C 1000
.
A
B x
x
mikroekw
D
−
=
Gdzie:
A – ilość cm
3
0,05 M KOH zużyta do miareczkowania próby właściwej
B – ilość cm
3
0,05 M KOH zużyta do miareczkowania próby zerowej
C – molowość użytego do miareczkowania KOH
D – ilość cm
3
wyciągu enzymatycznego w próbie poddanej miareczkowaniu
• Na wykresie przedstawić zależność mikroekwiwalentów uwolnionych
kwasów tłuszczowych w czasie doświadczenia (90min.).

Enzymologia
10
2. OZNACZENIE ILOŚCI POWSTAŁYCH WODORONADTLENKÓW KWASU
LINOLOWEGO POD WPŁYWEM LIPOOKSYGENAZY SOJOWEJ
Zasada metody
Podstawą metody jest pomiar wzrostu absorbancji przy λ=234 nm
towarzyszącej utlenianiu tłuszczowego substratu (kwas linolowy). Proces
utleniania przebiega w buforze boranowym (pH 9,0). Korzystając ze
współczynnika ekstynkcji dla powstałych wodoronadtlenków kwasu
linolowego i prawa Lamberta-Beera, można obliczyć ilość powstałych
nadtlenków.
Część analityczna
Materiały i odczynniki:
Probówki – 5szt
Pipeta automatyczna (10-100µl)
Pipeta automatyczna (5 ml)
Spektrofotometr
Vortex
Moździerz
Lejek
Sączki
Wirówka
Etanol 98%
Kwas linolowy
Bufor boranowy (pH 9)
Mąka sojowa (odtłuszczona)
Bufor octanowy (pH 4,5)
Postępowanie
Otrzymanie wyciągu lipooksygenazy
1g odtłuszczonej mąki sojowej ucierać w moździerzu z niewielką ilością
buforu octanowego o pH 4,5 przez 15 min. Następnie po dokładnym
wymieszaniu przenieść do naczyniek wirówkowych i odwirować przez 15 min
przy 3000 obr/min. Supernatant przesączyć przez sączki bibułowe. Klarowny
wyciąg lipooksygenazy używać do doświadczeń.
(Bufor octanowy sporządzić przez zmieszanie 430 cm
3
0,2 M CH
3
COONa z
570 cm
3
0,2 M CH
3
COOH)
Przygotowanie substratu
Odważyć 30 mg kwasu linolowego i rozpuścić go w 5 cm
3
etanolu
absolutnego (98%)
Oznaczenie
Do 2-3 probówek pobrać 2,9 cm
3
buforu boranowego (pH 9), dodać 50 µl
substratu (kwasu linolowego) i 50 µl wyciągu lipooksygenazy sojowej (do
próby zerowej dodać 50 µl buforu boranowego). Wymieszać na vortexie,
przenieść do kiuwet i dokonać pomiaru absorbancji przy λ=234 nm w czasie
5-10 min. w odstępach 60 sekundowych.
Wyniki zebrać i przedstawić w postaci tabel i wykresów w protokóle z ćwiczeń
(na końcu opracowania)
Enzymologia
11
• Wartości absorbancji i obliczoną ilość wodoronadtlenków zestawić w tabeli.
Wartość absorbancji przy
λ=234 nm
Nr próby
(powtórzenia)
Czas
(min.)
pomiar
średnia
Obliczona zawartość
wodoronadtlenków
1
2
3
0
1
2
3
1
1
2
3
2
1
2
3
3
1
2
3
4
1
2
3
5
• Obliczyć ilość powstałych wodoronadtlenków kwasu linolowego,
korzystając z prawa Lamberta-Beera, wiedząc że molowy współczynnik
absorbcji dla badanego produktu wynosi ε=23000 M
-1
cm
-1
c
A
l
ε
=
Gdzie:
A – absorbancja
ε – współczynnik absorbcji (absorbancja molowa)
l – droga jaką pokonuje światło w kuwecie (cm)
c – stężenie molowe substancji absorbującej w roztworze
• Na wykresie przedstawić zależność ilości powstałych wodoronadtlenków
w czasie
Enzymologia
12
3. ANALIZA WODORONADTLENKÓW PRZY ZASTOSOWANIU HPLC
Zasada metody
Wykorzystując chromatograf cieczowy z detektorem UV-Vis można
oznaczyć ilościowo poszczególne izomery wodoronadtlenków kwasów
tłuszczowych.
Postępowanie
Do analizy wykorzystać otrzymane w poprzednim doświadczeniu
wodoronadtlenki kwasu linolowego.
W
czasie
analizy
do
rozdziału
i
oznaczeń
ilościowych
wodoronadtlenków wykorzystujemy HPLC (Waters) z pompą perystaltyczną
(typ 600). Stosujemy kolumnę do rozdziału z odwróconymi fazami RP-18
LiChrosorb (250 x 4,6 mm; 5µm) (Merck, Darmstadt, Niemcy). Faza ruchomą
jest mieszanina acetonitrylu, wody i kwasu octowego (600:400:1,2 v/v/v) o
prędkość przepływu 1,5 ml/min. Detekcji dokonujemy przy λ = 234 nm
(Spektrofotometr UV-Vis typ 2487 Waters).
Ilościowo zawartość nadtlenków kwasów tłuszczowych w próbach
oznaczamy na podstawie krzywych kalibracji przygotowanych dla 13-HPODE
(wodoronadtlenek
13-oktadekadienowego
kwasu)
i
13-HPOTE
(wodornadtlenek 13- oktadekatrienowego kwasu), a uzyskanych na drodze
enzymatycznego utleniania kwasu linolowego i linolenowego.
y = 8E+06x
R
2
= 0,9997
0
500000
1000000
1500000
2000000
2500000
3000000
3500000
4000000
4500000
0
0,1
0,2
0,3
0,4
0,5
0,6
zawartość HPODE [ug]
p
o
w
ie
rz
ch
n
ia
p
ik
u
Krzywa standardowa dla wodoronadtlenków kwasu linolowego (13-HPODE)
A
U
0.000
0.005
0.010
0.015
0.020
0.025
0.030
0.035
0.040
0.045
Minutes
7.00
7.50
8.00
8.50
9.00
9.50
10.00
10.50
11.00
11.50
12.00
12.50
13.00
13.50
14.00
8
.4
2
3
9
.3
1
2
1
0
.1
6
7
1
0
.7
1
1
13-HPODE
cis-trans
13-HPODE
trans-trans
9-HPODE
cis-trans
9-HPODE
trans-trans
Przykładowy rozdział wodoronadtlenków kwasu linolowego

Enzymologia
1
Protokół z ćwiczenia –
enzymy lipolityczne
Poznań, dnia
................
2007r.
Imię i nazwisko....................................................
Rok, grupa............................................................
Prowadzący ćwiczenie...........................................
.................................................................................
Liczba punktów...............
Ćwiczenie 1
H
H
Y
Y
D
D
R
R
O
O
L
L
I
I
Z
Z
A
A
L
L
I
I
P
P
I
I
D
D
Ó
Ó
W
W
M
M
L
L
E
E
K
K
A
A
Z
Z
A
A
P
P
O
O
M
M
O
O
C
C
Ą
Ą
L
L
I
I
P
P
A
A
Z
Z
Y
Y
T
T
R
R
Z
Z
U
U
S
S
T
T
K
K
O
O
W
W
E
E
J
J
1
1
.
.
O
O
p
p
i
i
s
s
i
i
c
c
e
e
l
l
ć
ć
w
w
i
i
c
c
z
z
e
e
n
n
i
i
a
a

Enzymologia
2
2
2
.
.
W
W
y
y
n
n
i
i
k
k
i
i
p
p
o
o
m
m
i
i
a
a
r
r
o
o
w
w
e
e
Nr
próby
Czas
(min.)
Ilość cm
3
0,05 M KOH zużytego do
miareczkowania próby:
0
0
1
15
2
30
3
45
4
60
5
75
6
90
O
O
b
b
l
l
i
i
c
c
z
z
y
y
ć
ć
i
i
l
l
o
o
ś
ś
ć
ć
m
m
i
i
k
k
r
r
o
o
e
e
k
k
w
w
i
i
w
w
a
a
l
l
e
e
n
n
t
t
ó
ó
w
w
u
u
w
w
o
o
l
l
n
n
i
i
o
o
n
n
y
y
c
c
h
h
k
k
w
w
a
a
s
s
ó
ó
w
w
t
t
ł
ł
u
u
s
s
z
z
c
c
z
z
o
o
w
w
y
y
c
c
h
h
z
z
t
t
r
r
i
i
a
a
c
c
y
y
l
l
o
o
g
g
l
l
i
i
c
c
e
e
r
r
o
o
l
l
i
i
w
w
b
b
a
a
d
d
a
a
n
n
y
y
c
c
h
h
p
p
r
r
ó
ó
b
b
a
a
c
c
h
h
w
w
c
c
z
z
a
a
s
s
i
i
e
e
d
d
o
o
ś
ś
w
w
i
i
a
a
d
d
c
c
z
z
e
e
n
n
i
i
a
a
,
,
k
k
o
o
r
r
z
z
y
y
s
s
t
t
a
a
j
j
ą
ą
c
c
z
z
r
r
ó
ó
w
w
n
n
a
a
n
n
i
i
a
a
:
:
(
)
C 1000
.
A
B x
x
mikroekw
D
−
=
G
G
d
d
z
z
i
i
e
e
:
:
A
A
–
–
i
i
l
l
o
o
ś
ś
ć
ć
c
c
m
m
3
3
0
0
,
,
0
0
5
5
M
M
K
K
O
O
H
H
z
z
u
u
ż
ż
y
y
t
t
a
a
d
d
o
o
m
m
i
i
a
a
r
r
e
e
c
c
z
z
k
k
o
o
w
w
a
a
n
n
i
i
a
a
p
p
r
r
ó
ó
b
b
y
y
w
w
ł
ł
a
a
ś
ś
c
c
i
i
w
w
e
e
j
j
B
B
–
–
i
i
l
l
o
o
ś
ś
ć
ć
c
c
m
m
3
3
0
0
,
,
0
0
5
5
M
M
K
K
O
O
H
H
z
z
u
u
ż
ż
y
y
t
t
a
a
d
d
o
o
m
m
i
i
a
a
r
r
e
e
c
c
z
z
k
k
o
o
w
w
a
a
n
n
i
i
a
a
p
p
r
r
ó
ó
b
b
y
y
z
z
e
e
r
r
o
o
w
w
e
e
j
j
C
C
–
–
m
m
o
o
l
l
o
o
w
w
o
o
ś
ś
ć
ć
u
u
ż
ż
y
y
t
t
e
e
g
g
o
o
d
d
o
o
m
m
i
i
a
a
r
r
e
e
c
c
z
z
k
k
o
o
w
w
a
a
n
n
i
i
a
a
K
K
O
O
H
H
D
D
–
–
i
i
l
l
o
o
ś
ś
ć
ć
c
c
m
m
3
3
p
p
r
r
e
e
p
p
a
a
r
r
a
a
t
t
u
u
e
e
n
n
z
z
y
y
m
m
a
a
t
t
y
y
c
c
z
z
n
n
e
e
g
g
o
o
w
w
p
p
r
r
ó
ó
b
b
i
i
e
e
p
p
o
o
d
d
d
d
a
a
n
n
e
e
j
j
m
m
i
i
a
a
r
r
e
e
c
c
z
z
k
k
o
o
w
w
a
a
n
n
i
i
u
u

Enzymologia
3
Nr
próby
Czas
(min.)
Mikroekwiwalenty
kwasów
tłuszczowych
0
0
1
15
2
30
3
45
4
60
5
75
6
90
S
S
p
p
o
o
r
r
z
z
ą
ą
d
d
z
z
i
i
ć
ć
w
w
y
y
k
k
r
r
e
e
s
s
z
z
a
a
l
l
e
e
ż
ż
n
n
o
o
ś
ś
c
c
i
i
i
i
l
l
o
o
ś
ś
c
c
i
i
h
h
y
y
d
d
r
r
o
o
l
l
i
i
z
z
o
o
w
w
a
a
n
n
y
y
c
c
h
h
k
k
w
w
a
a
s
s
ó
ó
w
w
t
t
ł
ł
u
u
s
s
z
z
c
c
z
z
o
o
w
w
y
y
c
c
h
h
(
(
m
m
i
i
k
k
r
r
o
o
e
e
k
k
w
w
i
i
w
w
a
a
l
l
e
e
n
n
t
t
y
y
)
)
w
w
c
c
z
z
a
a
s
s
i
i
e
e
(
(
m
m
i
i
n
n
.
.
)
)
0
15
30
45
60
75
90
Czas [min.]
M
ik
ro
e
k
w
iw
a
le
n
ty
k
w
a
s
ó
w
t
łu
s
z
c
z
o
w
y
c
h

Enzymologia
4
3
3
.
.
W
W
n
n
i
i
o
o
s
s
k
k
i
i

Enzymologia
5
Ćwiczenie 2
O
O
Z
Z
N
N
A
A
C
C
Z
Z
E
E
N
N
I
I
E
E
I
I
L
L
O
O
Ś
Ś
C
C
I
I
P
P
O
O
W
W
S
S
T
T
A
A
Ł
Ł
Y
Y
C
C
H
H
W
W
O
O
D
D
O
O
R
R
O
O
N
N
A
A
D
D
T
T
L
L
E
E
N
N
K
K
Ó
Ó
W
W
P
P
O
O
D
D
W
W
P
P
Ł
Ł
Y
Y
W
W
E
E
M
M
L
L
I
I
P
P
O
O
O
O
K
K
S
S
Y
Y
G
G
E
E
N
N
A
A
Z
Z
Y
Y
1
1
.
.
O
O
p
p
i
i
s
s
i
i
c
c
e
e
l
l
ć
ć
w
w
i
i
c
c
z
z
e
e
n
n
i
i
a
a
2
2
.
.
W
W
y
y
n
n
i
i
k
k
i
i
p
p
o
o
m
m
i
i
a
a
r
r
o
o
w
w
e
e
Wartość absorbancji przy
λ=234 nm
Nr próby
(powtórzenia)
Czas
(min.)
pomiar
średnia
Obliczona zawartość
wodoronadtlenków
1
2
3
0
1
2
3
1
1
2
3
2
Enzymologia
6
1
2
3
3
1
2
3
4
1
2
3
5
O
O
b
b
l
l
i
i
c
c
z
z
y
y
ć
ć
i
i
l
l
o
o
ś
ś
ć
ć
p
p
o
o
w
w
s
s
t
t
a
a
ł
ł
y
y
c
c
h
h
w
w
o
o
d
d
o
o
r
r
o
o
n
n
a
a
d
d
t
t
l
l
e
e
n
n
k
k
ó
ó
w
w
k
k
w
w
a
a
s
s
u
u
l
l
i
i
n
n
o
o
l
l
o
o
w
w
e
e
g
g
o
o
,
,
k
k
o
o
r
r
z
z
y
y
s
s
t
t
a
a
j
j
ą
ą
c
c
z
z
p
p
r
r
a
a
w
w
a
a
L
L
a
a
m
m
b
b
e
e
r
r
t
t
a
a
-
-
B
B
e
e
e
e
r
r
a
a
,
,
w
w
i
i
e
e
d
d
z
z
ą
ą
c
c
ż
ż
e
e
w
w
s
s
p
p
ó
ó
ł
ł
c
c
z
z
y
y
n
n
n
n
i
i
k
k
e
e
k
k
s
s
t
t
y
y
n
n
k
k
c
c
j
j
i
i
d
d
l
l
a
a
b
b
a
a
d
d
a
a
n
n
e
e
g
g
o
o
p
p
r
r
o
o
d
d
u
u
k
k
t
t
u
u
w
w
y
y
n
n
o
o
s
s
i
i
ε
ε
=
=
2
2
3
3
0
0
0
0
0
0
M
M
-
-
1
1
c
c
m
m
-
-
1
1
c
A
l
ε
=
Gdzie:
A – absorbancja
ε – współczynnik absorbcji (absorbancja molowa)
l – droga jaką pokonuje światło w kuwecie (cm)
c – stężenie molowe substancji absorbującej w roztworze

Enzymologia
7
S
S
p
p
o
o
r
r
z
z
ą
ą
d
d
z
z
i
i
ć
ć
w
w
y
y
k
k
r
r
e
e
s
s
z
z
a
a
l
l
e
e
ż
ż
n
n
o
o
ś
ś
c
c
i
i
i
i
l
l
o
o
ś
ś
c
c
i
i
p
p
o
o
w
w
s
s
t
t
a
a
ł
ł
y
y
c
c
h
h
w
w
o
o
d
d
o
o
r
r
o
o
n
n
a
a
d
d
t
t
l
l
e
e
n
n
k
k
ó
ó
w
w
w
w
c
c
z
z
a
a
s
s
i
i
e
e
(
(
m
m
i
i
n
n
.
.
)
)
3
3
.
.
W
W
n
n
i
i
o
o
s
s
k
k
i
i
0
1
2
3
4
5
Czas [min.]
W
o
d
o
ro
n
a
d
tl
e
n
k
i
Wyszukiwarka
Podobne podstrony:
9) Oznaczanie aktywności enzymów amylolitycznych
oznaczanie aktywności enzymów, Biotechnologia, laborki
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Kraking katalityczny – oznaczanie aktywności katalizatorów metodą UOP
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Biochemia, Oznaczanie aktywnościi amylazy metodą Noeltinga i Bernfelda w ziarnie pszenicy
cwiczenie 5 amylaza oznaczanie aktywnosci enzymu metoda kolorymetryczna 05 05 2014
Spektrofotometryczna metoda oznaczania aktywności peroksydazy
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
biochemia III, Czynniki warunkujące aktywność enzymów
Aktywność enzymów przy niedoborze żelaza
Ćwiczenie 6 Oznaczanie aktywności katalazy
cwiczenie 1 oksydoreduktazy i transferazy wykrywanie aktywnosci enzymow w materiale biologicznym 05
3-Aktywność-enzymów-materiały, Biotechnologia SGGW
IG.6 - Oznaczanie aktywności enzymatycznej metaloproteinaz komórkowych, Genetyka, Inżynieria genetyc
Ćwiczenie 6 Oznaczanie aktywności katalazy
więcej podobnych podstron