1
opracowała dr. A Żylicz-Stachula
Chemia fizyczna w układach biologicznych.
ĆWICZENIE 6
Wykorzystanie przewodnictwa elektrycznego do rozdziału makromolekuł.
Oczyszczanie owoalbuminy z białka jaja kurzego. Elektroforeza poliakrylamidowa białek w
warunkach denaturujących (SDS-PAGE).
Materiały:
świeże jajko kurze
2 płytki szklane z „uszami”
2 płytki szklane bez uszu
2 przekładki teflonowe
1 grzebień teflonowy
podstawka do wylewania żelu
worki do wylewania żeli
aparat do elektroforezy
zasilacz prądu stałego
pipety automatyczne
naczynia do wybarwiania żeli
mikrowirówka
mieszadło magnetyczne
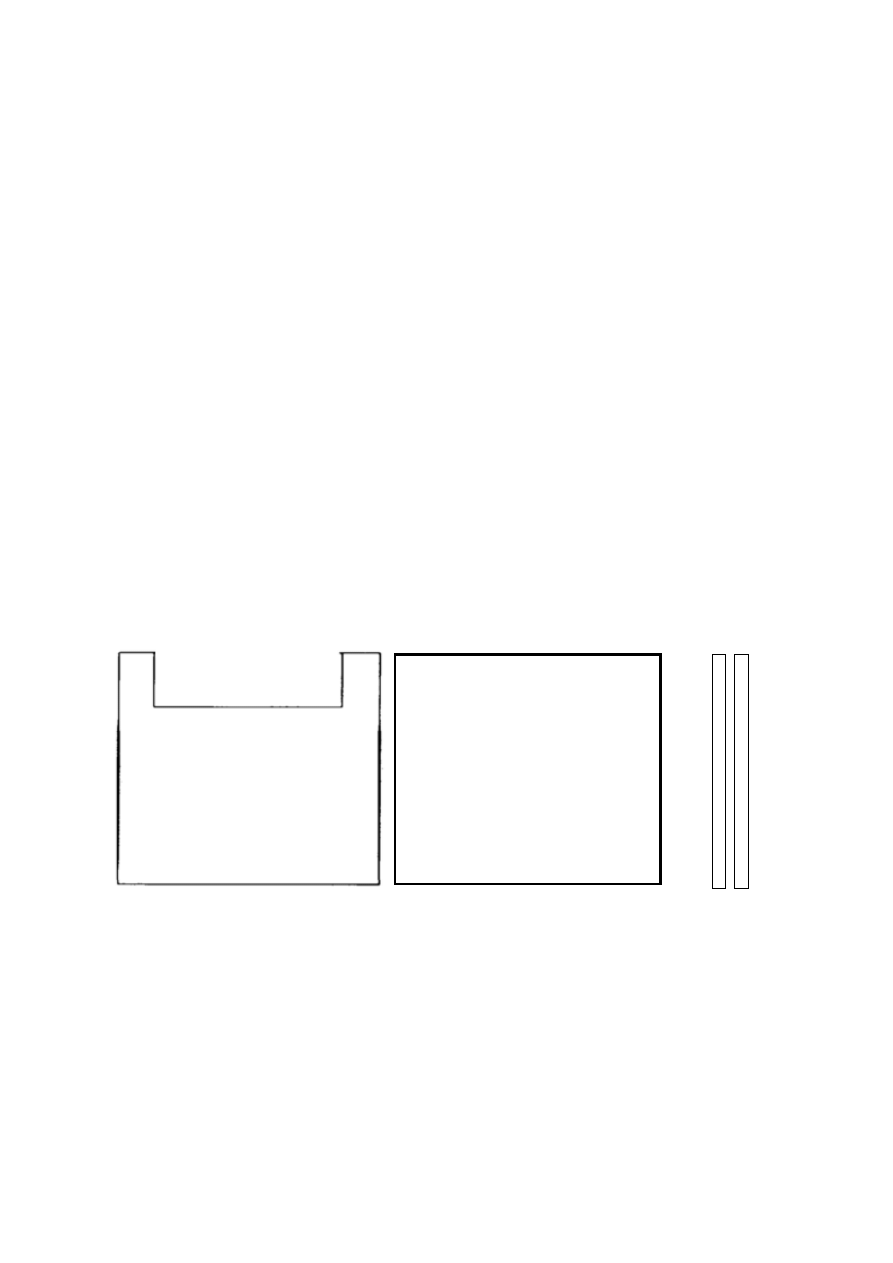
Rys.1. Szybka z „uszami”. Rys.2. Szybka bez „uszu” Rys. 3 Teflonowe przekładki
Odczynniki chemiczne:
Roztwór akrylamidów: 30%: 29% akrylamid , 1% N, N-metyleno-bisakrylamid
Woda 2x destylowana
Roztwór 10% SDS
Roztwór nadsiarczanu amonu (APS) 10%
Roztwór 1.5 M Tris-HCl (pH 8.8)
Roztwór 1 M Tris-HCl (pH 6.8)
TEMED - N, N, N’, N’- tetrametyloetylenodiamina

2
Barwnik do żeli poliakrylamidowych:
0.2% roztwór Coomassie Brilliant Blue R-250 w odbarwiaczu do żeli
poliakrylamidowych
Odbarwiacz do żeli poliakrylamidowych:
8 części wody
2 części metanolu
1 część bezwodnego kwasu octowego
Barwnik denaturujący (5x stężony) (do nanoszenia próbek na żel):
Tris-HCl (pH 6.8)
50 mM
EDTA (pH 8.0)
5 mM
SDS
25%
sacharoza
50%
2-merkaptoetanol (
Me)
25%
błękit bromofenolowy
0.05%
Bufor glicynowy do elektroforezy SDS-PAGE (5x stężony):
Tris-HCl (pH 8.3)
125 mM
glicyna
1.25 M
SDS
0.5%
INSTRUKCJA DO WYKONANIA ĆWICZENIA:
A. Przygotowanie i nanoszenie próbek. Rozdział elektroforetyczny.
1. Przygotować próbki do elektroforezy.
W tym celu należy przygotować 3 probówki typu Eppendorf 1.5 ml. Do każdej
probówki należy dodać za pomocą pipety po 14µl 50mM buforu Tris-HCl pH 8.0.
Następnie do przygotowanych probówek należy dodać po 1µl przygotowanych
roztworów białek i po 4µl 5x stężonego barwnika denaturującego. Tak
przygotowane próbki należy inkubować we wrzącej łaźni wodnej przez 5min.
Przygotowane, gorące próbki należy nanieść w całości do kolejnych studzienek w żelu
przy pomocy pipety automatycznej. Do pierwszej studzienki należy nanieść
odpowiednią ilość wzorca masowego Sigma (wzorzec udostępni prowadzący).
2. Przeprowadzić elektroforezę wstępną przy natężeniu 20 mA. Po wniknięciu próbek w
żel zwiększyć napięcie do 40 mA i kontynuować rozdział dopóki barwnik nie znajdzie
się 0.5 cm od końca żelu (około 1 godziny).
3. Po skończonym rozdziale wyłączyć prąd, wylać bufor i wyjąć żel z aparatu. Następnie
ostrożnie oddzielić szyby, wyjąć żel i umieścić w pudełku do barwienia z
przygotowanym barwnikiem do żeli poliakrylamidowych. Zagrzać żel w kuchence
mikrofalowej przez 1 minutę. Poczekać aż ostygnie.
4. Następnie zlać barwnik do butelki i umieścić żel w odbarwiaczu. Ponownie zagrzać i
poczekać aż ostygnie. Odbarwiacz zmieniać dwukrotnie, aż do uzyskania wyraźnych
prążków.
5. Żel zostawić prowadzącemu do zeskanowania. Zdjęcie wraz z opisem należy umieścić
w sprawozdaniu.
3
B. Przygotowanie żelu poliakrylamidowego.
1. Starannie umyć szyby detergentem (Rys. 1, 2), osuszyć czystym ręcznikiem
papierowym i przetrzeć wewnętrzne powierzchnie szyb etanolem.
2. Suche teflonowe przekładki umieścić pomiędzy szybami (jak najbliżej prawej i lewej
krawędzi) w taki sposób, aby krawędzie jednej szyby nie wystawały poza pole drugiej
szyby. Nie dotykać wewnętrznych powierzchni szyb palcami! Złożone szybki
ostrożnie wsunąć do worka, całość umieścić w aparacie do wylewania żeli i docisnąć
płytką z pleksi. Szybka z „uszami” (Rys. 2) powinna znaleźć się po zewnętrznej
stronie (od strony płytki pleksi), do góry „uszami”. Ostrożnie docisnąć poprzez
odpowiednie dokręcenie śruby. Wypoziomować aparat ustawiając bańkę powietrza w
zaznaczonym zakresie.
3. Sporządzić roztwór 8% żelu dolnego o odpowiednim stężeniu (według Tab. 1).
4. Wymieszać ostrożnie wszystkie składniki i wlać za pomocą pipety 6 ml roztworu
pomiędzy płytki szklane do takiej wysokości, żeby zostawić miejsce na około 1 cm
żelu górnego i grzebień.
5. Na żel nawarstwić ostrożnie za pomocą pipety 1 ml wody destylowanej. Pozostawić
do polimeryzacji (około 15 minut). Pozostałości żelu można pozostawić w koreksie,
co ułatwi wychwycenie momentu, w którym żel spolimeryzuje.
UWAGA !
APS
powoduje rozpoczęcie polimeryzacji, dlatego APS i TEMED dodaje się na samym końcu,
chwilę przed wlaniem roztworu żelu między szyby!!!
Składniki (na 10 ml)
Objętość [ml]
Procentowość żelu
8[%]
H
2
O
4.6 ml
30 % akrylamidy (z lodówki)
2.7 ml
1.5 M Tris-HCl (pH 8.8)
2.5 ml
10% SDS
100 μl
10% APS (z lodówki)
100 μl
TEMED (z lodówki)
6 μl
Tab. 1 Skład żelu dolnego.
Składniki na 4 ml
Objętość
H
2
O
2.7 ml
30 % akrylamidy
0.67 ml
1 M Tris-HCl (pH 6.8)
0.5 ml
10% SDS
40 μl
10% APS
40 μl
TEMED
4 μl
Tab. 2 Skład żelu górnego.
6. Przygotować żel górny zagęszczający według Tab. 2.
7. Przechylając aparat zlać wodę z nad żelu dolnego i delikatnie osuszyć papierowym
ręcznikiem.
8. Wlać roztwór żelu górnego między szyby i szybko włożyć grzebień. Grzebień
powinien być włożony symetrycznie, w taki sposób, aby miedzy zębami było ujście
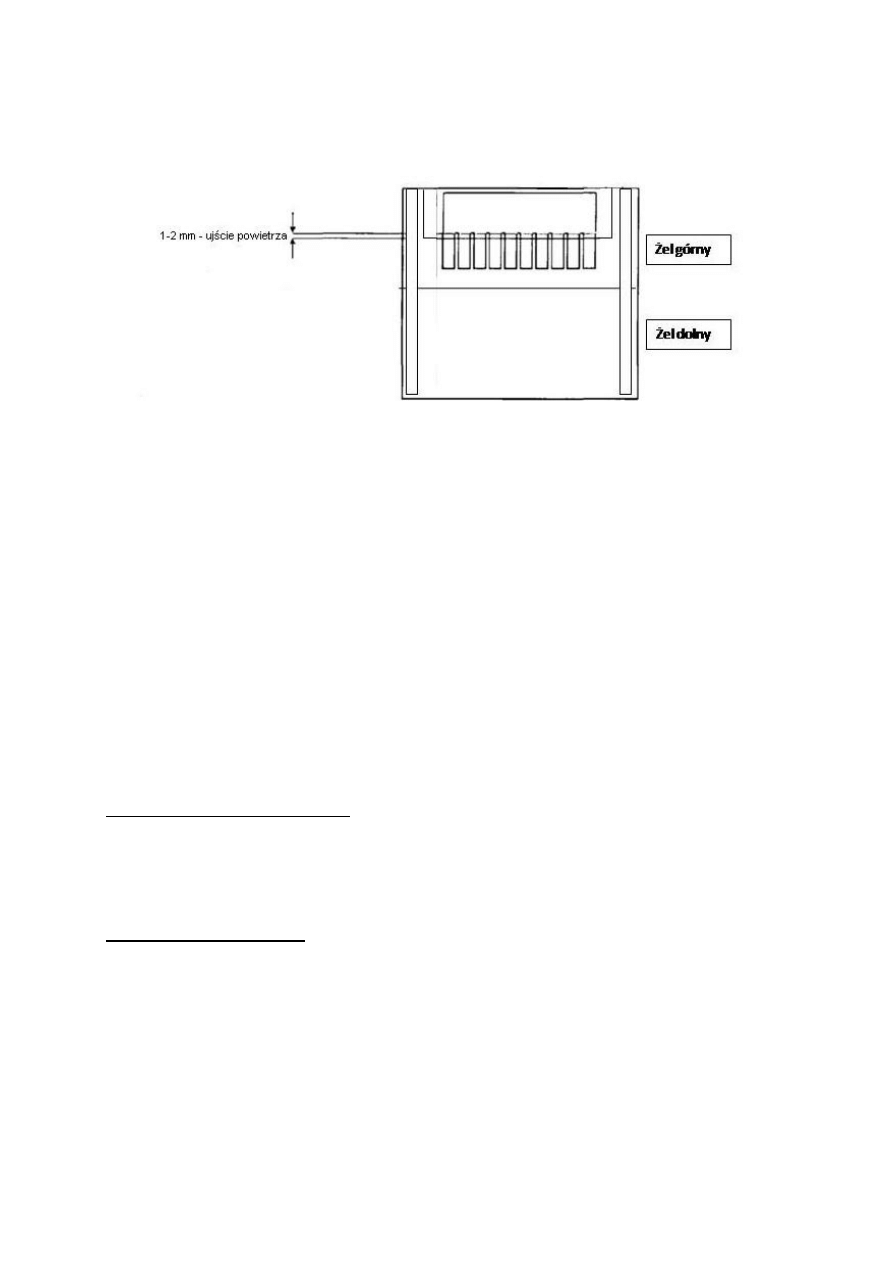
4
dla powietrza wychodzącego spomiędzy szyb po wylaniu żelu (Rys. 4). Uważać aby
przy zębach grzebienia nie utworzyły się pęcherzyki powietrza. Zostawić żel do
polimeryzacji.
Rys. 4. Prawidłowo umieszczony grzebień.
9. Po spolimeryzowaniu żelu górnego (około 15 min) wyjąć ostrożnie płytki z żelem z
worka i umieścić w aparacie do elektroforezy (szybka z „uszami” musi być
skierowana do środka aparatu), delikatnie dokręcając śruby.
10. Dolne i górne naczynie elektrodowe napełnić 1x stężonym buforem glicynowym
(około 350 ml; rozcieńczać wodą destylowaną). Studzienki w żelu muszą być
wypełnione buforem. Ostrożnie wyjąć grzebień.
11. Za pomocą pipety automatycznej ostrożnie przepłukać studzienki buforem i usunąć
pęcherzyki powietrza z dolnej części płytki.
UWAGA !
Akrtylamidy
są neurotoksyczne. Unikać kontaktu ze skórą i błonami śluzowymi. Używać
rękawiczek.
UWAGA! Roztwór APS może być przechowywany w lodówce przez tydzień.
Zakres wymaganego materiału:
Technika elektroforezy, ogólne informacje o białkach, koloidy, skład białka jaja kurzego,
metoda oznaczania masy cząsteczkowej białek metodą elektroforezy w żelu
poliakrylamidowym z SDS, punkt izoelektryczny, wysalanie białek, wirowanie.
Literatura uzupełniająca:
1. Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami. Redakcja naukowa: Zofia
Jóźwiak, Grzegorz Bartosz, PWN 2007 (str. 91-131; 288-292, 324-327, 330-331, 374-
375).
2. Podstawy inżynierii genetycznej. Józef Kur, Politechnika Gdańska 1994 (str. 107-113)
Wyszukiwarka
Podobne podstrony:
Opis i kolory przewodów do sąd lambda, AUTO - Instrukcje serwisowe itd
TECHNIKI CHROMATOGRAFICZNE WYKORZYSTYWANE DO ROZDZIAŁU BIAŁEK
cw 1 Chemia fluorowców Wykorzystanie metody chromatograficznej i analitycznej do rozdzielania anion
ROS wykorzystanie roslin do unieszkodliwiania osadow
Higiena Przewodnik do cwiczen
parazytologia lekarska przewodnik do ćwiczeń UM Poznań
instrukcja obs ugi do ekspresu do kawy JURA Impressa XS90 One Touch black PL (videotesty pl)
Przewodnik do ćwiczeń z hokeja na trawie
Instrukcja podłączenia sie do internetu na MS
MAGNUM DINAMIK INSTRUKCJA OBSŁUGI PROSTOWNIKÓW DO ŁADOWANIA I ROZRUCHU 440 PL
Instrukcja obslugi Stojak do be Nieznany
WODA DO ZAPRAWW I BETONÓW, przewodnik do betonów i zapraw
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,Wykorzystanie propyl
13 Pismo przewodnie do ZUS z dokumentacją powypadkową
ćw 17 Układ zasilania aparatu Epsteina do rozdziału strat metodą częstotliwościową
Instrukcja bhp półautomatu do ostrzenia wierteł i rozwiertaków, BHP, Instrukcje BHP, Przemysł ciężki
Broken Heart Od Prologu do Rozdziału 24
więcej podobnych podstron