LEKI DZIAŁAJĄCE NA UKŁAD KRĄŻENIA, P/ARYTMICZNE I SALURETYKI
Metyloksantyny i ich pochodne, pochodne pirymidyny i dihydropirymidyny, sole wapnia
Metyloksantyny i ich pochodne
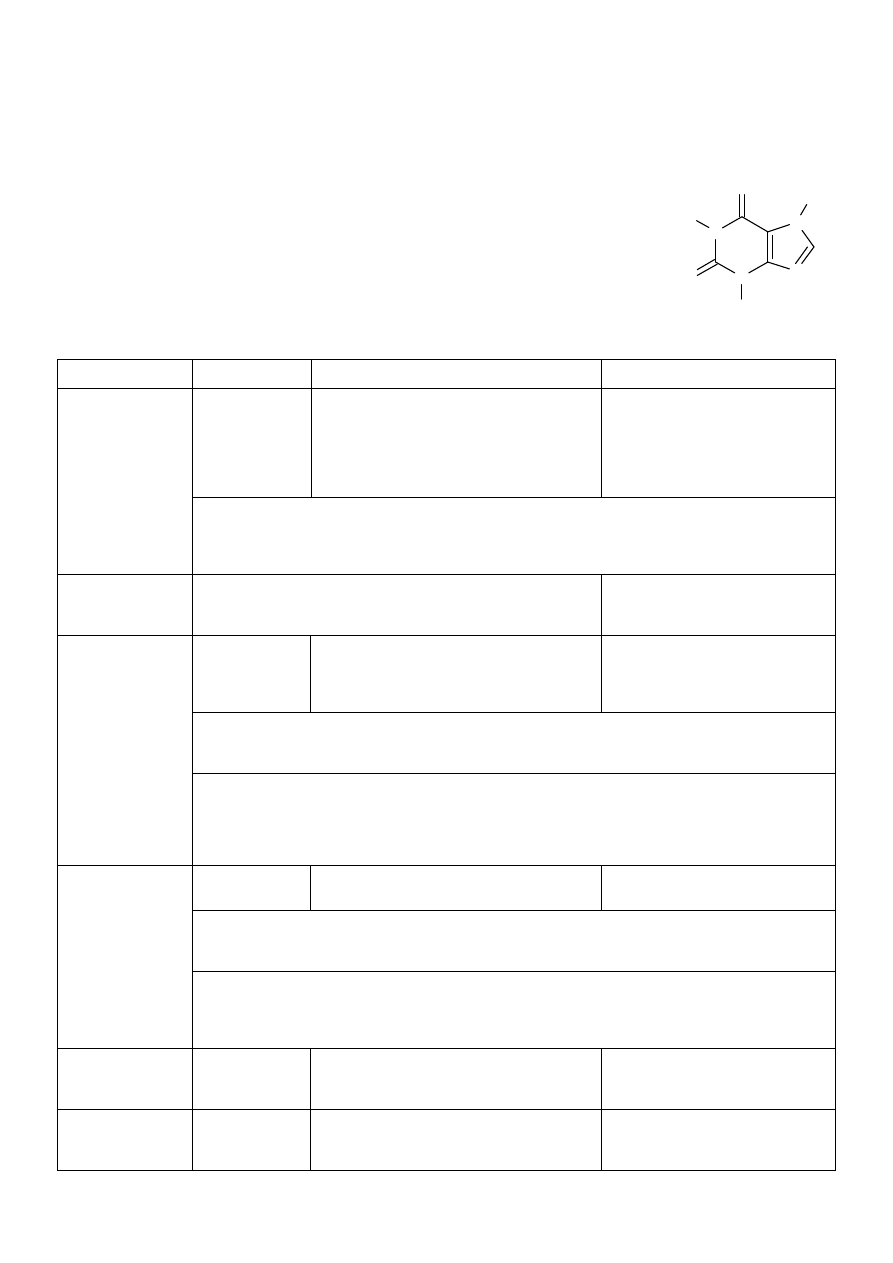
1. Theophyllinum (teofilina)
Nazwa chemiczna: 1,3-dimetylo-1,2,3,6-tetrahydropuryno-2,6-dion = 1,3-dimetyloksantyna
§
występuje w postaci bezwodnej lub uwodnionej
§
biały, krystaliczny proszek bez zapachu o gorzkawym smaki
§
rozpuszczalność:
§
trudno rozpuszczalny w wodzie i etanolu
§
rozpuszczalny w 10% amoniaku
§
rozpuszczalny w roztworach rozcieńczonych kwasów i zasad oraz chloroformie
§
praktycznie nierozpuszczalny w eterze etylowym
§
działanie: rozkurczające na mięśnie gładkie
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja
mureksydowa
H
2
O
2
Stęż. HCl
10% NH
3
Substancję zmieszać w parowniczce z kilkoma
kroplami nadtlenku wodoru i 5 kroplami
stężonego kwasu solnego.
Odparować do sucha na łaźni wodnej.
Pomarańczową pozostałość zwilżyć 10%
amoniakiem
Powstaje czerwono-fioletowa barwa
W reakcji mureksydowej odpowiednia pochodna puryny ulega utlenieniu do alloksanu lub rozszczepia się z
utworzeniem pochodnej kwasu pseudomoczowego. Ten ostatni może utlenić się do pochodnej kwasu 5-
aminobarbiturowego. Wobec amoniaku powstaje produkt pośredni, z którego powstaje mureksyd (sól amonowa
pochodnej kwasu purpurowego)
Ogrzewanie
Niewielką ilość analizowanej substancji ogrzewać na szpatelce lub w
suchej probówce
Substancja topi się, odparowuje a
następnie ulega resublimacji –
charakterystyczne, pierzaste płatki
Reakcja
teofilidynowa
20% KOH
kwas
diazobenzeno-
sulfonowy
Do niewielkiej ilości substancji dodać 20% KOH.
Całość ogrzewać do wrzenia przez kilka minut.
Po oziębieniu dodać kilka ml kwasu
dibenzoazosulfonowego
Powstaje czerwono-fioletowe
zabarwienie
Teofilina ogrzewana ze stężonym roztworem wodorotlenku potasowego ulega rozkładowi z otwarciem
pierścienia pirymidynodionu. Utworzona w ten sposób teofilidyna reaguje z kwasem diazobenzosulfonowym, w
środowisku alkalicznym tworzy się związek azowy o czerwono-fioletowym zabarwieniu
Tworzenie soli
amonowej
10% amoniak
1% AgNO
3
Niewielką ilość substancji rozpuścić w 10%
amoniaku, dodać 2ml 1% azotanu srebra
Powstaje biały, galaretowaty osad
Teofilina z roztworem amoniaku tworzy sól amonową. Po dodaniu roztworu azotanu srebra w wyniku
podwójnej wymiany wytrąca się osad soli srebrowej. Reakcja ta może być również podstawą do oznaczenia
ilościowego teofiliny metodą argentometryczną
Próba
fenoloftaleinowa
0,1M NaOH
fenoloftaleina
Do niewielkiej ilości substancji dodać 5ml wody, 1
kroplę 0,1M wodorotlenek sodowy i 2 krople
fenoloftaleiny
Różowe zabarwienie znika na zimno
(odróżnienie od kofeiny i teobrominy)
Reakcja z
utleniaczami
H
2
O
2
kwas solny
NH
4
OH
Do substancji dodać 0,1ml nadtlenku wodoru i
kwasu solnego. Ogrzewać na łaźni wodnej do
otrzymania pozostałości. Dodać NH
4
OH
Pozostałość o barwie żółto-czerwonej
po dodaniu wodorotlenku amonowego
przejdzie w czerwono-fioletowe
N
N
N
N
O
O
C
H
3
CH
3
H
Reakcja z KMnO
4
NaOH
nadmanganian
potasu
Niewielką ilość substancji rozpuścić w wodzie,
dodać roztworu NaOH oraz nadmanganianu
potasowego
Powstaje zielone zabarwienie
przechodzące w jasnożółte
2. Diprophyllinum (diprofilina)
Nazwa chemiczna: 7-β,γ-dihydroksypropylo-teofilina
§
biały, krystaliczny proszek
§
rozpuszczalność:
§
łatwo rozpuszczalny w wodzie (odczyn roztworu obojętny)
§
trudno rozpuszczalny w etanolu
§
praktycznie nierozpuszczalny w eterze etylowym
§
diprofilina jest nierozpuszczalna na zimno w stężonych
roztworach zasad (30% r-r wodorotlenku sodowego)
§
podstawienie w położeniu 7 powoduje zanik właściwości kwasowych teofiliny
§
działanie: rozkurczające i moczopędne
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja
mureksydowa
H
2
O
2
Stęż. HCl
10% NH
3
Substancję zmieszać w parowniczce z kilkoma
kroplami nadtlenku wodoru i 5 kroplami
stężonego kwasu solnego.
Odparować do sucha na łaźni wodnej.
Pomarańczową pozostałość zwilżyć 10%
amoniakiem
Powstaje czerwono-fioletowa barwa
W reakcji mureksydowej odpowiednia pochodna puryny ulega utlenieniu do alloksanu lub rozszczepia się z
utworzeniem pochodnej kwasu pseudomoczowego. Ten ostatni może utlenić się do pochodnej kwasu 5-
aminobarbiturowego. Wobec amoniaku powstaje produkt pośredni, z którego powstaje mureksyd (sól amonowa
pochodnej kwasu purpurowego)
Reakcja utleniania
kwas nadjodowy
rezorcynol
15% NaOH
Do niewielkiej ilości roztworu analizowanej
substancji dodawać porcjami, chłodząc w
strumieniu bieżącej wody ok.0,5g kwasu
nadjodowego. Do roztworu dodać kilka kropli
rezorcynolu i 15% NaOH. Ogrzać do wrzenia
Po dodaniu kwasu nadjodowego
wydziela się zapach formaldehydu, a
po dodaniu rezorcynolu i NaOH –
pojawia się czerwone zabarwienie
Podstawnik hydroksyalkilowy ulega dość łatwo utlenieniu np. w reakcji z kwasem nadjodowym powstaje
aldehyd teofilino-7-octowy, który wydziela się w postaci osad. Obecny w roztworze aldehyd mrówkowy można
wykryć po zapachu lub na podstawie prób chemicznych (reakcja z rezorcynolem)
Pochodne dihydropirymidyny
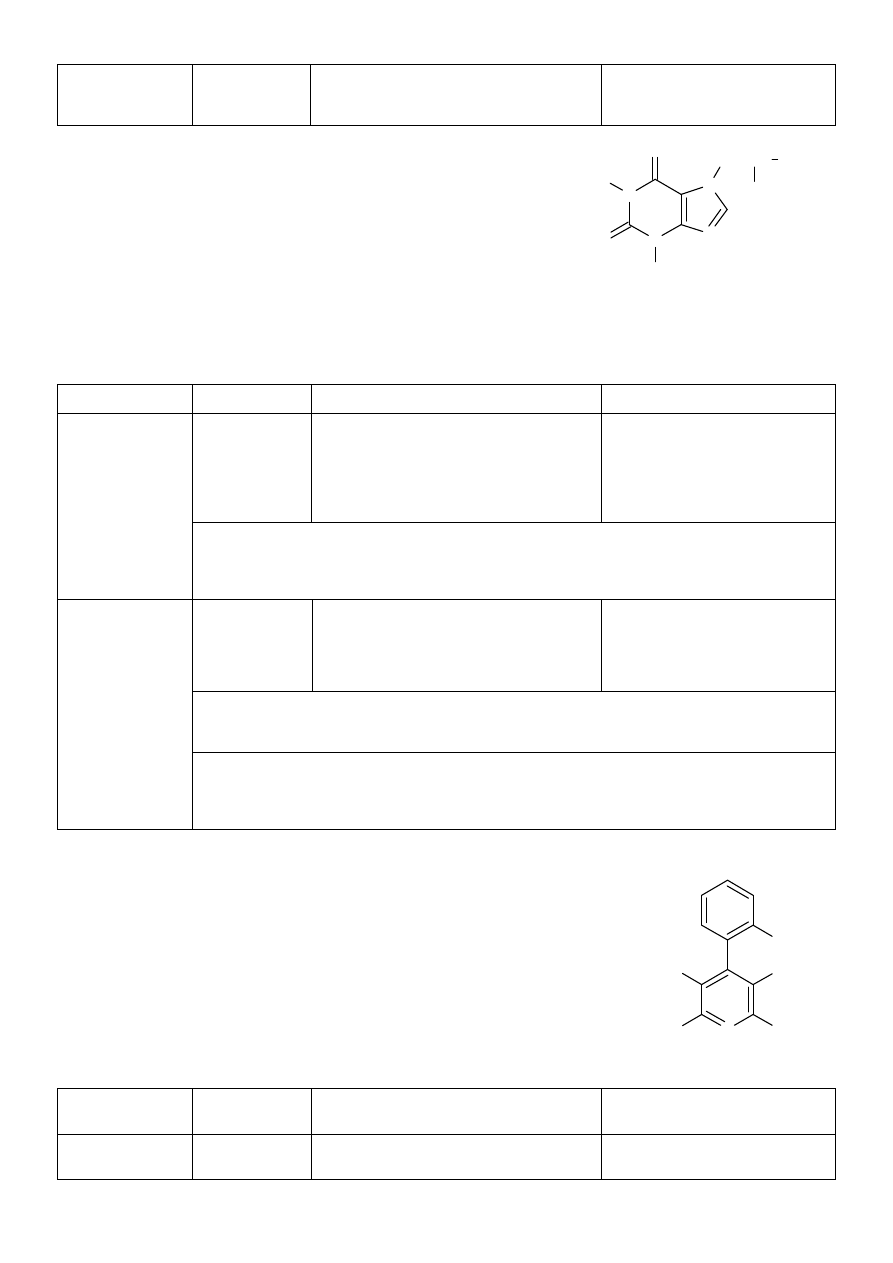
1. Nifedipinum (nifedipina)
Synonimy: Cordafen, Corinfar, ester di metylowy kwasu 1,4-dihydro-2,6-
dimetylo-4-(2-nitrofenylo)-2,5-pirymidynodikarboksylowego
§
żółty proszek
§
rozpuszczalność:
§
praktycznie nierozpuszczalny w wodzie
§
słabo rozpuszczalny w etanolu
§
rozpuszczalny w acetonie i chloroformie
§
jest wrażliwy na światło
§
działanie: wazodilatacyjne (naczynia wieńcowe)
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja z kwasem
siarkowym
stężony H
2
sO
4
Preparat umieścić na szkiełku. Dodać kroplę
stężonego kwasu siarkowego
Substancja barwi się na oranżowo
N
N
N
N
O
O
C
H
3
CH
3
CH
2
CH CH
2
OH
OH
N
NO
2
COOCH
3
CH
3
C
H
3
H
3
COOC
Reakcja z KOH
20% metanolowy
KOH
Do niewielkiej ilości analizowanej substancji
dodać 1ml 20% metanolowego roztworu KOH
występuje zabarwienie oranżowe
Leki przeciwarytmiczne
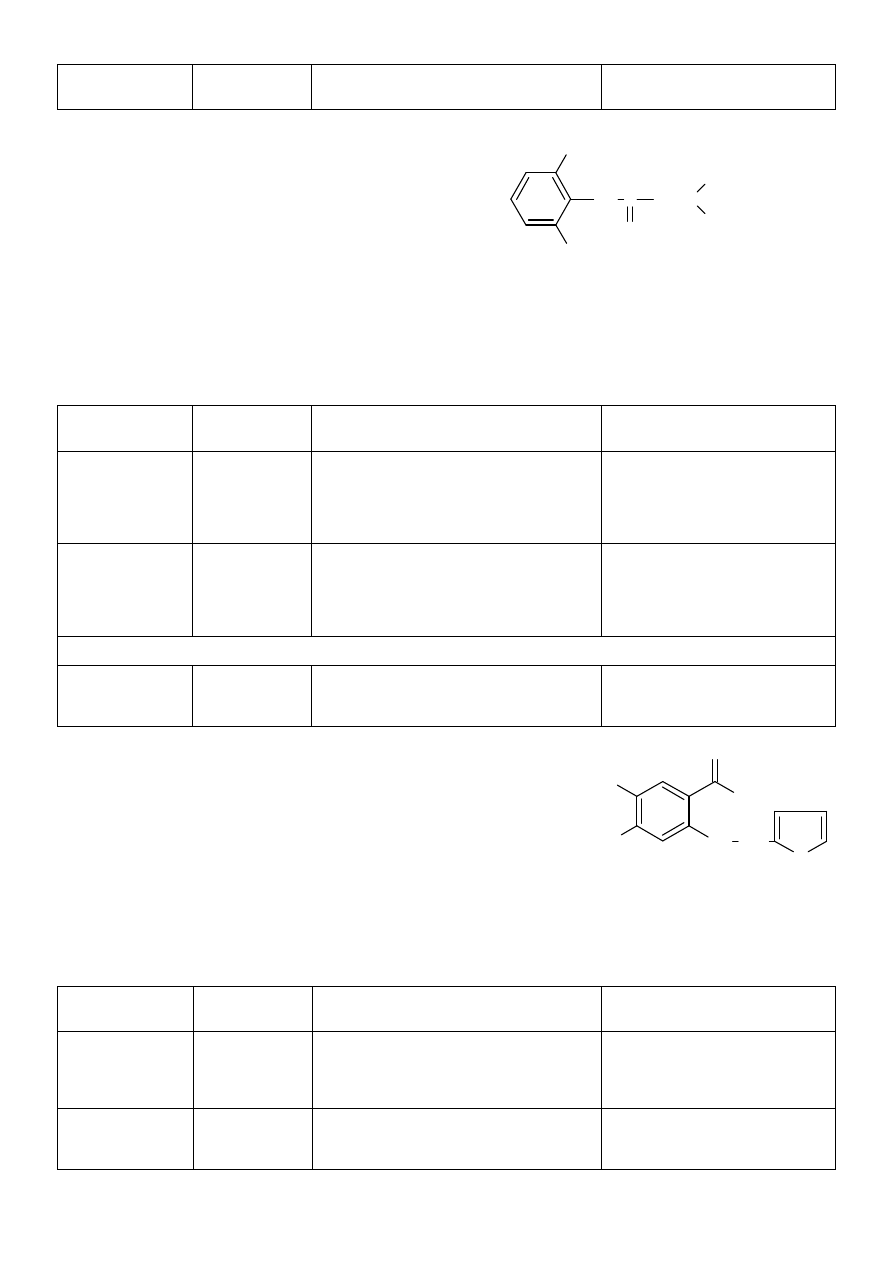
1. Lidocainum hydrochloricum (chlorowodorek lidokainy)
Synonimy: Lignocainum, Xylocainum, chlorowodorek 2-
(dietyloamino)-N-(2,6-dimetylofenylo)-acetamidu
§
biały, krystaliczny proszek
§
lidokaina, acylowa pochodna 2,6-ksylidyny, mimo
obecności grupy amidowej ma charakter zasadowy
wynikający z obecności w łańcuchu bocznym III-rzędowej
grupy aminowej
§
rozpuszczalność:
§
łatwo rozpuszcza się w wodzie i etanolu
§
praktycznie nie rozpuszcza się w eterze etylowym
§
działanie: miejscowo znieczulające, p/arytmiczne
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja z jonami
kobaltowymi
10% NaOH
etanol
chlorek kobaltu
Niewielką ilość analizowanej substancji
rozpuścić w wodzie, dodać 10% NaOH. Odsączyć
powstały osad i przemyć go wodą do reakcji
obojętnej wobec papierka uniwersalnego. Osad
rozpuścić w etanolu i dodać 2% chlorku kobaltu
Powstaje jasnozielony osad
Reakcja z
dymiącym HNO
3
dymiący kwas
azotowy
aceton
10% etanolowy
KOH
Do badanej substancji dodać kroplę dymiącego
kwasu azotowego i odparować do sucha na łaźni
wodnej. Do oziębionej pozostałości dodać
acetonu, kilka kropli 10% etanolowego roztworu
KOH
Powstaje zabarwienie zielone
Reakcja diazoniowania i sprzęgania z 36% kwasem siarkowym
Reakcje jonu
chlorkowego
1% AgNO
3
10% amoniak
Do wodnego roztworu analizowanej substancji
dodać azotanu srebrowego. Dodać roztworu
amoniaku
Powstaje biały osad, rozpuszczalny w
roztworze amoniaku
Saluretyki (sulfonamidy o działaniu moczopędnym)
1. Furosemidum (furosemid)
Synonimy: Lasix, kwas N-furfurylo-4-chloro-5-sulfamoiloantranilowy
§
biały lub prawie biały, krystaliczny proszek ciemniejący pod
wpływem światła
§
rozpuszczalność:
§
rozpuszczalny w roztworach zasad
§
trudno rozpuszczalny w etanolu
§
praktycznie nierozpuszczalny w wodzie
§
obecność wolnej grupy karboksylowej nadaje związkowi charakter wyraźnie kwasowy
§
działanie: moczopędne
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja z
aldehydem p-diM-
aminobenzoesowym
etanol
0,1% aldehyd p-
dimetyloamino-
benzoesowy
Substancję rozpuścić w 2ml acetonu, dodać 0,1%
roztworu aldehydu p-
dimetyloaminobenzoesowego w 65% H
2
SO
4
powstaje zabarwienie zielone,
przechodzące w ciemnoczerwone i
fioletowe
Reakcja z kwasem
chromotropowym
kwas chromo
tropowy w stęż.
H
2
SO
4
Substancję dodać do roztworu kwasu chromo
tropowego w stężonym kwasie siarkowym
Powstaje zabarwienie czerwone,
przechodzące w czerwono-fioletowe
CH
3
CH
3
NH C
CH
2
N
C
2
H
5
C
2
H
5
O
x HCl x H
2
O
H
2
NO
2
S
O
OH
NH
Cl
CH
2
O
Utworzenie
pochodnej
0,05M H
2
SO
4
5% azotyn sodowy
10% sulfaminian
amonowy
2% r-r di chloro-
wodorku N-(1-
naftylo)-
etylenodiaminy
Niewielką ilość substancji ogrzewać przez kilka
minut z 10ml 0,05M roztworu kwasu
siarkowego. Po ostudzeniu dodać 3 krople 5%
azotynu sodowego, po upływie 3min. 2 krople
10% sulfaminianu amonowego, a następnie 2
krople świeżo przygotowanego 2% roztworu di
chlorowodorku N-(1-naftylo)-etylenodiaminy w
50% etanolu
Powstaje intensywne purpurowe
zabarwienie.
Utworzona pochodna kwasu
antranilowego ulega diazowania, a
następnie sprzęganiu z N-(naftylo)-
etylenodiaminą wobec sulfaminianu
amonowego
Sole wapnia i glukoza
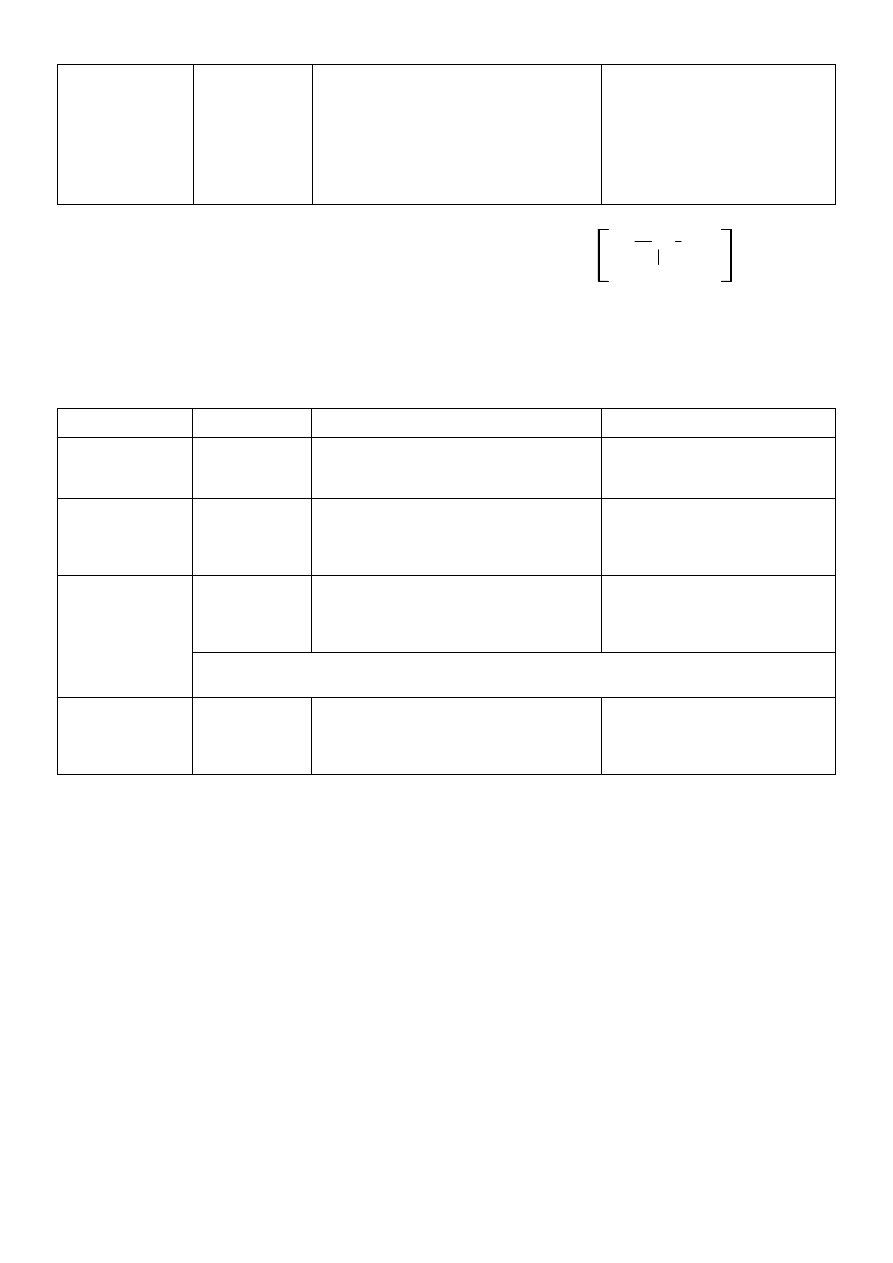
1. Calcium lacticum (mleczan wapnia)
§
biały proszek bez zapachu lub o słabym charakterystycznym zapachu
§
wietrzeje na powietrzu
§
rozpuszczalność:
§
rozpuszcza się w wodzie
§
łatwo rozpuszcza się w gorącej wodzie
§
trudno rozpuszcza się w etanolu
Najważniejsze reakcje potwierdzające tożsamość:
Próba
Substancje
Wykonanie
Efekt
Reakcja na jon
wapniowy
szczawian
amonowy
Do wodnego roztworu substancji dodać roztworu
szczawianu amonowego. Dodać 2M kwasu
siarkowego
Powstaje biały osad rozpuszczalny w
kwasie siarkowym
Utlenianie
16% H
2
SO
4
0,1M KMnO
4
Do wodnego roztworu analizowanej substancji
dodać 16% kwasu siarkowego celem strącenia
jonów wapniowych i zakwaszenia roztworu.
Dodać nadmanganianu i ogrzać
Roztwór odbarwia się wydzielając
zapach aldehydu octowego
Reakcja
jodoformowa
16% H
2
SO
4
15% NaOH
J
2
w KJ
Do wodnego roztworu dodać 16% H
2
SO
4
.
Przesączyć ewentualny osad. Dodać 15% NaOH i
kroplami J
2
w KJ do lekko żółtego zabarwienia.
Roztwór ogrzać, ochłodzić
Wydziela się żółty osad jodoformu
(CHJ
3
) o charakterystycznym zapachu
Reakcja z
rezorcynolem
16% H
2
SO
4
rezorcynol
96% H
2
SO
4
Wodny roztwór analizowanej substancji
zakwasić 16% kwasem siarkowym do strącenia
jonów wapniowych. Do przesączu dodać
rezorcynolu i 96% kwasu siarkowego
Powstaje czerwone zabarwienie. W
odpowiednich warunkach z jedną
cząsteczką utworzone aldehydu
octowego reagują 2 cząsteczki fenolu
C
H
3
CH COO
-
OH
2
Ca
2+
x 5H
2
O
Wyszukiwarka
Podobne podstrony:
Leki dzialajace na uklad oddechowy 2
Leki Działające Na Układ Przywspółczulny
Leki działające na układ oddechowy, Farmakologia
Leki działające na układ oddechowy 3
leki dzialajace na uklad krazen Nieznany
LEKI DZIAŁAJĄCE NA UKŁAD ODPORNOŚCIOWY, Farmakologia(15)
W05-SZ-W05 - Leki działające na układ równowagi krzepnięcia krwi (Krall), Naika, stomatologia, Farma
8 LEKI DZIALAJXCE NA UKLAD ODDECHOWY 3
leki dzialające na układ oddechowy
leki działające na układ krążenia (2)
LEKI DZIAŁAJˇCE NA UKŁAD KRˇ Ĺ»ENIA 2007
Leki działające na układ oddechowy
Leki działające na układ oddechowy, Farmakologia
leki działające na układ nerwowy, chemia organiczna
więcej podobnych podstron