
WODA
W ORGANIZMIE
CZŁOWIEKA – KOLOIDY
Zakład Chemii Medycznej
Pomorski Uniwersytet Medyczny

SKŁADNIKI UKŁADU
– substancje chemiczne, z których złożony
jest dany układ; tworzą ze sobą różnego rodzaju mieszaniny – co
sprawia, że w układzie mogą współistnieć ze sobą różne fazy
FAZA
- część układu oddzielona od pozostałych granicą, na której
następuje skokowa zmiana właściwości fizykochemicznych;
- faza zawierająca jeden składnik -
substancja czysta,
- faza składająca się z więcej, niż jednego składnika -
roztwór
ROZTWÓR
– mieszanina dwóch lub więcej substancji
rozpuszczonych w rozpuszczalniku, czyli substancji przeważającej
ilościowo nad pozostałymi składnikami roztworu

HETEROGENICZNE –
wielofazowe
(pozornie
jednofazowe),
niejednorodne; np. woda z lodem (układ heterogeniczny, dwufazowy,
jednoskładnikowy), woda z rtęcią (układ heterogeniczny, dwufazowy,
dwuskładnikowy)
HOMOGENICZNE –jednofazowe, jednorodne w całej przestrzeni
zarówno
pod
względem
chemicznym,
jak
i
fizycznym;
np. roztwór glukozy (układ homogeniczny, jednofazowy, dwuskładnikowy)
Podział
układów
ze względu na:
1)
liczbę występujących substancji:
jednoskładnikowe
wieloskładnikowe
2)
liczbę występujących faz:
jednofazowe
wielofazowe
UKŁADY:
UKŁADY

Rozpuszczanie związków to proces prowadzący do
otrzymania mieszaniny jednorodnej makroskopowo;
uzyskiwane jest przez
:
roztwarzanie związane z reakcją chemiczną rozpuszczanej substancji
z danym rozpuszczalnikiem (np. synteza kwasu fosforowego, siarkowego)
mieszanie dwóch substancji (np. gazu w gazie) - właściwie rozpraszanie
substancji, zachodzące przy braku współdziałania między cząsteczkami
rozpuszczalnika i substancji rozpuszczonej; prowadzi do osiągnięcia
stanu o maksymalnym nieuporządkowaniu. Rozpuszczanie jest w tym
przypadku wynikiem fizycznego procesu dyspersji danej substancji
w rozpuszczalniku
solwatację polegającą na grupowaniu się cząsteczek rozpuszczalnika
wokół cząsteczek substancji rozpuszczonej, czyli na izolowaniu od
siebie cząsteczek, atomów lub jonów substancji rozpuszczonej przez
cząsteczki rozpuszczalnika (sole, związki jonowe organiczne, związki
organiczne z polarnymi grupami funkcyjnymi)

TYPY ROZTWORÓW – w zależności od stanu
skupienia rozpuszczalnika i substancji rozpuszczonej:
roztwory w stanie stałym
– atomy pierwiastka rozpuszczonego są
rozproszone bezładnie w sieci rozpuszczalnika stałego i zajmują
pozycje węzłowe przynależne rozpuszczalnikowi lub pozycje między
węzłami (jeżeli atomy pierwiastka rozpuszczonego są znacznie mniejsze
niż atomy rozpuszczalnika), np. kryształy mieszane
roztwory gazowe
– otrzymywane przez zmieszanie np. jednego gazu
z drugim; taka mieszanina jest jednorodna (np. powietrze – mieszanina
azotu, tlenu, dwutlenku węgla, pary wodnej i gazów szlachetnych)
roztwory ciekłe
- otrzymywane przez rozpuszczenie gazu, cieczy
lub ciała stałego w cieczy; jest to więc mieszanina atomów, cząsteczek
lub jonów w ciekłym rozpuszczalniku

RODZAJE ROZTWORÓW – w zależności od
stopnia rozdrobnienia substancji rozproszonej
w fazie rozpraszającej:
RODZAJ ROZTWORU
ŚREDNICA CZĄSTEK
FAZY ROZPROSZONEJ
Właściwy/ rzeczywisty
(homogeniczny)
< 10
-9
m (<1nm)
Koloidalny (heterogeniczny)
10
-9
- 10
-7
m (1-100 nm)
Zawiesina
> 10
-7
m (>100 nm)
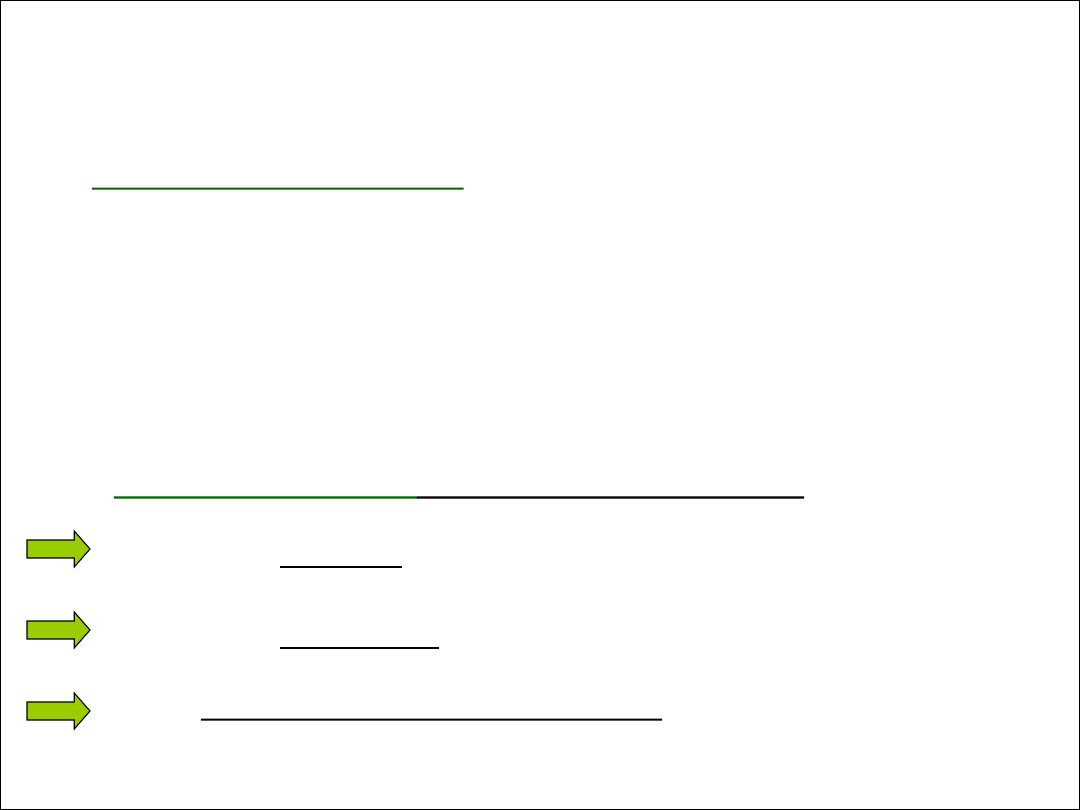
w przyrodzie ożywionej (białka, węglowodany)
w przyrodzie nieożywionej (gliny, mgły, pył wulkaniczny)
ROZTWORY KOLOIDALNE
- heterogeniczne układy dyspersyjne,
w których można wyróżnić fazę ciągłą rozpraszającą (rozpuszczalnik)
i nieciągłą fazę rozproszoną o średnicy cząsteczek 10
-9
- 10
-7
m
(1 – 100 nm, czasem nawet do 500nm)
UKŁADY KOLOIDALNE
są szeroko rozpowszechnione:
ROZTWORY KOLOIDALNE
wśród związków otrzymywanych sztucznie w laboratorium
(mydła , barwniki, siarka koloidalna, tlenki metali)
Wszystkie żywe komórki są zespołami różnorodnych
układów
koloidalnych
.
WŁAŚCIWOŚCI
ROZTWORÓW KOLOIDALNYCH (1)
Przesączają się przez zwykłe sączki bibułowe, ale są zatrzymywane
na ultrasączkach
Nie dializują – nie przechodzą przez błony półprzepuszczalne
pozostające w kontakcie z czystym rozpuszczalnikiem. Dializa to
proces polegający na oczyszczaniu koloidów, wykorzystujący
przechodzenie przez błony półprzepuszczalne tylko elektrolitu lub
substancji niskocząsteczkowych (
równowaga membranowa Donnana
)
Wykazują
ruchy Browna
, czyli ustawiczne i bezładne ruchy niezależne
od przyczyn zewnętrznych i nie znikające z czasem; są one wywołane
uderzeniami cząsteczek fazy rozpraszającej o powierzchnię cząstek
fazy rozproszonej
Są widoczne w ultramikroskopie

WŁAŚCIWOŚCI
ROZTWORÓW KOLOIDALNYCH (2)
Wykazują:
niewielkie obniżenie temperatury krzepnięcia
niewielkie obniżenie prężności par rozpuszczalnika
niewielkie podwyższenie temperatury wrzenia
małe wartości ciśnienia osmotycznego
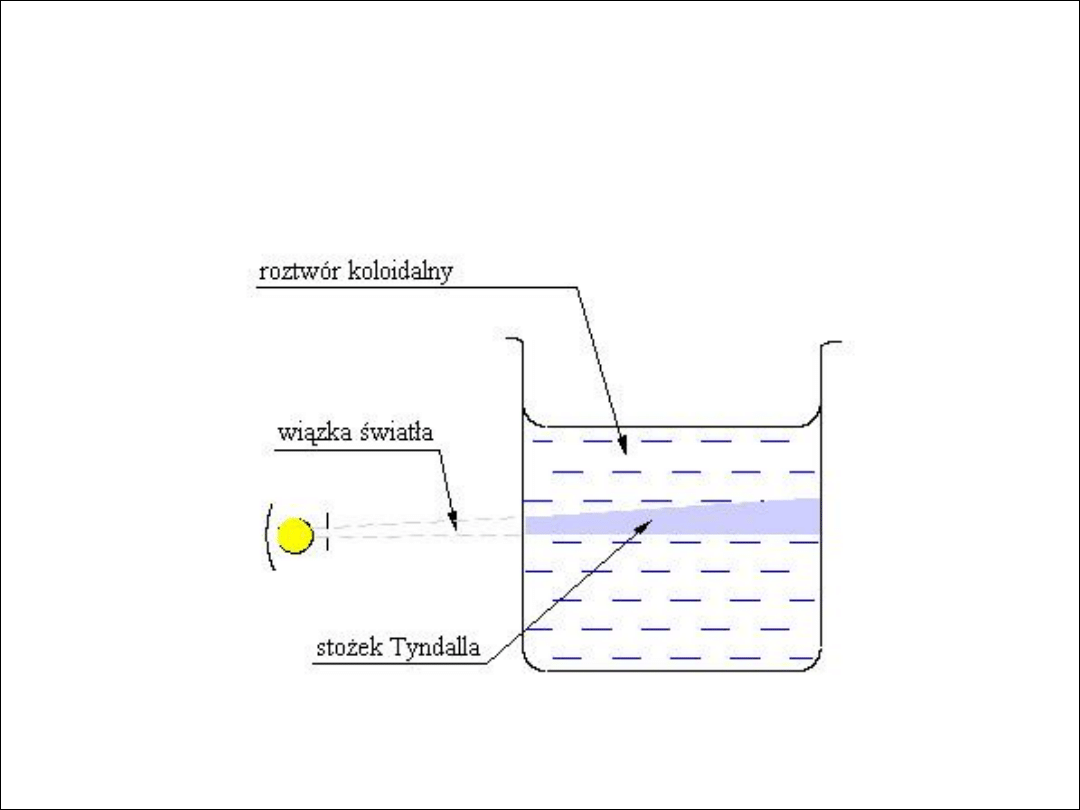
Wykazują
efekt Faraday’a-Tyndalla
(
czyli zjawisko polegające na
rozproszeniu światła przez drobne cząstki zawieszone w ośrodku
ciekłym, względnie gazowym, czyli w tzw. ośrodku mętnym (np. kurz,
mgła, mleko) z wytworzeniem charakterystycznego stożka świetlnego
tzw. stożka Tyndalla
Mogą ulegać
koagulacji
EFEKT FARADAY’A-TYNDALLA
KLASYFIKACJA UKŁADÓW KOLOIDALNYCH
W ZALEŻNOŚCI OD (1):
I. stanu skupienia fazy rozproszonej i rozpraszającej
FAZA
ROZPROSZONA
FAZA
ROZPRASZAJĄCA
KOLOID
PRZYKŁAD
Gaz
Ciecz
Ciało stałe
Gaz
Gaz
Gaz
-
Aerozole ciekłe
Aerozole stałe
-
Mgła, chmury, pary
Dym, kurz
Gaz
Ciecz
Ciało stałe
Ciecz
Ciecz
Ciecz
Piana
Emulsja
Zole
Piana: mydlana, na piwie
Kremy, lakier do paznokci,
mleko, majonez, masło
Zole tlenków i wodorotlenków
metali, roztwory
wielkocząsteczkowych
polimerów
Gaz
Ciecz
Ciało stałe
Ciało stałe
Ciało stałe
Ciało stałe
Piany trwałe
Emulsje stałe
Zole stałe
Pumeks, styropian
Galaretka, opale
Szkło rubinowe, barwne
kryształy

KLASYFIKACJA UKŁADÓW KOLOIDALNYCH
W ZALEŻNOŚCI OD (2):
wymiarów cząstek koloidalnych
monodyspersyjne (cząstki fazy rozproszonej mają jednakową wielkość)
polidyspersyjne
(cząstki fazy rozproszonej mają różne wymiary)
stosunku fazy rozproszonej do ośrodka rozpraszającego
koloidy liofilowe - mają duże powinowactwo do cząsteczek
rozpuszczalnika; na powierzchni cząstek koloidalnych tworzą się
otoczki z cząsteczek rozpuszczalnika
koloidy liofobowe - mają małe powinowactwo do rozpuszczalnika,
gromadzą na swej powierzchni dużą ilość jonów jednego rodzaju
z ośrodka rozpraszającego
II.
III.

KLASYFIKACJA UKŁADÓW KOLOIDALNYCH
W ZALEŻNOŚCI OD (3):
IV. jakości fazy rozproszonej ciekłe układy koloidalne dzieli się na:
roztwory molekularne – koloidy bardziej zbliżone do układów
jednofazowych niż dwufazowych a klasyfikowanie ich do koloidów wynika
głównie z rozmiarów cząsteczek np. wielkocząsteczkowe biopolimery
o dużych rozmiarach cząstek i dużych masach cząsteczkowych
(kwasy nukleinowe, polisacharydy, białka)
roztwory micelarne – cząstki mają niewielkie rozmiary i niewielkie masy
cząsteczkowe np. roztwory mydeł, detergentów, kwasów żółciowych.
Charakterystyczną cechą struktury molekularnej tych związków jest
występowanie obszarów o wybitnie polarnym i wybitnie niepolarnym
charakterze. Jeżeli stężenie fazy rozproszonej jest bardzo małe to
włąściwości tych koloidów niewiele różnią się od roztworów rzeczywistych
*
Roztwory
molekularne i micelarne
są hydrofilowe i noszą nazwę
emulsoidów
lub koloidów odwracalnych

KLASYFIKACJA UKŁADÓW KOLOIDALNYCH
W ZALEŻNOŚCI OD (cd 3):
cd.IV. jakości fazy rozproszonej ciekłe układy koloidalne dzieli się na:
emulsje – w organizmach żywych takie układy koloidalne są tworzone
przez lipidy (tłuszcze, glikolipidy, fosfatydy); drobne kropelki tłuszczu
mogą być utrzymane w środowisku wodnym w stanie rozproszenia
koloidalnego jedynie przy udziale cząstek mających zdolność
zmniejszania napięcia powierzchniowego, czyli
emulgatorów.
Emulgatorem
jest substancja, która wykazuje rozpuszczalność w obu
emulgowanych cieczach (np. spożyte tłuszcze w przewodzie pokarmowym są
emulgowane przez kwasy żółciowe zawarte w żółci).
*
Emulsje
mają charakter hydrofobowy i noszą nazwę
suspensoidów
lub koloidów nieodwracalnych.
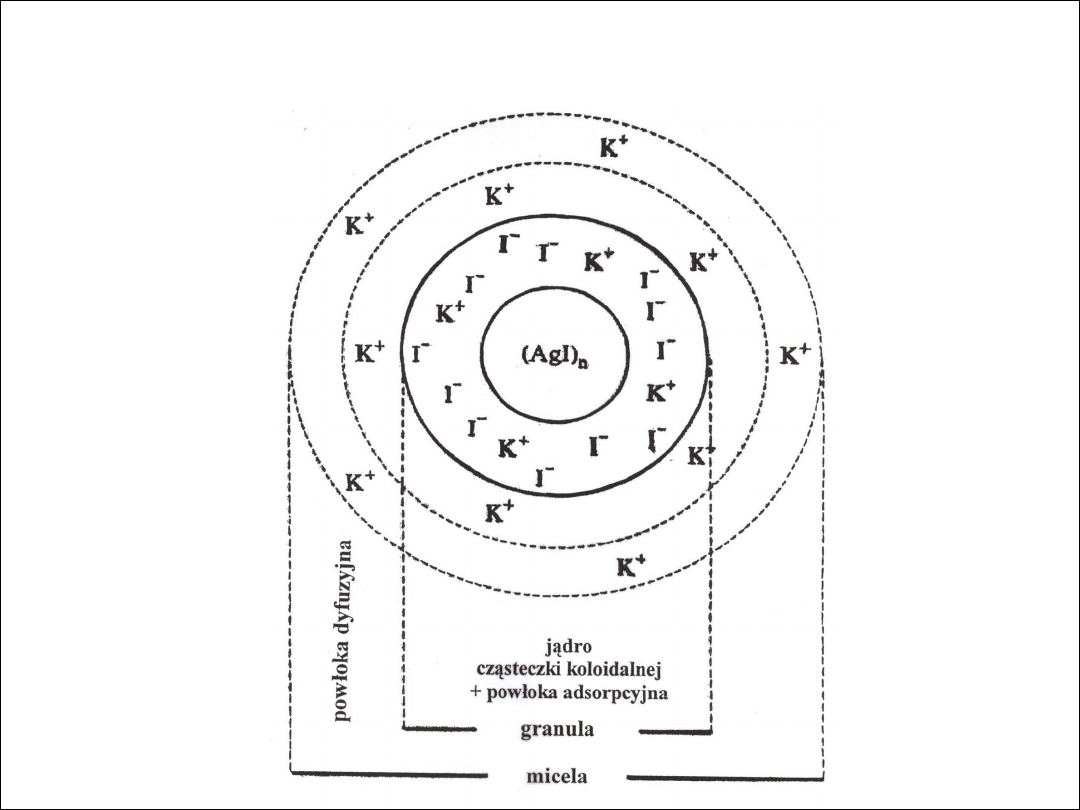
BUDOWA MICELI AgI WYTRĄCONEJ NADMIAREM KI

BUDOWA CZĄSTECZEK KOLOIDALNYCH
Hydrofobowe micele koloidalne są tworzone
najczęściej przez siarczki, tlenki, wodorotlenki
metali ciężkich
Koloidy hydrofilowe są zbudowane zwykle
z olbrzymich cząsteczek np. białka a swą trwałość
zawdzięczają
zaadsorbowanym
na
nich
cząsteczkom wody

KOAGULACJA (1)
KOAGULACJA
– dążenie cząsteczek koloidu do łączenia się
w większe jednostki (agregaty), które po osiągnięciu odpowiedniej
wielkości tracą zdolność do utrzymania się w roztworze i opadają
na dno naczynia (sedymentują).
1. Naświetlanie radiochemiczne – prom. beta powoduje koagulację zoli
dodatnich
2. działanie mechaniczne – mieszanie, wytrząsanie
3. ogrzewanie – ścinanie się białka
4. odparowanie lub wymrażanie ośrodka dyspersyjnego
5. dehydratacja lub desolwatacja środkami odwadniającymi – aceton,
alkohol
6. dodatek elektrolitu
Czynniki wywołujące koagulację :
KOAGULACJA (2)
Peptyzacja
– proces odwrotny do koagulacji - ponowne
rozdrobnienie wytrąconych produktów koagulacji i przechodzenie
skoagulowanego osadu z powrotem w stan koloidalny
ZOL
koagulacja
ŻEL/KOAGULAT
peptyzacja

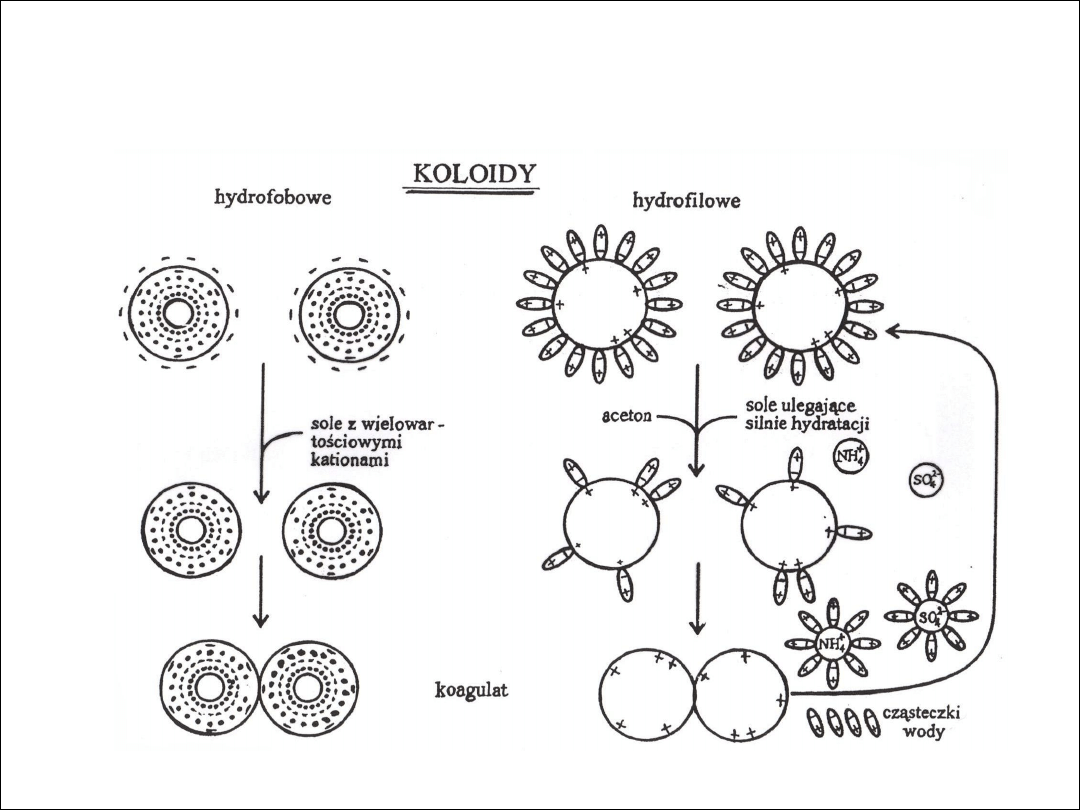
KOAGULACJA (3)
Koloidów hydrofobowych (nieodwracalna) – uzyskiwana przez
zobojętnienie ładunku elektrycznego nagromadzonego na
powierzchni cząsteczek koloidalnych.
Koloidów hydrofilowych (odwracalna) - polega na usunięciu
otaczającej cząsteczki koloidalne, warstwy hydratacyjnej
zwanej też otoczką lub płaszczem wodnym.
KOAGULACJA (4)

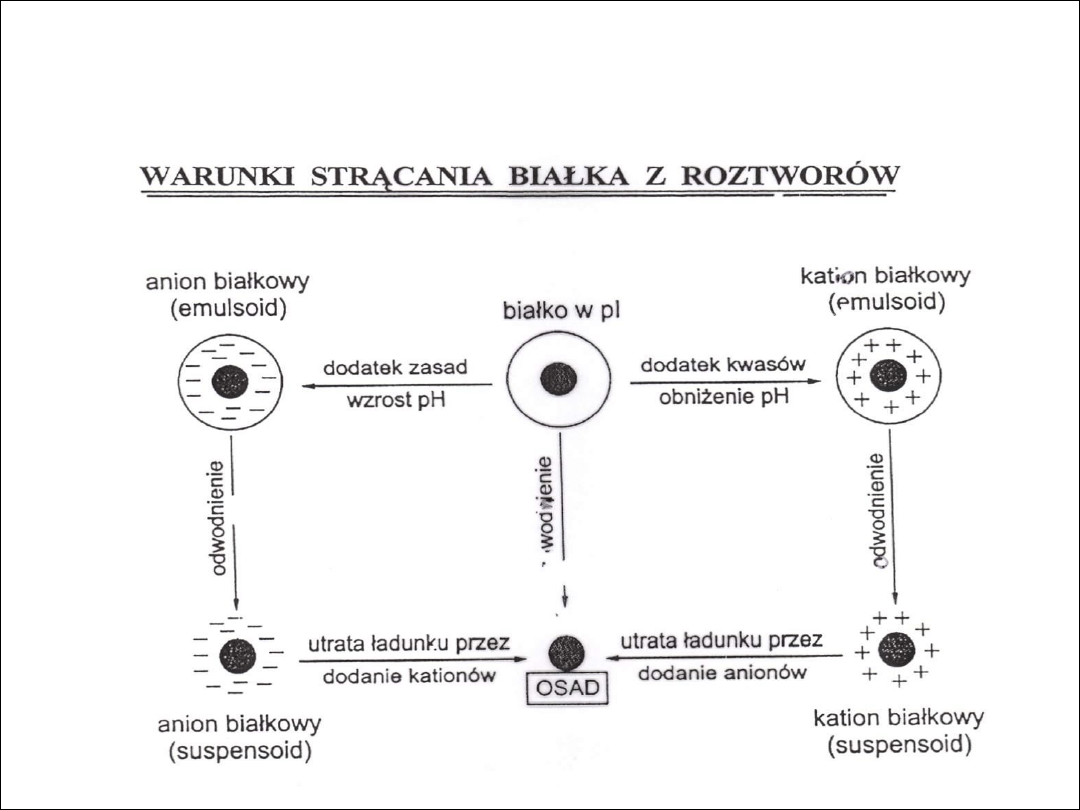
KOAGULACJA (5)
Białka najłatwiej jest wysolić w punkcie izoelektrycznym (pI) – cząsteczki
są elektrycznie obojętne i siły przyciągania między nimi są największe, co
sprawia, że łatwo ulegają agregacji prowadzącej do wytrącania osadu.
W pH różnym od pI dzięki posiadanemu ładunkowi cząsteczki białka
mogą się utrzymywać w roztworze mimo pozbawienia ich płaszcza wodnego
(zachowują się jak koloidy hydrofobowe).
Warunki strącania (wysalania) białka
Dodatek małych ilości jonów zobojętniających ładunek elektryczny
prowadzi do wytrącenia białek, których cząsteczki nie posiadają wtedy ani
płaszcza wodnego ani ładunku.
KOAGULACJA (6)

OCHRONNE DZIAŁANIE KOLOIDÓW
HYDROFILOWYCH NA KOLOIDY HYDROFOBOWE
Koloidy hydrofilowe
wykazują większą trwałość niż koloidy hydrofobowe,
działają tu bowiem dwa czynniki stabilizujące:
warstwa hydratacyjna
czasami jednoimienny ładunek cząstek (ładunek ten jest wynikiem dysocjacji
kwasowych lub zasadowych grup znajdujących się w cząsteczkach tworzących
cząstkę koloidalną)
Koloidy hydrofilowe działają ochronnie na koloidy hydrofobowe - dodatek
koloidu hydrofilowego do hydrofobowego powoduje powstanie trwałego
układu, z którego trudno wytrącić zawieszone cząstki hydrofobowe (np.
drobne ilości białka dodane do koloidalnej zawiesiny złota chronią ją przed
koagulacją).
Ochronne działanie koloidu można określić ilościowo, podając jego tzw.
liczbę
złota
(czyli najmniejszą liczbę miligramów koloidu ochronnego, w przeliczeniu
na czystą substancję, jaka zabezpiecza 10cm
3
0,1% formaldehydowego zolu
złota przed zmianą barwy z czerwonej na fioletową wskutek dodania 1cm3
10% roztworu NaCl).

Dziękuję za uwagę !
Wyszukiwarka
Podobne podstrony:
Biotechnologia zamkniete użycie (2012 13)
Algebra liniowa i geometria kolokwia AGH 2012 13
kol zal dod pop algebra ETI 2012 13
zestawienie fakultetow 2012 13 Nieznany
cw2 tip 2012 13
17 rzs 2012 13 net wersja pods Nieznany (2)
12skaly osadowe 2012 13
Harmonogram V Farmacji 2012 13
E1 2012 13 zad 4 id 149133
9 10 pierwotne kzn 2012 13 net Nieznany (2)
Dermatologia Lekarski Egzamin 2012
harmonogram zajęć filmoznawstwo 2012-13, Filmoznawstwo
Szereg Fouriera przyklady, SiMR, Studia inżynierskie, Semestr II 2, Równania różniczkowe, 2012 13
2012 13 egzamin 2id 28112 (2)
E1 2012 13 zad 1 id 149130
E1 2012 13 zad 3 id 149132
zagadnienia do egzaminu z Podstaw chemicznych, Studia, Chemia, Podstawy chemiczne nauk o Ziemi - dla
FIZJOLOGIA I rok tematy cw sem wyk 2012-13, Medycyna, I rok, Fizjologia
egz pop AM AiR IBM 2012 13
więcej podobnych podstron