
AMINOKWASY
BIAŁKA
SACHARYDY
ĆWICZENIE 1

6
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.
AMINOKWASY,
BIAŁKA,
SACHARYDY
–
PRÓBY CHARAKTERYSTYCZNE
1.1. AMINOKWASY
1.1.1. Podstawy teoretyczne
Najbardziej charakterystyczną reakcją barwną
-aminokwasów jest reakcja
z ninhydryną. Jest ona uwarunkowana równoczesną obecnością wolnej grupy aminowej
i karboksylowej przy tym samym atomie węgla. W reakcjach barwnych
uwarunkowanych budową łańcucha bocznego aminokwasu, pozytywne wyniki dają
również związki nie będące aminokwasami, których cząsteczki zawierają takie same lub
podobne grupy funkcyjne.
Białka, zawierające z reguły wszystkie rodzaje aminokwasów, dają również
pozytywne odczyny w reakcjach na łańcuchy boczne poszczególnych aminokwasów.
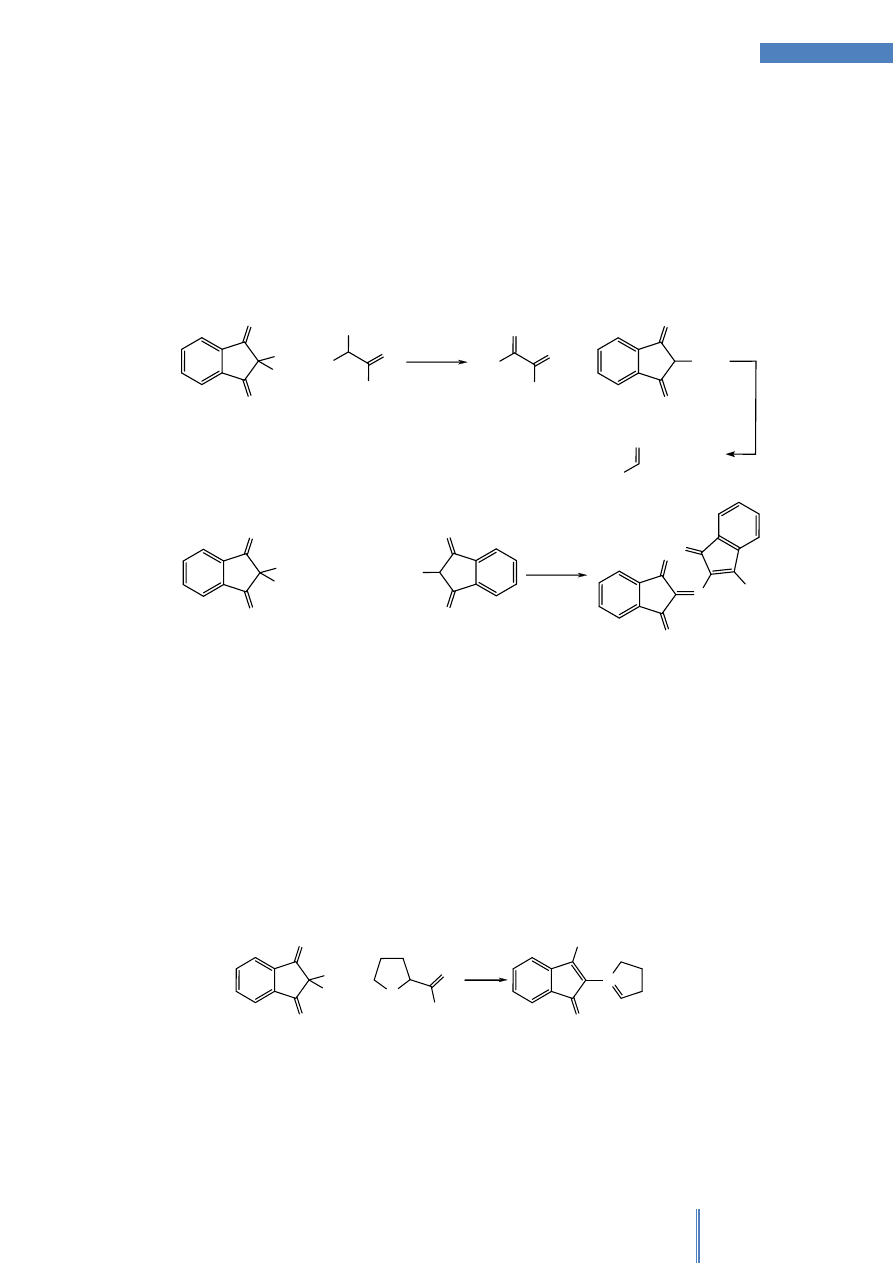
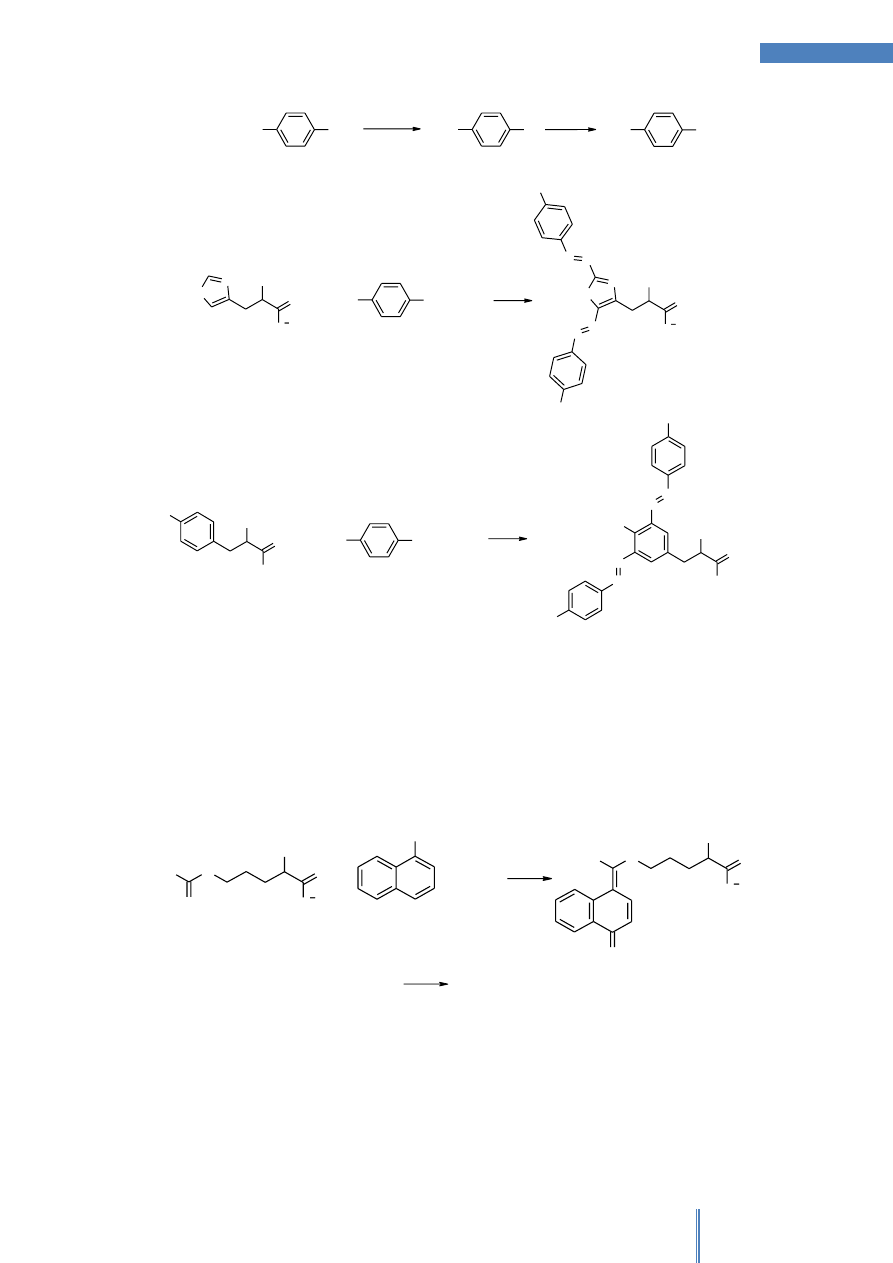
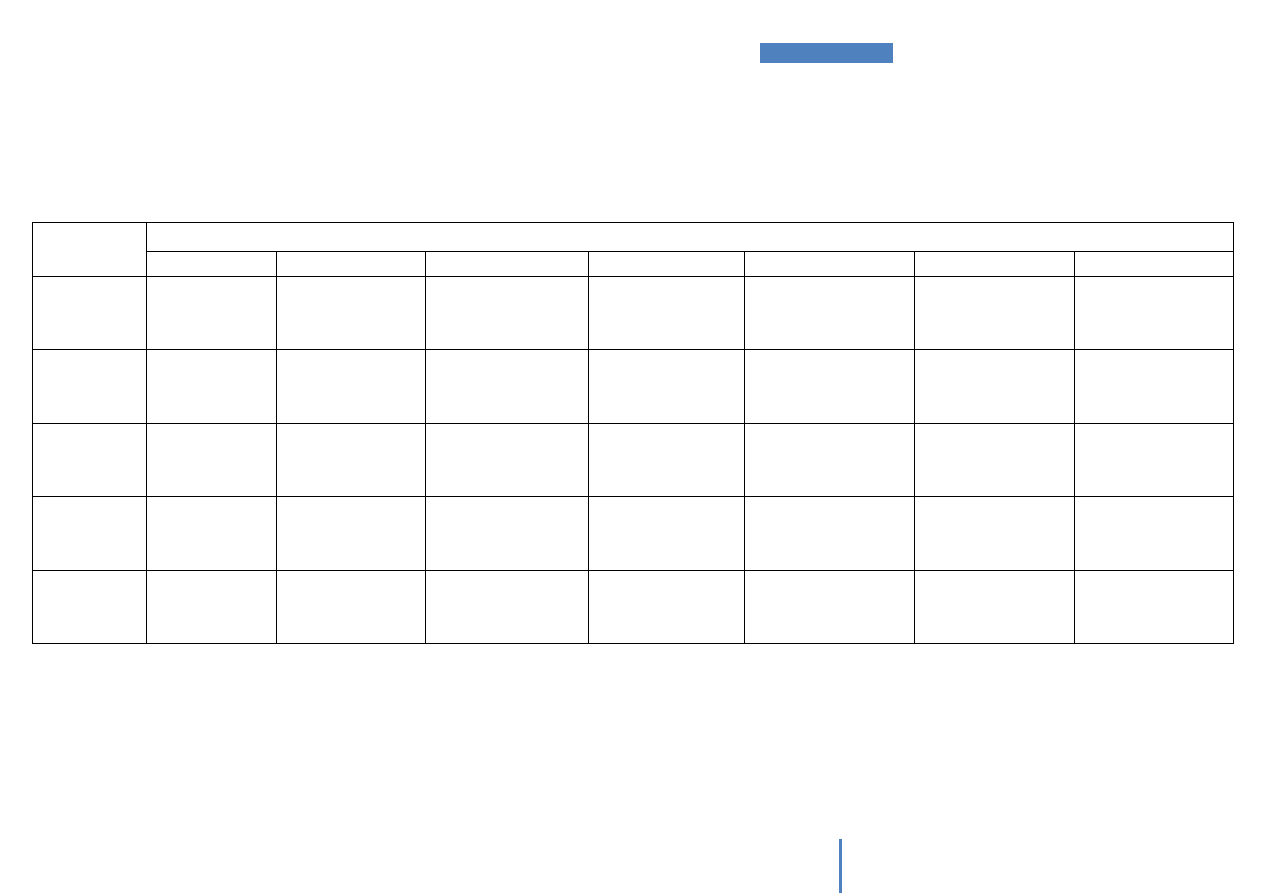
Schemat postępowania w celu identyfikacji aminokwasów przy wykorzystaniu
barwnych reakcji wskaźnikowych przedstawiono na Rysunku 1.
AA
S
[AA]
n
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Cys
R. KSANTOPROT.
INNE
AA-ARYL
Tyr
Phe+Trp
R. MILLONA
R. PAULY'EGO
R. SAKAGUCHI
R. HOPKONSA & COLE
Phe
Trp
His
Gly
Arg
R. NINHYDRYNOWA
PRÓBKA
BRAK AA & [AA]
n
AA & [AA]
INNE
INNE
Rysunek 1. Przebieg identyfikacji aminokwasów (AA) za pomocą barwnych reakcji
wskaźnikowych
7
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Reakcje ogólne aminokwasów
W reakcjach tych wykorzystuje się obecność wspólnych elementów strukturalnych
dla wszystkich aminokwasów czyli grupy aminowej –NH
2
oraz –COOH.
A. Reakcja z ninhydryną
Ninhydryna w reakcji z amoniakiem i aminami (również z białkami) daje produkty
barwne (Schemat 1). W przypadku reakcji z aminokwasami istotną rolę w przebiegu
reakcji odgrywa grupa karboksylowa ulokowana przy atomie węgla
.
O
O
OH
OH
NH
2
R
OH
O
+
O
O
OH
NH
R
OH
O
O
R
CO
2
NH
3
+
+
-H
2
O
O
O
OH
OH
O
O
N
O
O
-
- 3H
2
O
+H
2
O
+
O
O
HO
+
2NH
3
+
NH
4
+
purpura Ruhemana
Schemat 1. Reakcja aminokwasu z ninhydryną
Aminokwasy pod wpływem ninhydryny ulegają utlenieniu do amoniaku,
dwutlenku węgla i odpowiedniego aldehydu. Optymalne pH dla przeprowadzenia
reakcji ninhydrynowej mieści się w granicach 5.0-5.5. W roztworach o pH wyższym niż
4, amoniak reaguje dalej z ninhydryną i ze zredukowaną ninhydryną, dając związek o
barwie fioletowej (purpura Ruhemana), której natężenie jest proporcjonalne do
zawartości azotu aminowego aminokwasu.
Prolina posiadająca II-rzędową grupę aminową tworzy z ninhydryną produkty
innego typu. Posiadają one żółte zabarwienie z maksimum absorpcji przy 440 nm
(Schemat 2).
O
O
OH
OH
+
O
-
O
N
+
CO
2
+
+ 2H
2
O
N
H
OH
O
Schemat 2
Cysteinę i cystynę można oznaczyć tą metodą dopiero po przeprowadzeniu ich w
kwas cystynowy (HSO
3
CH
2
(NH
2
)CHCOOH).
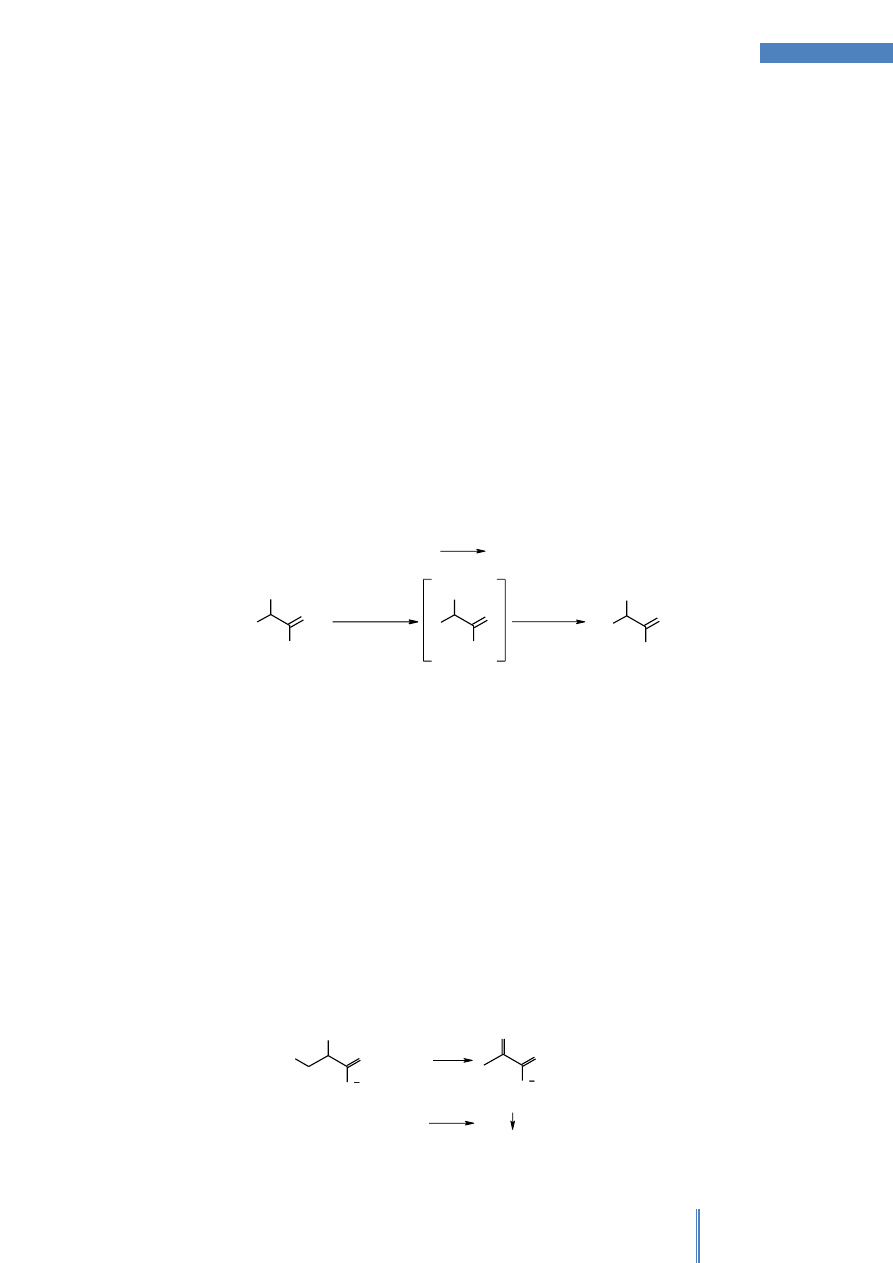
8
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Dodatni wynik reakcji z ninhydryną (oprócz aminokwasów, peptydów i białek)
dają także sole amonowe, aminocukry i amoniak. Z tego względu oznaczana próba musi
być wolna od tych związków.
Reakcja barwna aminokwasów i soli amonowych z ninhydryną stanowi podstawę
ilościowego oznaczania tych związków w metodach kolorymetrycznych, w których
mierzy się natężenie barwy zależnie od stężenia powstałego barwnego związku. W
metodach gazometrycznych mierzy się ilość wydzielonego dwutlenku węgla lub
amoniaku. Reakcja ta znalazła liczne zastosowania zarówno w próbach jakościowych,
jak i w metodach ilościowego oznaczania aminokwasów.
B. Reakcja van Slyke’a (z kwasem azotowym (III))
Aminokwasy wydzielają azot cząsteczkowy w reakcji z kwasem azotowym(III)
w wyniku deaminacji (Schemat 3). Reakcje te wykorzystuje się w gazometrycznej
metodzie ilościowego oznaczania aminokwasów metoda van Slyke'a. Również inne
związki zawierające 1-rzędową grupę aminową ulegają tej reakcji np. aminocukry.
Należy zaznaczyć że prolina jest aminokwasem posiadającym II-rzędową grupę
aminową i tej reakcji nie ulega.
NH
2
R
OH
O
R
OH
O
N
2
OH
R
OH
O
+
+ H
2
O
HNO
2
- N
2
NaNO
2
+ AcOH
HNO
2
+ AcONa
Schemat 3
Reakcje charakterystyczne wybranych aminokwasów
Opisane reakcje barwne są oparte na właściwościach chemicznych łańcuchów
bocznych (R) zawartych w aminokwasach.
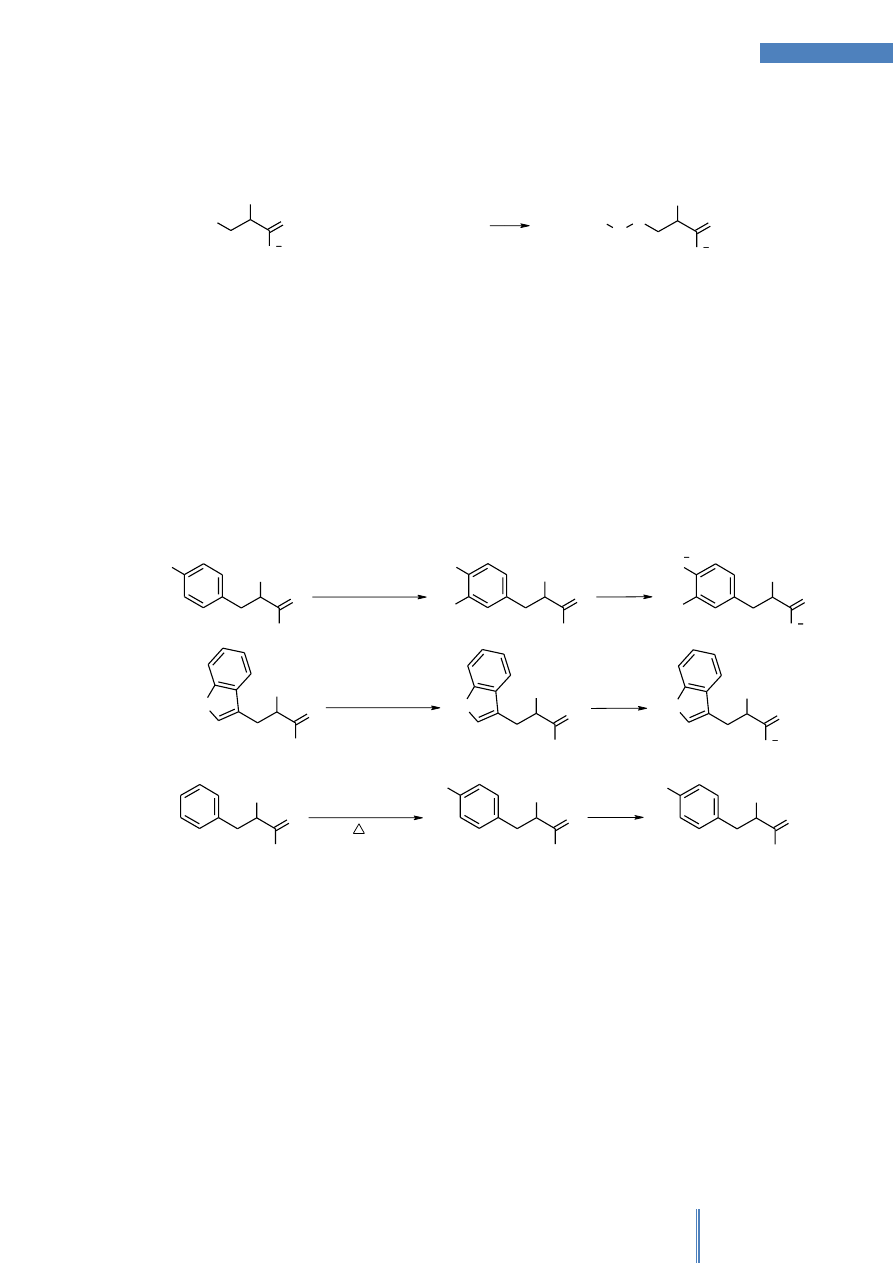
C. Reakcja na obecność aminokwasów siarkowych
Aminokwasy siarkowe z grupami –SH lub –S-S- (zarówno w stanie wolnym lub
związanym w białkach), jak cysteina i cystyna, ogrzewane w środowisku zasadowym
ulęgają rozkładowi, z utworzeniem kwasu pirogronowego, anionu siarczkowego i
amoniaku. Anion S
2-
w roztworach zawierających kationy ołowiu(II) tworzy czarny lub
szary osad siarczku ołowiu(II) (Schemat 4). Metionina, w której atom siarki uczestniczy
w utworzeniu wiązania tioeterowego, nie daje pozytywnego wyniku tej reakcji. Przebieg
reakcji cysteiny z jonami ołowiu (II) przedstawiony jest na Schemacie 4
NH
2
O
O
S
H
O
O
O
+ 2OH
Pb
2
PbS
-
+ NH
3
+ H
2
O + S
2
-
+
+ S
2
-
Schemat 4
9
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Cysteinę od cystyny można odróżnić w reakcji z nitroprusydkiem sodu. Grupy
tiolowe –SH tworzą z tym odczynnikiem związek kompleksowy o zabarwieniu
czerwonofiołkowym (Schemat 5).
NH
2
O
O
S
H
O
O
S
O
N
NH
2
+ [Fe(CN)
5
NO]
2
+ NH
3
-
+ NH
4
+
Fe(CN)
5
Schemat 5
D. Reakcja ksantoproteinowa na obecność pierścienia benzenowego
Pierścienie aromatyczne różnych związków ulegają nitrowaniu pod wpływem tzw.
mieszaniny
nitrującej
(Schemat
6).
Produkty
nitrowania
maja
barwę
od jasnożółtej do brązowej, znacznie intensywniejszą po zalkalizowaniu próby. Reakcja
zachodzi z różną szybkością i wydajnością w zależności od budowy związku i warunków
reakcji. Tyrozyna, tryptofan i białka zawierające te aminokwasy ulegają łatwo
nitrowaniu, natomiast fenyloalanina wymaga intensywnego ogrzewania. Natomiast
aromatyczny pierścień imidazolu obecny w histydynie w tych warunkach nie ulega
nitrowaniu i ten aminokwas nie daje pozytywnego wyniku tej próby.
HNO
3
/H
2
SO
4
NH
2
OH
O
O
H
NH
2
OH
O
O
H
O
2
N
NH
2
O
O
O
O
2
N
NH
2
OH
O
N
H
HNO
3
/H
2
SO
4
NH
2
OH
O
N
H
NH
2
O
O
N
H
HNO
3
/H
2
SO
4
NH
2
OH
O
NH
2
OH
O
O
2
N
NH
2
O
O
O
2
N
NaOH
NaOH
NaOH
Schemat 6
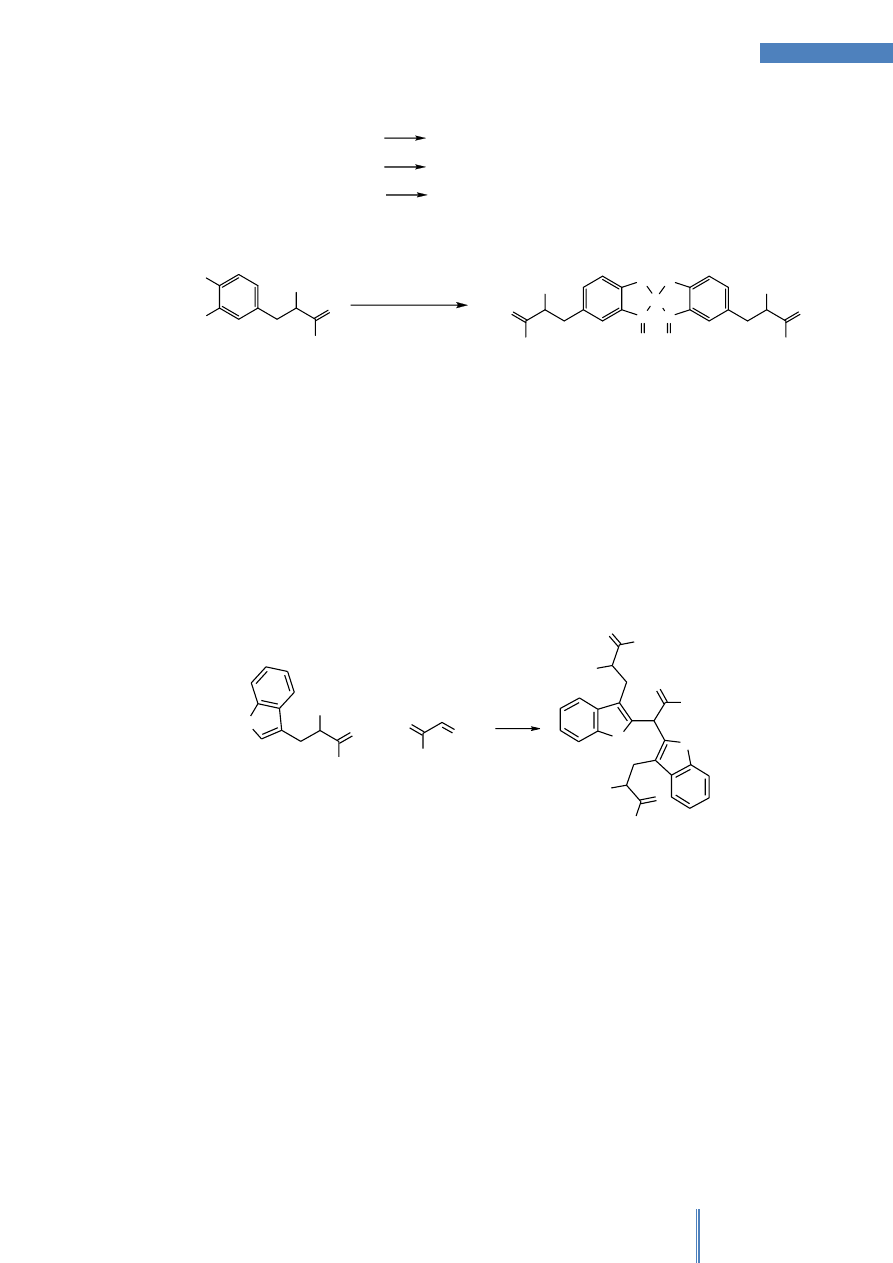
E. Reakcja Millona na obecność fenoli
Monofenole z odczynnikiem Millona ulegają reakcji nitrozowania w pozycji orto.
Powstająca nitrozopochodna w obecności jonów rtęci(II) tworzy kompleksy o barwie
czerwonej. Jest to reakcja charakterystyczna dla monofenoli, a wiec spośród
aminokwasów tylko dla tyrozyny. Służy do ilościowego oznaczania tyrozyny metodą
fotometryczną.
10
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
2 Hg + 6 HNO
3
2 Hg(NO
3
)
2
+ NO + NO
2
+ 3 H
2
O
NO + NO
2
N
2
O
3
N
2
O
3
+ H
2
O
2 HNO
2
otrzymywanie odczynnika Millona:
reakcja z tyrozyną
NH
2
HO
O
OH
oczynnik Millona
2
O=N
NH
2
O
OH
NH
2
O
OH
O
N
N
Hg
O
O
O
Schemat 7
F. Reakcja Hopkinsa i Cole na obecność tryptofanu
W środowisku kwaśnym tryptofan reaguje z aldehydami, między innymi
z kwasem glioksalowym (reakcja Hopkinsa i Cole) lub aldehydem mrówkowym (reakcja
Voisseneta). W obecności kwasu glioksalowego (lub innego aldehydu) pierścienie indolu
dwóch cząsteczek tryptofanu ulegają kondensacji z aldehydem, dając barwny produkt
(Schemat 8). W kwaśnych hydrolizatach peptydów lub białek wynik tej reakcji jest
ujemny, ponieważ tryptofan podczas kwaśnej hydrolizy ulega degradacji.
NH
3
OH
O
N
H
O
OH
O
H
3
N
OH
O
N
H
OH
O
N
H
H
3
N
O
H
O
+
+
+ H
2
O
+
+
2
Schemat 8
G. Reakcja Pauly'ego na obecność histydyny i tyrozyny
Pochodne imidazolu, jak również fenole i aminy aromatyczne, dają z solami
diazoniowymi w środowisku zasadowym barwne produkty sprzęgania. Pauly
zastosował w tym celu kwas diazobenzenosulfonowy, który przygotowuje się
bezpośrednio przed użyciem przez diazowanie kwasu sulfanilowego kwasem
azotowym(III) na zimno. Histydyna, tyrozyna i białka dają w reakcji Pauly'ego
jednakowe, czerwone lub pomarańczowe zabarwienie (Schemat 9).
11
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
NH
2
O
O
N
N
H
HO
3
S
NH
2
HO
3
S
N
2
O
3
S
N
2
O
3
S
N
2
NH
2
O
O
N
N
H
N
N
N
N
O
3
S
O
3
S
NH
2
OH
O
O
H
NH
2
OH
O
O
H
N
N
N
N
SO
3
O
3
S
O
3
S
N
2
+ H
2
O
NO
2
+
CO
3
2
+
-
-
+ 2
-
-
+ CO
3
2
-
+
-
+ CO
2
-
-
-
-
+ 2
+ CO
3
2
+
-
+ H
2
O
+ CO
2
Schemat 9
H. Reakcja Sakaguchi
Grupa guanidynowa argininy reaguje z
-naftolem i bromianem(I) sodu (lub
chloranu (I) sodu) w środownisku zasadowym utleniając się dając czerwony kompleks
(Schemat 10). Obecny w roztworze nadmiar NaOBr utlenia amoniak do wolnego azotu,
który pod postacią pęcherzyków gazu wydziela się z mieszaniny reakcyjnej.
NH
2
O
O
N
H
N
H
2
NH
OH
NH
2
O
O
N
H
N
H
2
O
2 NH
3
+ 3 BrO
N
2
+ 3 Br + H
2
O
-
-
+
BrO -
+
+ Br + H
2
O
-
Schemat 10

12
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.1.2. Wykonanie ćwiczeń
Uwaga: Białko jaja kurzego rozcieńczyć z wodą w stosunku objętościowym 1:1
Reakcje ogólne aminokwasów
A. Reakcja z ninhydryną
Do dwóch ponumerowanych próbówek odpipetować po 1 ml buforu fosforanowego o
pH 6 i dodać po 5 kropli roztworów: 1-glicyny; 2-proliny, 3-białka, 4-aminokwasu X.
Następnie dodać po 6 kropli roztworu ninhydryny i ogrzewać kilka minut we wrzącej
łaźni wodnej. Zanotować obserwacje.
B. Reakcja z kwasem azotowym(III)
Do próbówek odpipetować po 2 ml 10% NaNO
2
i 2 ml 2 M AcOH. Następnie dodać po 0,5
ml roztworów:1-glicyny, 2-proliny, 3-białka, 4-aminokwasu X. Dokładnie zamieszać.
Zanotować obserwacje.
Reakcje charakterystyczne niektórych aminokwasów
C. Reakcja na obecność aminokwasów siarkowych
Do próbówek odmierzyć po 5 kropli roztworów: 1-glicyny, 2-cystyny, 3-białka, 4-
aminokwasu X. Następnie dodać po 10 kropli 6 M NaOH i 5 kropli roztworu (AcO)
2
Pb.
Próbówki ogrzewać przez kilka minut we wrzącej łaźni wodnej. Zanotować obserwacje.
D. Reakcja ksantoproteinowa na obecność pierścienia benzenowego
Do ponumerowanych próbówek i odpipetować po 0,5 ml roztworów: 1-glicyny, 2–
tyrozyny; 3–tryptofanu; 4–fenyloalaniny; 5– białka; 6-aminokwasu X.
Do każdej probówki dodać po 2 krople stężonego kwasu azotowego(V) i 6 kropli
stężonego kwasu siarkowego(VI). Mieszaninę ogrzewać przez kilka minut we wrzącej
łaźni wodnej, a następnie ostudzić i ostrożnie dodać 2 ml 6 M roztworu NaOH (wlot
probówki skierować pod wyciąg). Gdyby zabarwienie nie wystąpiło, reakcje powtórzyć,
ogrzewając próbę w płomieniu mikropalnika do momentu pojawienia się brązowych par
tlenków azotu (kilka minut). Zanotować obserwacje.
E. Reakcja Millona na obecność fenoli
Ponumerować trzy próbówki i dodać po 10 kropli roztworów: 1-glicyny, 2-tyrozyny; 3-
białka, 4-aminokwasu X. Następnie dodać po 5 kropli odczynnika Miliona i ogrzewać
kilka minut we wrzącej łaźni wodnej. Zanotować obserwacje.
F. Reakcja Hopkinsa i Cole na obecność tryptofanu
Ponumerować próbówki i dodać po 10 kropli roztworów: 1-glicyny, 2-tryptofanu;
3-białka, 4-aminokwasu X oraz po 4 krople roztworu kwasu glioksalowego. Następnie
wprowadzić po ściance próbówki ok. 1 ml stężonego kwasu siarkowego(VI) w taki

13
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
sposób, aby nie wymieszać kwasu z roztworem wodnym. W obecności pochodnych
indolu na granicy faz powstanie fioletowe zabarwienie. Zanotować obserwacje.
G. Reakcja Pauly'ego na obecność histydyny
Zmieszać w próbówce po 2 ml roztworów kwasu sulfanilowego i azotanu(III) sodu
i zawartość próbówki wytrząsać przez kilka minut, chłodząc ją jednocześnie pod bieżącą
wodą. Następnie ponumerować cztery próbówek i odmierzyć do każdej po
5 kropli odczynnika diazowego i kolejno po 5 kropli roztworów:
1-glicyny 2-histydyny; 3-tyrozyny; 4-białka, 5-aminokwas X oraz po 10 kropli roztworu
Na
2
CO
3
. Zanotować obserwacje.
H. Reakcja Sakaguchi na obecność argininy
Do probówek wprowadzić około 1ml roztworów: 1-glicyny, 2-argininy, 3-białka,
4-aminokwasu X. Następnie do każdej probówki dodać w kolejności: ~0.5ml 10% NaOH,
3-krople 1% alkoholowego roztworu
-naftolu, 2 krople roztworu NaOBr; wymieszać i
dodać kilka kropel 40% roztworu mocznika (stabilizującego barwny produkt).
1.1.3. Przygotowanie sprawozdania (część pierwsza)
Uzyskane podczas wykonanych doświadczeń wyniki należy przedstawić w formie
zestawienia w Tabeli 1.
Wypełnienie Tabeli 2. Identyfikacja aminokwasu X. Napisanie równań lub schematów
zachodzących reakcji (lub zaznaczyć, że reakcja nie zachodzi) dla aminokwasu x. W
równaniach wskazać, który z produktów był obserwowany.
14
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
SPRAWOZDANIE (część pierwsza)
Obserwacje:
Tabela 1. Dla wszystkich prób
PRÓBA
OBSERWACJE
Gly
(Cys)
2
Phe
Tyr
Trp
His
Arg
Pro
Białko
Aminokwas
X
1.1.2.A.
Reakcja
z ninhydryną
+
-
-
-
-
-
-
-
+
+
1.1.2.B.
Reakcja
z HNO
2
+
-
-
-
-
-
-
+
+
+
1.1.2.C
Reakcja z
(CH
3
COO)
2
Pb
+
+
-
-
-
-
-
-
+
+
1.1.2.D
Reakcja
ksantoproteinowa
+
-
+
+
+
-
-
-
+
+
1.1.2.E
Reakcja
Millona
+
-
-
+
-
-
-
-
+
+
1.1.2.F
Reakcja
Hopkinsa i Cole
+
-
-
-
+
-
-
-
+
+
1.1.2.G
Reakcja
Pauly’ego
+
-
-
+
-
+
-
-
+
+
1.1.2.H
Rreakcja
Sakaguchi
+
-
-
-
-
-
+
-
+
+
15
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Obserwacje i wnioski:
Tabela 2. – tylko dla aminokwasu X
PRÓBA
OBSERWACJE
WNIOSKI
RÓWNANIE REAKCJI
1.1.2.A.
Reakcja
z ninhydryną
1.1.2.B.
Reakcja
z HNO
2
1.1.2.C
Reakcja z
(CH
3
COO)
2
Pb
1.1.2.D
Reakcja
ksantoproteinowa
16
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.1.2.E
Reakcja
Millona
1.1.2.F
Reakcja
Hopkinsa i Cole
1.1.2.G
Reakcja
Pauly’ego
1.1.2.H
Reakcja
Sakaguchi
IDENTYFIKOWANY AMINOKWAS:

17
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.2. BIAŁKA
1.2.1. Podstawy teoretyczne
Większość reakcji barwnych białek związana jest z rodzajem aminokwasów
z których są zbudowane. Reakcje te zostały omówione w poprzednim rozdziale. Do
reakcji wykorzystujących obecność wiązań peptydowych lub specyficzną budowę
przestrzenną cząsteczki należą: reakcja biuretowa i reakcje oparte na wytrącaniu białka
z roztworu za pomocą różnych czynników denaturujących.
A. Wytrącanie białek z roztworu
W określonym pH środowiska, powyżej lub poniżej pI, białka maja ładunek
odpowiednio ujemny lub dodatni, w wyniku czego zostają otoczone dipolarnymi
cząsteczkami wody (hydratacja). Wokół cząsteczek białka powstaje warstwa
solwatacyjna (otoczka wodna). Właściwość ta jest powodem powstawania roztworów
koloidalnych białka. Pozbawienie cząsteczek białka ładunku lub otoczki wodnej
prowadzi do łączenia się pojedynczych cząsteczek w agregaty i tworzenia się osadu
(koagulacja). Koagulacja jest procesem odwracalnym to znaczy, że np.: przez ponowne
dodanie wody wytrącone białko tworzy roztwór koloidalny a jego właściwości
biologiczne zostają zachowane.
Dzięki temu, że białka o różnym pI w tym samym pH środowiska będą miały różny
ładunek i powinowactwo do wody, możliwe jest ich frakcjonowanie. Wytrącanie
poszczególnych białek z roztworu przeprowadza się poprzez selektywne pozbawianie
ich ładunku, które można uzyskać w wyniku: zobojętnienia cząsteczek białka
odpowiednimi przeciwjonami, doprowadzenia pH roztworu do pI danego białka.
Wytrącanie białek uzyskuje się także przez usunięcie warstwy solwatacyjnej, dodając
związki o większym powinowactwie do wody niż cząsteczki białka (wysalanie) lub też
zmniejszenie liczby dipoli wodnych na powierzchni białka w wyniku dodania
rozpuszczalnika o niskiej stałej dielektrycznej.
Wiele czynników może prowadzić do denaturacji białka. Denaturacja jest procesem
nieodwracalnym i prowadzi do utraty właściwości biologicznych białka. W tym
przypadku zniszczona zostaje struktura II-rzędowa białka. Do denaturacji dochodzi pod
wpływem czynników chemicznych lub fizycznych. Do czynników denaturujących należą:
duże stężenia soli nieorganicznych, jony metali ciężkich, silne kwasy, zasady, reakcje
utleniania i redukcji, wysoka temperatura, promieniowanie UV, rentgenowskie,
radioaktywne, uszkodzenia mechaniczne. Rozpuszczalniki organiczne obniżające
potencjał elektrokinetyczny (alkohole, aceton, eter etylowy) i detergenty osłabiają
wiązania hydrofobowe cząsteczek białka; oddziałują bezpośrednio z naładowanymi
grupami na powierzchni cząsteczki, przez co dezorganizują warstwę solwatacyjną.
Działanie denaturacyjne tych związków pojawia sie przy stosowaniu ich w większych
stężeniach lub po dłuższym czasie działania i często w wyższych temperaturach
(powyżej 30°C).
Jednym z powszechniej stosowanych odczynników do odbiałczania jest kwas
trichlorooctowy (TCA), który w stężeniu 2-10% powoduje wytracenie większości białek
z roztworu. Do selektywnego wytrącania białek stosuje się najczęściej siarczan(VI)
amonu, a niekiedy siarczan(VI) magnezu lub etanol. Różnice stężeń tych odczynników, w
18
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
których poszczególne rodzaje białek dają się wysalać, służą do rozdzielania mieszanin
różnych rodzajów białek. Globuliny w środowisku pH 5-6 wytrącają się już przy stężeniu
15% etanolu, albuminy w środowisku pH 4,8 przy 40% etanolu. W przypadku albumin
w roztworze o pH znacznie różniącym się od pI (4,8) konieczne jest użycie wyższych
stężeń etanolu.
B. Próba biuretowa (reakcja Piotrowskiego)
Białka i peptydy zawierające co najmniej 2 wiązania peptydowe tworzą
z jonami miedzi(II) w środowisku zasadowym połączenia kompleksowe o barwie
fioletowej, natomiast produkty kompleksowego powiązania jonów miedzi(II)
z aminokwasami są niebieskie. Wyjątkiem jest histydyna, która ze względu na budowę
swego łańcucha bocznego daje produkt o barwie fioletowoniebieskiej.
W czasie przeprowadzania reakcji biuretowej dodatkowo zachodzi redukcja jonów Cu
2+
do Cu
+
w obecności tyrozyny, tryptofanu, cystyny i cysteiny. Reakcja biuretowa znalazła
zastosowanie w wielu metodach ilościowego oznaczania białek. Nazwa reakcji pochodzi
od
biuretu
-
najmniejszego
związku
dającego
pozytywny
wynik
w tej próbie (Rysunek 2). Najprostszymi związkami dającymi pozytywny wynik w tej
próbie są: biuret, diamid kwasu szczawiowego, tripeptyd.
O
N
N
H
R
O
N
N
H
R
Cu
2+
O
N
H
H
2
N
NH
2
O
biuret
kompleks jonów Cu
2+
białkami
NH
2
OH
O
N
HN
Cu
2+
kompleks jonów Cu
2+
z histydyną
H
H
H
H
Rysunek 2.
Reakcja biuretowa jest podstawą ilościowego oznaczania zawartości białka
w metodzie biuretowej i mikrobiuretowej. Oznaczenie białka tą metodą może utrudniać
siarczan(VI) magnezu, ponieważ w środowisku zasadowym powstaje nierozpuszczalny
wodorotlenek magnezu, maskujący zabarwienie prób, jak również sole amonowe
tworzące barwne kompleksy z jonami miedzi.
C. Reakcja Liebermanna
Reakcja ta jest charakterystyczna dla glikoprotein. W czasie ogrzewania
ze stężonym kwasem solnym następuje hydroliza białka, a jednocześnie z cukrów
powstają pochodne furfuralowe (patrz rozdział 1.3.4), które z fenolami, uwolnionymi w
czasie hydrolizy dają fioletowo zabarwione połączenia.
1.2.2. Wykonanie ćwiczenia
A. Wytrącanie białka za pomocą kwasu trichlorooctowego
Do 10 kropli roztworu 1-białka, 2-dowolnego aminokwasu dodać 3 krople 20%
roztworu TCA. Zanotować obserwacje.

19
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
B. Reakcja biuretowa (reakcja Piotrowskiego)
Do 5 kropli roztworu 1-wody destylowanej, 2-histydyny, 3-dowolneo innego
aminokwasu, 4-białka dodać 10 kropli 6 M NaOH i 2 krople 0,5% roztworu CuSO
4
.
Zanotować obserwacje.
1.2.3. Wykonanie sprawozdania (część druga)
Wypełnienie Tabeli 3 (obserwacje, wnioski). Jeśli jest to możliwe napisać wzór
substancji odpowiedzialnej za obserwowany efekt.

20
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
SPRAWOZDANIE (część druga)
Obserwacje i wnioski:
Tabela 3. Wykrywanie białek
OBSERWACJE
WNIOSKI
A. wytrącanie z użyciem TCA
roztwór aminokwasu
roztwór białka
B. próba biuretowa
roztwór histydyny
roztwór
innego
aminokwasu
roztwór białka
21
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.3. SACHARYDY
1.3.1. Właściwości redukujące sacharydów – odróżnianie mono-, di- oraz
polisacharydów
Wpływ zasad na cukry (Próba Moore’a)
W środowisku zasadowym monosacharydy ulegają enolizacji. Wiązanie enolowe
łatwo ulega rozerwaniu, więc z cukrów mogą wytwarzać się różne pochodne ulegające
ponad to polimeryzacji. Początkowo bezbarwny roztwór cukru przybiera barwę
brunatno czerwoną, przy czym może wydzielać się zapach przypalonego cukru.
Zarówno aldozy jak i ketozy ulegają w środowisku zasadowym tautomerii keto-
enolowej. W środowisku zasadowym ustala się równowaga pomiędzy izomerami np.:
heksoz (Schemat 13).
C
O
H
CH
2
OH
OH
H
OH
H
H
O
H
OH
H
CH
2
OH
C
CH
2
OH
OH
H
OH
H
H
O
H
O
C
OH
H
C
CH
2
OH
OH
H
OH
H
H
O
H
OH
C
O
H
CH
2
OH
OH
H
OH
H
H
O
H
H
O
H
HO
-
HO
-
HO
-
D-Glukoza
D-Mannoza
D-Fruktoza
Endiol
Schemat 11. Równowaga tautomeryczna heksoz
Na działanie zasad odporne jest wiązanie glikozydowe i dlatego oligo-i
polisacharydy nie dają pozytywnego wyniku tej próby Moore’a.
Właściwości redukujące cukrów
Ze względu na właściwości redoks sacharydy można podzielić na dwie grupy:
(a) Cukry redukujące (monosacharydy, większość disacharydów)
(b) Cukry nieredukujące (wybrane disacharydy, polisacharydy)
Za właściwości redukujące odpowiedzialna jest ‘wolna’ grupa karbonylowa. Tutaj warto
zaznaczyć, że ze względu na łatwą tautomerycację zarówno aldozy jak i ketozy mogą być
utleniane. Aby disacharyd posiadał właściwości redukujące przynajmniej jedna z grup
hydroksylowych obecnych przy anomerycznym atomie węgla nie może być
zaangażowana w tworzenie wiązania glikozydowego. Jest to warunek konieczny by
22
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
możliwe było otwarcie pierścienia cukru z odtworzeniem grupy karbonylowej. Tak więc
do disacharydów redukujących należą np.: maltoza, laktoza, celobioza; natomiast
sacharoza jest przykładem cukru nieredukującego. W przypadku naturalnie
występujących polisacharydów jedynie na końcach bardzo długich łańcuchów
biopolimerów może występować wolna grupa hydroksylowa przy anomerycznym
atomie węgla. Z tego powodu polisacharydy nie wykazują właściwości redukujących. W
przypadku polisacharydów dodatni wynik w reakcjach z odczynnikami redukującymi
można uzyskać po uprzedniej hydrolizie wiązań glikozydowych i pojawieniu się w
roztworze monosacharydów. Znanych jest wiele prób charakterystycznych
potwierdzających właściwości redukujące cukrów. Wybrane z nich zostały omówione
poniżej.
Podczas utleniania przy użyciu łagodnych utleniaczy (takich jakie są używane
podczas przeprowadzania popularnych ‘prób probówkowych’) aldozy utleniane są do
tzw. kwasów aldonowych (Schemat 12). Utlenianie ketoz jest procesem bardziej
skomplikowanym, w którym powstaje mieszanina poreakcyjna, złożona z kwasów
karboksylowych o różnej długości łańcucha węglowego.
O
OH
OH
OH
HO
OH
OH
OH
OH
HO
OH
O
[O]
OH
OH
OH
HO
OH
O
HO
inny zapis:
D-glukopiranoza
forma łańcuchowa
kwas glukonowy
O
HO
OH
HO
OH
OH
CHO
H
OH
HO
H
H
OH
OH
H
CH
2
OH
[O]
O
HO
OH
HO
OH
OH
COOH
H
OH
HO
H
H
OH
OH
H
CH
2
OH
OH
Schemat 12
A. Redukcja jonów metali
Cukry proste oraz część dwucukrów (z grupą OH przy anomerycznym atomie
węgla, która nie jest zaangażowana w tworzenie wiązania glikozydowego) wykazuje
właściwości redukujące, przejawiające się m.in. zdolnością do redukowania jonów
metali ciężkich (np.: Cu
2+
, Ag
+
) czy barwników (utleniona fuksyna, kwas pikrynowy).
W testach probówkowych zaobserwować można charakterystycznie zabarwione
produkty redukcji jonów metali (np.: Cu
2
O, Ag) lub niektórych związków organicznych.
W środowisku zasadowym zarówno monosacharydy jak i disacharydy
redukujące ulegają utlenieniu w obecności jonów Cu
2+
, Ag
+
. Z tego powodu nie jest
możliwe odróżnienie monosacharydów od disacharydów redukujących przy użyciu
zasadowych odczynników: Trommera, Fehlinga, Benedicta, Tollensa (Tabela 3).
W środowisku zasadowym tworzenie wewnątrzcząsteczkowego hemiacetalu jest
utrudnione i przeważa forma liniowa cukru z wolną grupą karbonylową, zdolną do
23
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
reakcji. Disacharydy redukujące ulegają wolniej utlenieniu od monosacharydów dopiero
w środowisku lekko kwasowym. W celu odróżnienia tych dwóch klas cukrów stosuje się
tzw. odczynnik Barfoeda. Dwucukry redukujące są w tych warunkach mniej reaktywne i
dopiero po dłuższym ogrzewaniu (powyżej 15 minut), gdy ulegną hydrolizie
do jednocukrów mogą dać dodatni wynik reakcji.
B. Redukcja utleniaczy organicznych
W roli odczynnika utleniającego można użyć niektórych związków organicznych.
Jednym z nich jest kwas pikrynowy, który w środowisku zasadowym, w obecności
cukrów jest przekształcany w sól sodową kwasu pikraminowego, od której pochodzi
brunatno-czerwone zabarwienie
O
-
NO
2
O
2
N
NO
2
[H]
O
-
NH
2
O
2
N
NO
2
anion pikrynianowy
anion pikraminianowy
Schemat 13
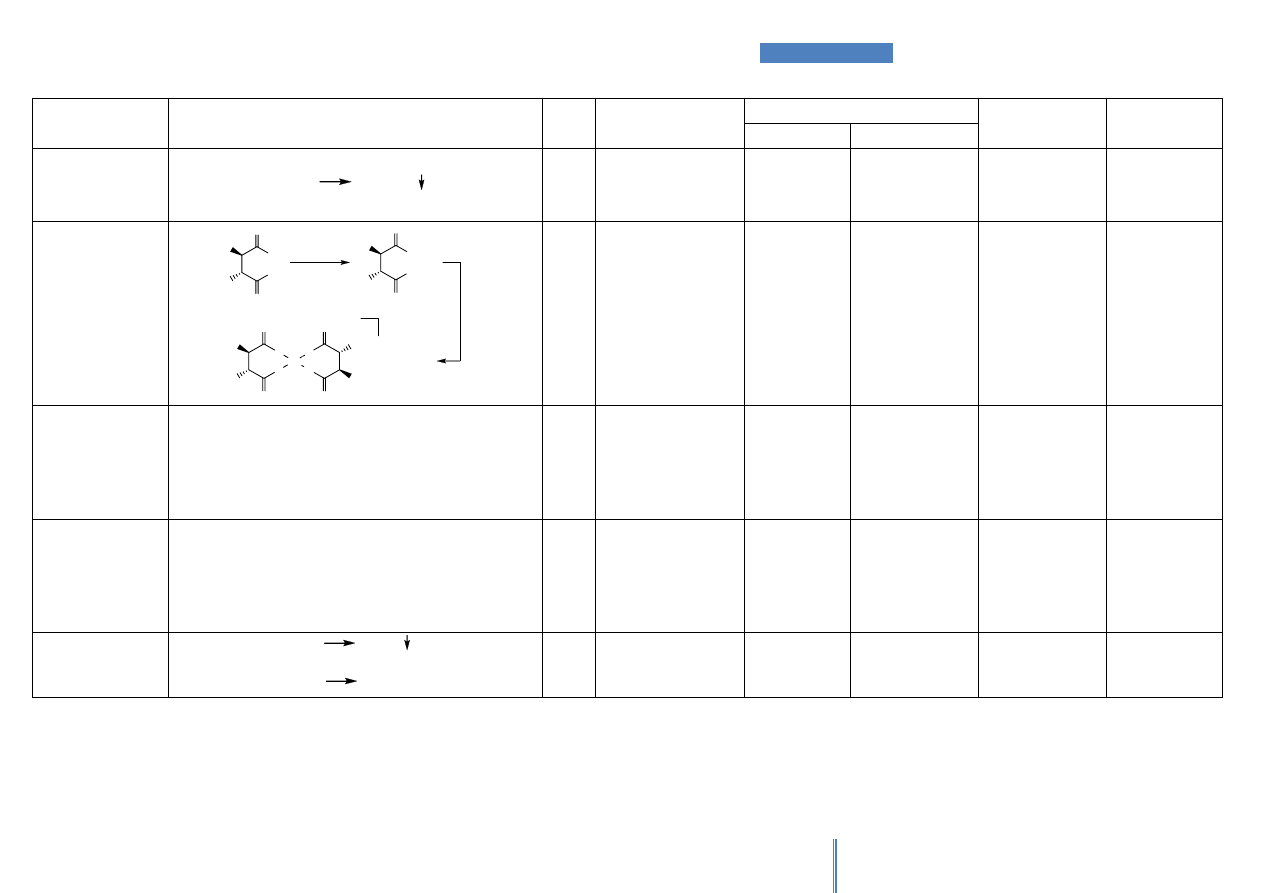
24
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Tabela 4. Odczynniki utleniające stosowane w próbach jakościowych
odczynnik
(próba)
otrzymywanie odczynnika redukującego
pH monosacharydy
disacharydy
polisacharydy
produkt
redukcji
redukujące nieredukujące
Trommera
CuSO
4
+
2 NaOH
Cu(OH)
2
+ Na
2
SO
4
> 7
+
+
-
-
Cu
2
O
(
ceglasto-
czerwony
)
Fehlinga
(
kompleks
jonów Cu
2+
z anionami
winianowymi)
+ 2 NaOH
HO
HO
OH
OH
O
O
HO
HO
O
-
Na
+
O
-
Na
+
O
O
- 2 H
2
O
HO
HO
O
O
O
O
OH
OH
O
O
O
O
Cu
2
-
2 Na
+
CuSO
4
> 7
+
+
-
-
Cu
2
O
(
ceglasto-
czerwony
)
Benedicta
(kompleks
jonów Cu
2+
z anionami
ctrynianowymi)
> 7
+
+
-
-
Cu
2
O
(
ceglasto-
czerwony
)
Barfoeda
(jony Cu
2+
w środowisku
kwasu
octowego)
< 7
+
-
-
-
Cu
2
O
(
ceglasto-
czerwony
)
Tollensa
2 AgNO
3
+ 2 NaOH
Ag
2
O
+ NaNO
3
+ H
2
O
Ag
2
O + 2 NH
3
.
H
2
O
2 Ag(NH
3
)
2
OH + H
2
O
> 7
+
+
-
-
Ag
(
srebrzysty
)

25
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.3.2. Wykonanie ćwiczenia
A1. Redukcja odczynnika Benedicta
Do pięciu ponumerowanych probówek wprowadzić po 0.5 ml roztworu cukru:
1-glukozy, 2-fruktozy, 3–laktozy, 4 i 5-sacharozy. Do probówek l, 2, 3 i 4 wprowadzić po
1 ml odczynnika Benedicta, wymieszać i ogrzewać we wrzącej łaźni wodnej przez około
3 minuty. Do probówki numer 5 dodać 4 krople 2 M kwasu solnego, ogrzewać we
wrzącej łaźni wodnej przez 5 minut, a następnie roztwór oziębić i zobojętnić, dodając 4
krople 2 M wodorotlenku sodu. W probówce 5 przeprowadzić reakcje z odczynnikiem
Benedicta. Zanotować obserwacje
A2. Próba z odczynnikiem Barfoeda
Do dwóch probówek wprowadzić po 5-10 kropli roztworu cukru: 1-glukozy,
2-laktozy, a następnie do obu dodać po 1 ml odczynnika Barfoeda. Zawartość probówek
wymieszać i ogrzewać do wrzenia w łaźni wodnej przez 4-5 minut. Zanotować
obserwacje.
1.3.3. Wykonanie sprawozdania (część trzecia)
Uzupełnienie Tabeli 5 (obserwacje, wnioski, równania reakcji lub zaznaczyć, że reakcja
nie zachodzi; w przypadku reakcji redoks ułożyć jej bilans jonowo-elektronowy).
W równaniach wskazać, który z produktów był obserwowany.
26
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
SPRAWOZDANIE (część trzecia)
Obserwacje i wnioski:
Tabela 5. Właściwości redukujące cukrów (mono-, disacharydy)
PRÓBA
OBSERWACJE
WNIOSKI
RÓWNANIE REAKCJI
A1. próby z odczynnikiem Benedicta
glukoza
fruktoza
27
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
laktoza
sacharoza
28
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
sacharoza + HCl
A2. próby z odczynnikiem Barfoeda
glukoza
29
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
laktoza
30
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.3.4. Identyfikacja monosacharydów
Wpływ kwasów na cukry
Polisacharydy ogrzewane w roztworach mocnych kwasów ulegają hydrolizie do
monosacharydów. Z kolei cukry proste ogrzewane z mocnymi kwasami ulegają
odwodnieniu z wytworzeniem furfuralu lub jego pochodnych (Schemat 10). Należy tu
zaznaczyć, że w środowisku silnie kwaśnym następuje tautomeryzacja ketoz do aldoz i
dlatego te pierwsze w obecności kwasów także tworzą odpowiednią pochodną furfuralu.
R
H
HO
H
H
OH
H
CHO
OH
OH
O
R
CHO
H
+
, T
- 3 H
2
O
Schemat 14. Produkty degradacji kwasowej cukrów
Tabela 4
R
cukier
produkt
H
pentoza
(np.: ksyoza)
furfural
CH
3
6-deoksyheksoza
(np.: ramnoza)
metylofurfural
CH
2
OH
heksoza
(np.: glukoza)
hydroksymetylofurfural
Związki te powstają z różną szybkością w zależności od rodzaju cukru, mogą
następnie ulegać kondensacji z fenolami lub aminami aromatycznymi tworząc produkty,
których barwa zależy od związku użytego do kondensacji, a często również od rodzaju
cukru. Odpowiedni dobór odczynników i warunków reakcji (czas i temperatura)
pozwala na rozróżnienie poszczególnych rodzajów cukrów. Niektóre reakcje tego typu
wykorzystywane są do oznaczeń ilościowych.
Reakcje charakterystyczne monosacharydów
A. Reakcja Molischa (ogólna reakcja na obecność cukrów)
Polega na sprzęganiu
-naftolu z grupą karbonylową odpowiedniego furfuralu,
utworzonego z danego cukru (Schemat 11). Pierwotnie utworzone produkty kondensacji
ulegają utlenieniu w obecności tlenu atmosferycznego w wyniku czego powstają
barwne, czerwono-fioletowe produkty. Używany w tej próbie kwas siarkowy(VI) jest na
tyle
silnym
kwasem,
że
katalizuje
hydrolizę
wiązań
glikozydowych
w wielocukrach (np. w celulozie), a powstałe monosacharydy dają pozytywny wynik
próby. Dodatni wynik reakcji nie wskazuje jednoznacznie obecności cukru, ponieważ
ulegają jej również niektóre hydroksyaldehydy i hydroksyketony.
31
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
H
+
, T
- 3 H
2
O
CHO
HC OH
HC OH
HC OH
HC OH
R
O
H
O
R = H, CH
3
, CH
2
OH
OH
O
OH
OH
R
H
[O]
[H]
O
O
OH
R
fiolet Molisha
R
Schemat 15
B. Reakcja Seliwanowa (odróżnienie aldoz od ketoz)
Na podobnej zasadzie oparta jest próba Seliwanowa, ale w odróżnieniu
od poprzedniej próby, do kondensacji używa się rezorcyny, a nie
-naftolu (Schemat 16).
Reakcja ta jest prowadzona w środowisku kwasu solnego i w tych warunkach furfural
powstaje łatwiej z ketoz niż aldoz i charakterystyczne, czerwone (czasem różowe)
zabarwienie pojawia się szybciej.
O
H
O
R = H, CH
3
, CH
2
OH
[O]
[H]
R
OH
HO
OH
+
+
O
H
O
R
HO
OH
OH
- 2 H
2
O
O
O
R
HO
O
związek barwny
HO
rezorcyna
Schemat 16
C. Odróżnienie pentoz, metyloheksoz (6-deoksyheksoz), heksoz
W próbie na odróżnienie pentoz, metylopentoz, heksoz najprawdopodobniej
następuje nukleofilowe otwarcie otwarcie pierścienia furfuralu pod wpływem aniliny
(schemat 17). W wyniku dalszych przekształceń powstaje barwny kation (posiadający
długi system sprzężonych wiązań podwójnych). Barwa produktu zależy od rodzaju
badanego cukru.
32
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
O
H
O
barwny kation
R
H
2
N-Ph
H
+
N
H
R
CHO
OH
H
2
N-Ph
H
+
N
H
R
OH
N
H
Ph
Ph
Ph
+
N
H
R
OH
N
H
Ph
Ph +
Schemat 17
D. Próba Biala na pentozy
Furfural powstający z pentoz w środowisku kwaśnym (HCl) daje z orcyną
związek, który w obecności soli żelaza(III) tworzy komplekso barwie zielonej (Schemat
17).
O
H
O
[O]
[H]
OH
HO
OH
+
+
O
H
O
HO
Me
OH
- 2 H
2
O
O
O
HO
O
w reakcji z Fe
3+
tworzy zielony
kompleks
HO
orcyna
Me
Me
Me
Me
Me
Schemat 17
E. Próba Dischego na 2-deoksypentozę
Deoksyryboza ogrzewana w środowisku kwaśnym odwadnia się i tworzy się
aldehyd gamma-hydroksylewulinowy, który tworzy z difenyloaminą niebieski związek o
nieokreślonej strukturze (Schemat 18). Ryboza i inne pentozy nie dają pozytywnego
wyniku w tej próbie.
O
OH
HO
OH
CHO
H
H
H
OH
H
OH
CH
2
OH
O
O
OH
CHO
H
H
H
H
O
CH
2
OH
- H
2
O
daje z difenyloaminą związek
o niebieskiej barwie
Schemat 18
33
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
F. Reakcja z kwasem azotowym(III) (identyfikacja aminocukrów)
Podobnie jak w przypadku aminokwasów obecność grupy aminowej
w cząsteczkach aminocukrów (np.: gluokozaminy) może być potwierdzona na drodze
reakcji z kwasem azotowym(III) (Schemat 19). Powstająca sól diazoniowa szybko ulega
rozkładowi z wydzieleniem gazowego azotu.
O
OH
NH
2
OH
HO
OH
(glukozamina)
D-2-aminoglukopiranoza
HNO
2
O
OH
N
2
OH
HO
OH
+
- N
2
O
OH
OH
HO
OH
OH
s
ól diazoniowa
Schemat. 19
Podsumowanie
Do identyfikacji poszczególnych mono- i disacharydów wykorzystuje się
omówione powyżej charakterystyczne dla nich barwne reakcje wskaźnikowe. Schemat
postępowania zaprezentowany jest na rysunku Rysunku 3.
+
-
+
+
-
cukier obecny
brak cukru
R. Molischa
R. Benedicta
cukry
nieredukujace
cukry redukujace
(glukoza, fruktoza, ramnoza, ksyloza, laktoza)
+ 20 min
+ 5 min
R. Barfoeda
disacharydy
redukujace
(laktoza)
monosacharydy redukujace
(glukoza, fruktoza, ramnoza, ksyloza)
R. Seliwanowa
szybko
wolno
ketozy
(fruktoza)
aldozy
(glukoza, ramnoza, ksyloza)
Identyfikacja pentoz, metylopentoz i heksoz
+
+
pentoza
(ksyloza)
metylopentoza
(ramnoza)
heksoza
(glukoza)
próbka
Rysunek 3. Schemat identyfikacji mono- i disacharydów

34
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Rozróżnienie izomerycznych sacharydów jest zagadnieniem o wiele
trudniejszym. Powyżej opisane próby pozwalają np.: wykryć aldoheksozę, ale nie
pozwalają one zidentyfikować czy badanym cukrem była glukoza czy mannoza lub inna
aldoheksoza. Współcześnie rozwój metod analizy instrumentalnej pozwala na
zautomatyzowane identyfikowanie izomerycznych cukrów. Historyczną metodą
pozwalającą na rozróżnienie izomerycznych mono- i disacharydów jest reakcja
utworzenia osazonów i porównanie morfologii ich kryształów i temperatur topnienia
z danymi wzorcowymi. Na schemacie 20 przedstawiona jest reakcja cukrów
z fenylohydrazyną, a na rysunku 4 ryciny pokazujące formy kryształów osazonów
otrzymanych z wybranych sacharydów. Cukry różniące się konfiguracją absolutną
jedynie przy C-1 i C-2, np. glukoza, fruktoza i mannoza dają identyczne osazony i dlatego
ta reakcja nie może służyć do ich rozróżniania.
CHO
H
OH
R
- H
2
O
N
NHPh
OH
H
R
H
2
NNHPh
2 H
2
NNHPh
- H
2
O
N
NHPh
N
R
NHPh
+ NH
3
+ H
2
NPh
Schemat 20.
Rysunek 4. Kryształy osazonów (Vogel, 2006)

35
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.3.2. Wykonanie ćwiczenia
Rozróżnianie monosacharydów
B. Odróżnienie aldoz od ketoz (reakcja Seliwanowa)
Do dwóch ponumerowanych probówek odpipetować po 1 ml odczynnika
rezorcynowego, a następnie dodać po 5-10 kropli roztworów: 1 – ksylozy;
2 – deoksyrybozy, 3 – glukozy, 4 – fruktozy, 5 – ramnozy, 6 – glukozaminy, 7 –
sacharozy, 8 – sacharydu X. Dokładnie wymieszać. Probówki zanurzyć we wrzącej łaźni
wodnej
na
30 sekund, a następnie szybko oziębić w strumieniu zimnej wody. Ketozy
(np.: fruktoza) dają zabarwienie czerwono-różowe, aldozy (glukoza, ksyloza) reagują
podobnie, ale po dłuższym ogrzewaniu.
C. Odróżnienie pentoz, metylopentoz, heksoz
Do trzech probówek odpipetować po 0.5 ml aniliny i 0.5 ml lodowatego kwasu
octowego. Zawartość probówek dokładnie wymieszać i ogrzać do wrzenia nad
palnikiem. (
Uwaga! Reakcje prowadzić w okularach ochronnych!
). Dodać do probówek
po kilka kropli cukru: 1–ksylozy; 2–deoksyrybozy, 3–glukozy, 4–fruktozy, 5–ramnozy,
6–glukozaminy, 7–sacharozy, 8–sacharydu X, a następnie po jednej kropli stężonego
kwasu solnego. Zabarwienie krwisto-czerwone daje ksyloza (z aniliną sprzęga się
furfural pentozy), żółte - ramnoza (tworzy się metylofurfural metylopentozy).
W przypadku glukozy (hydroksymetylofurfural heksozy) obserwuje się jasno-czerwone
zabarwienie.
D. Próba Biala na pentozy
Do 2 ml 0.2% roztworu orcyny w 20% roztworze HCl dodać kroplę 1% roztworu FeCl
3
i
0.5ml roztworu cukru: 1–ksylozy; 2–deoksyrybozy, 3–glukozy, 4–fruktozy, 5–ramnozy,
6–glukozaminy, 7–sacharozy, 8–sacharydu X. Wstawić do wrzącej łaźni wodnej na kilka
minut. Zielone zabarwienie powstaje w obecności pentoz.
E. Próba Dischego na 2-deoksypentozę
Do probówek wprowadzić kilka kropel roztworów: 1–ksylozy, 2–deoksyrybozy,
3–glukozy, 4–sacharydu X oraz po 2 ml odczynnika Dischego (difenyloamina, H
2
SO
4
w roztworze CH
3
COOH). Po zmieszaniu probówki umieścić we wrzącej łaźni wodnej na
czas 10 minut. Niebiesko-fioletowe zabarwienie pojawi się w probówce zawierającej
2–deoksypentozę.
F. Reakcja z kwasem azotowym(III) (identyfikacja aminocukrów)
Do próbówek odpipetować po 2 ml 10% NaNO
2
i 2 ml 2 M AcOH. Następnie dodać po 0,5
ml roztworów:1-glukozy, 2-glukozaminy, 3-sacharydu X. Dokładnie zamieszać.
Zanotować obserwacje.

36
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
1.3.3. Wykonanie sprawozdania
Uzupełnienie Tabeli 6 oraz Tabeli 7.
Napisanie równań lub schematów zachodzących reakcji (lub zaznaczyć, że reakcja nie
zachodzi). W równaniach wskazać, który z produktów był obserwowany. Jeśli badana
reakcja to ‘typowa’ reakcja redoks ułożyć jej bilans jonowo-elektronowy.
37
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
SPRAWOZDANIE (część czwarta)
Obserwacje:
Tabela 6. Reakcje charakterystyczne monosacharydów – dla wszystkich cukrów
próba
OBSERWACJE
ksyloza
2-deoksyryboza
glukoza
fruktoza
ramnoza
glukozamina
sacharyd X
B.
Seliwanowa
+
+
+
+
+
+
+
C.
z aniliną
+
+
+
+
+
+
+
D.
Biala
+
+
+
+
+
+
+
E.
Dischego
+
+
+
-
-
-
+
F.
z HNO
2
-
-
+
-
-
+
+
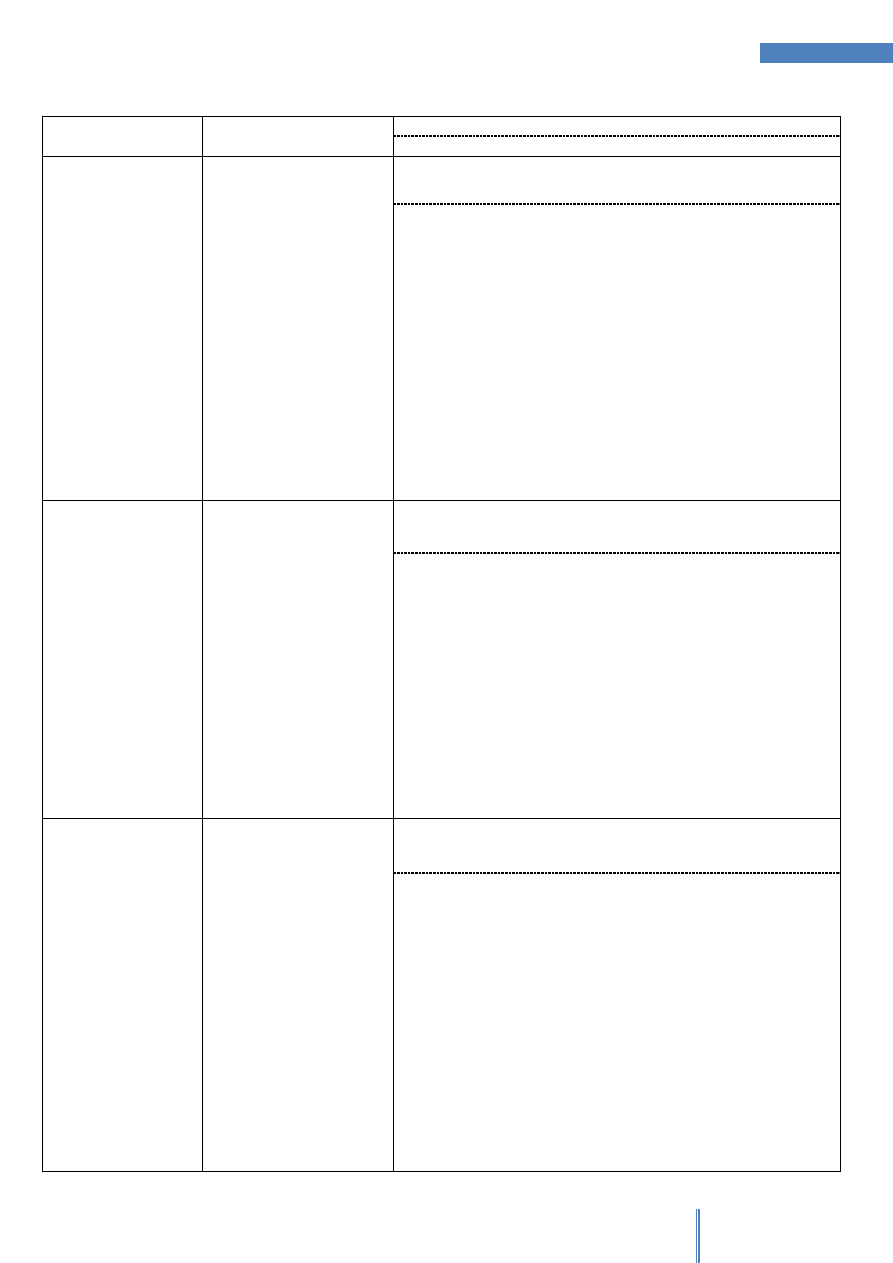
38
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
Wnioski:
Tabela 7. Identyfikacja monosacharydów – tylko dla sacharydu X
PRÓBA
OBSERWACJE
WNIOSKI
RÓWNANIE REAKCJI
B.
Reakcja
Seliwanowa
C.
Reakcja
z aniliną
D.
Próba Biala

39
Ćwiczenie 1
Pracownia z BIOCHEMII dla studentów III roku Wydziału Chemii UŁ
E.
Próba Dischego
F.
Reakcja
Z HNO
2
IDENTYFIKOWANY SACHARYD:
Wyszukiwarka
Podobne podstrony:
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
cwiczenie 7 Aminokwasy id 125541
Aminokwasy i białka
Aminokwasy i białka 2
Aminokwasy i białka Koagulacja i?naturacja białek
Aminokwasy i białka Reakcje charakterystyczne białek reakcja biuretowa
Aminokwasy i białka
pros 1 Aminokwasy Białka
AMINOKWASY I BIAŁKA BUDOWA WLASCIWOSCI I FUNKCJE
Aminokwasy bialka hydroksykwasy - 1, 1p
AMINOKWASY I BIAŁKA
6 Aminokwasy i bialka id 43565 Nieznany
więcej podobnych podstron