AMINOKWASY
AMINOKWASY
i BIAŁKA
i BIAŁKA
CHEMIA
CHEMIA
ORGANICZNA
ORGANICZNA
Podział białek
Białka należą do związków chemicznych typu makromolekuł,
czyli
wielkocząsteczkowych. Wśród składników żywych organizmów
białka
należą do substancji, które posiadają decydujące znaczenie dla
procesów
bioochemicznych detrminyjących zjawiska życiowe.
Ze względu na złożoną i wielopostaciową strukturę molekularną, białka
występują w różnych formach oraz wykazują różnorodność właściwości
biologicznych. Są zasadniczym i ilościowo najobficiej występującym
składnikiem komórek. W suchej masie ciała dorosłego człowieka zawartość
białek sięga 56%. Białka są obecne w każdej komórce, we krwi, płynach
tkankowych i mózgowo-rdzeniowych, limfie itp.
Odgrywają dużą rolę w regulacji ciśnienia osmotycznego, stężenia jonów
wodorowych spełniając rolę buforów, dalej biorą udział w krzepnięciu krwi i
procesach odpornościowych. Białka jako enzymy spełniają rolę
katalizatorów, a jako hormony regulują przemianę materii.
Wszystkie białka zawierają azot (ok. 16%), poza tym węgiel, wodór, tlen, a
często i inne pierwiastki, np. siarkę, fosfor, żelazo i miedź.
Białka dzieli się na dwie obszerne klasy:
białka fibrylarne (inaczej włókniste lub włókiennikowe)
białka globularne (inaczej białka kuliste lub kłębuszkowe)
Białka fibrylarne
Białka fibrylarne są materiałem budulcowym organizmów zwierzęcych.
Głównymi białkami fibrylarnymi są:
-
keratyna (białko znajdujące się we włosach, paznokciach i mięśniach
oraz
rogach, kolcach i piórach zwierząt)
-
kolagen (białko znajdujące się w ścięgnach, skórze, kościach i w
tkance łącznej
występującej między komórkami).
Czasteczki tej grupy białek są długie i nitkowate, mają skłonność do
układania się obok siebie i tworzenia włókien.
Białka globularne
Białka globuralne są pofałdowane, dzięki czemu tworzą zwarte jednostki,
które często przybierają kształty kuliste. Przedstawicielami tej grupy białek
są:
albuminy
- albumina surowicy krwi, owoalbumina występująca w
białku jaja,
laktoalbumina)
globuliny
- globulina surowicy, fibrynogen krwi,globulina jaja
występująca
w białku jaja, laktoglobulina).
Białka globuralne pełnią cały szereg funkcji związanych z podtrzymaniem i
regulacją procesów życiowych; pełnienie tych funkcji wymaga ruchliwości
białek, a zatem ich rozpuszczalności. Z tych białek są zbudowane: wszystkie
enzymy, wiele hormonów (insulina, tereoglobulina, przeciwciała,
hemoglobina, fibrynogen).
Pod względem chemicznym białka są wielkocząsteczkowymi polimerami o
masie cząsteczkowej od 10000 do kilku milionów, np. cieżar cząsteczkowy
insuliny wynosi 12000, albuminy 44000, hemoglobiny 68000, globuliny
167000, a hemocjany 6700000.
Białka posiadają strukturę koloidalną
Oprócz wcześniej opisanego podziału białek, często za podstawę
klasyfikacji bierze się właściwości fizykochemiczne. Uwzględniając
właściwości fizykochemiczne białka dzielimy na:
białka proste albo proteiny
(poddane procesowi hydrolizy
rozpadają się wyłącznie na aminokwasy)
białka złożone albo proteidy
, których część białkowa jest
związana ze składnikiem niebiałkowym zwanym grupą
prostetyczną.
Białka proste – proteiny
Do białek prostych zaliczamy te, które hydrolizując dają jedynie aminokwasy.
Białka proste dzielimy:
protaminy
- posiadaja masę cząsteczkową (1000 - 80000) o przewadze
zasadowych aminokwasów. Protaminy z kwasami dezoksyrybonukleinowymi
tworzą połączenia zwane nukleoproteidami.
albuminy
- białka zwierzęce i roślinne. W skład albumin wchodzą wszystkie
aminokwasy, dobrze rozpuszczają się w wodzie. Spotykamy je w białku jaja
kurzego, w osoczu krwi i mleku.
globuliny
- szeroko rozpowszechnione białko w świecie roślinnym i
zwierzęcym. Spotykane są w osoczu krwi, mleku i białku jaja kurzego.
histony
- występują w jądrze komórkowym. Bogate w histony są gruczoły
grasicy.
prolaminy
- białka roślinne, nierozpuszczalne w wodzie. Są składnikiem mąki.
Prolaminy zawierają dużo kwasu glutaminowego
gluteliny
- podobne do prolamin
keratyny
- należą do nich przede wszystkim białka tkanki łącznej tworów
zrogowaciałych (paznokcie, pióra i włosy)
Białka złożone – proteidy
Są to białka, w których część białkowa związana jest ze składnikiem
prostetycznym. Białka złożone hydrolizują na aminokwasy, kwasy,
cukry, barwniki, witaminy, itp. Do białek złożonych zaliczamy:
nukleoproteidy
- są podstawową masą komórki i wchodzi w skład
protoplazmy.
chromoproteidy
- białka posiadające jako grupę prostetyczną
substancję barwną. Do tej grupy należy hemoglobina - substancja
barwna czerwonych ciałek krwi.
metaloproteidy
- białka zawierające w części niebiałkowej grupę
prostetyczną składającą się z metali, które jednak nie wchodzą w skład
substancji barwnej. Do tych białek należy ferrytyna, zawierająca około
20% żelaza, które następnie dostarcza dla syntezy hemoglobiny
fosfoproteidy
- zawieraja kwas fosforowy związany z białkiem w
postaci estru. Fosfoproteidami są: kazeina mleka, witelina żółtka jaj.
glikoproteidy
- białka zawierające w grupie prostetycznej cukrowce
lipoproteidy
- białka, które w grupie prostetycznej zawierają lipidy.
spotykane są w osoczu krwi, żółtku jaja kurzego.
Aminokwasy i ich reakcje chemiczne
W latach 1900-1910 niemiecki chemik Emil Fischer udowodnił, że białka
zbudowane są z aminokwasów, które powiązane są w długie łańcuchy
zwane łańcuchami polipeptydowymi.
Gdy łączą się dwa aminokwasy, otrzymamy dwupeptyd, gdy trzy -
trójpeptyd, gdy więcej - wielopeptyd. Peptydy zawierające do 10 reszt
aminokwasów nazywamy oligopeptydami, gdy zawierają więcej reszt -
polipeptydami.
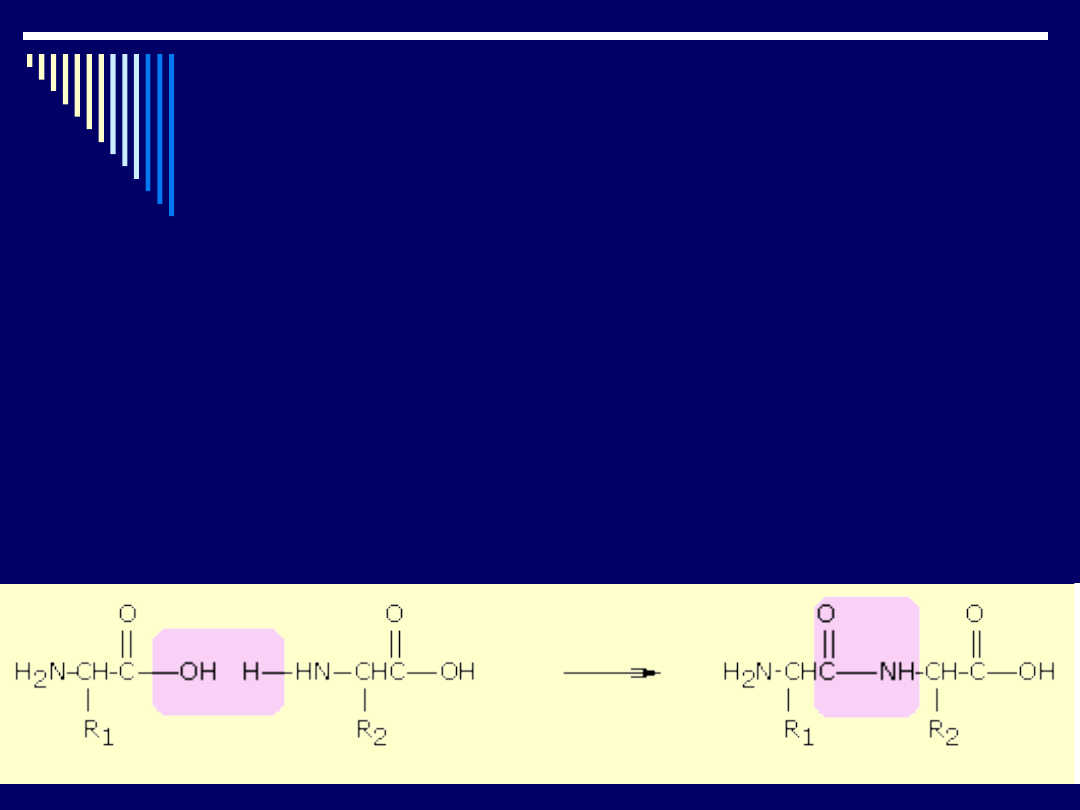
Peptyd powstaje przez połączenie grupy karboksylowej (-COOH)
jednego aminokwasu z grupą aminową (-NH
2
) drugiego aminokwasu z
wydzieleniem czasteczki wody.
Przykład - powstawanie dwupeptydu alanino-alanina z alaniny
Charakterystycznym wiązaniem, które powstaje przy połączeniu się dwóch
i więcej ze sobą aminokwasów jest tzw. wiązanie peptydowe (-NH-CO-),
zaznaczone na cząsteczce alanino-alaninie ramką.
Po utworzeniu wiązania peptydowego między dwiema cząsteczkami
aminokwasów powstaje wolna grupa aminowa (-NH
2
) oraz karboksylowa (-
COOH). Obie zatem mogą tworzyć dalsze wiązanie peptydowe z innymi
aminokwasami.
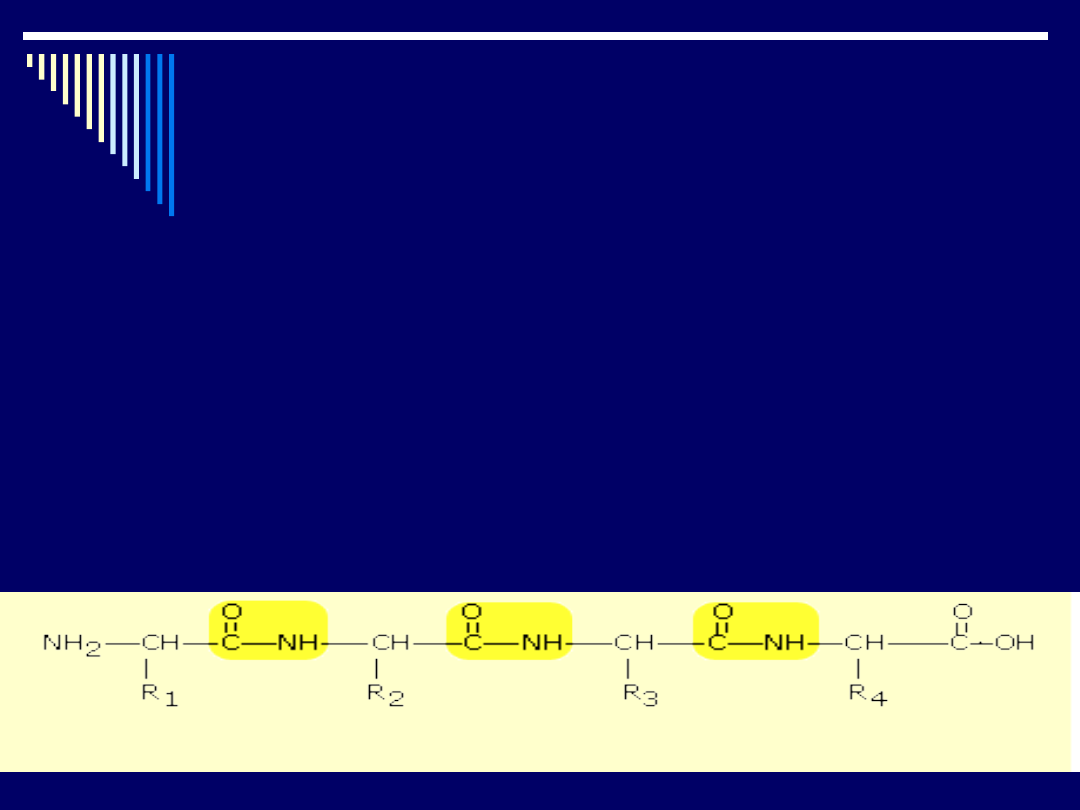
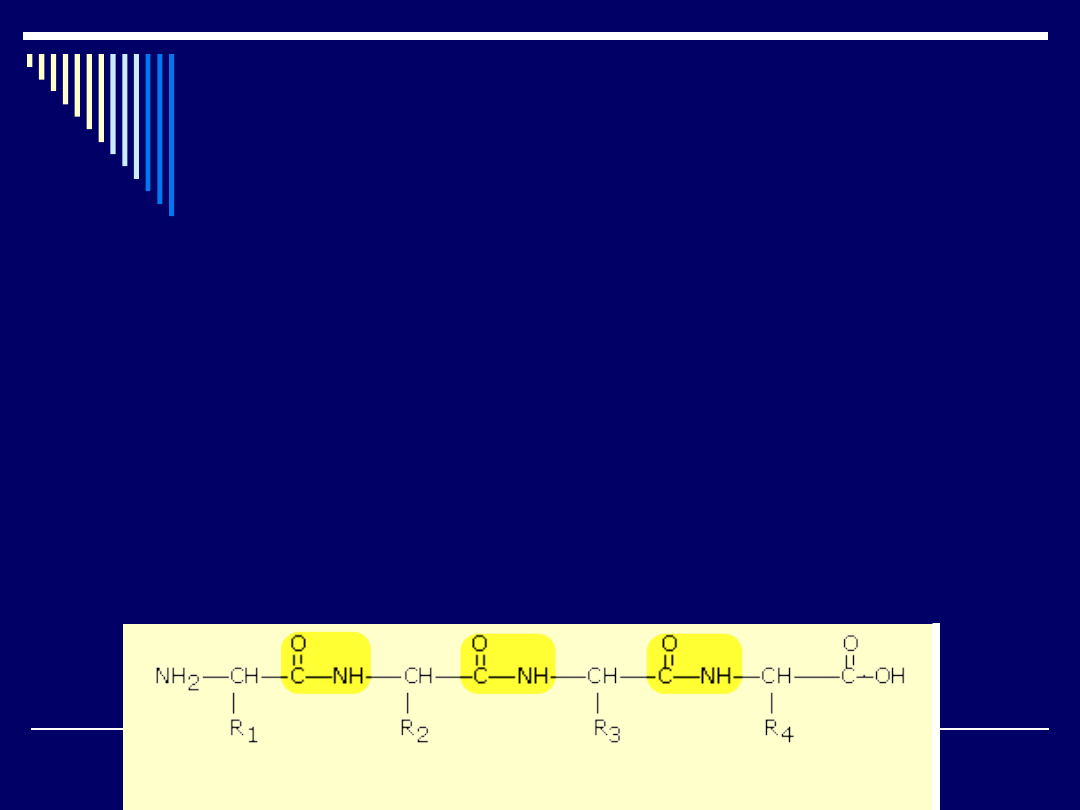
Dłuższy łańcuch powstaje z połączenia kilku aminokwasów, czyli tzw.
wielopeptyd, który można przedstawić następująco
Główne aminokwasy
występujące w białkach
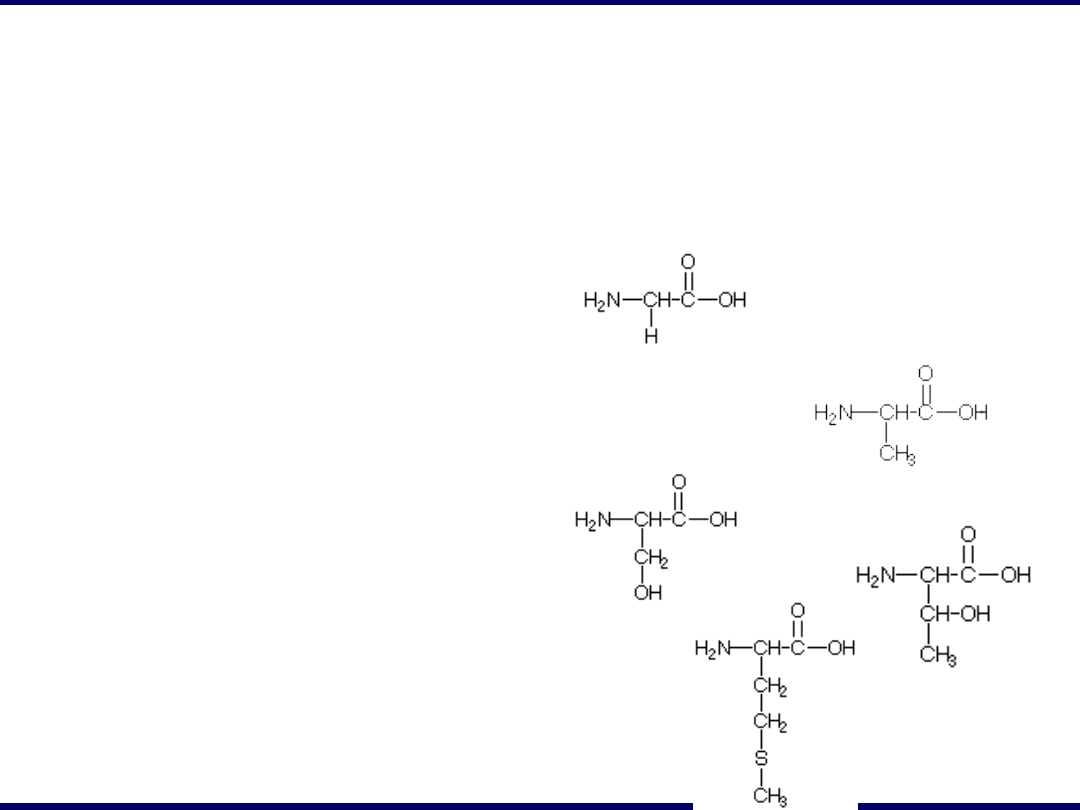
Skrót
Nazwa zwyczajowa
Wzór strukturalny
Kwasy monoaminomonokarboksylowe
Gly
glicyna
Ala
alanina
Ser
seryna
Thr
treonina
Met
metionina
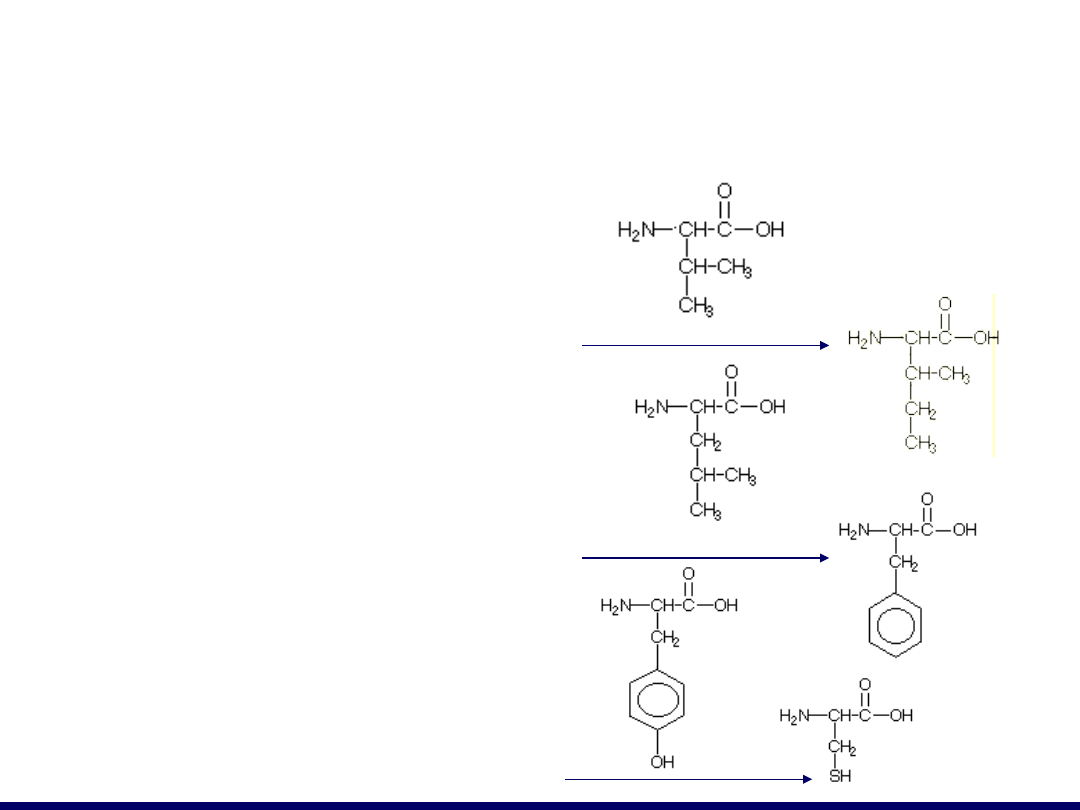
Skrót
Nazwa zwyczajowa
Wzór strukturalny
Kwasy monoaminomonokarboksylowe
Val
walina
Ile
izoleucyna
Leu
leucyna
Phe
fenyloalanina
Tyr
tyrozyna
Cys
cysteina
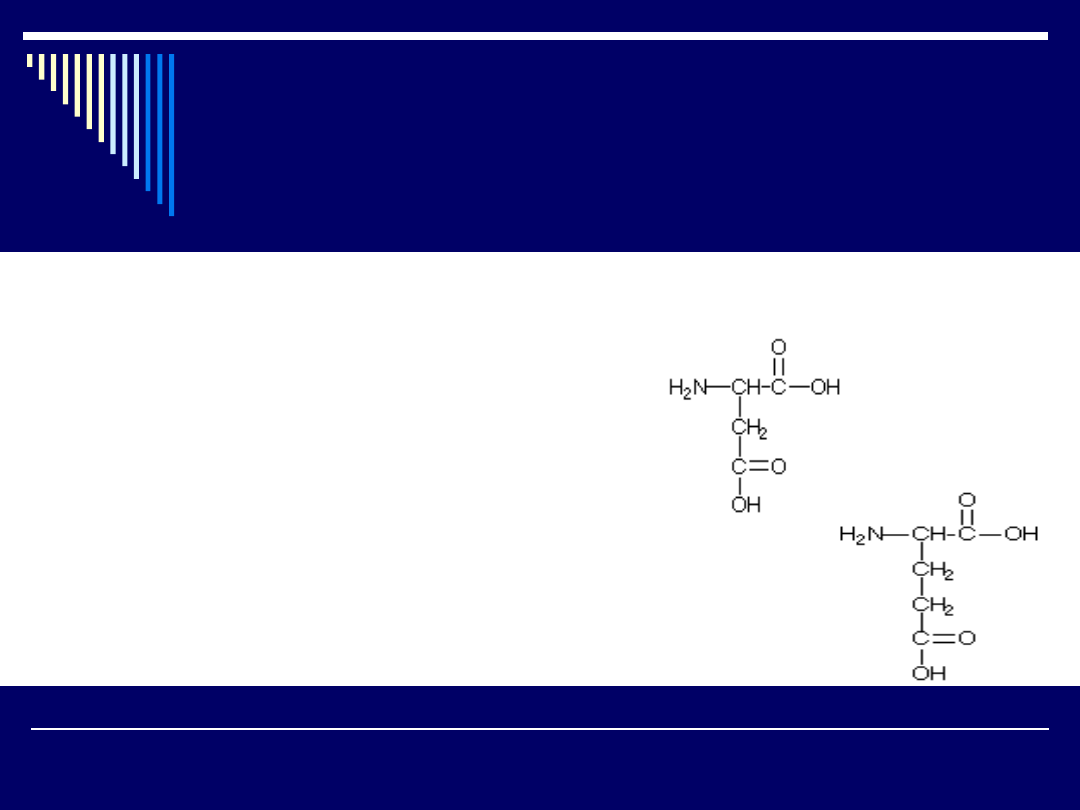
Kwasy monoaminodikarboksylowe
Asp
kwas asparginowy
Glu
kwas glutaminowy
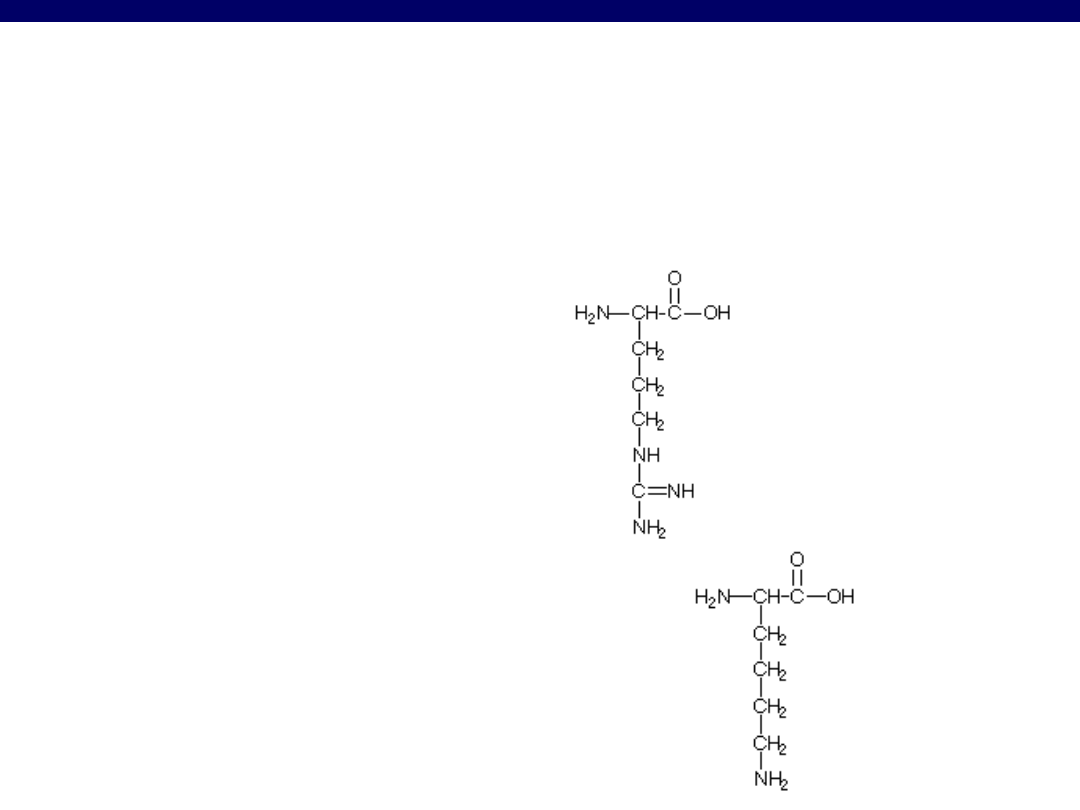
Kwasy diaminomonokarboksylowe
Arg
arginina
Lys
lizyna
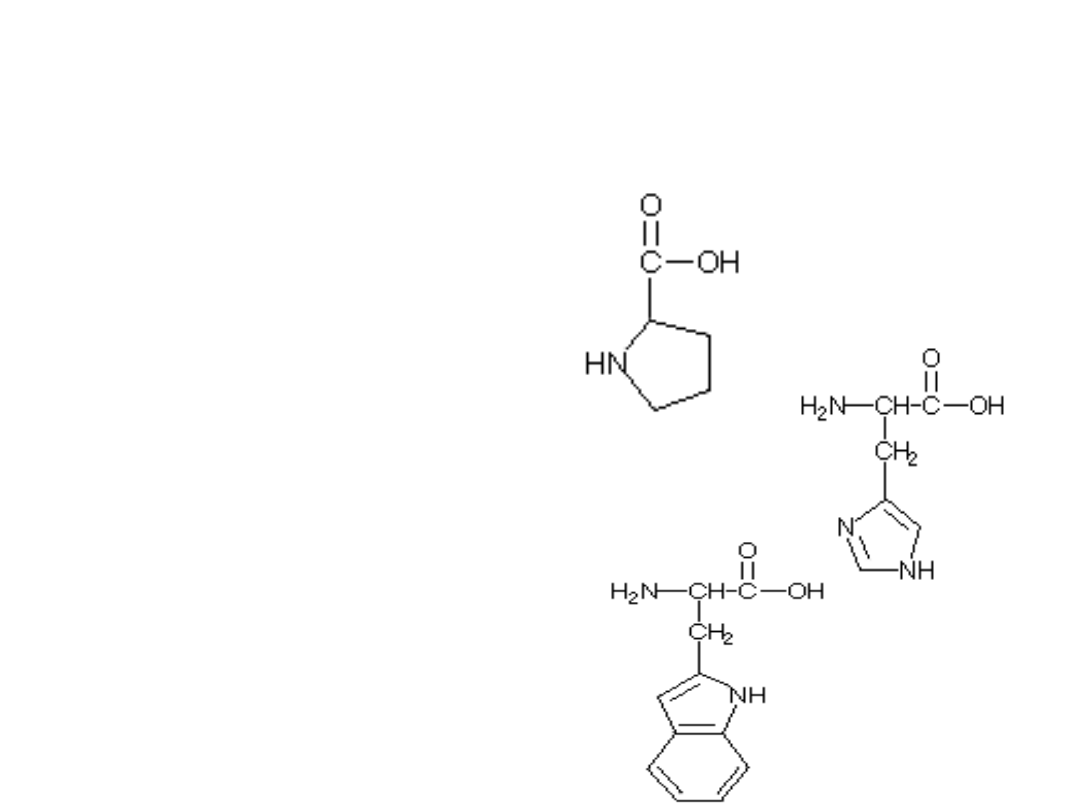
Aminokwasy zawierające pierścienie heterocykliczne
Pro
prolina
His
histydyna
Trp
tryptofan
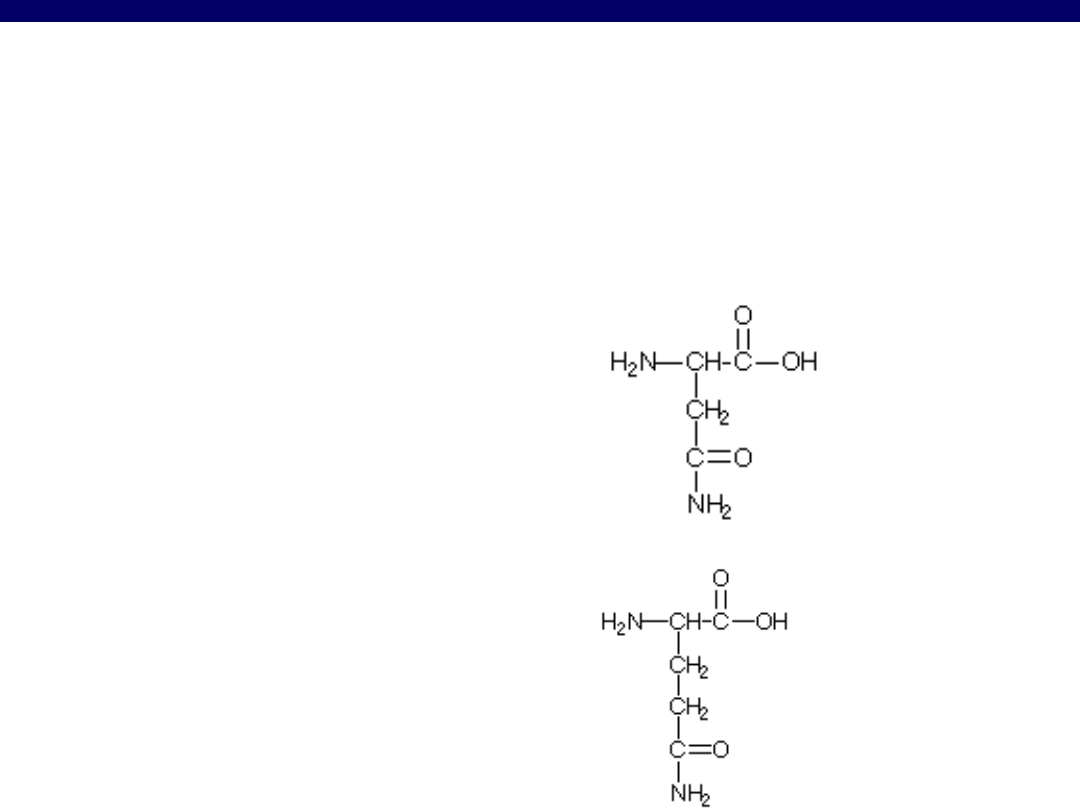
Aminokwasy zawierające grupę amidową
Asn
aspargina
Gln
glutamina
Aminokwasy i ich reakcje chemiczne
Z tablicy wynika, że wszystkie aminokwasy są kwasami
(alfa)-aminokarboksylowymi; w dwóch przypadkach (proliny i
hydroksyproliny) grupa aminowa wchodzi w skład pierścienia
pirolidynowego.
Ta wspólna cecha wyznacza zbiór wspólnych właściwości chemicznych
aminokwasów. Jedną z tych właściwości jest zdolność do łączenia się w
długie łańcuchy poliamidowe, z których składa się białko.
Stwierdzono, że chociaż aminokwasy przedstawia się jako związki o wzorze
H
2
NCHRCOOH zawierające w cząsteczce grupę aminową i grupę
karboksylową, to niektóre ich właściwości zarówno fizyczne jak i
chemiczne, nie są zgodne z taką strukturą.
Aminokwasy, w przeciwieństwie do amin i kwasów karboksylowych, są
nielotnymi krystalicznymi ciałami stałymi, które topią się i ulegają
rozkładowi w dość wysokiej temperaturze.
Aminokwasy są nierozpuszczalne w niepolarnych rozpuszczalnikach, takich
jak eter naftowy, benzen czy eter dietylowy. W wodzie rozpuszczaja się
dobrze.
Wodne roztwory aminokwasów zachowują się podobnie jak roztwory
substancji o dużym momencie dipolowym
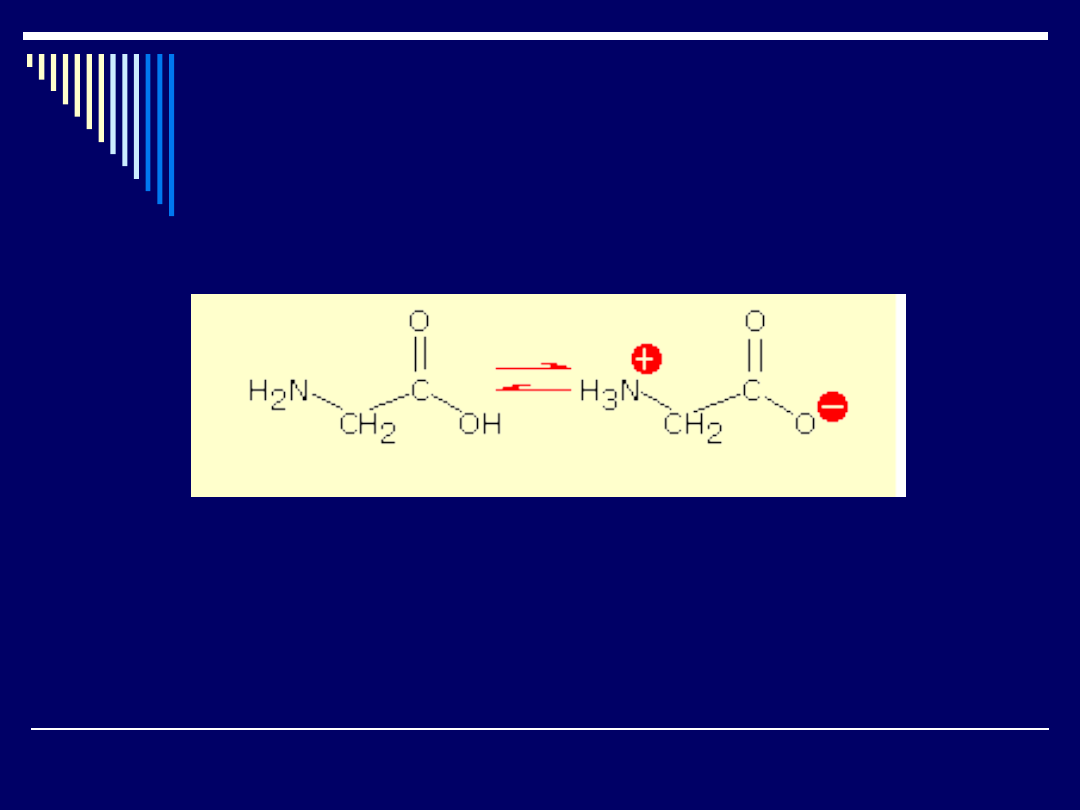
Wszystkie te właściwości aminokwasy zawdzięczają istnieniu jonu
obojnaczego.
Właściwości fizyczne - temperatura topnienia, duży moment dipolowy - są
właśnie takie , jakich można oczekiwać w przypadku soli tego typu.
Pod wpływem pola elektrycznego cząsteczki takie nie wędrują do elektrod,
czyli zachowują się obojętnie.
Wartość pH, przy której aminokwasy w polu elektrycznym do żadnej z
elektrod nie wędrują nazywa się punktem izoelektrycznym albo izojonowym.
Przy dodawaniu jonów wodorowych (kwasu) grupa ujemna przyjmuje protony
(jony wodorowe) i ulega rozładowaniu. Cząsteczka zatem przyjmuje ładunek
dodatni który zlokalizowany jest przy grupie -NH
3
+
. W tej sytuacji odczyn
roztworu zmienia się na kwaśny i aminokwas wędruje w polu elektrycznym do
katody, podobnie jak czynią to kationy.
Przy dodawaniu jonów wodorotlenowych OH
-
(z zasady) do roztworu
aminokwasu znajdującego się w punkcie izoelektrycznym, ulega dysocjacji
proton (jon H
+
) znajdujący się przy azocie grupy NH
3
+
, który z jonem OH
-
tworzy cząsteczki wody. Cząsteczka aminokwasu w takiej sytuacji przyjmuje
ładunek ujemny i w polu elektrycznym zachowuje się jak anion.
Można przyjąć, że aminokwas w punkcie izoelektrycznym zachowuje się
podobnie jak związek amfoteryczny, ponieważ reaguje zarówno z kwasami
jak i zasadami.
W aminokwasach podobnie jak i w cukrach występuje zjawisko izomerii
optycznej i strukturalnej. Przez analogię do cukrów należy spodziewać
się wśród aminokwasów odmian L i D oraz (+) i (-).
Jest to spowodowane obecnością w cząsteczkach aminokwasów centr
chiralnych (z wyjątkiem glicyny). Każdy aminokwas z wyjątkiem glicyny
może istnieć w tego rodzaju odmianach izomerycznych, różniących się
rozmieszczeniem w przestrzeni czterech podstawników związanych z
atomem węgla (alfa).
Najbardziej zadziwiającym faktem jest to, że tylko jeden z
enencjomerów każdego aminokwasu występuje w białkach roślinnych i
zwierzęcych i że konfiguracja tego enancjomeru jest taka sama dla
wszystkich aminokwasów. Tym enencjomerem jest zawsze odmiana L.
Zatem białka po hydrolizie dają zawsze (alfa)-aminokwasy odmiany L.
Zjawisko to jest tym ciekawsze, że nie udało się dotychczas wyjaśnić,
dlaczego organizmy żywe budują wyłącznie cząsteczki (alfa),L-
aminokwasów.
Struktura białek
Strukturę białek najczęściej rozpatruje się w czterech aspektach, tj.
struktury pierwszorzędowej
- określa, w jaki sposób atomy w
cząsteczkach białka są z sobą połączone wiązaniami kowalencyjnymi, czyli
jak tworzą się łańcuchy. Inaczej struktura pierwszorzędowa określa kolejność
aminokwasów w łańcuchu białkowym.
struktury drugorzędowej
- określa, w jaki sposób utworzone łańcuchy są
ułożone w przestrzeni, czyli jakie formy przestrzenne (spirale, arkusze albo
kule) tworzą one za pomocą wiązań wodorowych, łączących różne łańcuchy
lub różne części tego samego łańcucha
struktura trzeciorzędowa
- określa najbardziej korzystne uporządkowanie
przestrzenne poszczególnych części cząsteczki białka z punktu widzenia
energetycznego; zależy od oddziaływań między łańcuchami bocznymi jednej
lub większej liczby makrocząsteczek.
struktura czwartorzędowa
- określa sposób przestrzennego powiązania
kilku cząsteczek w jedną złożoną strukturę białka.
Struktura pierwszorzędowa
Białka są produktami kondensacji wielu aminokwasów.
Z dotychczasowych doświadczeń wynika, że aminokwasy nie są
połączone między sobą w sposób przypadkowy, lecz kolejność
ich jest specyficzna i charakterystyczna dla określonego białka.
Ta uprządkowana kolejność nazywana jest sekwencją
aminokwasów w białku. Sekwencja aminokwasów może na
przykład wyglądać następująco:
H
2
N Tyr-Tre-Wal-Asp-Leu-Gli-Gli-Cys-His COOH
Białka zbudowane są z łańcuchów peptydowych w którym do co
trzeciego atomu jest przyłączony łańcuch boczny (R
1
, R
2
, R
3
,
R
4
,...).
Struktura łańcucha bocznego zależy od reszty określonego
amionokwasu, np. w przypadku glicyny jest to atom - H, alaniny
- grupa (-CH
3
), waliny - grupa (-CH(CH
3
)
2
), itd
Niektóre z tych bocznych łańcuchów zawierają grupy zasadowe, np. grupę
-NH
2
i grupy kwasowe -COOH.
Ze względu na obecność tych kwasowych i zasadowych łańcuchów
bocznych wzdłuż łańcucha peptydowego rozmieszczone są grupy
naładowane dodatnio lub ujemnie.
I właśnie ta charakterystyczna dla określonego białka sekwencja łańcuchów
bocznych, nadaje mu charakterystyczne właściwości.
Łańcuchy boczne wywierają wpływ na właściwości białek nie tylko dzięki
swej kwasowości lub zasadowości, ale również poprzez inne właściwości
chemiczne, a nawet poprzez wielkość i kształt. Na przykład obecność grupy
wodorotlenowej (-OH) i grupy tiolowej (-SH) przyczynia się do reakcji
tworzenia estrów.
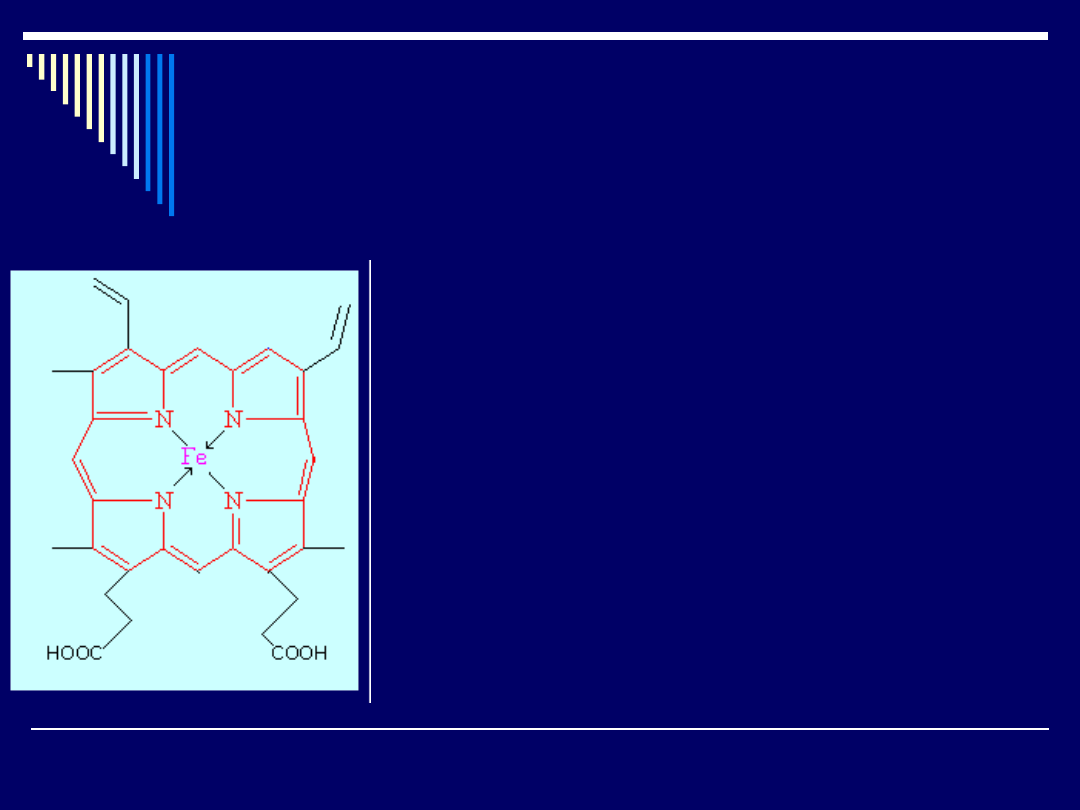
Niektóre cząsteczki białek zawierają fragmenty niepeptydowe
(nazywane grupą prostetyczną). Grupa prostetyczna jest ściśle
powiązana ze specyficzną biologiczną funkcją białka.
Na przykład grupą prostetyczną hemoglobiny jest hem
Jak wynika ze wzoru, hem zawiera atom żelaza
związany z układem pirolowym, znanym jako
porfina.
To właśnie utworzenie odwracalnego kompleksu
tlen-hem umożliwia hemoglobinie przenoszenie
tlenu z płuc do tkanek.
Tlenek węgla tworzy podobny, ale bardziej trwały
kompleks, dzięki czemu wiąże on hemoglobinę
uniemożliwiając transport tlenu, co powoduje
śmierć.
Hem jest połączony z peptydowym fragmentem
białka (globiną) w wyniku chelatowania atomu
żelaza przez histydynowe atomy azotu białka, a
także za pomocą wiązań wodorowych oraz sił van
der Waalsa działających pomiędzy
hydrofobowymi fragmentami dwóch cząsteczek.
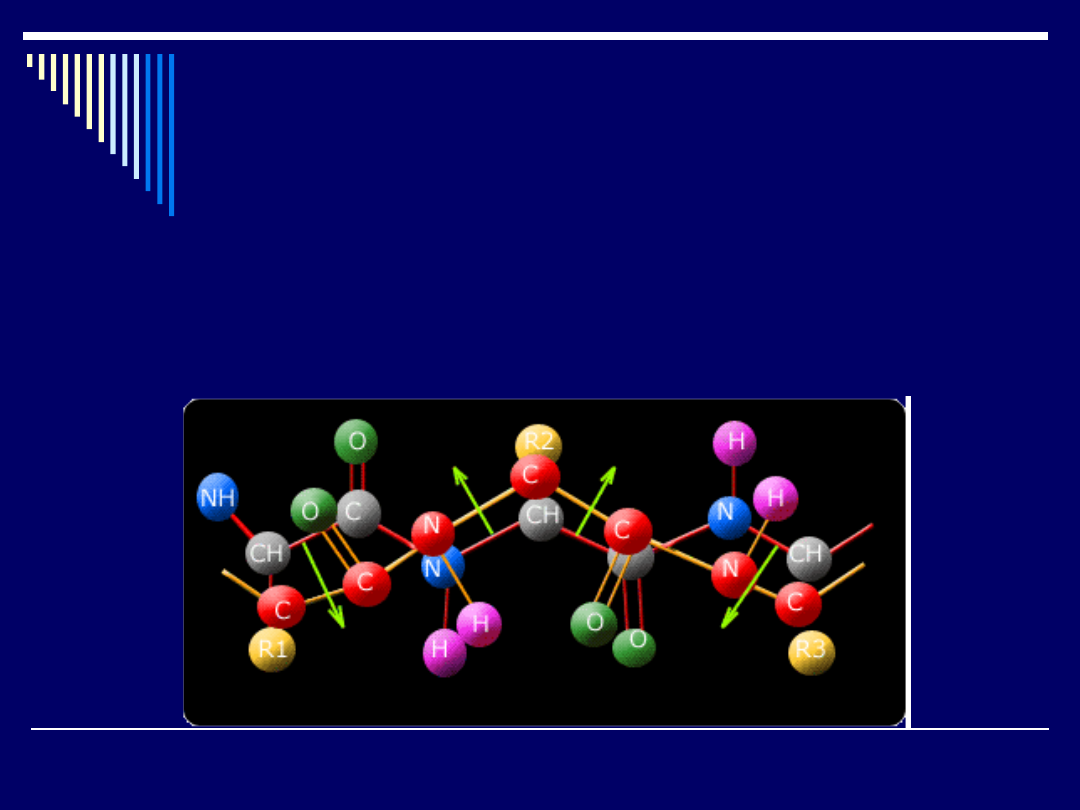
Struktura drugorzędowa
Termin "struktura drugorzędowa" określa wzajemne, przestrzenne ułożenie
aminokwasów w łańcuchu białkowym o określonej sekwencji. Badania
prowadzone metodami rentgenowskimi udowodniły, że nie wszystkie
możliwe struktury łańcucha białkowego są jednakowo cenne pod względem
trwałości.
Najtrwalsze muszą zawierać maksymalną liczbę wiązań wodorowych
między grupami karbonylowymi -C=O i grupami -N-H występującymi w
wiązaniu peptydowym. Wiązania wodorowe będą silnie stabilizować
strukturę, jednakże aby mogły powstać, odpowiednie grupy muszą znaleźć
się w odległości oddziaływań wodorowych.
W przypadku białek z grupy skleroproteidów trwała struktura osiągana jest
dzięki oddziaływaniom wodorowym między dwoma łańcuchami białkowymi
biegnącymi równolegle do siebie. Tworzą one wtedy tzw. strukturę
"pofałdowanej kartki (harmonijki)". Taka struktura nazywana jest również
strukturą beta.
To pofałdowanie powstaje w wyniku ściągnięcia łańcuchów
peptydowych, przez co zmienia się geometria wiązania
peptydowego aminokwasu z płaskiej na pofałdowaną.
Uzyskujemy wtedy bardziej korzystną strukturę do
rozmieszczenia małych lub średnich łańcuchów bocznych.
Na rysunku przedstawiono płaskie wiązanie peptydowe w
kolorze czarnym, natomiast kolorem różowym efekt ściągnięcia
łańcuchów peptydowych w strukturze beta.
Zmiana geometrii wiązania peptydowego podczas tworzenia
struktury beta
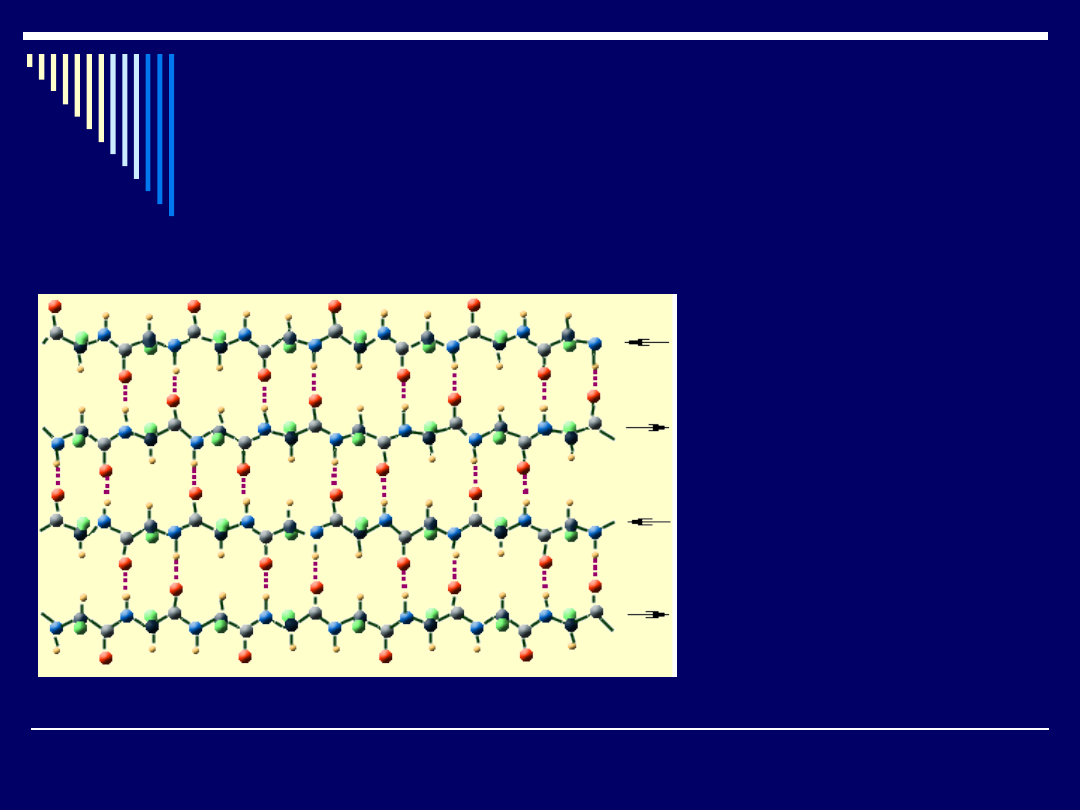
Na rysunku przedstawiono pełny obraz struktury
harmonijkowej (beta). W tej strukturze każdy łańcuch jest
połączony z innymi łańcuchami wiązaniem wodorowym (=O --
H-). Na rysunku wiązanie wodorowe zaznaczone jest kolorem
różowym.
Struktura
harmonijkowa
(struktura beta).
Ściągnięte łańcuchy
stwarzają miejsce dla
małych łańcuchów
bocznych; sąsiednie
łańcuchy są rozwinięte
w przeciwnych
kierunkach
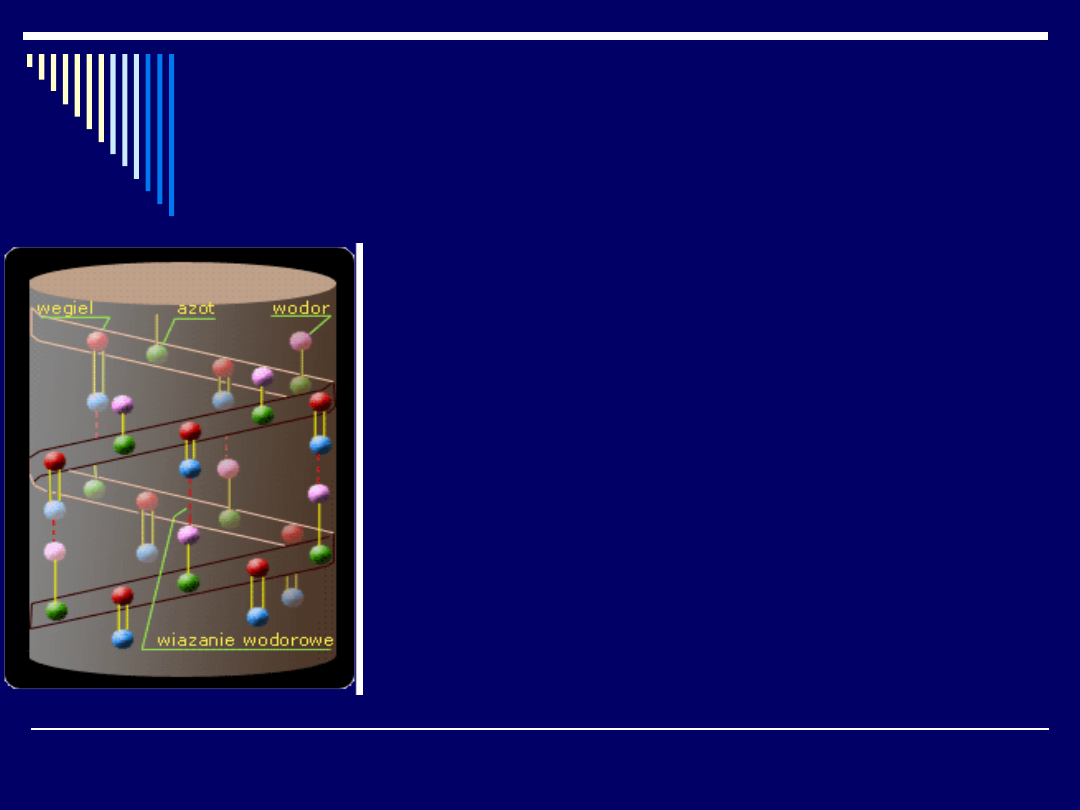
Struktura pofałdowana jest korzystna dla białek w których
łańcuchy boczne są małe.
Gdy łańcuchy boczne są bardzo duże, wówczas najlepsze
rozmieszczenie zapewnia struktura innego rodzaju, w której
każdy łańcuch jest zwinięty i tworzy heliks (struktura alfa).
Łańcuch peptydowy jest tu spiralnie owinięty
wokół hipotetycznego walca z taką gęstością
zwojów, aby grupy -C=O i -N-H zwojów
sąsiadujących ze sobą znalazły się w
odległości odpowiedniej do utworzenia
wiązań wodorowych. Z tego wynika, że różne
fragmenty tego samego łańcucha są
połączone wiązaniami wodorowymi, które
pomagają utrzymać strukturę heliksu.
Struktura alfa

Struktura heliksu (struktura alfa).
W prawoskrętnym heliksie na każdy skręt przypada 3,6
reszt; wiązania wodorowe znajdują się wewnątrz
łańcucha
Posługując się modelami można wykazać, że właśnie
taki heliks stwarza wystarczającą ilość miejsca dla
łańcuchów bocznych i pozwala utworzyć się wszystkim
możliwym wiązaniom wodorowym. Wyjaśnia to
powtarzającą sie odległość 0,15 nm, która jest
odległością pomiędzy resztami aminokwasowymi,
zmierzoną wzdłuż osi heliksu.
Każdy heliks może być sam skręcony w superheliks.
Dowiedziono, że struktura heliksu odgrywa kluczową
rolę w konstrukcji białek spotykanych w przyrodzie. Ale
tym zajmuje się struktura trzeciorzędowa
Struktura trzeciorzędowa
Struktura trzeciorzędowa określa sposób w jaki układają się i fałdują w
przestrzeni łańcuchy białkowe o określonej strukturze drugorzędowej.
Zwoje i fałdy jakie tutaj się obserwuje są utrzymywane różnego typu
wiązaniami. Tymi wiazaniami są: wiązania wodorowe - które mogą
powstawać między resztami aminokwasów zawierających grupy
funkcyjne, nie związane wiązaniami peptydowymi (seryna, arginina,
treonina, kwas glutaminowy), mostki siarczkowe - powstające między
resztkami cysteiny, które łączą różne punkty spirali, zaginając ją w
odpowiedni sposób, prolina (aminokwas z grupą aminową
umieszczoną w pierścieniu) - która może w różny sposób oddziaływać
na strukturę drugorzędową.
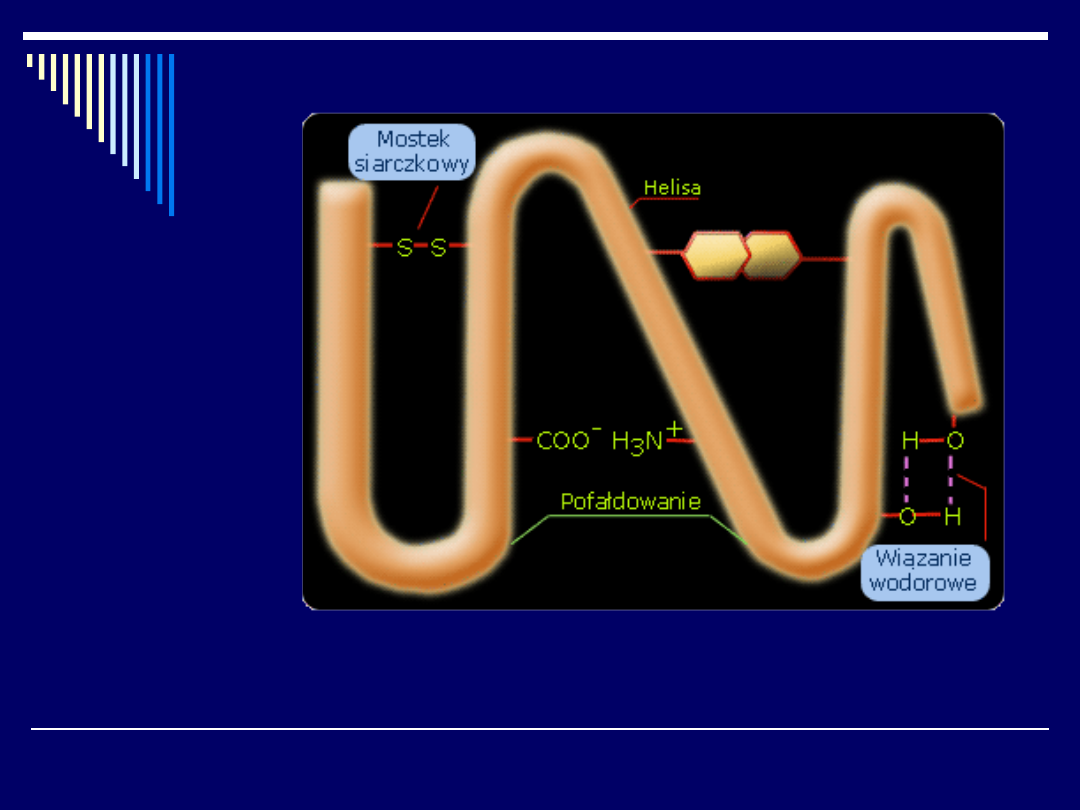
Model struktury trzeciorzędowej
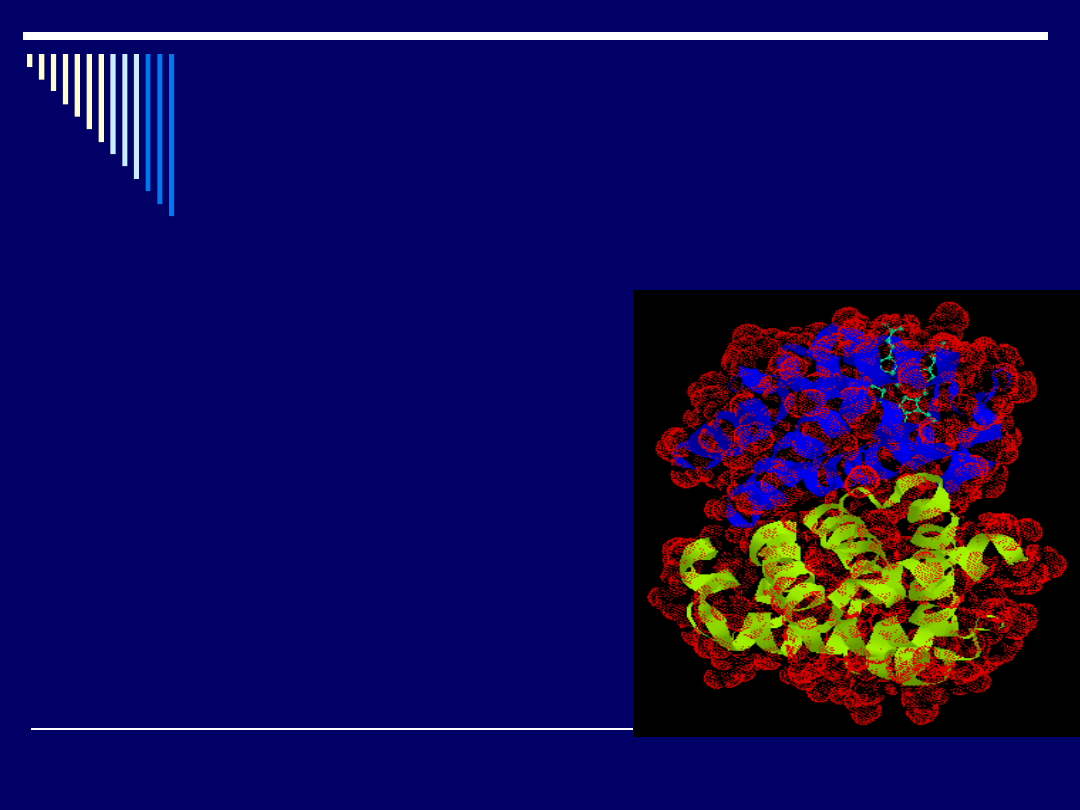
Struktura czwartorzędowa
Struktura czwartorzędowa określa występowanie niektórych
białek w postaci agregatów kilku podobnych lub nawet
identycznych podjednostek o charakterze białkowym.
Przykładem jest hemoglobina, gdzie cztery pofałdowane
łańcuchy hemoglobiny są do siebie dopasowane i tworzą w
przybliżeniu kulistą cząsteczkę (o wymiarach 6,4x5,5x5,0).
Cząsteczka
hemoglobiny
Cztery płaskie grupy hemowe, każda
zawierająca atom żelaza, który może
wiązać cząsteczkę tlenu, mieszczą się w
oddzielnych "kieszeniach" tej kuli.
Budowę podjednostkową ma również wiele
białek enzymatycznych.
Denaturacja białka
Denaturacja białka polega ogólnie na takiej zmianie jego budowy
przestrzennej, która powoduje zanik aktywności biologicznej (tj. np.
aktywności enzymu białkowego). Czynniki wywołujące denaturację, powodują
na ogół rozerwanie w pierwszym rzędzie słabych oddziaływań, utrzymujacych
struktury wyższych rzędów (np. rozerwanie mostków dwusiarczkowych,
zniesienie oddziaływań wodorowych, itp.)
Wiele różnych substancji działa na białka denaturująco. Wśród nich są kwasy,
zasady, alkohol, stężone roztwory mocznika. Czynnikiem denaturującym jest
również temperatura. W wiekszości wypadków denaturacja białek jest
procesem nieodwracalnym.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
1 Ch organiczna podzial reakcjeid 9107 ppt
2 Ch organiczna podzial reakcje IIid 20221 ppt
10 Ch organiczna LIPIDYid 10801 ppt
9 Ch organiczna WĘGLOWODANY
11 Zakres i główne trendy globalizacjiid 12273 ppt
11 Przełom XVIII XIX w 2id 12570 ppt
Ch organiczna wykład 1d
Aminokwasy i białka
Aminokwasy i białka 2
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Ch organiczna wykład 1g
Aminokwasy i białka Koagulacja i?naturacja białek
Aminokwasy i białka Reakcje charakterystyczne białek reakcja biuretowa
Podstawy zarządzania Franciszek Tomaszewski, zarzadz-11, STRUKTURA ORGANIZACYJNA PRZEDSIĘBIORSTWA
cw 10 11 S E Ch
Aminokwasy i białka
więcej podobnych podstron