
ENZYMY
Prawie
wszystkie
enzymy
są
białkami,
chociaż
zidentyfikowano cząsteczki RNA aktywne katalitycznie
(rybozymy)

Budowa enzymów
Ze względu na budowę chemiczną rozróżniamy 3 kategorie
enzymów:
•
Enzymy–białka proste
– zbudowane tylko z aminokwasów, grupę
czynną (centrum aktywne) pełnią specyficzne aminokwasy, których
nie można oddzielić od białka bez zniszczenia jego struktury
(pozbawienie działania katalitycznego)
Do enzymów będących białkami prostymi zalicza się większość enzymów
(hydrolaz) przewodu pokarmowego (pepsyna, trypsyna, amylazy).

Budowa enzymów
•
Enzymy-białka złożone zawierające koenzym
(nieaminokwasowe
grupy chemiczne luźno związane z białkiem)
Obie części składowe można łatwo oddzielić (np. za pomocą dializy). Oddzielnie
apoenzym i koenzym nie są czynne katalitycznie, ale po złączeniu ponownie
tworzą aktywny enzym. Koenzym wiąże się z białkiem niekowalencyjnie
•
Enzymy-białka złożone zawierające grupę prostetyczną
(nieaminokwasowe grupy chemiczne trwale (kowalencyjnie) związane z
cząsteczką białkową)
Oddzielenie grupy prostetycznej od białka i ponowne połączenie nie zawsze
prowadzi do zachowania czynności katalitycznej enzymu
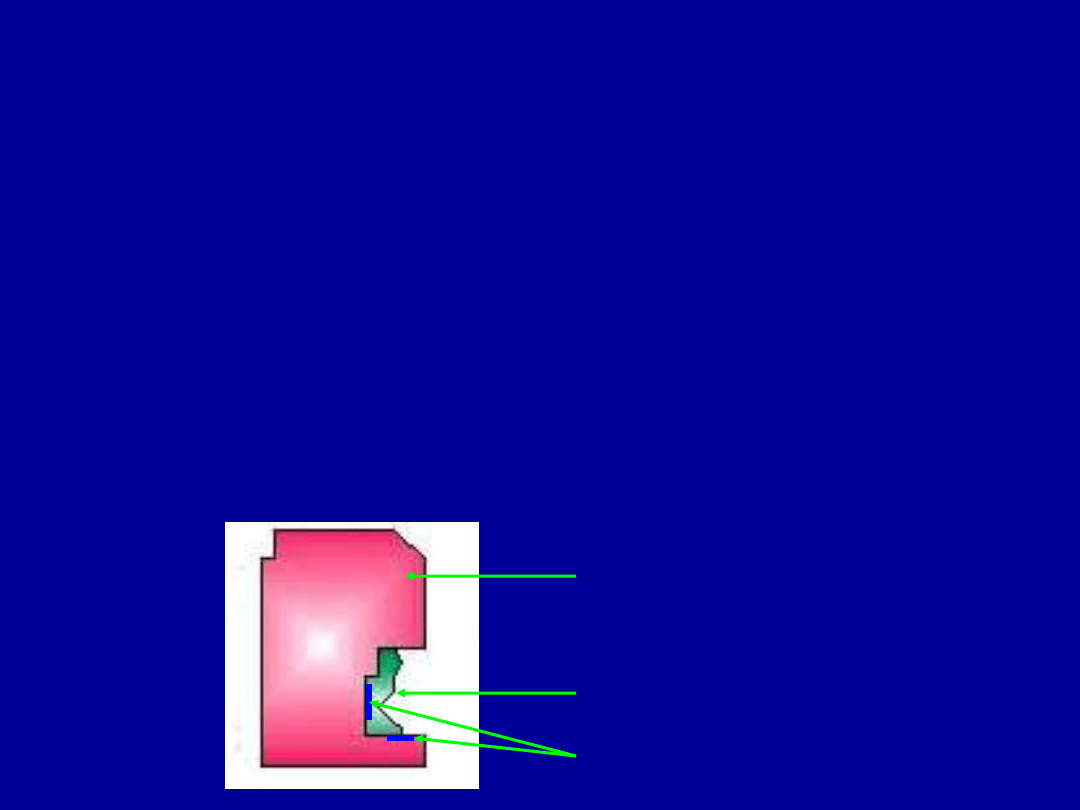
Budowa enzymów
Większość enzymów to białka złożone. Składają się z części białkowej i
składnika niebiałkowego – związku zwanego
kofaktorem (koenzymem)
.
Kofaktorami (koenzymami) mogą być jony nieorganiczne (Zn
2+
lub Fe
2+
)
i/lub złożone cząsteczki organiczne.
Koenzym, który jest kowalencyjnie (trwale) związany z enzymem nazywa
się
grupą prostetyczną
.
koenzym + apoenzym = holoenzym
(aktywny katalitycznie enzym)
apoenzym
koenzym
miejsce aktywne

Budowa enzymów
Apoenzym
decyduje o specyficzności substratowej działania enzymu,
ponieważ wykazuje powinowactwo do substratu i w ten sposób określa jaki
związek wejdzie w reakcję.
Te same grupy prostetyczne i koenzymy mogą brać udział w różnych
reakcjach chemicznych, zależnie od białka, z którym są związane.
Koenzym (grupa prostetyczna)
są tylko narzędziem pozwalającym na
przetwarzanie takiego czy innego materiału. Wyznaczają one typ
katalizowanej reakcji np. jakie atomy czy grupy mogą być przenoszone.
W reakcjach biochemicznych koenzym (grupa prostetyczna) przejściowo
zmienia swoją strukturę, ale po ich zakończeniu na skutek wtórnej reakcji
powraca do stanu pierwotnego.

Budowa enzymów
Koenzymy i grupy prostetyczne mają różną budowę. Mogą to być:
•
nukleotydy
•
witaminy
•
związki hemu
•
metale
•
pochodne cukrów i kwasów tłuszczowych
Niemal wszystkie koenzymy mają w swojej budowie nukleotyd. Wiele
koenzymów jest pochodnymi prekursorów witamin. Te nieodzowne do
procesów życiowych substancje w stałych nieznacznych ilościach muszą być
dostarczane w pożywieniu ponieważ większość organizmów nie ma zdolności
do ich samodzielnej syntezy. Niekiedy mogą być wytwarzane z bezpośrednich
prekursorów - prowitamin.
Klasycznymi przykładami koenzymu są NAD
+
i NADP, a grupy
prostetycznej FAD i żelazoporfiryny (hem)

Budowa enzymów
Najistotniejszym elementem budowy enzymów, któremu zawdzięczają aktywność
katalityczną jest miejsce aktywne
Miejsce aktywne (centrum aktywne)
- to region, który wiąże substrat
,
tworzy kompleks ES i przemienia go w produkt. Zajmuje niewielką część
cząsteczki enzymu i stanowi określoną trójwymiarową przestrzeń, utworzoną
przez reszty aminokwasów, które w liniowym łańcuchu polipeptydowym mogą
leżeć daleko od siebie.
Aminokwasy tworzące miejsce aktywne
zawierają dużą liczbę wolnych grup
funkcyjnych.
Miejsce aktywne jest często szczeliną na
powierzchni enzymu lub zagłębieniem w
cząsteczce enzymu, co ułatwia wiązanie
substratu
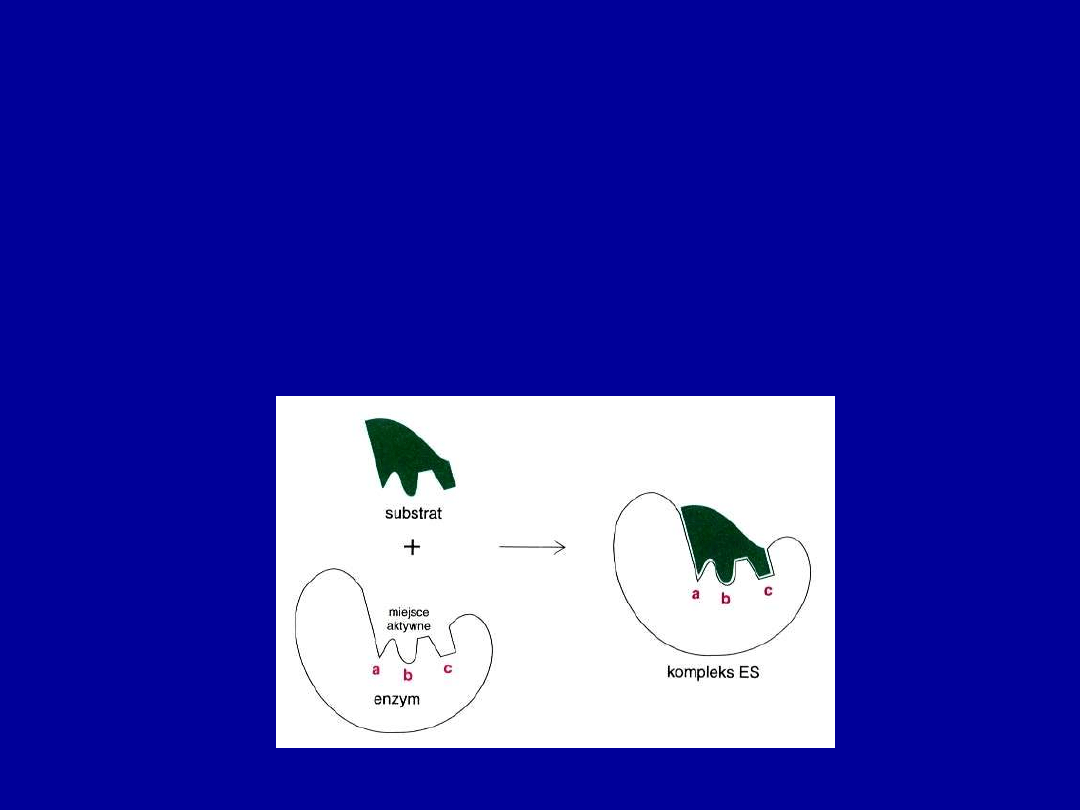
Dwa modele wiązania substratu przez enzym
Zaproponowano dwa modele wyjaśniające, jak enzym może wiązać swój
substrat.
W
modelu zamka i klucza
(Emil Fisher, 1894) kształt substratu i
aktywnego miejsca enzymu pasują do siebie jak klucz do zamka.
Oba kształty są sztywne, trwałe i pasują do siebie idealnie po odpowiednim
zestawieniu.
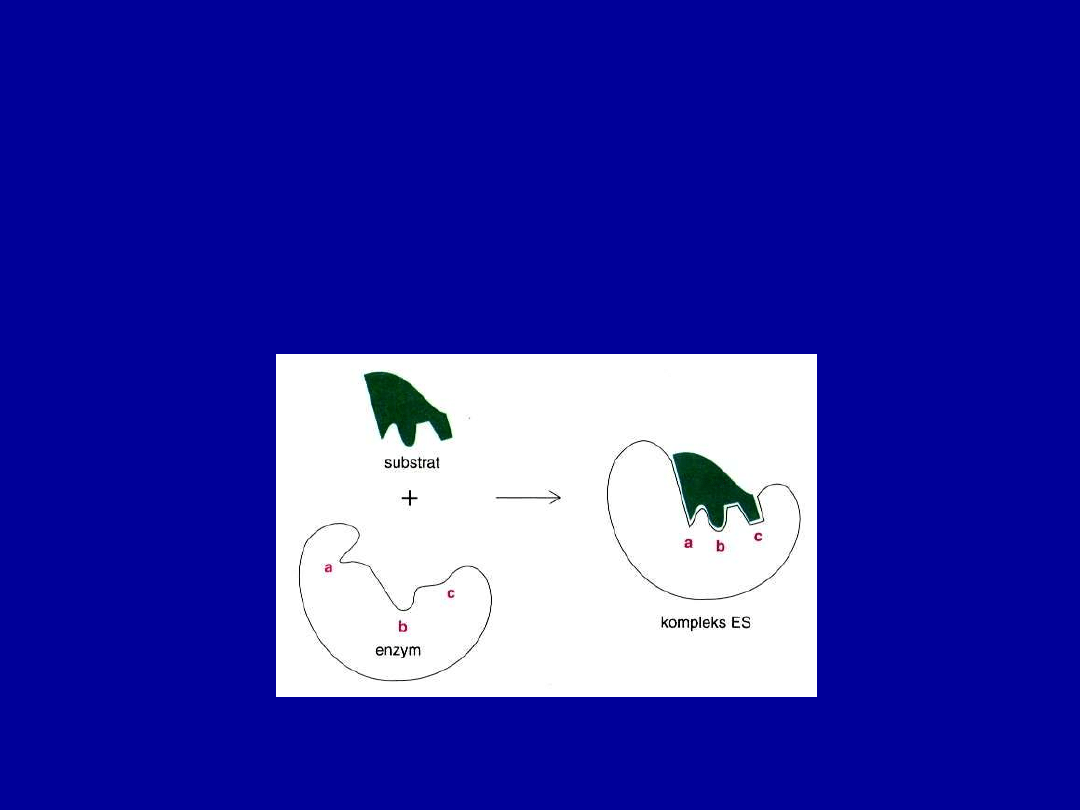
Dwa modele wiązania substratu przez enzym
W
modelu indukowanego dopasowania
(Daniel Koshland, 1958)
związanie substratu indukuje zmianę konformacyjną w aktywnym miejscu
enzymu, tak że jego miejsce aktywne przyjmuje kształt komplementarny do
substratu. Poza tym enzym może zniekształcić substrat wymuszając w nim
konformację podobną do stanu przejściowego.
W rzeczywistości różne enzymy wykazują cechy obu modeli, pewną
komplementarność i pewne zmiany konformacji.

Właściwości enzymów
•
Enzymy mają dużą siłę katalityczną
- są biokatalizatorami, które
przyspieszają reakcje chemiczne (10
6
-10
11
razy)
•
Katalityczne działanie enzymu zachodzi według schematu:
Enzym + Substrat kompleks Enzym-Substrat Enzym + Produkt
(stan przejściowy)
E + S E-S E + P
•
Enzymy zmniejszają energię aktywacji, zwiększając przez to
szybkość przebiegu reakcji
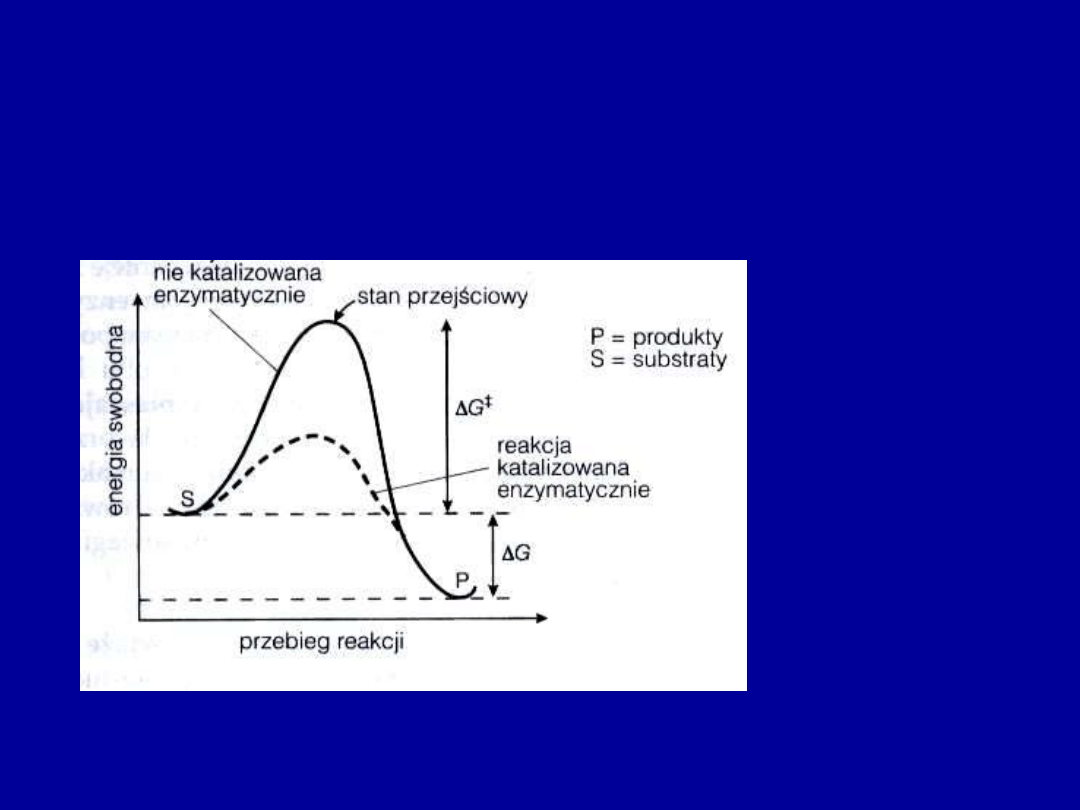
Aby zaszła reakcja biochemiczna, musi zostać pokonana bariera
energetyczna związana z przekształceniem cząsteczki substratu w stan
przejściowy
Stan przejściowy ma w przebiegu reakcji największą energię swobodną
- H
2
O
Różnica energii swobodnej między substratem a stanem przejściowym
nazywa się
energią aktywacji
- jest to ilość energii niezbędna dla
zapoczątkowania reakcji
Zmiany energii zachodzące podczas przebiegu reakcji biochemicznej
Właściwości enzymów

Właściwości enzymów
•
Cechą
charakterystyczną
enzymów
jest
ich
wysoka
specyficzność pod względem:
•
katalizowanej reakcji
- każdy enzym katalizuje tylko jedną (lub
grupę bardzo podobnych) reakcji
•
substratu, na który działają
(i produktu, który tworzą)
O specyficzności substratowej decydują właściwości i ułożenie przestrzenne
reszt aminokwasów tworzących aktywne miejsce enzymu. Specyficzność
enzymów w stosunku do substratu jest zróżnicowana, zwykle jest znaczna, a
czasami nawet absolutna
Specyficzność niektórych enzymów dotyczy nawet przestrzennej budowy
związku – są enzymy rozpoznające i przekształcające tylko jeden izomer
przestrzenny np. L-aminokwasy, D-cukry (bezwzględna=absolutna swoistość)
Porównanie specyficzności enzymów wobec substratu
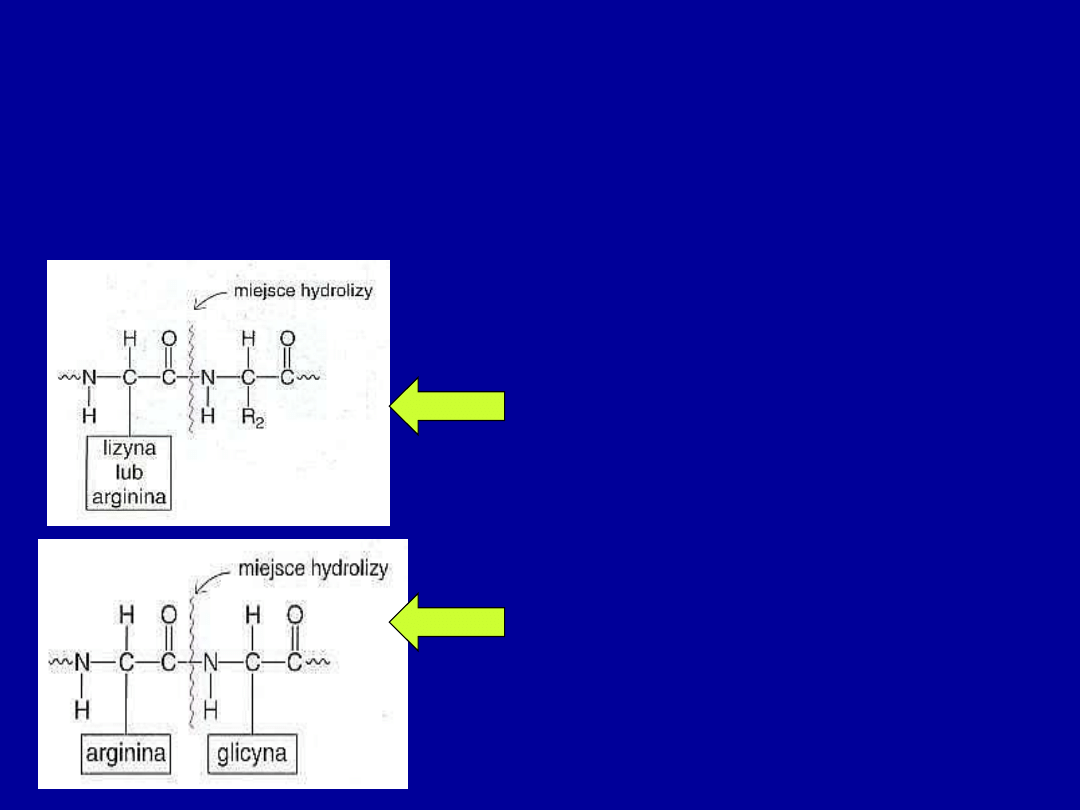
Enzymy proteolityczne
(peptydazy) katalizują hydrolizę wiązania
peptydowego, różnią się stopniem specyficzności wobec substratu
•
Subtilopeptydaza
(bakterie) – nie
wyróżnia bocznych łańcuchów
aminokwasów sąsiadujących z
hydrolizowanym wiązaniem peptydowym
•Trypsyna
– większa specyficzność -
rozszczepia wiązania peptydowe, które
znajduja się po karboksylowej stronie
Lys i Arg
• Trombina
(bierze udział w procesie
krzepnięcia krwi) – jeszcze większa
specyficzność – hydrolizuje tylko wiązania
peptydowe występujące pomiędzy
Arg i Gly

Oznaczanie enzymów
Znaczenie biomedyczne (diagnostyka kliniczna):
Pewne
choroby
są
spowodowane
genetycznie
uwarunkowanymi
nieprawidłowościami w syntezie enzymów (wrodzone wady metabolizmu, np.
fenyloketonuria, albinizm)
Pomiar aktywności niektórych enzymów w osoczu jest podstawą diagnozowania
ważnych zaburzeń (zawał serca, wirusowe zapalenie wątroby). Gdy komórki są
uszkodzone (np. przez ograniczenie dopływu krwi lub stan zapalny) pewne
enzymy przechodzą do osocza.
Aktywność enzymu najczęściej wyraża się jako początkową szybkość
(V
o
)
katalizowanej reakcji.
Jednostką
V
o
jest
mikromol/min (μmol x min
-1
)
, można ją też wyrażać w
jednostkach enzymatycznych (U).
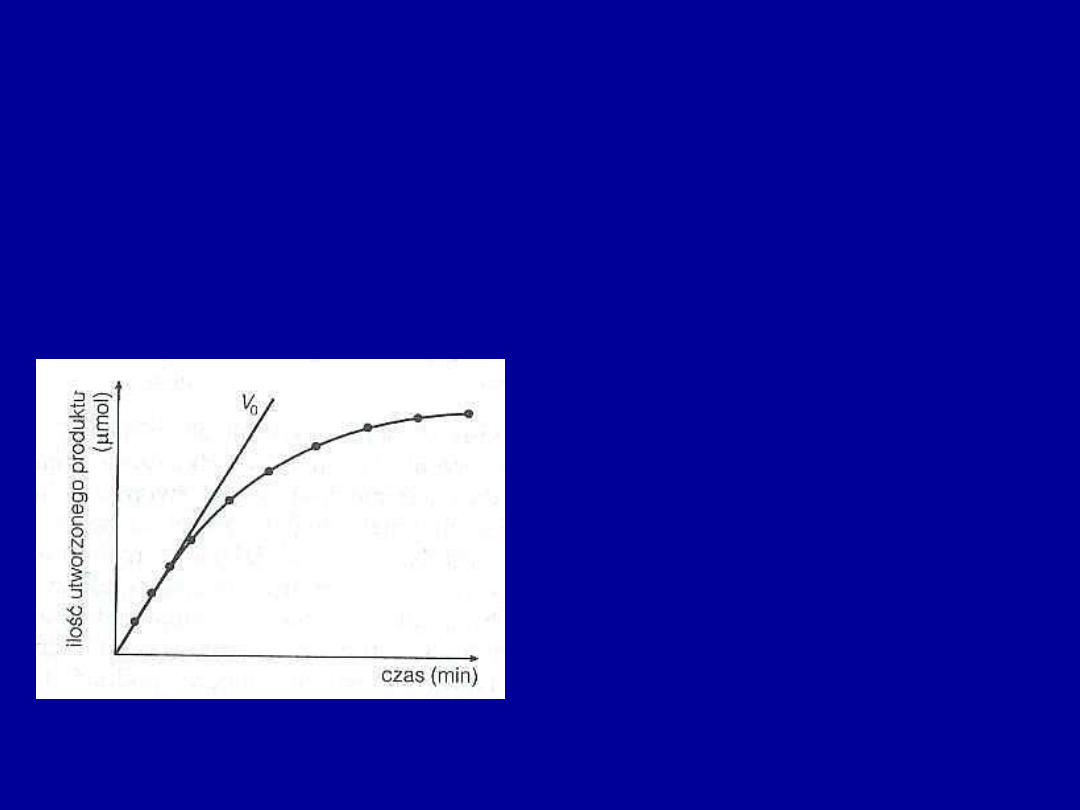
Szybkość działania enzymu
Szybkość reakcji – tempo przebiegu reakcji katalizowanej przez enzym,
oznacza przyrost produktu w czasie
Szybkość reakcji podaje się zazwyczaj w czasie zerowym (
V
o
) - jest wtedy
największa, bo nie ma jeszcze produktu
W początkowym etapie przebieg jest
prostoliniowy, co odpowiada szybkiemu
przyrostowi produktu
Wartość V
o
oblicza się kreśląc linię
prostą styczną do początkowego odcinka
krzywej
Nachylenie tej prostej (tg α) ma wartość
V
o
α
Typowy wykres powstawania produktu jako funkcji
czasu dla reakcji katalizowanej enzymatycznie
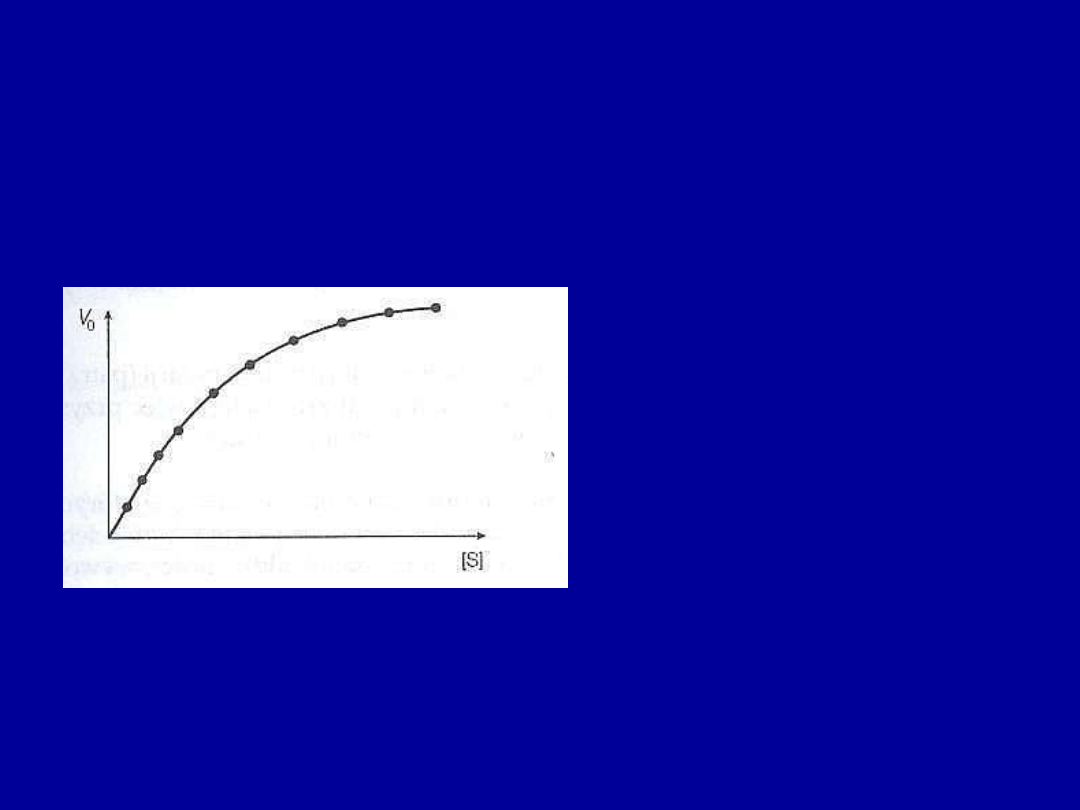
Czynniki wpływające na aktywność enzymów
• Stężenie substratu
–
przy małych stężeniach substratu ([S]) podwojenie
[S] powoduje podwojenie początkowej szybkości (V
o
).
• Stężenie enzymu
– gdy wszystkie cząsteczki enzymu mają związany
substrat, podwojenie stężenia enzymu powoduje podwojenie Vo
Przy większych stężeniach
substratu enzym ulega wysyceniu
(wszystkie cząsteczki enzymu są
związane z substratem) i dalszy
wzrost [S] powoduje tylko
niewielką zmianę wartości V
o
.
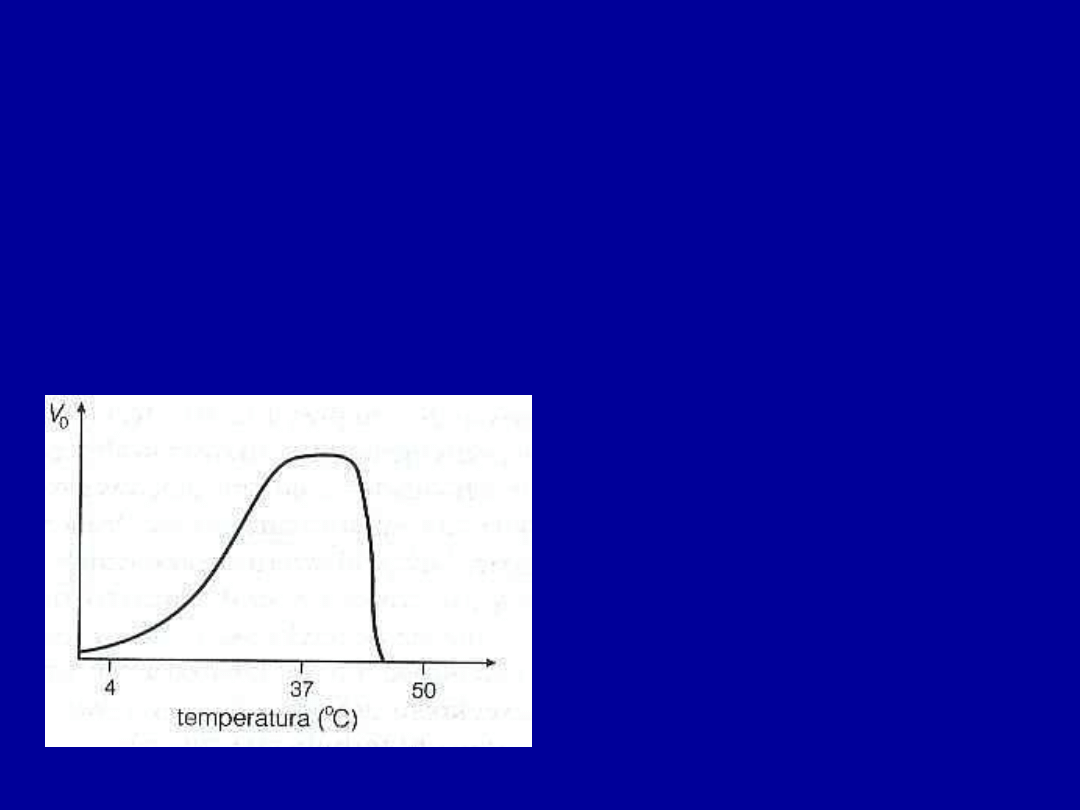
Czynniki wpływające na aktywność enzymów
• Temperatura
- niewielki wzrost temperatury powoduje wzrost szybkości
reakcji enzymatycznej (zwiększa się energia termiczna cząsteczek substratu,
łatwiej pokonać energię aktywacji)
Ale dalszy wzrost temperatury prowadzi do
denaturacji
(rozfałdowania)
enzymu - zrywanie wiązań stabilizujących trójwymiarową strukturę enzymu,
nawet małe zmiany mogą zmieniać strukturę miejsca aktywnego i w efekcie
prowadzić do spadku aktywności katalitycznej
Dla wielu enzymów ssaków
optimum termiczne przypada na
około 37
o
C
Są też organizmy, których enzymy
przystosowały się do działania w
zarówno wyższych jak i niższych
temperaturach
Czynniki wpływające na aktywność enzymów
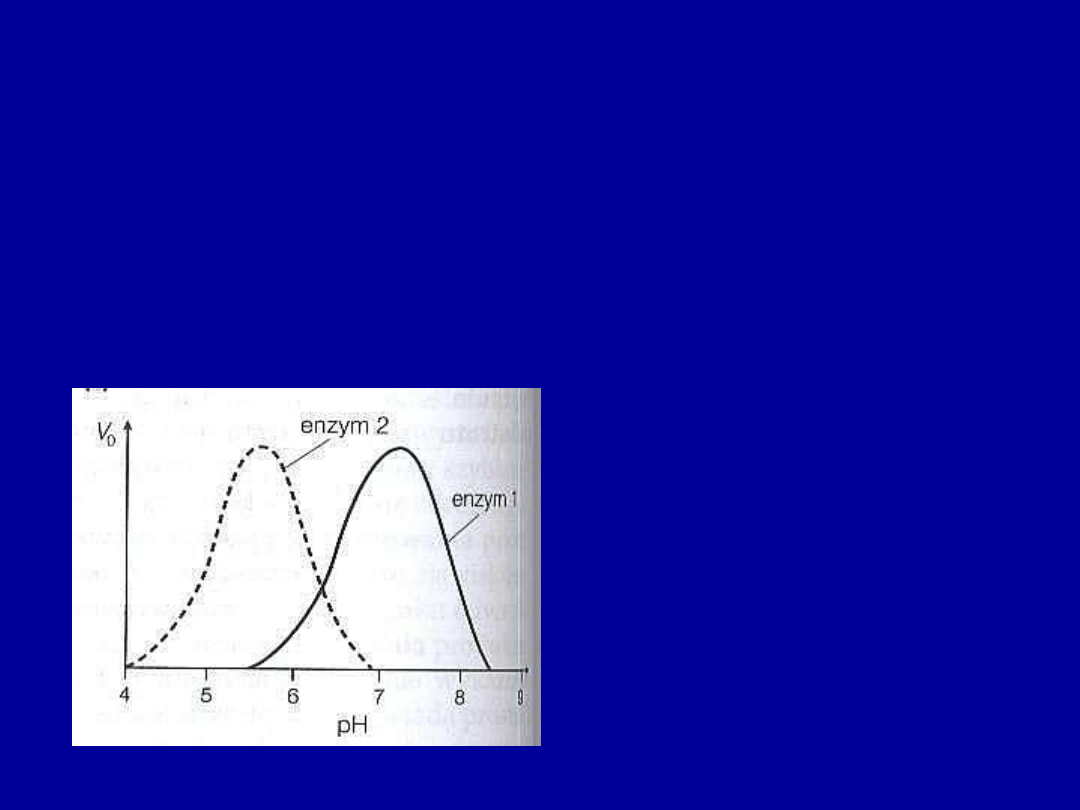
• Wartość pH
– każdy enzym ma optymalne pH działania, przy którym
szybkość katalizowanej przez niego reakcji jest maksymalna.
Małe odchylenia pH od wartości optymalnej powodują spadek aktywności –
zmiany jonizacji grup w miejscu aktywnym
Większe odchylenia pH prowadzą do denaturacji białka enzymatycznego
Enzym 1 - Optymalne pH = 7,2
Enzym 2 – Optymalne pH = 5,5

Czynniki wpływające na aktywność enzymów
• Obecność aktywatorów i inhibitorów
Aktywator
-
cząsteczka działająca na enzym w kierunku zwiększenia jego
szybkości katalitycznej (jony nieorganiczne, np. Mg, Ca, Zn, Cl)
Enzymy mogą ulegać inhibicji (hamowanie aktywności) przez różne cząsteczki
.
Inhibitor
-
cząsteczka działająca na enzym w kierunku zmniejszenia jego
szybkości katalitycznej
Inhibitorami enzymów mogą być
– metabolity komórkowe (naturalna metaboliczna kontrola odpowiedniego
szlaku)
– substancje obce dla organizmu (toksyny, leki)

Czynniki wpływające na aktywność enzymów
Obecność aktywatorów i inhibitorów, cd:
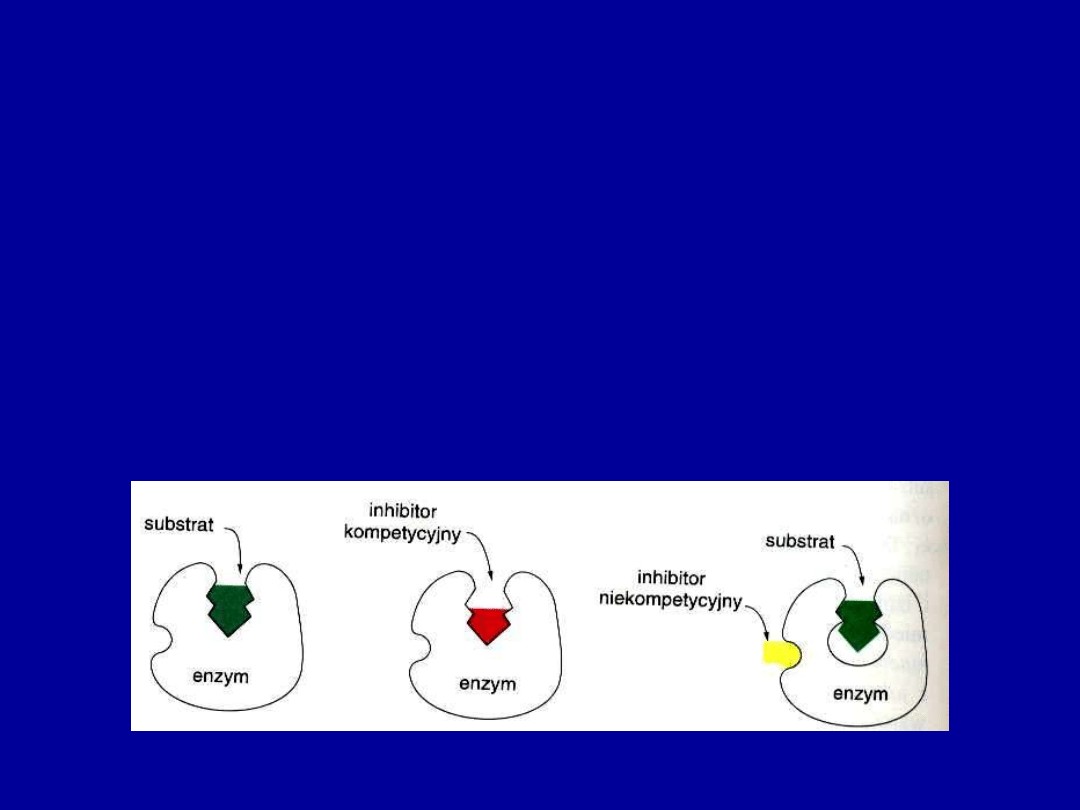
Rozróżnia się dwa główne typy inhibicji enzymów
•
nieodwracalną
– inhibitor wiąże się w miejscu aktywnym lub w jego
pobliżu i inaktywuje enzym na stałe
– diizopropylofluorofosforan (DIPF) - składnik gazów bojowych
– penicylina - hamuje enzym obecny w ścianie komórek bakteryjnych)
•
odwracalną
•
kompetycyjną
•
niekompetycyjną
Czynniki wpływające na aktywność enzymów
• Inhibitor kompetycyjny
– strukturalnie podobny do substratu danego
enzymu. Współzawodniczy z cząsteczkami substratu o wiązanie się z miejscem
aktywnym
• Inhibitor niekompetycyjny
– wiąże się w innym miejscu enzymu niż
jego miejsce aktywne i powoduje zmianę przestrzennego kształtu –
zmniejszenie aktywności katalitycznej
Mechanizmy kontroli aktywności
enzymatycznej
Aktywność wielu enzymów podlega regulacji:
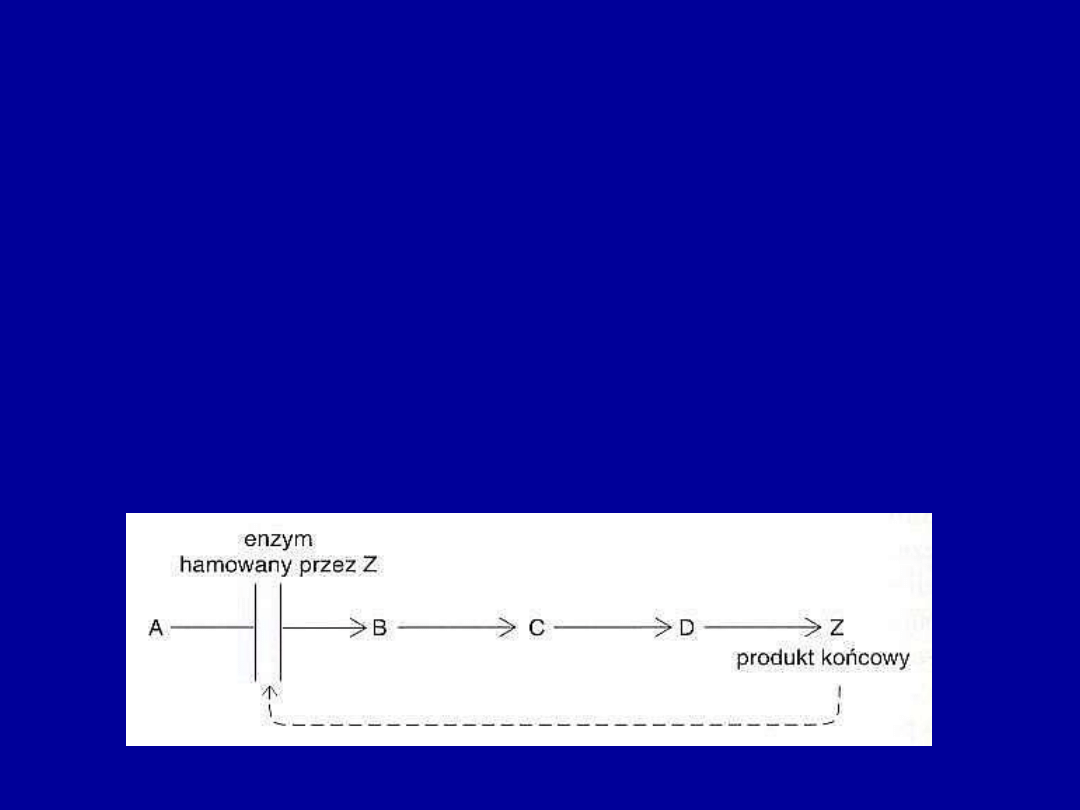
•
Regulacja przez sprzężenie zwrotne
– enzym katalizujący pierwszy
etap szlaku biosyntetycznego jest hamowany przez produkt końcowy (Z) tego
szlaku.
Kiedy stężenie Z osiąga odpowiednio wysoki poziom aktywność enzymu
zostaje zahamowana. Gdy stężenie Z zmniejszy się enzym odzyskuje swoją
aktywność, co prowadzi do ponownego rozpoczęcia biosyntezy Z.

Kontrola aktywności enzymatycznej
•
Enzymy allosteryczne
– mają często więcej niż jedno miejsce
aktywne, które to miejsca kooperatywnie wiążą cząsteczki substratu.
Dzięki temu związanie substratu w jednym miejscu aktywnym indukuje
w enzymie zmianę konformacyjną zmieniającą powinowactwo do
substratu w innych miejscach aktywnych
•
Enzymy allosteryczne są często białkami złożonymi z wielu podjednostek,
z których każda ma miejsce aktywne
•
Enzymy allosteryczne mogą być kontrolowane przez aktywatory lub
inhibitory, które wiążą się do miejsc innych niż miejsca aktywne,
powodując przez to zmianę konformacji miejsca aktywnego, co zmienia
szybkość działania enzymu

Kontrola aktywności enzymatycznej
•
Odwracalne modyfikacje kowalencyjne
– aktywność wielu
enzymów jest zmieniana przez odwracalne dołączanie grupy fosforanowej
do specyficznych reszt seryny i treoniny
•
Specyficzne enzymy, o nazwie
kinazy
katalizują dołączenie grup
fosforanowych, natomiast
fosfatazy
katalizują usuwanie tych grup w
drodze hydrolizy
•
Dodawanie i usuwanie grupy fosforanowej powoduje zmiany w
trzeciorzędowej
strukturze
enzymu
co
zmienia
jego
aktywność
katalityczną
Ufosforylowana forma enzymu może być albo mniej, albo bardziej
aktywna w porównaniu z jego formą defosforylowaną
•
Cykl
(fosforylacja/defosforylacja)
działa
jako
szybki
odwracalny
przełącznik włączający lub wyłączający szlak metaboliczny w zależności
od potrzeb komórki
Kontrola aktywności enzymatycznej
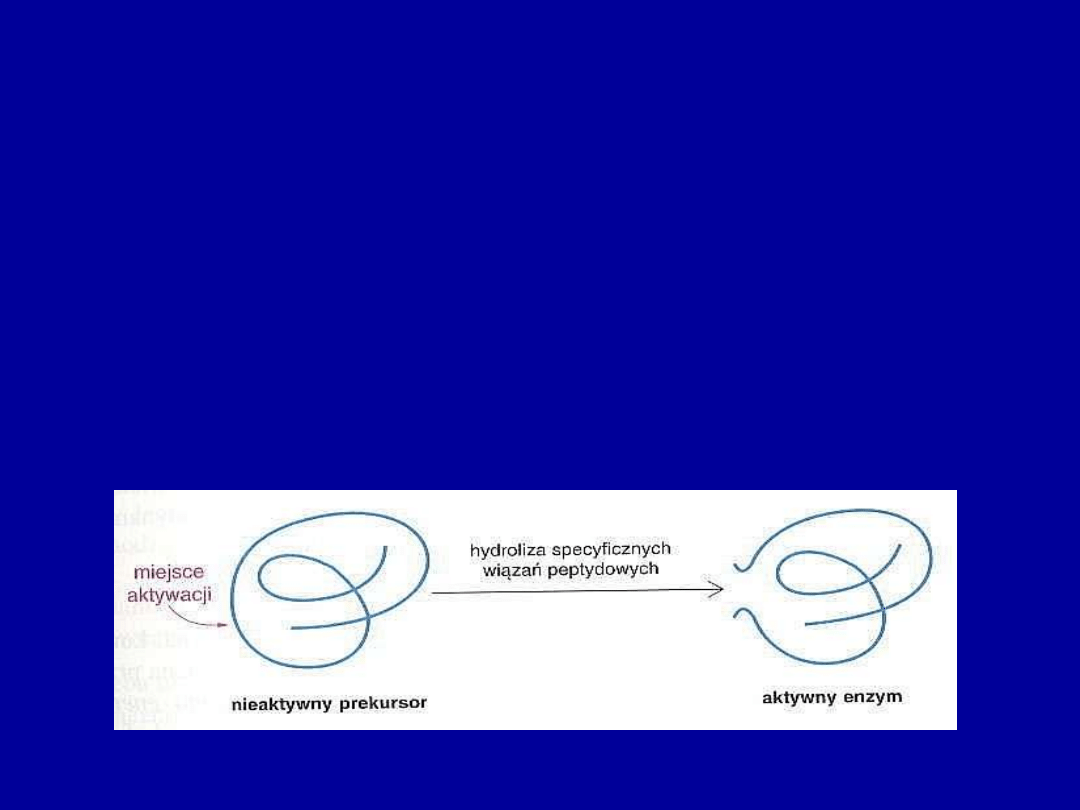
•
Aktywacja proteolityczna
– pewne enzymy są syntetyzowane jako
większe, nieaktywne formy prekursorowe o nazwie proenzymy lub
zymogeny
•
Aktywacja zymogenów polega na nieodwracalnej hydrolizie jednego lub
więcej wiązań peptydowych
•
Enzym trawienny (trypsyna) powstaje w trzustce jako zymogen
(trypsynogen), a dopiero w jelicie cienkim ulega aktywacji przez
rozszczepienie
specyficznych
wiązań
peptydowych
przez
enzym
enteropeptydazę, który jest wytwarzany tylko w jelicie
Aktywacja zymogenu

Klasyfikacja i nomenklatura enzymów
Początkowo nazwy enzymów tworzono przez dodanie końcówki
-aza
do nazwy substratu, na który działają:
• amylazy
- enzymy rozkładające wielocukier skrobię
• lipazy
- enzymy rozkładające tłuszcze
• proteinazy (proteazy)
- enzymy rozkładające białka
Pewne enzymy (np. trawienne) mają nazwy zwyczajowe - trypsyna, pepsyna
W celu ujednolicenia nazw enzymów opracowano system nazewnictwa
enzymów, uzgodniony międzynarodowo
(Enzyme Commission - EC)
System ten dzieli wszystkie enzymy na 6 głównych klas, opartych na typie
katalizowanej reakcji:

Klasyfikacja i nomenklatura enzymów
Numer
klasy
Nazwa klasy
Typ katalizowanej reakcji
Przykład
enzymu
1
Oksydoreduktazy
Przenoszenie elektronów
dehydrogenaza
2
Transferazy
Przenoszenie grup funkcyjnych
heksokinaza
3
Hydrolazy
Reakcje hydrolizy
(rozpad przy udziale H2O)
trypsyna
4
Liazy
Rozszczepianie wiązań C-C, C-O, C-N
(często tworzenie podwójnego
wiązania)
dekarboksylaza
5
Izomerazy
Przenoszenie grup w obrębie cząsteczki
izomeraza
6
Ligazy (syntetazy)
Tworzenie wiązań sprzężone z
hydrolizą ATP
karboksylaza

Klasyfikacja i nomenklatura
enzymów
Każdy enzym ma numer międzynarodowej klasyfikacji składający się z
czterech liczb oddzielonych od siebie kropkami
trypsyna
ma numer
(EC) 3.4.21.4
chymotrypsyna (EC) 3.4.21.1
Pierwsza liczba (3) oznacza klasę (hydrolaza)
Druga liczba (4) – podklasę (proteaza, która hydrolizuje wiązanie peptydowe)
Trzecia liczna (21) - pod-podklasę (proteaza serynowa)
Czwarta liczba (1 ) - kolejny numer enzymu przypisany do tej pod-podklasy
Każdy enzym ma też przypisaną mu nazwę systematyczną, np.
lipaza
to
Hydrolaza estrów glicerolowych

Wykorzystanie enzymów
Enzymy są wytwarzane wyłącznie przez żywe komórki, ale mogą działać poza
komórkami
Wiele enzymów wykorzystuje się na skalę przemysłową m.in. w: przemyśle
•
spożywczym (produkcja serów, pieczywa)
•
farmaceutycznym (produkcja antybiotyków, witamin)
•
chemicznym (produkcja proszków do prania)
•
tekstylnym
Enzymy (głównie mikroorganizmów) są wykorzystywane w wielu procesach
biotechnologicznych i ochronie środowiska (przy oczyszczaniu ścieków)

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
enzymy
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
enzymy
Enzymy
biochemia enzymy2
Enzymy podział na klasy
07 Enzymy 1
08 Enzymy 2
enzymy restrykcyjne
enzymy (2)
enzymy3
więcej podobnych podstron