
ENZYMY
Kinetyka reakcji
enzymatycznych

• Komórka potrzebuje osobnego
katalizatora do prawie każdej reakcji
jaka w niej zachodzi. Liczba enzymów
jest więc ogromna.
• „Jakąkolwiek reakcję wymyśli chemik
organik, to w świecie ożywionym na
pewno już istnieje enzym który ją
katalizuje” – czy to na pewno
paradoks?

Przykłady zastosowania reakcji
enzymatycznych w przemyśle
• Przemysł spożywczy – prod. alkoholi,
jogurtów, serów
• Przemysł farmaceutyczny – prod.
penicyliny, hydrokortyzonu, insuliny,
witamin A, B
2
, B
12
• Ochrona środowiska – biologiczne
oczyszczalnie ścieków
• Otrzymywanie białka z ropy naftowej
• Wzbogacanie rud uranu

Co odróżnia enzymy od
„zwykłych” katalizatorów ?
• Efektywność – enzymy mogą przyspieszać niektóre reakcje nawet 10
9
raza
• Selektywność – komórka potrzebuje osobnego katalizatora do każdej reakcji
jaka w niej zachodzi
• Stereospecyficzność – np. dehydrogenaza mleczanowa katalizuje reakcję
utleniania prawoskrętnego izomeru kwasu mlekowego do kwasu pirogronowego,
a jest zupełnie nieaktywna w stosunku do izomeru lewoskrętnego tego substratu.
2(H)
CH
3
COOH
CO
+
CH
3
COOH
CH(OH)
Co odróżnia enzymy od
„zwykłych” katalizatorów ? cd.
• Specyficzna wrażliwość na zmiany temperatury.
Większość enzymów dobrze działa w przedziale
temperatur 35 – 40
O
C.
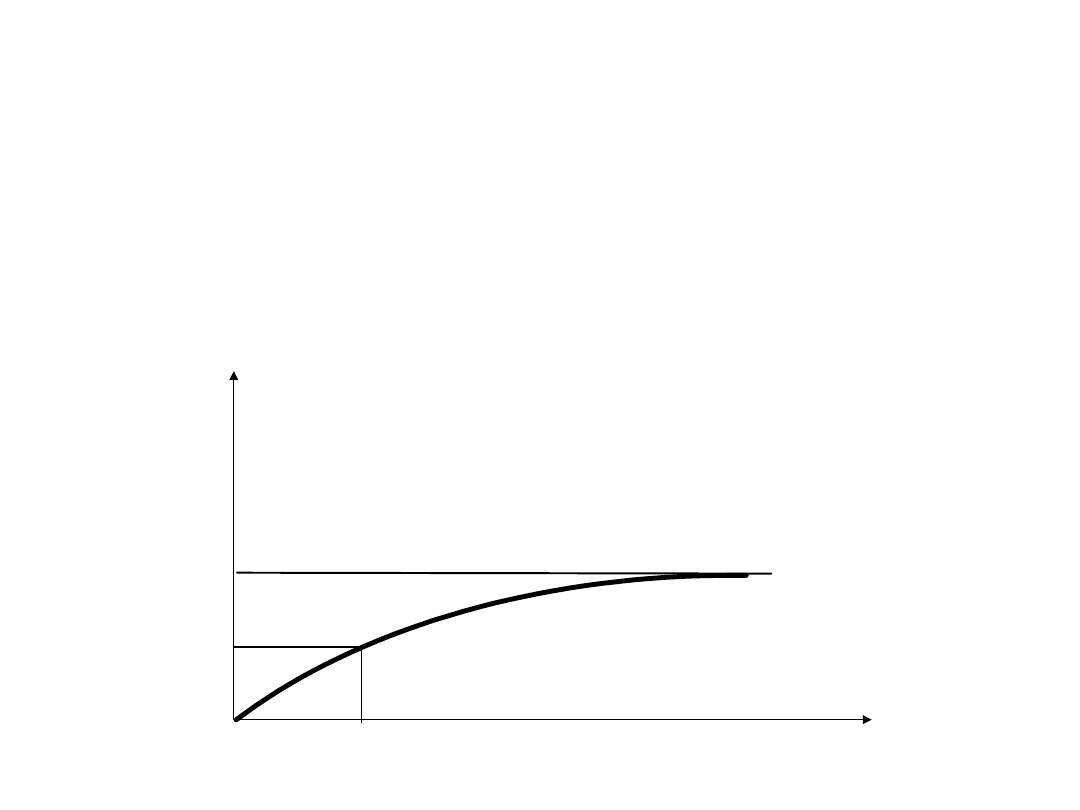
• Ogromna wrażliwość na zmiany pH
pH
100%
7.0 8.0
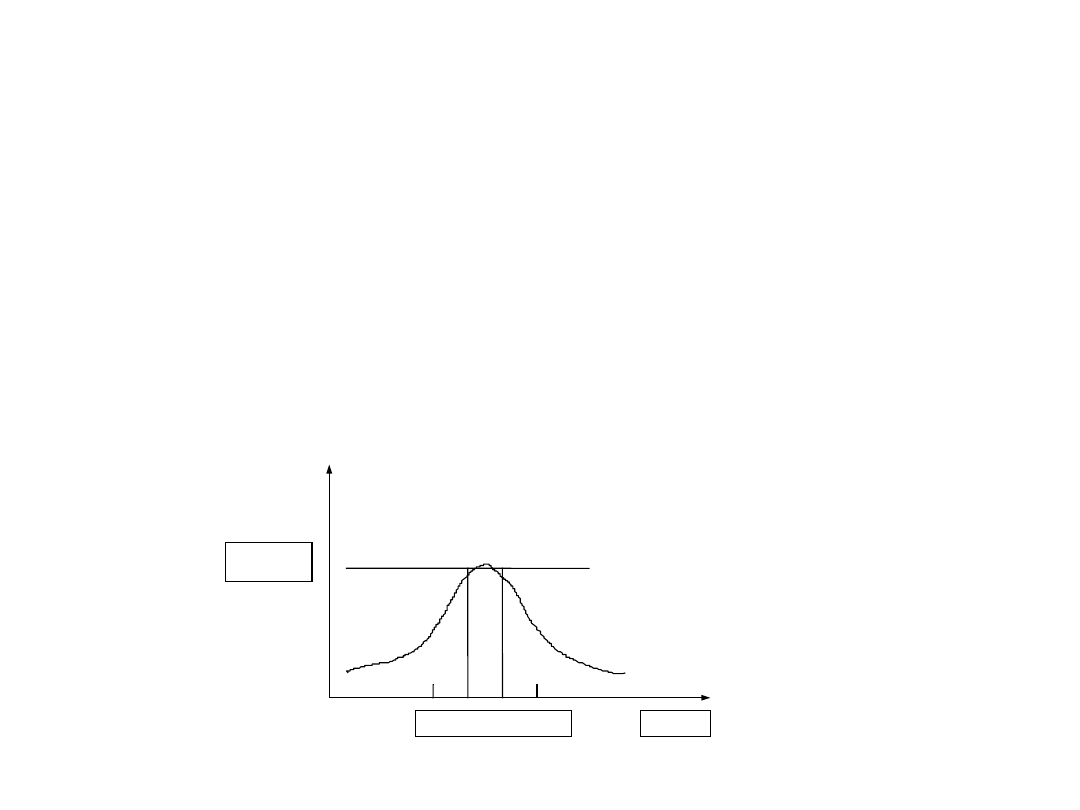
Zależność szybkości reakcji
enzymatycznej od stężenia
substratu
• Krzywa Michaelisa – Menten
C
substr
V
V
max
1/2 V
max
K
max
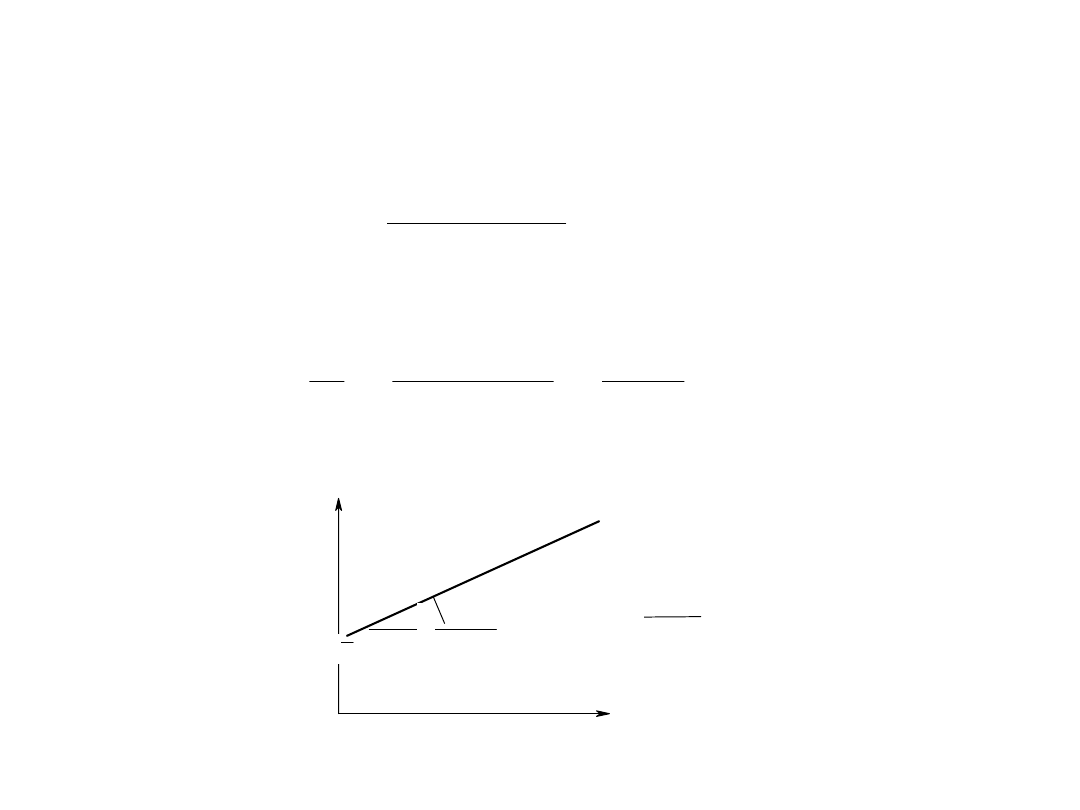
Równanie opisujące krzywą Michaelisa
]
[
]
[
S
K
S
V
V
Max
Max
Max
Max
Max
V
S
V
K
V
1
]
[
1
tg =
K
Max
V
Max
1/V
1/[S]
1/V
Max

Mechanizm reakcji
enzymatycznej
Produkty
Kompleks
Kompleks
Enzym
Substrat
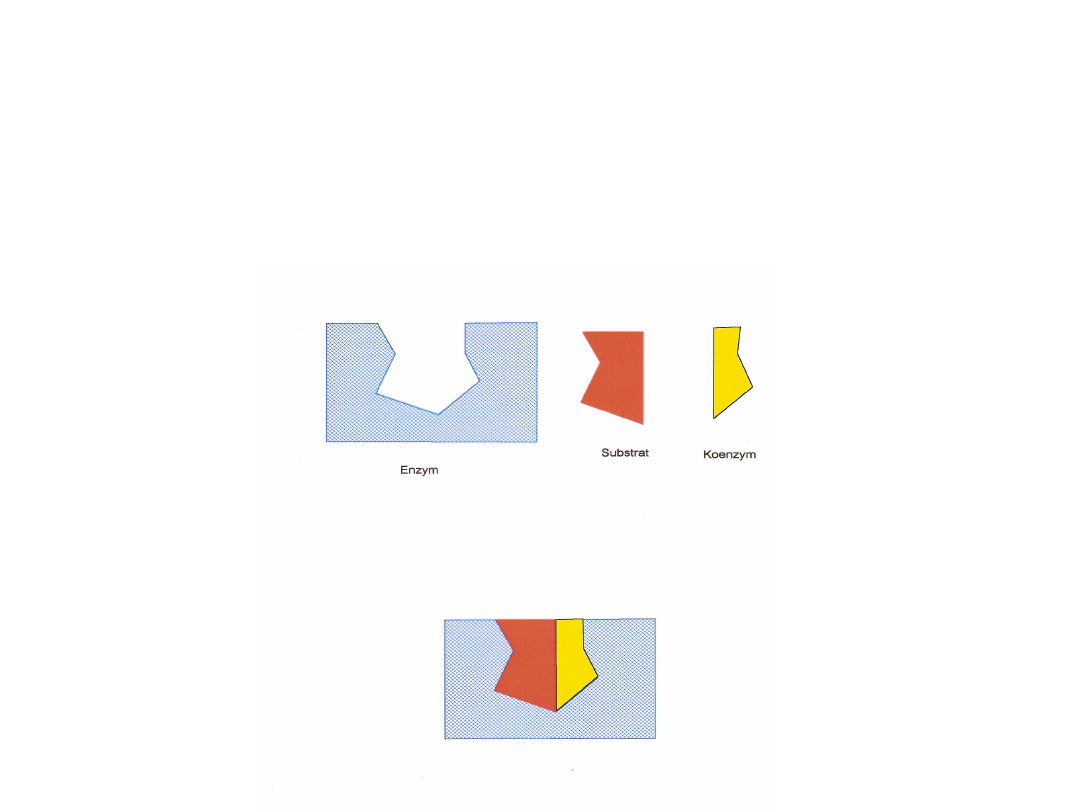
Istota reakcji enzymatycznej
• Budowa centrum aktywnego – komplementarność kształtu i
rozkładu ładunków substratu i centrum aktywnego jako
warunek działania (analogia zamek-klucz)

W jaki sposób enzym zwiększa
reaktywność substratu?
• W czasie tworzenia kompleksu cząsteczka
substratu może zostać rozciągnięta lub
zniekształcona, co ułatwia jej rozbicie.
• Dzięki precyzji kontaktu jaki substrat tworzy
z enzymem, cząsteczka może znaleźć się
trwale w korzystnej orientacji do
oddziaływania z inną.
• Efektem działania enzymu może być także
zwiększenie zagęszczenia cząsteczek
substratu w ograniczonym obszarze, co
zwiększa prawdopodobieństwo zajścia reakcji

Inhibitory enzymatyczne (1)
Niezwykła precyzja budowy centrum
aktywnego enzymu oznacza że
jakakolwiek zmiana kształtu cząsteczki w
tym miejscu przeszkodzi w utworzeniu
się kompleksu z substratem.
• Enzymy, których działanie opiera się na szczególnym
rozkładzie ładunków są łatwo hamowane przy zmianie pH.
• enzymy z grupami tiolowymi są hamowane przez jony
metali wykazujących powinowactwo do siarki np. Hg(II),
Pb(II)
• enzymy, których aktywność zależy od określonego jonu
metalu będą unieczynniane po zamianie tego jonu na
inny.

Inhibitory enzymatyczne (2).
• Inny mechanizm inhibicji wynika z tego że
również cząsteczka substratu musi dokładnie
pasować do centrum enzymu.
• Jeżeli jakaś cząsteczka istotnie różni się od substratu to
nie pasuje ona do centrum aktywnego i nie blokuje
enzymu.
• Jeżeli cząsteczka jest podobna do cząsteczki substratu,
to może ona wcisnąć się do luki strukturalnej enzymu
ale nie być wystarczająco podobna aby przereagować.
Klinuje się ona wtedy w centrum i blokuje enzym.
(analogia zamek – klucz
)
• Istnieją także inhibitory nie mające
powinowactwa do centrum aktywnego.
Wiążą się one z enzymem gdy utworzył on już kompleks
z substratem uniemożliwiając zajście reakcji
–
inhibitory
niekompetytywne.

Inhibitory enzymatyczne (3)
• Inhibicja może być odwracalna i
nieodwracalna.
W tym ostatnim przypadku mówi się o
zatruciu enzymu.
• Termin
zatrucie
nie jest tylko metaforą. Większość trucizn
to substancje blokujące określone enzymy.
• Np. sarin blokuje enzym zwany esterazą cholinową, której zdaniem jest
powstającej w organizmie silnie toksycznej acetylocholiny.
Zablokowanie enzymu powoduje zatrucie organizmu nierozłożoną
acetylocholiną
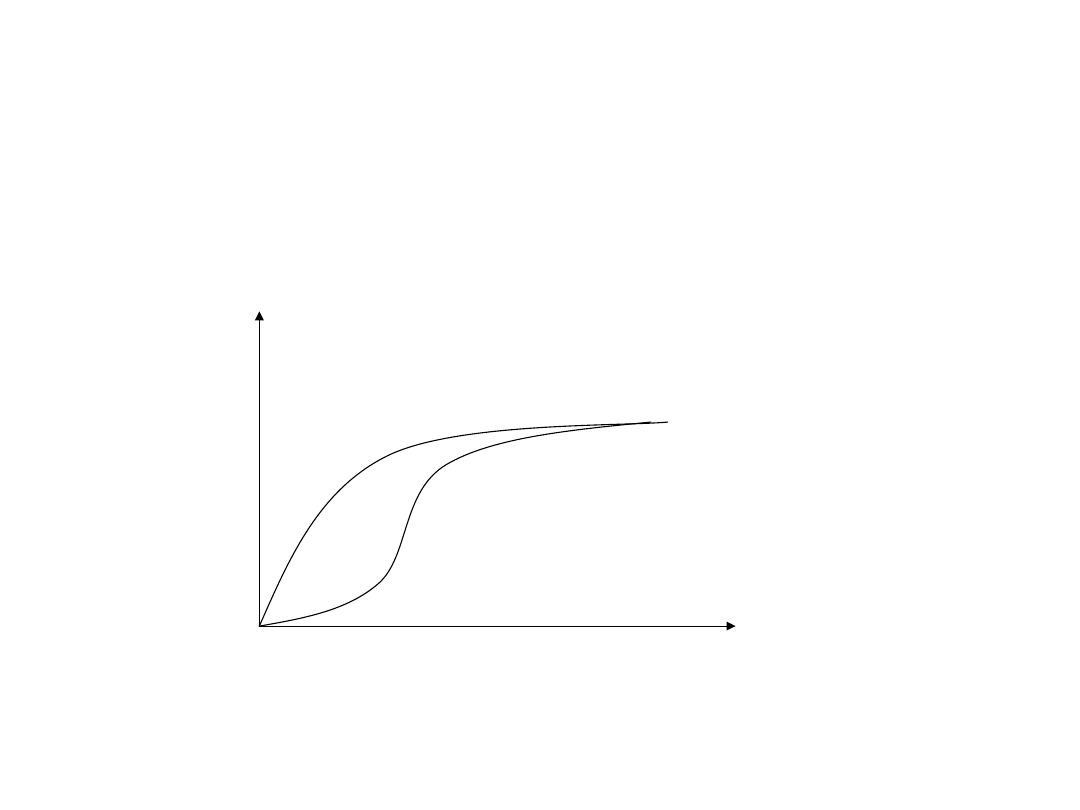
Enzymy allosteryczne
• Posiadają więcej niż jedno miejsce aktywne w
stosunku do tego samego substratu. Przyłączenie
substratu w jednym miejscu ułatwia przyłączenie w
kolejnych. (Istnieje również inhibicja allosteryczna).
Csubstr
V
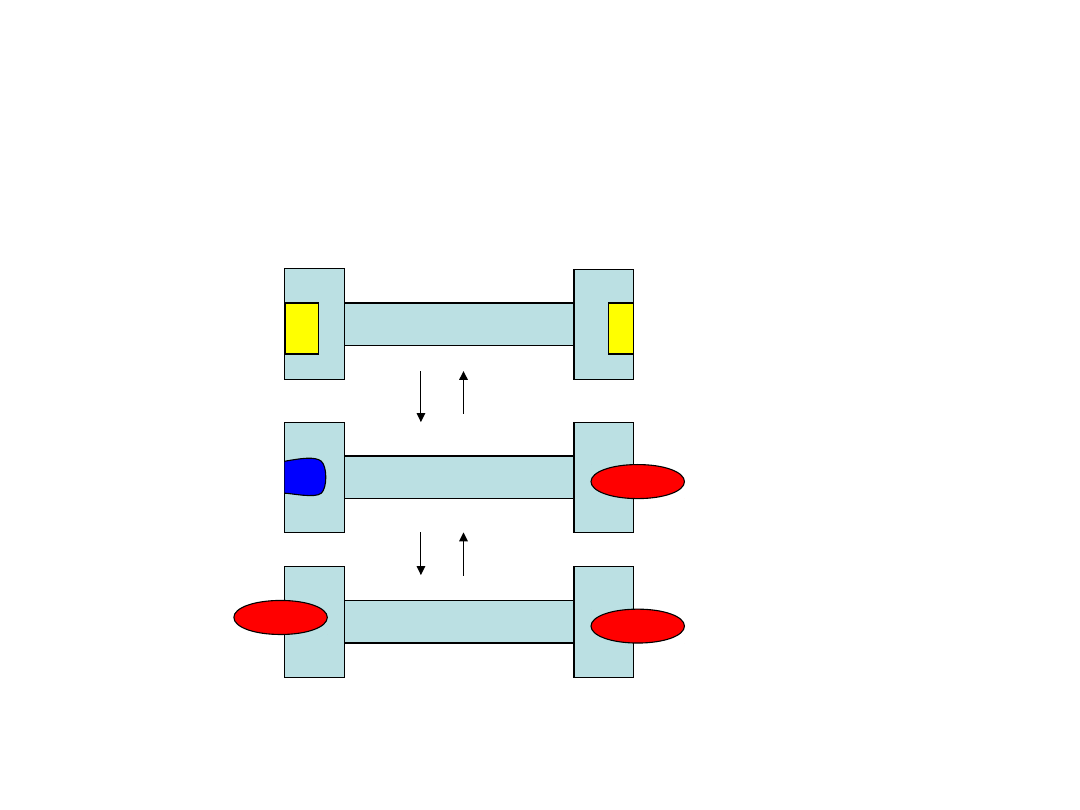
Allosteria (1)
• Schemat J. Monoda, J. Wymana i J.P.Changeaux
Z
Z
Z
Z
N
N
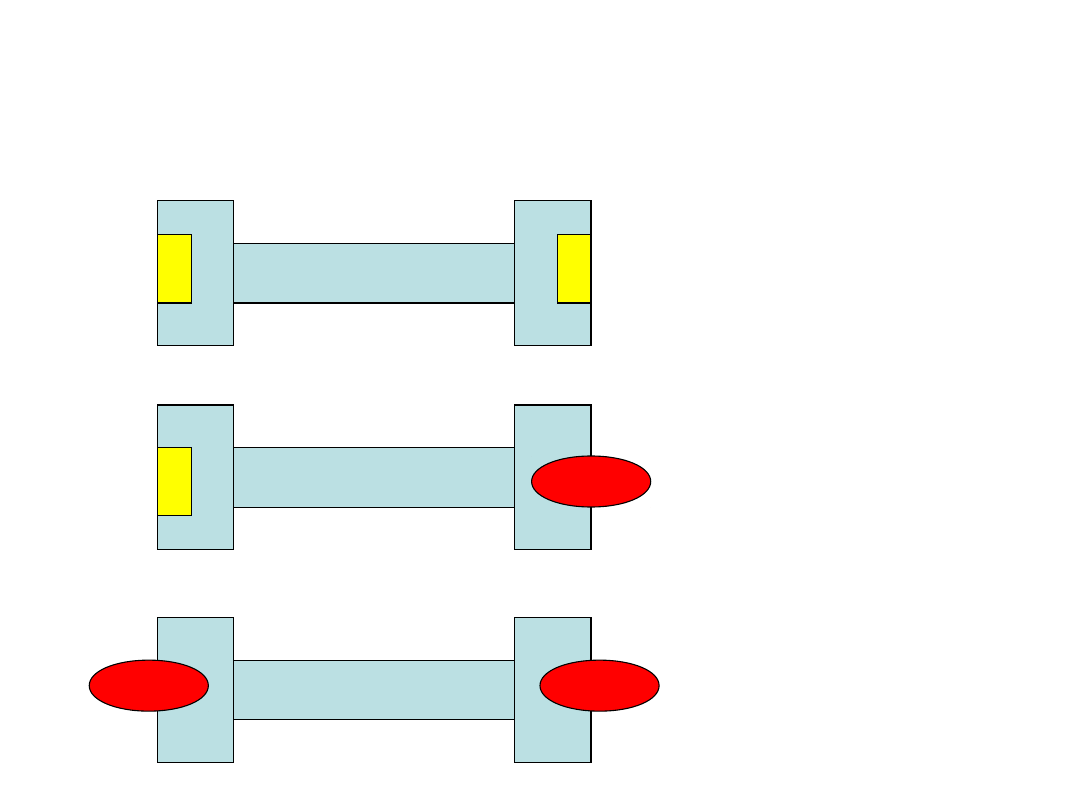
Allosteria (2)
• Model D. Koshlanda

Podział enzymów
• Oksyreduktazy – katalizują reakcje utleniania i redukcji
• Transferazy – katalizują reakcje typu A-B + C = A + B-C
• Hydrolazy – katalizują reakcje hydrolizy i reakcje do
nich przeciwne
• Liazy – katalizują reakcje rozkladu nie polegające na
hydrolizie
• Izomerazy – przyspieszają reakcje izomeryzacji
substratu
• Ligazy – uczestniczą w tworzeniu większych cząsteczek
z ich prekursorów

Enzymy zawierające jony metali
• Enzymy z mocno związanym jonem metalu
log K > 8. Dają się wydzielić w stanie
czystym. Stanowią część grupy
prostetycznej -
metaloenzymy
• Enzymy ze słabo związanym jonem metalu
log K < 8. Podczas prób wydzielania tracą
zwykle jon metalu. Są koenzymami lub
stanowią część kenzymu –
enzymy
aktywowane jonami metali
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
enzymy
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
enzymy
Enzymy
biochemia enzymy2
Enzymy podział na klasy
07 Enzymy 1
08 Enzymy 2
enzymy restrykcyjne
enzymy (2)
enzymy3
więcej podobnych podstron