
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
1
BADANIE WYNIKÓW NAUCZANIA Z CHEMII
POZIOM ROZSZERZONY
(OBLICZENIA CHEMICZNE)
Czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów.
Zadanie 1. (2 pkt)
1.1
Chlor to pierwiastek występujący w postaci dwóch trwałych izotopów, z których jeden zawiera 18 neutro-
nów, a drugi 20 neutronów w jądrze. Wiadomo, że rozpowszechnienie w przyrodzie izotopu o mniejszej
masie atomowej jest 3,5-krotnie większe w porównaniu z izotopem o większej masie atomowej.
Na podstawie odpowiednich obliczeń ustal średnią masę atomową chloru. Wynik podaj z dokładno-
ścią do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Zadanie 2 (2 pkt)
2.1
Próbka metalicznego rodu o masie 100 g zawiera 1% masowy promieniotwórczego izotopu rodu
101
Rh,
którego okres półtrwania T
1/2
= 3,3 roku. Pozostałą masę próbki stanowią trwałe izotopy rodu.
Oblicz całkowitą masę rodu zawartego w próbce 6,6 roku temu.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
2
Zadanie 3 (2 pkt)
3.1
Na 10 g stopu glinu z miedzią podziałano stężonym kwasem azotowym(V). W wyniku reakcji wydzieliło
się w warunkach normalnych 3,36 dm
3
brunatnego gazu, przy 75-procentowej wydajności procesu.
Oblicz zawartość procentową glinu w badanym stopie.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Zadanie 4 (1 pkt)
4.1
Pewien gazowy węglowodór reaguje z 13 cm
3
tlenu, tworząc 8 cm
3
tlenku węgla(IV) i 10 cm
3
pary wodnej.
Pomiary wykonano w tych samych warunkach ciśnienia i temperatury.
Ustal wzór sumaryczny spalanego węglowodoru.
Wzór sumaryczny węglowodoru: ................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
3
Zadanie 5 (3 pkt)
5.1
Do próbki pewnego nasyconego alkoholu dihydroksylowego o masie 9 g wrzucono kawałek sodu. W wy-
niku reakcji wydzieliło się 2,45 dm
3
bezbarwnego gazu (przy 100-procentowej wydajności procesu).
Doświadczenie przeprowadzono w temperaturze 22ºC i pod ciśnieniem 1000 hPa. R = 83,14
hPa dm
mol K
⋅
⋅
3
Na podstawie odpowiednich obliczeń ustal wzór sumaryczny badanego alkoholu.
Obliczenia:
Wzór sumaryczny alkoholu: ................................................
Zadanie 6 (2 pkt)
6.1 6.2
Do dwóch zlewek zawierających po 100 cm
3
kwasu solnego o stężeniu 1 mol ∙ dm
–3
wprowadzono różne
substancje w ilościach podanych na poniższym schemacie:
HCl
(aq)
1.
2.
17 g AgNO
3(s)
2,24 dm
3
NH
3(g)
(warunki normalne)
a) Podaj numer lub numery zlewek, w których po reakcji pH < 7. …………………………
b) Spośród wymienionych jonów wybierz i podkreśl wzory tych, których stężenie w zlewce oznaczo-
nej numerem 1 będzie po reakcji największe.
Ag
+
NO
3
–
Cl
–
H
+
OH
–
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
4
Zadanie 7 (2 pkt)
7.1
W 10 dm
3
wodnego roztworu kwasu metanowego znajduje się 1,053 ∙ 10
23
anionów metanianowych
i 17,325 mola niezdysocjowanych cząsteczek HCOOH.
Oblicz stopień i stałą dysocjacji kwasu metanowego.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Zadanie 8 (3 pkt)
8.1 8.2
W reaktorze o objętości 1 dm
3
przebiega w stałej temperaturze T reakcja opisana schematem:
A
(g)
+ 2B
(g)
→
← C
(g)
+ D
(g)
Po zmieszaniu substratów A i B w stosunku molowym 1 : 2 zainicjowano reakcję. W chwili ustalenia się stanu
równowagi reakcji uległo 50% substratu A, tworząc produkty C i D. Stała równowagi reakcji wynosi 2.
a) Oblicz stężenia początkowe substratów A i B.
Obliczenia:
Odpowiedź: ................................................................................................................................................
b) Zakładając, że powyższa reakcja jest reakcją egzoenergetyczną oceń poprawność poniższych zdań.
Uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
P / F
Wzrost temperatury w układzie powoduje zmniejszenie wartości stałej równowagi reakcji.
Wzrost ciśnienia w układzie powoduje zwiększenie wartości stałej równowagi reakcji.
Zwiększenie stężenia substratu B powoduje zmniejszenie wartości stałej równowagi reakcji.
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
5
Zadanie 9 (2 pkt)
9.1
Pomiędzy osadem trudno rozpuszczalnej substancji a obecnymi w roztworze nasyconym jonami ustala się
stan równowagi, który przedstawia poniższy zapis:
A
x
B
y(s)
→
← xA
y+
+ yB
x–
Iloczyn rozpuszczalności (I
r
) można traktować, jako stałą równowagi powyższego procesu, opisaną wyra-
żeniem:
I
r
= [A
y+
]
x
∙ [B
x–
]
y
,
gdzie [A
y+
], [B
x–
] – stężenia odpowiednich jonów w roztworze nasyconym.
W temperaturze 25ºC zmieszano ze sobą równe objętości roztworu Ca(NO
3
)
2
o stężeniu 0,02 mol ∙ dm
–3
i roztworu NaOH o pH = 12. Wykonując obliczenia, ustal, czy po zmieszaniu wytrącił się osad Ca(OH)
2
,
jeżeli wartość iloczynu rozpuszczalności w temperaturze 25ºC wynosi I
rCa(OH)
2
= 5,5 ∙ 10
–6
.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Zadanie 10 (2 pkt)
10.1
Dla przebiegającej w fazie gazowej reakcji: 2NO
(g)
+ O
2(g)
→ 2NO
2(g)
równanie kinetyczne ma postać: ν = k ∙ [NO]
2
∙ [O
2
]
Na podstawie odpowiednich obliczeń ustal, jak zmieni się szybkość reakcji w czasie t względem szyb-
kości początkowej, jeżeli stężenia początkowe substratów wynosiły odpowiednio: [NO] = 2 mol ∙ dm
–3
oraz [O
2
] = 1 mol ∙ dm
–3
, a w czasie t stężenie tlenu wynosiło [O
2
] = 0,5 mol ∙ dm
–3
.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
6
Zadanie 11 (2 pkt)
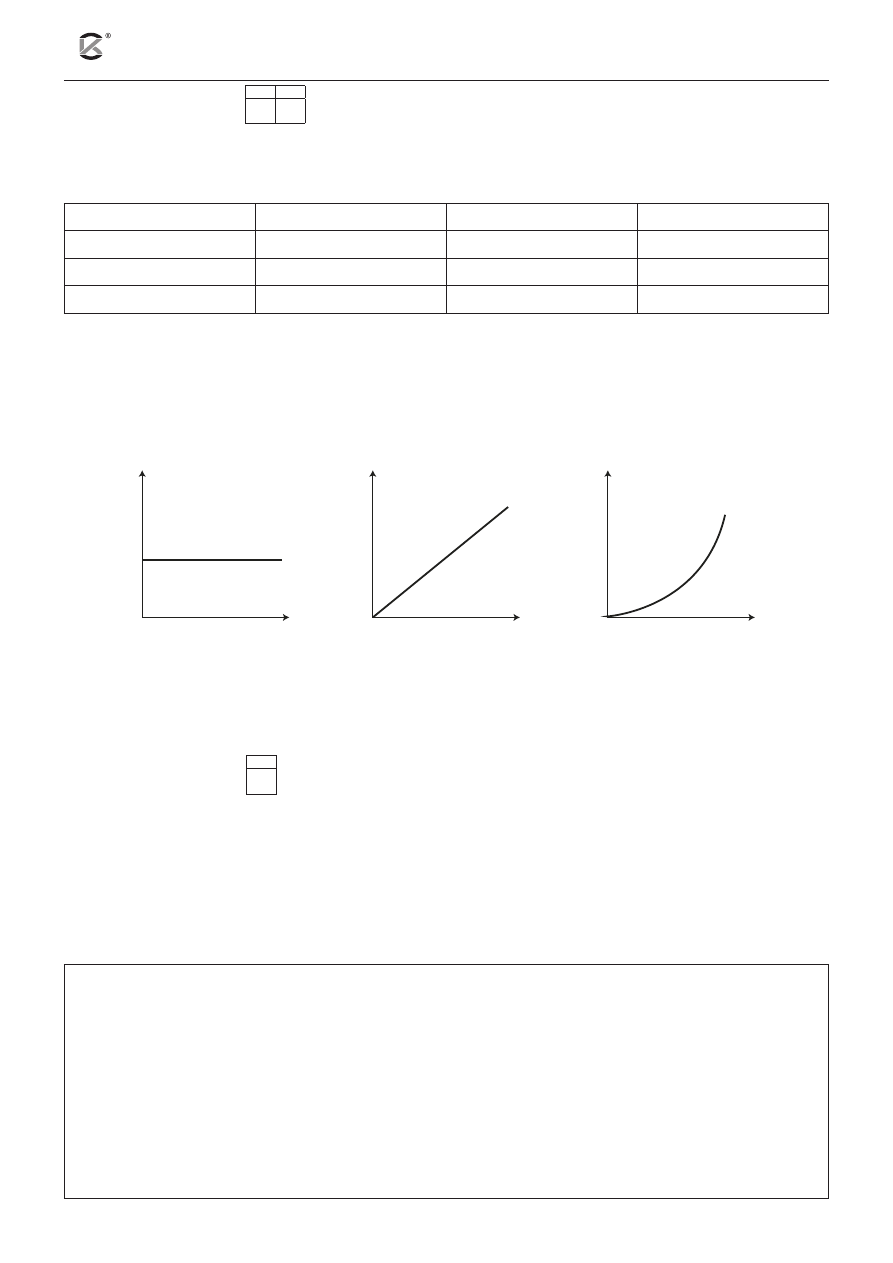
11.1 11.2
Przeprowadzono doświadczenie, którego celem było zbadanie wpływu stężenia substratów na szybkość
pewnej reakcji chemicznej opisanej równaniem: A
(aq)
+ 3B
(aq)
→ D
(aq)
.
W temperaturze 298 K wykonano trzy pomiary. Wyniki zanotowano w tabeli.
Numer pomiaru
[A], mol ∙ dm
–3
[B], mol ∙ dm
–3
ν , mol ∙ dm
–3
∙ s
–1
1
0,1
0,1
2 ∙ 10
–2
2
0,1
0,2
8 ∙ 10
–2
3
0,3
0,1
2 ∙ 10
–2
a) Wybierz i wpisz w wolne miejsce odpowiedni numer (I–III).
Zależność szybkości reakcji od stężenia molowego substratu A ilustruje wykres oznaczony numerem .... .
Zależność szybkości reakcji od stężenia molowego substratu B ilustruje wykres oznaczony numerem .... .
stężenie substratu
stężenie substratu
stężenie substratu
I
II
III
szybkość reakcji
szybkość reakcji
szybkość reakcji
b) Dokończ poniższy zapis, tak aby otrzymać równanie kinetyczne dla opisanej reakcji.
ν = k ∙ ................
Zadanie 12 (2 pkt)
12.1
Poniżej podano równania reakcji otrzymywania fosforowodoru z pierwiastków:
P
4(biały)
+ 6H
2(g)
→ 4PH
3(g)
P
4(czerwony)
+ 6H
2(g)
→ 4PH
3(g)
Korzystając z podanych wyżej równań oraz znając:
– standardową entalpię tworzenia fosforowodoru z fosforu białego ∆H
0
1
= 5,44 kJ/mol,
– standardową entalpię tworzenia fosforowodoru z fosforu czerwonego ∆H
0
2
= 22,90 kJ/mol,
oblicz standardową entalpię przemiany fosforu białego w fosfor czerwony.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
7
Zadanie 13 (2 pkt)
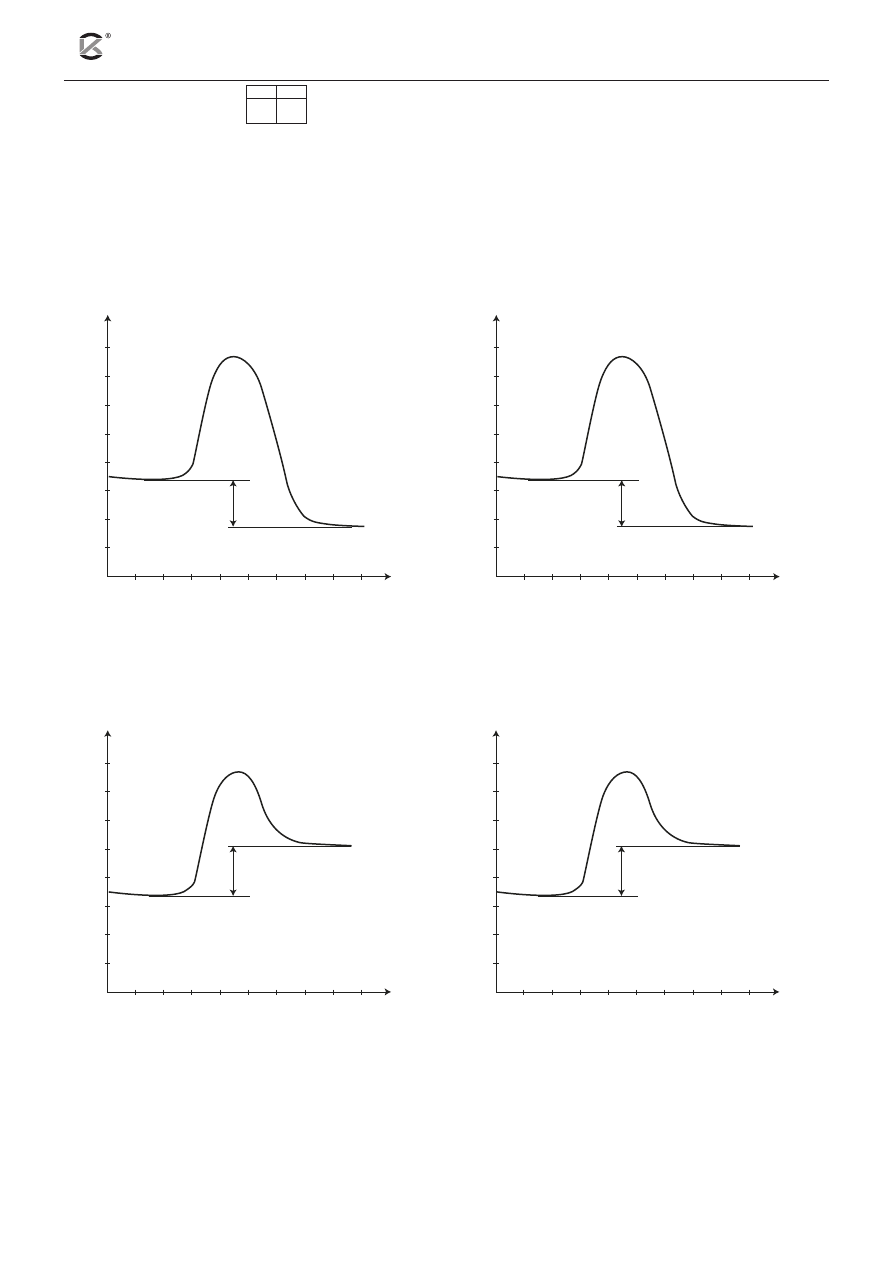
13.1 13.2
Poniżej podano termochemiczne równanie spalania etenu w warunkach standardowych:
2C
2
H
4(g)
+ 6O
2(g)
→ 4CO
2(g)
+ 4H
2
O
(c)
+ 2602 kJ
a) Podaj standardową entalpię spalania etenu. ........................................................................................
b) Wskaż, który wykres przedstawia zmiany energii reagentów podczas przebiegu powyższej reakcji.
2C
2
H
4
+ 6O
2
4CO
2
+ 4H
2
O
przebieg reakcji
A
C
B
D
ener
gia kJ
–2302 kJ
2C
2
H
4
+ 6O
2
4CO
2
+ 4H
2
O
przebieg reakcji
ener
gia kJ
+2302 kJ
2C
2
H
4
+ 6O
2
4CO
2
+ 4H
2
O
przebieg reakcji
ener
gia kJ
–2302 kJ
2C
2
H
4
+ 6O
2
4CO
2
+ 4H
2
O
przebieg reakcji
ener
gia kJ
+2302 kJ
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
8
Zadanie 14 (3 pkt)
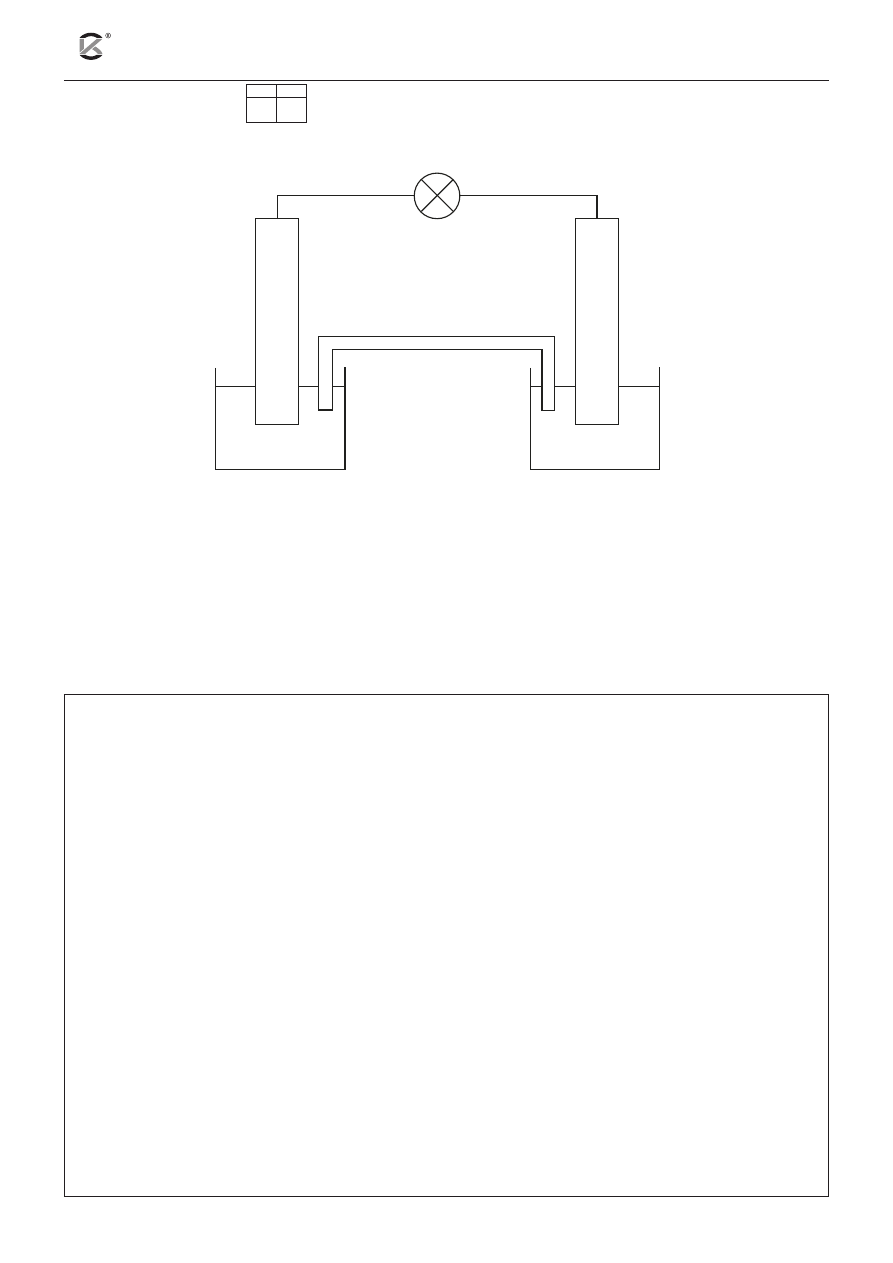
14.1 14.2
Zbudowano ogniwo zgodnie z poniższym rysunkiem:
klucz
elektrolityczny
Zn
ZnCl
2(aq)
AgNO
3(aq)
Ag
V
1
= 100 cm
3
c
1
= 1,00 mol ∙ dm
3
c
2
= 1,00 mol ∙ dm
3
V
2
= 100 cm
3
a) Oblicz siłę elektromotoryczną ogniwa w warunkach standardowych.
SEM = ............................................................................................................................................................
Po pewnym czasie pracy ogniwa układ rozmontowano i stwierdzono, że masa płytki srebrowej wzrosła
o 0,108 g.
b) Oblicz końcowe stężenie kationów cynku przy założeniu, że objętość roztworu nie uległa zmianie.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
obliczenia arkusz rs 5 1392900864
doswiadczenia arkusz rs 6 1392900606
obliczenia model rs 5 1392900934
nieorganiczna 2 arkusz rs 2 1392901336
doswiadczenia arkusz rs 6 1392900606
obliczenia model rs 5 1392900934
nieorganiczna 2 arkusz rs 2 1392901336
doswiadczenia arkusz rs 6 1392900606
obliczenia model rs 5 1392900934
organiczna 2 arkusz rs 4 1392901126
doswiadczenia model rs 6 1392900786
organiczna 2 model rs 4 1392901170
organiczna 1 model rs 3 1392901271
nieorganiczna 2 model rs 2 1392901381
doswiadczenia model rs 6 1392900786
więcej podobnych podstron