Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
1
BADANIE WYNIKÓW NAUCZANIA
POZIOM ROZSZERZONY
CHEMIA ORGANICZNA (część 2)
Czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów
Zadanie 1. (2 pkt)
1.1 1.2
Aminy to związki organiczne. Można je uznać za pochodne amoniaku, w którym jeden, dwa lub trzy atomy
wodoru zastąpiono resztami węglowodorowymi.
Aminy oznaczone literami A i B są izomerami o wzorze sumarycznym C
3
H
9
N. Amina A jest aminą pierw-
szorzędową, zaś amina B – aminą drugorzędową.
a) Narysuj wzór półstrukturalny (grupowy) cząsteczki aminy A,
wiedząc, że grupa funkcyjna jest położona przy
pierwszorzędowym atomie węgla.
b) Podaj nazwę systematyczną aminy B: ..............................................................................
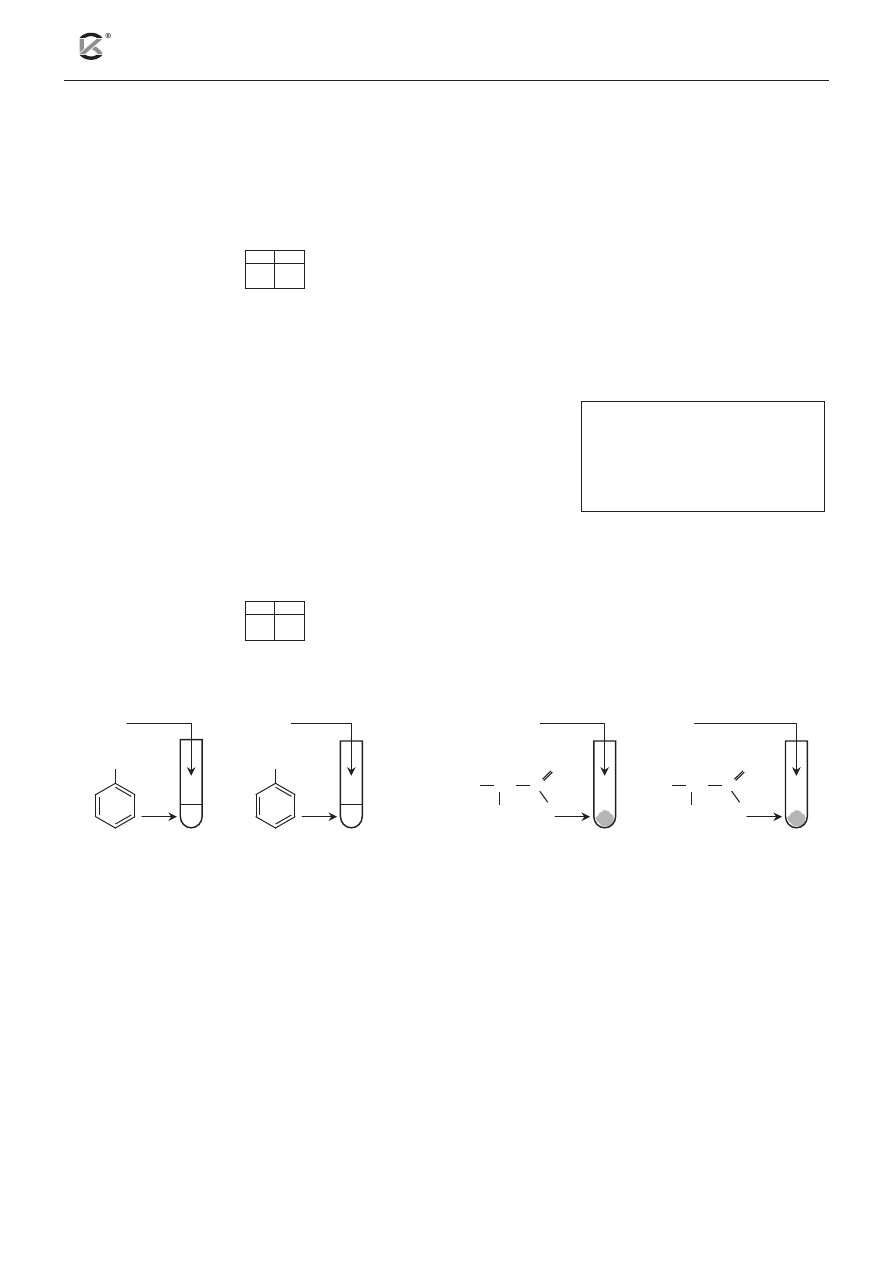
Zadanie 2. (4 pkt)
2.1 2.2
Wykonano doświadczenie, którego przebieg przedstawiono na poniższym schemacie.
2.
HCl
(aq)
KOH
(aq)
HCl
(aq)
KOH
(aq)
1.
3.
4.
NH
2
(aq)
NH
2
(aq)
(s)
CH
CH
3
C
O
OH
NH
2
(s)
CH
CH
3
C
O
OH
NH
2
Stosując wzory półstrukturalne (grupowe) związków organicznych, napisz w formie cząsteczkowej
równania reakcji zachodzących podczas tego doświadczenia lub zaznacz, że reakcja nie zachodzi.
Probówka nr 1: ...............................................................................................................................................
Probówka nr 2: ...............................................................................................................................................
Probówka nr 3: ...............................................................................................................................................
Probówka nr 4: ...............................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
2
Zadanie 3. (4 pkt)
3.1 3.2 3.3 3.4
W wyniku hydrolizy pewnego tripeptydu otrzymano mieszaninę aminokwasów o podanych niżej wzorach
A, B, C w stosunku molowym 1 : 1 : 1. Aminokwasem N-końcowym tripeptydu, który poddano hydrolizie,
była alanina.
glicyna (Gly)
alanina (Ala)
seryna (Ser)
CH
CH
3
C
O
OH
NH
2
CH
CH
2
C
O
OH
NH
2
OH
CH
2
C
O
OH
NH
2
a) Napisz, posługując się trzyliterowymi symbolami aminokwasów, wszystkie możliwe wzory tripep-
tydów, które mogły zostać poddane hydrolizie.
Sekwencje tripeptydów: ............................................................................................................................
b) Uzupełnij poniższy schemat tak, aby otrzymać wzór stereoizomeru seryny, który występuje
w białkach.
COOH
CH
2
OH
c) Narysuj wzór półstrukturalny (grupowy) tripeptydu o sekwencji zgodnej z malejącą masą czą-
steczkową podanych aminokwasów.
d) Podaj, ile moli cząsteczek wody potrzeba do całkowitej hydrolizy dwóch moli dowolnego tripep-
tydu.
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
3
Zadanie 4. (2 pkt)
4.1
Punkt izoelektryczny (pI) to pH roztworu, w którym dany aminokwas występuje głównie w postaci jonu
obojnaczego. Dla aminokwasu o nazwie kwas 2-amino-4-metylopentanowy (leucyna) wartość punktu izo-
elektrycznego pI = 5,98.
(na podstawie: John McMurry, Chemia organiczna, cz. 2, PWN 2000 r.)
a) Narysuj wzór półstrukturalny (grupowy) formy,
w jakiej występuje leucyna w roztworze o pH = 5,98.
b) Narysuj wzór półstrukturalny (grupowy) formy,
w jakiej występuje leucyna w roztworze o pH = 4,00.
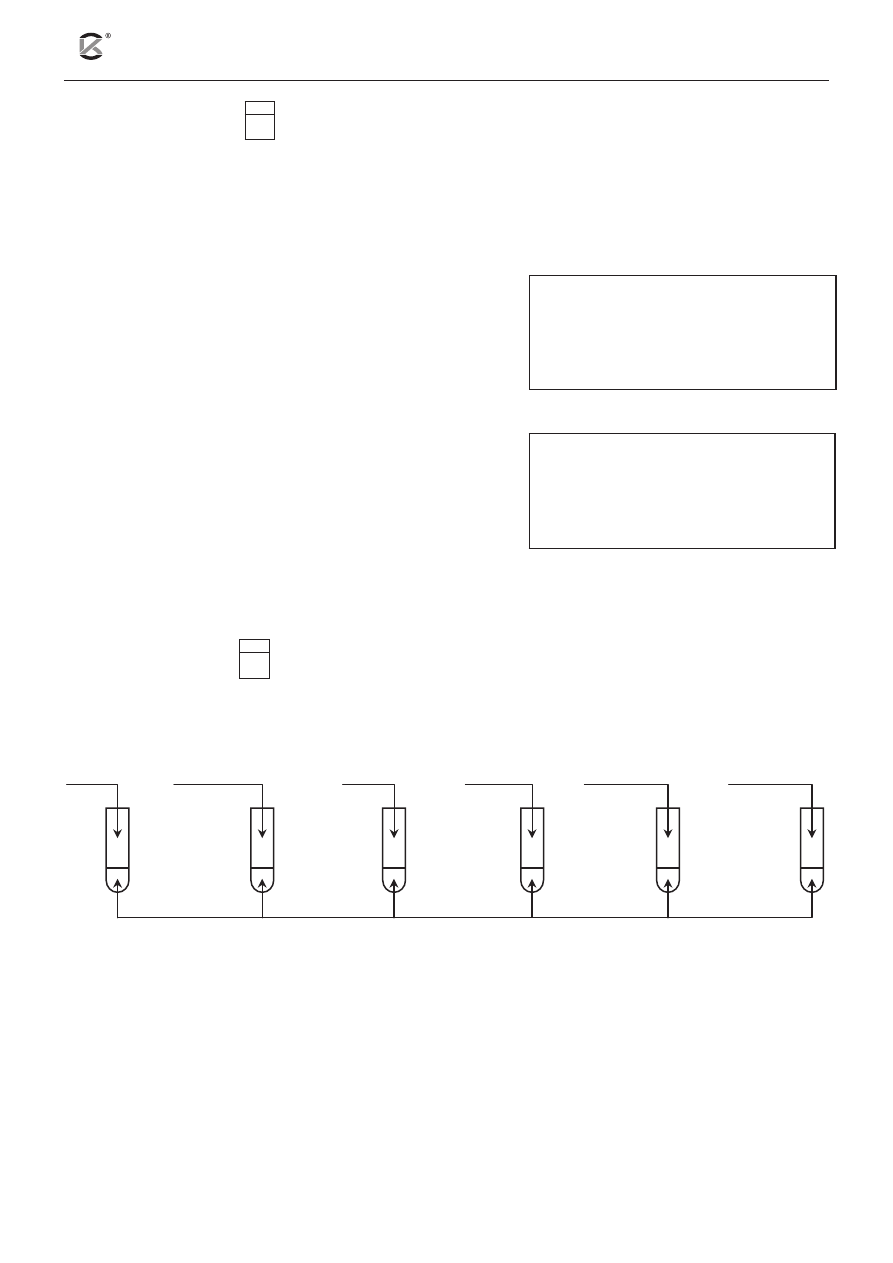
Zadanie 5. (1pkt)
5.1
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym schemacie.
HNO
3
C
2
H
5
OH
wodny roztwór białka kurzego
Na
2
SO
4(aq)
HCl
(aq)
1.
HCHO
(aq)
2.
NH
4
NO
3(aq)
5.
6.
3.
4.
Podaj numery probówek, w których białko jaja kurzego uległo denaturacji.
Białko uległo denaturacji w probówkach nr: .................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
4
Zadanie 6. (2 pkt)
6.1
Mocznik można otrzymać w wyniku reakcji syntezy amoniaku z tlenkiem węgla(IV) w odpowiednich wa-
runkach. Obok podano równanie tej reakcji:
CO
2
+ 2NH
3
→ CO(NH
2
)
2
+ H
2
O
Do wyprodukowania 900 kg mocznika zużyto 705,6 m
3
amoniaku odmierzonego w warunkach normalnych.
Oblicz wydajność procesu. Wynik podaj w procentach z dokładnością do drugiego miejsca po prze-
cinku.
Obliczenia:
Odpowiedź: .................................................................................................................................................
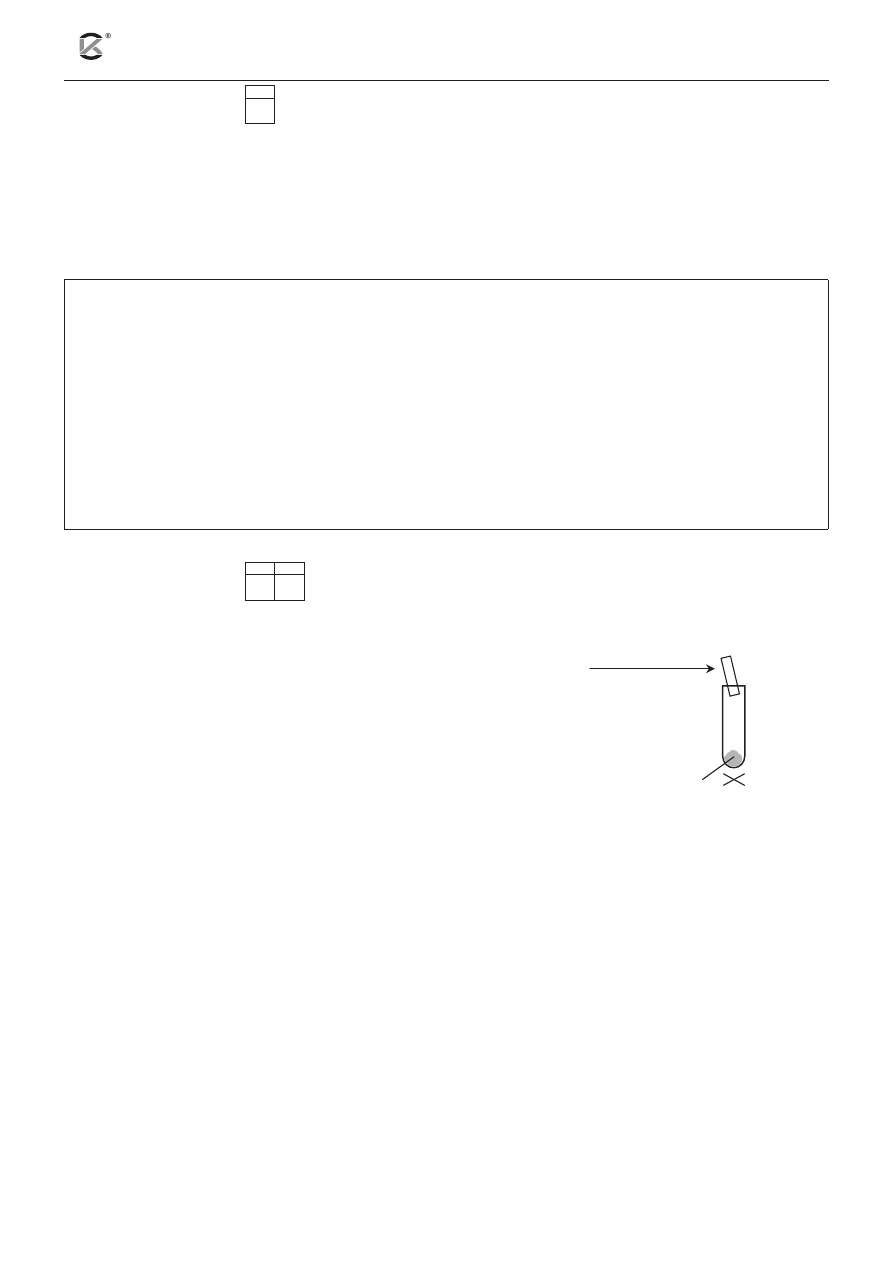
Zadanie 7. (2 pkt)
7.1 7.2
Przeprowadzono doświadczenie według przedstawionego
obok schematu i zanotowano obserwacje.
Obserwacje: Pod wpływem ogrzewania ciało stałe uległo stopieniu,
a umieszczony u wylotu probówki zwilżony uniwersalny papierek
wskaźnikowy zabarwił się na kolor niebieskozielony.
a) Zapisz, stosując wzory półstrukturalne (grupowe) związków organicznych, równanie reakcji, któ-
rej ulega mocznik w przedstawionym doświadczeniu. Posługując się podziałem charakterystycz-
nym dla chemii organicznej, określ typ tej reakcji.
Równanie reakcji: ......................................................................................................................................
Typ reakcji chemicznej: .............................................................................................................................
b) Po przeprowadzeniu powyższego doświadczenia probówkę wraz z zawartością ochłodzono, a następnie
dodano do niej roztwór siarczanu(VI) miedzi(II) i zasady sodowej. Całość wymieszano.
Zapisz obserwacje.
....................................................................................................................................................................
....................................................................................................................................................................
mocznik
zwilżony wodą
uniwersalny papierek
wskaźnikowy
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
5
Zadanie 8. (4 pkt)
8.1 8.2
Glukozę poddano reakcjom według przedstawionego schematu.
OH
OH
OH
H
H
H
H
HO
CH
2
OH
redukcja
X
Y
Z
1
3
2
Cu(OH)
2
, ogrzewanie
Cu(OH)
2
na zimno
C
O
H
a) Podaj wzory (w projekcji Fischera) organicznych produktów oznaczonych na schemacie literami
X i Y.
Związek organiczny X:
Związek organiczny Y:
b) Dla reakcji oznaczonych na schemacie numerami 2 i 3 podaj zmiany, jakie zaobserwowano
w trakcie ich przebiegu.
Reakcja nr 2: ...............................................................................................................................................
Reakcja nr 3: ...............................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
6
Zadanie 9. (2 pkt)
9.1
Cukry proste w stanie stałym występują w postaci dwóch izomerów zwanych anomerami α i β.
Rozpuszczony w wodzie jeden z anomerów przechodzi poprzez formę łańcuchową w drugi anomer, aż do
ustalenia się charakterystycznego dla danego cukru stanu równowagi. Proces ten można zapisać ogólnym
schematem:
anomer
H
2
O
H
2
O
forma łańcuchowa
anomer
Uzupełnij, stosując wzór Fischera dla formy łańcuchowej i wzór Hawortha dla formy pierścieniowej
schemat przemiany β-D-fruktofuranozy w α-D-fruktofuranozę.
OH
H
OH
H
OH
O
H
-D-
fruktofuranoza
-D-
fruktofuranoza
D-
fruktoza
CH
2
OH
CH
2
OH
H
2
O
H
2
O
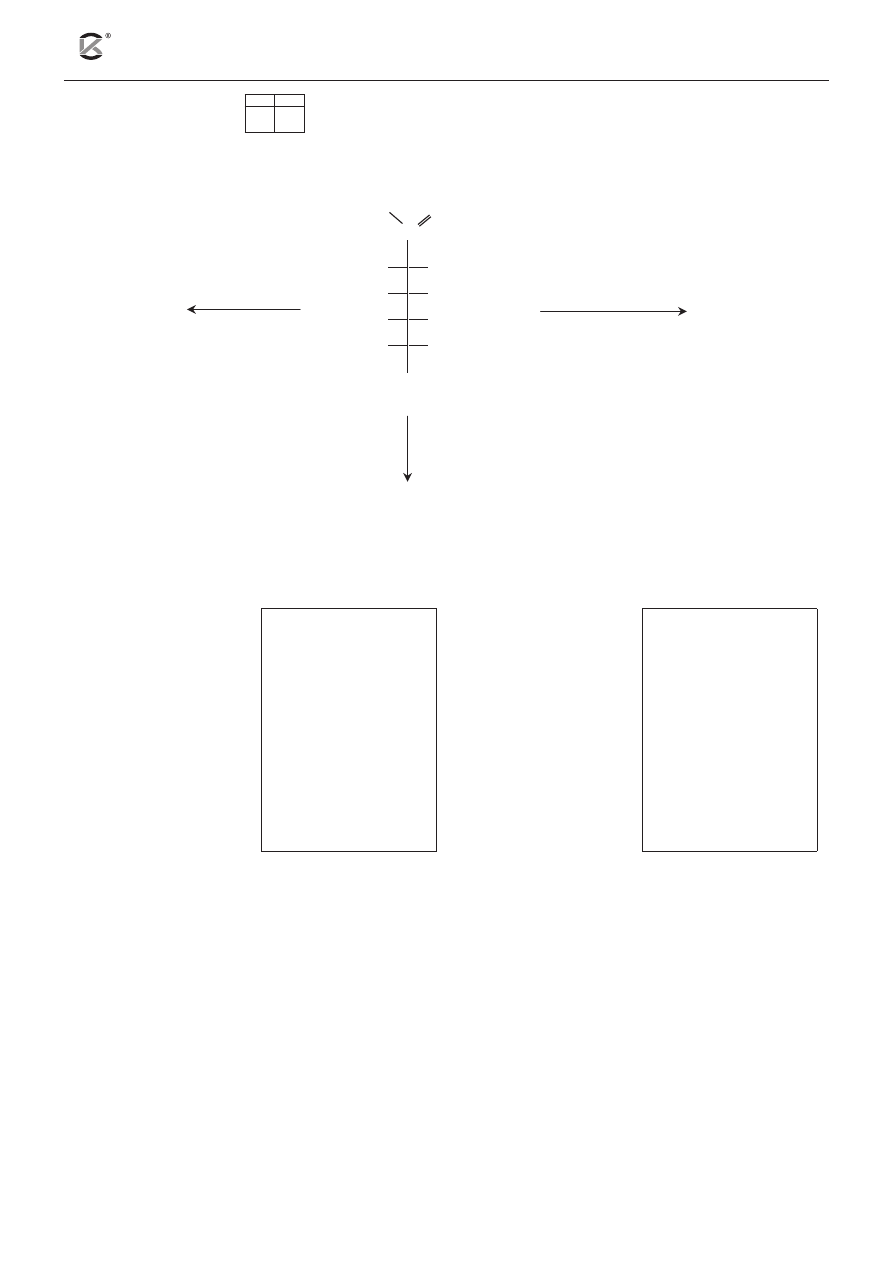
Zadanie 10. (4 pkt)
10.1 10.2 10.3
Glukoza w środowisku wodorowęglanu sodu reaguje z wodą bromową według poniższego schematu:
CH
2
OH–(CHOH)
4
–CHO + Br
2
+ HCO
–
3
→ CH
2
OH–(CHOH)
4
–COO
–
+ Br
–
+ CO
2
+ H
2
O
a) Napisz w formie jonowej z uwzględnieniem pobranych lub oddanych elektronów (zapis jonowo-
-elektronowy) równania procesów redukcji i utleniania.
Równanie procesu redukcji: ............................................................................................................................
Równanie procesu utleniania: .........................................................................................................................
b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym schemacie.
…CH
2
OH–(CHOH)
4
–CHO + …Br
2
+ …HCO
–
3
→ …CH
2
OH–(CHOH)
4
–COO
–
+ …Br
–
+ …CO
2
+ …H
2
O
c) Odpowiedz, czy roztwór fruktozy odbarwi wodę bromową w środowisku wodorowęglanu sodu.
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am or
7
Zadanie 11. (3 pkt)
11.1 11.2
Maltozę hydrolizie poddano. Reakcję przebiegającą według podanego poniżej równania przeprowadzono
do końca. Powstały produkt poddano procesowi fermentacji alkoholowej.
H
+
C
12
H
22
O
11
+ H
2
O
2C
6
H
12
O
6
maltoza
glukoza
a) Napisz, stosując wzory sumaryczne związków organicznych, równanie reakcji fermentacji alko-
holowej glukozy.
Równanie reakcji: .......................................................................................................................................
b) Oblicz, ile gramów maltozy zawierał roztwór, jeżeli w wyniku fermentacji alkoholowej z otrzyma-
nej glukozy wydzieliło się 9,03∙10
23
cząsteczek CO
2
(załóż, że wydajność każdego etapu wynosiła
100%). Wynik podaj z dokładnością do drugiego miejsca po przecinku.
Obliczenia:
Odpowiedź: .................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
organiczna 2 arkusz rs 4 1392901126
obliczenia arkusz rs 5 1392900864
doswiadczenia arkusz rs 6 1392900606
organiczna 2 model rs 4 1392901170
organiczna 1 model rs 3 1392901271
nieorganiczna 2 arkusz rs 2 1392901336
obliczenia arkusz rs 5 1392900864
doswiadczenia arkusz rs 6 1392900606
organiczna 2 model rs 4 1392901170
nieorganiczna 2 arkusz rs 2 1392901336
doswiadczenia arkusz rs 6 1392900606
obliczenia arkusz rs 5 1392900864
doswiadczenia model rs 6 1392900786
obliczenia model rs 5 1392900934
nieorganiczna 2 model rs 2 1392901381
doswiadczenia model rs 6 1392900786
więcej podobnych podstron