
NH
4
NCO
→
H
2
N – CO - NH
2
cyjanian amonu
ogrzewanie
mocznik
H
2
N
\
H
4
N – O – C ≡ N
C = O
/
H
2
N
CH
4
N
2
O
CH
4
N
2
O
Cechy związków nieorganicznych:
występują w minerałach skorupy ziemskiej
stanowią połączenia wszystkich dowolnych pierwiastków
większość wytrzymuje prażenie w wysokich temperaturach
większość jest elektrolitami
Cechy związków organicznych:
występują w roślinach, w organizmach zwierząt i ludzi oraz w
ciałach pochodzenia roślinnego lub zwierzęcego
podstawowym pierwiastkiem jest zawsze węgiel
rozkładają się podczas prażenia
bardzo nieliczne są elektrolitami
Węgiel ma więc obojętny charakter chemiczny i tworzy bardzo trwałe
związki zarówno z elektrododatnim wodorem i z elektroujemnym tlenem. Ten
obojętny charakter węgla jest przyczyną łączenia się atomów węgla ze
sobą w łańcuchy proste lub rozgałęzione stanowiące podstawę budowy
związków łańcuchowych, czyli acyklicznych.
\ /
| |
C
- C – C –
\ / \ /
| |
C - C
- C – C –
/ \
| |
związki pierścieniowe, czyli cykliczne
Niektóre związki organiczne mają budowę mieszaną, ich cząsteczki
zawierają pierścienie oraz łańcuchy:
\ /
C
\ / \ | | |
- C C – C – C – C -
| | | | |
- C - C
| / \
Jeżeli w skład pierścieni wchodzą wyłącznie atomy węgla, związki
nazywamy izocyklicznymi lub karbocyklicznymi.

Znane są również bardzo liczne związki, których podstawę budowy stanowią
pierścienie złożone nie tylko z atomów węgla, ale także różnych od węgla
pierwiastków, najczęściej są to tlen, azot, siarka, ogólnie zwane
heteroatomami. Takie związki nazywamy związkami heterocyklicznymi.
Systematyka związków
Rodniki i grupy czynne:
Podstawowym elementem budowy cząsteczkowej związków organicznych jest
węgiel czterowartościowy. Cztery wartościowości węgla mogą być wysycone
czterema atomami wodoru. Powstają wówczas cząsteczki metanu CH
4
:
H
|
H - C - H
|
H
Dwa atomy węgla mogą połączyć się ze sobą jedną, dwiema lub trzema
wartościowościami:
| |
\ /
- C – C -
C = C
- C ≡ C –
| |
/ \
Do pozostałych wartościowości dołączają się atomy wodoru lub dalsze
atomy węgla.
W ten sposób powstają łańcuchy, które mogą być otwarte lub zamknięte,
proste(normalne) lub rozgałęzione.
Rodniki alkilowe(alkile) – łańcuchy węglowodorowe o jednej wolnej
wartościowości węgla.
metyl CH
3
-
etyl C
2
H
5
-
propyl C
3
H
7
- butyl C
4
H
9
–
Rodniki aromatyczne – są to pierścienie aromatyczne(złożone z węgla i
wodoru) z wolną wartościowością węgla.
fenyl C
6
H
5
-
naftyl C
10
H
7
–
CH – CH
CH - CH
//
\\
// \\
HC
C –
CH
C -
\
/
\ /
CH ≡ CH
C - C
/ \
CH CH
\\ //
CH – CH

Wolne wartościowości rodników są wysycone w związki albo wodoru albo
tzw. grupę czynną, charakterystyczną dla określonego związku.
Grupą czynną w związku organicznym jest ta część cząsteczki, która ulega
reakcjom chemicznym. Np. reakcje alkoholi i kwasów są reakcjami grup –OH
oraz –COOH.
C
2
H
5
-
- OH
rodnik grupa alkoholowa
(etyl) (hydroksylowa)
C
2
H
5
-
- COOH
rodnik
grupa kwasowa
(karboksylowa)
Rodniki alkilowe oznaczamy ogólnym symbolem R, np.
R – OH
oznacza dowolny alkohol
R – COOH oznacza dowolny kwas organiczny
Podstawowa klasyfikacja związków organicznych
Podział według typów budowy:
1.Związki alifatyczne.
W cząsteczkach związków alifatycznych atomy węgla połączone są w
łańcuchy otwarte, np.
CH
3
– CH
2
– CH
2
– CH
3
CH
3
– CH
2
– CH – CH
3
|
CH
3
2.Związki alicykliczne.
Atomy węgla tworzą pierścienie o różnej liczbie atomów: 3, 4, 5 itd.,
np.
H
2
C – CH
2
CH
2
– CH
2
\ /
| |
CH
2
CH
2
– CH
2
cyklopropen (?)
cyklobutan
CH = CH
|
|
CH
2
CH
2
\ /
CH
2
cyklopenten

CH
// \
CH CH
2
| |
CH
2
CH
2
\ /
CH
2
cykloheksen
3.Związki aromatyczne
Podstawowym elementem budowy związków jest pierścień 6-atomowy o trzech
wiązaniach podwójnych. Pierścień ten odznacza się szczególną trwałością.
4.Związki heterocykliczne
Występują pierścienie, w których oprócz atomów węgla znajdują się
również atomy innych pierwiastków, np. tlen, azot.
Podział związków organicznych według stopnia nasycenia i wartościowości.
a)związki nasycone – wszystkie wartościowości wszystkich atomów węgla są
wysycone wartościowościami innych atomów. Wiązania między poszczególnymi
atomami węgla są pojedyncze. W związkach nasyconych atomy pierwiastków
związanych z węglem można podstawiać(wymieniać).
b)związki nienasycone – zachowują się tak jak gdyby niektóre
wartościowości węgla nie były wysycone. Do związków tych można
przyłączać pierwiastki, takie jak wodór, czy chlorowce. Przyłączanie
następuje zawsze do węgli, między którymi istnieje wiązanie podwójne lub
potrójne.
Związki aromatyczne przede wszystkim ulegają reakcjom podstawiania,
jednak w specjalnych warunkach mogą również przyłączać; na tej podstawie
związki aromatyczne można uznać za szczególnie trwałą odmianę związków
nienasyconych. Ze względu na ich szczególne własności wyodrębnia się je
jako odrębny typ związków. Np. chlorowanie benzenu:
H
H
|
|
C
C
// \
// \
H – C C – H
H – C C - Cl
| || + Cl
2
→
| | + HCl
H - C C – H
H – C C - H
\\ /
\\ /
C
C
|
|
H
H
Podstawianie
Podział związków organicznych wg czynnych grup charakterystycznych.

Własności związków organicznych związane są z charakterystycznymi
podstawnikami. Zależnie od obecności podstawników, związki organiczne
łączą się w określone rodziny chemiczne.
a)węglowodory są to związki składające się tylko z C i H. Mogą być
nasycone, nienasycone i aromatyczne. Grupami czynnymi są wyłącznie
wiązania wielokrotne(?). Np.
C
2
H
6
etan,
C
2
H
4
etylen, C
6
H
6
benzen
b)chlorowcopochodne węglowodorów, czyli chlorowcoalkile, są to związki,
które w cząsteczce mają chlorowce(zamiast 1 lub kilku atomów H). Grupą
czynną jest chlorowiec. Np.
C
2
H
5
Cl chloroetan,
CHCl
3
chloroform
c)alkohole – grupa charakterystyczna alkoholi to grupa OH połączona z
węglem. Zależnie od miejsca przyłączenia pierwiastka mogą być I -, II -,
lub III – rzędowe.
d)aldehydy – grupą charakterystyczną jest grupa – CHO
O
//
– C
\
H
e)ketony – grupą charakterystyczną jest grupa ketonowa(karbonylowa)
\
C = O
/
f)kwasy organiczne – grupą charakterystyczną jest grupa karboksylowa.
Wodór grupy – COOH dysocjuje w słabym stopniu jako kation.
O
//
– C
\
H
g)estry – pochodne kwasów i alkoholi. Wodór i grupa OH odczepiają się i
powstaje związek analogiczny do soli: zamiast metalu w kwasie jest
rodnik organiczny. Grupą charakterystyczną jest – COOR, gdzie R oznacza
rodnik alkilowy. Estry nie dysocjują.
h)etery – grupą charakterystyczną jest tlen pomiędzy dwoma rodnikami
alkilowymi. Np.
CH
3
– O - CH
3
eter dimetylowy
C
2
H
5
– O - CH
3
eter metyloetylowy
C
2
H
5
– O – C
2
H
5
eter dietylowy

i)aminy – są to związki zawierające azot. Grupy charakterystyczne zależą
od rzędowości aminów:
aminy I – rzędowe - NH
2
\
aminy II – rzędowe
NH
/
\
aminy III – rzędowe
NH
//
Np.
CH
3
NH
2
metyloamina,
(CH
3
)
2
NH dimetyloamina
j)cyjanki, czyli nitryle – związki zawierające azot potrójnie związany z
węglem. Grupa charakterystyczna to grupa nitrylowa – C ≡ N
k)związki nitrowe(nitrozwiązki) – grupą charakterystyczną nitrozwiązków
jest – NO
2
. Nitrozwiązki są bardzo pospolitymi pochodnymi związków
aromatycznych. Np. nitrobenzen
CH
/ \
CH \
| \
CH C – NO
2
\\ |
CH – CH
Hydroksykwasy, czyli alkoholokwasy zawierają równocześnie grupy kwasowe
i alkoholowe.
Aminokwasy oprócz grupy kwasowej zawierają grupę aminową. Np.
CH
3
CHNH
2
COOH kwas α-aminopropionowy
SZEREG HOMOLOGICZNY – jest to zbiór związków tego samego typu,
uporządkowanych wg wzrastającej liczby atomów węgla w cząsteczce. Każdy
następny człon szeregu różni się od poprzedniego o grupę – CH
2
-.
Własności fizyczne zmieniają się w miarę wzrostu ciężaru cząsteczkowego.
O
2
Substancja organiczna (C,N,H) ----------> CO
2
+ H
2
O + NO
CuO, PbCrO
4
, CeO
2
PbCrO
4
– chromian potasu
W celu ustalenia wzoru chemicznego analizowanego związku, zawartość
procentową składników dzieli się przez ich masy atomowe określając w ten
sposób stosunek liczby atomów poszczególnych pierwiastków.

Zadanie:
W wyniku analizy elementarnej bezbarwnej krystalicznej substancji
ustalono następujący skład procentowy próbki: 20,23 % C, 6,71 % H,
46,63 % N, 27,23 % O
20,33 / 12,01 = 1,68 C
6,71 / 1 = 6,66 H
46,63 / 14,01 = 3,33 N
27,23 / 16 = 1,70 O
C : H : N : O
1,68 : 6,66 : 3,33 : 1,70 / : 1,68
1 : 4 : 2 : 1
Obliczony stosunek atomu odpowiada składowi:
C
1
H
4
N
2
O
1
– wzór elementarny(empiryczny)
Dla ustalenia rzeczywistego wzoru sumarycznego konieczna jest znajomość
masy cząsteczki, pozwala na ustalenie wartości liczby x.
(C
1
H
4
N
2
O
1
)
x
M
cząst x
= 60u
x = 60u / 12u + 4u + 28u +16u = 60u / 60u = 1
Wzór elementarny jest równy wzorowi sumarycznemu.
CH
4
N
2
O – mocznik
H
2
N
\
C = O
/
H
2
N
Wzór sumaryczny substancji podaje nam rodzaj i liczbę atomów obecnych w
cząsteczce, nie wystarcza natomiast do napisania wzoru strukturalnego.
C
2
H
6
O
H H
| |
H – C – C – OH
| |
H H
alkohol etylowy (temp. wrzenia 78,5º C)
H H
| |
H – C – C – OH
| |
H H
eter dimetylowy (temp. wrzenia -23,6º C)

Cztery podstawowe reakcje:
Normalną konsekwencja złożonej i różnorodnej budowy związków
organicznych jest uderzająca wielka rozmaitość ich przemian chemicznych.
Mimo ich wielkiej różnorodności przemiany chemiczne związków
organicznych sprowadzają się do zaledwie czterech elementarnych reakcji.
Są to:
1)Reakcje addycji(przyłączania):
W reakcji przyłączania z dwóch cząsteczek powstaje jedna. W najczęściej
spotykanych przypadkach substratami są związki nienasycone:
CH
2
= CH
2
+ X – Y -> XCH
2
– CH
2
Y
Nie jest możliwe przedstawienie addycji za pomocą jednego ogólnego
schematu uwzględniającego wszystkie spotykane przypadki; dla porównania
budowy substratu i produktu pozwala zawsze na łatwe rozpoznawanie tej
reakcji.
2)Reakcje substytucji(podstawienia):
Są to reakcje wymiany podstawników, przebudowanie wg następującego
schematu:
R – X + Y -> R – Y + X
Symbolem R oznacza się grupy charakterystyczne. Nazwa podstawnik odnosi
się do dowolnego atomu lub grupy atomów połączonych z atomów węgla lub
innych pierwiastków.
CH
3
– Br + CN
-
-> CH
3
– CN + Br
-
bromek metylu cyjanek metylu
3)Reakcje eliminacji:
W najczęściej spotykanych reakcjach eliminacji następuje odłączenie
dwóch podstawników i powstanie produktów z wiązaniami podwójnymi.
X – CH
2
– CH
2
– Y -> CH
2
= CH
2
+ X – Y
CH
3
– CH
2
– Br +OH
-
-> CH
2
= CH
2
+ H
2
O + Br
-
Eliminacja jest reakcją odwrotną do addycji.
4)Reakcje przegrupowania:
Produktami przegrupowań są izomery substratów. Bardzo prostym przykładem
przegrupowań jest izomeracja 1-chloropropanu do 2-chloroporpanu,
katalizowana przez chlorek glinu:
AgCl
3
CH
3
CH
2
CH
2
Cl -----> CH
3
CHCH
3
|
Cl
Przegrupowania są zazwyczaj reakcjami złożonymi prowadzącymi do
rozległych zmian strukturalnych.
HOMOLITYCZNY I HETEROLITYCZNY ROZPAD WIĄZAŃ:
W rozpadzie wiązań homolitycznym para elektronów tworzących wiązanie
zostaje rozdzielona i powstają fragmenty zawierające po jednym
niesparowanym elektronie:
X : Y -> Xº + Yº
W rozpadzie heterolitycznym para elektronów pozostaje w całości przy
jednym z fragmentów:
X : Y -> Xº + Y
-

Sposób rozpadu wiązań leży u podstaw podziału reakcji związków
organicznych na reakcje jonowe i rodnikowe.
Wolne rodniki – fragmenty cząsteczek powstających w wyniku
homolitycznego rozpadu wiązań. Są to zazwyczaj nietrwałe struktury o
czasie życia rzędu tysięcznych części sekundy. Cechą wyróżniającą
rodniki jest obecność niesparowanych elektronów.
Wolne rodniki są produktami pośrednimi reakcji homolitycznych. Np.
CH
3
– CH
3
-> 2CH
3
rodnik metylowy
Karbokationy – jony z ładunkiem dodatnim przy atomie węgla.
Jony takie powstają w wyniku heterolitycznego rozpadu wiązań, gdy grupa
odchodząca oddala się razem z parą elektronów.
Grupami odchodzącymi nazywamy te podstawniki w cząstkach substratów,
które w wyniku reakcji oddalają się od atomu węgla.
(CH
3
)
3
C – X -> (CH
3
)
3
C
+
+ X
-
grupa odchodząca
karbokation t-butylowy
CH
2
= CH
2
+ X
+
-> X – CH
2
– CH
2
+
Karboaniony – jony z ładunkiem ujemnym przy atomie węgla.
Heteroliza wiązań z pozostawieniem pary atomów przy atomie węgla
prowadzi do powstania karboanionów.
CHCl
3
+ OH
-
-> CCl
3
-
+ H
2
O
karboanion trichlorometylowy
Karboaniony tworzą się wtedy, gdy związki reagują z dostatecznie silnymi
zasadami.
Hybrydyzacja sp
3
Gdy jeden elektron orbitalu s pod działaniem energii uwalniającej się w
trakcie reakcji wiązania się atomu węgla z innym atomem przemieszcza się
do nieobsadzonego orbitalu p, w skutek czego powstaje układ złożony z
jednego orbitalu s i trzech orbitali p:
s p p p
Orbitale te mieszają się ze sobą, czyli ulegają hybrydyzacji, tworzą się
cztery nowe identyczne orbitale hybrydyzowane.
Taka hybrydyzacja zmienia kształt orbitali. W hybrydyzowanych orbitalach
pośredni jest zarówno kształt jak i kierunek w przestrzeni w stosunku do
orbitali składowych.
↑↓↑↑ → ↑↑↑↑
s
2
p
2
sp
3
niehybrydyzowany atom węgla -> atom węgla w stanie hybrydyzacji sp
3
W tej konfiguracji cztery orbitale (s,p
x
,p
y
,p
z
) są teraz obsadzone
pojedynczymi elektronami, co wyjaśnia możliwość tworzenia się czterech
nasyconych wiązań
Orbitale molekularne(cząsteczkowe) podobnie jak w obrębie jednego i tego
samego atomu, mogą ulegać hybrydyzacji także orbitale dwóch lub więcej
atomów tych samych lub różnych pierwiastków, co prowadzi do powstania
wiązania chemicznego między atomami.

Wiązanie σ i wiązanie π.
Każdy atom węgla niezależnie od typu hybrydyzacji zdolny jest do
utworzenia czterech wiązań, jednak charakter wiązania ulega zmianie w
zależności od tego czy w jego tworzeniu bierze udział hybrydyzowany czy
niehybrydyzowany atom. Na tej podstawie rozróżniamy dwa typy wiązań
pomiędzy atomami węgla: wiązanie σ, w którego tworzeniu bierze udział
hybrydyzowany orbital atom węgla i wiązanie π, które powstaje przy
udziale niehybrydyzowanych orbitali atomowych.
Wiązanie między atomami jest tym silniejsze im bardziej nakładają się
nawzajem biorące w nim udział orbitale atomu.
W przypadku, gdy warunek nie jest spełniony, powstaje wiązanie π.
Wiązanie π tworzy się we wszystkich przypadkach, gdy nie ma warunków do
powstania trwalszego od niego wiązania σ.
Omów hybrydyzację metanu.
Cząsteczka metanu powstaje w wyniku hybrydyzacji czterech orbitali 1s
należących do czterech atomów wodoru i czterech hybrydyzowanych orbitali
atomu węgla typu sp
3
. Cząsteczka metanu zawiera zatem cztery wiązania σ.
ETAN: sześć orbitali 1s atomów wodoru i sześć orbitali typu sp
3
tworzą
jedno wiązanie C – C typu β. Razem cząsteczka etanu zawiera siedem
wiązań σ, tj. sześć wiązań C – H i jedno wiązanie C – C.
Tworzenie orbitali cząsteczkowych przez dwa atomy węgla w stanie
hybrydyzacji sp
3
.
Trzy orbitale biorące udział w hybrydyzacji sp
2
są zdolne do utworzenia
trzech orbitali cząsteczkowych σ.
Każdy z dwóch atomów węgla w stanie hybrydyzacji sp
3
tworzy jeden orbital
cząsteczkowy σ C – C, po dwa orbitale cząsteczkowe σ C – H.
Pozostałe niehybrydyzowane orbitale p, prostopadłe do płaszczyzny
orbitali o hybrydyzacji sp
2
, zdolne są do utworzenia orbitali
cząsteczkowych σ, ponieważ są do siebie równoległe.
Niezhybrydyzowane orbitale p rozciągają się w przestrzeni leżącej
powyżej i poniżej płaszczyzny wiązania σ.
Powstawanie wiązań walencyjnych σ i π w cząsteczce C
2
H
4
.
Sp
2
W zawierającej dwa atomy węgla cząsteczce etanu 4 orbitale atomowe 1s
wodoru nakładają się na 4 hybrydy sp
2
, łączą się ze sobą wzdłuż wspólnej
osi dając wiązanie C – C typu σ.
Pozostają 2 orbitale p, których osie są do siebie równoległe i tworzą
wiązanie typu π.
Sp
Atom węgla w stanie hybrydyzacji sp jest zdolny do utworzenia dwóch
orbitali cząsteczkowych σ i dwóch orbitali cząsteczkowych π, ponieważ
posiada dwa niehybrydyzowane orbitale p. W cząsteczce o wzorze C
2
H
2
występują więc dwa wiązania σ C – C i dwa wiązania π.

H – C ≡ C – H
C
2
H
2
W zawierającym dwa atomy węgla acetylenie dwa wiązania C – H typu σ
powstają wskutek nakładania się orbitali 1s dwóch atomów wodoru i dwóch
orbitali atomów węgla typu sp.
Wiązania pomiędzy atomami węgla, na które składają się elektrony w
orbitalu cząsteczkowym σ i dwóch orbitali cząsteczkowych π nazywamy
wiązaniem potrójnym.
WĘGLOWODORY:
związki, w skład których wchodzą wyłącznie atomy węgla i wodoru.
Dzielimy je na:
a) węglowodory alifatyczne(alkany, alkeny, alkiny i cykloalkany)
b) węglowodory aromatyczne
Węglowodory nasycone – alkany
1) węglowodory o budowie łańcuchowej – alkany C
n
H
2n+2
(o łańcuchach
prostych n-alkany; o łańcuchach rozgałęzionych)
2) węglowodory o budowie pierścieniowej – cykloalkany C
n
H
2n
(bez
bocznych łańcuchów; z bocznymi łańcuchami).
Alkany zawierają tylko wiązania pojedyncze.
SZEREG HOLOGICZNY
CH
4
– metan
C
2
H
6
– etan
C
3
H
8
– propan
C
4
H
10
– butan
C
5
H
12
– pentan
C
6
H
14
– heksan
C
7
H
16
– heptan
C
8
H
18
– oktan
C
9
H
20
– nonan
C
10
H
22
– dekan
C
11
H
24
– undekan
C
12
H
26
– dodekan
C
13
H
28
– tridekan
C
14
H
30
– tetradekan C
15
H
32
– pentadekan
C
16
H
34
– heksadekan C
17
H
36
– heptadekan C
18
H
38
– oktadekan
C
19
H
40
– nonadekan
C
20
H
42
– ejkozan
Szereg homologiczny – grupa związków o podobnej budowie.
Metan – strukturę metanu można utworzyć poprzez ułożenie czterech
orbitali sp
3
węgla z orbitalami 1s czterech atomów wodoru. Utworzona
cząsteczka ma kształt czworościanu foremnego.
Właściwości fizyczne i chemiczne metanu:
- główny składnik gazu ziemnego
- występuje z ropą i w złożach węgla kamiennego
- bezbarwny
- bezwonny
- palny
- dwa razy lżejszy od powietrza
CH
3
COONa + NaOH → CH
4
↑ + Na
2
CO
3
CH
4
+ 2O
2
→ CO
2
+ H
2
O
CH
4
+ 3/2O
2
→ CO + 2H
2
O
CH
4
+ O
2
→ C + 2H
2
O
Metan jest związkiem biernym chemicznie, wynika to z charakteru wiązań
C – H. Elektroujemności węgla i wodoru są bardzo zbliżone (C – 2,5 ;
H – 2,1), w związku z czym wiązanie C – H jest wiązaniem kowalencyjnym

bardzo słabo spolaryzowanym. Takie wiązania są często bardzo trwałe
chemicznie.
Metan reaguje tylko z reaktywnymi(?) fluorowcami(niezbędne jest
światło).
H H
| światło |
H – C – H + Br – Br → H – C – Br + HBr
| |
H H
metan brom bromometan bromowodór
lub w miejsce Br wstawiamy Cl
Reakcje chlorowania metanu.
1.Rozerwanie wiązania w cząsteczce chloru z utworzeniem dwóch atomów
chloru wymaga dostarczenia energii w formie światła lub ogrzania do
odpowiednio wysokiej temperatury. Atomy chloru zawierają 7 elektronów
walencyjnych czyli jeden z nich jest niesparowany. Cząstka taka,
zawierająca niesparowany elektron, nosi nazwę rodnika.
Rodniki odznaczają się wysoką reaktywnością, ponieważ niesparowany układ
elektronów jest niekorzystny energetycznie. Atom chloru atakuje
cząsteczka metanu, odrywając od niej atom wodoru z jednym elektronem,
dając rodnik metylowy CH
3
oraz cząsteczkę chlorowodoru.
Rodnik metylowy reaguje z cząsteczką chloru tworząc cząsteczkę
chlorometanu i odtwarzając rodnik chloru. Reakcje tworzą łańcuch,
ponieważ w każdej z nich powstaje rodnik będący substratem w następnej
reakcji. Teoretycznie więc po wytworzeniu na początek jednego rodnika
chloru reakcja może przebiegać dalej samorzutnie aż do wyczerpania
substratów.
W praktyce zachodzą jednak reakcje między rodnikami, w wyniku których
liczba rodników obecnych maleje w układzie i wymaga odtworzenia. W
wyniku reakcji dwóch rodników metylowych powstaje etan. Wykrycie
obecności etanu stanowi dowód na przebieg takich reakcji. Mechanizm
reakcji chlorowania metanu jest przykładem reakcji łańcuchowego
chlorowania metanu.
Izomeria łańcuchowa.
Ważną cechą wiązania pojedynczego C – C jest to, że połączone z nim
atomy mogą obracać się względem siebie tak jakby wiązanie było osią
obrotu.
Uproszone wzory strukturalne alkanów:
C
4
H
10
CH
3
– CH
2
– CH
2
– CH
3
n – butan(poprzedza nazwę, gdy łańcuch jest prosty)
CH
3
– CH – CH
3
|
CH
3
izobutan(jeśli rozgałęziony jest tylko jeden)
Izomeria – zjawisko występowania związków organicznych o tym samym
wzorze sumarycznym, lecz innej budowie cząsteczki.

Izomeria łańcuchowa polega na występowaniu związków o tym samym składzie
pierwiastkowym, a co za tym idzie, o tej samej masie cząsteczkowej, lecz
o różnej budowie łańcucha.
Neo(?) – jeden z atomów węgla, związany jest z czterema innymi atomami
węgla.
Swobodny obrót wokół wiązania pojedynczego C – C w pierścieniu jest
zahamowany, gdyż musiałby prowadzić do zrywania i odtwarzania
pozostałych wiązań w pierścieniu. Jeśli przyjąć, że pierścień tworzy
jedną płaszczyznę, to łatwo wyobrazić sobie, że pozostałe wiązania
każdego węgla tworzą płaszczyzny prostopadłe do płaszczyzny pierścienia.
Można więc podzielić te wiązania na dwie grupy leżące nad i pod
płaszczyzną pierścienia.
Wyobraźmy sobie teraz strukturę 1,2 – dimetylocyklopentanu. Grupy
metylowe mogą leżeć po tej samej stronie płaszczyzny pierścienia lub po
stronie przeciwnej.
Otrzymamy w ten sposób dwa izomery dimetylocyklopentanu. Taki typ
izomerii nazywa się izomerią geometryczną, a związki – izomerami
geometrycznymi.
Izomer, w którym dwie grupy metylowe leżą po tej samej stronie
płaszczyzny pierścienia nazywamy izomerami cis(?), a izomery, w których
grupy metylowe leżą po przeciwnej stronie płaszcza pierścienia –
izomerami trans.
Węglowodory nienasycone – węglowodory zawierające w cząsteczce wiązania
podwójne lub potrójne C – C:
1)
alkeny C
n
H
2n
2)
alkiny C
n
H
2n-2
3)
węglowodory z wieloma
wiązaniami podwójnymi lub potrójnymi
Węglowodory łańcuchowe, których cząstki zawierają dwa atomy węgla
hybrydyzowane sp
2
, zaliczamy do alkenów. Nazwy alkenów tworzy się od
nazwy alkanów o tej samej liczbie atomów węgla w cząsteczce, zmieniając
końcówkę z -an na –en.
Jeśli w łańcuchu węglowym obecne są dwa wiązania podwójne, związki
nazywamy alkadienem(?) lub dienem(?).
Dodatkowo musimy uwzględnić w nazwie obecność wiązania nienasyconego w
związku z czym:
najdłuższy łańcuch węglowy
wybiera się tak, by obejmował jak największą liczbę wiązań
nienasyconych, a do nazwy dodaje się końcówkę –en(wiązanie
podwójne) lub –in, -yn(wiązanie potrójne).
położenie wiązania
nienasyconego w łańcuchu węglowym oznacza się numerem węgla, od
którego się zaczyna.

węgle łańcucha głównego
numeruje się w taki sposób, by liczba oznaczająca położenie
wiązania nienasyconego była jak najmniejsza.
liczbę wiązań nienasyconych
określa się łacińskim przedrostkiem di-, tri-, itp.
Przedstawicielem alkenów jest eten(etylen), zawiera on dwa atomy węgla w
stanie hybrydyzacji sp
2
, czyli dwa atomy węgla połączone wiązaniem
podwójnym.
H H
\ /
C = C
/ \
H H
C
2
H
4
- eten
Wzór sumaryczny alkenów: C
n
H
2n
H
2
C = CH
2
eten
H
2
C = CH – CH
3
propen
H
2
C = CH – CH
2
– CH
3
1 butan
H
2
C = CH – CH
2
– CH
2
– CH
3
1 penten
H
2
C = CH – (CH
2
)
x
– CH
3
1 alken
H
2
C – CH = CH – CH
3
2 buten
Związek taki nosi nazwę 2 – buten dla zaznaczenia, że wiązanie podwójne
zaczyna się od atomu węgla 2.
Na podstawie badań fizykochemicznych ustalono, że wszystkie atomy,
tworzące cząsteczkę etylenu, leżą w jednej płaszczyźnie, a kąty między
wiązaniami C – C – H i H – C – H są równe 120º.
Bardzo ważną cechą wiązania podwójnego, decydującą o jego właściwościach
fizycznych jest nierówno(?) obu par elektronowych tworzących to
wiązanie. Jedna z nich ma charakter zbliżony do wiązania pojedynczego w
alkenach, w związku z czym bardzo trudno ulega rozerwaniu. Druga para
rozrywa się znacznie łatwiej dzięki czemu etylen łatwo ustępuje w
reakcjach chemicznych.
CH
2
= CH
2
+ Br
2
→ Br – CH
2
– CH
2
– Br
1, 2 dibromoetan
Oprócz fluorowców jest wiele substancji, które mogą przyłączać się do
wiązania podwójnego C = C. Należą do nich między innymi chlorowodór,
bromowodór oraz H
2
O.
CH
2
= CH
2
+ HBr → CH
3
– CH
2
– Br
bromoetan
CH
2
= CH
2
+ HBr → CH
3
– CH
2
– OH
etanol
W odpowiednich warunkach ciśnienia i temperatury etylen może reagować
sam ze sobą, przy czym jego cząsteczki łączą się w długie łańcuchy,
zawierające tylko wiązania pojedyncze – polietylen.
Reguła pozwalająca przewidzieć kierunek przyłączenia wodoru nosi nazwę
reguły Markownikowa.

Alkiny
Węglowodory łańcuchowe, których cząsteczki zawierają dwa atomy węgla w
stanie hybrydyzacji sp.
Nazwy alkinów tworzy się od nazw alkanów o tej samej liczbie atomów
węgla w cząsteczce zmieniając końcówkę –an na –yn.
Cechą charakterystyczną alkinów jest obecność w ich cząsteczce
potrójnego wiązania – C ≡ C -.
Alkiny tworzą szereg homologiczny, którego przedstawicielem jest
etyn(acetylen).
H – C ≡ C – H etyn(acetylen)
H
3
C – C ≡ C – H propyn
H
3
C – CH
2
– C ≡ C – H 1-butyn
CH
3
– C ≡ C – CH
3
2-butyn
Węglowodory aromatyczne(areny)
Związki aromatyczne to substancje, których cząsteczki mają budowę
pierścieniową(cykliczną) i zawierają wiązanie zdelokalizowane, łączące
wszystkie atomy tworzące pierścień. Dzielą się na: węglowodory
aromatyczne oraz aromatyczne związki heterocykliczne.
Benzen C
6
H
6
Benzenu nie można zaliczyć do węglowodorów nienasyconych, ponieważ nie
reaguje on z wodą bromową i roztworem KMnO
4
.
Właściwości chemiczne benzenu różnią się zarówno od właściwości alkanów,
jak i alkenów. Przyczyną tego jest specyficzna budowa cząsteczkowa
benzenu. Benzen reaguje z Br w obecności katalizatora(np. FeBr
3
) dając
bromobenzen i bromowodór:
Br
|
FeBr
3
+ Br
2
→ + HBr
Jest to reakcja podstawienia wodoru atomem fluorowca. W odróżnieniu
jednak od podobnej reakcji, której ulegają alkany, rekacja benzenu z Br
może zachodzić w ciemności, ale wymaga użycia katalizatora. Przyczyną
jest odmienny mechanizm tych reakcji.
Drugą ważną reakcją charakterystyczną dla benzenu jest reakcja ze
stężonym kwasem azotowym(V), zachodzi szczególnie łatwo w obecności
stężonego kwasu siarkowego(VI).
NO
2
|
H
2
SO
4
+ HNO
3
→ + H
2
O

benzen nitrobenzen
Reakcja ta polega podstawieniu atomu wodoru grupą nitrową NO
2
. Jest to
reakcja nitrowania.
W odpowiednich warunkach(wysoka temperatura i ciśnienie oraz
katalizator) benzen ulega reakcji uwodornienia.
kat(Ni)
+ 3H
2
→
2,5 MPa
200º
benzen cykloheksan
Produktem tej reakcji jest cykloheksan. Benzen ulega uwodornieniu
znacznie trudniej niż alkeny.
Kwas siarkowy w podwyższonej temperaturze sulfonuje benzen i inne areny
tworząc jako produkty reakcji kwasy sulfonowe:
SO
3
H
obeum /
+ H
2
SO
4
→ + H
2
O
kwas benzenosulfonowy
Podstawienie grupy alkilowej do pierścienia benzenowego uzyskuje się w
reakcji pomiędzy związkiem aromatycznym i halogenkiem alkilowym:
R
AlCl
3
/
+ R - CL
→ + HCl
Homologi benzenu:
Najbliższym homologiem benzenu jest metylobenzen, zwany toluenem, a
następnym zawierającym zamiast grupy metylowej grupę etylową –
etylobenzen.
CH
3
CH
2
– CH
3
|
|
toluen
etylobenzen
W zależności od tego, który atom wodoru zastąpimy grupą metylową
otrzymamy wzór jednego z trzech izomerycznych dimetylobenzenów,
nazywanych zwyczajowo ksylenami:
CH
3
CH
3
| CH
3
|
/
\
CH
3
1, 2 – dimetylobenzen(orto-ksylen) 1, 3 – dimetylobenzen(meta-ksylen)
CH
3
|
|
CH
3
1, 4 dimetylobenzen(para-ksylen)
Nazwa grupa arylowa oznacza jednowartościową grupę utworzoną przez
oderwanie od pierścienia aromatycznego jednego atomu wodoru.
Najprostszym przykładem grupy arylowej jest grupa fenylowa.
Izomeria związków aromatycznych wynika z:
różnych podstawień pierścienia aromatycznego; w przypadku benzenu
prowadzi to do izomerów orto-, meta- i para-. Ten rodzaj izomerii
nazywamy izomerią położenia.
różnej budowy reszt alkilowych lub sposobu ich podstawienia.
CH
2
– CH
2
– CH
3
/
n – propylobeznen
CH
3
/
CH
/ \
CH
3
izopropylobenzen
ze sposobu ułożenia pierścieni skondensowanych w związkach
wielopierścieniowych – izomeria pierścieniowa(antracen i fenatren)

Przedrostek orto odnosi się do izomeru, w którym podstawniki znajdują
się przy sąsiednich atomach węgla. Izomer meta charakteryzuje się
układem, w którym podstawiony atom węgla oddziela jeden atom
niepodstawiony. W izomerze para podstawniki występują przy
przeciwległych atomach węgla.
Jeśli wyjściowy aren zwiera już jakiś podstawnik wówczas wyróżnić można
trzy nierówno cenne pozycje, w których może zostać podstawiony następny
podstawnik.
Grupa metylowa i inne grupy alkilowe powodują podstawienia w pozycji
orto-, para-, grupa o takim działaniu nosi nazwę I rodzaju.
1. Kierunek podstawienia zależy wyłącznie od rodzaju podstawienia
znajdującego się w układzie.
2. Podstawniki I rodzaju ułatwiają podstawienie, uaktywniając pozycję
orto- i para-.
3. Podstawniki II rodzaju zubażają pierścień aromatyczny w elektrony,
dezaktywują pozycje orto- i para- umożliwiając reakcje w pozycji
meta-.
4. Jeśli w układzie benzenu znajdują się dwa podstawniki różnego
rodzaju, to o kierunku podstawienia decyduje podstawnik I rodzaju,
ponieważ on aktywuje pierścień.
Związki aromatyczne, jako grupy, nazywane są arenami, a pozbawiony
jednego wodoru aren to aryl.
Pierścień benzenowy pozbawiony jednego atomu wodoru nazywa się fenylem
Własności fizyczne
Węglowodory aromatyczne są cieczami lub ciałami stałymi,
nierozpuszczalnymi w wodzie, świetnie rozpuszczającymi się w eterze,
chloroformie i acetonie. Same są również dobrymi rozpuszczalnikami
substancji organicznych. Najczęściej wykazują działanie toksyczne i
powinno unikać się wdychania par.
Lotne areny są łatwopalne i palą się kopcącym płonieniem.
Własności chemiczne:
1.Reakcje podstawienia w pierścieniu aromatycznym: reakcja nitrowania,
reakcja bromowania i reakcja chlorowania
2.Reakcje uwodornienia(zachodzą bardzo trudno w odróżnieniu od
analogicznej reakcji alkenów).
Ropa naftowa – destylacja
Pierwszym etapem przeróbki wstępnie oczyszczonej ropy(odgazowanej i
odwodnionej) jest destylacja frakcyjna. Polega ona na rozdzieleniu ropy
na grupy składników(frakcje) – z wykorzystaniem różnic temperatur
wrzenia tych składników.
Najwyżej odbiera się frakcję benzynową(40 - 180º). Następną frakcją jest
nafta(180 - 280º). Kolejną – olej napędowy(280 - 350º). Powyżej 350º
otrzymujemy składniki zwane mazutem. W wyniku destylacji mazutu
uzyskujemy oleje smarowe.
Benzyna – mieszanina węglowodorów zawierających od 5 do 10 atomów węgla
w cząsteczce.
Aldehydy:
W cząsteczkach aldehydów grupa karboksylowa połączona jest z atomem
wodoru.
O O
// //
R – C - C grupa aldehydowa
\ \ (formylowa)
H H
O O
//
2
1
//
H – C metanal CH
3
– C etanal
\ \
H H
O
4
3
2
1
//
CH
3
– C
C – C 2 butynal
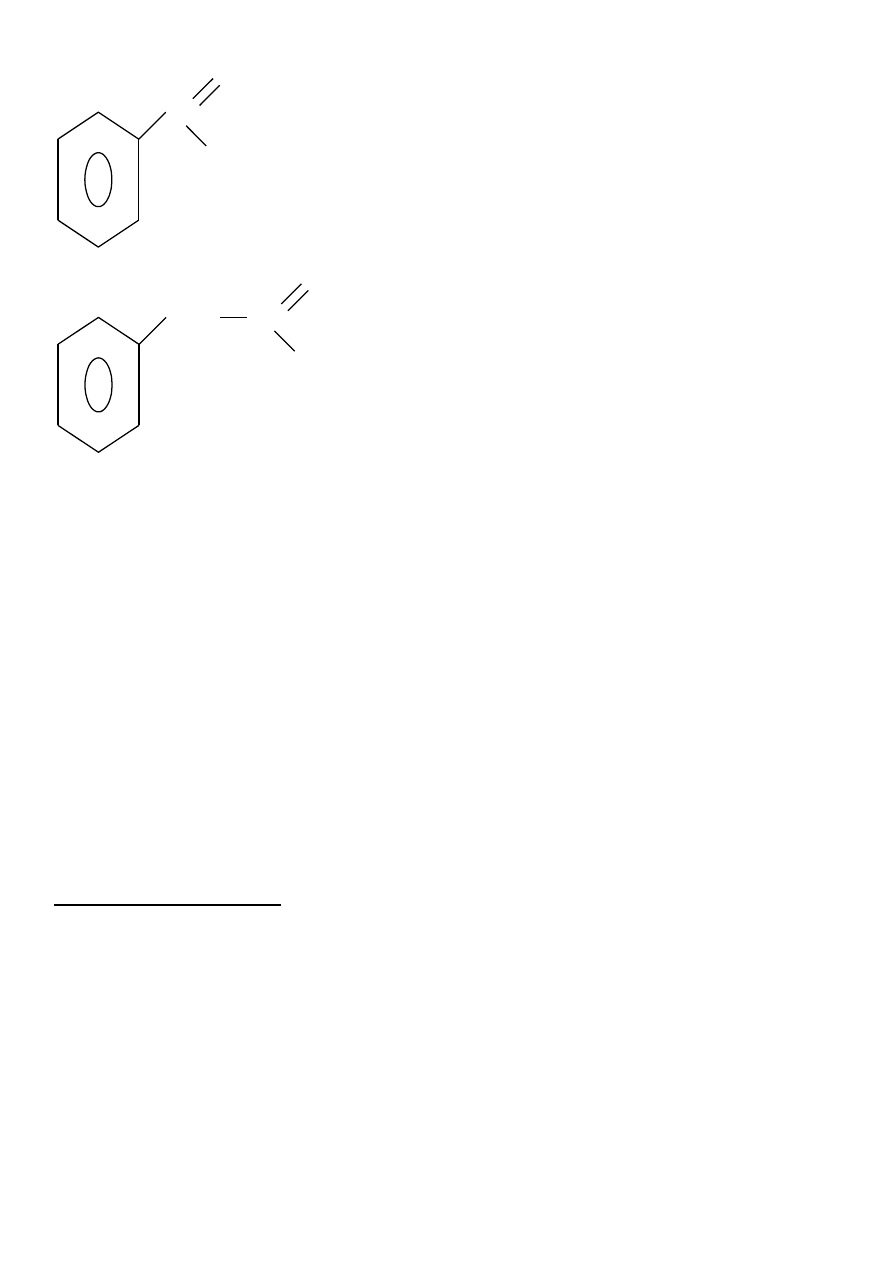
\
H
C
O
H
cykloheksanokarboaldehyd
C
O
H
benzenokarboaldehyd
CH
2
O
H
C
fenyloetanal
O O
\\ //
C – CH
2
- CH
2
– C butanodial
/ \
H H
O
//
CH
2
= CH – C propenal
\
H
Aldehydy alifatyczne:
C
n
H
2n+1
CHO
Reakcje charakterystyczne:
o reakcje utleniania do kwasów karboksylowych
O O
// [o] //
R – C
R – C [o] – ogólny symbol
\ \ czynnika utleniającego
H O – H

o Próba Tollensa (ważne – umieć!)
O O
// //
R – C + Ag
2
O + OH
-
R – C + 2Ag
+ H
2
O
\ \
H O
-
o Próba Trommera (ważne – umieć!)
O O
// //
R – C + 2Cu(OH)
2
+ OH
-
R – C + Cu
2
O
+ 3H
2
O
\ \
H O
-
o reakcje redukcji do alkoholi I-rzędowych
O
// [H] [H] – ogólny symbol
R – C
R – CH
2
– OH czynnika redukującego
\
H
O
// kat.
R – C + H
2
R – CH
2
– OH
\
H
Innym przykładem właściwości aldehydów jest obecność podwojnego
wiązania C = O (warunkuje ich zdolność do polimeryzacji).
O
//
nH - C + H
2
O
H – [-O–CH
2
-]n - OH
\
H
Ketony:

W cząsteczkach ketonów grupa karboksylowa połaczona jest z dwiema
resztami węglowodorowymi.
O
C
/ \
R
1
R
2
R
1
,R
2
- grupy alkilowe lub arylowe
O
C
2
propenon
1
/ \
3
CH
3
CH
3
O
1
2
C – CH
3
4
3
/ 3buten-2on
CH
2
– C
\
H
O
cyklohesanon

CH
2
O
C
CH
3
keton
Reakcje charakterystyczne:
o reakcje redukcji do alkoholi II-rzędowych
O OH
[H]
C
R
1
– CH – R
2
/ \
R
1
R
2
O OH
kat.
C + H
2
CH
3
– CH - CH
3
/ \
H
3
C CH
3
aceton 2propanal
Kwasy karboksylowe:
O
//
R – C
\
O – H
R – grupy alkilowe lub arylowe; wyjątkiem jest kwas mrówkowy, w którego
wzorze R oznacza atom wodoru.
O
//
gr. karboksylowa - C
\
O – H

Właściwości chemiczne:
R
C
O
O
H
Kwas:
mrówkowy HCOOH
octowy CH
3
COOH
propionowy CH
3
CH
2
COOH
masłowy CH
3
(CH)
2
COOH
Kwasy karboksylowe można podzielić w zależności od budowy reszty
węglowodorowej na alifatyczne (nasycone i nienasycone), cykloalifatyczne
i aromatyczne.
O
Kwas metanowy //
(mrówkowy) H – C
\
O – H
(ważne – umieć!)
O
Kwas etanowy //
(octowy) CH
3
– C
\
O - H
Kwas etanodiowy O O
(szczawiowy) \\ //
C - C
/ \
HO OH
Reakcje charakterystyczne:
1. tworzenie soli
2. tworzenie estrów
3. tworzenie amidów

Ad.1)
O O
// //
2R – C + Mg
2R – C + Mg
2+
+ H
2
\ \
O – H O
-
O O
// //
2R – C + CuO
2R – C + Cu
2+
+ H
2
O
\ \
O – H O
-
O O
// //
R – C + HCO
3
-
R - C + CO
2
+ H
2
O
\ \
O – H O
-
Ad.2)
O O
// [H
+
] //
R
1
– C + R
2
– OH
R
1
– C + H
2
O
\ \
O – H O – R
2
Ester
Ad.3)
O O
// //
R - C
+ NH
3
R – C + H
2
O
\ \
O – H NH
2

Kwasy alkanowe:
O
//
C
n
H
2n+1
C
\
O – H
Nienasycone kwasy jednokarboksylowe:
Z licznych nienasyconych kwasów jednokarboksylowych o ogólnym wzorze
C
n
H
2n-1
COOH
najważniejszy jest kwas akrylowy (inaczej nazywany kwasem propynowym)
O
//
CH
2
= CH – C
\
OH
Kwasy aromatyczne:
Grupa karboksylowa może być związana także z pierścieniem
aromatycznym - takie kwasy nazywamy aromatycznymi.
Kwasy wielokarboksylowe (wielozasadowe) to związki, które zawierają
kilka grup karboksylowych COOH.
Najprostszy z kwasów dwukarboksylowych – kwas szczawiowy, zawiera
połączone ze sobą dwie grupy karboksylowe. W przypadku wyższych kwasów
dwukarboksylowych, grupy karboksylowe są oddzielone od siebie łańcuchami
alifatycznymi.
Nazwy tworzy się od nazw węglowodorów podstawowych, podając numer
atomu węgla, z którym związane są grupy karboksylowe, dołączając
końcówkę „dwukarboksylowy”.
Estry:
Estry są produktami reakcji alkoholi i fenoli z kwasami
karboksylowymi lub tlenowymi kwasami nieorganicznymi.

o Estry kwasów karboksylowych:
Cechą charakterystyczną estrów kwasów karboksylowych jest
obecność grupy estrowej:
O
//
- C
\
O –
Wzór ogólny estrów:
O
//
R
1
– C
\
O – R
2
Symbole R1 i R2 oznaczają dowolne grupy alkilowe (nasycone i
nienasycone) lub grupy arylowe.
Estry są więc pochodnymi kwasów karboksylowych o wzorze R1-COOH, w
których zamiast atomu wodoru grupy karboksylowej znajduje się grupa
alkilowa lub grupa arylowa R2.
O
//
CH
3
– C octan sodu
\
ONa
O
//
CH
3
- C octan etylu
\
O – CH
2
– CH
3
O
//
H – C mrówczan metylu
\
O – CH
3
O
//
H – C mrówczan etylu
\
O – CH
2
– CH
3
O
//
CH
3
– C octan metylu
\
O – CH
3
O
//
CH
3
– C octan etylu
\
O - CH
2
– CH
3
O
//
CH
2
= CH – C akrylan metylu (ester metylowy kwasu propenowego)
\
O – CH
3
O
C
CH
3
O
ester metylowy kwasu cykloheksanokarboksylowego

CH
2
O
C
CH
3
O
benzoesan etylu
Reakcje powstawania estrów.
1. bezpośrednie działanie kwasu na alkohol.
Estry otrzymuje się w reakcji kwasów karboksylowych z alkoholami zachodzącej w obecności jonów H
+
jako
katalizatora.
Reakcja tworzenia estrów z kwasów i alkoholi nosi nazwę reakcji estryfikacji.
Ogólne równanie estryfikacji:
O O
// H
+
//
R
1
-O + R
2
-OHR
1
-C + H
2
O
\ alkohol \
O-H O-R
2
Kwas karboksylowy ester
Reakcja estryfikacji jest przykładem reakcji kondensacji.
2. Działanie chlorków kwasowych na alkohole przebiega jako reakcja odwracalna:
CH
3
COCl + HOC
2
H
5
-><- CH
3
CCOC
2
H
5
+ HCl
Chlorek acetylu alkohol octan etylu
3. Działanie chlorków kwasowych na alkoholany przebiega jako reakcja nieodwracalna.

CH
3
CH
2
COCL+NaOC
2
H
5
->CH
3
H
2
COOC
2
H
5
+NaCl
Chlorek etanolan propianian
Prapionylu sodu etylu
Reakcje charakterystyczne:
- reakcja hydrolizy katalizowanej jonami H
+
O O
// H
+
//
R
1
– C + H
2
O--> R
1
– C + R
2
-OH
\ \
O-R
2
OH
Reakcja hydrolizy zasadowej pod wpływem jonów OH
-
O O
// H
2
O //
R
1
-C + OH
-
R
1
-C + R
2
-OH
\ \
O-R
2
O
-
O O
// H
2
O //
CH
3
-C + NaOH CH
3
-C + CH
3
-CH
2
-OH
\ \
O-CH
2
-CH
3
ONA
O
Przykłady: //
Mrówczan metylu: H-C
\
O-CH
3

Szczawian dietylu COO-CH
2
-CH
3
|
COO-CH
2
-CH
3
Alkohole mogą reagowad z utworzeniem estrów nie tylko z kwasami karboksylowymi, ale i z kwasami
nieorganicznymi: H
2
SO
4
, HNO
3
, H
3
PO
4
.
Kwasy jednoprotonowe mogą reagowad tylko z jedną cząsteczką alkoholu, dwuprotonowe – z 1 lub 2-a,
trójprotonowe – także z trzema.
Azotany (V) alkoholi wielowodorotlenowych są stosowane jako materiały wybuchowe. Najbardziej znany jest triazan
(V) glicerynu.
CH
2
-O-NO
2
|
CH-O-NO
2
|
CH
2
-O-NO
2
Tłuszcze
Pod względem chemicznym tłuszcze są estrami gliceryny i kwasów karboksylowych, najczęściej o długich łaocuchach.
Ponieważ cząsteczka gliceryny ma 3 grupy hydroksylowe, w cząsteczce jej estru znajdują się 3 reszty kwasowe.
Ogólny wzór kwasów tłuszczowych:
O
||
CH
2
-O-C-R
1
| O
| ||
CH-O-C-R
2
| O
| ||
CH
2
-O-C-R
3
Tłuszcze podobnie jak inne estry ulegają reakcji hydrolizy.
Zasadowa hydroliza tłuszczów, zwana jest reakcją zmydlania.
Jej produktami są: gliceryna, sole kwasów tłuszczowych, czyli mydło.

Równanie reakcji zmydlania na przykładzie tristearynianu gliceryny:
CH
2
-OOC-(CH
2
)
16
-CH
3
CH
2
-OH
| |
CH-OOC-(CH
2
)16-CH
3
+3NaOH CH-OH + 3CH
3
-(CH
2
)
16
-COONa
| | mydło
CH
2
-OOC-(CH
2
)
16
-CH
3
CH
2
-OH
Tristearynian gliceryny gliceryna
Tłuszcze wprowadzone z pokarmem ulegają hydrolizie pod wpływem katalizatorów biochemicznych.
Stan skupienia tłuszczów zależy od obecności wiązao podwójnych w łaocuchach reszt kwasowych.
Tłuszcze ciekłe można przekształcad w stałę w reakcji katalicznego uwodornienia wiązao podwójnych. Proces ten nosi
nazwę utwardzania tłuszczów.
Związki organiczne zawierające azot.
Aniny- organiczne pochodne amonialu, powstają przez podstawienie atomu wodoru rodnikami alkilowymi.
Wyróżniamy:
1) aminy I-rzędowe o ogólnym wzorze RNH
2
, zawierające grupę – NH
2
2) aminy II-rzędowe o ogólnym wzorze R
I
zawierające grupę ininową \
\ NH
NH /
/
R
3) aminy III-rzędowe o ogólnym wzorze R
III
\ nie zawierające wodowu związanego z
R
I
– N z azotem.
R /
CH
3
-NH
2
metyloanina
CH
3
-CH
2
-NH
2
etyloanina
CH
3
-CH
2
-CH
2
-NH
2
1-propyloanina
CH
3
-CH-CH
3

| 2-propyloanina
NH
2
CH
3
=CH-CH
2
-NH
2
2-propylo 1 anina
NH
2
cykloheksanoalina
/
NH
2
fenyloanina
/
NH
2
/ 2- metylofenyloamina
\
CH
3
Aminy II-rzędowe:
H
/
CH
3
-N dimetyloamina
\
CH
3
H
/
CH
3
-CH
2
-N
\
CH
3
N-metyloetyloamina
H

|
/ N\ difenyloamina
O O
Aminy III-rzędowe:
CH
3
/
CH
3
-N trimetyloamina
\
CH
3
O
|
/ N \ trifenyloamina
O O
Przykład typowego związku należącego do tej grupy to:
H
/
O-N amilina
\
H
Właściwości chemiczne amin wynikają z obecności grupy aminowej.
Ich wodne roztwory zawierają jony OH
-
powstałe w wyniku reakcji z H
2
O.
H H
/ |
R-N + H
2
O--> R-N-H+OH
-
\ |
H H

Aminy alifatyczne są zasadami o mocy porównywalnej z mocą amoniaku, czyli dośd słabymi.
Słaby charakter zasadowy amin aromatycznych jest spowodowany oddziaływaniem wodnej pary elektronowej gr. –
NH
2
z sekstetem elektronowym pierścienia, w wyniku czego maleje cząsteczkowy ładunek ujemny atomu azotu i
pojawia się cząsteczkowy ładunek ujemny na atomie węgla orto- i pora- pierścienia aromatycznego.
Zasadowy charakter amin przejawia się również w ich reakcjach z kwasami.
Aminy kwasowe. Mocznik.
- pochodne kwasów karboksylowych w których grupa – OH grupy karboksylowej została zastąpiona grupą aminową –
NH
2
.
O O
// //
R-C R-C
\ \
O-H N-H
Kwas karbosylowy |
H
Amid kwasu karbosylowego
Grupą funkcyjną amidów jest grupa amidowa, której szczególnym przypadkiem jest grupa amidowa amidów I-
rzędowych.
C O
// //
-C - C
\ \
N- NH
2
| gr, amidowa amidów I-rzędowych
grupa amidowa
Amidy I-rzędowe:
O

//
H-C formamid (amid kwasu mrówkowego)
\
NH
2
O
//
CH
3
-C acetamid (amid kwasu octowego)
\
NH
2
Amid II-rzędowy:
O
//
CH
3
-C CH
3
\ /
N
|
H
N- metyloacetamid
O
//
CH
3
-C CH
3
\ /
N
|
CH
3
N,N – dimetyloacetamid
Amidy łatwo ulegają hydrolizie zarówno w środowisku kwaśnym jak i zasadowym.

O O
// //
CH
3
-C + H
2
SO
4
+ H
2
O CH
3
- C + NH
4
HSO
4
\ \
NH
2
OH
O O
// //
CH
3
-C + NaOH CH
3
-C NH
3
\ \
NH
2
Ona
Specyficznym przykładem amidu jest mocznik. Jest on diamidem kwasu węglowego:
O O
|| ||
C C
/ \ / \
HO OH H
2
N NH
2
Kw. Węglowy mocznik
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
chemia organiczna 2003 cała PDF(1)
Egzamin Chemia organiczna zestawy 1 8
więcej podobnych podstron