
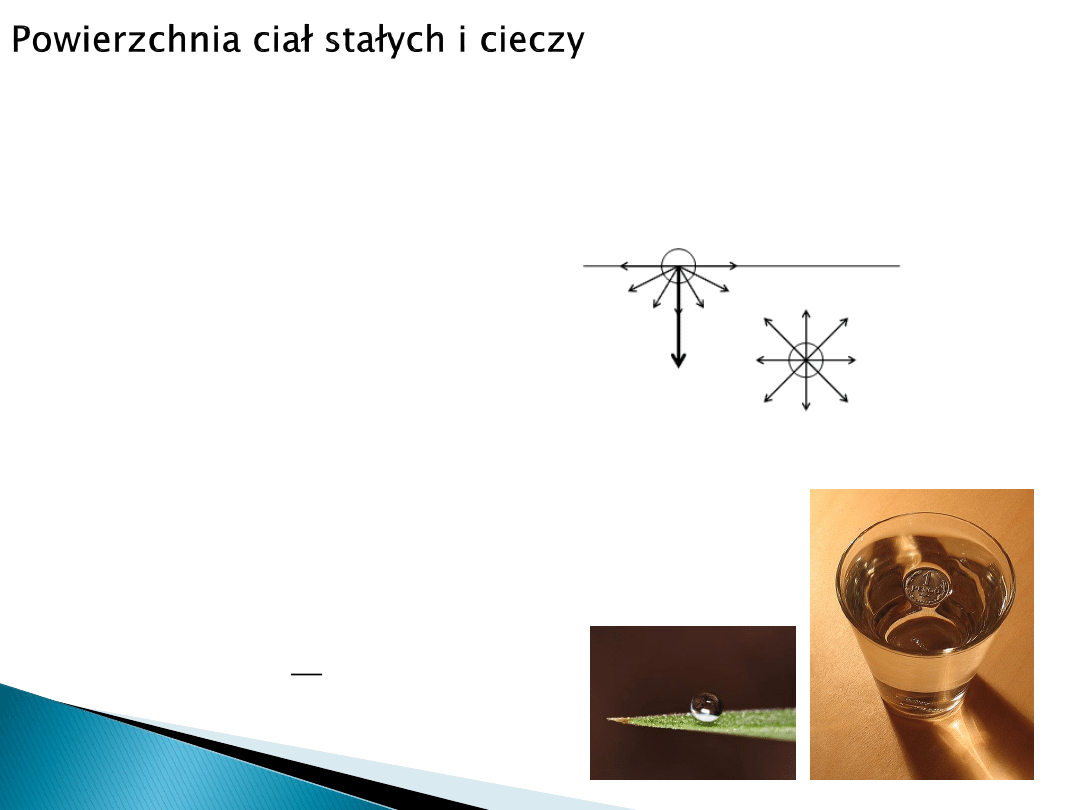
Na powierzchni zetknięcia dwóch faz zawsze występuje pewne pole niewysyconych
sił przyciągających (wiązań chemicznych, sił Van der Waalsa itp.). Siły te natomiast
kompensują się we wnętrzu fazy.
W konsekwencji, atomy znajdujące się na
powierzchni mają wyższą energię.
W przypadku cieczy można zaobserwować zjawisko
napięcia powierzchniowego
–
powierzchnia cieczy w kontakcie z fazą gazową, ciałem stałym
lub inną cieczą zachowuje się jak sprężysta błonka.
Miarą napięcia powierzchniowego
γ
jest praca
W
, jaką trzeba
wykonać, by utworzyć jednostkową powierzchnię cieczy
S
:
powierzchnia
wnętrze
𝛾 =
𝑊
Δ𝑆
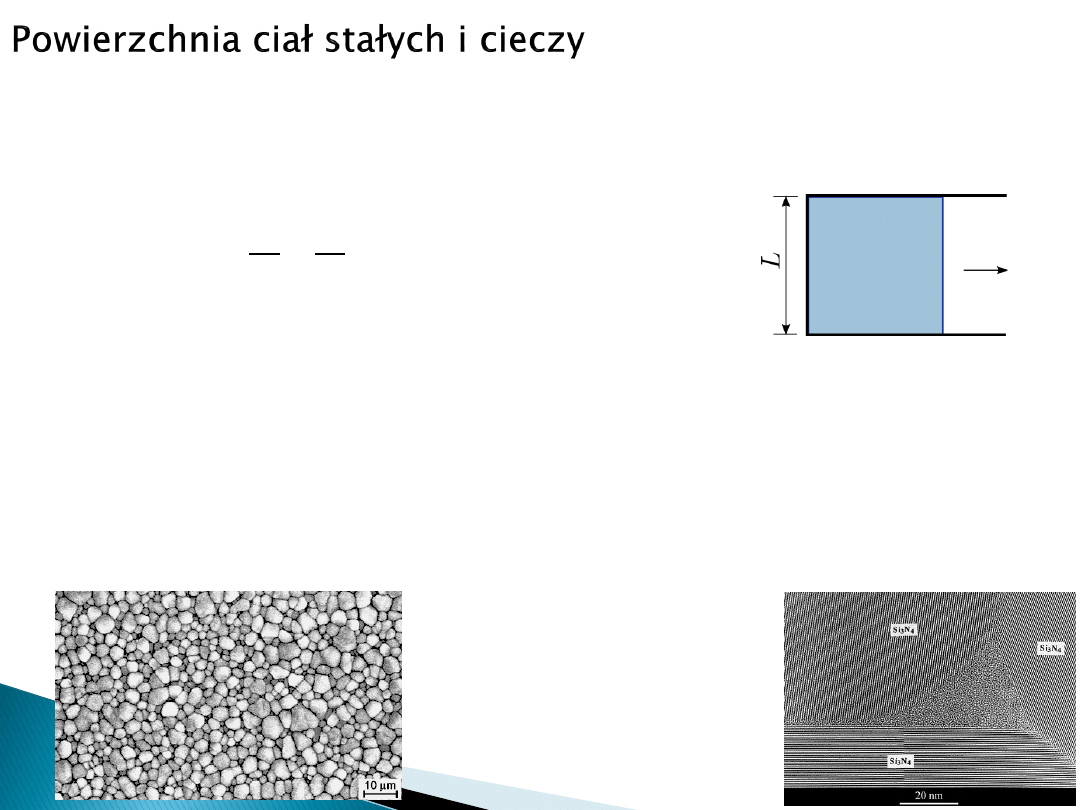
Alternatywnie, można określić napięcie powierzchniowe na podstawie „rozciągania
cieczy do formy cienkiej błonki” jak na rysunku (siła zapewniająca utrzymanie
powierzchni błonki).
Wtenczas:
W przypadku ciał stałych atomy z powierzchni posiadające nadmiarową energię są
przyczyną większej reaktywności materiałów posiadających ziarna w skali nano
(dla których znaczna część atomów należy do powierzchni.
Budowa granicy fazowej ciało stałe – ciało stałe jest skomplikowana. W przypadku
próbek polikrystalicznych (nawet jeśli są jednofazowe) można wyróżnić granice
nisko- i wysokokątowe. Układ atomów na granicy ziarna jest zaburzony.
𝛾 =
𝑊
Δ𝑆
=
𝐹
2𝐿
F
mikrostruktura
spieku
polikrystalicznego
faza amorficzna
pomiędzy trzema
ziarnami krystalicznymi

W wyniku oddziaływania niezrównoważonych sił powierzchniowych substancje
pozostające w fazie gazowej nad cieczą lub ciałem stałym oraz substancje
rozpuszczone w roztworze mogą być selektywnie gromadzone w pobliżu granicy
faz lub też odpychane z tej przestrzeni.
W konsekwencji, mogą występować różnice stężeń pomiędzy średnim składem
ośrodka gazowego lub ciekłego, a składem warstw przyległych do granicy faz.
Zjawisko to nazwano
adsorpcją
.
Adsorpcja jest zjawiskiem złożonym. Na jej przebieg (w przypadku ciała stałego)
wpływa przede wszystkim niejednorodność powierzchni
adsorbentów
(defekty
punktowe, defekty jedno-, dwu- i trójwymiarowe).
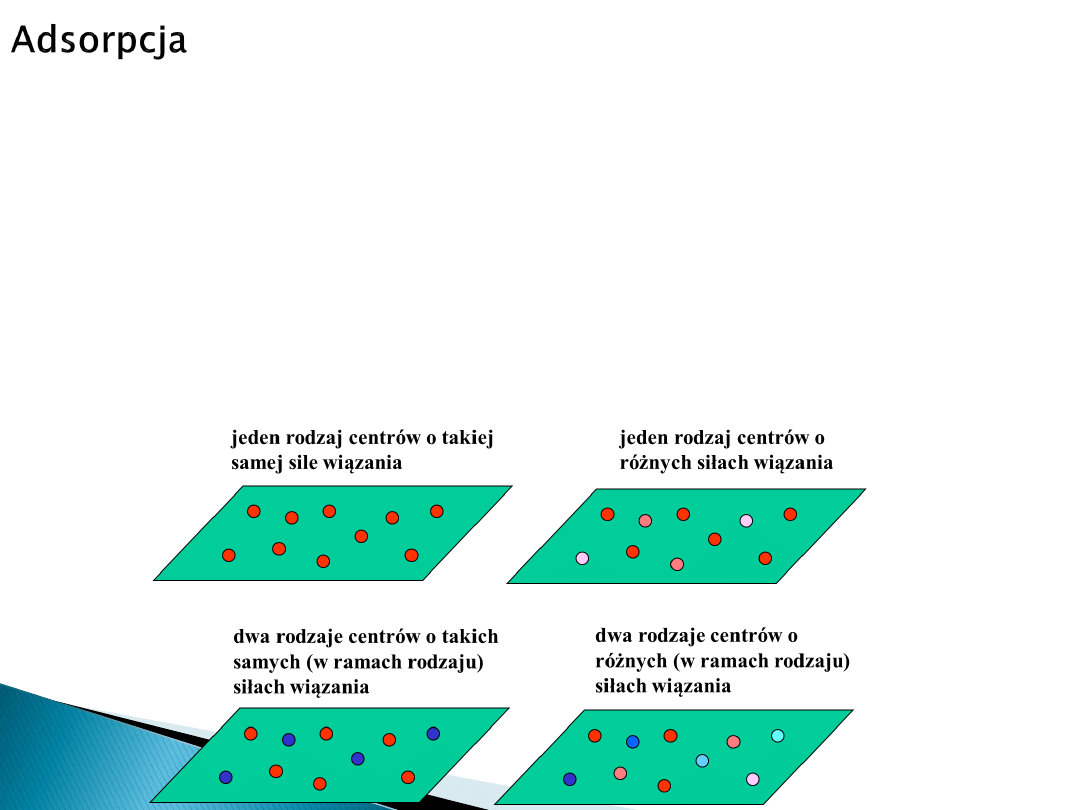
W zależności od geometrycznego ułożenia atomów na powierzchni ciała stałego
oraz od rodzaju tych atomów, w różnych punktach powierzchni adsorbentu
działają siły o różnej naturze i wartości.
Na skutek tego na powierzchni istnieją miejsca różniące się wartościami energii
wiązania danego adsorbentu z
adsorbatem
, a więc miejsca o różnej aktywności
w procesie adsorpcji i o różnym cieple adsorpcji.
Miejsca, gdzie adsorpcja zachodzi preferencyjnie nazywa się
centrami aktywnymi
.

W zależności od natury sił działających pomiędzy powierzchnią adsorbentu
a adsorbatu rozróżniamy
adsorpcję fizyczną
(siły Van der Waalsa) i
chemiczną
:
chemisorpcję
(wiązania chemiczne).
Chemisorpcja jest zwykle jednowarstwowa, adsorpcja fizyczna może być
wielowarstwowa.
Jeden z prostszych modeli adsorpcji na ciele stałym przy ustalonej temperaturze
zaproponował Langmuir przy założeniach:
1. powierzchnia adsorbentu zawiera ustaloną liczbę miejsc dla adsorbowanych
cząsteczek (centra aktywne),
2. każde takie miejsce, może być obsadzone przez jedną cząsteczkę (może się
wytworzyć tylko warstwa jednocząsteczkowa),
3. ciepło adsorpcji jest stałe, niezależne od stopnia pokrycia powierzchni ,
4. ustala się dynamiczna równowaga: adsorpcja – desorpcja.
W oparciu o powyższe, szybkość zmian stopnia pokrycia
Θ
dana jest jako (
k
1
–
stała szybkości adsorpcji,
k
2
– stała szybkości desorpcji,
p
– ciśnienie):
Θ
k
Θ
p
k
dt
dΘ
2
1
)
1
(
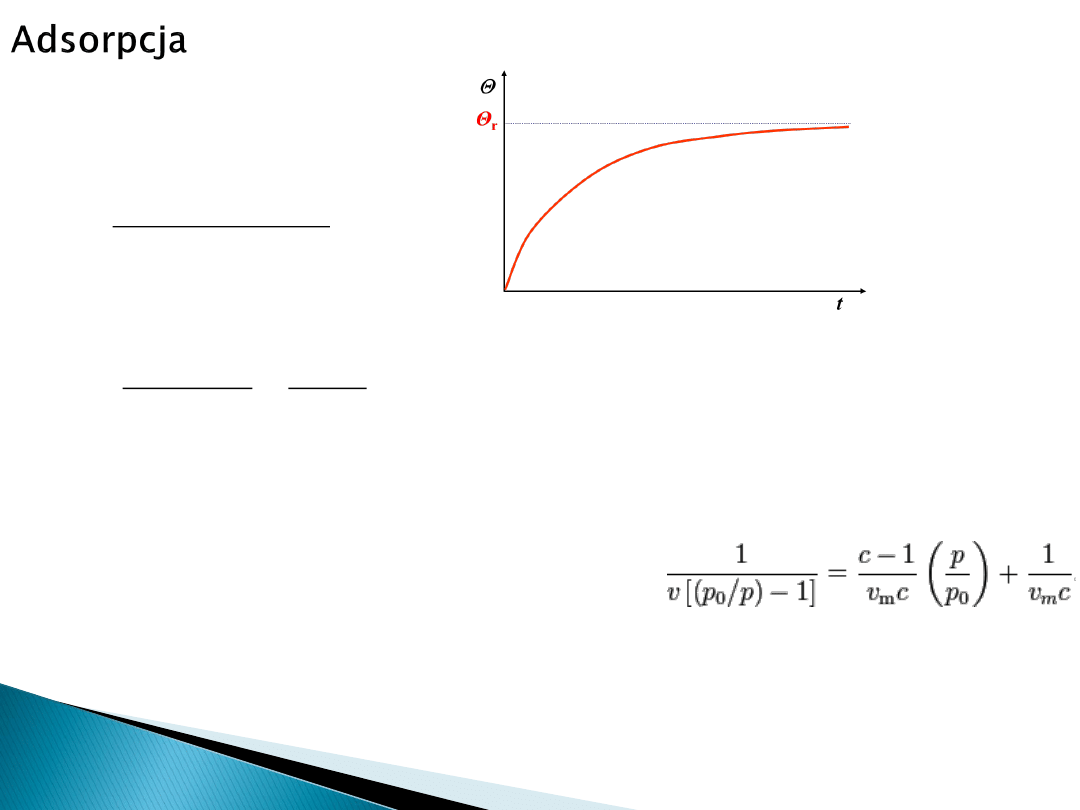
W efekcie:
Wartość równowagowa
Θ
r
:
Dla wielowarstwowej adsorpcji fizycznej rozważa się izotermę Brunauera-Emmeta-
Tellera (BET).
W zapisie dla nieskończenie-warstwowej adsorpcji:
gdzie:
v
- ilość zaadsorbowanej substancji,
v
m
– ilość zaadsorbowanej substancji
w monowarstwie,
p
– ciśnienie równowagowe,
p
0
– prężność par adsorbatu w danej
temperaturze,
c
– stała izotermy BET.
2
1
1
2
1
1
k
p
k
e
p
k
Θ
t
k
p
k
1
2
1
1
bp
bp
k
p
k
p
k
Θ
r
Wyszukiwarka
Podobne podstrony:
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie ćw 7 zależ
chemia analityczna wyklad 11 i 12
chemia fizyczna I wykład(1)
chf wykład 6, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 10
Chemia fizyczna wykład 4
chf wykład 3, Studia, Chemia, fizyczna, wykłady
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Chemia fizyczna wykład 12
chf wykład 8, Studia, Chemia, fizyczna, wykłady
Chemia fizyczna wykład 9
Chemia fizyczna wykład 1
tech.chem. PGd chemia fizyczna wyklady, Technologia chemiczna, Chemia fizyczna, Wykłady, wykłady na
Chemia fizyczna wyklad, Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 3), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Chemia fizyczna (wyklad 4), Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
chf wykład 1, Studia, Chemia, fizyczna, wykłady
chemia fizyczna wykład4
więcej podobnych podstron