
Ogłoszenia:
e-portal
W. 7
Podstawy chemii fizycznej
(biotechnologia)
prof. Ludwik Komorowski
pok. 315 A-3. wt., czw. 14-16

Plan W.7
1. Równowaga adsorpcji na powierzchni stałej
2. Izoterma Langmuira
3. Ciepło adsorpcji
4. Izoterma BET
5. Chromatografia
6. Energia powierzchniowa cieczy, ciśnienie
pęcherzykowe
7. Prężność pary nad zakrzywioną powierzchnią
8. Adhezja i zwilżanie powierzchni
9. Napięcie powierzchniowe roztworów
10. Izoterma Gibbsa
11. Równanie Szyszkowskiego

Parowanie - skraplanie
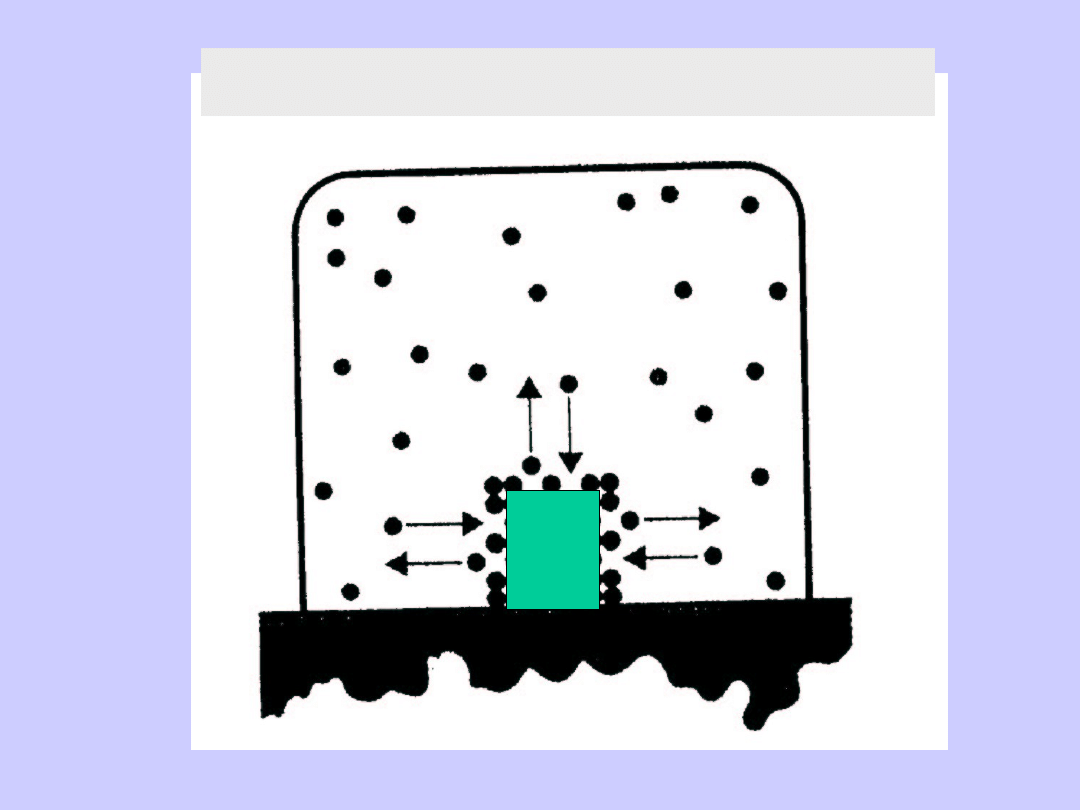
Adsorpcja na powierzchni fazy stałej

Zjawisko adsorpcji na powierzchni
fazy stałej
W pojemniku o objętości V, gaz w ilości n moli
wytwarza ciśnienie,
Po wprowadzeniu fazy stałej w ilości „m”, ciśnienie
obserwowane p’<p pozwala znaleźć zmianę liczby
moli gazu w pojemniku:
Pokrycie próbki wynosi
RT
p n
V
(
')
V
n
p p
RT
n
a
m

Dla adsorpcji jednowarstwowej istnieje
.
Równowaga adsorpcji oznacza, dla
Izoterma Langmuira
'(1
)
'
1
k
k
p
bp
k
b
bp
k
maks
a
maks
a
a

Izoterma Langmuira
Stopień pokrycia powierzchni
=a/a
max
; 0<
< 1
w zależności od ciśnienia
=bp/(1+bp)
0
1
Współczynnik adsorpcji
b(T)
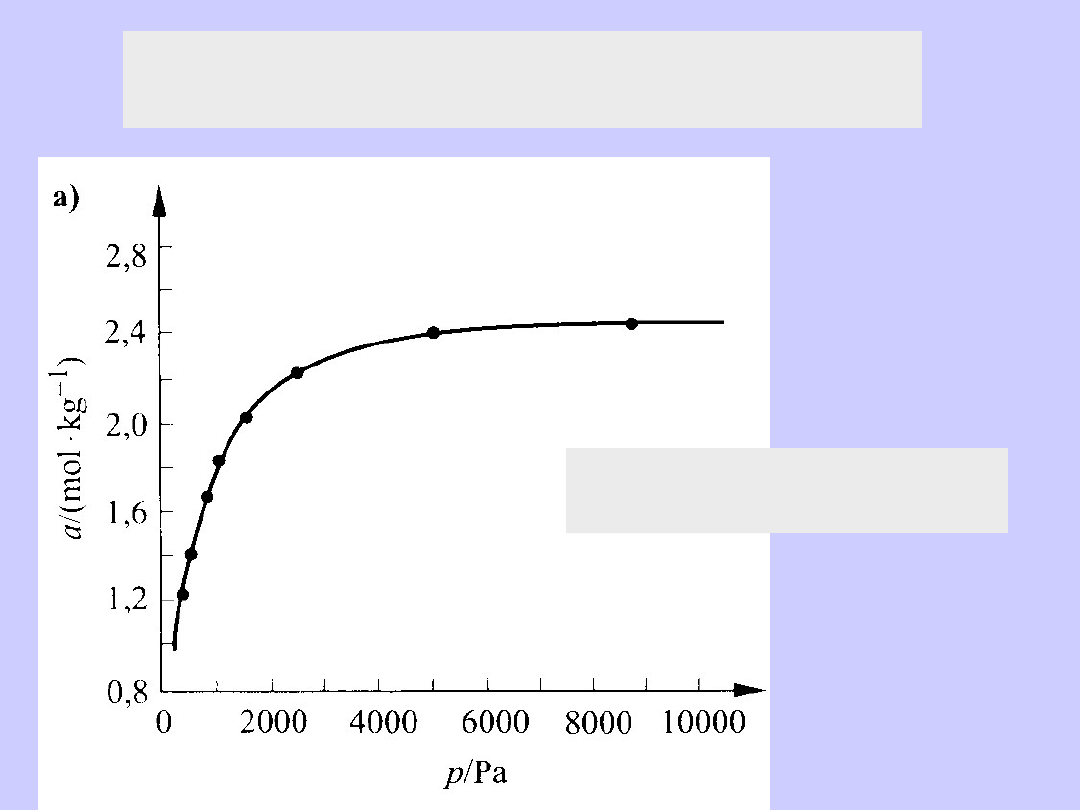
Izoterma adsorpcji
par benzenu na sproszkowanym węglu brunatnym
a=a
max
bp/(1+bp)
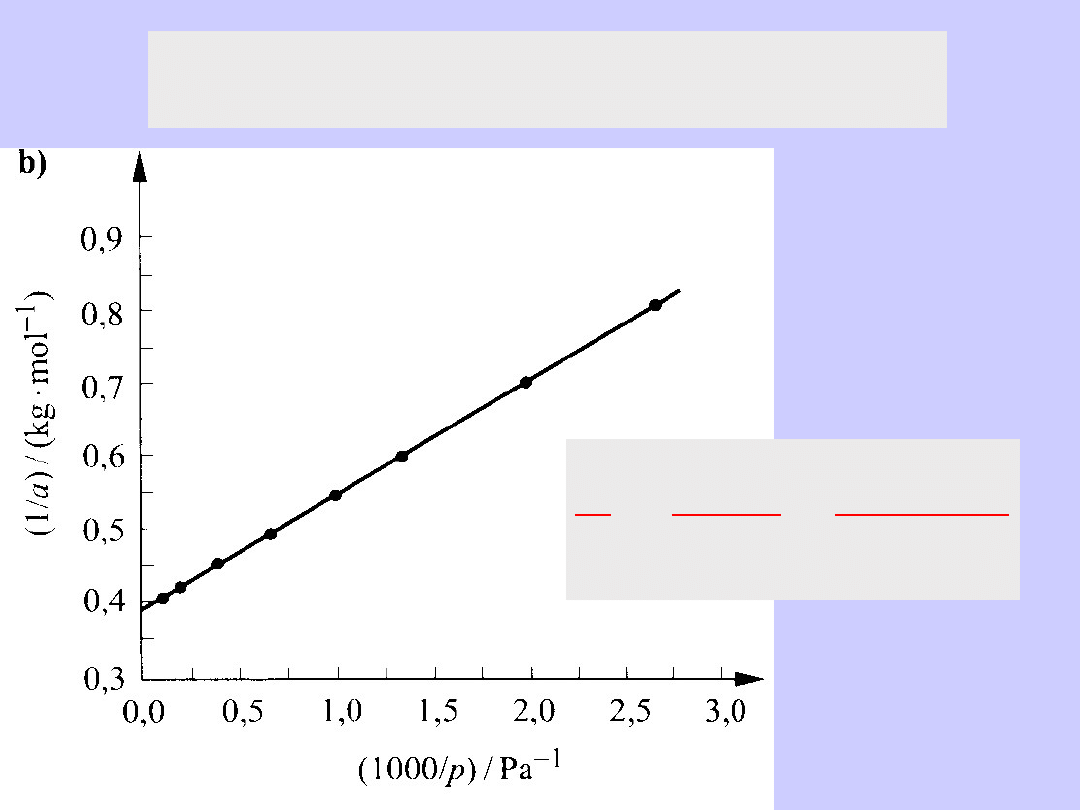
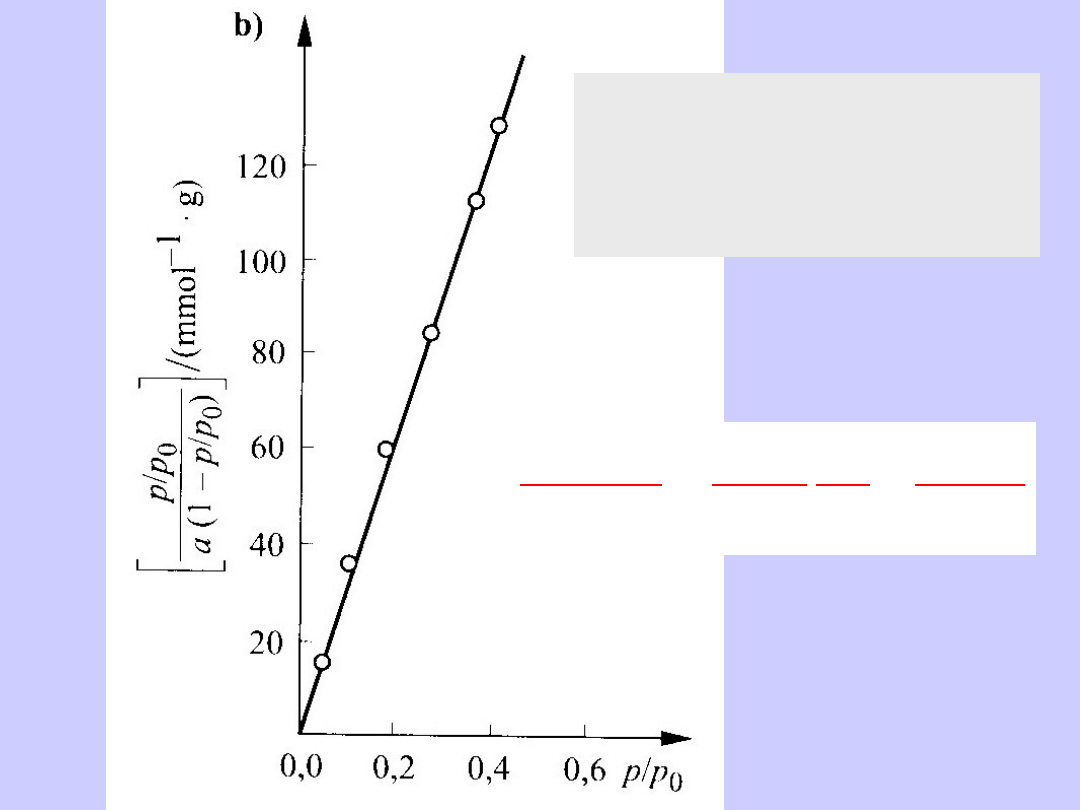
Anamorfoza liniowa izotermy adsorpcji
par benzenu na sproszkowanym węglu brunatnym
1
1
1
maks
maks
a
a
pba

Hoffa.
vant
izobara
z
Identyczne
ln
ln
ln
ln
1
ln
ln
ln
1
1
Langmuira
izotermy
Z
2
,
2
,
RT
H
T
b
RT
H
T
b
T
p
const
b
b
p
b
p
o
i
o
i
Współczynnik adsorpcji b
Wniosek: stała b
w równaniu izotermy Langmuira
ma sens stałej równowagi
Izosteryczne
molowe
ciepło
adsorpcji
,
0
o
i
H
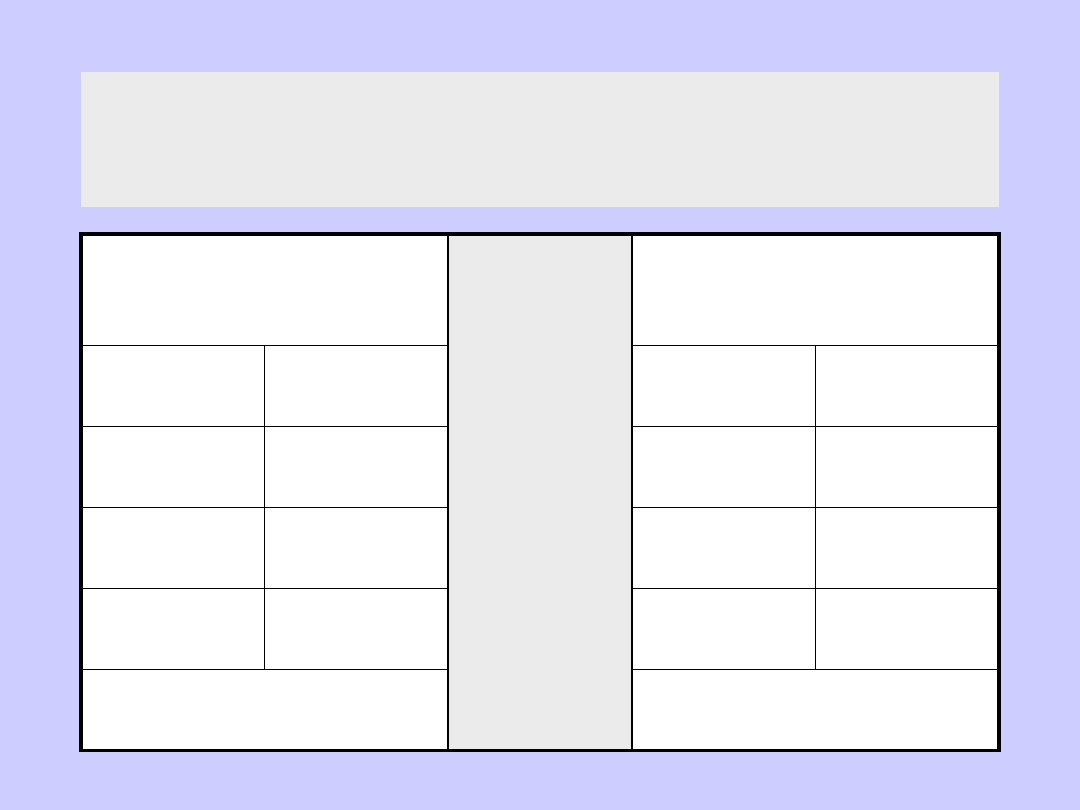
Ciepło adsorpcji [kJ/mol]
Adsorpcja na węglu
aktywnym
Adsorpcja na
sproszkowanym Fe
CH
4
-21
C
2
H
4
-285
H
2
-84
CO
-192
H
2
O
-59
H
2
-134
N
2
-21
NH
3
-188
Adsorpcja fizyczna
Chemisorpcja
Produkty desorpcji
(dowód procesów chemicznych na
powierzchni – chemisorpcja)
O
2
(C
akt
) CO, CO
2
, O
2
H
2
(W) H
O
2
(W) O
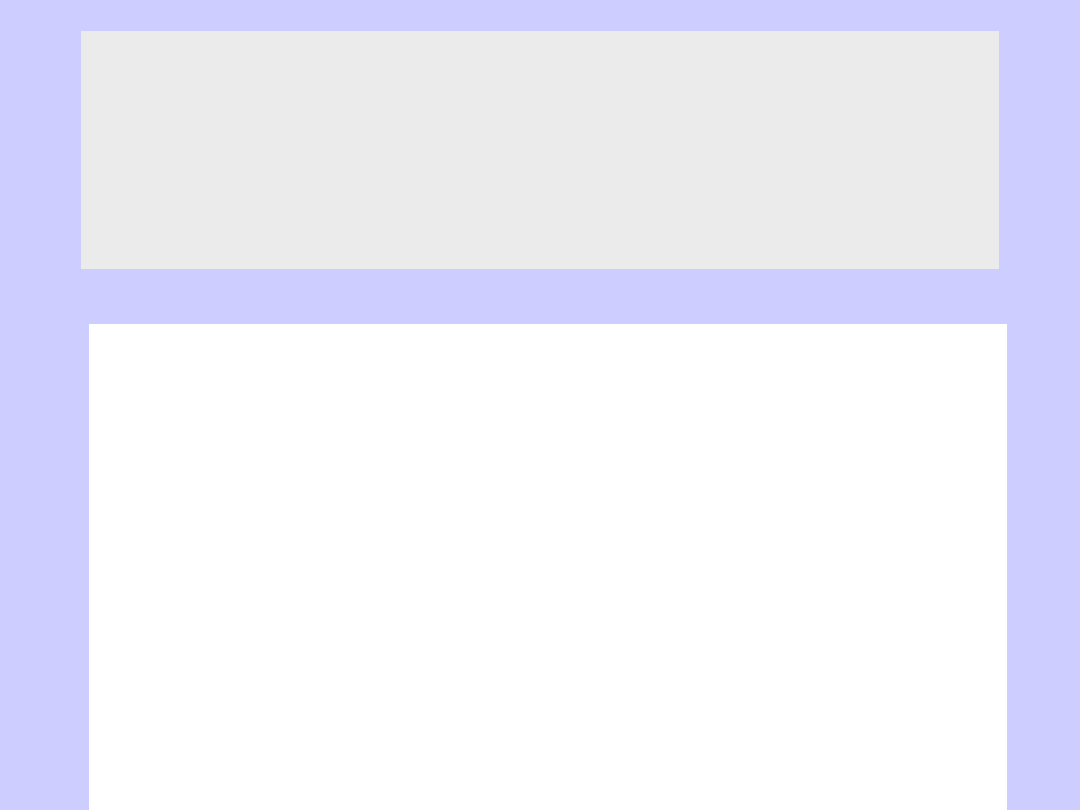
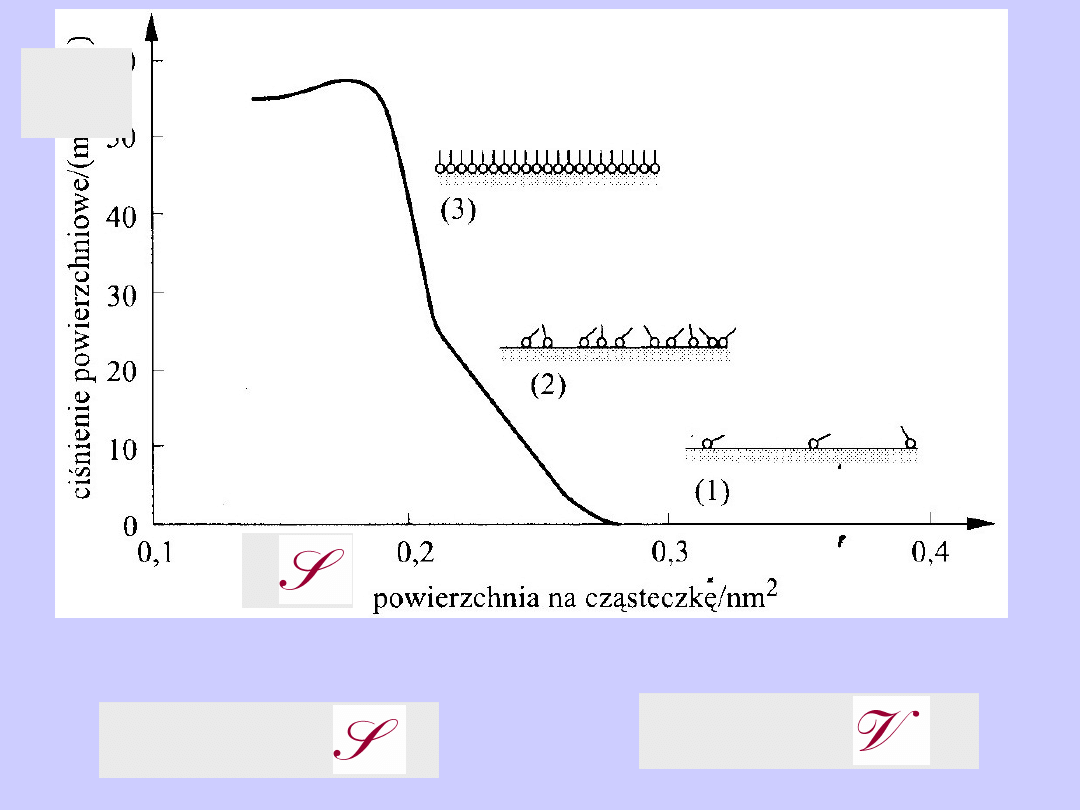
Izoterma adsorpcji
par benzenu na sproszkowanym ksylitowym węglu brunatnym
p
o
jest prężnością par benzenu
Izoterma BET
adsorpcja wielowarstwowa
z
C
z
z
C
a
a
a
RT
C
p
p
z
m
m
o
skr
i
o
i
o
)
1
(
1
)
1
(
y
monowarstw
dla
exp
,
,
o
par
i
o
skr
i
o
skr
i
o
i
,
,
,
,
poniewaz
,
0
oraz
0
Anamorfoza liniowa
wg równania izotermy
BET (z=p/p
o
)
1
1
(1
)
m
m
z
C
z
a
z
C a
C a

Chromatografia bibułowa
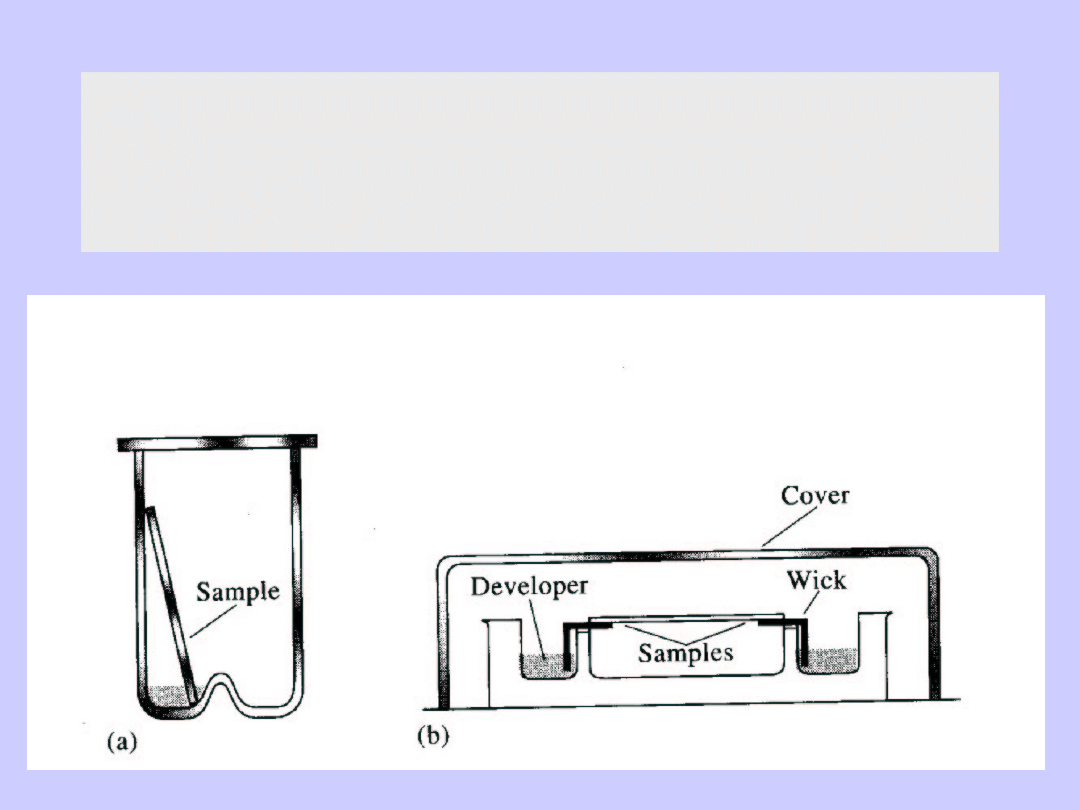
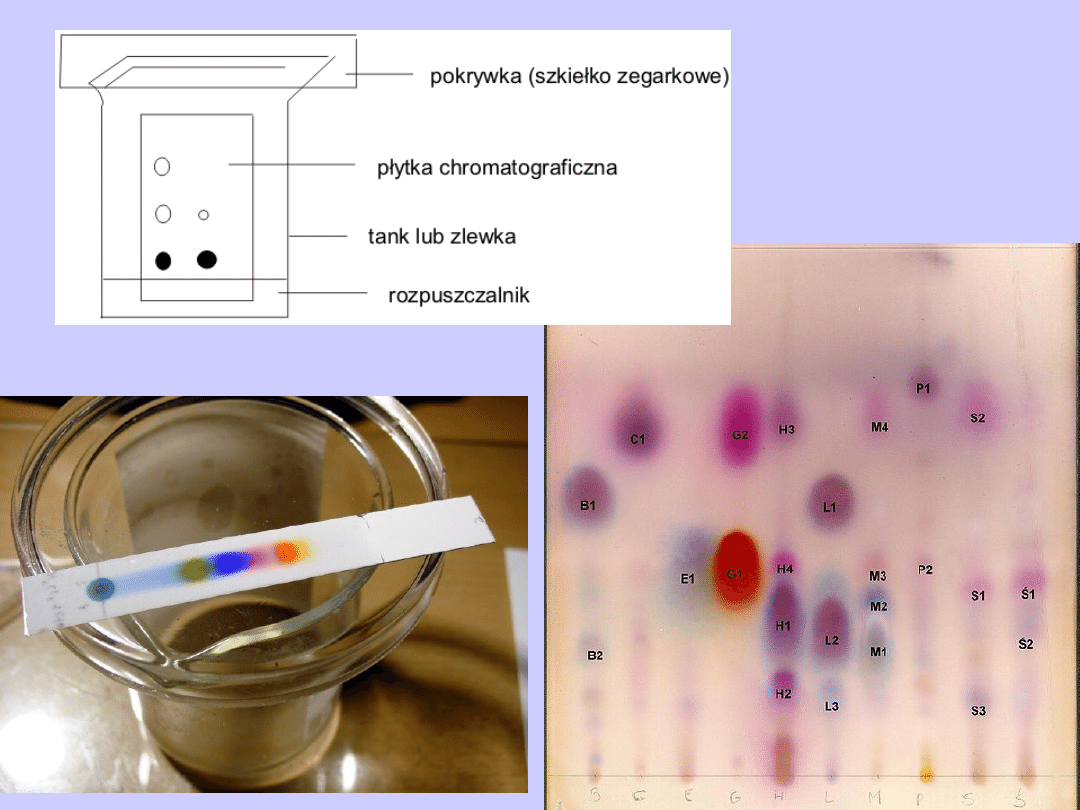
Chromatografia cienkowarstwowa
na warstwach proszku (SiO
2
, Al
2
O
3
i in.)
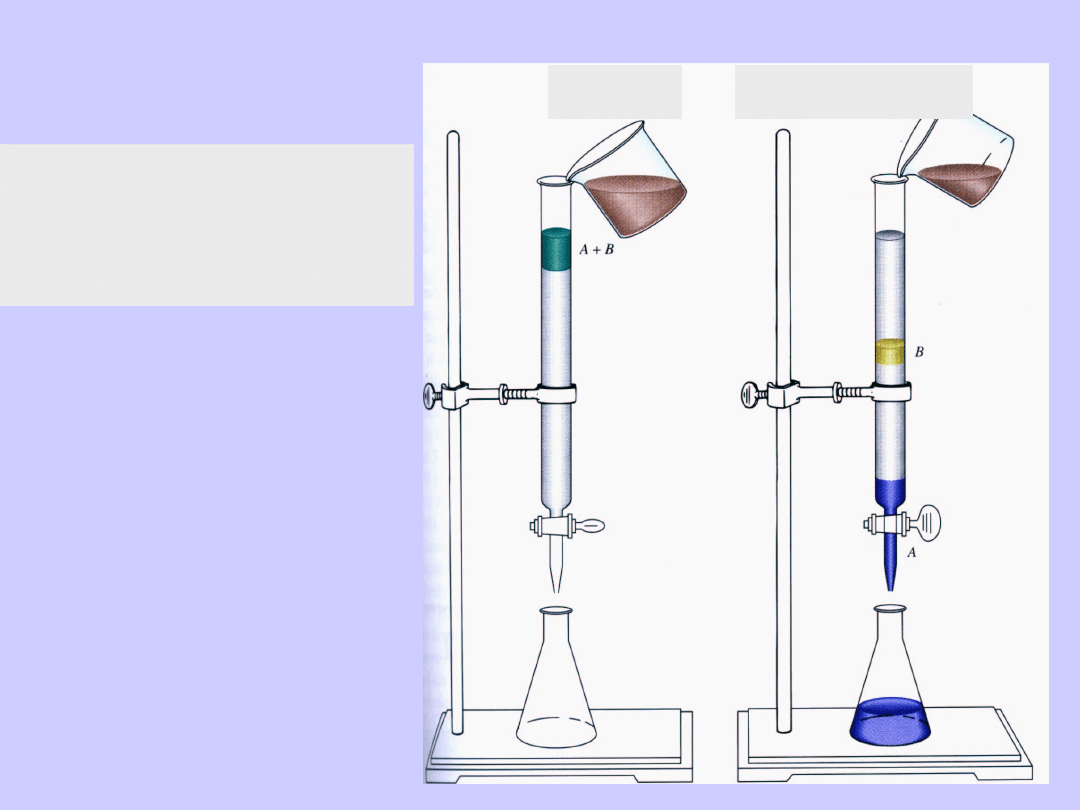
Kolumna
chromatograficzna
roztwór
rozpuszczalnik
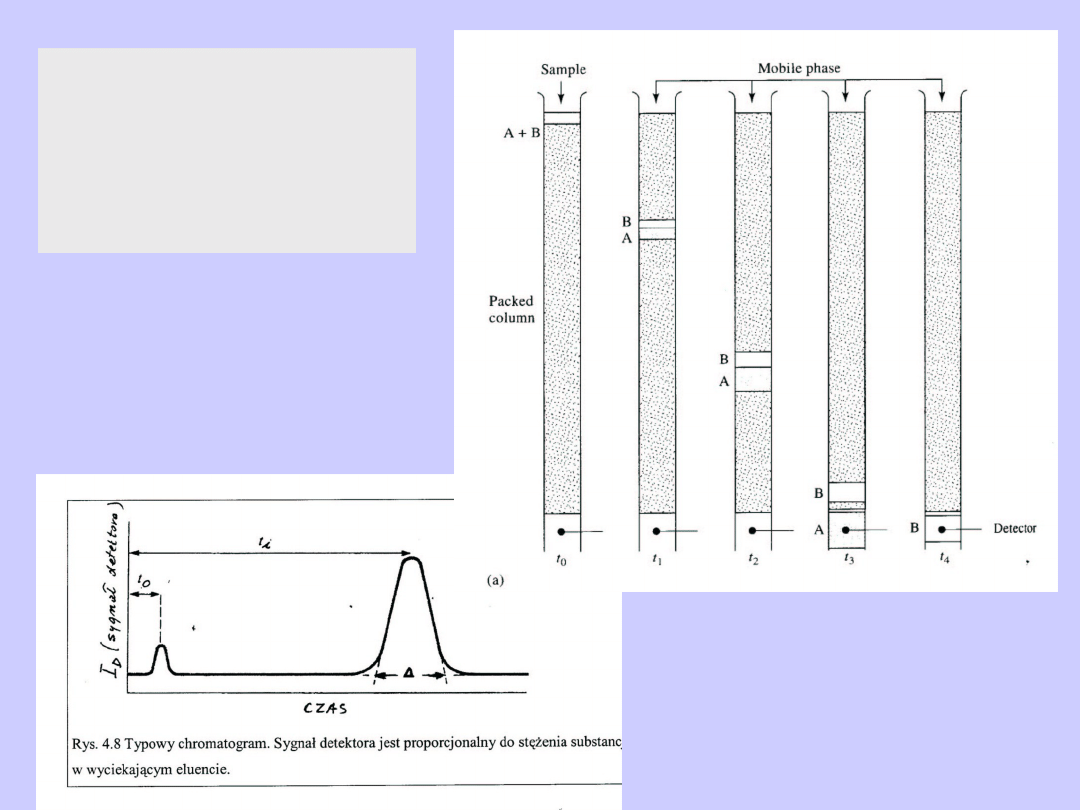
Chromatografia
kolumnowa,
cieczowa
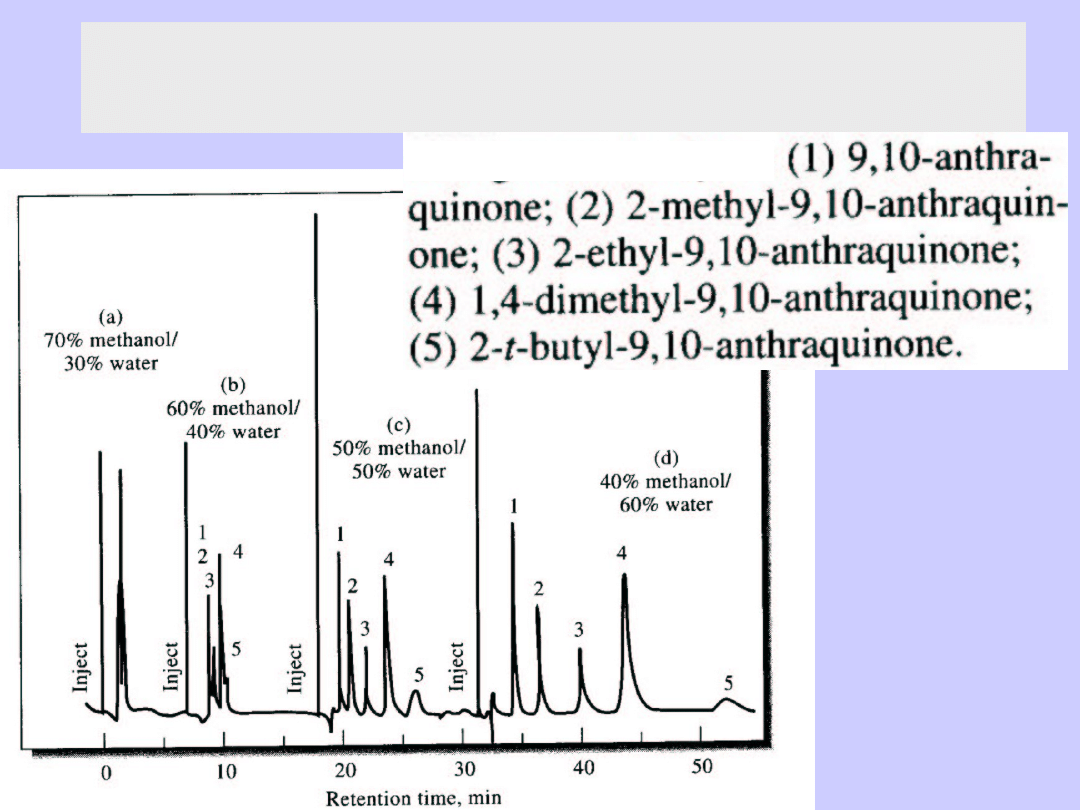
Chromatografia kolumnowa, cieczowa
Wpływ rozpuszczalnika
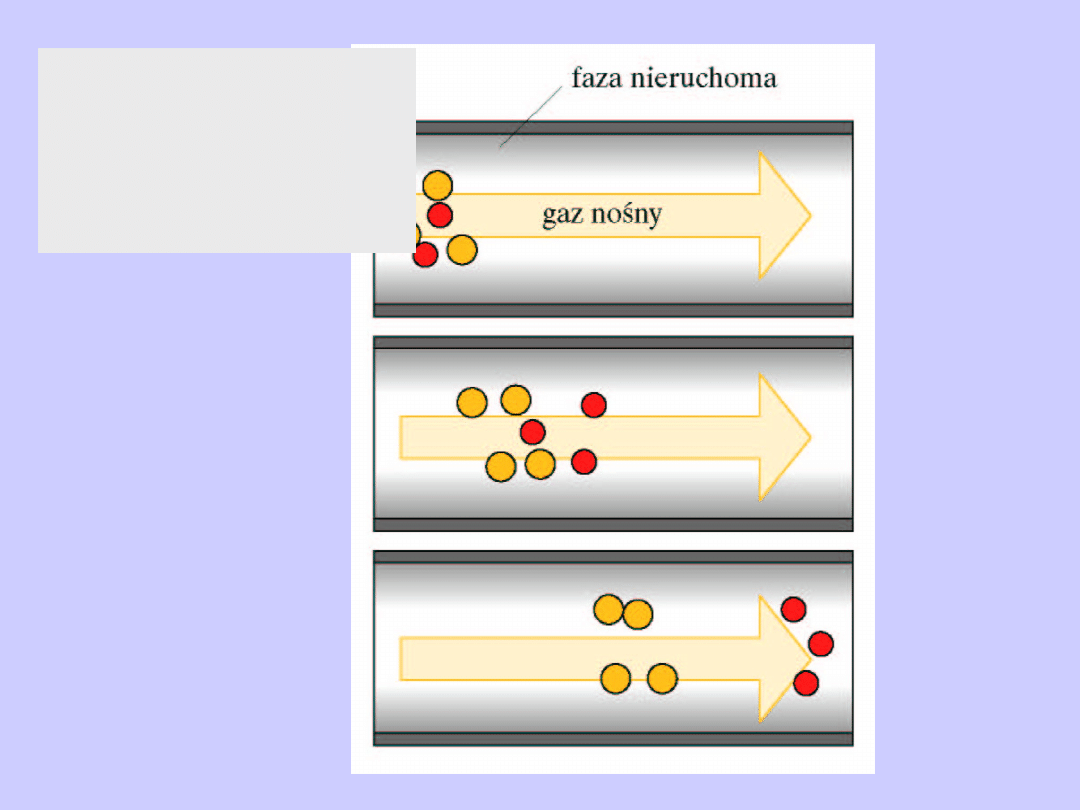
Chromatografia
kolumnowa,
gazowa
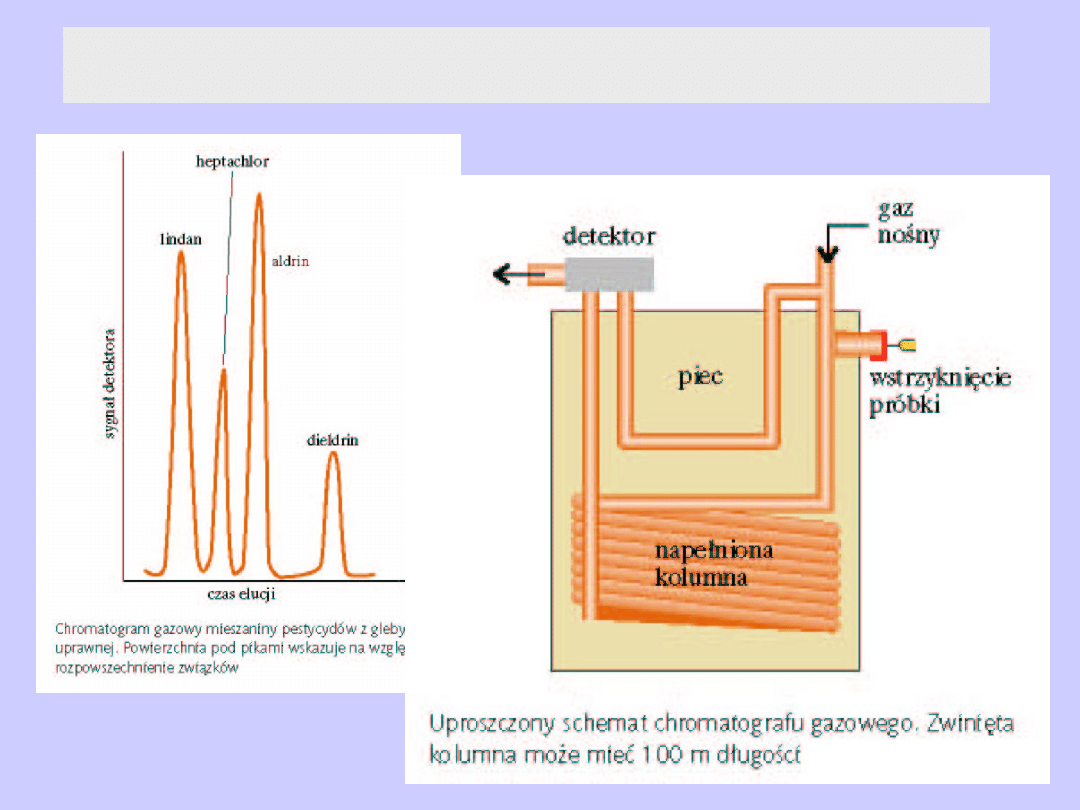
Chromatografia gazowa – schemat
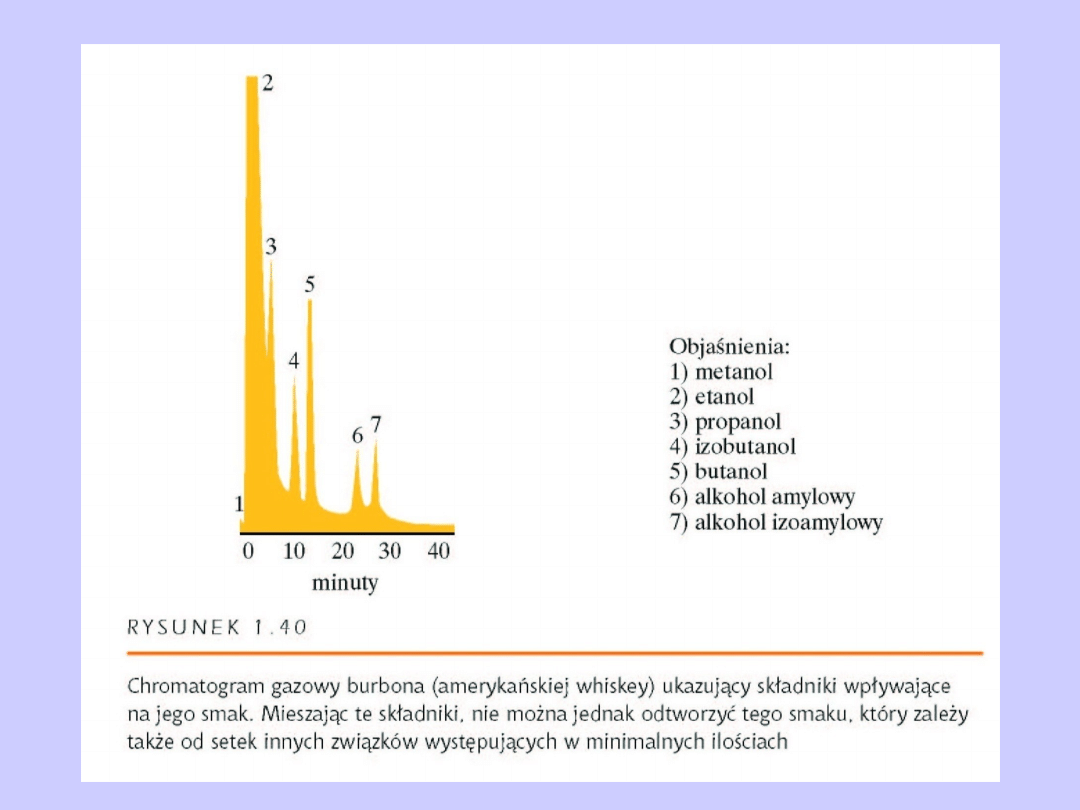
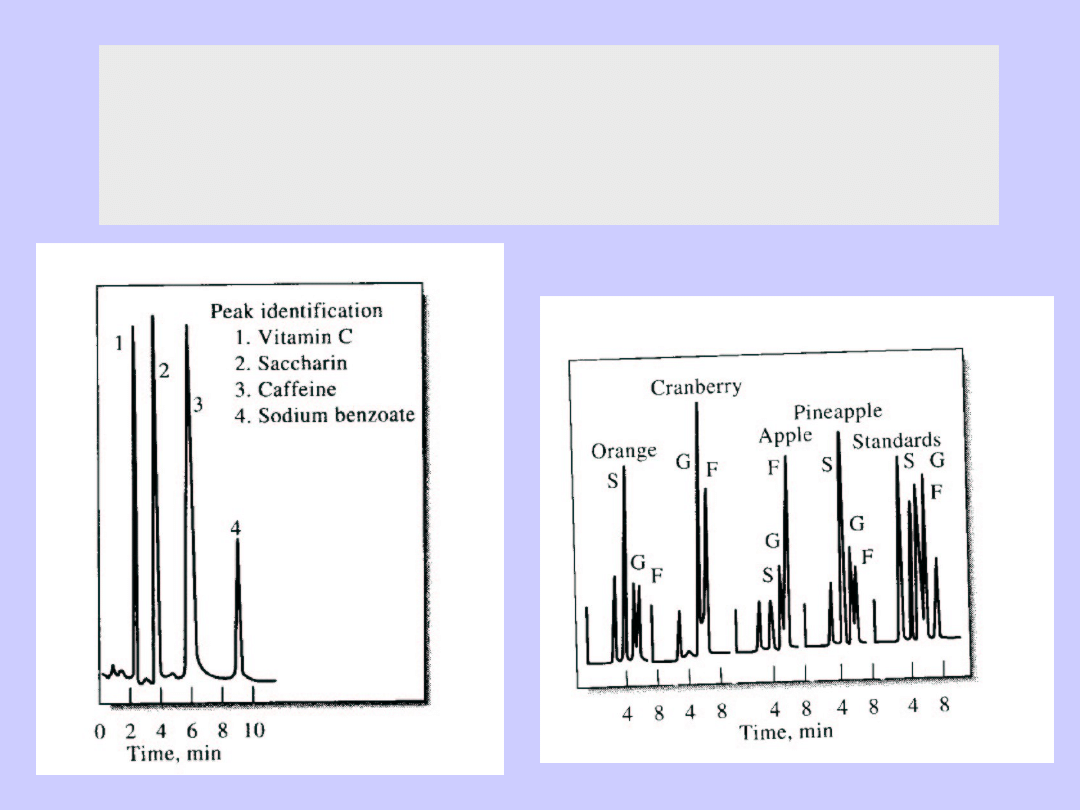
HPLC Chromatografia wysokociśnieniowa
Przykłady analizy próbek żywności
(S-sacharoza, F-fruktoza, G-glukoza)
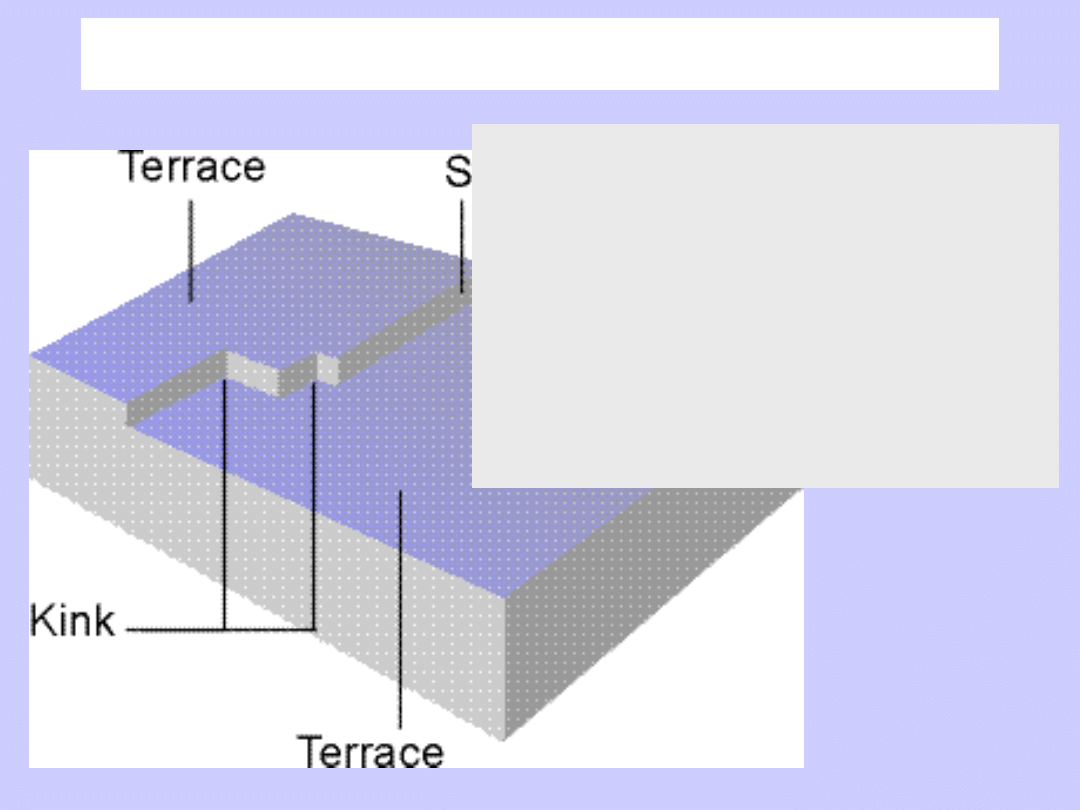
Powierzchnia
Przyczyna zjawiska adsorpcji:
oddziaływanie przyciągające
miedzy cząsteczkami gazu a stałą
powierzchnią.
Ponieważ H
ads
<0, zjawisko
adsorpcji związane jest z
obniżeniem energii.
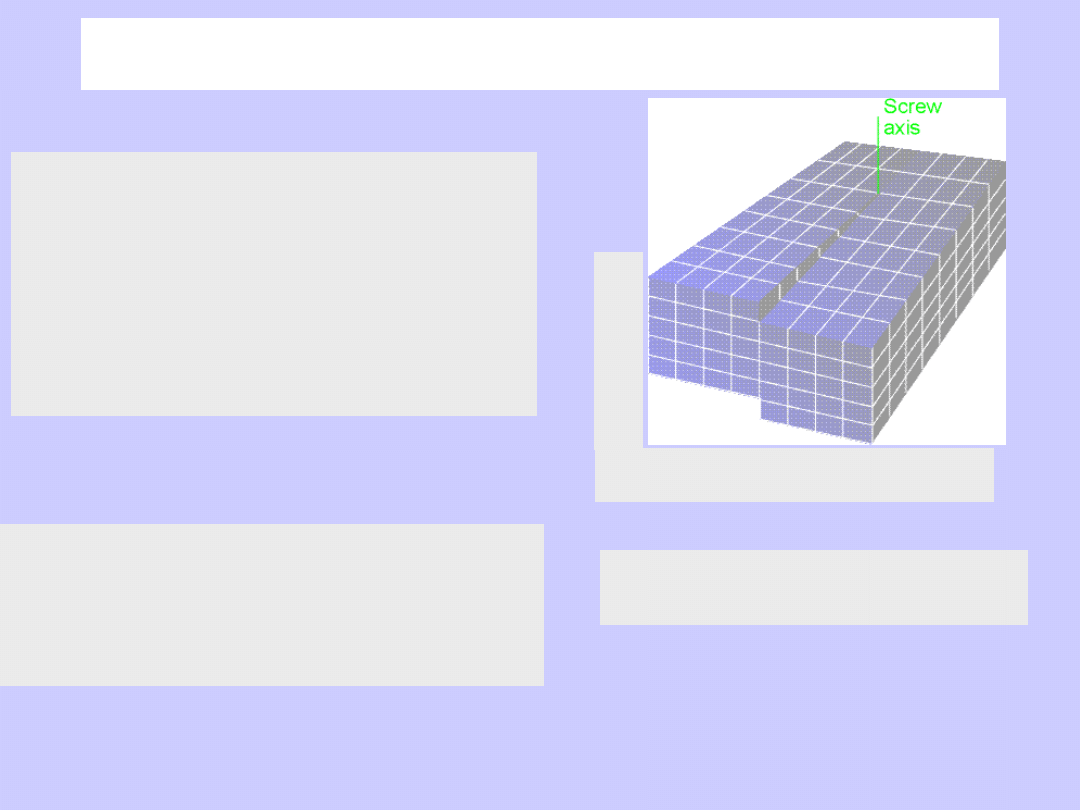
Powierzchnia
E
1
E
2
E
3
E
4
...
E
V
E
1
> E
2
> E
3
> E
4
... > E
V
Im więcej sąsiadów,
tym większe oddziaływanie.
Energia cząsteczek (atomów)
w głębi fazy (
E
V
)
jest najniższa.
F = -grad E = -
E
Siła działająca w kierunku
prostopadłym do powierzchni,
skierowana do wnętrza fazy

Energia powierzchni
T = const., V = const.
F = U - RT
dF = W
el
=
ds.
Nieobjętościowa praca
związana ze zmianą
wielkości powierzchni
fazy.
0
,
V
T
s
F
Energia fazy zależy
nie tylko od T i V,
lecz i od wielkości powierzchni !
Jednostkowa
energia powierzchni
Energia wewnętrzna
jako funkcja wielkości powierzchni „s”
,
,
,
,
,
,
,
,
0
0
0
T V
T V
el pow
el pow
el pow
el pow
T V
V
T V
V
V
U
F
S
F
T
S
s
s
s
T
U
ds
ds T
ds
dU
W
Q
s
T
T
W
Q

Równowaga
mechaniczna:
zachowanie stałej
objętości kulistej
kropli cieczy
p
1
- p
2
= 2
/r>0
p
1
p
2
dF=-p
1
dV
1
-p
2
dV
2
+
ds=0
dV
1
=-dV
2
=4
r
2
dr
ds=8
rdr
Kształt kropli
kulistej wynika z
minimum energii
powierzchniowej
Równowaga
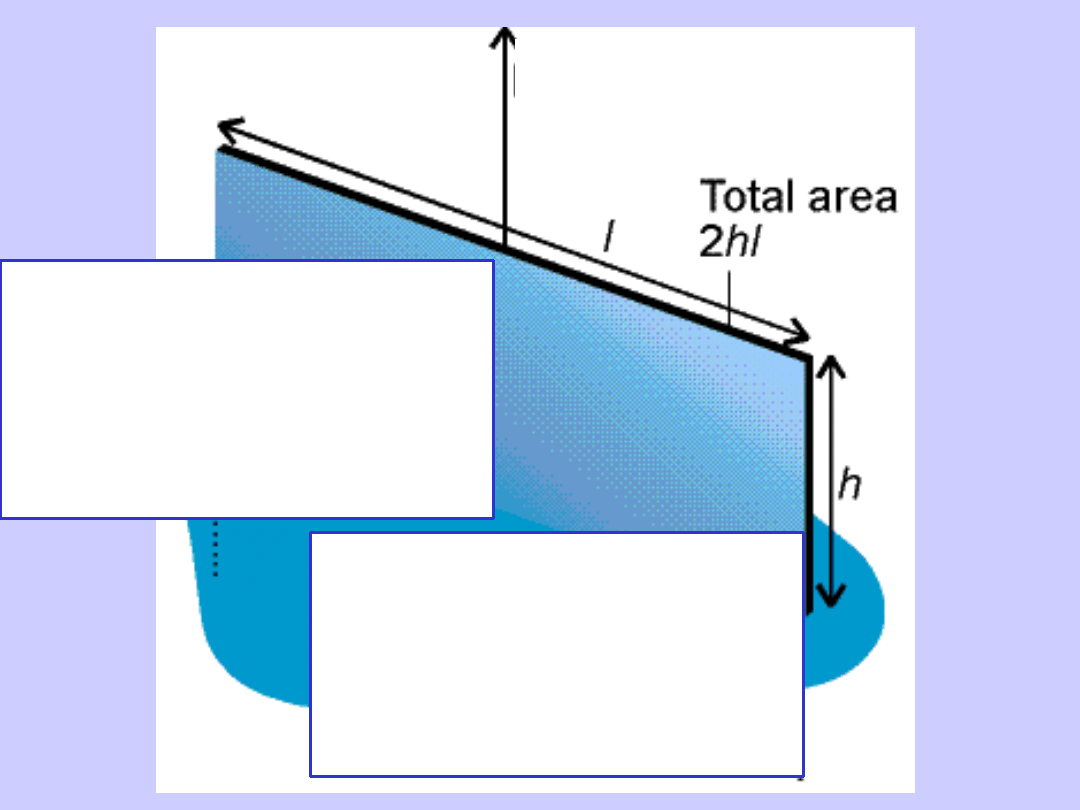
Siła
styczna do powierzchni
,
przypadająca na jednostkę
długości krawędzi.
[N/m]
Fh= 2hl
=F/2l
Praca konieczna do zwiększenia
powierzchni o jednostkę
[J/m2]
W= 2hl
=W/2hl
W=Fh
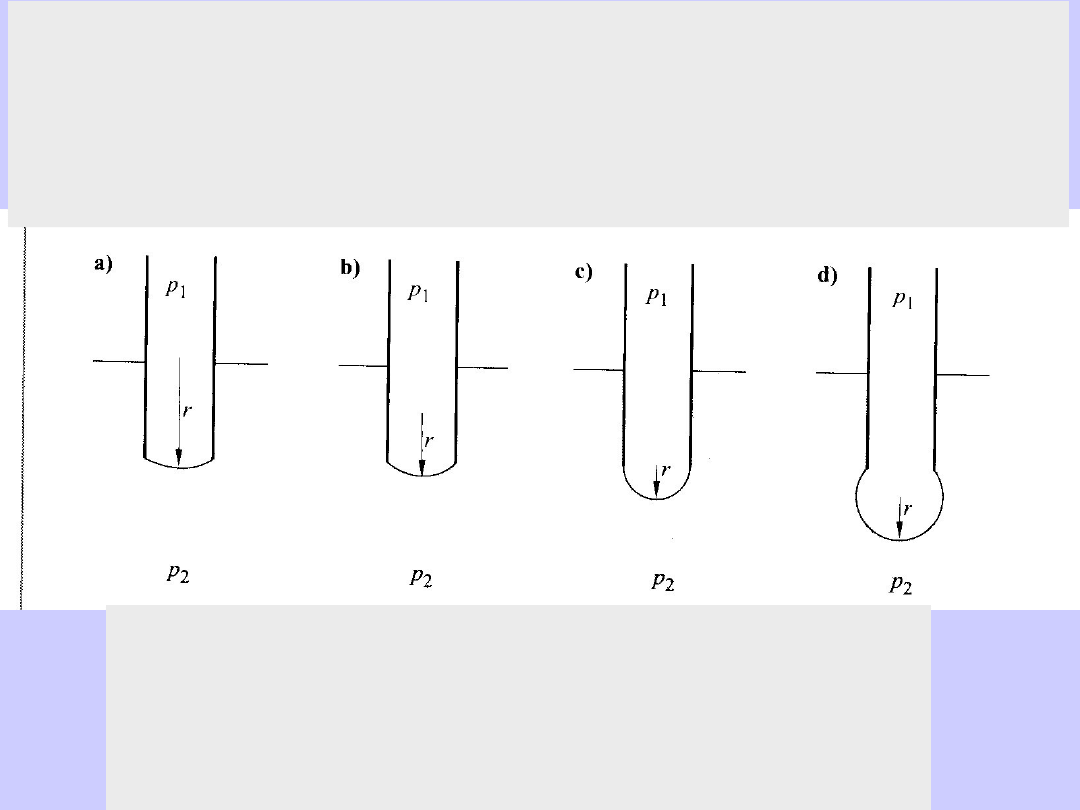
Pomiar metodą pęcherzykową:
pomiar ciśnienia, przy którym pęcherzyk powietrza
odrywa się od kapilary o promieniu r.
p
x
- p
zew
=2
/r
kapilary
Pęcherzyk jest stabilny, aż do osiągnięcia kształtu półkuli przy „p
x
”.
Dla p<p
x
panuje równowaga, ponieważ p - p
zew
= 2
/r>0
Gdy p>p
x
, pęcherzyk samorzutnie rośnie przy stałym p
(brak równowagi) ponieważ p - p
zew
> 2
/r dla rosnącego r
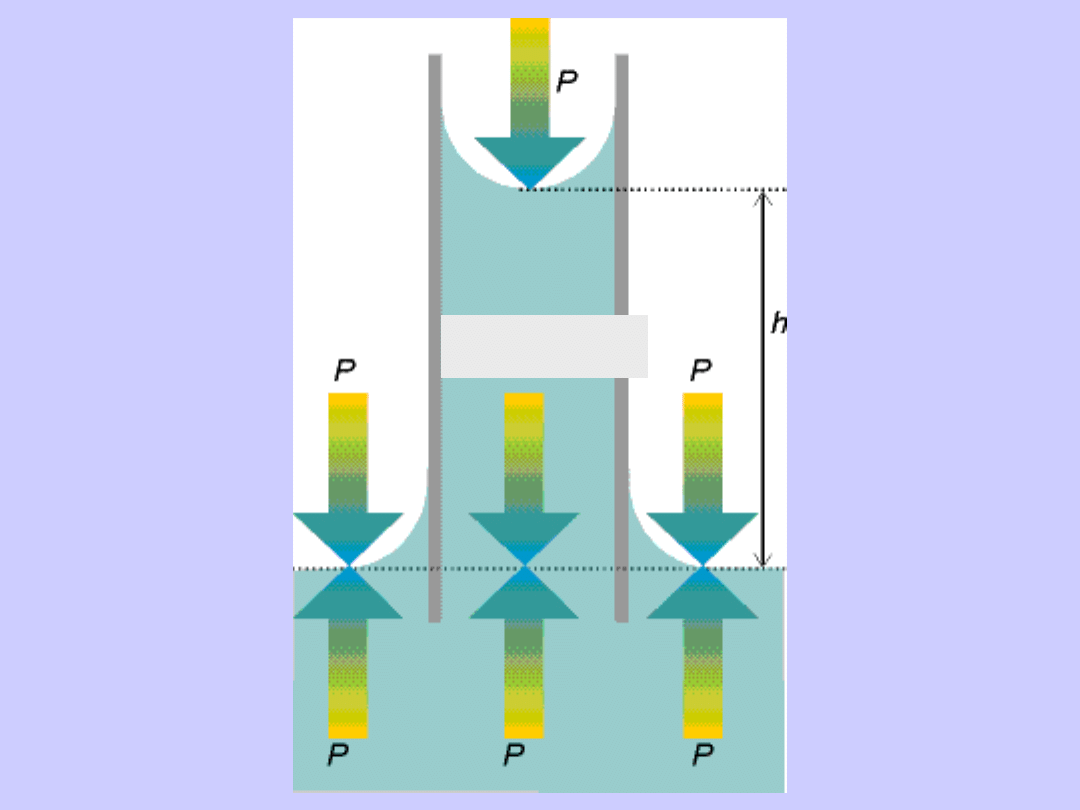
P-2/r+gh
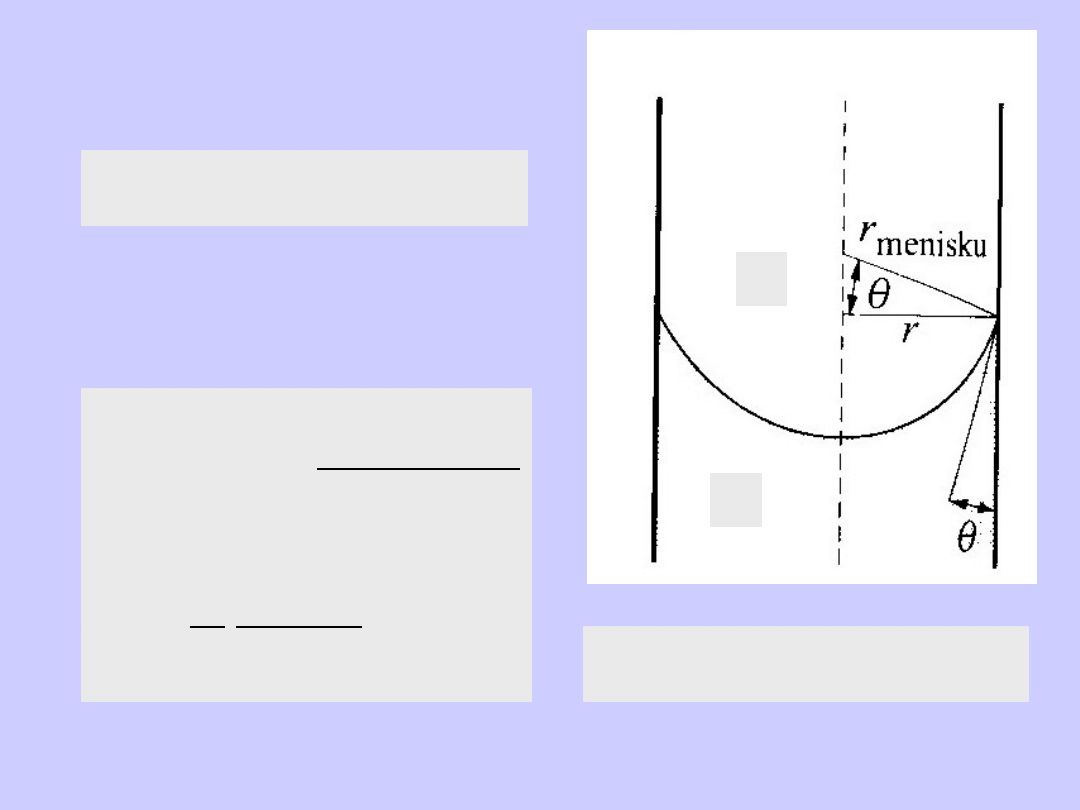
r
menisku
= r/cos
cos
2
1
cos
2
2
1
rhg
r
p
p
p
2
p
1
p
1
-p
2
=
gh >0
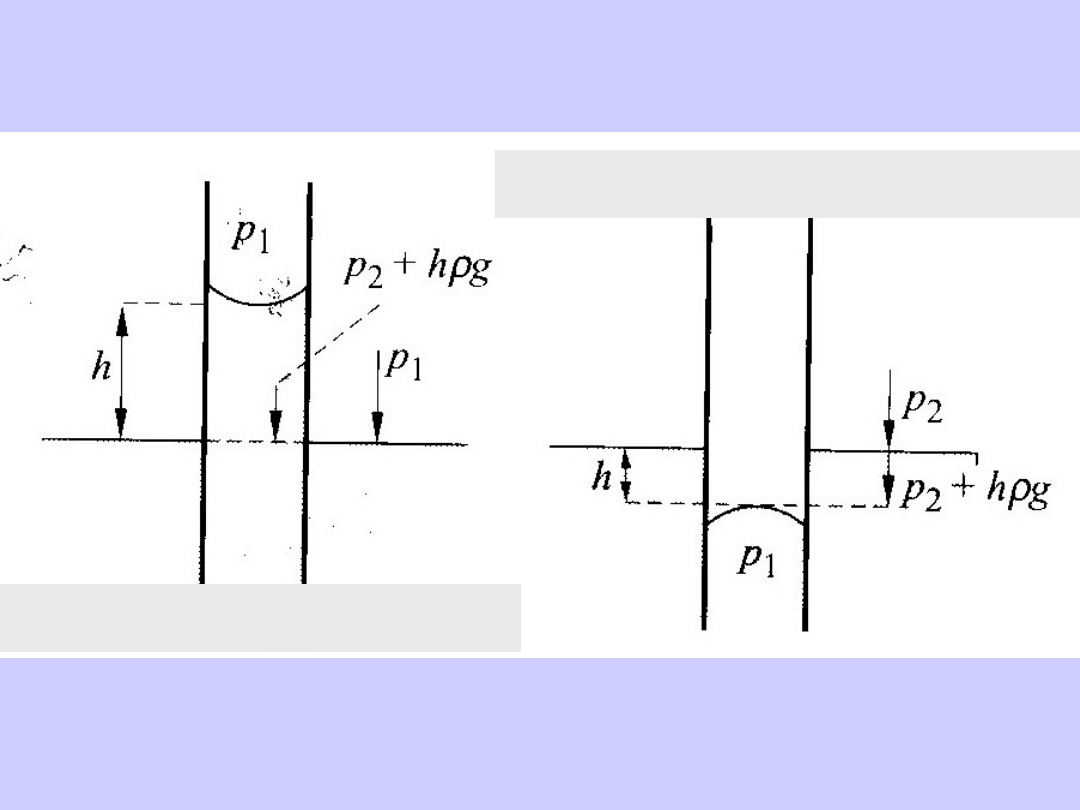
h>0, cos
>0, 0<
<90
o
h<0, cos
<0, 90
o
<
<180
o
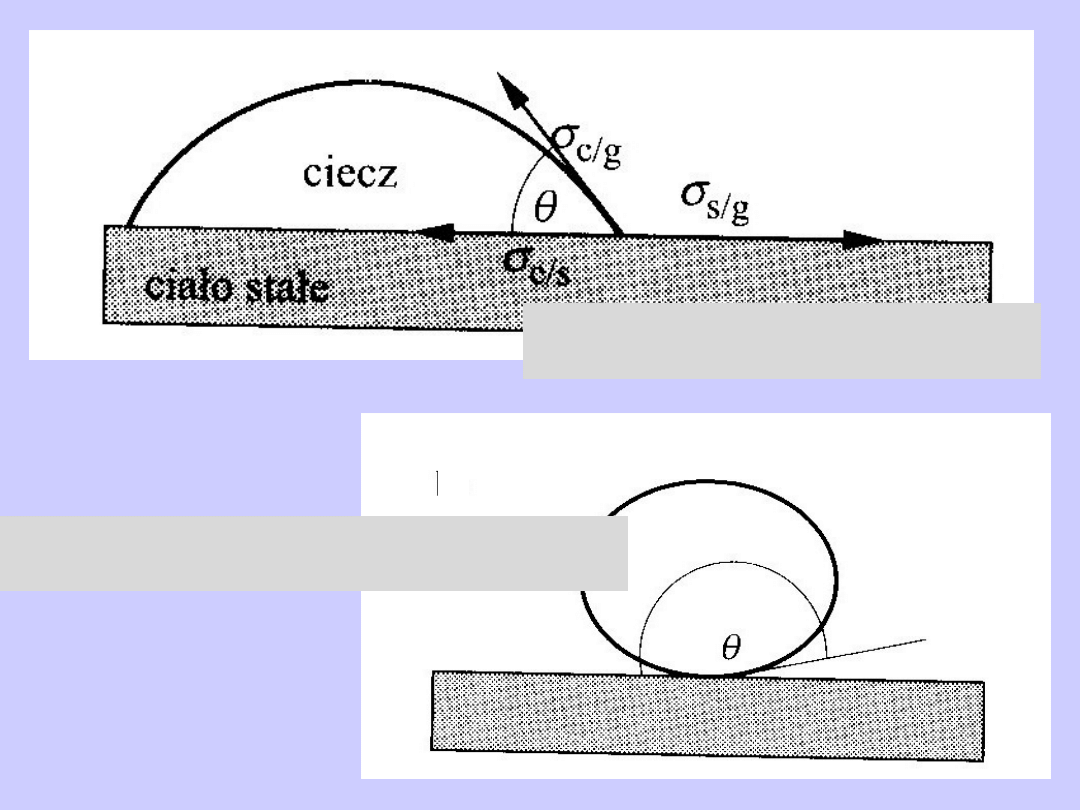
Zwilżanie powierzchni
Brak zwilżania powierzchni
s/g
l/g
s/l
cos
/
/
/
g
c
s
c
g
s
Bilans sił pozostających
w równowadze na styku
cieczy i powierzchni stałej
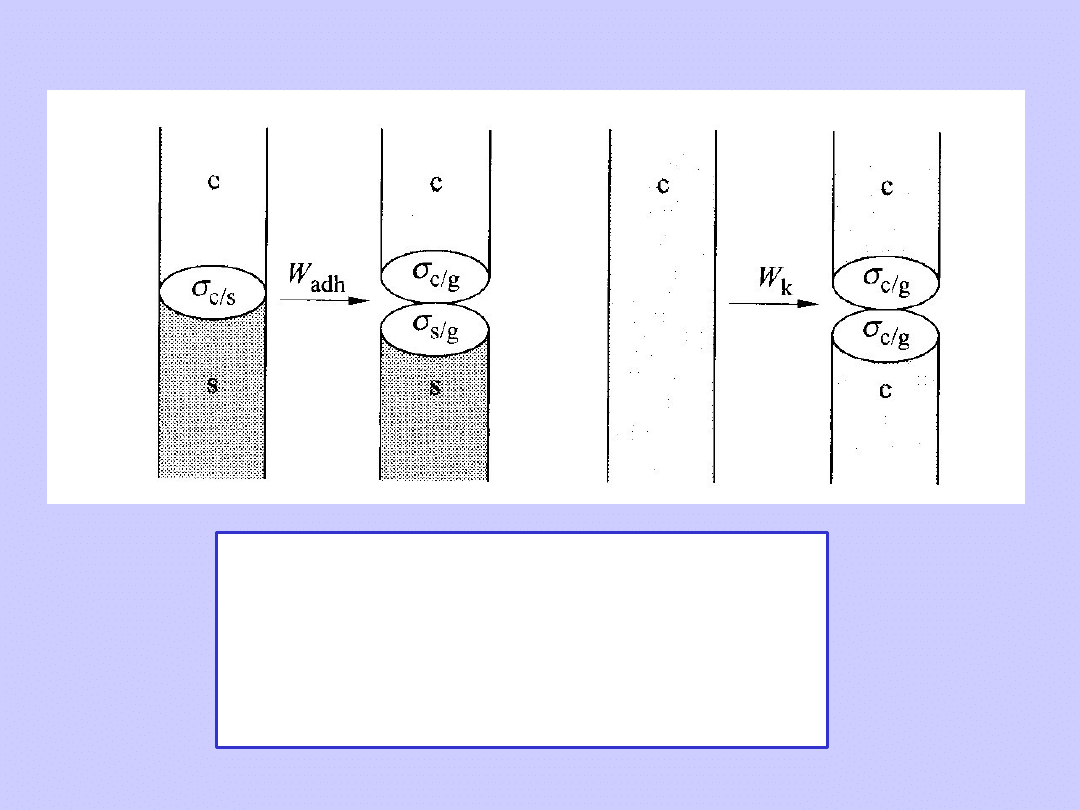
W
adh
energia adhezji (przylegania)
cieczy na powierzchni stałej.
W
k
energia kohezji (spójności)
cieczy.
g
c
k
g
c
adh
s
c
g
s
g
c
adh
W
W
W
/
/
/
/
/
2
)
cos
1
(
W
adh
jest czynnikiem decydującym
o zwilżaniu powierzchni stałej
(cos
) przez ciecz (
)
Duża adhezja = dobre zwilżanie.
2
cos
1
adh
k
W
W
cos
1
0
cos
1
180
o
adh
k
o
adh
k
W
W
W
W
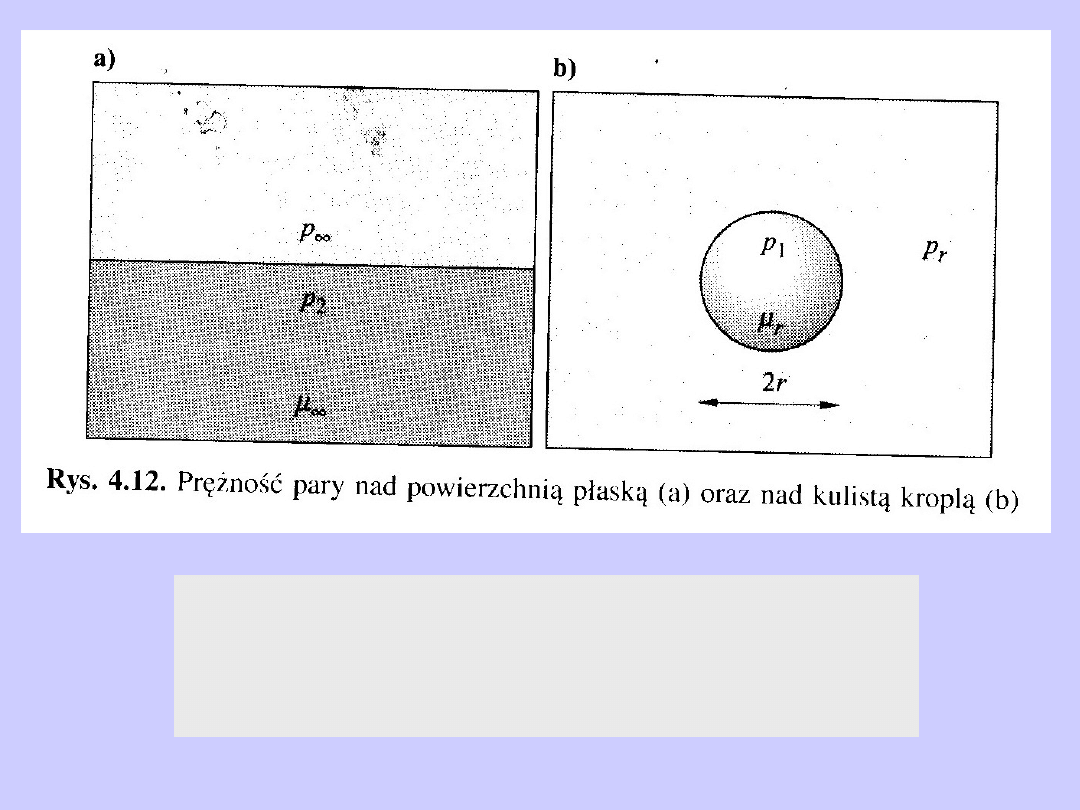
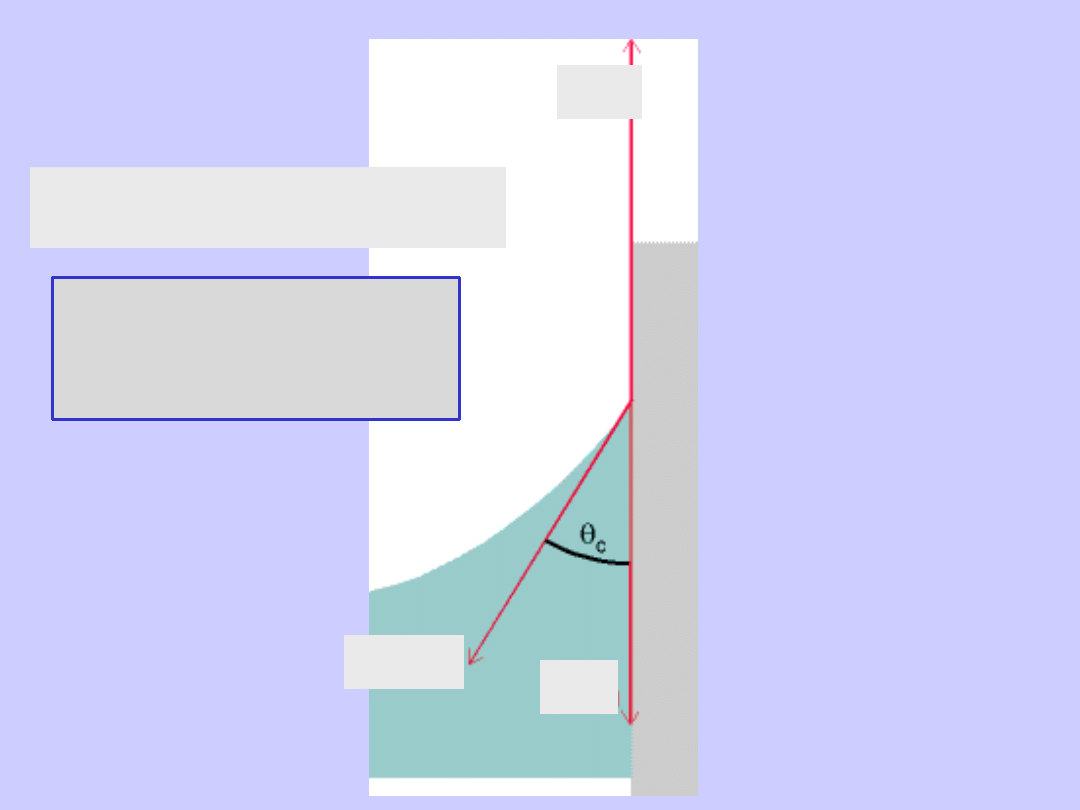
Równowaga termodynamiczna
w procesie parowania cieczy
z powierzchni kropli kulistej o promieniu r

!
paruje
silniej
kropla
0
2
ln
oraz
wiec
2
1
p
p
Kelvina
wzór
RTr
p
p
p
p
p
p
r
r
r
r
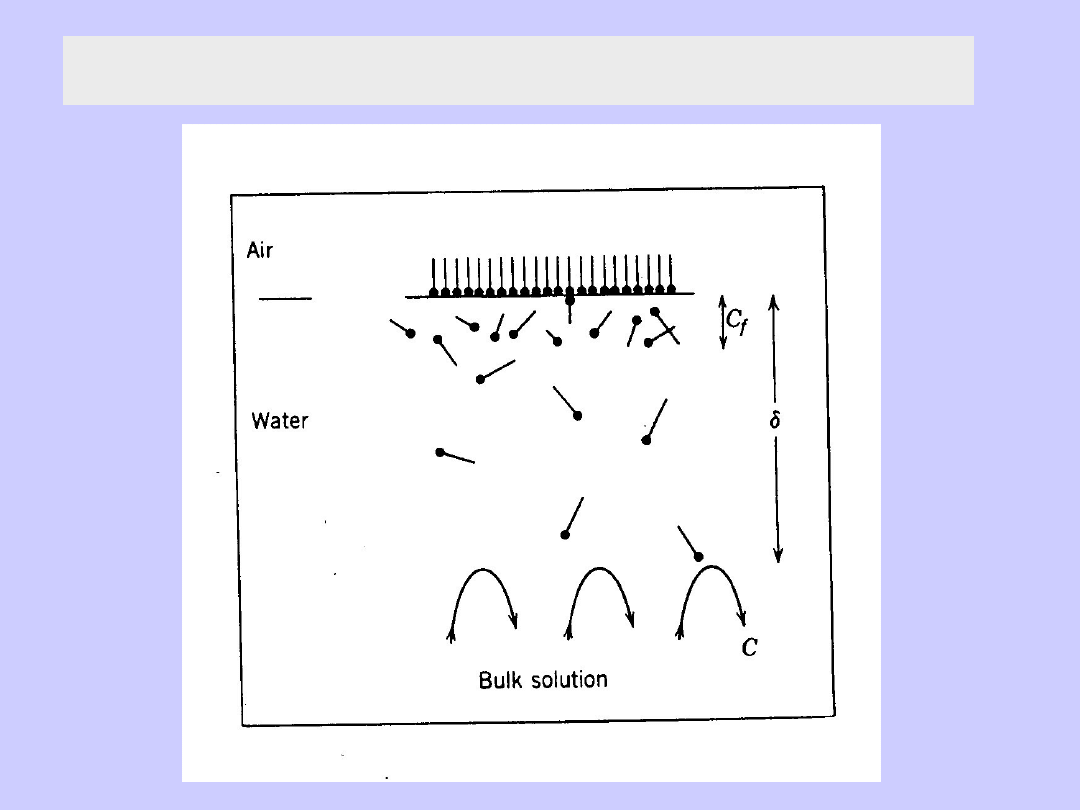
Adsorpcja w roztworze na powierzchni cieczy
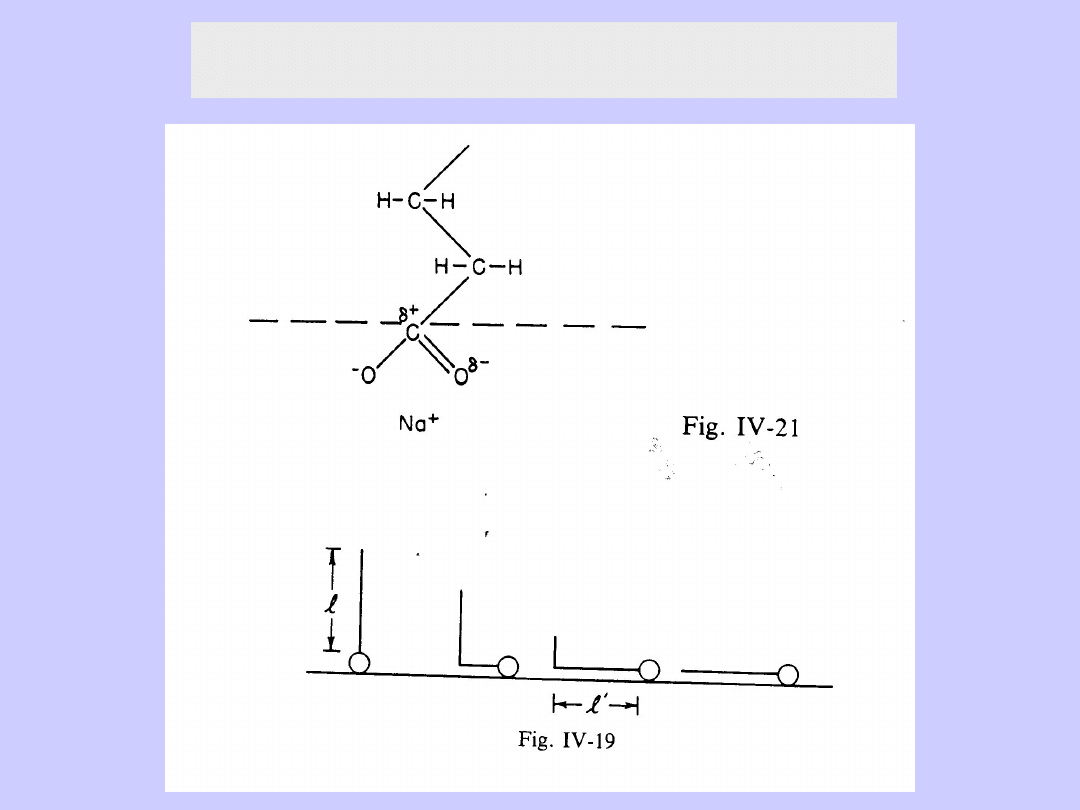
Środki powierzchniowo czynne
'
2
2
1
1
1
'
2
2
2
2
,
2
2
n
n
n
n
s
n
p T
n
n
s
c
RT
c
RT
c
c
Nadmiar
powierzchniowy
substancji
rozpuszczonej (2)
w roztworze.
Izoterma Gibbsa
Równanie Szyszkowskiego
0
1
ln(1
)
1
1
Gdy
1
Równanie gazu powierzchniowego
Powierzchnia 1 czasteczki (1 mola)
b
ac
bac
ba
b
ac
c
ac
R
bac
T
ac
ac
RT
RT
RT
RT=p
RT=
Wyszukiwarka
Podobne podstrony:
W7 zarządzanie zapasami
W7 Mosty
W7 IMMUNOLOGIA INFEKCJI
spoleczna w7
W7 WZNACNIACZ OPERACYJNY RZECZYWISTY
PRI W7 UML
FiR Matma w7 2011
FM zaocz W7 8 pp
Systemy Bezprzewodowe W7
IB w7
w7 kwestie spol bieda 2
PPS 2011 W7 id 381592 Nieznany
więcej podobnych podstron