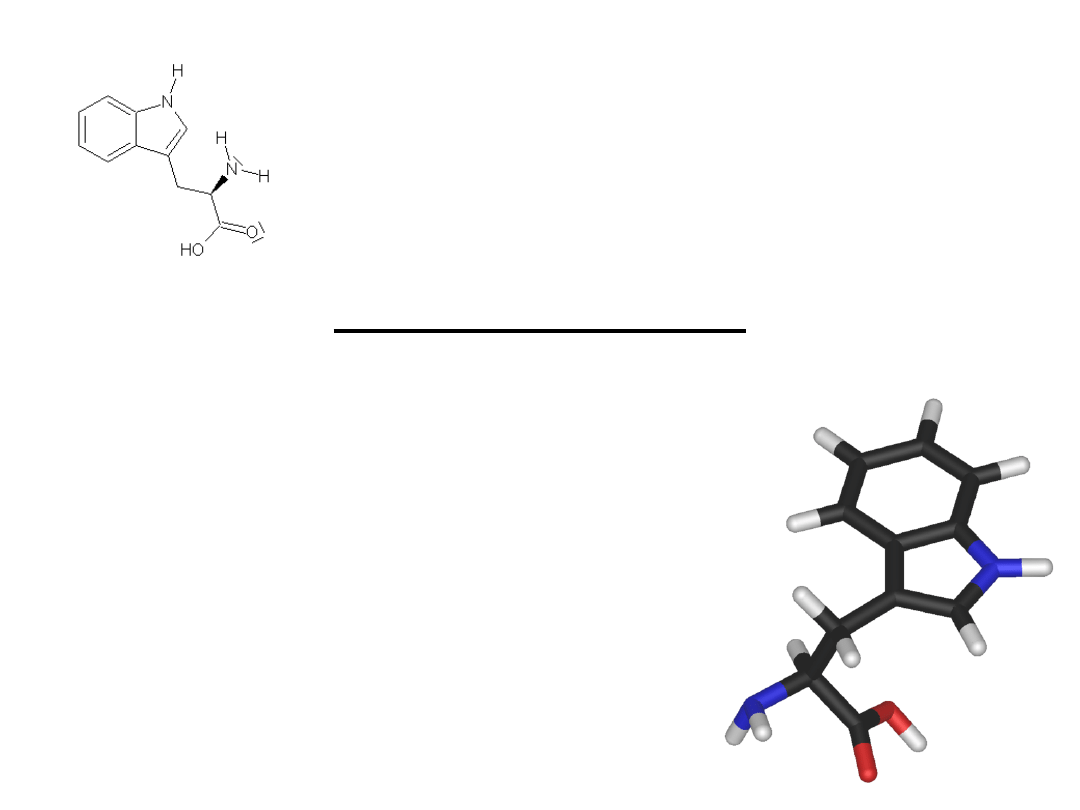
TRYPTOFAN

Tryptofan
jest to niezbędny, egzogenny, ketotwórczy aminokwas – kwas L-alfa-amino-beta-
indolopropionowy, C
11
H
12
N
2
O
2
. Tryptofan jest przekształcany (dekarboksylacja,
hydroksylacja) do neurotransmitera – serotoniny (5-hydroksytryptaminy). Niedobór
serotoniny powoduje depresję. Dlatego też w grupie leków przeciwdepresyjnych znalazł
się ten aminokwas, ponadto prekursory i pochodne tryptofanu oraz serotoniny.
Największa koncentracja serotoniny u człowieka występuje w mózgowiu, przewodzie
pokarmowym i w trombocytach. Roślinami bogatymi w tryptofan są banany,
Funkcje:
-
pomaga w zasypianiu
-
zmniejsza wrażliwość na ból
-
zmniejsza łaknienie alkoholu
-
naturalny środek antydepresyjny
-
pomaga zmniejszyć lęki i niepokój
-
jest używany przez mózg z wieloma witaminami i minerałami do
wytwarzania serotoniny,
neuroprzekaźnika znajdującego się w mózgu
-
w bardzo dużych dawkach może być toksyczny (zaburzenia wątroby, astma,
toczeń)
tego aminokwasu nie powinny przyjmować kobiety ciężarne, planujące
ciążę, osoby stosujące
antydepresyjne inhibitory MAOTauryna
-
jako pomoc w zasypianiu lekarz może zalecić 500mg łącznie z witamina B6,
amidem
kwasu nikotynowego i magnezem do przyjmowania na ok
godzinę przed położeniem się spać
Źródła:
biały ser, mleko, mięso, ryby, indyk, banany, ogólnie białka są dobrymi źródłami tego
aminokwasu

Indol i serynę kontaktuje się z enzymem, otrzymanym z takich mikroorganizmów, jak E. Coli,
Claviceps, Neurospora, B. Subtilis, Saccaromyces i naniesionym w znany sposób na strukturę
włóknistą polimeru włóknotwórczego.
Sposób ten można także stosować do zwiększania ilości tryptofanu
w hydrolizowanych proteinach. Doprowadza się wówczas pH do odpowiedniej wartości,
następnie do protein dodaje się żądaną ilość indolu i kontaktuje z włóknem, zawierającym
kompleks enzymatyczny. Część seryny znajdującej się w mieszaninie reakcyjnej ulega
wówczas przemianie do tryptofanu.
Enzym zawarty w strukturze włóknistej można łatwo wyodrębnić
po zakończeniu reakcji i stosować go wielokrotnie.
Włókno, zawierające bardzo małe otwory, w których znajdują się enzymy oddzielone od
przestrzeni reakcyjnej bardzo cienką membraną, nie pozwalającą na dyspersję enzymów w
mieszaninie reakcyjnej, a umożliwiającą wykorzystanie ich aktywności katalitycznej. Jako
polimer włóknotwórczy stosuje się estryfikowaną celulozę, jak na przykład azotan celulozy,
poliolefiny, polimery i kopolimery otrzymywane z akrylonitrylu, akrylanu, metakrylanów,
estrów winylowych, chlorku winylu, chlorku winylidenu, styrenu, poliamidy, poliwinylobutyral
I i tym podobnych. Enzymy, katalizujące reakcję sprzęgania seryny i indolu, otrzymuje się w
znany sposób z mikroorganizmów takich, jak E. Coli, Claviceps, Neurospora, B. Subtilis,
Saccaromyces.
Najkorzystniejsze wyniki uzyskuje się, stosując w roli katalizatora naniesiony na włókno z
trójoctanu celulozy enzym, otrzymany z E. Coli.
Enzymy, znajdujące się w polimerze, długo zachowują aktywność.
Stwierdzono, że nie tracą one aktywności po upływie 6 miesięcy przy pracy w normalnych
warunkach ruchowych. Zmniejsza to znaczenie, lub nawet czyni zupełnie nieistotnym koszt
otrzymywania katalizatora, wpływając na koszty wytwarzania tryptofanu. Pozwala to na
stosowanie bardzo czystych związków enzyma tycznych, które są bardzo długo aktywne.
Sposób enzymatycznego wytwarzania L-
tryptofanu

Enzymy nie dyfundują z polimeru do mieszaniny reakcyjnej, wskutek czego nie istnieje
problem ich wyodrębniania, a poreakcyjny roztwór tryptofanu nie zawiera zanieczyszczeń
utrudniających ekstrakcję, jak to ma miejsce w sposobach fermentacyjnych.
W sposobach fermentacyjnych otrzymuje się stosunkowo duże ilości innych
aminokwasów, przede wszystkim alaniny i waliny, a ponadto w środowisku reakcji znajduje się
szereg zanieczyszczeń. Ponieważ enzymy działają tylko na L-serynę, natomiast w sposobie
omawianym według jako mieszaninę reakcyjną stosuje się L, D-serynę. Niezużytą B-serynę
wyodrębnia się z dobrą wydajnością, racemizuje sposobem chemicznym, a następnie zawraca.
Nie jest konieczny szczególnie pracochłonny dobór i ochrona mikroorganizmów, niezbędnych
do wytwarzania L-tryptofanu, ani też prowadzenie reakcji w środowisku, zawierającym
pożywki dla tych mikroorganizmów.
Inną zaletą sposobu jest możliwość pracy systemem ciągłym, co znacznie upraszcza wytwórnię
i zmniejsza koszty wytwarzania L-tryptofanu. Wytwarzanie tego aminokwasu sposobem
fermentacyjnym wymaga stosowania skomplikowanej aparatury, zapewniającej dobre
mieszanie, napowietrzanie i sterylizację masy reakcyjnej, oraz dobrą kontrolę parametrów,
wpływających na przebieg zjawisk w reaktorze.
Omawiany sposób wymaga stosowania jednej lub więcej kolumn stalowych albo kolumn z
tworzyw sztucznych oraz pomp. Można również prowadzić reakcję sposobem periodycznym,
kontaktując substraty z enzymami w ciągu niezbędnego okresu czasu, usuwając i podając do
reaktora nową porcję substratów
Włókno z naniesionym enzymem stosuje się wielokrotnie. W procesie ciągłym prowadzi się
reakcję katalizowaną enzymem, naniesionym na włókno, ekstrahuje powstały L-tryptofan
znanymi sposobami, na
przykład przez adsorpcję na węglu aktywnym lub żywicy jonowymiennej, lub też wyodrębnia
przez krystalizację po uprzednim doprowadzeniu do stanu nasycenia.
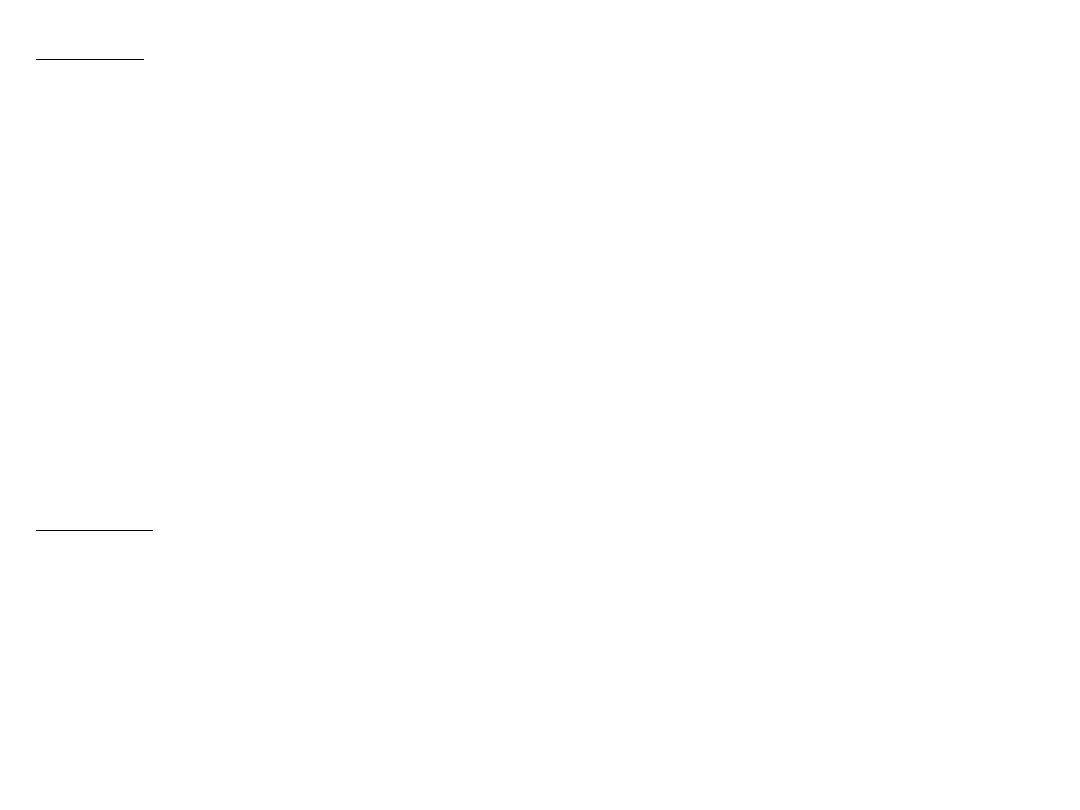
Przykład I.
Do 70 g komórek E. Coli, hodowanych na podłożu mineralnym Davisa dodano niewielką ilość indolu w
140 ml buforu fosforanowego o pH=7,8 (0,01 m EDTA i 0,0001 m fosforanu pirydoksalu). Zawiesinę
poddano obróbce ultradźwiękami, następnie odwirowano, ogrzano w ciągu 3 minut w temperaturze 0°C
w roztworze siarczanu amonowego o stężeniu, odpowiadającym 0,3—0,5 stopnia całkowitego nasycenia,
rozpuszczono w buforze fosforanowym (0,01 m EDTA, 0,02 m D, L-seryny, 0,0004 m fosforanu
pirydoksalu i gliceryny w ilości 30% objętościowych).
Tak otrzymany roztwór zawierał 32 mg protein/ml i 110 jednostek zdolnych do syntetyzowania
tryptofanu na 1 mg protein. Jako jednostkę przyjęto taką ilość enzymów, która powoduje syntezę 0,1
mola L-tryptofanu w temperaturze 25°C w ciągu 30 minut.
20 g trójoctanu celulozy rozpuszczono, mieszając, w 265 g chlorku metylenu i do całości dodano 30 ml
roztworu enzymatycznego.
W wyniku intensywnego mieszania w temperaturze 0°C w ciągu 30 minut otrzymano emulsję. Po
przelaniu emulsji do niewielkiego zbiornika, utrzymywanego w temperaturze 0°C, przędzono włókna w
atmosferze azotu, a następnie koagulowano
w toluenie w temperaturze pokojowej. Włókna suszono pod zmniejszonym ciśnieniem w celu usunięcia
toluenu.
Do cylindrycznego reaktora o pojemności 2 litrów, zanurzonego w łaźni o temperaturze 25°C i
obracającego się wokół własnej osi, wprowadzono 10 g włókna z naniesionym katalizatorem i 1 litr
mieszaniny reakcyjnej, zawierającej 20 mg D, L-seryny w 1 ml, 2 mg fosforanu pirydoksalu/ml w 0,01 m
buforze fosforanowym o pH=7,8. Indol w postaci stałej dodawano porcjami ze względu na jego małą
rozpuszczalność. Reakcję prowadzono w ciągu 8 godzin, po czym
ciecz usunięto z reaktora, do którego wprowadzono następną porcję mieszaniny reakcyjnej. Cykl ten
powtarzano wielokrotnie. Ilość L-tryptofanu w cieczy poreakcyjnej wynosiła 7,9 g po pierwszym cyklu,
po 150 cyklach zaś praktycznie nie uległa zmianie i wynosiła 7,7 g
Przykład II.
Postępując w sposób analogiczny do opisanego w przykładzie I, otrzymano włókno z 20 g trójoctanu
celulozy z naniesionym
enzymem i 40 ml mieszaniny wody z gliceryną, zawierającej 90 mg protein/ml o aktywności właściwej 110
jednostek/mg. Włókna te zawierały 180 mg protein i miały aktywność 19800 jednostek na 1 g trójoctanu
celulozy. Stosując reaktor, opisany w przykładzie I, mieszano 10 g tych włókien w temperaturze 25°C z 1
litrem mieszaniny reakcyjnej o składzie podobnym do opisanego w przykładzie I. Po 8 godzinach w
roztworze znajdowało się 15 g L-tryptofanu.
Otrzymany tryptofan i niepszereagowaną serynę zaabsorbowano przy użyciu żywicy jonowymiennej i
wymyto oddzielnie roztworami o
różnym pH. Wyodrębniono w ten sposób 98% L-tryptofanu i 90% seryny. Serynę racemizowano chemicznie i
wykorzystywano do syntezy L-tryptofanu wyżej opisanym sposobem.

Przykład III.
Do wytwarzania tryptofanu użyto aparat składający sie ze szklanej kolumny o średnicy
wewnętrznej 4 cm i długości 50 cm otoczonej płaszczem termostatującym. Wlot i wylot z
tej kolumny połączony był z reaktorem, zaopatrzonym w mieszadło, przy czym na wlocie
zainstalowano pompę perystaltyczną o wydajności 0—1000 ml/min. 10 g włókna,
stosowanego w przykładzie II, wprowadzono do kolumny, po czym rozpoczęto
cyrkulowanie z szybkością 600 ml/min 2 litrów mieszaniny reakcyjnej o składzie takim, jak
mieszanina opisana w przykładzie I i II. Indol dodawano do reaktora porcjami, stale
mieszając. Po 8 godzinnym mieszaniu, gdy stężenie tryptofanu wynosiło 8 mg/ml, usunięto
1 litr mieszaniny, zastępując je 1 litrem świeżej mieszanki. Mieszaninę poreakcyjną
zatężono pod zmniejszonym ciśnieniem w celu wytrącenia części tryptofanu. Pozostały
roztwór zawrócono do reaktora, doprowadzając w ten sposób, stopniowo, do całkowitej
przemiany L-seryny.
Roztwór D-seryny racemizowano sposobem chemicznym i również zawracano. Postępując
w ten sposób można osiągnąć stopień przemiany racematu seryn do L-tryptofanu równy
około 80%.
Przykład IV.
100 g shydrolizowanych protein, pochodzących z mieszaniny kazeiny i krwi wołowej w
stosunku wagowym 1:1 i zawierających 5,4 części wagowych L-seryny, rozpuszczano w
500 ml 0,1 m buforu fosforanowego, po czym pH całości doprowadzano do wartości 7,8. Po
podaniu 2 mg fosforanu pirydoksalu roztwór cyrkulowano w aparacie, opisanym w
przykładzie III w temperaturze 25°C, aż do momentu uzyskania przemiany 20% L-seryny
do L-tryptofanu. Roztwór analizowano za pomocą automatycznego
analizatora aminokwasów, stwierdzając, że zawartość L-tryptofanu wynosi 4 mg/ml.

Przykład V.
Na rysunku przedstawiono schemat pracującej w sposób ciągły instalacji do enzymatycznej syntezy L-
tryptofanu z indolu i D, L-seryny. Mieszaninę reakcyjną przygotowuje się periodycznie w zbiorniku 5 otoczonym
płaszczem, do którego przewodami 1, 2, 3 i 4 doprowadza się D, L-serynę, indol, fosforan pirydoksalu i 0,1 m
wodny roztwór fosforanu potasowego o pH=7,8. Reagenty miesza się intensywnie w celu przyśpieszenia
rozpuszczania. Za pomocą pompy 6 mieszaninę reakcyjną podaje się, przewodem 7, do zbiornika 8, z którego
zasilany jest w sposób ciągły reaktor 12 zawierający włókna z naniesionym enzymem. Włókna te nie powinny
być zbyt gęsto upakowane w reaktorze, aby umożliwić lepsze wykorzystanie aktywności katalitycznej enzymów.
Zaleca się takie upakowywanie włókien, aby gęstość wynosiła 10—100 kg włókien/m3 objętości reaktora.
Oczywiście szybkość przemiany L-seryny maleje w miarę przebiegu reakcji. Dlatego też korzystne jest takie
prowadzenie ruchu instalacji, aby osiągnąć stopień przemiany 60—70%, wskutek
czego unika się niskich szybkości reakcji. Nieprzereagowaną L, D-serynę zawraca się do reaktora.
Bilans materiałowy reaktora na 1 kg enzymatycznego przedstawia się następująco. Pompa 9 podaje do reaktora
120 g/godz. D, L-seryny, 50,8 g/godz. indolu, 6 mg/godz. fosforanu pirydoksalu, 30 kg/godz. wody i 0,3
mola/godz. fosforanu potasowego. Z reaktora 12 otrzymano 60 g/godz. D-seryny, 20 g/godz. L-seryny, 78 g/godz
L-tryptofanu, 6 g/godz. indolu, 30 kg/godz. wody, 6 mg/godz. fosforanu pirydoksalu i 0,3 mola/godz. fosforanu
potasowego.
Pompa 10 służy do wywoływania intensywnej cyrkulacji mieszaniny reakcyjnej w reaktorze 12, homogenizując
mieszaninę i utrzymując niskie stężenie indolu w reaktorze. Natężenie przepływu wynosi około 1 m8/godz. na 1
kg włókna. Regulacja pH nie jest konieczna, ponieważ nie zmienia się ono zasadniczo podczas przebiegu
reakcji. Z wodnego roztworu, opuszczającego reaktor
12 ekstrahuje się indol inną cieczą, na przykład toluenem. Operację tę można prowadzić przy użyciu odstojnika
z mieszadłem w jednym lub w kilku etapach. Według schematu na rysunku indol ekstrahuje się W zbiorniku 13
za pomocą toluenu, doprowadzanego przewodem 30. Obie fazy ciekłe rozdziela się następnie w separatorze 14,
z którego przewodem 31 odbiera się rozpuszczalnik i kieruje do oczyszczenia. Fazę wodną, zawierającą serynę i
tryptofan, przesyła się pompą 15 do separatora 16 w celu wyodrębnienia tryptofanu,
co można zrealizować przy użyciu żywicy jonowymiennej lub węgla aktywnego. W pierwszym przypadku wolny
roztwór seryny i tryptofanu przepuszcza się, na przykład, przez kolumnę wypełnioną Amberlitem IR 118 w
formie wodorowej , na którym zostają
zaadsorbowane oba związki. Następnie kolumnę wymywa się kolejno 0,2 m wodnym roztworem NH4CI, w
którym rozpuszcza się seryna, oraz 0,2 m wodnym roztworem amoniaku, w celu odzyskania tryptofanu. Na
schemacie przedstawiono drugi sposób wy¬
odrębniania tryptofanu. Ze zbiornika 14 wodny roztwór przesyła się do koliummy 16, wypełnionej węglem
aktywnym, na którym adsorbouje się tryptofan, podczas gdy roztwór zawierający całą D-serynę i
nieprzereagowaną L-serynę podaje się przewodem 17 do reaktora 18. Stosuje się układ kolumn pracujących
równolegle w celu zapewnienia ciągłej pracy układu adsorpcyjnego. W jednej z kolumn adsorbuje się tryptofan,
w innych wymywa się zaadsorbowany tryptofan i przemywa węgiel aktywny wodą demiineralizowaną,
podawaną do kolumny przewodem 20 i odbieraną przewodem 32. Tryptofan wymywa się mieszaniną wody z
alkoholem w stosunku wagowym 1:1 (pH = 8), doprowadzaną przewodem 18. Przewodem 21 odpływa roztwór
tryptofanu, homogenizowany następnie w zbiorniku 22. Roztwór ten zawiera śladowe ilości fosforanu
pirydoksalu. Pompą 23 roztwór przesyła się do wyparki 24, w której stęża się go pod zmniejszonym ciśnieniem
w temperaturze 40°C, a następnie podaje przewodem 25 wymiennika ciepła 26 i krystalizatora 27.
W krystalizatorze 27 tryptofan wytrąca się, doprowadzając pH mieszaniny do wartości 5,9. Tak otrzymaną
zawiesinę odwirowuje się, zawracając część wody przewodem 28 do zbiornika 22 i usuwając pozostałą
część w celu uniknięcia nagromadzenia się zanieczyszczeń w obiegu. Wilgotne kryształy suszy się pod
zmniejszonym ciśnieniem. Roztwór D, L-seryny, opuszczający kolumny 16, racemizuje się w reaktorze 18
drogą podgrzania w wymienniku 29, przesyła się go do zbiornika 33, z którego pobiera się go do zbiornika
5 w celu przygotowania mieszaniny reakcyjnej. Przed wymiennikiem 29 można odprowadzać część
roztworu w celu zmniejszenia ilości zanieczyszczeń w obiegu
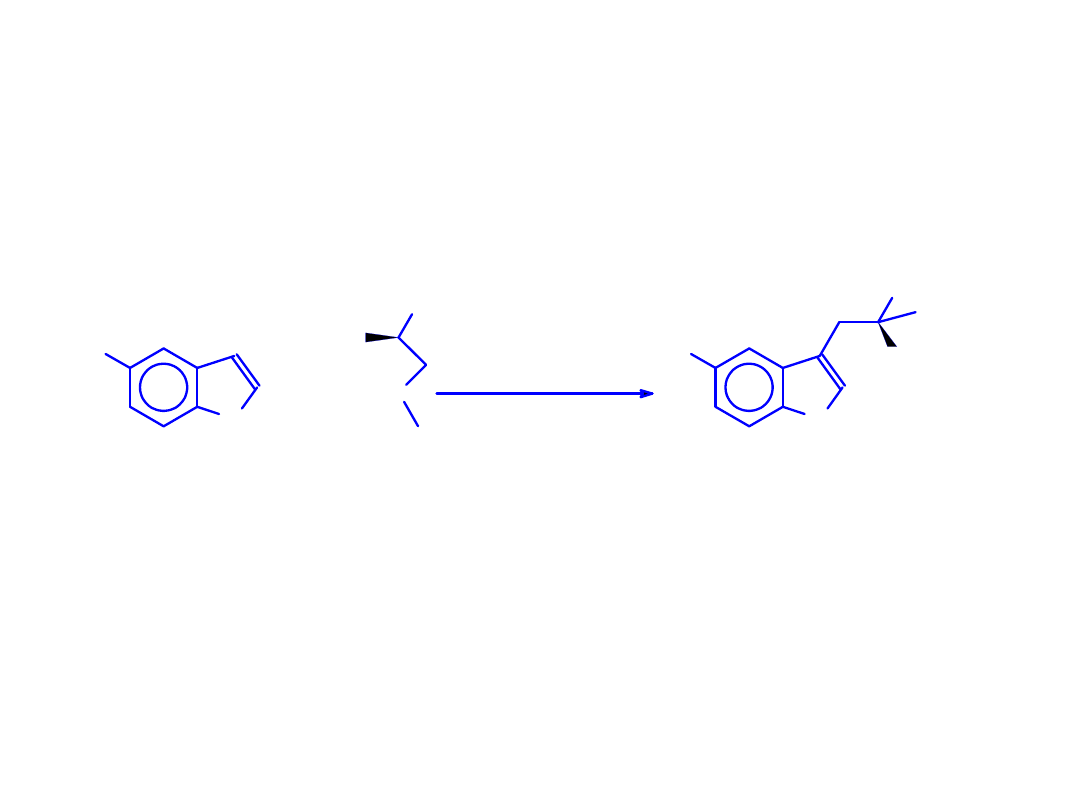
Enzymatyczna synteza L-tryptofanu i 5’-hydroksy-L-
tryptofanu znakowanego izotopami wodoru w pozycji
COOH
NH
2
S
R = -H or -OH
NH
R
TPase (EC 4.1.99.1)
+
NH
COOH
NH
2
R
D
2
O
(HTO lub DTO)
D/
T
(5'-R)-indol
S-metyl-L-cysteina
(5'-R)[2-
D/
T
]-L-Trp
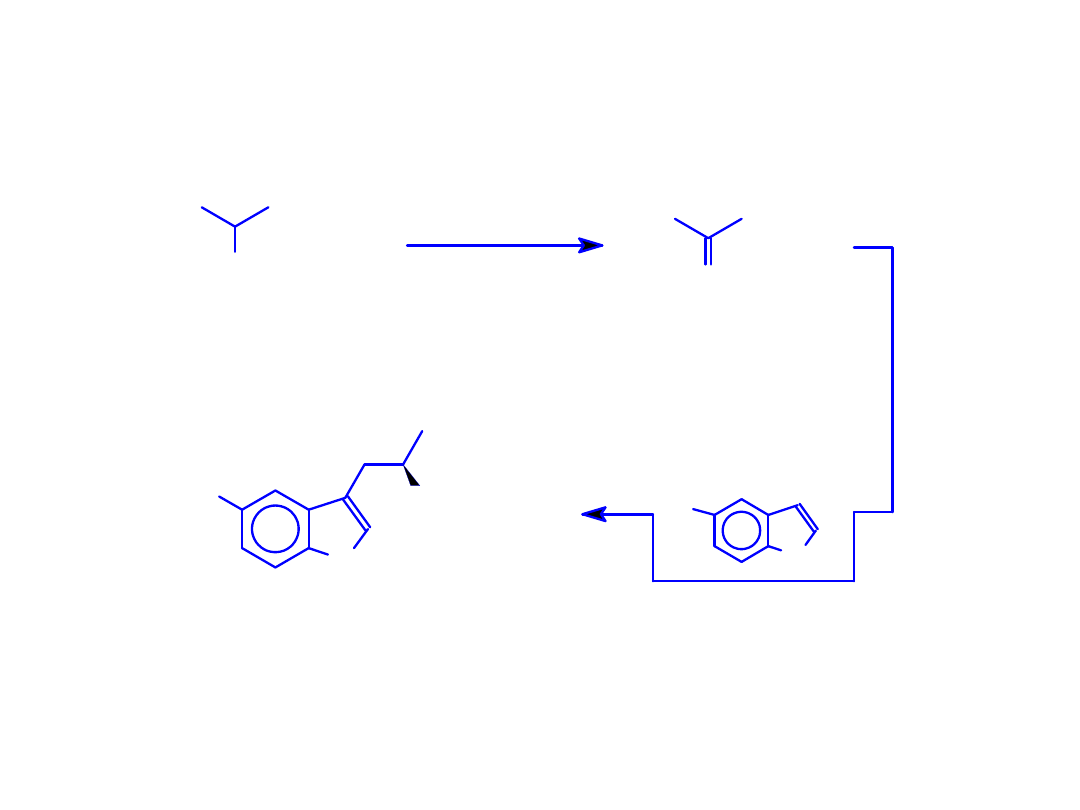
Synteza [1-
14
C]-L-tryptofanu
i 5’-hydroksy-[1-
14
C]-L-tryptofanu
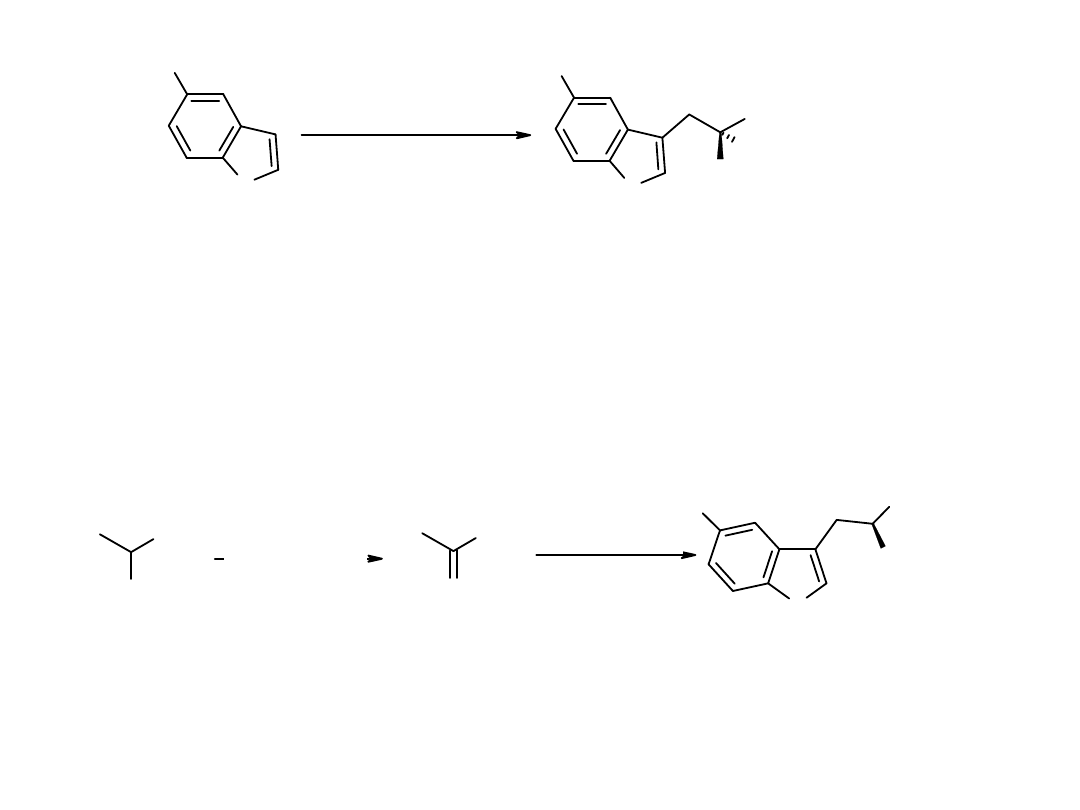
tryptophanase
NH
NH
2
R
R = H or OH
NH
R
O
GPT
D-AAO/catalase
NH
2
14
C
OOH
14
C
14
C
OOH
OOH
[1-
14
C]-alanina
kwas [1-
14
C]-pirogronowy
[1-
14
C]-L-Trp
lub
5'-OH-[1-
14
C]-L-Trp
N
H
COOH
R
H
2
NH
2
N
H
R
R = OH, 5'-hydroksy-[2 -
2
H]-L-tryptofan
5'-hydroksy-[2 -
3
H]-L-tryptofan
R = H, [2 -
2
H]-L-tryptofan
[2 -
3
H]-L-tryptofan
S-metylo-L-cysteina
PLP
2-merkaproetanol
Tryptofanaza
CH
3
SH
2
H
2
O lub
3
HHO
lub
3
H
+
R = OH, 5-hydroksyindol
R = H, indol
N
H
NH
2
C
14
R
C
14
NH
2
C
14
O
D-AAO / katalaza
GPT
tryptofanaza
indol lub
5-hydroksyindol
R = OH, 5'-hydroksy-[1 -
14
C]-L-tryptofan
R = H, [1 -
14
C]-L-tryptofan
D,L-[1-
14
C]-alanina
OOH
OOH
OOH
kwas [1 -
14
C]pirogronowy
Synteza L-tryptofanu i 5’-hydroksy-L-tryptofanu znakowanych izotopami wodoru.
Synteza L-tryptofanu i 5’-hydroksy-L-tryptofanu znakowanych
14
C.
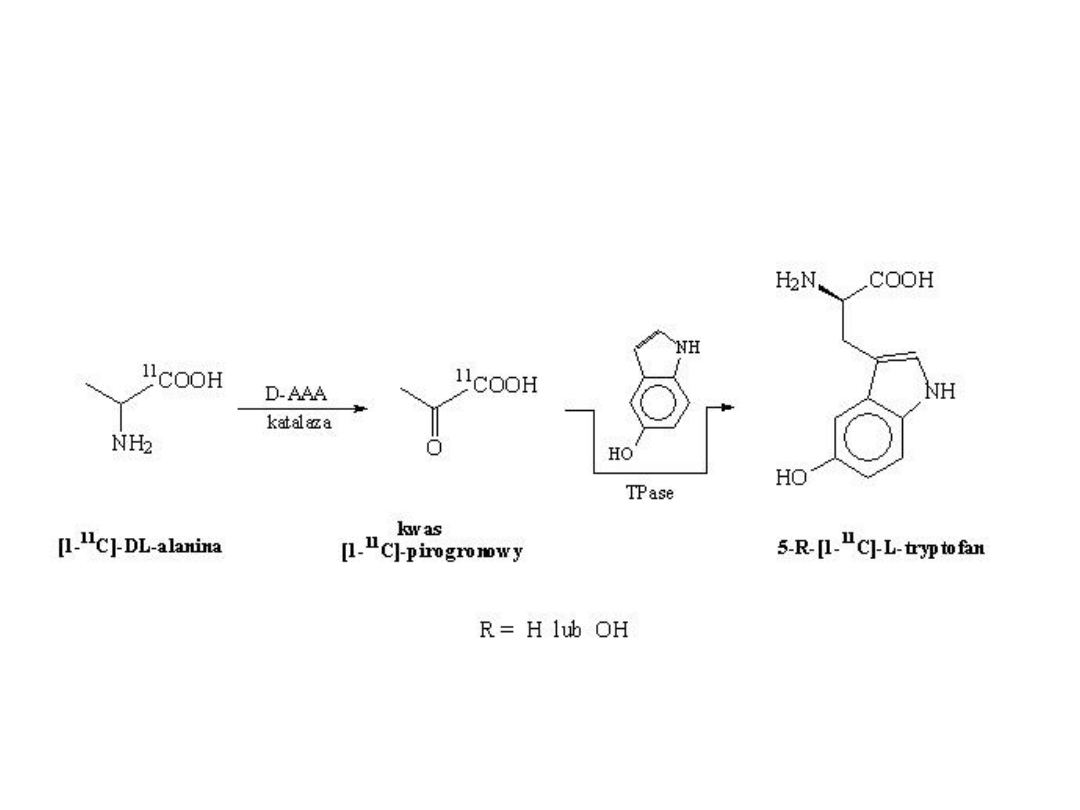
W drodze multienzymatycznej syntezy otrzymuje się [1-
11
C]-L-tryptofan i jego pochodną 5'-
hydroksy[1-
11
C]-L-tryptofan W ostatnim etapie reakcji sprzęgania kwasu pirogronowego z
indolem lub 5-hydroksyindolem uczestniczy enzym tryptofanaza (Tpase).
SYNTEZA ZE ZWIAZKÓW
INDOLOWYCH
BIOSYNTEZA I
PRODUKCJA
PRZEMYSŁOWA
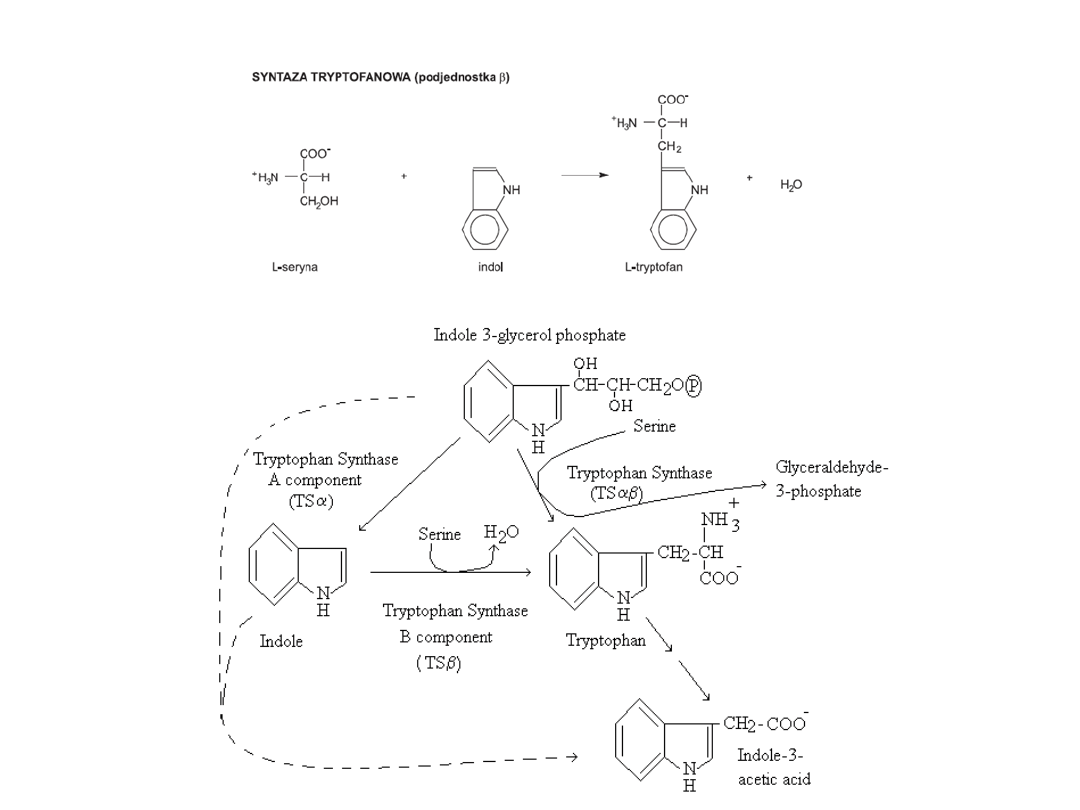
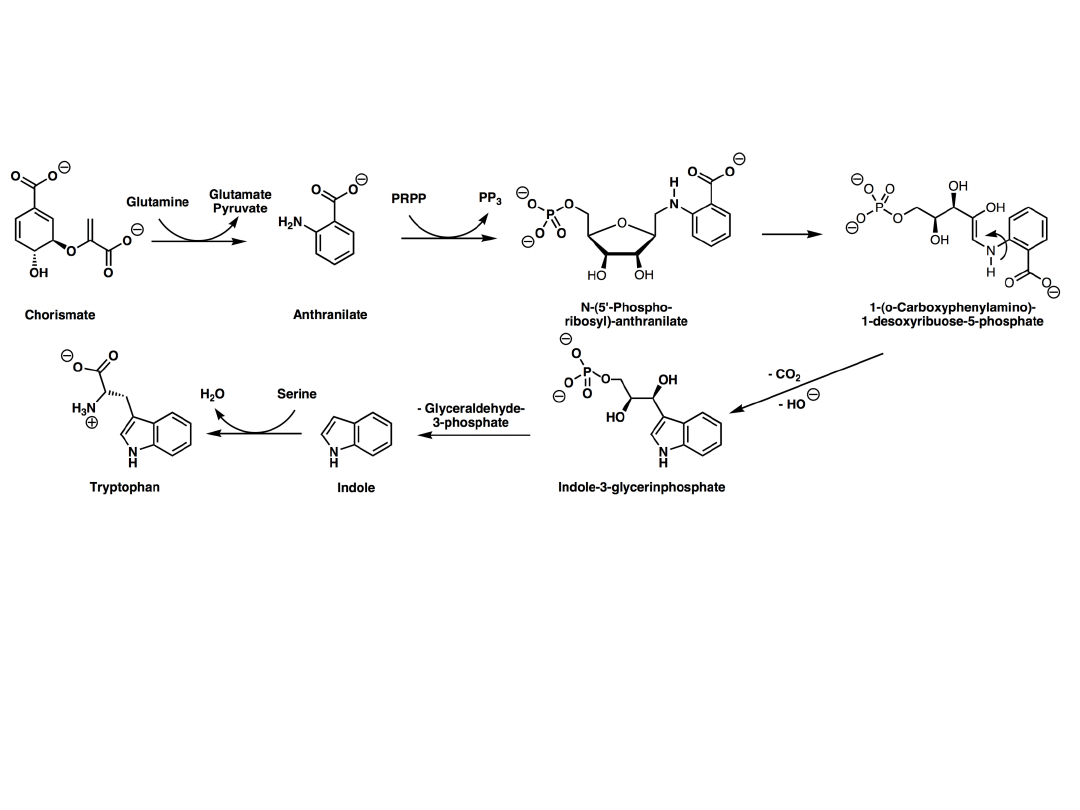
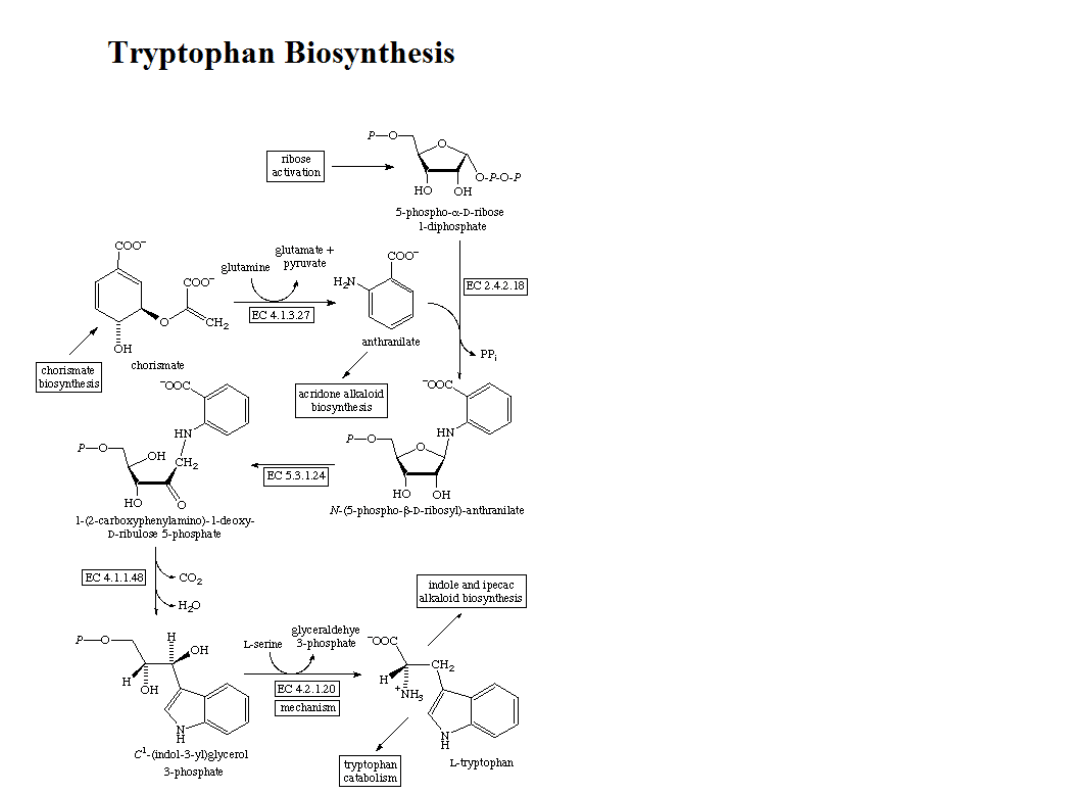
Plants and microorganisms commonly synthesize tryptophan from shikimic acid or anthranilate The
latter condenses with phosphoribosylpyrophosphate (PRPP), generating pyrophosphate as a by-
product. After ring opening of the ribose moiety and following reductive decarboxylation, indole-3-
glycerinephosphate is produced, which in turn is transformed into indole. In the last step, tryptophan
synthase catalyzes the formation of tryptophan from indole and the amino acid, serine.
The industrial production of tryptophan is also biosynthetic and is based on the fermentation of
serine and indole using either wild-type or genetically modified E. coli. The conversion is catalyzed
by the enzyme tryptophan synthase
Grupa naukowców ze słynnej firmy
biotechnologicznej Monsanto pod
kierunkiem Jihonga Lianga
skonstruowała genetycznie
modyfikowaną soję, która produkuje
duże ilości tryptofanu.
Naukowcy dodali do genomu soi gen
kodujący enzym syntazę antranilanu
(AS) pochodzący od kukurydzy. Enzym
AS jest niezbędny dla produkcji
tryptofanu przez komórki roślinne.
Syntaza antranilanu jednak
samodzielnie reguluje ilość
wytwarzanego tryptofanu, reagując
na zbyt wysokie stężenie tego
aminokwasu. Aby zatem zwiększyć
ilość powstającego tryptofanu,
naukowcy wykorzystali zmieniony
gen, niewrażliwy na stężenie
tryptofanu. Dzięki temu produkcja
aminokwasu nie była hamowana.
Ziarna transgenicznej soi zawierały
do 30 razy więcej tryptofanu niż
dzikie ziarna, a cecha ta utrzymuje się
z pokolenia na pokolenie. Białko i olej
sojowy z transgenicznych roślin nie
różniły się od normalnych ani
walorami smakowymi, ani
właściwościami.
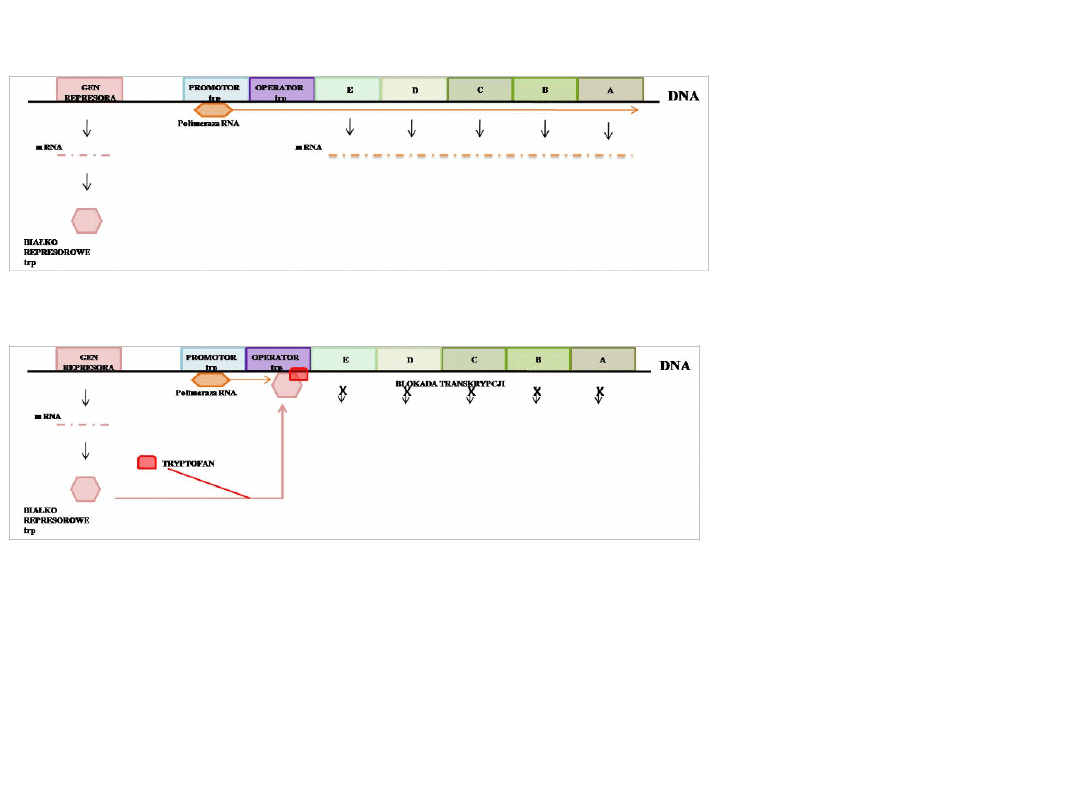
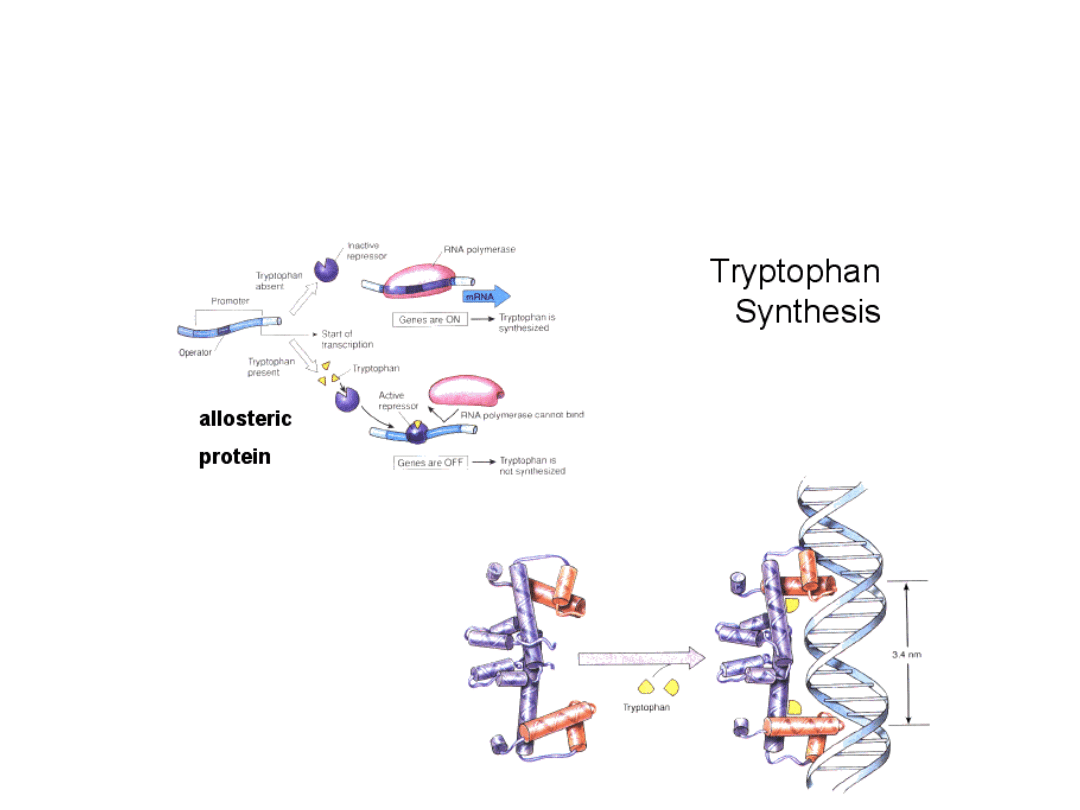
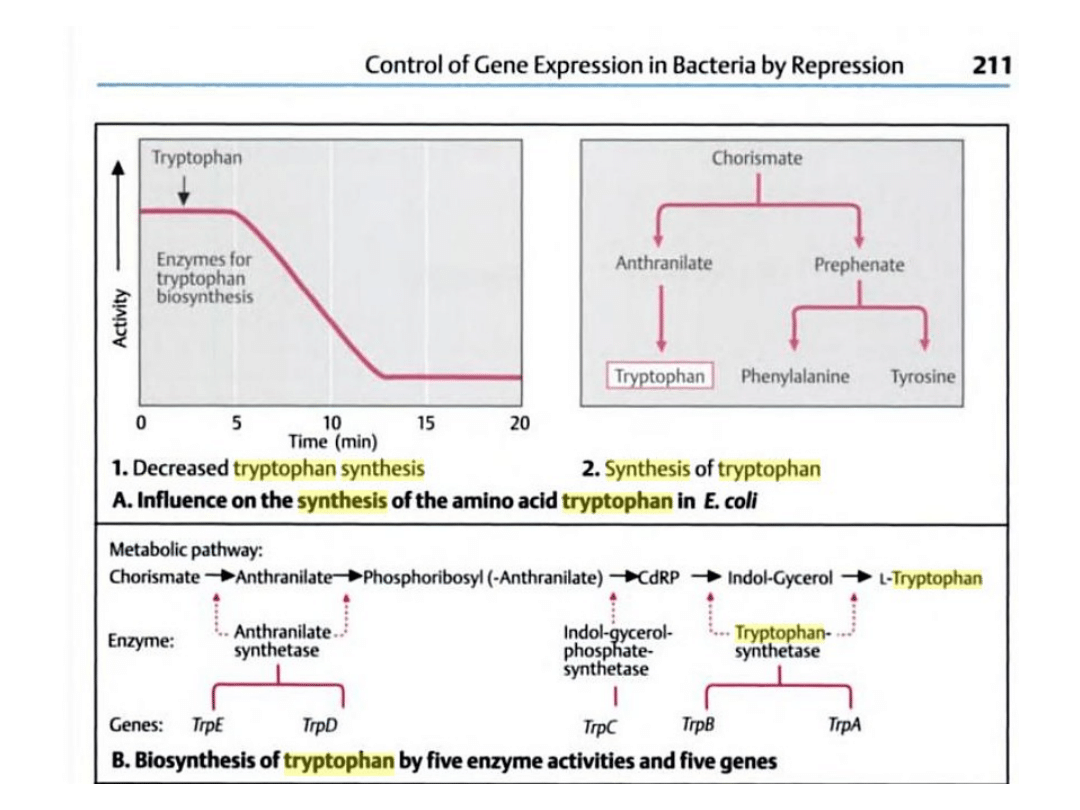
Synteza tryptofanu u
bakterii
Struktura i działanie operonu tryptofanowego przy
braku tryptofanu
Struktura i działanie operonu tryptofanowego w
obecności tryptofanu
Operon ten składa się z pięciu
genów: E, D, C, B i A
kodujących enzymy szlaku
biosyntezy tryptofanu. W
wyniku transkrypcji tych
genów tworzona jest dla nich
jedna cząsteczka mRNA.
Sekwencja genów struktury
poprzedzona jest sekwencją
promotorową (wspólną dla
wszystkich genów) oraz
sekwencją operatora
znajdującego się między nimi.
Genom bakterii zawiera także
gen regulatorowy kodujące
białko – represor, wiąże się z
sekwencją operatora po
wcześniejszym połączeniu z
tryptofanem.
Gdy w podłożu nie ma
tryptofanu, białko represorowe
nie może się związać z
operatorem, polimeraza może
swobodnie przesuwać się po
nici DNA i transkrybować geny
operonu.
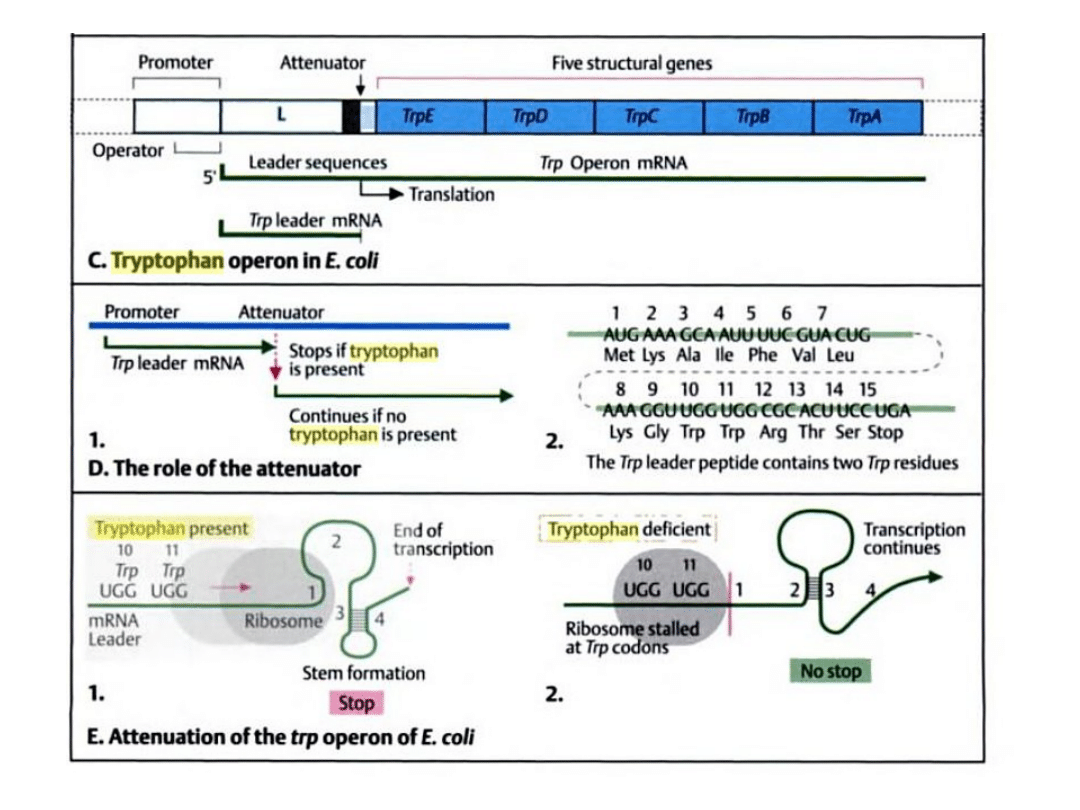
Operon tryptofanowy może być także kontrolowany na zasadzie mechanizmu atentacji,
wrażliwego na ilość tryptofanu. Opiera się on na zdolności nici DNA do tworzenia dwóch
różnych struktur przestrzennych w okolicy operatora w zależności od dostępności tryptofan.
Gdy jest go mało lub nie ma go wcale powstaje struktura zwana antyterminatorem nie
zatrzymująca transkrypcji i translacji. Jeśli stężenie tryptofanu jest wysokie nić DNA tworzy
strukturę uniemożliwiającą dalszą transkrypcje i translacje operonu – terminator.
Tryptofan jest bardzo popularny w USA jako odzywka, sprzedawana bez recepty. Praktycznie
caly tryptofan na rynku amerykanskim jest otrzymywany z transgenicznych bakterii, a
producentem jest jedna firma. W pewnym okresie produkcji uproszczono procedure
oczyszczania co spowodowalo pozostawienie w produkcie handlowym substancji toksycznych.
Prykład bakreti syntetyzujacych tryptofan:
Clavicepspurpurea (prekursor-Indol)
Hansenulaanomala (prekursor- Kwas antranilowy )


Materiał wyjściowy
Źródło energii
Powstające aminokwasy
CH
4
, NH
3
, H
2
, H
2
O
Wyładowanie elektryczne Gly, Ala, Abu
CH
4
, NH
3
, H
2
, H
2
S
Wyładowanie elektryczne Cys, Met i inne
HCHO, NO
3
-
, H
2
O, FeCl
3
Promieniowanie UV
Ser, Asp, Asn, Gly, Ala, Thr, Val,
Arg, Pro, Glu, His, Leu, Ile, Lys
Glukoza, NH
3
Promieniowanie UV
Gly, Ala, Asp, Val, Lys
CH
4
, C
2
H
6
, NH
3
, H
2
S, HCN
Wyładowanie elektryczne
promieniowanie UV
Phe, Tyr
HCHO, KNO
3
, H
2
O
Światło słoneczne 24-500
h
Asp, Lys, Ala, Gly, Arg, Glu, His,
Ser
Kwas winowy, KNO
3
, H
2
O
Światło słoneczne 500 h
Asp, Ala
CH
3
COONH
4
, H
2
O
Promieniowanie b
Asp, Glu
(NH
4
)
2
CO
3
Promieniowanie c
Gly, Ala
HCHO, NH
2
OH
ogrzewanie
Gly, Ala, Ser, Thr, Asp
HCONH
2
, N
2
230°C
Gly, Ala, Asp, Thr, Ser, Glu, Val,
Leu,
CH
4
, NH
3
, H
2
O(SIO
2
)
950°C
Gly, Ala, Asp, Thr, Ser, Glu, Val,
Leu, Pro, Ile, Tyr,
HCN, NH
3
, H
2
O
90°C ,18h
Arg, Ala, Gly, Ser, Asp, Glu, Leu,
Ile, Thr
Abiogenetyczne powstawanie aminokwasów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
efektt tryptofan
GB1008594A process for the production of amines tryptophan tryptamine
DL Tryptofan
DL Tryptofan (2)
tryptofan
tryptophan cu chelate decarbox
GB1008594A process for the production of amines tryptophan tryptamine
Tryptofan
an alternative and simple preparation of tryptamine from l tryptophan by catalytic decarboxylation w
Przemiana tryptofanu do melatoniny
Tryptofan
analytical characterisation of the routes by thermolytic decarboxylation from tryptophan to tryptami
więcej podobnych podstron