
Związki kompleksowe
Związki kompleksowe
(kompleksy, związki koordynacyjne)
to związki chemiczne, w których można wyróżnić jeden lub
więcej atomów centralnych, otoczonych przez inne atomy lub
ich grupy zwane ligandami, przy czym przynajmniej jedno
wiązanie atomu centralnego z ligandem ma charakter wiązania
koordynacyjnego.
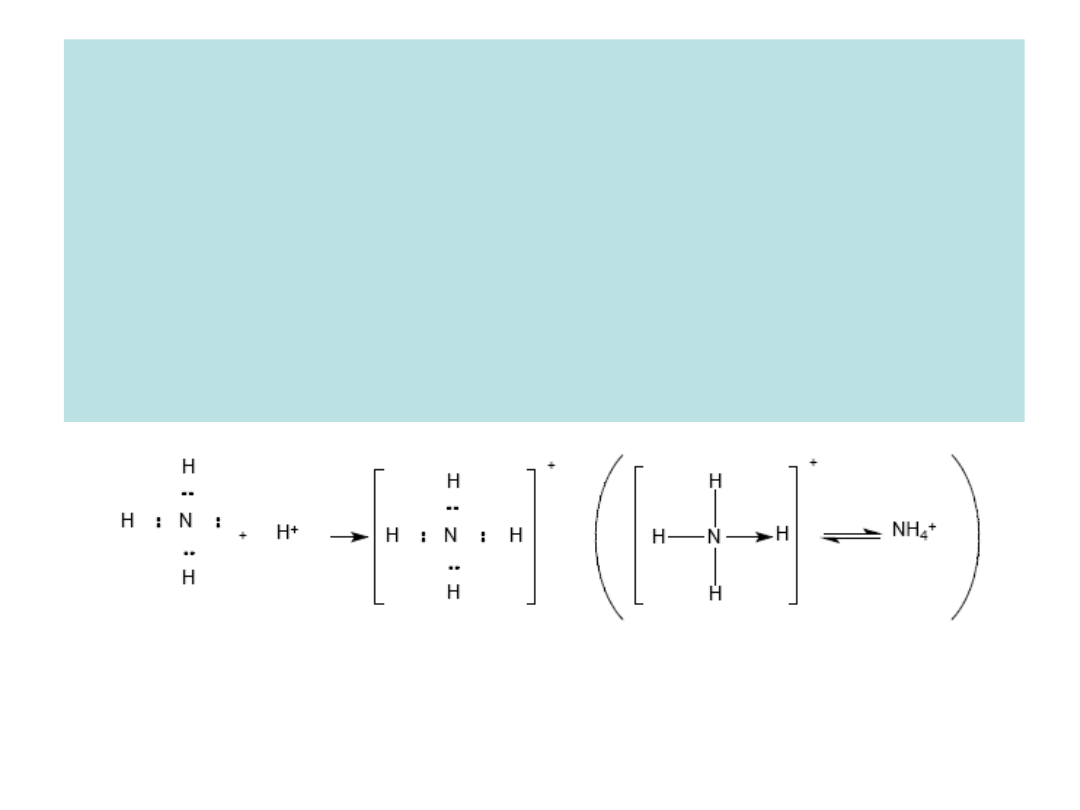
Wiązanie koordynacyjne to rodzaj wiązania kowalencyjnego.
Istotą tego wiązania jest uwspólnienie pary elektronowej między
dwoma atomami, przy czym oba te elektrony formalnie pochodzą od
jednego atomu.
Wiązanie koordynacyjne jest zazwyczaj klasyfikowane jako podtyp
wiązania kowalencyjnego. Różnica między wiązaniem
kowalencyjnym a koordynacyjnym polega głównie na źródle
współdzielonych elektronów.
W wiązaniach koordynacyjnych wyróżnia się atom donora
(dostarczyciela) i akceptora (przyjmującego) elektronów. Donorem
elektronów jest atom bardziej elektrododatni, a akceptorem bardziej
elektroujemny.
Reakcja pomiędzy amoniakiem i dodatnim jonem wodorowym.
Posiadający wolne orbitale jon wodorowy, akceptuje jako wspólną
parę elektronową pochodzącą od atomu azotu w cząsteczce
amoniaku.

Wiązanie koordynacyjne
Wiązanie koordynacyjne
• Tworząca je para elektronów pochodzi od
jednego atomu –
donoru
. Atom donora w
wyniku uwspólnienia nie zyskuje
dodatkowych elektronów
• Drugi atom –
akceptor
uzupełnia ostatnią
powłokę elektronową do konfiguracji
najbliższego gazu szlachetnego
• Donor uzyskuje ładunek dodatni, akceptor
uzyskuje ładunek ujemny
Donorem elektronów jest atom bardziej elektrododatni, a
akceptorem bardziej elektroujemny.

Wiązanie koordynacyjne
Wiązanie koordynacyjne
• Donorami elektronów są atomy lub jony z
przynajmniej jedną wolną parą elektronów, np. N, S,
O, F
-
, Cl
-
, Br
-
, I
-
, OH
-
, CN
-
, SCN
-
, C
2
O
4
2-
, H
2
O, CO, NH
3
, itp.
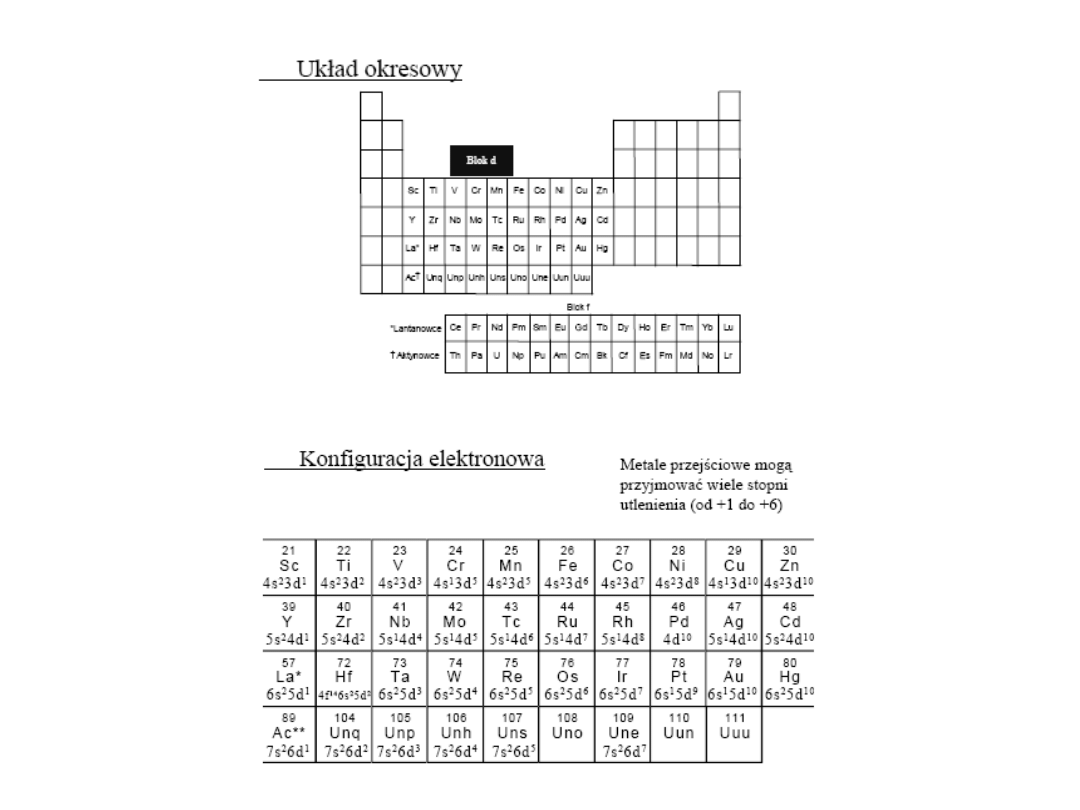
• Akceptorami zazwyczaj są jony wodorowe oraz atomy
mające lukę oktetową (np. metale przejściowe czyli
pierwiastki bloku d, itp).
• Bardzo liczną grupę akceptorów stanowią jony metali
przejściowych. Powstają wtedy związki o bardziej
złożonej budowie zwane związkami kompleksowymi.
Chemia związków kompleksowych jest w zasadzie
chemią metali przejściowych

Jeżeli bezbarwny, bezwodny siarczan(VI) miedzi(II) CuSO
4
rozpuścimy
w wodzie, jon miedzi Cu ulega hydratacji przyłączając cząsteczki
wody. Jon [Cu(H
2
O)
4
] przyjmuje barwę niebieską.
Gdy do takiego roztworu dodamy amoniaku i cząsteczki wody
zostaną zastąpione cząsteczkami amoniaku, roztwór uzyskuje barwę
lazurowo-niebieską
CuSO
4
+ 4H
2
O → [Cu(H
2
O)
4
]SO
4
[Cu(H
2
O)
4
] + 4NH
3
(aq) → [Cu(NH
3
)
4
] + 4H
2
O
Adsorpcję światła przez związki nieorganiczne w zakresie
widzialnym obserwuje się przede wszystkim u jonów mających
niecałkowicie wypełniony podpoziom d osłonięty wyższym
podpoziomem zapełnionym przez
elektrony (jony barwne).
Związki kompleksowe
Związki kompleksowe
sfera
zewnętrzna wewnętrzna
K
4
[Fe(CN)
6
]
jon centralny
ligandy
Formułując wzory związków kompleksowych umieszcza się symbole
zarówno jonu centralnego jak i otaczających go ligandów w nawiasie
kwadratowym. Nawias obejmuje sferę koordynacji. Kompleks może być
kationem, np. [Ag(NH
3
)
2
]
-
, cząsteczką obojętną, np. [PtCl
2
(NH
3
)
2
] lub
anionem, np. [Fe(CN)
6
]
3-
.
Jeżeli część związku kompleksowego złożonego z jonu centralnego i
ligandu jest obdarzona ładunkiem, czyli jest jonem, to sferę zewnętrzną
tworzą proste jony o przeciwnym znaku.

Związki kompleksowe -
Związki kompleksowe -
jon centralny
Jon centralny, atom lub jon przyłączający
(koordynujący) cząsteczki :
– najczęściej kationy metali takich jak Fe, Co, Ni,
Mn oraz platynowce miedziowce i cynkowce
– niemetale, które tworzą jony kompleksowe
będące resztami odpowiednich kwasów
tlenowych
Ładunek przypisywany centralnemu atomowi
nazywa się jego stopniem utlenienia.

Związki kompleksowe - ligandy
Związki kompleksowe - ligandy
• Ligandy są to skoordynowane z atomem
centralnym podstawniki, czyli atomy, grupy
atomów lub jony ujemne.
• Otaczają one atomy centralne i dostarczają
przynajmniej jedną wolną parę elektronów.
• Ligandy znajdują się w bezpośrednim
otoczeniu jonu centralnego i są z nim
połączone za pomocą wiązania
koordynacyjnego.
• W ligandach atomami, które są dawcami
elektronów najczęściej są atomy azotu,
tlenu, siarki i węgla.
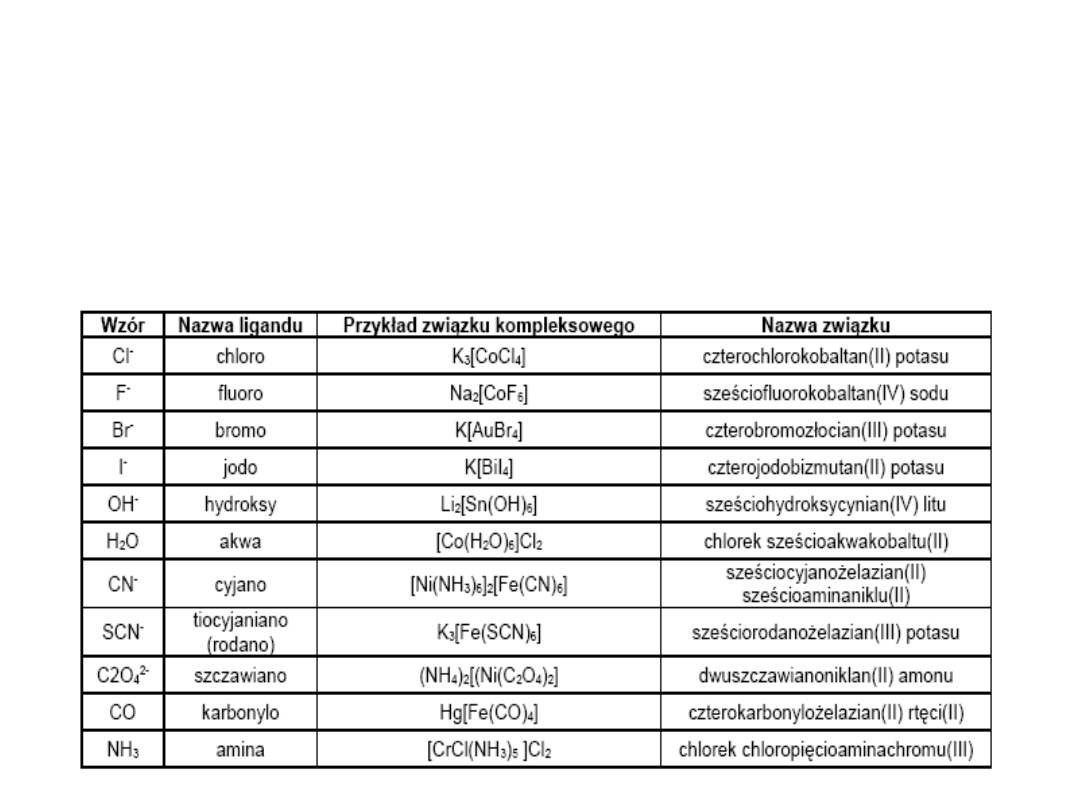
Nazwy związków mające charakter soli piszemy zgodnie z ogólnie przyjętymi
zasadami:
piszemy wzór kation-anion
czytamy wzór anion-kation
H
2
O akwa NH
3
amina
CO karbonyl NO nitrozyl
Nazwy najczęściej spotykanych
ligandów
Nazwy ligandów obojętnych

Liczba koordynacyjna
Liczba koordynacyjna
Liczbę przyłączonych par
elektronowych, która najczęściej
odpowiada liczbie podstawników
przypadających na jon centralny
nazywamy liczbą koordynacyjną.

Liczba koordynacyjna
Liczba koordynacyjna
•Wartość liczby koordynacyjnej zależy od:
– stosunków przestrzennych, tzn. od rozmiaru jonu
centralnego i wielkości ligandów.
Im większy jest jon centralny w stosunku do
ligandów, tym liczba koordynacyjna ma większą
wartość
– możliwości jonu centralnego do przyjęcia par
elektronowych na wolne wewnętrzne podpowłoki d
•Liczba koordynacyjna przyjmuje najczęściej
wartości 2, 4 lub 6. Wartość ta jest
charakterystyczna dla danego jonu centralnego

Każdy atom centralny ma charakterystyczną liczbę
koordynacyjną czyli tzw. „ligandowość”, która jest
liczbą atomów bezpośrednio z nim związanych. W
najczęściej spotykanych kompleksach liczba
koordynacyjna (LK) jest następująca:
jeżeli centralny jest atom metalu
jednowartościowego, to zwykle LK = 2 np. [Ag(CN)
2
]
-
jeżeli centralny jest atom metalu dwuwartościowego,
to zwykle LK = 4 np. [Cu(NH
3
)
4
]
2+
jeżeli centralny jest atom metalu trójwartościowego,
to zwykle LK = 6 np. [Al(H
2
O)
6
]
3+
Liczba koordynacyjna
Liczba koordynacyjna
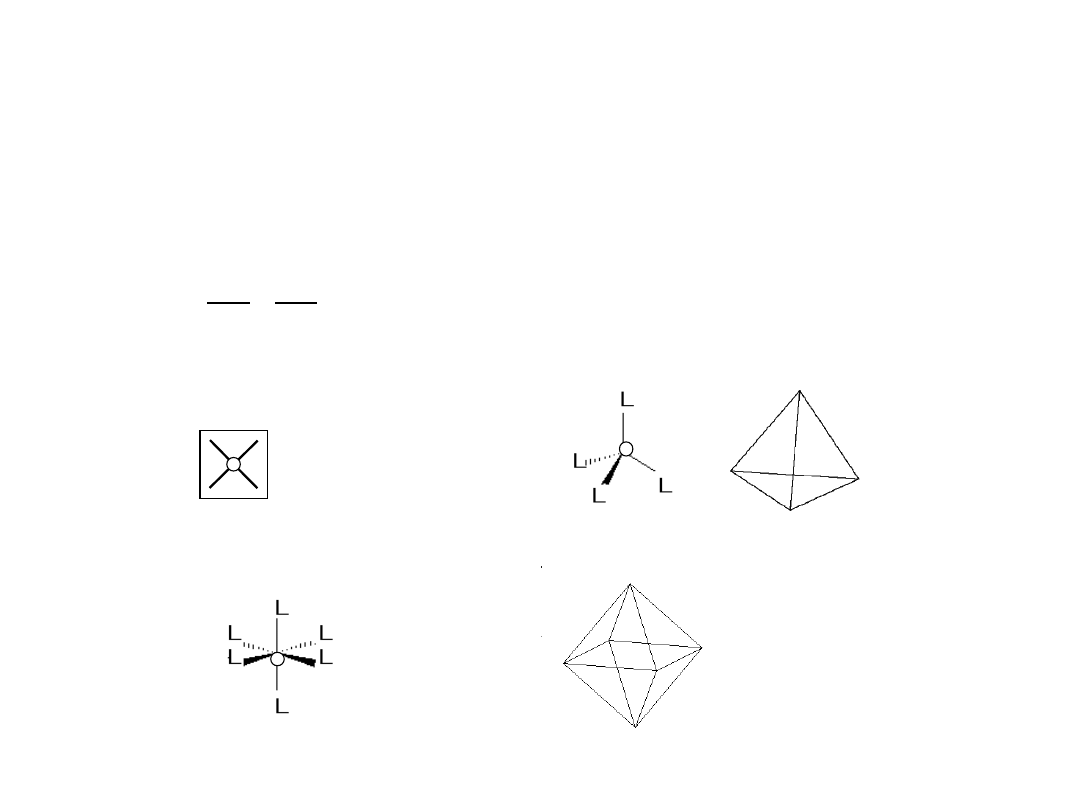
Przestrzenna budowa
kompleksów
W przypadku najprostszych kompleksów:
jeżeli LK = 2, to struktura przyjmuje kształt liniowy:
L O L
jeżeli LK = 4, to kompleks przyjmuje kształt płaskiego kwadratu lub
czworościanu:
lub
jeżeli LK = 6, to kształt bipiramidy tetragonalnej czyli
ośmiościanu:
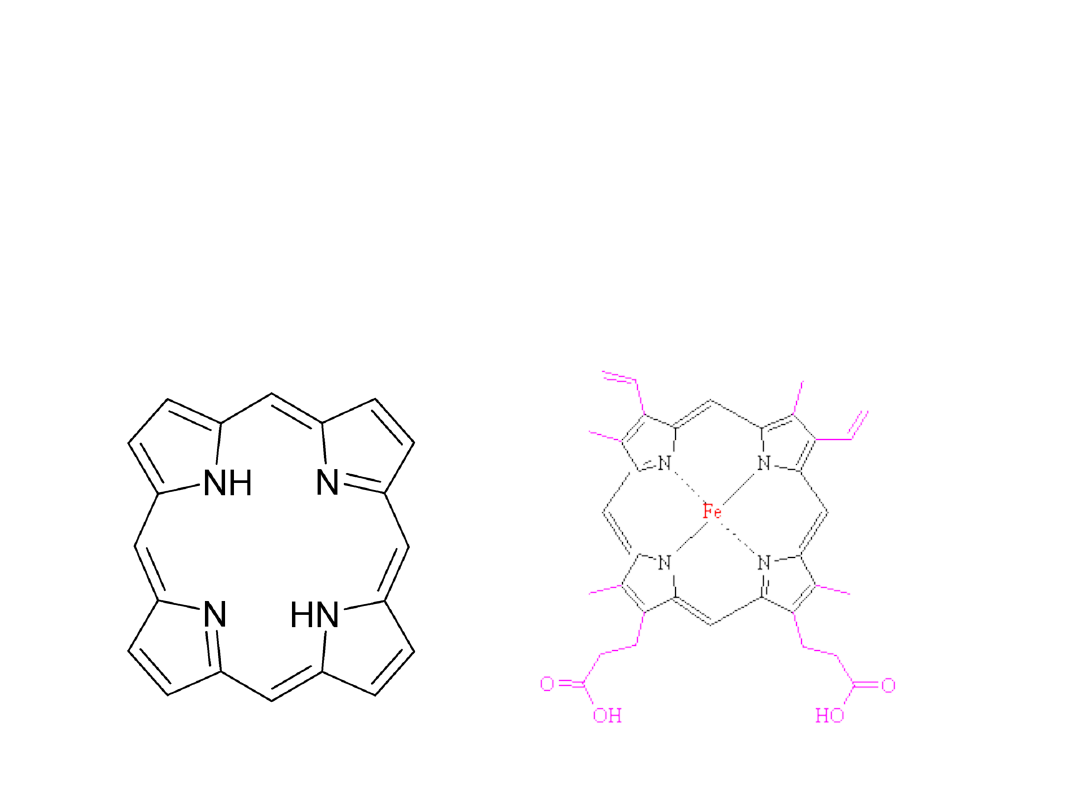
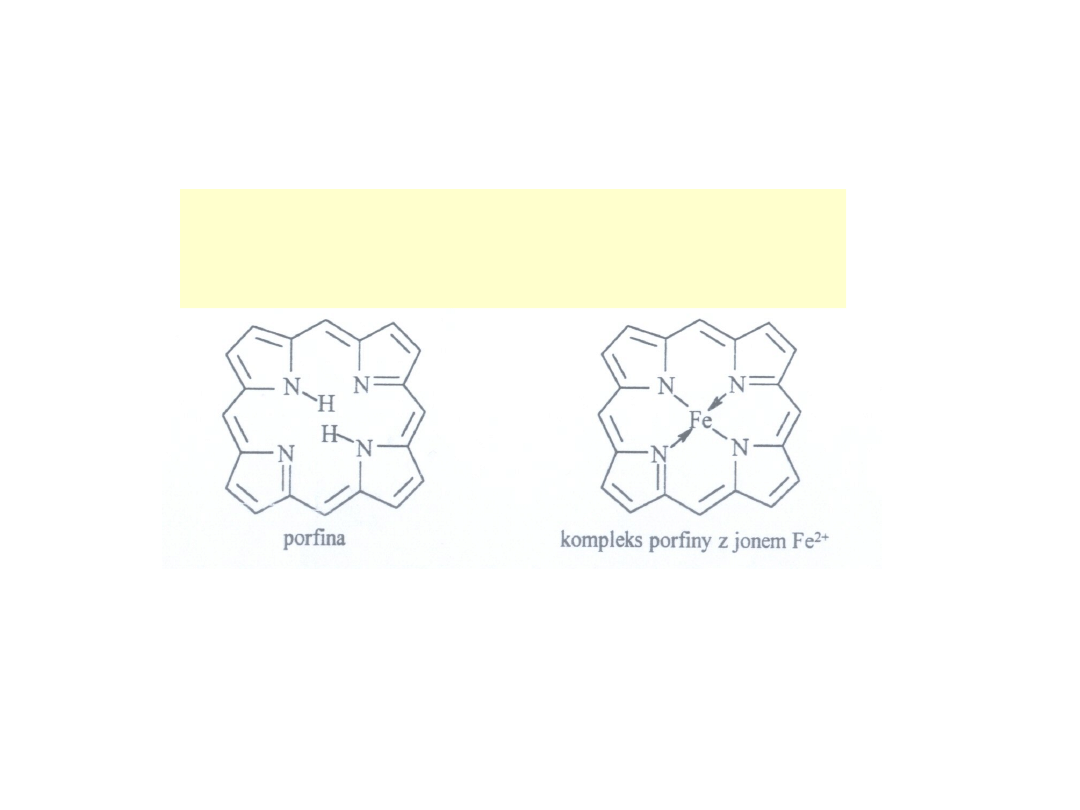
Związki kompleksowe – w
Związki kompleksowe – w
przyrodzie
przyrodzie
• Do najważniejszych z nich zaliczamy kompleks
żelazo – porfirynowy. Jest on obecny w hemie
hemoglobiny i mioglobiny
Pochodne pirolu
Porfiryny i pochodne
• hemoglobina, mioglobina (grupa hemowa z
Fe)
• cytochromy (grupa hemowa z Fe)
• katalazy i peroksydazy (grupa hemowa i
NADPH)
• chlorofil (Mg)
Porfiryny są barwne i fluoryzują
Max absorpcji hematoporfiryny 400
nm
Związki kompleksowe – w
Związki kompleksowe – w
przyrodzie
przyrodzie
• Inne ważne z biochemicznego punktu widzenia
związki kopleksowe to witamina B12 jon centralny
– kobalt, chlorofil (magnez)
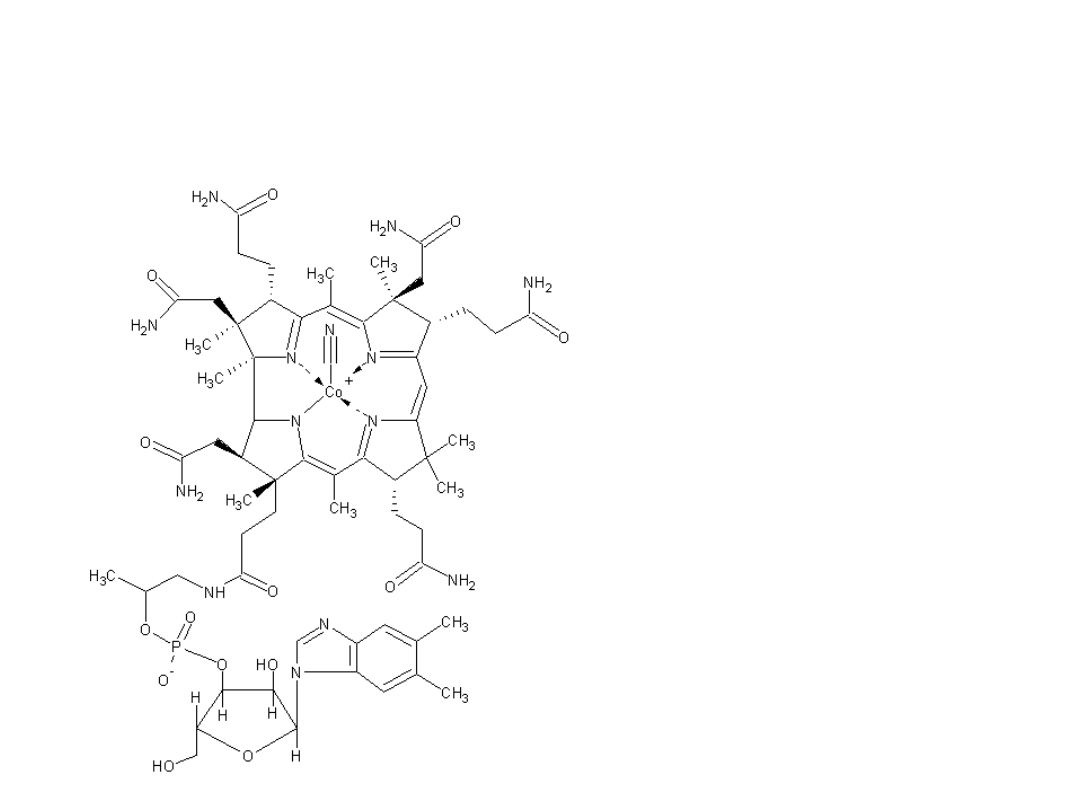
Witamina B12 (nazwy chemiczne: cyjanokobalamina, kobalamina)
- złożony metaloorganiczny związek chemiczny, pełniący w
organizmach żywych rolę regulatora produkcji erytrocytów. Jego
niedobór powoduje niedokrwistość.
Witamina B12 bierze udział w
przemianie węglowodanowej,
białkowej, tłuszczowej i w
różnorodnych procesach,
zapewnia aktywność,
umożliwia syntezę kwasów
nukleinowych w komórkach,
przede wszystkim szpiku
kostnego; wpływa na
funkcjonowanie układu
nerwowego, uczestniczy w
tworzeniu otoczki mielinowej
ochraniającej komórki
nerwowe i neuroprzekaźników
nerwowych, zapewnia dobry
nastrój, równowagę
psychiczną, pomaga w uczeniu
się, skupieniu uwagi; dzięki
niej zmniejsza się poziom
lipidów we krwi; wpływa na
układ kostny, pobudza apetyt.
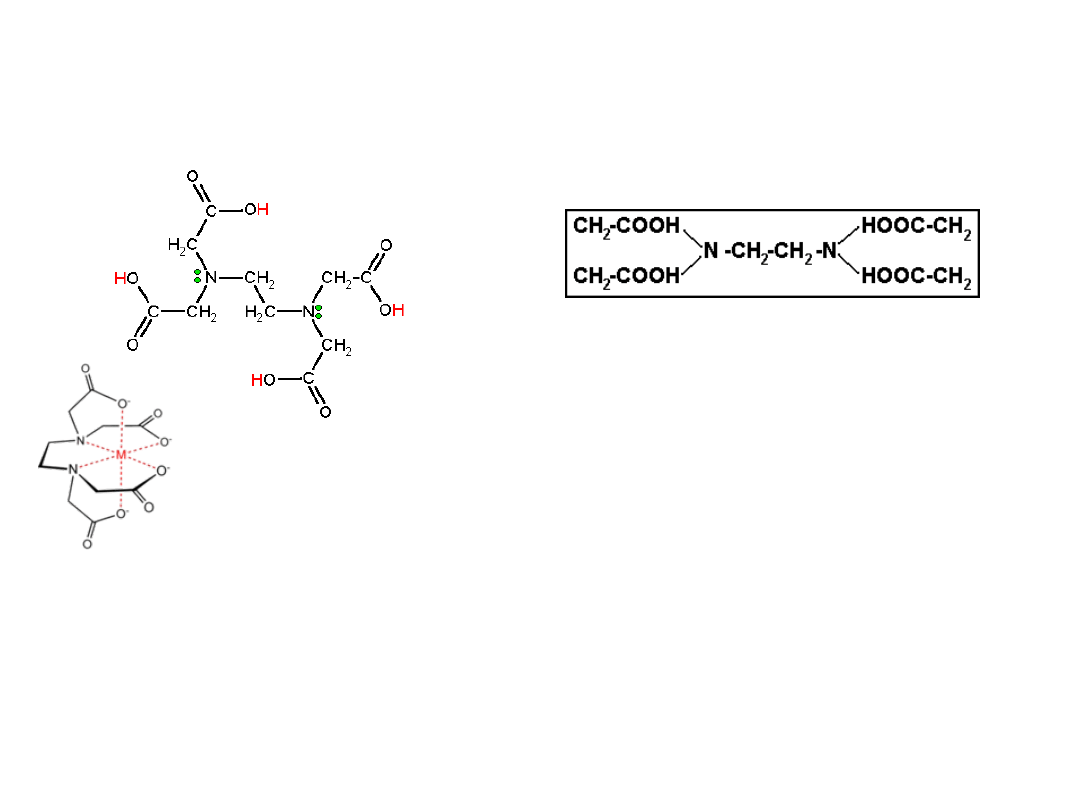
Związki kompleksowe – EDTA
Związki kompleksowe – EDTA
(
(
kwas etylenodiaminotetraoctowy, kwas wersenowy)
kwas etylenodiaminotetraoctowy, kwas wersenowy)
nadmiar Cu
2+
w
żywności (tzw. choroba
Wilsona) leczy się za
pomocą bioligandu
EDTA,
Jest szeroko stosowanym
czynnikiem kompleksującym
wiele kationów metali, takich
jak Ca
2+
, Mg
2+
,Fe
3+
. Zazwyczaj
stosowany w postaci soli
disodowej ze względu na jej
większą rozpuszczalność w
wodzie (komplekson III)
Kompleks chelatowy
EDTA z jonem metalu
Me
środek konserwujący żywność (wiązanie kationów
metali ciężkich - kofaktorów niepożądanych
enzymów)
składnik roztworów buforowych
zapobieganie pozaustrojowemu krzepnięciu krwi
(wiązanie jonów wapnia)
stosowany jako odtrutka w zatruciach metalami
ciężkimi
stosowany w nawozach mikroelementowych
inhibitor metaloproteaz

Ile jest znanych w chwili
obecnej związków
organicznych?
ok. 18
milionów
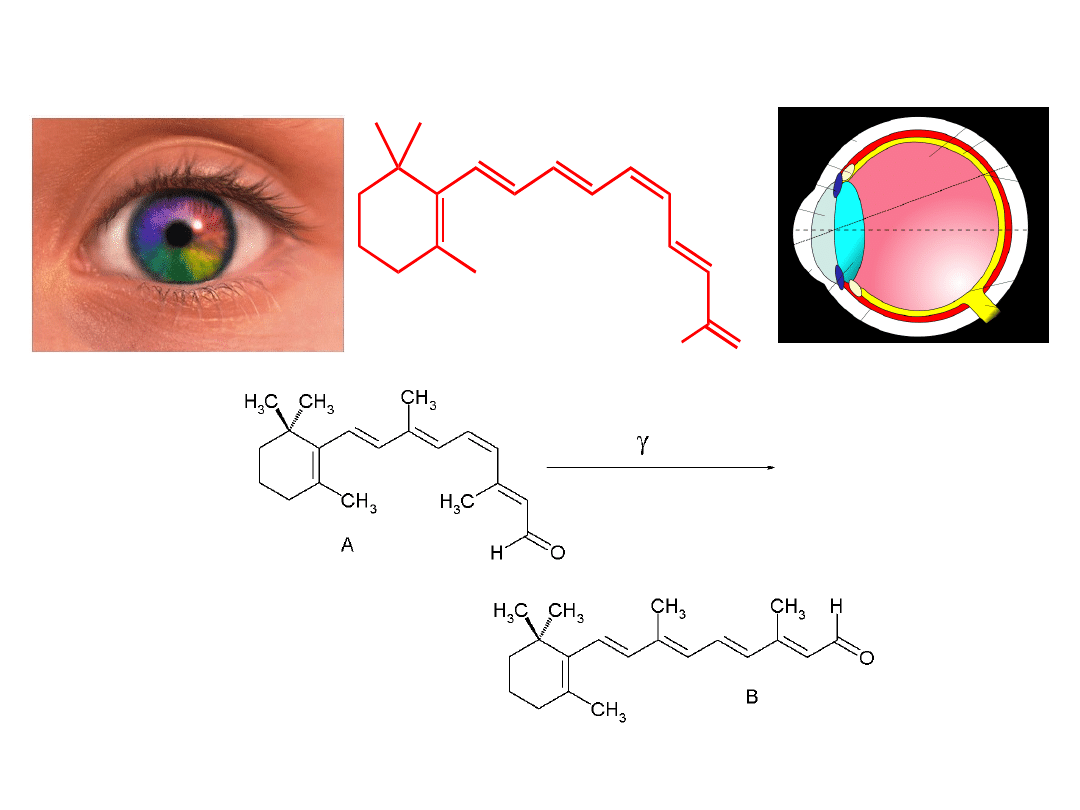
Związki organiczne w życiu codziennym
11-cis-retinal
– odpowiada za pochłanianie promieniowania w
ludzkim oku
O
H
Związki organiczne w życiu codziennym
N
H
HO
NH
2
Dopamina, Serotonina
– związki
pośredniczące w przekazywaniu impulsów
nerwowych
HO
HO
NH
2

Związki organiczne w życiu codziennym
HH
HH n
Polietylen (
polieten - polimer etenu,
PE)
–
popularne tworzywo sztuczne, używane do
produkcji wielu materiałów użytkowych

Związki organiczne w życiu codziennym
HH
H
n
Polistyren
– inaczej nazywany styropian, tworzywo
sztuczne stosowane do produkcji płyt
termoizolacyjnych i wypełnień

Związki organiczne w życiu codziennym
O
O
HN
N
H
n
Kevlar
– (PPTA, poli(tereftalano-1,4-fenylodiamid) lub poli (p-
fenylo- tereftalanoamid), -[-CO-C
6
H
4
-CO-NH-C
6
H
4
-NH-]
n-
) polimer
z grupy poliamidów, a dokładniej aramidów otrzymywany na
bazie arylowych pochodnych diamin i kwasów karboksylowych

Związki organiczne w życiu codziennym
CN
O
O
2-Cyjanoakrylan metylu
– monomer sprzedawany pod
nazwą
Kropelka, Super Glue
i td. Na powietrzu samoistnie
polimeryzuje
Związki organiczne w życiu codziennym
HN
O
NH
O
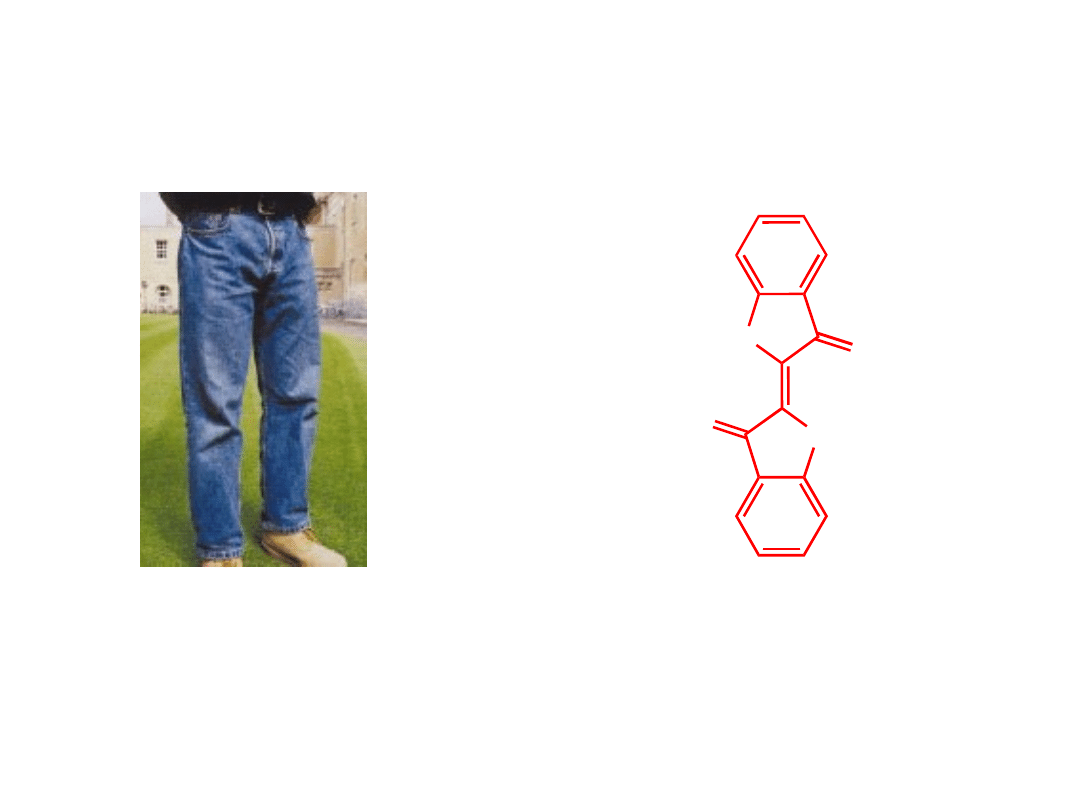
Indygo
– niebieski barwnik odpowiedzialny za kolor
jeansów
Związki organiczne w życiu codziennym
NH
O
OH
O
OH
O
O
OH
O
N
N
N
HO
3
S
O
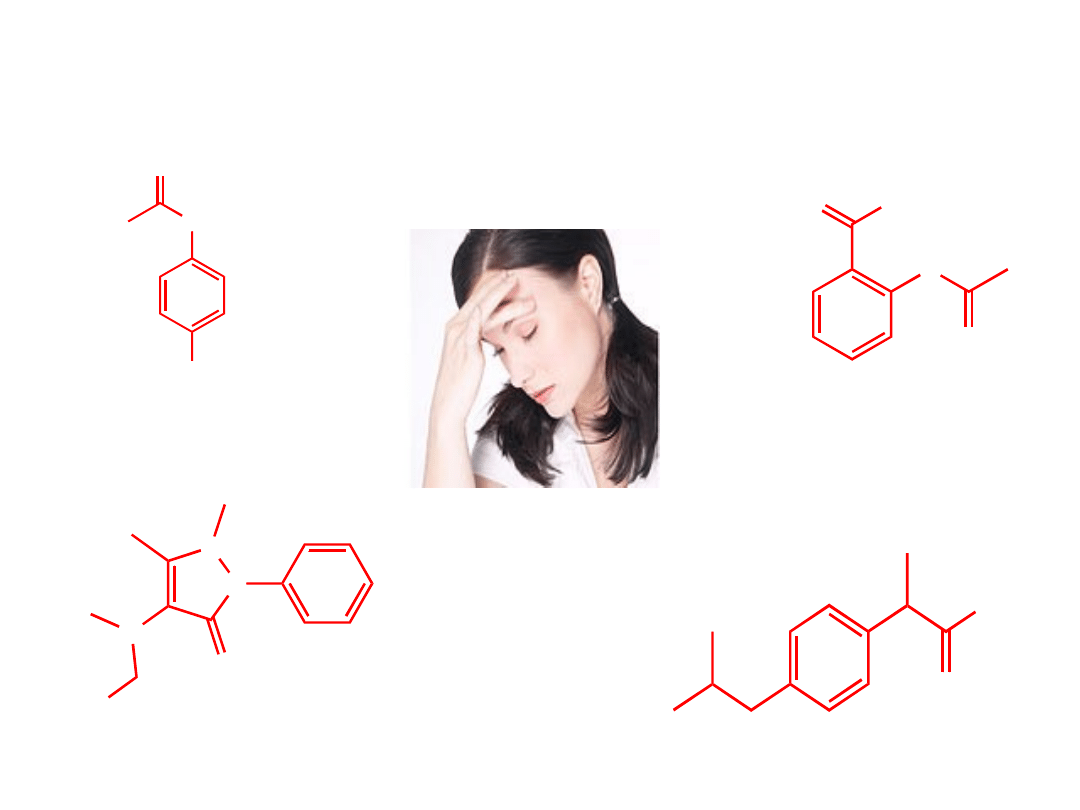
Paracetam
ol
Kwas
acetylosalicylowy
(Aspiryn
a)
Ibuprofe
n
(Ibum, Ibufen,
Nurofen)
Metamiz
ol
(Pyralgina,
Novalgin)
Związki organiczne w życiu codziennym
O
OH
H
O
HO
O
O
O
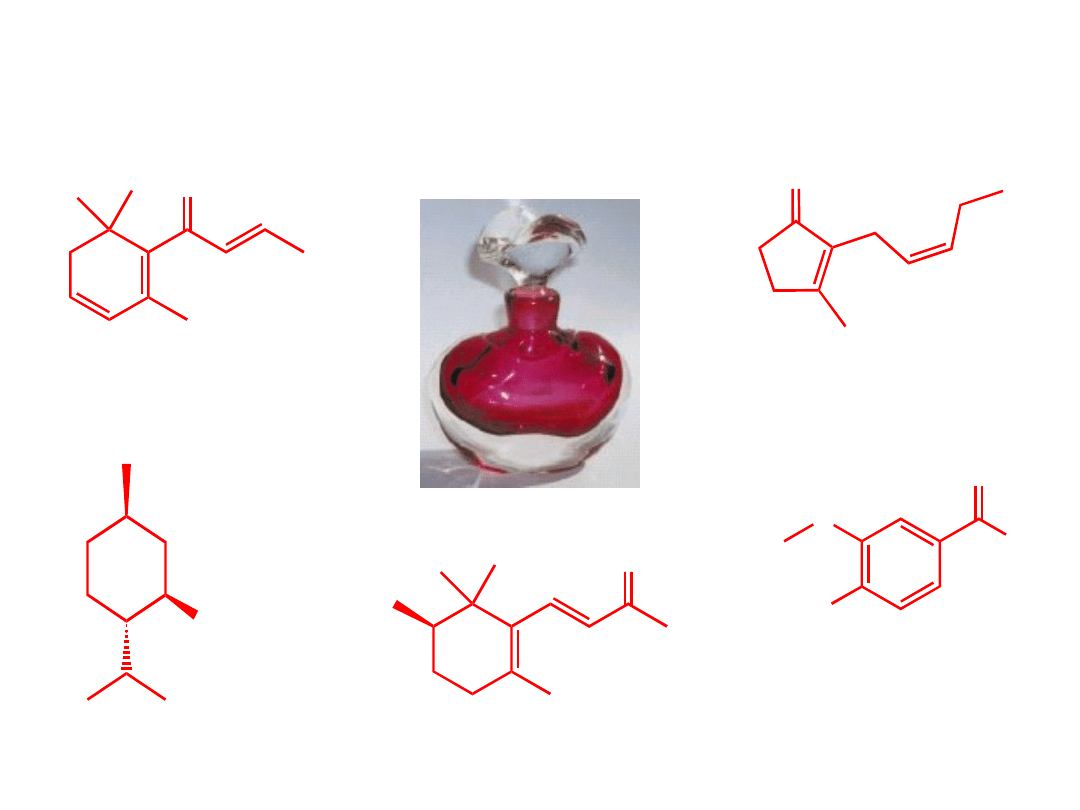
cis-Jasmon
–
zapach jaśminu
Aldehyd
waniliowy
–
zapach wanilii
Mentol
–
zapach mięty
Damascenon
–
zapach róż
Iron
– zapach
irysów
Związki organiczne w życiu codziennym
N
N
O
HO
O
HO
O
O
O
OH
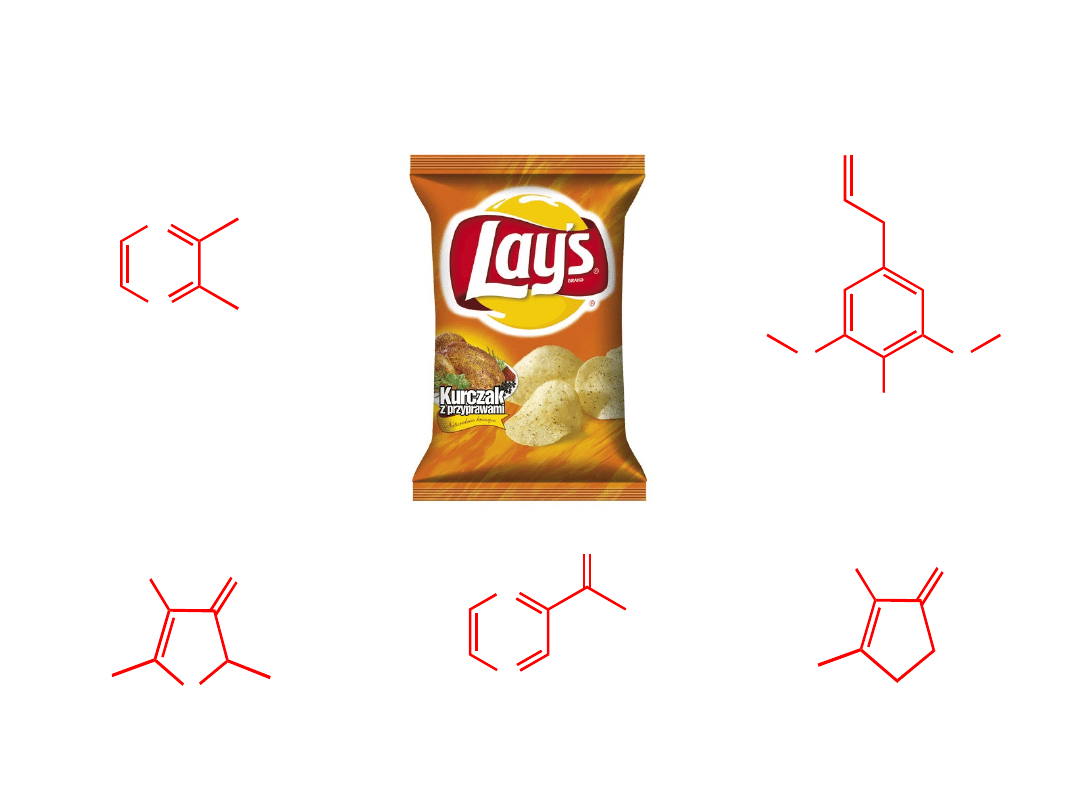
zapach
pieczonego mięsa
zapach boczku
zapach pieczonego
mięsa
zapach
przypalonego
karmelu
N
N
O
zapach popcornu
Związki organiczne w życiu codziennym
NH
2
N
O
O
O
O
HN
N
H
O
N
Amfetami
na
Kokaina
(metylobenzoiloekgoni
na) – C
17
H
21
O
4
N
LSD
W temp. pok. higroskopijna bezbarwna
ciecz o właściwościach silnie
zasadowych i gęstości trochę
mniejszej od wody. Amfetamina w
postaci wolnej zasady na gorąco
matowi szkło sodowe oraz niszczy
gumę. Ma niezbyt przyjemny i
charakterystyczny "mysi" zapach.
Początkowo planowano wykorzystać tę
substancję jako lek działający
pobudzająco na układ krwionośny i
oddechowy. W trakcie dalszych badań
poznano jego psychodeliczne
właściwości. Lek był w latach 40. i 50. XX
wieku stosowany w psychiatrii. Jest to
jedna z najaktywniejszych substancji
psychodelicznych
– substancja pobudzająca
pochodzenia roślinnego. Jest to
alkaloid tropanowy otrzymywany z
liści krasnodrzewu pospolitego
(koki) (Erythroxylon coca),

Związki organiczne w życiu codziennym -
podsumowanie
• polimery syntetyczne
• barwniki
• leki, antybiotyki
• związki zapachowe
• narkotyki
• dodatki żywnościowe
• pestycydy, insektycydy, herbicydy
Wykorzystanie ogromnego potencjału związków organicznych
nie byłoby możliwe bez znajomości podstaw tej dziedziny nauki
Związki organiczne zawładnęły dzisiejszym życiem człowieka
i pozwoliły osiągnąć dzisiejszy stan technologiczny i
społeczny
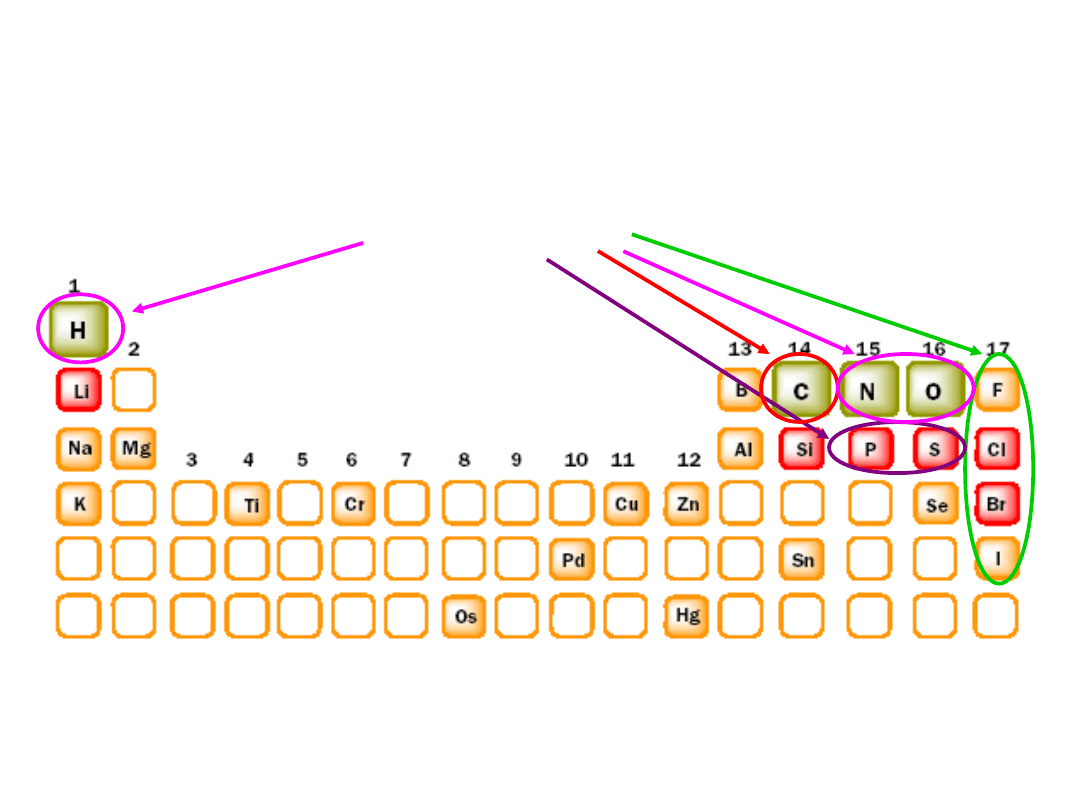
Pierwiastki najczęściej spotykane w związkach
organicznych
Chemia organiczna
Chemia organiczna jest chemią związków posiadających
wiązanie C-C
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
gr2, Związki kompleksowe (inaczej kompleksy, związki koordynacyjne) to związki chemiczne, w których
6. Związki kompleksowe, ZWIĄZKI KOORDYNACYJNE (KOMPLEKSOWE)
związki koordynacyjne
Chemia związków koordynacyjnych
Kompleksowe cwiczenie koordynac cz 2 id 243096
Kompleksowe ćwiczenie koordynacji i techniki cz 1
07 Otrzymywanie i metody badania związków koordynacyjnychid 6732 ppt
Chemia związków koordynacyjnych
związki koordynacyjne
07 ZWIĄZKI KOMPLEKSOWE (KOORDYNACYJNE)
zwiazki kompleksowe 2
Sprawozdanie 6 związki kompleksowe
Cw2 Zwiazki kompleksowe
otrzymywanie i właściwości związków kompleksowych
7 Związki kompleksowe
więcej podobnych podstron