
1
Wydział Chemii UJ Podstawy chemii - wykład 11/1
dr hab. W. Makowski
Wyk
Wyk
ł
ł
ad 11: Zwi
ad 11: Zwi
ą
ą
zki koordynacyjne
zki koordynacyjne
Definicje
Definicje
Struktura
Struktura
Nomenklatura
Nomenklatura
Izomeria
Izomeria
Ligandy
Ligandy
chelatowe
chelatowe
Trwa
Trwa
ł
ł
o
o
ść
ść
Wydział Chemii UJ Podstawy chemii - wykład 11/2
dr hab. W. Makowski
Zwi
Zwi
ą
ą
zki koordynacyjne (kompleksowe)
zki koordynacyjne (kompleksowe)
to produkty reakcji oboj
to produkty reakcji oboj
ę
ę
tnego atomu lub kationu metalu (
tnego atomu lub kationu metalu (
kwasu
kwasu
Lewisa
Lewisa
) z anionami lub oboj
) z anionami lub oboj
ę
ę
tnymi cz
tnymi cz
ą
ą
steczkami, b
steczkami, b
ę
ę
d
d
ą
ą
cymi
cymi
donorami pary elektronowej (
donorami pary elektronowej (
zasadami Lewisa
zasadami Lewisa
). W wyniku reakcji
). W wyniku reakcji
powstaje wi
powstaje wi
ą
ą
zanie koordynacyjne.
zanie koordynacyjne.
Fe
Fe
2+
2+
+ 6 CN
+ 6 CN
-
-
= Fe(CN)
= Fe(CN)
6
6
4
4
-
-
Cu
Cu
2+
2+
+ 4 NH
+ 4 NH
3
3
= Cu(NH
= Cu(NH
3
3
)
)
4
4
2+
2+
Ni + 4 CO = Ni(CO)
Ni + 4 CO = Ni(CO)
4
4
Ligandy
Ligandy
: zasady Lewisa wchodz
: zasady Lewisa wchodz
ą
ą
ce w sk
ce w sk
ł
ł
ad cz
ad cz
ą
ą
steczki zwi
steczki zwi
ą
ą
zku
zku
kompleksowego
kompleksowego
Liczba koordynacyjna
Liczba koordynacyjna
(LK): liczba ligand
(LK): liczba ligand
ó
ó
w otaczaj
w otaczaj
ą
ą
cych atom (lub
cych atom (lub
jon) centralny
jon) centralny

2
Wydział Chemii UJ Podstawy chemii - wykład 11/3
dr hab. W. Makowski
Struktura zwi
Struktura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
struktura piramidy trygonalnej – np. [SnCl
3
]
-
LK 2
struktura liniowa – np. [H
3
N–Ag–NH
3
]
+
, [NC–Ag–CN]
-
, [Cl–Au–Cl]
-
LK 3
struktura trójkątna płaska – np. [HgI
3
]
-
, [Cu(CN)
3
)]
2-
pozorna LK 3
- struktury z ligandami mostkowymi
(AlCl
3
)
Wydział Chemii UJ Podstawy chemii - wykład 11/4
dr hab. W. Makowski
Struktura zwi
Struktura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
LK 4
struktura tetraedryczna – np. [Li(H
2
O)
4
]
+
, [BeF
4
]
2-
, [AlCl
4
]
-
metale grup głównych, metale przejściowe o konfiguracji
d0 i d10
struktura płaska kwadratowa – np. związki jonów Ni
2+
, Pd
2+
, Pt
2+
, Cu
2+
metale przejściowe o konfiguracji
d8 i d9
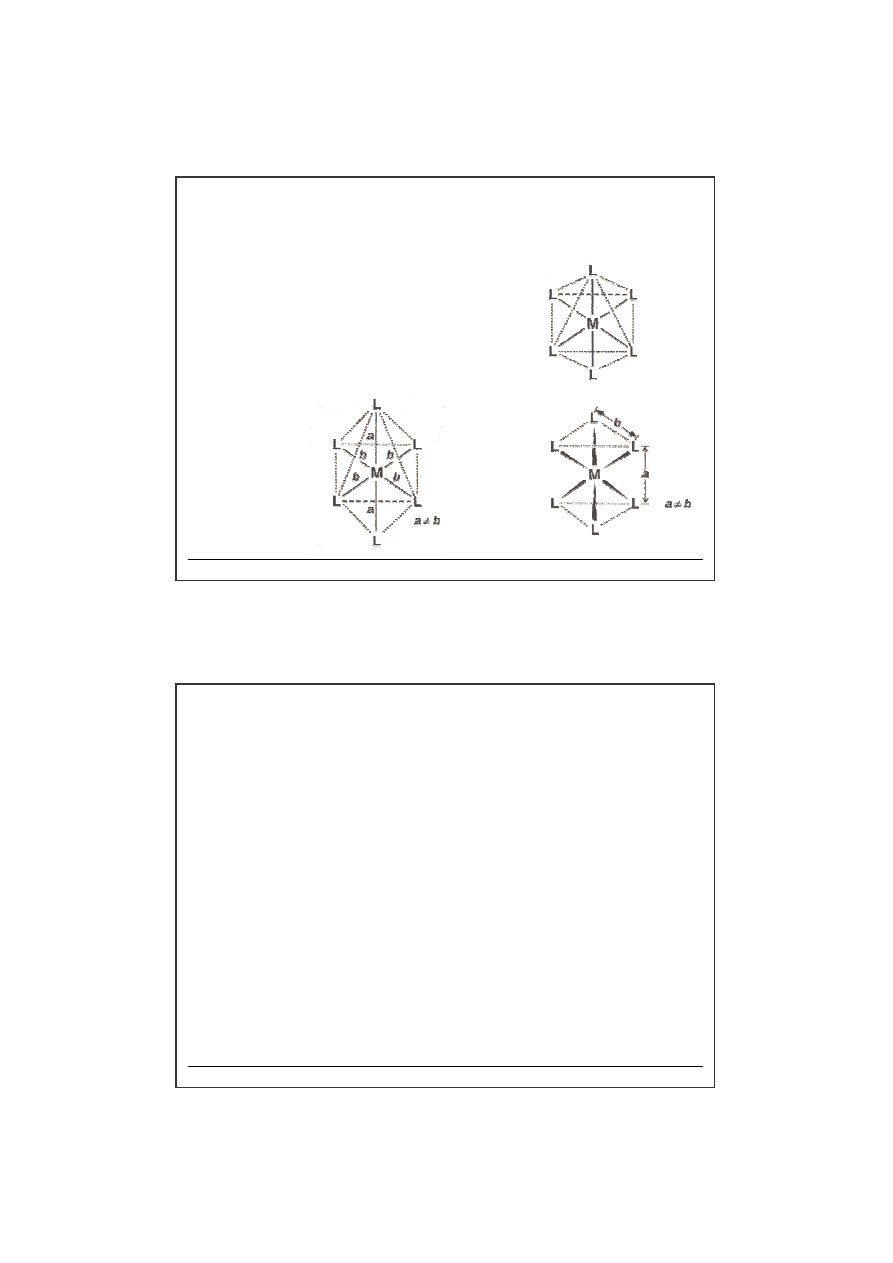
LK 5
struktura bipiramidy trygonalnej
struktura piramidy tetragonalnej
np. [Ni(CN)
5
]
-
3
Wydział Chemii UJ Podstawy chemii - wykład 11/5
dr hab. W. Makowski
Struktura zwi
Struktura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
LK 6
struktura oktaedryczna – kompleksy
prawie wszystkich kationów
odkształcenie
tetragonalne
odkształcenie
trygonalne
Możliwe odkształcenia
(deformacje) oktaedru
Wydział Chemii UJ Podstawy chemii - wykład 11/6
dr hab. W. Makowski
Nomenklatura zwi
Nomenklatura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
1. W nazwie związku kompleksowego wymienia się najpierw ligandy, a
następnie atom centralnego. We wzorach zachowuje się porządek
odwrotny.
2. Stopień utlenienia atomu centralnego podaje się umieszczając po
nazwie kompleksu cyfrę rzymską ujętą w nawias okrągły.
3. W przypadku związków zawierających aniony kompleksowe do
nazwy atomu centralnego dodaje się końcówkę -an lub -ian. W
kompleksach kationowych podaje się nie zmienioną nazwę
pierwiastka.
4. Ligandy, zarówno w nazwie jak i we wzorze, wymienia się w
porządku alfabetycznym. Przy ustalaniu kolejności nie uwzględnia
się przedrostków liczbowych określających liczbę danego rodzaju
ligandów.

4
Wydział Chemii UJ Podstawy chemii - wykład 11/7
dr hab. W. Makowski
Nomenklatura zwi
Nomenklatura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
5. Nazwy ligandów anionowych kończą się na o. W przypadku anionów
nieorganicznych, których nazwy zawierają przedrostki liczbowe,
ujmuje się ich nazwę w nawias. Nazwy ligandów obojętnych stosuje
się bez zmiany. Wyjątek stanowi nazwa
akwa
dla cząsteczki wody
występującej jako ligand,
amina
– dla NH
3
,
karbonyl
– dla CO oraz
nitrozyl
dla NO.
6. Dla oznaczenia liczby ligandów używa się przedrostków greckich
mono-, di-, tri-, tetra- itd. W przypadku ligandów o bardziej
skomplikowanej budowie nazwę ligandu ujmuje się w nawias, przed
którym stawia się określenie bis, tris, tetrakis (dwa, trzy, cztery)
itd.
7. Jeżeli w kompleksie pojawia się grupa mostkowa, łącząca dwa atomy
stanowiące centra koordynacyjne, poprzedza się jej nazwę literą
grecką
µ
.
Wydział Chemii UJ Podstawy chemii - wykład 11/8
dr hab. W. Makowski
Nazwy ligand
Nazwy ligand
ó
ó
w
w
O
O
2
2
-
-
okso
okso
OH
OH
-
-
hydrokso
hydrokso
S
S
2
2
-
-
tio
tio
I
I
-
-
jodo
jodo
Br
Br
-
-
bromo
bromo
Cl
Cl
-
-
chloro
chloro
F
F
-
-
fluoro
fluoro
CO
CO
3
3
2
2
-
-
w
w
ę
ę
glano
glano
CN
CN
-
-
cyjano
cyjano
C
C
2
2
O
O
4
4
2
2
-
-
szczawiano
szczawiano
SCN
SCN
-
-
tiocyjaniano
tiocyjaniano
O
O
2
2
2
2
-
-
perokso
perokso
H-
hydrydo lub hydro
NO
3
-
azotano
ONO
-
nitrito-
O
NO
2
-
nitrito-
N
SO
4
2-
siarczano
S
2
O
3
2-
tiosiarczano
NH
2
-
amido
NH
2-
imido
NH
3
amina
H
2
O
akwa
CO
karbonyl
NO
nitrozyl

5
Wydział Chemii UJ Podstawy chemii - wykład 11/9
dr hab. W. Makowski
Nomenklatura zwi
Nomenklatura zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
–
–
przyk
przyk
ł
ł
ady
ady
K
K
4
4
[Fe(CN)
[Fe(CN)
6
6
]
]
K
K
3
3
[Fe(CN)
[Fe(CN)
6
6
]
]
Na
Na
2
2
[Fe(CN)
[Fe(CN)
5
5
NO]
NO]
Na
Na
3
3
[Ag(S
[Ag(S
2
2
O
O
3
3
)
)
2
2
]
]
[Co(NH
[Co(NH
3
3
)
)
6
6
]Cl
]Cl
3
3
[Cr(H
[Cr(H
2
2
O)
O)
6
6
]Cl
]Cl
3
3
[CoCl
[CoCl
2
2
(NH
(NH
3
3
)
)
4
4
]
]
+
+
[PtCl
[PtCl
4
4
]
]
2
2
-
-
[PtCl
[PtCl
2
2
(NH
(NH
3
3
)
)
2
2
]
]
Fe(CO)
Fe(CO)
5
5
[(NH
[(NH
3
3
)
)
5
5
Cr(OH)Cr(NH
Cr(OH)Cr(NH
3
3
)
)
5
5
]Cl
]Cl
5
5
heksacyjano
heksacyjano
ż
ż
elazian(II
elazian(II
) potasu
) potasu
heksacyjano
heksacyjano
ż
ż
elazian(III
elazian(III
) potasu
) potasu
pentacyjanonitrozyl
pentacyjanonitrozyl
ż
ż
elazian(III
elazian(III
) sodu
) sodu
di(tiosiarczano)srebrzan(l
di(tiosiarczano)srebrzan(l
) sodu
) sodu
chlorek
chlorek
heksaaminakobaltu(III
heksaaminakobaltu(III
)
)
chlorek
chlorek
heksaakwachromu(III
heksaakwachromu(III
)
)
kation
kation
tetraaminadichlorokobaltu(III
tetraaminadichlorokobaltu(III
)
)
anion
anion
tetrachloroplatynianowy(II
tetrachloroplatynianowy(II
)
)
diaminadichloroplatyna(II
diaminadichloroplatyna(II
)
)
pentakarbonyl
pentakarbonyl
ż
ż
elazo(0)
elazo(0)
pentachlorek
pentachlorek
µ
µ
-
-
hydrokso
hydrokso
-
-
bis(pentaaminachromu
bis(pentaaminachromu
)
)
Wydział Chemii UJ Podstawy chemii - wykład 11/10
dr hab. W. Makowski
Izomeria zwi
Izomeria zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
Izomeria strukturalna
Izomeria strukturalna
1.
1.
Izomeria jonowa
Izomeria jonowa
[Co(NH
[Co(NH
3
3
)
)
5
5
Br]SO
Br]SO
4
4
ciemnofioletowy
ciemnofioletowy
[Co(NH
[Co(NH
3
3
)
)
5
5
SO
SO
4
4
]Br
]Br
czerwony
czerwony
2.
2.
Izomeria hydratacyjna
Izomeria hydratacyjna
[Cr(H
[Cr(H
2
2
O)
O)
6
6
]Cl
]Cl
3
3
fioletowy
fioletowy
[Cr(H
[Cr(H
2
2
O)
O)
5
5
Cl]Cl
Cl]Cl
2
2
·
·
H
H
2
2
O
O
niebieskozielony
niebieskozielony
[Cr(H
[Cr(H
2
2
O)
O)
4
4
Cl
Cl
2
2
]Cl
]Cl
·
·
2H
2H
2
2
O
O
zielony
zielony
3.
3.
Izomeria koordynacyjna
Izomeria koordynacyjna
[Co(NH
[Co(NH
3
3
)
)
6
6
][Cr(CN)
][Cr(CN)
6
6
] oraz [Cr(NH
] oraz [Cr(NH
3
3
)
)
6
6
][Co(CN)
][Co(CN)
6
6
]
]
4.
4.
Izomeria
Izomeria
wi
wi
ą
ą
zaniowa
zaniowa
[Co(NH
[Co(NH
3
3
)
)
5
5
ONO]
ONO]
2+
2+
kation
kation
pentaamina(nitrito
pentaamina(nitrito
-
-
O)kobaltu(III
O)kobaltu(III
)
)
[Co(NH
[Co(NH
3
3
)
)
5
5
NO
NO
2
2
]
]
2+
2+
kation
kation
pentaamina(nitrito
pentaamina(nitrito
-
-
N)kobaltu(III
N)kobaltu(III
)
)
6
Wydział Chemii UJ Podstawy chemii - wykład 11/11
dr hab. W. Makowski
Izomeria zwi
Izomeria zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
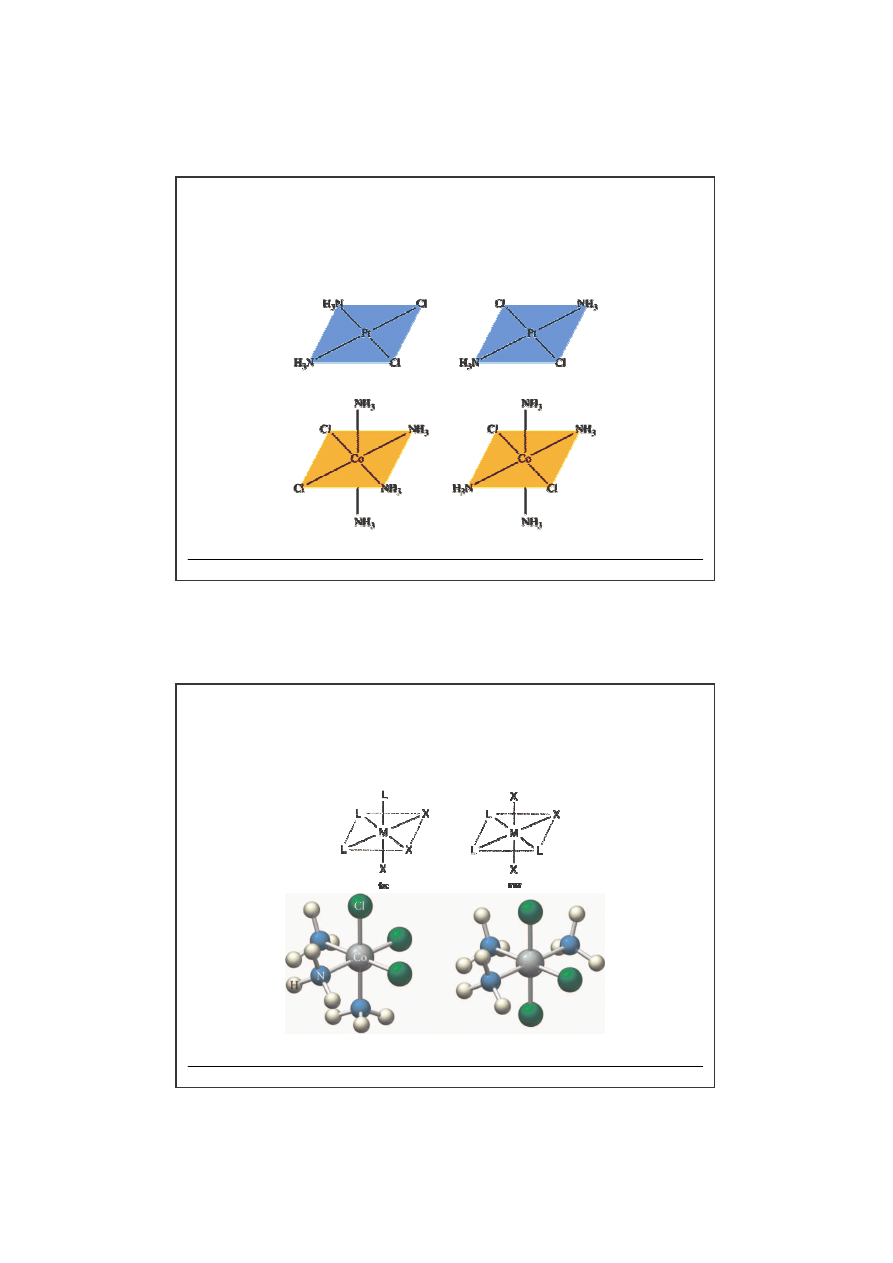
w koordynacyjnych
Stereoizomeria
Stereoizomeria
-
-
izomeria geometryczna
izomeria geometryczna
cis
cis
-
-
trans
trans
cis-
[Co(NH
3
)
4
Cl
2
]
trans-
[Co(NH
3
)
4
Cl
2
]
cis
-[Pt(NH
3
)
2
Cl
2
]
trans
-[Pt(NH
3
)
2
Cl
2
]
Wydział Chemii UJ Podstawy chemii - wykład 11/12
dr hab. W. Makowski
Izomeria zwi
Izomeria zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
Stereoizomeria
Stereoizomeria
-
-
izomeria geometryczna
izomeria geometryczna
fac
fac
-
-
mer
mer
mer
-[Co(NH
3
)
3
Cl
3
]
fac
-[Co(NH
3
)
3
Cl
3
]
7
Wydział Chemii UJ Podstawy chemii - wykład 11/13
dr hab. W. Makowski
Izomeria zwi
Izomeria zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
Stereoizomeria
Stereoizomeria
-
-
izomeria optyczna
izomeria optyczna
L-L – ligand
dwukleszczowy
etylenodiamina
(en)
cis-
[Co(en)
2
Cl
2
]
+
[Co(en)
3
]
3+
Wydział Chemii UJ Podstawy chemii - wykład 11/14
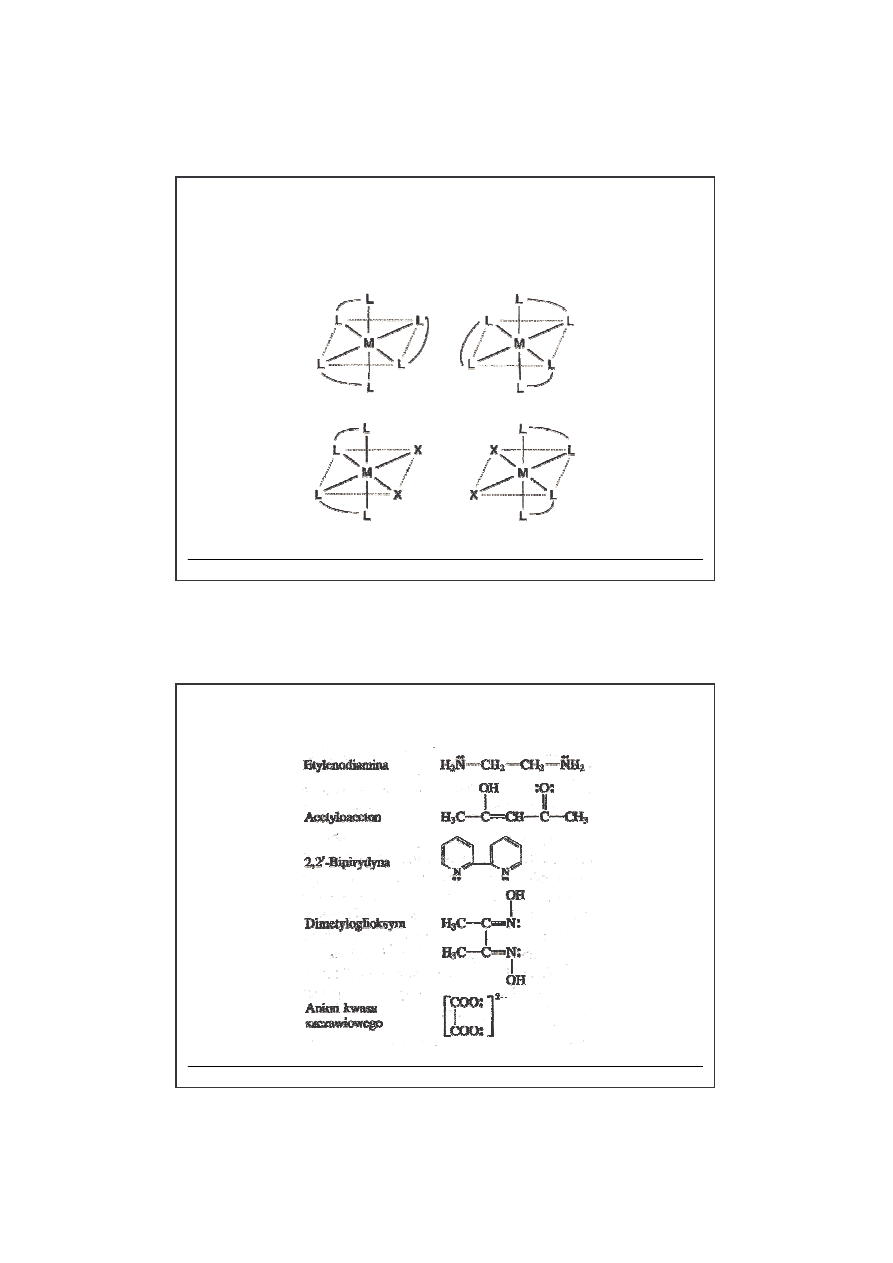
dr hab. W. Makowski
Ligandy
Ligandy
chelatowe
chelatowe
dwukleszczowe
dwukleszczowe

8
Wydział Chemii UJ Podstawy chemii - wykład 11/15
dr hab. W. Makowski
Ligandy
Ligandy
chelatowe
chelatowe
wielokleszczowe
wielokleszczowe
Wydział Chemii UJ Podstawy chemii - wykład 11/16
dr hab. W. Makowski
Przyk
Przyk
ł
ł
ady kompleks
ady kompleks
ó
ó
w
w
chelatowych
chelatowych

9
Wydział Chemii UJ Podstawy chemii - wykład 11/17
dr hab. W. Makowski
Sta
Sta
ł
ł
e trwa
e trwa
ł
ł
o
o
ś
ś
ci zwi
ci zwi
ą
ą
zk
zk
ó
ó
w kompleksowych
w kompleksowych
Sta
Sta
ł
ł
e stopniowe
e stopniowe
[Ni(H
[Ni(H
2
2
O)
O)
6
6
]
]
2+
2+
+ NH
+ NH
3
3
(
(
aq
aq
)
)
= [Ni(H
= [Ni(H
2
2
O)
O)
6
6
NH
NH
3
3
]
]
2+
2+
+ H
+ H
2
2
O
O
Wydział Chemii UJ Podstawy chemii - wykład 11/18
dr hab. W. Makowski
Sta
Sta
ł
ł
e trwa
e trwa
ł
ł
o
o
ś
ś
ci zwi
ci zwi
ą
ą
zk
zk
ó
ó
w kompleksowych
w kompleksowych
Sta
Sta
ł
ł
e skumulowane
e skumulowane

10
Wydział Chemii UJ Podstawy chemii - wykład 11/19
dr hab. W. Makowski
Trwa
Trwa
ł
ł
o
o
ść
ść
zwi
zwi
ą
ą
zk
zk
ó
ó
w koordynacyjnych
w koordynacyjnych
wartości stopniowych stałych równowagi
K
i
maleją ze
wzrostem liczby ligandów
Wydział Chemii UJ Podstawy chemii - wykład 11/20
dr hab. W. Makowski
Trwa
Trwa
ł
ł
o
o
ść
ść
kompleks
kompleks
ó
ó
w
w
chelatowych
chelatowych
Wi
Wi
ę
ę
ksza trwa
ksza trwa
ł
ł
o
o
ść
ść
jonu kompleksowego [Ni(en)
jonu kompleksowego [Ni(en)
3
3
]
]
2+
2+
wynika z wi
wynika z wi
ę
ę
kszego wzrostu entropii uk
kszego wzrostu entropii uk
ł
ł
adu w drugiej reakcji
adu w drugiej reakcji
Wyszukiwarka
Podobne podstrony:
Chemia związków koordynacyjnych
Związki kompleksowe (kompleksy, związki koordynacyjne
07 Otrzymywanie i metody badania związków koordynacyjnychid 6732 ppt
Chemia związków koordynacyjnych
gr2, Związki kompleksowe (inaczej kompleksy, związki koordynacyjne) to związki chemiczne, w których
6. Związki kompleksowe, ZWIĄZKI KOORDYNACYJNE (KOMPLEKSOWE)
07 ZWIĄZKI KOMPLEKSOWE (KOORDYNACYJNE)
izomeria zwiazkow organicznych
zasady i problemy koordynacji polityki regionalnej 6
Ostre Zatrucie Związkami Rtęci
3 ch org zwiazki funkcyjne
7 władza w bliskim związku
zwiazki kompleksowe 2
Związki chemiczne
więcej podobnych podstron