

Wprowadzenie
Klinicznym obrazem
niewydolności toru krzepnięcia
jest hemofilia, a przejawem
nadmiernej aktywacji tego układu
– trombofilia.


HEMOFILIA
Hemofilie (łac. haemophilia, z gr. αἷμα = "krew" +
φιλíα = "kochać") – grupa trzech uwarunkowanych
genetycznie skaz krwotocznych, których objawy
wynikają z niedoborów czynników krzepnięcia:
- VIII (hemofilia A)
- IX (hemofilia B)
- XI (hemofilia C)
Łączna częstość hemofilii A i B w populacji wynosi
około 1:12 000. Hemofilia A jest 4 do 8 razy
częstsza niż hemofilia B.

Etiologia
Hemofilia A i B są chorobami sprzężonymi z płcią.
Geny, których mutacje wywołują choroby,
znajdują się na chromosomie X. Hemofilie
dziedziczone są w sposób recesywny, co oznacza,
iż chorują jedynie osoby z pełną ekspresją
recesywnego genu:
mężczyźni hemizygotyczni względem
zmutowanego genu
kobiety homozygotyczne względem zmutowanego
genu.

Etiologia
Kobieta nosicielka zmutowanego allela genu
posiada drugi chromosom X z prawidłowym
allelem, i nie choruje.
Syn, który urodzi się ze związku z nosicielką
wadliwego genu, może odziedziczyć od matki
mutację i wtedy będzie chorował na hemofilię,
natomiast córka z takiego związku może być
tylko nosicielką zmutowanego allelu
(prawdopodobieństwo odziedziczenia
wadliwego allelu wynosi 50%).

Etiologia
Możliwe jest zachorowanie na hemofilię córki kobiety-
nosicielki wadliwego genu, w przypadku, kiedy ojciec
takiej dziewczynki będzie chory na hemofilię:
wówczas obydwie kopie genu będą miały mutacje.
Dziecko mężczyzny chorującego na hemofilię będzie
zdrowe(chłopiec) lub będzie nosicielem(dziewczynka)
– (przy założeniu, że drugi rodzic nie jest nosicielem
uszkodzonego genu).
Dziecko kobiety będącej nosicielką może być
nosicielem (dziewczynka) lub może być chore
(chłopiec), ale może też być zdrowe – (przy założeniu,
że ojciec nie jest chory na hemofilię czyli nie jest
nosicielem uszkodzonego genu).
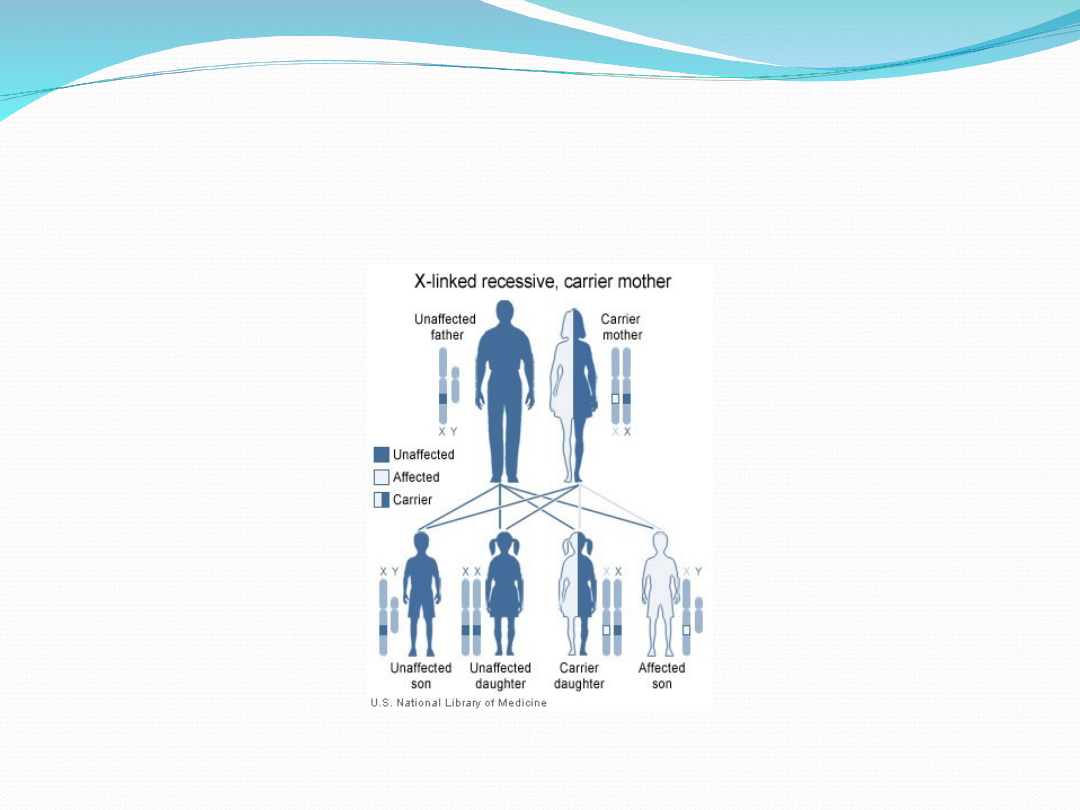
Schemat dziedziczenia hemofilii ( Jasny niebieski oznacza chorego,
ciemny – osobę zdrową.)

Typy hemofilii
Hemofilia A – spowodowana mutacją w locus
Xq28 powodującą niedobór VIII czynnika
krzepnięcia krwi (czynnika antyhemolitycznego);
klasyczna hemofilia.
Hemofilia B – mutacja w locus Xq27.1-q27.2,
niedobór IX czynnika krzepnięcia krwi (czynnika
Christmasa).
Hemofilia C – mutacja w locus 4q35, niedobór XI
czynnika krzepnięcia krwi (czynnika Rosenthala),
najczęściej w populacji Żydów Aszkenazyjskich,
dziedziczenie autosomalne recesywne.

Postacie kliniczne
•
ciężka, stężenie czynnika VIII/IX w osoczu
<2% normy
•
umiarkowana, stężenie czynnika VIII/IX w
osoczu 2-5% normy
•
łagodna, stężenie czynnika VIII/IX w osoczu 5-
25% normy
•
utajona, stężenie czynnika VIII/IX w osoczu 25-
50% normy

Objawy hemofilii
krwawienia podskórne
wylewy do mięśni
nawracające wylewy do dużych stawów: obrzęk,
ucieplenie, ograniczenie ruchomości, bolesność,
zniszczenie struktury stawu – artropatia hemofilowa
krwawienia z błony śluzowej jamy ustnej i nosa
krwioplucie okołoinfekcyjne
u niemowląt i małych dzieci wylewy na głowie
krwiomocz
krwawienie do ośrodkowego układu nerwowego (objawia
się silnym bólem głowy)
krwawienie pozaotrzewnowe, do mięśnia biodrowo-
lędźwiowego

Rozpoznanie
wydłużony czas kaolinowo-kefalinowy (APTT)
obniżenie aktywności VIII lub IX
czas protrombinowy jest prawidłowy
czas krwawienia jest prawidłowy
ilość płytek krwi jest prawidłowa.
Prosty test różnicujący hemofilię A i B polega
na dodaniu osocza pacjenta z hemofilią B, jeśli
badane osocze pochodzi od pacjenta z
hemofilią A, dojdzie do korekcji czasu
kaolinowo-kefalinowego

Leczenie
Leczenie polega na suplementacji preparatami
czynników VIII lub IX. Preparaty są
rekombinowane (uzyskane metodami inżynierii
genetycznej) lub wysokooczyszczone, i na ogół
są słabo immunogenne. Czynnik VIII ma czas
biologicznego półtrwania 10-15 godzin, czynnik
IX około 24 godzin, stąd w dawkowaniu czynnika
IX podaje się go raz na dobę, a w celu
utrzymania prawidłowego stężenia czynnika VIII
połowę dawki początkowej podaje się co 12
godzin

Leczenie
W zależności od postaci hemofilii leczenie może
przebiegać profilaktycznie bądź objawowo.
Leczenie profilaktyczne (zapobiegawcze)
polega na okresowym, powtarzanym
uzupełnieniu brakującego czynnika krzepnięcia
(dożylnie).
Leczenie objawowe polega na podawaniu
dawek czynnika jedynie w przypadku
wystąpienia krwawienia i ma na celu jego
zatrzymanie.

Leczenie
Leczenie profilaktyczne prowadzone jest dwa razy w
tygodniu w przypadku hemofilii B lub trzy razy w
tygodniu w przypadku hemofilii A. Podawanie leku chroni
stawy dzieci przed uszkodzeniami i późniejszym
inwalidztwem.
W łagodnych postaciach hemofilii A lekiem z wyboru jest
pochodna wazopresyny (DDAVP), uwalniająca czynnik
VIII z rezerwy tkankowej jaką są komórki śródbłonka. Po
podaniu DDAVP stężenie czynnika VIII wzrasta w osoczu
2-4 razy w ciągu 2-4 godzin. PO 3-4 dniach leczenia
DDAVP należy się spodziewać zjawiska tachyfilaksji.

Powikłania
Najczęściej występującymi powikłaniami są
postępujące zmiany zwyrodnieniowe (artropatia
hemofilowa) na skutek długotrwałych,
nawracających wylewów dostawowych. Dzieje
się tak gdy dzieci chore na hemofilię nie są
objęte leczeniem profilaktycznym, polegającym
na regularnym podawaniu czynnika krzepnięcia
do 18. roku życia.
Powikłaniem leczenia koncentratem czynnika
VIII (rzadziej IX) jest wytworzenie przeciwciał
skierowanych przeciwko temu białku. Dotyczy to
15-20% leczonych pacjentów.

Historia
Najstarsze wzmianki o hemofilii znajdują się w
księgach Starego Testamentu i na papirusach
pochodzących ze starożytnego Egiptu. Pisemne
opisy chorych z objawami skazy krwotocznej,
prawdopodobnie hemofilii, zawarte są w Talmudzie,
w którym przedstawiono przypadki śmiertelnego
wykrwawienia obrzezanych chłopców. Te relacje
pochodzą mniej więcej z roku 140 n.e. Najstarszy
opis hemofilii na obszarze europejskim wyszedł
spod pióra arabskiego lekarza i autora podręcznika
chirurgii Khalaf ibn Abbas, znany także jako
Albucasis z Kordoby już w XI wieku.

Historia
Królowa Wiktoria przekazała mutację swojemu
synowi Leopoldowi oraz swoim córkom: Alice i
Beatrycze (nosicielki genu hemofilii), co
zapoczątkowało "epidemię" hemofilii wśród
członków rodów królewskich w całej Europie, w
Hiszpanii, Niemczech i Rosji. Stąd też
hemofilię nazywa się często "chorobą królów".

Historia – królowa
Wiktoria

Historia
Hemofilia wywarła także wielki wpływ na losy carskiej
Rosji – a przez to na losy całej Europy. Syn ostatniego
cara, a jednocześnie prawnuk królowej Wiktorii
(carewicz Aleksiej) był hemofilikiem – a wówczas nie
istniały skuteczne leki na tę dolegliwość. Jedną z
przyczyn pojawienia się Rasputina na dworze carskim
była właśnie jego obietnica, że będzie w stanie
uzdrowić Aleksego.
W decydującej chwili car Mikołaj zdecydował się
abdykować na rzecz swojego brata (a nie syna) –
ponieważ obawiał się, że Aleksy nie będzie w stanie
znieść ciężaru władzy. Brat cara z kolei nie był
zainteresowany przejęciem władzy, co doprowadziło
do pogłębienia kryzysu i w konsekwencji
przyspieszyło wybuch rewolucji.

Historia
Choroba natomiast przeniosła się dalej:
Księżniczka Alice, która jako nosicielka przekazała
gen 3 swoim dzieciom:
Księżna Irene, która przekazała go dalej swoim
synom: Waldemarowi i Henry'emu
Książę Friedrich
Caryca Aleksandra Fiodorowna Romanowa, która
przekazała chorobę tylko jednemu synowi:
Aleksejowi.
Jego hemofilia była jednym z czynników
przyczyniających się do upadku Imperium
Rosyjskiego w trakcie Rewolucji w 1917 roku


Trombofilia
Trombofilia – wrodzony lub nabyty zespół
chorobowy charakteryzujący się zwiększona
skłonnością do tworzenia zakrzepów żylnych
lub rzadko tętniczych spowodowaną
zaburzeniami w układzie krzepnięcia

Przyczyny trombofilii
wrodzonej
Częste:
niedobór białka C (6-9%)
mutacja Leiden czynnika V (> 20%)
Rzadkie
niedobór antytrombiny III
niedobór białka C
niedobór białka S (kofaktora białka C)

Leiden V
Mutacja pojedynczego nukleotydu w genie
czynnika V (mutacja typu Leiden) odpowiada za
oporność na aktywowane białko C.
Czołowe miejsce pod względem częstości
występowamnia na liście genetycznych
czynników ryzyka trombofilii, stwierdza się u 20-
50% pacjentów z zakrzepicą żylną
Wśród kobiet stosujących doustną antykoncepcję
hormonalną, u których wystąpiła zakrzepica, 80%
to homozygoty czynnika V Leiden

Polimorfizmy innych białek a
zwiększone ryzyko dziedzicznej
trombofilii
Protrombina
Czynnik VII
Fibrynogen
Inhibitor aktywatora plazminogenu
Trombomodulina
Homocysteina
Plazminogen
Białko bogate w histydynę (HRPG)
Kofaktor II heparyny

Przyczyny trombofilii
nabytej
zespół antyfosfolipidowy
palenie tytoniu
Document Outline
- Genetyczne podstawy zaburzeń układu krzepnięcia
- Wprowadzenie
- Genetyczne podstawy zaburzeń układu krzepnięcia HEMOFILIA
- HEMOFILIA
- Etiologia
- Slide 6
- Slide 7
- Schemat dziedziczenia hemofilii ( Jasny niebieski oznacza chorego, ciemny – osobę zdrową.)
- Typy hemofilii
- Postacie kliniczne
- Objawy hemofilii
- Rozpoznanie
- Leczenie
- Leczenie
- Slide 15
- Powikłania
- Historia
- Slide 18
- Historia – królowa Wiktoria
- Slide 20
- Slide 21
- Genetyczne podstawy zaburzeń układu krzepnięcia TROMBOFILIA
- Trombofilia
- Przyczyny trombofilii wrodzonej
- Leiden V
- Polimorfizmy innych białek a zwiększone ryzyko dziedzicznej trombofilii
- Przyczyny trombofilii nabytej
Wyszukiwarka
Podobne podstrony:
DO TEL! 5= Genetyka nadci nieni Nieznany
DO TEL! 4= Genetyka chorEb uk a Nieznany
DO TEL! 4. Genetyka kliniczna (06.05.2014 r.)
DO TEL! Genetyka kliniczna wady wrodzone, u pokarmowy i alergie
DO TEL! GENETYKA MOLEKULARNA CHOR B ALERGICZNYCH
DO TEL! 5= Genetyka nadci nieni Nieznany
DO TEL! 4 Genetyka kliniczna (06 05 2014 r )
DO TEL! 5= Genetyka nadci nienia i chorĘb nerek
DO TEL! Genetyka kliniczna wady wrodzone, u pokarmowy i alergie
DO TEL! Wskazania do skierowania pacjenta, genetyka
DO TEL! Wskazania do skierowania pacjenta genetyka
więcej podobnych podstron